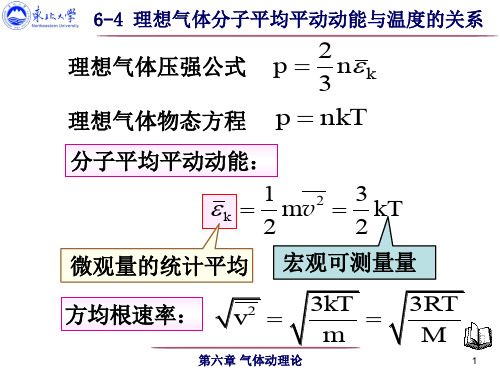
理想气体分子平均平动动能与温度的关系
描述理想气体的统计规律

描述理想气体的统计规律
对单个分子来说,每个气体分子的运动都可视为质点运动, 遵从牛顿运动定律,只是由于受到其他分子极其频繁而又无法 预测的碰撞,其运动状态瞬息万变,显得杂乱无章,具有很大 的偶然性.但总体而言,在一定条件下,大量分子的热运动却遵从 确定的规律.这种大量偶然事件的总体所显示的规律性称为统计 规律性.显然,统计规律性不适用于少数或个别的分子,从而就 能对与其热运动相关联的宏观现象做出微观解释.
(3)利用压强的定义式
及大量分子热运动的统计
规律,推导出压强公式.
描述理想气体的统计规律
二、 温度的微观本质 1. 温度公式
根据理想气体的压强公式和状态方程,可以得到气 体的温度与分子的平均平动动能之间的关系,从而揭示 温度这一宏观量的微观本质.
将式(6- 2)与理想气体的压强公式
(6- 8)
描述理想气体的统计规律
可见,这个能量很大.
描述理想气体的统计规律
2. 气体分子的方均根速率
根据理想气体分子平均平动动能与温度的关系,可以求 出理想气体分子的方均根速率v2,它是气体分子速率的一种 统计平均值.
描述理想气体的统计规律
上式表明,气体分子的方均根速率与温度的平方根成正比, 与气体摩尔质量的平方根成反比.同一种气体,温度越高,方均根 速率越大;不同气体在同一温度下,分子质量或摩尔质量越大, 方均根速率越小.例如,在0 ℃时,虽然氢分子和氧分子的平均平 动动能相等,均为
描述理想气体的统计规律
利用式(6-8),可以计算出任何温度下理想气体分子的平均平动 动能εk.计算表明,εk一般是很小的.例如,当T=300 K时,εk约为 6.21×10-21J,即使理想气体的温度高达108 K,εk也只有2.07×10- 15J.但因为气体的分子数密度很大,因而气体分子的平均平动动能的 总和还是很大的.例如,当T=300 K,p=1.013×105 Pa时,由式( 12- 2)可得分子数密度为
气体方程与状态方程:气体状态方程与理想气体行为的关系

气体方程与状态方程:气体状态方程与理想气体行为的关系气体方程是描述气体性质的数学方程,而状态方程是用来描述气体在不同压力、温度和体积下的物理状态的方程。
气体状态方程描述的是气体在一定条件下的状态,其中最常用的方程是理想气体状态方程。
理想气体状态方程是描述理想气体性质的方程,也叫做理想气体定律。
它是理想气体行为的一个近似模型,假设气体分子之间不存在吸引力和排斥力,分子之间的碰撞完全弹性,从而使得气体分子运动服从一些简单的物理规律。
理想气体状态方程可以用来描述气体在不同条件下的状态变化,以及计算气体的压强、体积和温度等物理量的关系。
理想气体状态方程的数学形式为 PV = nRT,其中 P 代表气体的压强,V 代表气体的体积,n 为气体的物质量(一般用摩尔表示),R 为气体常数,T 代表气体的绝对温度。
根据这个方程,我们可以推导出其他一些气体性质的关系。
理想气体状态方程的推导基于以下几个假设:气体是由大量非常小的分子组成的,分子之间不断自由运动,彼此之间会发生碰撞;气体分子之间不存在吸引力和排斥力,碰撞是完全弹性的;气体分子的体积可以忽略不计,分子间距较大,相对于有效体积可以忽略不计。
根据这些假设,我们可以推导出理想气体状态方程。
首先考虑一个气体分子,它的动量可以用动能定理表示为FΔt = Δp,其中 F 为分子受到的作用力,Δt 为时间间隔,Δp 为动量的变化量。
由于气体分子之间的碰撞完全弹性,它们在碰撞过程中动量守恒。
考虑一个气体容器,里面有 N 个气体分子,由这些分子所受到的所有碰撞力的总和可以表示为F_total = N Δp / Δt。
这样,我们可以得到理想气体的状态方程为 F_total/A = P =NΔp / ΔtA,其中 A 为气体容器的面积。
根据动能定理,我们有Δp = 2mv,其中 m 为气体分子的质量,v 为分子的速度。
代入这个表达式,我们有P = 2 mv N / ΔtA。
考虑到 N = nNA,其中 n 为气体的物质量(摩尔数),NA 为阿伏伽德罗常数,我们可以得到 P = 2 nmNANA / ΔtA。
第十二章气体动理论题库

第十二章气体动理论第十二章气体动理论 (1)12.1平衡态理想气体物态方程热力学第零定律 (3)判断题 (3)难题(1题)中题(1题)易题(1题)选择题 (4)难题(1题)中题(1题)易题(1题)填空题 (5)难题(1题)中题(1题)易题(2题)计算题 (7)难题(1题)中题(2题)易题(2题)12.2物质的微观模型统计规律性 (13)判断题 (13)难题(0题)中题(0题)易题(0题)选择题 (14)难题(1题)中题(1题)易题(1题)填空题 (16)难题(0题)中题(1题)易题(1题)计算题 (17)难题(0题)中题(0题)易题(0题)12.3理想气体的压强公式 (19)判断题 (19)难题(0题)中题(0题)易题(2题)选择题 (20)难题(3题)中题(4题)易题(1题)填空题 (22)难题(0题)中题(4题)易题(3题)计算题 (24)难题(1题)中题(3题)易题(2题)12.4理想气体分子的平均平动动能与温度的关系 (28)判断题 (28)难题(0题)中题(0题)易题(3题)选择题 (29)难题(1题)中题(6题)易题(1题)填空题 (31)难题(5题)中题(6题)易题(3题)计算题 (36)难题(2题)中题(5题)易题(3题)12.5能量均分定理理想气体内能 (42)判断题 (42)难题(0题)中题(0题)易题(3题)选择题 (43)难题(0题)中题(2题)易题(1题)填空题 (44)难题(0题)中题(0题)易题(3题)计算题 (46)难题(1题)中题(1题)易题(1题)12.6麦克斯韦气体分子速率分布率 (49)判断题 (49)难题(0题)中题(1题)易题(2题)选择题 (50)难题(1题)中题(9题)易题(5题)填空题 (56)难题(2题)中题(5题)易题(7题)计算题 (60)难题(2题)中题(8题)易题(4题)12.8分子平均碰撞次数和平均自由程 (68)判断题 (68)难题(0题)中题(1题)易题(1题)选择题 (69)难题(1题)中题(4题)易题(2题)填空题 (71)难题(0题)中题(3题)易题(0题)计算题 (73)难题(1题)中题(1题)易题(3题)第十二章气体动理论12.1平衡态理想气体物态方程热力学第零定律判断题判断(对错)题每个小题2分;难题1201AAA001、如果容器中的气体与外界之间没有能量和物质的传递,则这种状态叫做平衡态………………………………………………………………………………………………()解:○1考查的知识点:对平衡态概念的理解○2试题的难易度:难○3试题的综合性:12-1 平衡态○4分析:如果容器中的气体与外界之间没有能量和物质的传递,气体的能量也没有转化为其他形式的能量,气体的组成及其质量均不随时间变化,则气体的物态参量不随时间的变化这种状态叫做平衡态正确答案:(错误)中题1201AAB001、两系统达到热平衡时,两系统具有一个共同的宏观性质——温度………()解:○1考查的知识点:对平衡态概念的理解○2试题的难易度:中○3试题的综合性:12-1--平衡态○4分析:平衡态的概念正确答案:(正确)易题1201AAC001、平衡态是一种动态平衡态…………………………………………………()解:○1考查的知识点:对平衡态概念的理解○2试题的难易度:易○3试题的综合性:12-1--平衡态○4分析:平衡态的概念正确答案:(正确)选择题难题1201ABA001、处于平衡态的一瓶氮气和一瓶氦气的分子数密度相同,分子的平均平动动能也相同,则他们()(A)温度、压强均不相同(B)温度、压强都相同(C)温度相同、但氦气压强小鱼氮气的压强(D)温度相同、但氮气压强小鱼氦气的压强解:○1考查的知识点:理想气体物态方程○2试题的难易度:难○3试题的综合性:综合运用了32kkTε=和p nkT=○4分析:理想分子气体的平均平动动能为32kkTε=仅与温度有关因此当分子的平均平动动能相同时,温度也相同,又由于理想气体物态方程p nkT=,分子数密度相同,所以气体的压强也相同正确答案:(C)中题1201ABB001、若理想气体的体积为V,压强为p,温度为T,一个分子的质量为m,k为玻尔兹曼常量,R为普适气体常量,则该理想气体的分子数为:()(A)pV / m;(B)pV /(kT);(C)pV /(RT);(D)pV / (mT).解:○1考查的知识点:理想气体物态方程○2试题的难易度:中○3试题的综合性:12-1理想气体物态方程的公式pV NkT=○4分析:理想气体物态方程的公式pV NkT=;式中N是体积V中的气体分子数,k 为玻尔兹曼常量,此题容易和另一个公式p nkT=混用,导致出错。
大学物理 部分公式

1.理想气体物态方程:pV=NkT 变形1:Pv=νRT (R=N A k)变形2:P=nkT (n=N/V为分子数密度)2.理想气体压强公式:P=(1/3)nmv^2 变形:P=2/3nεk (εk分子平均平动动能)3理想气体平均平动动能与温度关系:1/2mv^2=εk=3/2kT4方均根速率: Vrms=(3kT/m)^(1/2)= (3Rt/M)^(1/2)5自由度:单i=3 双刚=5 双非=7 三以上刚=6 ε =i1/2kT6理想气体内能:E=N A i1/2kT =i/2RT7三种统计速率:1)最概然速率V p=(2kT/m)^(1/2)= (2RT/M)^(1/2) 2)平均速率v =(8kT/πm)^(1/2) 3)4 8分子平均碰撞次数:Z,分子连续两次碰撞间的路程均值叫做平均自由程λλ=v/ Z Z =1.41πd ^2 vn 9准静态过程中体积变化做功:ΔW=PΔV=(Sv1v2)pdV10.摩尔定体热容:C v,m=dQ/dT dE=:C v,m* dT11热机效率:η=W/Q1 =(Q1-Q2)/Q1 =1-Q1/Q2 (Q1为吸热量 Q2为热源吸收量)12等体过程中V为常量,即dW=0 dQ=dE 吸收热量全部转化为内能13转动定理:M=Jα常见转动惯量1)中心轴细棒:ml^2 /12 2)圆柱体:mR^2 / 2 3)薄圆环J=mR24)端点轴细棒:J=ml2/14平行轴定理:J=J C+md215电容器电能:W=1/2 QU=1/2 CU216 电场能量密度:w=1/2εΕ217.磁场能量:W=1/2 LI2 密度w=W/V=B2/2μ19.毕奥撒法尔定律:dB=(μ0/4π)*(Idlsinθ/r^2)= (μ0/4π)*(Idl e r/r^2)20.运动电荷磁场:B=(μ0/4π)*(qvr/r^3)21.无限长直导线B=μ0I/2πr022.库伦定律 F=(1/4πε0)(q1q2/r^2)e r23圆形载流导线轴线上一点 B=(μ0/2)(R2I/(R2+x2)3/2) x>>R B=μ0IR2/2x3A-B 等温膨胀内能不变对外做功W1=从T1高温处吸热Q1W1=Q1=vRTT1ln(V2/V1)B-C 绝热膨胀对外做功等于气体减少的内能W2=vCv,m(T1-T2)C-D 等温压缩:外界对气体做功等于气体给低温热源的热量W3=Q2= vRTT2ln(V4/V3)。
分子平均平动动能-精品

12-4 理想气体分子平均平动动能与温度的关系
第五版
理想气体压强公式
p
2 3
n k
理想气体物态方程 p nkT
分子平均平动动能:
k
1mv2 2
3kT 2
微观量的统计平均 宏观可测量量
第十二章 气体动理论
1
物理学
12-4 理想气体分子平均平动动能与温度的关系
第五版
温度 T 的物理意义
第十二章 气体动理论
4
物理学
12-4 理想气体分子平均平动动能与温度的关系
第五版
2 理想气体体积为 V ,压强为 p ,温度为 T . 一个分子 的质量为 m ,k 为玻耳兹曼常 量,R 为摩尔气体常量,则该理想气体的分 子数为:
(A) pV m (B) pV(kT)
(C) pV(RT) (D) pV(mT)
k
1mv2 2
3kT 2
(1)温度是分子平均平动动能的量度.
k T
(2)温度是大量分子的集体表现.
(3)在同一温度下各种气体分子平均平 动动能均相等.
第十二章 气体动理论
2
物理学
12-4 理想气体分子平均平动动能与温度的关系
第五版
注意
热运动与宏观运动的区别:温度所 反映的是分子的无规则运动,它和物体 的整体运动无关,物体的整体运动是其 所有分子的一种有规则运动的表现.
解 p nkT
N nV pV kT
第十二章 气体动理论
5
第十二章 气体动理论
3
物理学
12-4 理想气体分子平均平动动能与温度的关系
第五版
讨论
1 一瓶氦气和一瓶氮气质量密度相同,分子 平均平动动能相同,且都处于平衡状态,则:
大学物理习题册答案

练习 十三知识点:理想气体状态方程、温度、压强公式、能量均分原理、理想气体内能一、选择题1. 容器中储有一定量的处于平衡状态的理想气体,温度为T ,分子质量为m ,则分子速度在x 方向的分量平均值为 (根据理想气体分子模型和统计假设讨论) ( )(A )x υ=(B )x υ= (C )m kT x 23=υ; (D )0=x υ。
解:(D)平衡状态下,气体分子在空间的密度分布均匀,沿各个方向运动的平均分子数相等,分子速度在各个方向的分量的各种平均值相等,分子数目愈多,这种假设的准确度愈高.2. 若理想气体的体积为V ,压强为p ,温度为T ,一个分子的质量为m ,k 为玻耳兹曼常量,R 为摩尔气体常量,则该理想气体的分子数为 ( )(A )pV /m ; (B )pV /(kT ); (C )pV /(RT ); (D )pV /(mT )。
解: (B)理想气体状态方程NkT T N R N RT m N Nm RT M M pV AA mol ====3.根据气体动理论,单原子理想气体的温度正比于 ( )(A )气体的体积; (B )气体的压强;(C )气体分子的平均动量;(D )气体分子的平均平动动能。
解: (D)kT v m k 23212==ε (分子的质量为m )4.有两个容器,一个盛氢气,另一个盛氧气,如果两种气体分子的方均根速率相等,那么由此可以得出下列结论,正确的是 ( )(A )氧气的温度比氢气的高; (B )氢气的温度比氧气的高; (C )两种气体的温度相同; (D )两种气体的压强相同。
解:(A) kT v m k 23212==ε,2222H O H O T T m m =(分子的质量为m ) 5.如果在一固定容器内,理想气体分子速率都提高为原来的2倍,那么 ( )(A )温度和压强都升高为原来的2倍;(B )温度升高为原来的2倍,压强升高为原来的4倍; (C )温度升高为原来的4倍,压强升高为原来的2倍; (D )温度与压强都升高为原来的4倍。
大学物理第5章题库(含答案)

大学物理第5章题库(含答案)05章气体动理论一、填空题(一)易(基础题)1、一定质量的气体处于平衡态,则气体各部分的压强相等(填相等或不相等),各部分的温度相等(填相等或不相等)。
2、根据能量按自由度均分原理,设气体分子为刚性分子,分子自由度为i,则当温度为T1时,(1)一个分子的平均能量为(平均总动能)ikT2i2;(2)摩尔理想气体的内能为(3)一个双原子分子的平均转动动能为kTRT;3、对于单原子分子理想气体,①体的内能;②3RT代表的物理意义为:1mol单原子分子理想气23R代表的物理意义为:单原子分子理想气体的定体摩尔热容2iPV。
24、自由度数为i的一定量的刚性分子理想气体,其体积为V,压强为p时,其内能E=5.两瓶不同种类的理想气体,它们温度相同,压强也相同,但体积不同,则它们分子的平均平动动能相同,单位体积内分子的总平动动能相同。
(均填相同或不相同)6.一定量的某种理想气体,装在一个密闭的不变形的容器中,当气体的温度升高时,气体分子的平均动能增大,气体分子的密度不变,气体的压强增大,气体的内能增大(均填增大、不变或减少)7、理想气体的压强公式为PnkT,理想气体分子的平均平动动能与温度的关系为k3kT28、有两瓶气体,一瓶是氧气,另一瓶是氢气(均视为刚性分子理想气体),若它们的压强、体积、温度均相同,则氧气的内能是氢气的▁▁1▁▁倍。
9、一容器内贮有气体,其压强为1atm,温度为27oC,密度为1.3kgm,则气体的摩尔质量为__3210____kgmol,由此确定它是__氧____气.31310、Nf(u)du表示的物理意义是表示速率分布在~d内的分子数------------------------------------。
11、òu2u1f(u)du表示的物理意义是表示速率分布在1~2范围内的分子数3___倍.5占总分子数的比率.12、在相同条件下,氧原子的平均动能是氧分子的平均动能的___(二)中(一般综合题)1、如图1所示,两条曲线分别表示相同温度下,氢气和氧气分子的速率分布曲线,则a表示▁氧▁▁气分子的速率分布曲线;b表示▁▁氢▁气分子的速率分布曲线。
【清华】清华大学《大学物理》习题库试题及答案_07_热学习题

氢气分子的平均碰撞频率 Z 和平均自由程 λ 的变化情况是:
(A) Z 和 λ 都增大一倍
(B) Z 和 λ 都减为原来的一半
(C) Z 增 大一 倍而 λ 减 为原 来的 一半
(D) Z 减 为原 来的 一半 而 λ 增 大一 倍
[
]
32.4465:在一封闭容器中盛有 1 mol 氦气(视作理想气体),这时分子无规则运动的平均
]
B
24.4126:如图表示的两个卡诺循环,第一个沿 ABCDA
进行,第二个沿 ABC′D′A 进行,这两个循环的效率η1 和η2
C C′
的关系及这两个循环所作的净功 W1 和 W2 的关系是
A
(A) η1 = η2 ,W1 = W2
D
D′
V
4126 图
(B) η1 > η2 ,W1 = W2
(C) η1 = η2 ,W1 > W2
[
]
E
B
30.4056:若理想气体的体积为 V,压强为 p,温度为 T,一
个分子的质量为 m,k 为玻尔兹曼常量,R 为普适气体常量,则该
理想气体的分子数为:
(A) pV / m
(B) pV / (kT)
A
O
V
(C) pV / (RT) (D) pV / (mT)
[
]
4101 图
31.4407:气缸内盛有一定量的氢气(可视作理想气体),当温度不变而压强增大一倍时,
( ) ( ) (A) 图中a表示氧气分子的速率分布曲线; v p O2 / v p H2 =4
( ) ( ) (B) 图中a表示氧气分子的速率分布曲线; v p O2 / v p H2 =1/4
分子平均平动动能:

分子平均平动动能:分子平均平动动能是描述分子热运动的一种物理量,它揭示了分子在热运动过程中的平均运动情况。
在我们日常生活中,热能是无处不在的,分子的平动动能是构成热能的基本要素之一。
本文将从定义、计算方法以及一些实际应用等方面来详细介绍分子平均平动动能。
首先,我们来看一下分子平均平动动能的定义。
分子平均平动动能是指一个系统中所有分子平动动能的平均值。
根据动能的定义,分子平均平动动能可以用公式K_avg = (1/2) mv^2 来表示,其中m是分子的质量,v是其速度。
这个公式表明,分子的运动速度越大,分子的平动动能也就越大。
那么如何计算分子平均平动动能呢?我们需要用到统计物理学中的一些基本概念和理论。
首先,我们需要知道系统中分子的数目N和总的平动动能E,那么分子平均平动动能K_avg =E/N。
在理论计算中,可以采用玻尔兹曼分布定律来确定分子速度的分布概率,进而计算出分子平均平动动能。
实际上,分子平均平动动能不仅仅是一个理论概念,它在很多实际应用领域都有很大的作用。
首先,分子平均平动动能是理解物质的热性质和热传导的基础。
在热力学中,平动动能的增加意味着系统的温度升高,而热传导则是分子平均平动动能在不同物体之间的传递。
此外,分子平均平动动能还在研究化学反应动力学和速率论方面具有重要意义。
在化学反应中,分子发生碰撞并因此发生反应。
分子平均平动动能的高低会对化学反应的速率和动力学过程产生影响。
分子平均平动动能还与气体的压力有密切关系。
根据理想气体状态方程,P V = N k T,其中P是气体的压力,V是气体的体积,N是气体的分子数,k是玻尔兹曼常量,T是气体的温度。
由此可见,温度升高和分子平均平动动能的增加,会导致气体的压强增加。
最后需要注意的是,分子平均平动动能只是热能的一部分,还有分子的转动动能和振动动能等。
这些能量组成了分子的总动能。
而热能是分子或粒子的总动能的表现形式,它包括热力学性质(如温度、热容等)和能量传递机制的研究。
12-4理想气体分子的平均平动动能与温度的关系讲解

则 pV NkT 或 p nkT
温度的微观本质
p
nkT 与压强公式
P
2 3
n k
比较
得
k
1 2
v2
3 2
kT
处于平衡态的理想气体,分子的平均平 动动能与气体的温度成正比。
例1 计算标准状态下,任何气体在1cm3体积中 含有的分子数 。
1 2 3
若各种气体的分子数密度分别为 n1,n2,n3,…
则混合气体的分子数密度为
n=n1+n2+n3+…
将n代入 p 2n / 3 ,得
p
2 3
n
2 3
(n1
n2
n3
)
p
2 3
n11
2 3
n2 2
2 3
n3 3
即 p p1 p2 p3
—— 道尔顿分压定律。
其中
p1
2 3
n11,
p2
2 3
n2 2 ,
p3
2 3
n3 3 ,
例3 有一容积为 10 cm3 的电子管,当温度为
300 K时用真空泵抽成高真空,使管内压强为 5×10-6 mmHg。求 (1) 此时管内气体分子的
数目; (2) 这些分子的总平动动能。
解 (1) 由理想气体状态方程得
N
pV kT
5106 133.3105 1.381023 300
12.4 温度的微观本质
一、理想气体温度与分子平均平动动能的关系
理想气体分子的平均平动动能为
1 v2 1 3kT
2
2
3 kT
2
理想气体分子平均平动动能与温度的关系

四、理想气体分子平均平动动能与温度的关系(可以用一个公式加以概括)k ε=kT v m 23212=1.简单推导:理想气体的物态方程:RT m N m N RT M m PV A ''== 而⎪⎭⎫ ⎝⎛=⎪⎭⎫ ⎝⎛=2221322132v m V N v m n P n=N/V 为单位体积内的分子数,即分子数密度, k =R /N A =1.38×10-23J·K -1称为玻尔斯曼常量。
所以:kT v m 23212= 这就是理想气体分子的平均平动动能与温度的关系,是气体动理论的另一个基本公式。
它表明分子的平均平动动能与气体的温度成正比。
气体的温度越高,分子的平均平动动能越大;分子的平均平动动能越大,分子热运动的程度越剧烈。
因此,温度是表征大量分子热运动剧烈程度的宏观物理量,是大量分子热运动的集体表现。
对个别分子,说它有多少温度,是没有意义的。
从这个式子中我们可以看出2.温度的统计意义该公式把宏观量温度和微观量的统计平均值(分子的平均平动动能)联系起来,从而揭示了温度的微观本质。
关于温度的几点说明1.由kT v m 23212=得021 02=v m T =,=ε,气体分子的热运动将停止。
然而事实上是绝对零度是不可到达的(热力学第三定律),因而分子的运动是用不停息的。
2.气体分子的平均平动动能是非常小的。
J K T 2110,300-==ε J K T 15810 ,10-==ε例1. 一容器内贮有氧气,压强为P=1.013×105Pa ,温度t=27℃,求(1)单位体积内的分子数;(2)氧分子的质量;(3)分子的平均平动动能。
解:(1)有P=nkT得 ()3252351045.2273271038.110013.1--⨯=+⨯⨯⨯==m kT P n (2)kg N M m A 262331031.51002.61032--⨯=⨯⨯==(3)J kT k 21231021.6)27327(1038.12323--⨯=+⨯⨯⨯==ε例2. 利用理想气体的温度公式说明Dalton 分压定律。
6-4 理想气体分子的平均平动动能与温度的关系
温度 T 的物理意义
k
1 2
mv2
3 2
kT
(1)温度是分子平均平动动能的量度.
k T
(2)温度是大量分子的集体表现.
(3)在同一温度下各种气体分子平均平 动动能均相等.
第六章 气体动理论
2
6-4 理想气体分子平均平动动能与温度的关系
注意
热运动与宏观运动的区别:温度所 反映的是分子的无规则运动,它和物体 的整体运动无关,物体的整体运动是其 中所有分子的一种有规则运动的表现.
第六章 气体动理论
3
6-4 理想气体分子平均平动动能与温度的关系
理想气体压强公式
p
2 3
n k
理想气体物态方程 p nkT
分子平均平动动能:
k
1 2
mv2
3 2
kT
微观量的统计平均 宏观可测量量
பைடு நூலகம்
方均根速率: v2 3kT m
第六章 气体动理论
3RT M
1
6-4 理想气体分子平均平动动能与温度的关系
大学物理:理想气体的温度
1 2 3 t m v k T 2 2
v
2
3 kT m
3RT M m ol
在相同温度下,由两种不同分子组成的混合气 体,它们的方均根速率与其质量的平方根成反比。
1 1 2 2 mv mv 1 1 2 2 2 2
v 12 v 22
m2 m1
3 t kT 2
宏观可测量量
微观量的统计平均值
理想气体分子的平均平动动能与温度成正比。 或者说: 温度 T 是分子平均平动动能的量度。 温度是大量分子集体运动的宏观表现,它反 映了大量分子集体运动的剧烈程度。
注意:
①温度公式反映了宏观量T 与微观量 t 之间的关系 T ∝ t 与气体性质无关; ②温度是大量分子无规则运动的集体表现, 单个分子的温度无意义。 ③温度平衡过程就是能量平衡过程。
例 理想气体体积为 V ,压强为 p ,温度为 T , 一个分子 的质量为 m ,k 为玻尔兹曼常量,R 为摩 尔气体常量,则该理想气体的分子数为:
(A)
pV m
(B) pV( kT ) (D)pV( m T )
(C) pV (RT )
解:
p nkT
pV N nV kT
2、方均根速率 由
讨论
一瓶氦气和一瓶氮气密度相同,分子平均平动动 能相同,而且它们都处于平衡状态,则它们 (A)温度相同、压强相同。
(B)温度、压强都不同。 (C)温度相同,但氦气的压强大于氮气的压强。 (D)温度相同,但氦气的压强小于氮气的压强。
N k 解: p nkT kT T V m p ( N ) p ( He ) m ( N ) m ( He ) 2 2
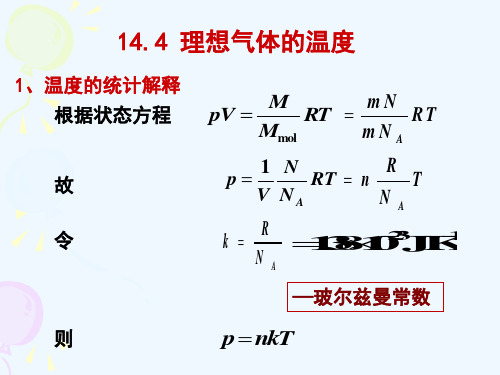
14.4 理想气体的温度
高二物理竞赛理想气体的温度和分子平均平动动能课件

(1) 理想气体的内能只取决于分子运动的自由度 如质点被限制在平面或曲面上运动,则 i= 2;
试证:室温由 T1 升高到 T2,房间内气体的内能不变。
i
和热力
学温度T,或者说理想气体的内能只是温度T的单值函数, 如静止于地面的物体,相对于地面,它的机械能(包括动能和重力势能)等于零;
实验和理论证明,分子速率分布函数 f (v) 的具体形式依赖于系统的性质和宏观条件。
1、 理想气体的温度和分子平均平动动能
由
p
nkT
2 3
n t
t
3 2
kT
平均平动动能只与温度有关
理想气体温标或热力学温标
说明了温度的微观意义,即热力学温度是分子平均平动动 能的量度,气体的温度越高,分子的平均平动动能就越大; 分子的平均平动动能越大,分子热运动的程度越激烈。因 此, 可以说温度反映了物体内部分子无规运动的剧烈程度。
设总分子数N,其中速率分布在v ~ v+dv速率区间内的分
子数 dNv
速率分布函数
则
dNv = f (v) dv
N
速率 在v 附近的单位速率区间内的分子数占总分子数的百 分比。
用“概率”来解释
dNv
一个分子的速率在 v 附近 dv 区间内的概率
N
f (v)
一个分子的速率在 v 附近单位速率区间内的概率
单原子分子 经典励志短句(二)
不要志气高大,倒要俯就卑微的人。不要自以为聪明。
刚性双原子分子 刚性双多原子分子
与其当一辈子乌鸦,莫如当一次鹰。
k
3 kT 2
k
5 kT 2
k 3kT
理想气体的内能
气体的内能是指它的内动能,即它所包含的所有分子的动 能(相对于质心参考系)和分子间的相互作用势能的总和。
7-4理想气体分子的平均平动动能与温度的关系

8
p = nkT
物理学 教程
7-4 理想气体分子平均平动动能与温度的关系 理想气体分子平均平动动能与温度的关系
3 一容器内储有氧气,温度为 oC,其 一容器内储有氧气,温度为27 压强为1.02×105Pa,求: (1)气体分子数密 压强为 , ) 度 ; (2)氧气的密度 (3)分子的平均平动 )氧气的密度; ) 动能; 动能 (4)分子间的平均距离. )分子间的平均距离. 解 (1) n = p / kT = 2.44×1025 m−3
M = mN A ,
m ′ = mN
m′ N R ∴ pV = RT ⇒ p = T M V NA
理想气体状态方程可改写为: 理想气体状态方程可改写为: 其中: 其中:
p = nkT
n= N V
N A = 6.02 × 10 23 mol −1
玻尔兹曼常数
k=
R = 1.3806513 × 10 − 23 J ⋅ K −1 NA
2 p = nε k 3
( 平均平动动能只与温度有关)
2 2 2 ∴ p = n1 ε k + n2 ε k + K + nn ε k 3 3 3 p = p1 + p 2 + K + p n 于是有
这就是说, 总压强等于各气体分压强之和, 这就是说, 总压强等于各气体分压强之和,这就 是道尔顿分压定律。 是道尔顿分压定律。
6
物理学 教程
7-4 理想气体分子平均平动动能与温度的关系 理想气体分子平均平动动能与温度的关系
讨论
1 一瓶氦气和一瓶氮气密度相同,分子平均 一瓶氦气和一瓶氮气密度相同, 平动动能相同,而且都处于平衡状态, 平动动能相同,而且都处于平衡状态,则: (A)温度相同、压强相同 )温度相同、压强相同. (B)温度、压强都不同 )温度、压强都不同. (C)温度相同,氦气压强大于氮气压强 )温度相同,氦气压强大于氮气压强. (D)温度相同,氦气压强小于氮气压强 )温度相同,氦气压强小于氮气压强. N k 解 p = nkT = kT = ρ T V m
温度是分子平均动能的标志

温度是分子平均动能的标志温度是表示物体冷热程度的物理量,微观上来讲是物体分子热运动的剧烈程度。
温度是表征大量分子热运动剧烈程度的宏观物理量,含有统计意义,是大量分子热运动的集体表现。
对个别分子,说它有多少温度,是没有意义的。
分子作无规则运动所具有的动能叫做“分子的动能”。
由于各个分子的运动速度是不同的,因而分子的动能亦不相等,而它们动能的平均值,叫做“分子平均动能”。
物体中分子热运动的速率大小不一,所以各个分子的动能也有大有小,而且在不断改变。
在热现象的研究中,我们关心的是组成系统的大量分子整体表现出来的热学性质,因而重要的不是系统中某个分子的动能大小,而是所有分子动能的平均值。
物质的温度是它的分子热运动的平均动能的标志。
更细致来看,温度是分子平均平动动能的标志, 不同种类的分子, 在相同的温度下平均平动动能是相同的, 而平均动能还与分子的自由度有关. 对于自由度不同的分子, 即使温度相同平均动能也不同。
通过对自由度的认识, 我们不难知道: 分子的运动具有平动、转动、振动三种形式. 从能量角度说也就是分子动能包含平动动能、转动动能、振动动能。
又有能量均分定理:在温度为T 的平衡状态下, 物质( 气体、液体或固体) 分子的每一个自由度都具有相同的平均动能, 其大小都等于1/2kT 。
因此, 如果某种气体的分子有t 个平动自由度, r 个转动自由度, s 个振动自由度, 则分子的平均平动动能, 平均转动动能和平均振动动能就分别:t/2KT,r/2KT,s/2KT,而分子的平均总动能即为1/2(t+r+s)KT。
由此可见,分子的平均动能包含平动动能, 转动动能和振动动能, 即E=i/2kT , (其中k 为玻尔兹曼常数, T 为物质的温度, i 为分子的自由度)对于单原子分子, i = 3; 对于双原子分子, i = 6; 对于三原子和多原子分子, i 视具体情况定, 最多可以取3 n. 刚性分子表现为平动和转动, 所以, 这种情况下单原子分子i = 3, 双原子分子i = 5, 三原子及以上分子i= 6。
分子平动动能

分子平动动能简介在物理学和化学中,分子平动动能是指分子在空间中的直线运动所具有的能量。
它是分子热运动的一部分,与分子的质量和速度有关。
分子平动动能的理解对于研究物质的性质和行为非常重要。
在本文档中,我们将详细讨论分子平动动能的定义、计算方法以及与其他能量形式的关系。
分子平动动能的定义分子平动动能是分子在三维空间中的直线运动所具有的能量。
它是分子热运动中的一项重要能量形式。
根据动能定理,分子平动动能可以通过以下公式计算:KE = 1/2 * m * v^2其中,KE代表分子平动动能,m代表分子的质量,v代表分子的速度。
分子平动动能的计算要计算分子平动动能,我们需要知道分子的质量和速度。
分子的质量可以通过实验测量得到,通常以单位为kg或g表示。
分子的速度也可以通过实验测量得到,通常以单位为m/s表示。
分子平动动能的计算公式如下:KE = 1/2 * m * v^2其中,KE代表分子平动动能,m代表分子的质量,v代表分子的速度。
将分子的质量和速度代入公式即可得到分子平动动能的数值。
分子平动动能与其他能量形式的关系在热力学中,分子平动动能与其他能量形式之间存在着密切的关系。
分子平动动能是热能的一种形式,它与温度和系统的热容量有关。
根据分子平均动能定理,一个系统内所有分子的平均动能与温度成正比。
换句话说,当温度升高时,分子平均动能也会增加。
因此,分子平动动能可以用于描述系统的温度。
另外,分子平动动能也与系统的热容量有关。
热容量是指在吸收或释放一定量的热能时,系统温度的变化量。
根据热容量的定义,它可以用分子平动动能来表示。
总体而言,分子平动动能与系统的温度和热容量密切相关,通过分子平动动能的计算和研究,我们可以深入了解物质的热性质和行为。
应用案例分子平动动能在许多领域都有重要的应用。
下面是几个相关的应用案例:1.化学反应动力学:在化学反应中,分子的运动速度和动能决定了反应的速率。
研究分子平动动能可以帮助我们理解反应速率的变化和反应机理。
气体的分子速度决定其温度

气体的分子速度决定其温度气体是由大量微小分子组成的物质,具有高度扩散性和可压缩性。
而气体的温度则是描述其分子平均运动状况的物理量。
分子速度是决定气体温度的重要因素之一,分子速度越高,温度越高。
首先,为了理解分子速度对温度的影响,我们需要了解分子动理论。
根据分子动理论,气体中的分子以高速无规则运动,不断碰撞和相互作用。
这种运动使得分子具有动能,其大小与分子速度相关。
气体的温度是分子平均运动的一种衡量指标。
更具体地说,温度与气体分子的平均动能成正比。
而分子的动能取决于其速度的平方。
因此,气体温度增加意味着分子速度的增加,反之亦然。
那么,为什么分子速度决定着气体的温度呢?这涉及到分子碰撞的动能转移过程。
当气体分子之间发生碰撞时,它们的动能会互相转移。
碰撞速度越高,动能转移越大。
因此,如果气体中的分子速度越高,它们之间的碰撞能量也将更大。
通过大量分子间的碰撞,快速运动的分子将动能转移给其他分子,使整个气体系统的分子能量分布趋于均衡。
当分子的平均速度增加时,它们之间碰撞所带来的平均动能转移也增加。
而分子速度的增加,又与气体的温度正相关。
因此,气体的分子速度决定着其温度。
此外,根据麦克斯韦-玻尔兹曼分布定律,分子速度的分布在给定温度下具有特定的概率分布。
即使在相同温度下,不同分子的速度也存在一定的差异,呈现高斯分布。
这意味着气体的分子速度是多样的,其中包括一小部分高速分子和许多较慢的分子。
另外,气体的温度还受到其他因素的影响,如分子间相互作用力、气体的种类和压力等。
分子间的相互作用力可以改变气体分子之间碰撞时的动能转移过程,从而影响气体的温度。
不同种类的气体分子相对质量的差异也会导致它们具有不同的速度分布和温度。
此外,气体的压力增加会导致分子间的碰撞频率增加,进而提高气体的温度。
总之,气体的分子速度对其温度具有重要影响。
分子速度越高,气体的温度越高。
分子速度决定着分子间碰撞的动能转移过程,进而在大量分子间形成能量均衡的系统。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
四、理想气体分子平均平动动能与温度的关系
(可以用一个公式加以概括)
k ε=kT v m 23212=
1.简单推导:理想气体的物态方程:RT m N m N RT M m PV A '
'== 而⎪⎭⎫ ⎝⎛=⎪⎭⎫ ⎝⎛=2221322132v m V N v m n P n=N/V 为单位体积内的分子数,即分子数密度, k =R /N A =1.38×10-23J ·K -1称为玻尔斯曼常量。
所以:kT v m 2
3212= 这就是理想气体分子的平均平动动能与温度的关系,是气体动理论的另一个基本公式。
它表明分子的平均平动动能与气体的温度成正比。
气体的温度越高,分子的平均平动动能越
大;分子的平均平动动能越大,分子热运动的程度越剧烈。
因此,温度是表征大量分子热运
动剧烈程度的宏观物理量,是大量分子热运动的集体表现。
对个别分子,说它有多少温度,
是没有意义的。
从这个式子中我们可以看出
2.温度的统计意义
该公式把宏观量温度和微观量的统计平均值(分子的平均平动动能)联系起来,从而揭示
了温度的微观本质。
关于温度的几点说明
1.由kT v m 23212=得02
1 02=v m T =,=ε,气体分子的热运动将停止。
然而事实上是绝对零度是不可到达的(热力学第三定律),因而分子的运动是用不停息的。
2.气体分子的平均平动动能是非常小的。
J K T 2110
,300-==ε J K T 15
810 ,10-==ε
例1. 一容器内贮有氧气,压强为P=1.013×105Pa ,温度t=27℃,求(1)单位体积内的分
子数;(2)氧分子的质量;(3)分子的平均平动动能。
解:(1)有P=nkT
得 ()
325235
1045.2273271038.110013.1--⨯=+⨯⨯⨯==m kT P n (2)kg N M m A 26233
1031.510
02.61032--⨯=⨯⨯==
(3)J kT k 21231021.6)27327(1038.12
323--⨯=+⨯⨯⨯==ε
例2. 利用理想气体的温度公式说明Dalton 分压定律。
解:容器内不同气体的温度相同,分子的平均平动动能也相同,即
k kn k k εεεε==== 21
而分子数密度满足
∑=
i n n 故压强为
()∑∑∑∑=⎪⎭
⎫ ⎝⎛=⎪⎭⎫ ⎝⎛===i ki i k i k i k P n n n n P εεεε32323232 即容器中混合气体的压强等于在同样温度、体积条件下组成混合气体的各成分单独存在时的
分压强之和。
这就是Dalton 分压定律。
例3. 证明Avogadro 定律。
由 n=P/kT
两边同乘以体积V ,则
N=PV/RT
结论:在同温同压下,相同体积的任何理想气体所含的分子数相同,这就是Avogadro 定律。
课堂练习题:
1. 若在某个过程中,一定量的理想气体的内能E随压
强p的变化关系为一直线(其延长线过E-p图的原点),
则该过程为
(A)等温过程. (B)等压过程.
(C)等容过程. (D)绝热过程.
4. 一瓶氦气和一瓶氮气密度相同,分子平均平动
动能相同,而且它们都处于平衡状态,则它们 (A)温度相同、压强相同.
(B)温度、压强都不相同.
(C)温度相同,但氦气的压强大于氮气的压强.
(D)温度相同,但氦气的压强小于氮气的压强.
5. 若室内生起炉子后温度从15℃升高到27℃,而室内气压不变,则此时室内的分子数
减少了
(A) 0.5%. (B)4%.
(C)9%. (D)21%.
Welcome 欢迎您的下载,资料仅供参考!。
