酸碱盐综合复习基础
酸碱盐复习提纲

酸碱盐复习提纲一、物质分类及其概念1、单质:由一种元素组成的纯净物。
例如;铁,氧气2、氧化物:由两种元素组成且一种元素是氧元素的化合物。
例如:二氧化碳3、酸:电离时生成的阳离子全部都是氢离子的化合物如:HCl==H+ + Cl -HNO3==H+ + NO3-H2SO4==2H+ + SO42-4、碱:电离时生成的阴离子全部都是氢氧根离子的化合物如:KOH==K+ + OH -NaOH==Na+ + OH -Ba(OH)2==Ba2+ + 2OH -5、盐:电离时生成金属阳离子(或铵根阳离子)和酸根离子的化合物如:KNO3==K+ + NO3-Na2SO4==2Na+ + SO42-BaCl2==Ba2+ + 2Cl –NH4NO3==NH4+ +NO3-6、有机物:含碳的化合物。
CO,CO2,碳酸盐除外。
练习:下列物质由C H O Na 中的一种或几种元素组成,写物质的化学式①常温下呈固态的单质,②金属氧化物,常温下呈液态的氧化物③酸,④碱,⑤盐,⑥有机物二、盐酸浓盐酸是的水溶液,有性,打开浓盐酸的瓶塞,看到现象,原因是。
练习1一瓶敞口放置在空气一段时间的浓盐酸,下列量是如何变化的?(填“变大”或“变小”或“不变”)溶液溶质质量;溶液溶剂质量;溶液质量;溶液浓度。
练习2实验室制取二氧化碳选取的药品是和。
为什么不选择浓盐酸?三、硫酸1、浓硫酸有性,常作为某些气体的干燥剂。
练习2一瓶敞口放置在空气一段时间的浓硫酸,下列量是如何变化的?(填“变大”或“变小”或“不变”)溶液溶质质量;溶液溶剂质量;溶液质量;溶液浓度。
2、浓硫酸溶于水放热。
小结:物质溶于水放热的是、、。
练习下列物质溶于水时,溶液温度明显降低的是()A.氯化钠B.硝酸铵C.浓硫酸D.氢氧化钠3、浓硫酸具有强烈的(脱水性),能将皮肤、衣服、木材中的氢氧元素以水的形式脱去,使其变。
4、浓硫酸不慎沾到皮肤或衣服上的处理方法。
5、浓硫酸的稀释方法是。
酸碱盐知识点复习
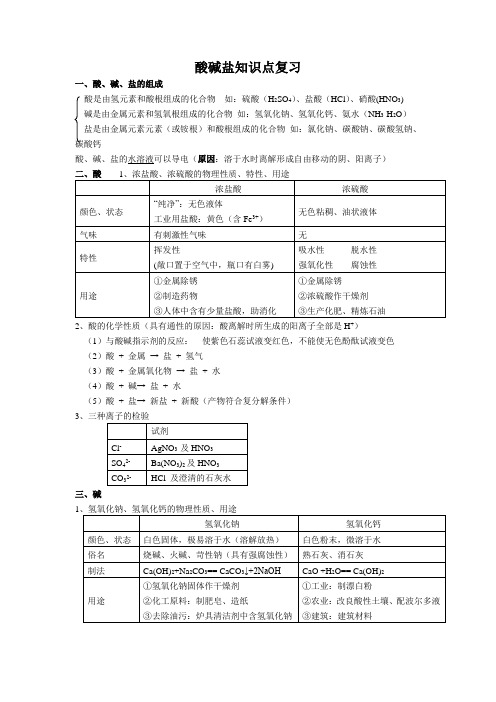
酸碱盐知识点复习一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)盐是由金属元素元素(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠、碳酸氢钠、碳酸钙酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)2、酸的化学性质(具有通性的原因:酸离解时所生成的阳离子全部是H+)(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)酸+ 金属→ 盐+ 氢气(3)酸+ 金属氧化物→ 盐+ 水(4)酸+ 碱→ 盐+ 水(5)酸+ 盐→ 新盐+ 新酸(产物符合复分解条件)3三、碱12、碱的化学性质(具有通性的原因:离解时所生成的阴离子全部是OH-)(1)与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)碱+ 非金属氧化物→ 盐+水(CO例外)(3)碱+ 酸→ 盐+水(4)碱+ 盐→ 新盐+新碱(反应物均可溶,产物符合复分解条件)四、盐1、氯化钠、碳酸钠、碳酸氢钠、碳酸钙2、盐的化学性质(1)盐+ 金属→ 新盐+ 新金属(2)盐+ 酸→ 新盐+ 新酸(3)盐+ 碱→ 新盐+ 新碱(4)盐+ 盐→ 新盐+ 新盐注意:①酸碱盐之间的反应都属于复分解反应,要发生反应的活,就必须满足生成物中有沉淀或有气体或有水生成时,②常见溶液的颜色:含Cu2+的溶液呈蓝色;含Fe3+的溶液呈黄色;含Fe2+的溶液呈浅绿色③常见沉淀的颜色:Cu(OH)2是蓝色沉淀;Fe(OH)3是红褐色沉淀;常见7种白色沉淀(如CaCO3、BaCO3、Mg(OH)2、Ag2CO3、Al(OH)3。
AgCl、BaSO4等)。
在上述沉淀中只有AgCl和BaSO4不溶于稀硝酸,其余沉淀都可以溶于酸。
四、中和反应溶液酸碱度的表示法——pH1、定义:酸与碱作用生成盐和水的反应2、应用:(1)改变土壤的酸碱性(2)处理工厂的废水(3)用于医药3、溶液酸碱度的表示法——pH(1酸性增强中性碱性增强(2)pH的测定:最简单的方法是使用pH试纸用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)(3)酸雨:正常雨水的pH约为5.6(因为溶有CO2)pH<5.6的雨水为酸雨。
(完整版)酸碱盐总复习综合练习题目精华版

酸碱盐总复习一、酸1、常见的酸的特性注意:⑴浓硫酸溶于水时会放出大量的热。
因此,稀释浓硫酸时,一定要使浓硫酸沿器壁慢慢注入水里,并不断搅拌,使产生的热量迅速扩散,切不可把水倒入浓硫酸里。
⑵浓硫酸的脱水原理指它能把木材、纸张、蔗糖等物质中的氢元素和氧元素按水分子的组成比夺取出来,使它们变黑、碳化,是化学变化。
2、酸的化学性质酸溶液中都含有__________,所以酸具有相似的化学性质。
(1)酸溶液与指示剂作用酸溶液能使_____________________变_________。
(2)酸+活泼金属反应→盐+H2↑Mg + HCl =Al + HCl =Fe + HCl =Zn + HCl =Mg+ H2SO4 =Al + H2SO4 =Zn + H2SO4 =Fe+ H2SO4 =(3)酸+碱→盐+水(中和反应属于复分解反应)HCl+ NaOH=HCl+ Al(OH)3=HCl+ Mg(OH)2﹦HCl+ Fe(OH)3﹦H2SO4+ Mg(OH)2﹦H2SO4+ Cu(OH)2﹦(4)酸+金属氧化物→盐+水CuO + H2SO4 =Fe2O3+ H2SO4 =(5)酸+某些盐→新盐+新酸CaCO3 + HCl =Na2CO3 + HCl =AgNO3+ HCl =Na2CO3 + H2SO4 =CaCO3 + H2SO4 =BaCl2+ H2SO4 =二、碱1.常见的碱的性质2.碱的化学性质碱溶液中都有_________,所以碱具有相似的化学性质。
(1)碱溶液与指示剂作用碱溶液能使______________________变_____,能使________________________变______。
(2)酸+碱→盐+水(中和反应属于复分解反应)(3)碱溶液+非金属氧化物→盐+水实验室检验CO2气体: CO2 + Ca(OH)2 =实验室吸收CO2气体:CO2 + NaOH =SO2 + Ca(OH)2 =SO2 + NaOH=(4)碱溶液+某些盐溶液反应→新盐+新碱NaOH + FeCl3 =Ca(OH)2 + CuCl2 =Ca(OH)2 + Na2CO3 =三、盐2、盐的化学性质(1)可溶性盐+较活泼金属→新盐+较不活泼金属湿法炼铜:Fe+ CuSO4=Cu+ AgNO3=Fe+ AgNO3=(2)酸+某些盐→新盐+新酸(3)碱溶液+某些盐溶液反应→新盐+新碱(4)可溶性盐+可溶性盐→另外两种盐NaCl+ AgNO3=Na2CO3+ CaCl2=CuSO4+ BaCl2=四、金属活动性顺序表K、Ca、Na、_____、_____、_____、_____、Sn、Pb、(H)_____、Hg、_____、Pt、Au金属活性依次减弱注意:Fe发生置换反应后显+2价;五、复分解反应⑴定义:两种化合物互相交换成分,生成另外两种化合物,这样的反应叫做复分解反应。
九年级化学酸碱盐知识点归纳

九年级化学酸碱盐知识点归纳一、酸碱盐的基本概念酸:电离时生成的阳离子全部是氢离子的化合物。
如:HCl、H2SO4、HNO3、CH3COOH 等。
碱:电离时生成的阴离子全部是氢氧根离子的化合物。
如:NaOH、KOH、Ca(OH)2、Ba(OH)2、NH3·H2O等。
盐:由金属离子(或铵根离子)和酸根离子组成的化合物。
如:NaCl、Na2CO3、CuSO4、NH4Cl等。
二、酸碱盐的通性酸的通性:使紫色石蕊试液变红,无色酚酞试液不变色。
与活泼金属反应生成盐和氢气。
与金属氧化物反应生成盐和水。
与碱反应生成盐和水。
与盐反应生成新盐和新酸。
碱的通性:使紫色石蕊试液变蓝,无色酚酞试液变红。
与非金属氧化物反应生成盐和水。
与酸反应生成盐和水。
与盐反应生成新盐和新碱。
盐的通性:有些盐能与酸反应生成新盐和新酸。
有些盐能与碱反应生成新盐和新碱。
有些盐能与某些盐反应生成两种新盐。
三、酸碱盐之间的反应酸碱中和反应:酸和碱反应生成盐和水,这类反应属于复分解反应。
如:HCl + NaOH = NaCl + H2O。
盐与酸的反应:生成新盐和新酸。
如:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑。
盐与碱的反应:生成新盐和新碱。
如:CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4。
盐与盐的反应:生成两种新盐。
如:Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl。
四、酸碱盐在生活中的应用酸:用于清洁金属表面、除锈、生产化肥等。
碱:用于中和酸性废水、生产洗涤剂、肥皂等。
盐:用于调味、防腐、生产化学原料等。
五、常见的酸碱指示剂紫色石蕊试液:遇酸变红,遇碱变蓝。
无色酚酞试液:遇酸不变色,遇碱变红。
六、溶液的酸碱度pH值:表示溶液酸碱度的数值,范围为0-14。
pH < 7为酸性,pH = 7为中性,pH > 7为碱性。
酸碱指示剂与pH试纸:用于测定溶液的酸碱度。
七、常见的酸碱盐及其性质盐酸(HCl):无色液体,具有刺激性气味,能与多种物质发生反应。
酸碱盐基本知识复习

《物质分类》知识总结一、酸碱盐的定义及组成酸、碱、盐的水溶液可以导电,其原因是:溶于水时电离形成自由移动的阴阳离子。
电离方程式:用化学符号表示物质电离成自由移动离子的过程。
HCl= HNO3=Ba(OH)2= NaOH=Fe2(SO4)3= NaHCO3=注意:电离方程式左右两边正负电荷之和相等。
二、酸1、酸的再分类:1)按照每个酸分子所能电离出的H+个数(初学阶段可简单理解为酸分子中含有的H原子个数)分为:一元酸:每个酸分子能电离出个H+,如HCl、HNO3、CH3COOH(醋酸)二元酸:每个酸分子能电离出个H+,如H2SO4、H2SO3、H2CO3、H2S三元酸:每个酸分子能电离出个H+,如H3PO42)按照酸分子中是否含有氧元素可分为:含氧酸:如HNO3、H2SO4、H2SO3、H2CO3、H3PO4 等无氧酸:如HCl、H2S 等3)按照酸分子中挥发性可分为:易挥发性的酸:盐酸硝酸等难挥发性的酸:硫酸磷酸(H3PO4) 等4)按照酸酸的强弱分为:强酸:盐酸硝酸硫酸高氯酸(HClO4)等弱酸:醋酸碳酸次氯酸(HClO)硅酸(H2SiO3)等2、酸的通性:具有通性的原因:酸电离时所生成的阳离子全部是。
(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)金属 + 酸→H2↑+盐。
举例出实验室制氢气的所有反应。
结论:这类反应能够发生的条件是该金属在“金属活动性顺序”中的位置应处于的前面!)(3)金属氧化物+ 酸→水+盐。
写出氧化铜、氧化钙、氧化镁、氧化铁与酸的反应。
注意:并非所有的金属氧化物均能和碱反应生成盐和水!例如Mn2O7并不能和碱反应生成盐和水。
(4)碱+酸→盐 + 水(酸碱中和反应)写出醋酸、盐酸、硫酸和氨水的反应。
(5)盐 + 酸→新盐 + 新酸写出实验室制备二氧化碳的反应。
思考:NaCl +H2SO4→?是不是任何一种酸和盐都能发生反应?盐和酸反应的条件是什么?。
(完整版)高一化学——酸碱盐专题复习资料

酸碱盐专题一、几种常见的酸1.盐酸是HCl的水溶液。
纯净的浓盐酸是无色。
盐酸具有挥发性,浓盐酸在空气里会形成白雾。
2.浓硫酸:无色液体、无味;(1)有吸水性,在实验室中常用它作干燥剂。
(2)浓硫酸具有强腐蚀性,使用时必须十分小心。
它能夺取纸张、木材、布料、皮肤里的水分,生成黑色的炭。
(3)稀释浓硫酸的正确操作:将浓硫酸沿着烧杯壁缓慢地注入盛有水的烧杯里,用玻璃棒不断搅动。
3.常见的酸有盐酸、硫酸、硝酸、碳酸、醋酸等。
浓盐酸和浓硝酸都具有挥发性。
浓硫酸具有吸水性、脱水性和强氧化性,醋酸也具有挥发性。
4.酸有一些相似的化学性质(1)能使酸碱指示剂显示不同的颜色酸溶液使使紫色的石蕊试液变红色,可使无色的酚酞试液不变色;(2)能与多种活泼金属反应,生成氢气。
Fe+ 2HCl ==FeCl2 + H2↑ Zn+ H2SO4 ==ZnSO4 + H2↑2Al+ 6HCl==2AlCl3 + 3H2↑ 2Al+ 3H2SO4== Al2(SO4)3 + 3H2↑(3)能与某些金属氧化物反应,生成水。
铁锈+盐酸:Fe2O3 + 6HCl====2FeCl3 + 3H2O(黄色溶液);铁锈+硫酸Fe2O3 + 3H2SO4====Fe2(SO4)3 + 3H2O(4)酸与碱反应(写化学方程式)⑴盐酸中和氢氧化钠:NaOH + HCl = NaCl + H2O (中和反应)(5)酸与某些盐反应生成新盐和新酸。
HCl+ AgNO3 ==AgCl↓+ HNO3H2SO4 + BaCl2==BaSO4↓+ HClCaCO3 + 2HCl = CaCl2 + H2O + CO2↑例题1.(07山东)下列质量增加的变化有一种与其它三种存在本质的区别,这种变化是A.长期放置在空气中的氢氧化钠质量增加B.长期敞口放置的浓硫酸质量增加C.久置的生石灰质量增加D.久置的铁钉生锈质量增加例题2.(07济南).某同学设计的下列各实验方案中,你认为不能达到实验目的的是A.用燃着的木条鉴别二氧化碳和氧气B.加入适量的澄清的石灰水,以除去CaCl2溶液中的HClC.用浓硫酸除去氢气中混有的水蒸气D.用石蕊试液鉴别澄清的石灰水和氢氧化钠溶液例题3.下列含氧酸中,易挥发的是( )A.浓盐酸B.浓硫酸C.浓硝酸D.稀硫酸二、几种常见的碱1、常见的碱:NaOH 、Ca(OH)2、 KOH 、氨水(NH3·H2O)潮解:氢氧化钠暴露在空气中时容易吸收水分,表面潮湿并逐渐溶解,这种现象叫做潮解。
第一章 酸碱盐复习(知识点_加试题_附答案)

初三化学《酸-碱-盐》知识点一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物 如:硫酸(H 2SO 4)、盐酸(HCl )、硝酸(HNO 3) 碱是由金属元素和氢氧根组成的化合物 如:氢氧化钠、氢氧化钙、氨水(NH 3·H 2O ) 盐是由金属元素元素(或铵根)和酸根组成的化合物 如:氯化钠、碳酸钠酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子) 二、酸1、浓盐酸、浓硫酸的物理性质、特性、用途浓盐酸浓硫酸颜色、状态 “纯净”:无色液体工业用盐酸:黄色(含Fe 3+) 无色粘稠、油状液体 气味 有刺激性气味无特性挥发性(敞口置于空气中,瓶口有白雾)吸水性 脱水性 强氧化性 腐蚀性 用途①金属除锈 ②制造药物③人体中含有少量盐酸,助消化①金属除锈②浓硫酸作干燥剂 ③生产化肥、精炼石油2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H +)(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色,不能使无色酚酞试液变色 (2)金属 + 酸 → 盐 + 氢气 (3)碱性氧化物 + 酸 → 盐 + 水 (4)碱 + 酸 → 盐 + 水(5)盐 + 酸 → 另一种盐 + 另一种酸(产物符合复分解条件)3、三种离子的检验试剂 Cl -AgNO 3 及HNO3SO 42- ①Ba(NO 3)2及HNO 3②HCl 及BaCl 2 CO 32-HCl 及石灰水三、碱1、氢氧化钠、氢氧化钙的物理性质、用途氢氧化钠氢氧化钙颜色、状态 白色固体,极易溶于水(溶解放热)白色粉末,微溶于水 俗名烧碱、火碱、苛性钠(具有强熟石灰、消石灰腐蚀性)制法Ca(OH)2+Na 2CO 3== CaCO 3↓+2NaOHCaO +H 2O== Ca(OH)2 用途①氢氧化钠固体作干燥剂 ②化工原料:制肥皂、造纸 ③去除油污:炉具清洁剂中含氢氧化钠①工业:制漂白粉②农业:改良酸性土壤、配波尔多液 ③建筑:2、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH -)(1)碱溶液与酸碱指示剂的反应: 使紫色石蕊试液变蓝色,使无色酚酞试液变红色 (2)酸性氧化物+碱 → 盐+水 (3)酸+碱 → 盐+水(4)盐+碱 → 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件) 注:①难溶性碱受热易分解(不属于碱的通性) 如Cu(OH)2 ΔCuO +H 2O 2Fe(OH)3 ΔFe 2O 3+3H 2O②常见沉淀:AgCl ↓ BaSO 4↓ Cu(OH)2↓ F e(OH)3↓ Mg(OH)2↓ BaCO 3↓ CaCO 3↓ ③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
第一章酸碱盐知识点复习

酸碱盐复习建议一、必须熟练掌握的知识1、元素符号、化合价、书写化学式2.酸、碱、盐的认识:二、写出下列物质的俗名和化学式石灰石______;纯碱、苏打________食盐_________;干冰________;铁锈__________;胃舒平____________;生石灰____________;草木灰___________;小苏打____________;氯化亚铁硫酸铵沼气___________;酒精_____________;碱石灰__________;食醋_________;三、酸、碱、盐、氧化物的概念:1、判断下列物质化学式属酸、碱、盐:NaHCO3 ()BaCl2()NaOH()HClO()KMnO4()NH3·H2O()Ca(OH)2()2、(1)由H、C、O、Na三种元素按要求写出化学式:气体单质固体单质非金属氧化物金属氧化物酸碱盐。
四、必须记忆的颜色黄色溶液:含的溶液如、、蓝色溶液:含的溶液如、、浅绿色溶液:含的溶液如、、红褐色沉淀:蓝色沉淀:白色沉淀:、(不溶于稀硝酸)白色沉淀:、、可溶于稀硝酸)黑色固体粉末:、、等红色固体粉末:、等五、反应类型:1、四大基本反应类型的定义并各举一例:化合反应:分解反应:置换反应:复分解反应:中和反应的实质并一例:2、判断下列反应是哪一类反应:C + CuO─NaOH + H2SO4─CO2 + H2O —H2O2─六、反应条件:金属活动顺序表:1、金属与酸反应:判断是否反应生成氢气:Cu + H2SO4——Zn + HNO3——Fe + H2SO4——Al + HCl——Mg + H2SO4——Ag + HCl——(1)反应条件是?(2)哪些酸与金属反应不能生成氢气2、金属与盐溶液反应:判断下列反应是否反应:Fe + CuSO4 、Mg + HCl 、Cu + AgNO3、Cu + FeSO4、Fe + AgNO3反应的条件?例、判断下列反应中不正确的是()①Zn+2HCl==ZnCl2+H2↑②2Fe+3H2SO4==Fe2(SO4)+3H2↑3③Cu+Hg(NO3)==Cu(NO3)+Cu ④Cu+2AgCl==CuCl2+2Ag2 23、复分解反应的定义酸、碱、盐发生复分解反应的条件是。
酸碱盐基础知识复习 带答案

酸碱盐基础知识复习1、酸碱指示剂定义:遇到酸或碱溶液发生特定颜色变化的物质。
常见的酸碱指示剂有 紫 色石蕊试液和 无 色的酚酞试液。
2、指示剂的变色规律判断下列说法是否正确:①紫色石蕊试液能使稀盐酸变红( × )说明:变色的是酸碱指示剂而不是酸碱。
②紫色石蕊试液遇到稀盐酸变红( √ )③所有的碱都能使无色酚酞变红( × )说明:难溶性碱不能电离出OH -,不能使酚酞变红④能使紫色石蕊变蓝的溶液一定是碱溶液( × )说明:有些盐溶液如Na 2CO 3溶液显碱性,也能使酚酞变红。
3、石蕊试纸的使用方法4、酸的定义:电离出的阳离子全都是氢离子的化合物_,酸中一定含__氢___元素,可能含__氧__元素。
请分别举出含氧酸与不含氧酸的例子___HCl_____、____H 2SO 4____。
5、碱的定义:电离出的阴离子全都是氢氧根离子的化合物_,碱中一定含__氢__、__氧__元素,不一定含_金属_元素,例如__NH 3·H 2O__中就不含。
碱根据是否可溶于水,可分为可溶性碱和难溶性碱两类,常见的可溶性碱有KOH 、NaOH 、Ba(OH)2、Ca(OH)2、NH 3·H 2O 等5种。
常见的难溶性碱有Cu(OH)2、Fe(OH)3、Mg(OH)2等。
6、①酸溶液中都含有__H +_使溶液显__酸__性;溶液显酸性说明溶液中含有_ H +_,但并不是只有酸的溶液中才有H +,某些盐溶液例如NH 4Cl 等也能电离出H +,它们的水溶液也显酸性。
②碱溶液中都含有__OH -__使溶液显_碱_性;溶液显碱性,说明溶液中含有__OH -__,但并不是只有碱的溶液中才有OH —。
某些盐溶液例如__Na 2CO 3__等也能电离出OH —,它们的水溶液也显碱性。
③酸溶液和酸性溶液的共同点是都含有H +,不同点是酸溶液阳离子全都是H +,酸性溶液中的阳离子除了H +,还有其它阳离子。
初三化学-酸碱盐的综合复习

01 酸碱盐的综合复习一、基础知识复习知识点一:酸的复习1.常见的酸(1)浓盐酸①盐酸的物理性质:盐酸是_____色透明的液体,有_____气味,具有_____性。
【拓展】通常盐酸为无色液体,工业盐酸因含FeCl3而显黄色。
②挥发性:盐酸浓度越大,挥发性越_____。
浓盐酸瓶口出现_____,这是由于___________________________________________的缘故。
保存时必须__________,敞口放在空气中,溶质质量_______,溶液浓度会_______。
(2)浓硫酸①物理性质:纯净的硫酸是无色、粘稠、油状的液体,不易挥发,易溶于水并放出大量的热。
浓硫酸稀释时,需把浓H2SO4沿容器壁慢慢注入水中且边倒边搅拌,切不可将水倒入浓硫酸。
※②吸水性、脱水性、强氧化性。
③硫酸的用途:用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等,在实验室中还可作干燥剂。
2.稀酸的通性酸的组成中均含有________,因此酸具有相似的性质。
(1)酸溶液与指示剂反应。
(2)中和反应:酸+ 碱→ 盐+ 水①定义:酸和碱反应,生成盐和水并放出热量的反应称为中和反应。
如盐酸与氢氧化铁的反应,实验现象是:再如H2SO4 +2NaOH = Na2SO4 + 2H2O;无明显现象,需要使用酸碱指示剂判定反应的发生。
②中和反应的应用:a.___________:改良酸性土壤。
b.___________:治疗胃酸过多。
(4)酸+ 活泼金属(活动性顺序表中排在H前的金属)→盐+ H2↑铁钉和盐酸反应:;现象:;【注意】一般采用稀硫酸或者稀盐酸,浓盐酸挥发性太强,产生的氢气中含有大量氯化氢气体,浓硫酸或硝酸与金属反应不产生氢气。
(5)酸与某些盐反应:①与碳酸盐反应生成二氧化碳:实验现象:有气泡产生②与一些盐反应生成沉淀用氯化钡溶液检验硫酸:_________________________________;用硝酸银溶液检验盐酸:_________________________________;【酸的基础小练习】1.下列物质与盐酸反应,既不生成沉淀,又无气体放出,且溶液显无色的是()A.Na2CO3B.AgNO3C.MgO D.Cu(OH)22.经测定某溶液的pH=1,下列物质中不能在该溶液中大量存在的是()A.氯化钠B.氯化铜C.氢氧化钾D.稀硫酸3.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种。
《酸碱盐》综合知识点整理

《酸碱盐》综合知识点整理酸碱盐是化学中重要的概念和知识点,涉及到很多方面。
本文对酸碱盐的综合知识点进行整理,包括基本概念、性质、检验、应用等方面,旨在帮助读者更全面地了解酸碱盐。
一、酸碱盐的基本概念1. 酸:酸是指在水溶液中能够产生H+(氢离子)的化合物。
酸的特性包括酸味、酸性溶液对蓝色石蕊试纸的变红等。
常见的酸包括硫酸、盐酸、硝酸等。
2. 碱:碱是指在水溶液中能够产生OH-(氢氧根离子)的化合物。
碱的特性包括苦味、碱性溶液对红色石蕊试纸的变蓝等。
常见的碱包括氢氧化钠、氢氧化钙、氨水等。
3. 盐:盐是由酸和碱反应得到的化合物。
盐的特性包括无味、不导电、溶于水呈中性等。
常见的盐包括氯化钠、硫酸铜、硝酸钾等。
二、酸碱盐的性质1. 酸的性质:酸具有以下性质:(1)酸和金属反应生成盐和氢气,例如硫酸和锌反应生成硫酸锌和氢气。
(2)酸和碱反应生成盐和水,例如盐酸和氢氧化钠反应生成氯化钠和水。
(3)酸和酸性氧化物反应生成盐和水,例如硝酸和二氧化氮反应生成硝酸盐和水。
(4)酸和金属碱土反应生成盐和水,例如硫酸和氢氧化钙反应生成硫酸钙和水。
(5)酸和酸性氧化物反应生成盐和水,例如硫酸和二氧化氮反应生成硝酸盐和水。
2. 碱的性质:碱具有以下性质:(1)碱和非金属酸性氧化物反应生成亚硝酸盐和水,例如氢氧化钠和二氧化硫反应生成亚硝酸钠和水。
(2)碱和非金属酸反应生成盐和水,例如氢氧化钠和硫酸反应生成硫酸钠和水。
(3)碱和金属酸性氧化物反应生成盐和水,例如氢氧化钠和二氧化氮反应生成硝酸钠和水。
3. 盐的性质:盐具有以下性质:(1)盐溶于水时呈现离子状态,能够导电。
(2)盐在高温下能够发生熔融,形成熔融盐。
三、酸碱盐的检验1. 酸的检验:可以通过以下方法进行酸的检验:(1)使用蓝色石蕊试纸,酸性溶液会使试纸变红。
(2)使用酸性指示剂,如酚酞溶液,酸性溶液会变红。
2. 碱的检验:可以通过以下方法进行碱的检验:(1)使用红色石蕊试纸,碱性溶液会使试纸变蓝。
酸碱盐基础知识——综合复习

酸碱盐基础知识一、酸碱盐的概念及溶解性1、酸碱盐(1)酸:电离时生成的___________________________________的_______________。
从形式上看:________________________,特例____________________________。
酸根离子:_____________________________________________________________。
(2)碱:电离时生成的___________________________________的________________。
从形式上看:________________________,特例__________________________________。
(3)盐:电离时_________________________________________的________________。
从形式上看:________________________________,特例_________________________。
2、溶解性表(初中常见物质):酸________。
碱:______(溶、不溶)的少,包括___________________,其余均为______(溶、不溶)。
盐:______________盐全溶,氯离子的盐_________________,硫酸盐_______________,碳酸盐只有_______________________________溶。
3、沉淀八君子:六种白色沉淀________________________________________________。
蓝色沉淀_________;红褐色沉淀___________。
二、酸碱性与pH1、酸碱性2、溶液中酸碱性的强弱程度叫做溶液的____________,用pH表示,pH的范围通常在____________之间。
初中化学酸碱盐知识归纳

一、概念:1、酸的组成——氢离子+酸根离子2、碱的组成——金属离子+氢氧根离子3、盐的组成——金属离子+酸根离子4、复分解反响——由两种化合物互相交换成分,生成另外两种化合物的反响,叫做复分解反响。
AB+CD=AD+CB5、稀释浓硫酸的方法——一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。
6、中和反响——酸跟碱作用生成盐和水的反响叫做中和反响。
二、熟记常见元素和原子团的化合价口诀:〔正价〕一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷。
〔负价〕负一价:氟、氯、溴、碘;负二价:氧和硫。
〔可变正价〕:一二铜汞,二三铁,二四碳,四六硫。
〔原子团的化合价负一价:氢氧根〔OH〕,硝酸根〔NO3〕,氯酸根〔ClO3〕,高锰酸根〔MnO4〕;负二价:硫酸根〔SO4〕,碳酸根〔CO3〕,亚硫酸根〔SO3〕,锰酸根〔MnO4〕;负三价:磷酸根〔PO4〕;正一价:铵根〔NH4〕。
三、熟记以下反响方程式:〔一〕酸的性质〔1〕与指示剂反响紫色石蕊试液变红色,无色酚酞试液不变色。
〔2〕酸+碱=盐+水。
〔3〕酸+*些金属氧化物=盐+水。
〔4〕酸+活泼金属=盐+氢气。
〔5〕酸+盐=新盐+新酸。
1、锌跟稀盐酸反响: Zn + 2HCl = ZnCl2 + H2 ↑有气泡产生,锌粒逐渐减少。
2、锌跟稀硫酸反响: Zn + H2SO4 = ZnSO4 + H2 ↑3、铁跟稀盐酸反响: Fe + 2HCl = FeCl2 + H2 ↑有气泡产生,铁逐渐减少,4、铁跟稀硫酸反响: Fe + H2SO4 =FeSO4 + H2 ↑溶液变成浅绿色。
5、铁锈跟稀盐酸反响:Fe2O3 +6HCl = 2FeCl3 + 3H2O 红色铁锈逐渐消失,6、铁锈跟稀硫酸反响:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 溶液变成黄色7、氧化铜跟稀盐酸反响:CuO + 2HCl =CuCl2 +H2O 黑色氧化铜逐渐消失,8、氧化铜跟稀硫酸反响:CuO + H2SO4 = CuSO4 + H2O 溶液变成蓝色。
初三化学复习 酸碱盐基础

2、硝酸钾溶液和稀硫酸
3、稀盐酸和硝酸银溶液
3、下列物质中,不属于盐类的是 A.硝酸钾 B.碳酸钙 C.氯化钾 D.氢氧化钡
4、下列常见的盐中,难溶于水的是 A.氯化镁 B.硝酸银 C.硫酸钡 D.硝酸钾
盐的定义和分类(金头酸尾)
盐:由金属离子(或NH4+)和酸根离子形成的化合物
钾盐:氯化钾、碳酸钾、硝酸钾、硫酸钾……
按阳离子 划分
钠盐:氯化钠、碳酸钠、硫酸钠、碳酸氢钠……
铵盐:氯化铵、硝酸铵、硫酸铵、碳酸氢铵……
盐的定义和分类(金头酸尾)
盐:由金属离子(或NH4+)和酸根离子形成的化合物
硫酸盐:硫酸钠、硫酸铜、硫酸钾、硫酸钡……
按阴离子 划分
碳酸盐:碳酸钠、碳酸钙、碳酸钾、碳酸钡……
硝酸盐:硝酸钠、硝酸铜、硝酸钾、硝酸钙……
酸碱盐的溶解性(室温)
口诀:
钾钠铵盐水中溶, 硝酸盐入水无影踪; 氯化物除去银、亚汞; 硫酸钡、铅水不溶; 若问碳酸、磷酸其它盐, 钾钠铵外都不溶。
复分解反应 通式:AB+CD=AD+CB
复分解反应
初三化学复习Leabharlann —酸碱盐基础JC 2021.3.11
酸的定义和分类(氢头酸尾)
碱的定义和分类(金头碱尾)
阴
盐的定义和分类(金头酸尾)
盐:由金属离子(或NH4+)和酸根离子形成的化合物
正盐:硫酸铜、碳酸钠、硝酸钾、氯化钠……
按盐的成 分划分
酸式盐:碳酸氢钠、碳酸氢铵……
碱式盐:碱式碳酸铜(铜绿)、碱式氯化镁……
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质地变化:化学变化与物理变化地区别5、下列物质地名称、俗名与化学式完全对应地是 (D )1、物质发生化学变化时,一定有 (C )A •气体生成B •有沉淀生成 C.新物质生成 D .颜色地改变 2、下列各种现象,都属于化学变化地一组是(A ) A 、食物腐烂、钢铁生锈B 、汽油挥发、 木炭燃烧C 、水分蒸发、滴水成冰D 、蜡烛熔化、 白磷自燃 3、以下现象不属于化学变化地是(D )A 、蜡烛燃烧B 、植物进行光合作用C 、氢氧化钠溶液变质D 、利用干冰人工降酸地性质:1) .酸能与酸碱指示剂反应:紫色石蕊试液遇酸变红色,无色酚酞遇酸不变色• 2) .酸能与金属氧化物、与碱、与盐反应•••••3) •常见地酸:硫酸,盐酸,硝酸 ……•1、 用焊锡进行焊接时,为了清除金属表面地锈,焊接处要滴几滴(B ) A 、食盐 B 、盐酸 C 、蒸馏水 D 、烧碱2、 稀释浓硫酸地正确操作是( D )当某人胃酸过多时,适合食用地食物是(A )C 、 苹果D 、葡萄 A 、鸡蛋清 B 、牛奶 5、下列离子组能在 PH=1地无色溶液中大量共存地是( B) A 、NO 3 3+ + - Fe Na OH + B 、K2- + SO 4 Na NO 3-精品文档收集整理汇总 C 、C 「 + 2+ 2+ K SO 4 Ba 2+ D 、Ca - 2 Cl CO 3 +精品文档收集整理汇总 Na 碱地性质:1)碱能与酸碱指示剂反应:碱使无色酚酞变红,使紫色石蕊试剂变蓝 . 2. )碱能与非金属氧化物、与酸、与盐反应 …••3. )常见地碱:氢氧化钠(NaOH )、氢氧化钙Ca (OH ) 2等,熟识各自地俗名,相应地性质1、下列物质属于碱地是(B ) A 、 纯碱 E 、苛性钠 C 、生石灰D 、苏打下列物质能使无色酚酞变红地是(C) A 、稀 H 2SO 4B 、Cu(OH)2C 、Na 2CO 3D 、BaCl 2精品文档收集整理汇总 2、下列气体中地水蒸汽不能用固体氢氧化钠干燥地是 ( B ) A 、H 2 B 、CO 2 C 、CO D 、 O 2精品文档收集整理汇总3、向滴有石蕊试液地稀盐酸中,慢慢滴入过量氢氧化钠溶液,石蕊颜色变化地过程是 (D )A 、红-蓝—紫B 、紫-蓝-红 4、长期保存下列药品,不用密封保存地是( A 、苛性钠 E 、浓硫酸A.将水缓缓倒入盛有浓硫酸地烧杯中,边倒边搅拌B. 将浓硫酸缓缓倒入盛有水地量筒中,边倒边搅拌C. 将浓硫酸和水同时倒入一试剂瓶中,充分振荡D. 将浓硫酸缓缓倒入盛有水地烧杯中,边倒边搅拌C 、蓝-紫-红D )C 、浓盐酸D 、红-紫-蓝 D 、木炭粉B .碳酸氢钠 纯碱 NaHCO 3精品文档收集整理汇总 .氢氧化钠 火碱 NaOH 6、某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如下图所示地四组实验方案,其中能达到目地地是 A.氯化钠C.氢氧化钙食盐 NaCI 2 熟石灰CaO D 盐酸几种重要地盐:酚酞 石蕊 1)、碳酸钠( feCO 3)、•食盐(NaCl ) 2) 盐地性质: 盐+ 3) 盐地制取: A •★酸、碱、盐地溶解性(牢记) 详细见溶解性表(1 三盐地性质I ==新盐+新酸OH 一:只有 K 、Na 、NH 4、CaNOf :全溶 Cl ■:只有AgCI 不溶 SO :—:只有BaSO 4不溶 CO2 -:只有 K 、Na 、NH 4 溶 1、由Na *、Ca 2+> OH 、Cl 、SQ 2五种离子里地两种构成地物质中属于盐地共有(C )精品文档收集整理汇总A.二种B. 三种C. 四种D. 五种 2、 下列各反应有监色絮状沉淀生成地是( A) A 、硫酸铜溶液中滴加氢氧化钾溶液B 、氯化钡溶液中滴加稀硫酸C 、氯化铁溶液中滴加氢氧化钠溶液D 、盐酸中滴加碳酸钠溶液3、 要除去NaCI 中混有地少量Na 2CQ , 取好加入适量地 .................. ( B )A .稀H 2SC 4B .稀HCI C. H 2OD . Ca (OH )?精品文档收集整理汇总 4、下列各组物质地溶液之间,不能发生复分解反应地是(D ) A 、NaCI 和 AgNO 3 B 、HCI 和 Na z CO s C 、NaOH 和 HCI D 、HCI 和 NaCI 精品文档收集整理汇总5、 下列两种物质地溶液混合后,能发生反应,且溶液地总质量不会发改变地是(A ) A.氢氧化钠溶液和稀盐酸B. 碳酸钠溶液和稀盐酸C.氯化钠溶液和稀硫酸D. 碳酸钠溶液和氯化钙溶液6、 将下列物质同时加入到水中,能大量共存且得到无色透明溶液地是(A ) A . CaCl 2 HCI NaNO 3C . K 2CO 3 Ba(NO 3)2 NaOH B . KOH HCID . FeCb NaCI (NH 4)2SO 4精品文档收集整理汇总 KNO 3精品文档收集整理汇总7、有四种物质地溶液:① Ba (OH ) 2、②Na 2SO 4、③HNO 3、④FeCb ,不用其他试剂就可将它们逐一鉴别出来,其鉴 别顺序是(B ) A .④③②①B .④①②③C .①③④②D .①④②③精品文档收集整理汇总 金属地变化规律: 金属活动性顺序表(牢记)1、 某金属放入稀硫酸中不产生气泡,该金属可能是(D ) A 、 Mg B 、 Fe C 、 Zn D 、 Cu2、 下列物质可用金属和稀盐酸反应直接制得地是 (B )XY Z :Wr.氧化碳 a 2CO 3)、(2巫盐+碱==新盐+新碱左B .复分解反应(概念及其反应发生地条件)( D )精品文档收集整理汇总4、废旧计算机地某些部件含有 Zn 、Fe 、Cu 、Ag 、Pt (铂)、Au (金)等金属,经物理方法初步处理后,与足量稀盐酸充分反应,然后过滤.剩余地固体中不应有地金属是(B )精品文档收集整理汇总 A. Cu Ag B . Fe 、ZnC . Pt 、CuD . Ag 、Au5、将一根螺旋状地细铁丝放入稀硫酸铜溶液中(见右图),经过较长一段时间后观察发现 (A ) A 、铁丝表面覆盖了一层红色固体物质B 、溶液蓝色变为无色C 在试管底部沉积一层黑色固体物质D 、试管内溶液地颜色上浅下深有机物: 1) .有机化合物含有碳元素地化合物( CO 、CO 2、H 2CO 3和碳酸盐除外)2) 有机物地性质,几种常见地有机物 …••化肥….1、环保部门为了使城市生活垃圾得到合理利用,近年来实施了生活垃圾分类投放地办法•其中 塑料袋、废纸、旧橡胶制品等属于( B ) C 、盐类 D 、非金属单质 精品文档收集整理汇总A 、无机物B 、有机物2、尿素 CO(NH 2) 2 是 种咼效化肥,它属于, (A ) A 、氮肥 B 、磷肥C 、钾肥D 、复合肥料精品文档收集整理汇总 3、沼气和天然气地主要成分是甲烷 ,疋最简单地有机物 •写出它燃烧地化学方程式: ___________________________ .精品文档收集整理汇总 综合题28、经常盛放石灰水地试剂瓶内壁上往往粘有一层白色固体, 它地成分是 碳酸钙 ,写岀要洗去这种固体最好选用地试剂为稀盐酸, 此化学反应方程式 __ CaCO © + 2HCI === CaCI 2 + H ?0 + CO?f•精品文档收集整理汇总 1、硫酸铜晶体俗称胆矶,化学名称五水硫酸铜,化学式 CuSO ・5H 2O .加热硫酸铜晶体发生变化地证据是能观察到 __蓝色变成白色 ______ ,同时—有水生成__,由此推测出硫酸铜晶体地一种化学性质是受热易分解—,其变化地化学方程式为 CuSO 4 • 5H 2O === CuSO4+5H?O ________ .精品文档收集整理汇总 2、 )X 、Y 、Z 三种物质有如下转化关系:以上关系写出下列物质 式 : XMgSO 4, Y Mg (OH ) 2 ,Z MgCI — ; 精品文档收集整理汇总剂甲—NaOH —,试剂乙 _AgNO 3—A 、FeCbB 、ZnCI 2C 、CuCI 2D 、AgCI 精品文档收集整 理汇总 3、x 、Y 、z 、W 是四种不同地金属,为比较金属活动性地强弱,某同学利用这四种金属单质、盐 酸、Z 地硝酸盐、W 地硝酸盐,进行有关实验,结果如下表 (能发生置换反应地记为 V”,不能 反应地记为 一”,无标记地表示未做该实验 ).这四种金属地活动性顺序为( A )精品文档收集整理汇总 A.X>W>Y>Z B.X>Y>W>ZC.W>X>Y>ZD.Y>W>Z>X盐酸V —— V Z 地硝酸盐V W 地硝酸盐V 根据 地化学 试剂甲 硝酸钡溶液3、过碳酸钠(Na2CO4)是一种常见地漂白杀菌剂,其水溶液显碱性,能和盐酸发生下列反应:2Na2CO4 + 4HCI = 4NaCI + 2CO2f + O2 f + 2H2O•工业用地过碳酸钠往往含有少量地碳酸钠,为了测定其纯度,某小组选择利用一部分下列仪(1) 为完成实验,需要测定过碳酸钠样品与稀盐酸反应过程中产生地过碳酸钠地纯度•精品文档收集整理汇总文档收集整理汇总°* 1 2▲(填化学式)地体积,从而推算出(2) 请选取该实验需要地装置,并按正确连接顺序排列 B D E F ▲(填字母,仪器中地试剂皆足量) •精品氧化钙溶液氢颦化钠溶蔽水带在变质前地质量.镁带在变质前地质量为 4.92精品文档收集整理汇总(3) 实验进行一段时间后,不再有气泡产生,此时判定过碳酸钠样品是否完全反应地实验操作方法以及现象是继续加稀盐酸若无气泡产生,说明样品已完全反应.精品文档I攵集整理匚总带在变质前地质量.镁带在变质前地质量为 4.92精品文档收集整理汇总版权申明本文部分内容,包括文字、图片、以及设计等在网上搜集整理.版权为个人所有This article in eludes some parts, in cludi ng text, pictures, and desig n.Copyright is pers onal own ership. 精品文档收集整理汇总用户可将本文地内容或服务用于个人学习、研究或欣赏,以及其他非商业性或非盈利性用途,但同时应遵守著作权法及其他相关法律地规定,不得侵犯本网站及相关权利人地合法权利.除此以外,将本文任何内容或服务用于其他用途时,须征得本人及相关权利人地书面许可,并支付报酬.精品文档收集整理汇总Users mayuse the contents or services of this article for personal study, research or appreciation, and other non-commercial or non-profit purposes, but at the same time, they shall abide by the provisions of copyright law and other releva nt laws, and shall not infringe upon the legitimate rights of this website and its releva nt obligees. In additi on, whe n any content or service of this article is used for otherbe obta ined from the pers on concerned and the releva nt obligee. 精品文档收集整理汇总转载或引用本文内容必须是以新闻性或资料性公共免费信息为使用目地地合理、善purposes, written permission and remuneration shall本文部分内容,包括文字、图片、以及设计等在网上搜集整理 .版权为个人所有be obta ined from the pers on concerned and the releva nt obligee.精品文档收集整理汇总意引用,不得对本文内容原意进行曲解、修改,并自负版权等法律责任Reproduction or quotation of the content of this article and good-faith citati on for the use of n ews or in formative public free in formation .It shall n ot misi nterpret or modify the origi nalcontent of this article, and shall bear legal liability such as copyright.品文档收集整理汇总.精品文档收集整理汇总 must be reas on able intention of theThis article in eludes some parts, in cludi ng text, pictures, and desig n.Copyright is pers onal own ership. 精品文档收集整理汇总用户可将本文地内容或服务用于个人学习、研究或欣赏,以及其他非商业性或非盈利性用途,但同时应遵守著作权法及其他相关法律地规定,不得侵犯本网站及相关权利人地合法权利.除此以外,将本文任何内容或服务用于其他用途时,须征得本人及相关权利人地书面许可,并支付报酬.精品文档收集整理汇总Users mayuse the contents or services of this article for personal study, research or appreciation, and other non-commercial or non-profit purposes, but at the same time, they shall abide by the provisions of copyright law and other releva nt laws, and shall not infringe upon the legitimate rights of this website and its releva nt obligees. In additi on, whe n any content or service of this article is used for other purposes,本文部分内容,包括文字、图片、以及设计等在网上搜集整理.版权为个人所有written permission and remuneration shall意引用,不得对本文内容原意进行曲解、修改,并自负版权等法律责任.精品文档收集整理汇总Reproducti on or quotatio n of the content of this article must be reas on able and good-faith citati on for the use of n ews or in formative public freeinformation. It shall not misinterpret or modify the original intention of thecontent of this article, and shall bear legal liability such as copyright. 精品文档收集整理汇总(4) 如果已知过碳酸钠样品已经完全反应,那么你认为可能导致实验误差地原因是(一条即可):气体从NaOH溶液中带出一部分水蒸气或少量氧气溶于水(合理即可) ________ .精品文档收集整理汇总4、有A、B、C、D、E、F六种物质,已知A为一种氯化物,B为一种钠盐,C为一种碱,D为一种常见地气体•它们之间有如下关系:精品文档收集整理汇总①A和B地溶液混和无明显现象;② B和C地溶液混和生成不溶于稀硝酸地白色沉淀E;③A和C地溶液混和有蓝色沉淀生成;④把D通入C地溶液中有白色沉淀F生成,该沉淀溶于稀硝酸•精品文档收集整理汇总根据上述信息,推断:be obta ined from the pers on concerned and the releva nt obligee. 精品文档收集整理汇总(1) 写出B、D、F地化学式:B _______Na2S°4 __________ ; D _____ C°2 ____________ ; F BaCO g .精品文档收集整理汇总(2) A 与C反应地化学方程式:CuCI? + Ba(OH)? =Cu(OH)g J + BaC ______________________ .精品文档收集整理汇总5、现有一条5 g表面已经部分氧化(变成MgO)地镁带,跟一定量地稀盐酸恰好完全反应,生成氢气0.4 g,求镁。
