大学无机化学碱金属与碱土金属共75页
合集下载
碱金属碱土金属课件

药物合成
碱金属和碱土金属的化合物在药物合成中具有重要作用,如锂盐在抑郁症治疗中的应用。
医学成像
某些碱金属和碱土金属的放射性同位素可用作医学成像的示踪剂,如氟-18在正电子发 射断层扫描中的应用。
钾
总结词
中等活跃的碱金属元素
详细描述
钾是碱金属元素中的一种,原子序数为19,原子量为39.098。在标准条件下, 钾是银白色的金属,具有较高的熔点和沸点,与水反应剧烈。
铷
总结词
较为活泼的碱金属元素
详细描述
铷是碱金属元素中的一种,原子序数为37,原子量为85.4678。在标准条件下,铷是银白色的金属, 具有较低的熔点和沸点,与水反应非常剧烈。
碱金属在常温下呈液态的有锂、钠、钾,呈固态的有铯; 碱土金属在常温下都是固态。
熔点与沸点
碱金属的熔点较低,其中钠、钾的熔点在300℃ 01 以下,锂的熔点略高于钠、钾。
碱土金属的熔点较高,如铍、镁、钙的熔点均在 02 1000℃以上。
碱金属的沸点较低,如钠、钾的沸点在800℃左 03 右;而碱土金属的沸点较高,如钙的沸点为
与空气的反 应
碱金属与空气的反 应
碱金属元素暴露在空气中易被氧化, 如钠在空气中会逐渐氧化成氧化钠或 过氧化钠。
碱土金属与空气的反 应
碱土金属元素在空气中也容易被氧化, 如镁在空气中会逐渐氧化成氧化镁。
碱金属和碱土金属的物理性 质
颜色与状态
碱金属单质通常是银白色金属,但铯略带金色;碱土金 属单质则是银白色或灰色。
铯
总结词
最活泼的碱金属元素
详细描述
铯是碱金属元素中的一种,原子序数为55,原子量为 132.90547。在标准条件下,铯是银白色的金属,具有最低 的熔点和沸点,极易与水和氧气反应,甚至在空气中就可以 自燃。
碱金属和碱土金属的化合物在药物合成中具有重要作用,如锂盐在抑郁症治疗中的应用。
医学成像
某些碱金属和碱土金属的放射性同位素可用作医学成像的示踪剂,如氟-18在正电子发 射断层扫描中的应用。
钾
总结词
中等活跃的碱金属元素
详细描述
钾是碱金属元素中的一种,原子序数为19,原子量为39.098。在标准条件下, 钾是银白色的金属,具有较高的熔点和沸点,与水反应剧烈。
铷
总结词
较为活泼的碱金属元素
详细描述
铷是碱金属元素中的一种,原子序数为37,原子量为85.4678。在标准条件下,铷是银白色的金属, 具有较低的熔点和沸点,与水反应非常剧烈。
碱金属在常温下呈液态的有锂、钠、钾,呈固态的有铯; 碱土金属在常温下都是固态。
熔点与沸点
碱金属的熔点较低,其中钠、钾的熔点在300℃ 01 以下,锂的熔点略高于钠、钾。
碱土金属的熔点较高,如铍、镁、钙的熔点均在 02 1000℃以上。
碱金属的沸点较低,如钠、钾的沸点在800℃左 03 右;而碱土金属的沸点较高,如钙的沸点为
与空气的反 应
碱金属与空气的反 应
碱金属元素暴露在空气中易被氧化, 如钠在空气中会逐渐氧化成氧化钠或 过氧化钠。
碱土金属与空气的反 应
碱土金属元素在空气中也容易被氧化, 如镁在空气中会逐渐氧化成氧化镁。
碱金属和碱土金属的物理性 质
颜色与状态
碱金属单质通常是银白色金属,但铯略带金色;碱土金 属单质则是银白色或灰色。
铯
总结词
最活泼的碱金属元素
详细描述
铯是碱金属元素中的一种,原子序数为55,原子量为 132.90547。在标准条件下,铯是银白色的金属,具有最低 的熔点和沸点,极易与水和氧气反应,甚至在空气中就可以 自燃。
第17章碱金属、碱土金属_无机化学

Na[Sb(OH)6]、KClO4、 Li3PO4、K2Na[Co(NO2)6] 难溶盐往往是在与大阴离子相配时出现。
(2) IIA盐类难溶居多,常见盐类除氯化物、硝酸
盐外, 其他难溶,如MCO3、MC2O4、M3(PO4)2、 MSO4、 MCrO4
(3) 离子型盐类溶解度的定性判断标准
巴素洛规则:阴阳离子电荷绝对值相同, 阴阳离子半径 较为接近则难溶,否则,易溶。
对应阳离子的半径小极化力较大,在水溶液中极 易同水分子结合形成水合离子,这种强烈的倾向能释 放出较大的水合能,总效应超过了需要激发时需补偿 的较高电离能和升华热等能量变化,使锂在水溶液中 的还原能力大大提高,电极电势显著下降;
17 - 2 碱金属和碱土金属单质
一、物理性质
IA
IIA
这些金属单质都具有银白色
第 17 章 碱金属和碱土金属
17 - 1 碱金属和碱土金属的通性 17 - 2 碱金属和碱土金属的单质 17 - 3 碱金属和碱土金属的化合物 17 - 4 离子晶体盐类的溶解性
17 - 1 碱金属和碱土金属的通性
金属性强; 多形成离子键 Li, Be共价倾向显著
+1
+2
ns1
ns2
锂的特殊性:
钾的沸点(766 ºC)比钠的(890 ºC)低,当反应体系的温 度控制在两沸点之间,使金属钾变成气态,金属钠和KCl 、NaCl 仍保持在液态,钾由液态变成气态,熵值大为增 加,反应的 TΔrSm 项变大,有利于ΔrGm变成负值使反应 向右进行。
同时,钾为蒸气状态,设法使其不断离开反应体系,
让体系中其分压始终保持在较小的数值,有利于反应向右
碱金属和碱土金属都有很强的还原性,与许多非金 属属单质直接反应生成离子型化合物。在绝大多数化合物 中,它们以阳离子形式存在。
(2) IIA盐类难溶居多,常见盐类除氯化物、硝酸
盐外, 其他难溶,如MCO3、MC2O4、M3(PO4)2、 MSO4、 MCrO4
(3) 离子型盐类溶解度的定性判断标准
巴素洛规则:阴阳离子电荷绝对值相同, 阴阳离子半径 较为接近则难溶,否则,易溶。
对应阳离子的半径小极化力较大,在水溶液中极 易同水分子结合形成水合离子,这种强烈的倾向能释 放出较大的水合能,总效应超过了需要激发时需补偿 的较高电离能和升华热等能量变化,使锂在水溶液中 的还原能力大大提高,电极电势显著下降;
17 - 2 碱金属和碱土金属单质
一、物理性质
IA
IIA
这些金属单质都具有银白色
第 17 章 碱金属和碱土金属
17 - 1 碱金属和碱土金属的通性 17 - 2 碱金属和碱土金属的单质 17 - 3 碱金属和碱土金属的化合物 17 - 4 离子晶体盐类的溶解性
17 - 1 碱金属和碱土金属的通性
金属性强; 多形成离子键 Li, Be共价倾向显著
+1
+2
ns1
ns2
锂的特殊性:
钾的沸点(766 ºC)比钠的(890 ºC)低,当反应体系的温 度控制在两沸点之间,使金属钾变成气态,金属钠和KCl 、NaCl 仍保持在液态,钾由液态变成气态,熵值大为增 加,反应的 TΔrSm 项变大,有利于ΔrGm变成负值使反应 向右进行。
同时,钾为蒸气状态,设法使其不断离开反应体系,
让体系中其分压始终保持在较小的数值,有利于反应向右
碱金属和碱土金属都有很强的还原性,与许多非金 属属单质直接反应生成离子型化合物。在绝大多数化合物 中,它们以阳离子形式存在。
第15章 碱金属和碱土金属

CaCl2的作用: a.降低电解质的熔点,防止钠的挥发; b.减小金属Na的分散性(混盐密度>金属钠,钠浮 咸阳师在范上学层院)。化学与化工学院
陕西高等学校精品资源共享课程 无机化学
15.1.3 金属单质的制备
2. 热还原法:一般采用焦炭或碳化物为还原剂 MgO(s) + C(s) = CO(g) + Mg(g)
(3)与CO2反应:4MO2+2CO2 = 2M2CO3+3O2 因此,它们用来除去CO2和再生O2,较易制备的 KO2常用于急救箱中。
咸阳师范学院化学与化工学院
陕西高等学校精品资源共享课程 无机化学
4. 臭氧化物
1、制备 臭氧同K、Rb或Cs的氢氧化物作用, 可以得到它们 的臭氧化物。例如:
3KOH(s)+2O3(g)= 2KO3(s)+KOH·H2O(s)+ O2(g) 用液氨重结晶可得橙红色晶体KO3 2、性质 (1) KO3不稳定,缓慢分解成KO2和O2 (2) 臭氧化物和水剧烈反应,但不形成过氧化物: 咸阳4M师O范3-学(s院) +化2H学2O与=化4工M学OH院+5O2
MO2 (M = K、 MO3 (M=K、
Rb、Cs)
Rb、Cs)
:¨O—¨O: 2¨¨
•
•• -
:O—O:
¨¨
抗磁性
顺磁性
OO 35 O 顺磁性
咸阳师范学院化学与化工学院
陕西高等学校精品资源共享课程 无机化学
1. 普通氧化物
Li、ⅡA金属与空气作用或由碳酸盐加热分 解时均生成氧化物:
4M+O2====4M2O (M=碱金属,常温)
MO+H2O=M(OH)2 (M=碱土金属)
陕西高等学校精品资源共享课程 无机化学
15.1.3 金属单质的制备
2. 热还原法:一般采用焦炭或碳化物为还原剂 MgO(s) + C(s) = CO(g) + Mg(g)
(3)与CO2反应:4MO2+2CO2 = 2M2CO3+3O2 因此,它们用来除去CO2和再生O2,较易制备的 KO2常用于急救箱中。
咸阳师范学院化学与化工学院
陕西高等学校精品资源共享课程 无机化学
4. 臭氧化物
1、制备 臭氧同K、Rb或Cs的氢氧化物作用, 可以得到它们 的臭氧化物。例如:
3KOH(s)+2O3(g)= 2KO3(s)+KOH·H2O(s)+ O2(g) 用液氨重结晶可得橙红色晶体KO3 2、性质 (1) KO3不稳定,缓慢分解成KO2和O2 (2) 臭氧化物和水剧烈反应,但不形成过氧化物: 咸阳4M师O范3-学(s院) +化2H学2O与=化4工M学OH院+5O2
MO2 (M = K、 MO3 (M=K、
Rb、Cs)
Rb、Cs)
:¨O—¨O: 2¨¨
•
•• -
:O—O:
¨¨
抗磁性
顺磁性
OO 35 O 顺磁性
咸阳师范学院化学与化工学院
陕西高等学校精品资源共享课程 无机化学
1. 普通氧化物
Li、ⅡA金属与空气作用或由碳酸盐加热分 解时均生成氧化物:
4M+O2====4M2O (M=碱金属,常温)
MO+H2O=M(OH)2 (M=碱土金属)
大学无机化学——碱金属和碱土金属

2 Na2O2 2CO2 2 Na2CO3 O2
Fe2O3 3 Na2O2 2 Na2 FeO4 Na2O Cr2O3 3 Na2O2 2 Na2CrO4 Na2O
还原性
5 Na2O2 2 MnO4 16 H 5O2 2 Mn2 10 Na 8 H 2O BaO2 H 2 SO4 H 2O2 BaSO4
性质 颜色 溶解度 酸碱性 碱金属 均为白色 很大(LiOH除外) 均为碱性 碱土金属 均为白色 较小(Mg(OH)2、 Be(OH)2难溶) 碱性(Be(OH)2除 外)
碱金属的其他性质:白色固体、易吸潮、溶于水放出大量的热
2)原因
溶解度规律: 阴、阳离子半径相差较大的离子型化合物在水中溶解
度较大,相近的溶解度较小,即 “相差溶解” 规律。
金属的氨溶液中含有金属离子和溶剂化自由电子, 这种溶剂化自由电子非常活泼,具有极强的还原能力, 金属的氨溶液:强还原性(低温)、导电性、顺磁性
氨合电子结构示意图
• 由于氨合电子存在, 溶液有导电性和顺磁 性, e(NH3)y- 是很强的还原剂, 用于无机和 有机合成. • 痕量杂质如过渡金属盐,氧化物,氢氧化物 存在或光化作用,能促进碱金属与氨的反应
第12章 碱金属和碱土金属
12-1 金属单质
12-2 含氧化合物
12-3 盐类
Li
Na
K
Rb Cs
Be
Mg
Ca
Sr
Ba
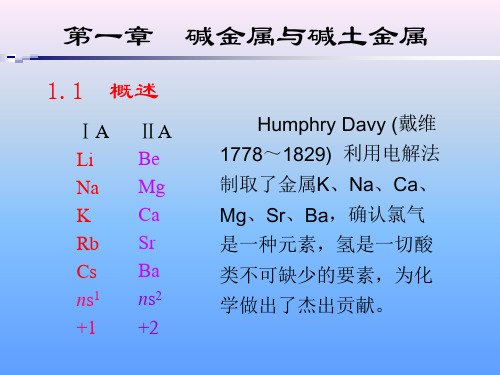
碱金属:IA族的金属单质。 锂、钠、钾、铷、铯、钫
碱土金属:IA族的金属单质。 铍、镁、钙、锶、钡、镭
由于IA族金属的氢氧化物都是强碱, 故称该族元素为碱金属
钙锶钡碱性“ 碱金属氧化物”和土性的 “氧化铝”之间,故称该族元素为碱土金 属
无机化学:碱金属与碱土金属

2 Mg(NO3)2 = 2 MgO + 4 NO2 + O2 4 LiNO3 = 2 Li2O + 4 NO2 + O2 2 NaNO3 = 2 NaNO2 + O2
LiCl·H2O = LiOH + HCl MgCl2·6H2O = Mg(OH)Cl + HCl + 5 H2O Mg(OH)Cl = MgO + HCl
性质 (1)室温下,均能与水和稀酸反应:
Na2O2+2H2O→2NaOH+H2O2 Na2O2+H2SO4→Na2SO4+H2O2 2KO2+2H2O→2KOH+H2O2+O2↑ 2KO2+2H2SO4→2K2SO4+H2O2+O2↑
(2)与CO2的反应:
2Na2O2+2CO2→2NaCO3+O2 ↑
552 1070 4351
564 971 3575
电负性
1.57 1.31 1.00 0.95 0.89
标准电极电势(酸)
-1.85 -2.375 -2.76 -2.89 -2.90
标准电极电势(碱)
-2.28 -2.69 -3.02 -2.99 -2.97
M2+(g)水合热/kJ·mol-1 2494 1921 1577 1443 1305
碱金属与碱土金属
第1节 一般性质 一、所形成的化合物多为离子型化合物(除Li,Be外) 以Be为例: 1、共价性强,BeF2 带有共价 性; 2、水解性,Be2+离子只能在 酸性溶液中存在,否则水解; 3、配合性质,形成的配合物 的数目比其他的元素多; 4、聚合性质,4BeAc2 + H2O = Be4OAc6 + 2HAc
碱金属碱土金属教学课件

特性
碱金属元素具有较低的原子序数,表现出强烈的金属性,具 有活泼的化学性质;碱土金属元素具有较高的原子序数,表 现出相对较强的非金属性,化学性质相对较稳定。
在周期表中的位置
碱金属元素
包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr),位于 周期表中的第1族(IA族)。
碱土金属元素
水生生物毒性效应
高浓度的碱金属和碱土金 属会对水生生物产生毒性 效应,影响其生长和繁殖 。金属和碱土金属在土壤中积累,会 导致土壤污染,影响农作物的生长和 质量。
这些金属元素会降低土壤中微生物的 活性,影响土壤的生态平衡。
土壤结构破坏
过量的碱金属和碱土金属可能导致土 壤结构破坏,影响土壤的通气性和保 水性。
碱金属碱土金属教学课件
contents
目录
• 碱金属和碱土金属的简介 • 碱金属和碱土金属的物理性质 • 碱金属和碱土金属的化学性质 • 碱金属和碱土金属的化合物 • 碱金属和碱土金属的应用 • 碱金属和碱土金属的环境影响
01
碱金属和碱土金属的 简介
定义与特性
定义
碱金属和碱土金属是元素周期表中的两类元素,位于IA和IIA 族。
热导率
碱金属和碱土金属的热导率较高,这 意味着它们具有良好的热传导性能。 这主要是因为金属中的自由电子可以 有效地传递热量。
03
碱金属和碱土金属的 化学性质
氧化还原反应
总结词
碱金属和碱土金属在氧化还原反应中表现出不同的性质。
详细描述
碱金属元素如锂、钠、钾具有较强的还原性,容易失去电子成为正离子,而碱土金属元素如镁、钙、锶、钡则具 有相对较弱的还原性。在氧化还原反应中,碱金属通常作为还原剂,而碱土金属则可以作为氧化剂或还原剂。
碱金属元素具有较低的原子序数,表现出强烈的金属性,具 有活泼的化学性质;碱土金属元素具有较高的原子序数,表 现出相对较强的非金属性,化学性质相对较稳定。
在周期表中的位置
碱金属元素
包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr),位于 周期表中的第1族(IA族)。
碱土金属元素
水生生物毒性效应
高浓度的碱金属和碱土金 属会对水生生物产生毒性 效应,影响其生长和繁殖 。金属和碱土金属在土壤中积累,会 导致土壤污染,影响农作物的生长和 质量。
这些金属元素会降低土壤中微生物的 活性,影响土壤的生态平衡。
土壤结构破坏
过量的碱金属和碱土金属可能导致土 壤结构破坏,影响土壤的通气性和保 水性。
碱金属碱土金属教学课件
contents
目录
• 碱金属和碱土金属的简介 • 碱金属和碱土金属的物理性质 • 碱金属和碱土金属的化学性质 • 碱金属和碱土金属的化合物 • 碱金属和碱土金属的应用 • 碱金属和碱土金属的环境影响
01
碱金属和碱土金属的 简介
定义与特性
定义
碱金属和碱土金属是元素周期表中的两类元素,位于IA和IIA 族。
热导率
碱金属和碱土金属的热导率较高,这 意味着它们具有良好的热传导性能。 这主要是因为金属中的自由电子可以 有效地传递热量。
03
碱金属和碱土金属的 化学性质
氧化还原反应
总结词
碱金属和碱土金属在氧化还原反应中表现出不同的性质。
详细描述
碱金属元素如锂、钠、钾具有较强的还原性,容易失去电子成为正离子,而碱土金属元素如镁、钙、锶、钡则具 有相对较弱的还原性。在氧化还原反应中,碱金属通常作为还原剂,而碱土金属则可以作为氧化剂或还原剂。
复旦大学无机化学 课件 第1章 碱金属和碱土金属
BX3是以形成大π 键来满足
对电子的要求 由于有空轨道,可接受外来 电子,均为Lewis酸
π46
BF3+NH3 == F3B:NH3
BF3+ HF == H+[BF4]- 酸性强:BF3<BCl3<BBr3<BI3 C5H5N(l)+BX3(g) C5H6N: BX3
△rH(kJ· -1) mol
BF3(g) = BCl3(g) = BBr3(g) =
-143
-189 -217
3.3 硼酸及其盐
3.3.1. 硼酸
B:SP2杂化;存在分子间氢键;
层与层之间的分子作用力结合。
H3BO3是Lewis酸,是一元酸。
其酸性很弱,Ka=5.8×10-10加入多羟
基化合物可增加酸性。
2
H2SO4
H3BO3+3CH3OH== B(OCH3)3+3H2O
Na2B4O7+CoO=2NaBO2· Co(BO2)2
除氧化物 定性分析 陶瓷、玻璃上釉 制造人造宝石
Cr2O3为绿色
Fe2O3为黄色.
Na2B4O7+7H2O == 4H3BO3+2NaOH
H3BO3+OH- == B(OH)4- PH=9.24
缓冲溶液 洗衣粉填料
3.4
GaCl2
Ga、In、Tl 简介
最简单的硼烷是B2H6
2BH3(g)=B2H6(g) △H=-148kJ· -1 mol
点击 观看 动画
三中心 两电子 氢桥键
B2H6
2L
均裂
2BH3L
异裂
[BH2L2]++[BH4]-
无机化学第12章--碱金属、碱土金属课件

150.5 109.5 91.5 86.1 79.9 520.1 495.7 418.6 402.9 375.6
△Hh(M)/kJ·mol-1 △H (M) /kJ·mol-1
-514.1 -413.8 -342.8 -321.9 -297.1 163.1 197.3 175.1 165.1 158
ф 0.25 Be(OH)2 0.18 Mg(OH)2 0.15 Ca(OH)2 0.13 Sr(OH)2 0.12 Ba(OH)2
碱金属氢氧化物均为碱性,Be(OH)2为两性, 其它碱土金属氢氧化物为碱性。
12 - 3 盐类 12 - 3 - 1 盐类的共同特点
重要盐类:卤化物、硝酸盐、硫酸盐、碳酸盐
自学指导(二)
1、作者运用哪几种方法去刻画人物的形象?从文 中找出具体句子进行分析。并说说你是如何看待这 两个人物的。 2、从这个故事中你懂得了什么道理?
陈尧咨(善射)
神态 忿然 笑而遣之
卖油翁(善酌)
睨之
语言 动作
汝亦知射乎 吾射不亦精乎 尔安敢轻吾射
笑而遣之
性格: 自矜(骄傲)
对比
无他,但手熟尔 以我酌油知之 我亦无他,惟手熟尔
氧化物热稳定性总的趋势是,同族从上到下依次降 低,熔点也按此顺序降低。
碱土金属离子半径较小,电荷高,其氧化物的晶格能 大,因而其熔点比碱金属氧化物的熔点高得多。
12 - 2 - 2 氢氧化物
1 氢氧化物性质
碱金属和碱土金属的氢氧化物都是白色固体。 Be(OH)2为两性氢氧化物,LiOH和Be(OH)2为中强 碱,其余氢氧化物都是强碱。 碱金属的氢氧化物都易溶于水,在空气中很容易吸潮, 它们溶解于水时放出大量的热。除氢氧化锂的溶解度稍 小外,其余的碱金属氢氧化物在常温下可以形成很浓的 溶液。
大学无机下册第12章 碱金属和碱土金属

过氧化物(O22-) 超氧化物(O2-)
2 * 2 2 4 * 4 KK (σ ) ( σ ) ( σ ) ( ) ( π ) 2 s 2 p 2s 2p 2p 2 * 2 2 4 * 3 KK (σ ) ( σ ) ( σ ) ( ) ( π ) 2 s 2 p 2s 2p 2p
1.碱金属氧化物
M+离子半径越小,作用于水分子的电场越强, 水合热越大,水合物越稳定。
碱土金属规律不明显。 6. 水解性
碱金属弱酸盐均水解-碱性 碱土金属:BeCl2· 4H2O BeO+2HCl+3H2O
MgCl2· 6H2O→Mg(OH)Cl → MgO
7. 形成复盐的能力
光卤石类:MCl· MgCl2· 6H2O M=K+、Rb+、Cs+ M2SO4· MSO4· 6H2O M2SO4· M2(SO4)3· 24H2O
⑵与两性金属(Zn、 Al)、某些非金属(B、Si) 及其氧化物反应 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑ Al2O3+2NaOH=2NaAIO2+H2O
Si+2NaOH(浓)+H2O=Na2SiO3+2H2↑
SiO2+2NaOH=Na2SiO3+H2O(玻璃瓶用橡皮塞)
2Na2CO3 + O2↑ 2Na2CrO4 + Na2O
2Na2CrO4+4NaOH
2NaCrO2 + 3Na2O2 + 2H2O
Na2MnO4 (熔矿剂)
碱性条件下为强氧化剂,遇棉花、木炭等爆炸.
⑶ 超氧化物 K (Rb、Cs) + O2
2 * 2 2 4 * 4 KK (σ ) ( σ ) ( σ ) ( ) ( π ) 2 s 2 p 2s 2p 2p 2 * 2 2 4 * 3 KK (σ ) ( σ ) ( σ ) ( ) ( π ) 2 s 2 p 2s 2p 2p
1.碱金属氧化物
M+离子半径越小,作用于水分子的电场越强, 水合热越大,水合物越稳定。
碱土金属规律不明显。 6. 水解性
碱金属弱酸盐均水解-碱性 碱土金属:BeCl2· 4H2O BeO+2HCl+3H2O
MgCl2· 6H2O→Mg(OH)Cl → MgO
7. 形成复盐的能力
光卤石类:MCl· MgCl2· 6H2O M=K+、Rb+、Cs+ M2SO4· MSO4· 6H2O M2SO4· M2(SO4)3· 24H2O
⑵与两性金属(Zn、 Al)、某些非金属(B、Si) 及其氧化物反应 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑ Al2O3+2NaOH=2NaAIO2+H2O
Si+2NaOH(浓)+H2O=Na2SiO3+2H2↑
SiO2+2NaOH=Na2SiO3+H2O(玻璃瓶用橡皮塞)
2Na2CO3 + O2↑ 2Na2CrO4 + Na2O
2Na2CrO4+4NaOH
2NaCrO2 + 3Na2O2 + 2H2O
Na2MnO4 (熔矿剂)
碱性条件下为强氧化剂,遇棉花、木炭等爆炸.
⑶ 超氧化物 K (Rb、Cs) + O2
无机化学13碱金属和碱土金属全解

△
3Ca+N2====Ca3N2
△
3Mg+N2===Mg3N2
思考:活泼金属 应当如何保存?
要防止与空气接触。锂要保存于蜡中,钾、 钠、钙等应保存于煤油中。
Li2O
Na2O2
镁 带 的
燃
KO2
烧
2M(s)+ 2NH3 (l) →2M+ + 2NH-2 + H2 (g)
与 液 氨 作 用
1、为什么自然界没有游离态的碱金属和 碱土金属?它们主要以哪些形式存在?
位〕 Ф 0.22 碱性
0.22 Ф 0.32 两性Ф 0 Nhomakorabea32 酸性
LiOH Be(OH)2
NaOH KOH RbOH
Mg(OH)2 碱
Ca(OH)2
性 增
Sr(OH)2 强
CsOH Ba(OH)2
酸性增强
你能用有关理论解释为何Be(OH)2具有两性吗?
LiOH 中强
Be(OH)2 两性
NaOH 强
温度为900℃时,反响:Na(l)+KCl(l)——NaCl(l)+K(g),钾 成为气体挥发,使平衡向右移动,反响得以进展。
氢氧化物
碱金属的氢氧化物对皮肤和纤维有强烈 的腐蚀作用,所以又称为荷性碱。
物理性质
碱金属和碱土金属的氢氧化物均为白色 固体,吸水容易潮解,溶于水时放热。
溶解度增大
溶解性 mol·l-1
无机化学13碱金属和碱土金属全 解
第一节 碱金属和碱土金属的通性
第IA族包括锂、 钠、钾、铷、铯 和钫六种元素, 由于它们的氢氧 化物都是易溶于 水的强碱,所以 称它们为碱金属 元素。其中钫是 放射性元素。
无机化学 碱金属和 碱土金属元素

本文档主要讨论了碱金属和碱土金属元素,这些元素在周期表中占据特定位置,并拥有一系列独特的化学性质。然而,关于不含金属元素的碱,即非金属碱,文档并未直接给出具体的化学式。非金属碱通常指的是那些不含金属离子,但能接受质子(H+)或释放出氢氧根离子(OH-)的化合物,如水(H2O)、氨(NH3)等。这些化合物在溶液中能表现出碱性,但由于本文档主要聚焦于碱金属和碱土金属,因此未对非金属碱进行详细阐述。若需了解不含金属元素的碱的化学式及性质,建议查阅相
第12章碱金属和碱土金属

Na2O2常用作氧化分解矿石的溶剂
11
第12章 碱金属和碱土金属
性质二:氧气发生剂。
12.2 含氧化合物
Na 2O2 2H 2O H2O2 2NaOH
Na 2O2 H2SO(4 稀) H2O2 2Na 2SO4
易吸潮,呈强碱性
2H2O2 立 即分解 2H2O O2
Na2O2常用作漂白剂和氧气发生剂
29
M'O4 M'=Ca Sr Ba
臭氧化物 MO3 (M=K,Rb,Cs)
O2-
O3-
7
第12章 碱金属和碱土金属
1. 普通氧化物 制备
碱金属
12.2 含氧化合物
碱土金属
2Li
1 2
O2
Li 2O
2Na+Na2O2→2Na2O
10K+2KNO3→6K2O+N2
2M+O2 →2MO
2M(NO3)2→2MO+4NO2+O2
磷酸盐 0.039 11 0.661
26
第12章 碱金属和碱土金属
12.3 盐类
(3)铍和铝对角相关性
★氧化物和氢氧化物两性, IIA族其余的氧化物 和氢氧化物显碱性;
★ 无水氯化物BeCl2, AlCl3共价成份大, 可溶于 醇、醚、易升华, 其余IIA族的MCl2是离子 晶体;
★ Be, Al和冷浓HNO3接触时, 钝化, 其余IIA族 金属易于和HNO3反应。
2. 过氧化物 (Peroxide) 2-
结构 [
]
O的氧化数为-1
制备(Na2O2)
2Na + O2 →Na2O2
10
第12章 碱金属和碱土金属
大学无机化学——碱金属和碱土金属

Na 2NH3 Na (NH3 ) e (NH3 )
金属的氨溶液中含有金属离子和溶剂化自由电子,
这种溶剂化自由电子非常活泼,具有极强的还原能力, 金属的氨溶液:强还原性(低温)、导电性、顺磁性
第十五页,共75页。
氨合电子结构示意图
第十六页,共75页。
• 由于氨合电子存在, 溶液有导电性和顺磁性, e(NH3)y-是很强的还原剂, 用于无机和有机合成.
12—2—1含氧化合物
12—2—1 氧化物 分类:普通氧化物、过氧化物超氧化物和臭氧化物
普通氧化物 过氧化物 超氧化物 臭氧化物
所有的碱金 除Be以外 Na、K、Rb
属和碱土金 的所有碱 、Cs、Ca
属
金属和碱
土金属
Na、K Rb、Cs
第二十九页,共75页。
碱金属和碱土金属在充足的空气中燃烧
普通氧化物 过氧化物 超氧化物 臭氧化物
SrO2
一定温度
Ba O2
BaO2
第三十二页,共75页。
过氧化物的性质
物理性质:粉末状固体、吸潮性
化学性质:
性质
方程式
与水或稀酸反应 与二氧化碳反应
Na2O2 2H2O H2O2 2NaOH Na2O2 H 2SO4 H 2O2 Na2SO4
2Na2O2 2CO2 2Na2CO3 O2
半径大的正离子稳定:K、Rb、Cs、Sr、Ba超氧 化物温稳定,Na的超氧化物不稳定
熔点 同族从上到下依次升高
反应 Na/K/Rb/Cs+O2(过量)→超氧化物
强氧化 性
(可做氧 气源)
2KO2 2H 2O O2 H 2O2 2KOH 4KO2 2K2O 3O2 4K2O 2CO2 2K2CO3 3O2
金属的氨溶液中含有金属离子和溶剂化自由电子,
这种溶剂化自由电子非常活泼,具有极强的还原能力, 金属的氨溶液:强还原性(低温)、导电性、顺磁性
第十五页,共75页。
氨合电子结构示意图
第十六页,共75页。
• 由于氨合电子存在, 溶液有导电性和顺磁性, e(NH3)y-是很强的还原剂, 用于无机和有机合成.
12—2—1含氧化合物
12—2—1 氧化物 分类:普通氧化物、过氧化物超氧化物和臭氧化物
普通氧化物 过氧化物 超氧化物 臭氧化物
所有的碱金 除Be以外 Na、K、Rb
属和碱土金 的所有碱 、Cs、Ca
属
金属和碱
土金属
Na、K Rb、Cs
第二十九页,共75页。
碱金属和碱土金属在充足的空气中燃烧
普通氧化物 过氧化物 超氧化物 臭氧化物
SrO2
一定温度
Ba O2
BaO2
第三十二页,共75页。
过氧化物的性质
物理性质:粉末状固体、吸潮性
化学性质:
性质
方程式
与水或稀酸反应 与二氧化碳反应
Na2O2 2H2O H2O2 2NaOH Na2O2 H 2SO4 H 2O2 Na2SO4
2Na2O2 2CO2 2Na2CO3 O2
半径大的正离子稳定:K、Rb、Cs、Sr、Ba超氧 化物温稳定,Na的超氧化物不稳定
熔点 同族从上到下依次升高
反应 Na/K/Rb/Cs+O2(过量)→超氧化物
强氧化 性
(可做氧 气源)
2KO2 2H 2O O2 H 2O2 2KOH 4KO2 2K2O 3O2 4K2O 2CO2 2K2CO3 3O2
碱金属与碱土金属

LiCHENLI
Na
K
11
Ca
问题: Na 与Li、Ca比较,谁更活泼?
12 CHENLI
囱
1、从与水的反应现象看
碱土金属:
M3N2 , MO (M = Mg、Ca、Sr、Ba)
BaO2 10 CHENLI
2、与水作用:
Na反应猛烈; K、Rb、Cs燃烧,量大发生爆炸;
Li、Ca、Sr、Ba反应比较慢;Be、Mg与水蒸气反应。
元素 锂 钠 钾 铷 铯 铍 镁 钙锶钡
性质
φAo /V
-3.045 -2.714 -2.925 -2.925 -2.923 -1.85 -2.36 -2.87 -2.89 -2.91
3. 碱土金属由于核外有2个有效成键电子,晶体中原子间距小, 金属键强度较大,因此熔点、沸点和硬度均较碱金属高。
4. 碱土金属的物理性质变化不如碱金属那么有规律,是由于其晶 格类型不完全相同。
9 CHENLI
三、化学性质
1、与空气作用: 碱金属: Li2O、Li3N; M2O2 (M = Na、K、Rb、Cs) MO2 (M = K、Rb、Cs)
第六章
碱金属和碱土金属
(Alkali and Alkaline Earth Metals)
(IA、IIA族)
1 CHENLI
第六章 碱金属和碱土金属
§6-1 碱金属和碱土金属的通性
§6-2 碱金属和碱土金属的单质
§6-3 化合物
§6-4 冠醚配合物
2 CHENLI
元素
碱 Li
金 属
锂
Lithium
0.98 0.93 0.82 0.82 0.79 1.57 1.31 1.00 0.95 0.89
