无机化学实验二十二_碱金属和碱土金属
无机化学实验二十二 碱金属和碱土金属

无机化学实验实验二十二碱金属和碱土金属[实验目的]比较碱金属、碱土金属的活泼性。
试验并比较碱土金属氢氧化物和盐类的溶解性。
练习焰色反应并熟悉使用金属钾、钠的安全措施。
[实验用品]仪器:烧杯、试管、小刀、镊子、坩埚、坩埚钳、离心机固体药品:钠、钾、镁条、醋酸钠液体药品:汞、NaCl(1mol·L-1)、KCl(lmol·L-1)、MgC12(0.5mol·L-1)、CaC12(0.5mol·L-1)、BaC12(0.5mol·L-1)、新配制的NaOH(2mol·L-1)、氨水(6mol·L-1)、NH4Cl(饱和)、Na2CO3(0.5mol·L-1、饱和)、HCl(2mol·L-1)、HAc(2mol·L-1、6mol·L-1)、HNO3(浓)、Na2SO4(0.5mol·L-1)、CaSO4(饱和)、K2CrO4(0.5mol·L-1)、KSb(OH)6(饱和)、(NH4)2C2O4(饱和)、NaHC4H4O6(饱和)、AlCl3(0.5mol·L-1)材料:铂丝(或镍铬丝)、pH试纸、钴玻璃、滤纸[实验内容]一、钠、钾、镁的性质1.钠与空气中氧的作用用镊子取一小块金属钠(绿豆大),用滤纸吸干其表面的煤油,切去表面的氧化膜,立即置于坩埚中加热。
当钠开始燃烧时,停止加热。
观察反应情况和产物的颜色、状态。
冷却后,往坩埚中加入2ml蒸馏水使产物溶解,然后把溶液转移到一支试管中,用pH试纸测定溶液的酸碱性。
再用2mol·L-1H2SO4酸化,滴加1~2滴0.01mol·L-1KMnO4溶液。
观察紫色是否褪去。
由此说明水溶液是有H2O2,从而推知钠在空气中燃烧是否有Na2O2生成。
写出以上有关反应方程式。
现象和解释2Na + O2Na2O2黄色粉末Na2O2 + 2H2O == H2O2++ 2NaOH5H2O2 + 2MnO4- + 6H+ == 2Mn2+ + 8H2O + 5O22、钠、钾、镁与水的作用用镊子取一小块金属钾和金属钠,用滤纸吸干其表面的煤油,切去表面的氧化膜,立即将它们分别放入盛水的烧杯中。
无机化学-碱金属与碱土金属元素单质的制备与性质

Fe盐的催化剂
2M(s) 2NH3(l) 2M 2NH2 H2 (g)
溶剂合电子
18
M- : alkalide; Na- : sodide
钠阴离子
en = ethylenediamine 2 Na (s) + en Na+(en) + Na-(en) NaK(l) + en K+(en) + Na-(en)
10
1. 与水的反应
Akali metal: 2 M(s) + 2 H2O (l) = 2 M+(aq) + 2OH-(aq) + H2(g) Akaline earth metal: M(s) + 2H2O (l) = M2+(aq) + 2OH-(aq) + H2(g)
Li
Na
K
应用:金属钠与
16
碱土金属的反应性
碱土金属活泼性略差,室温下这些金属
镁
表面缓慢生成氧化膜。它们在空气中
与
加热发生反应,生成氧化物和少量氮
二
化物(如:Ca3N2、Mg3N2)。
氧 化
因此在金属熔炼中常用Li、Ca等除去
碳
溶解在熔融金属中的氮气和氧气,在电
反
子工业中常用Ba除去真空管中痕量氮
应
气和氧气,在高温时碱金属和碱土金属
2. DG 的大小则由 D r Gm= D r Hm-T D r Sm 决定. 其中熵变 一般对DG的贡献比较小, DG的大小主要由D r Hm来决 定. D r Hm则要由设计的 Born-Haber 循环来决定. 而循环 中的晶格能值的大小对整个反应能否进行及产物稳定性 关系重大.
3. 晶格能又正比于阴、阳离子电荷的乘积,反比于阴、阳 离子的距离. 这样就要求阴、阳离子具备一定的 “匹配 ” 条件,产生最好的能量效应. 此即所谓的“大-大,小小”规则.
碱金属和碱土金属实验报告

碱金属和碱土金属实验报告本次实验是针对碱金属和碱土金属进行的,在实验中大家通过与这些金属进行反应来了解它们的性质和特点。
本文将从实验前后的准备工作、实验过程、实验结果以及结论四个方面为大家详细介绍这次实验。
实验前准备工作在进行实验前,我们需要对相关知识进行学习,并仔细阅读实验指导书,了解实验原理和步骤,同时进行必要的安全措施,如佩戴手套、护目镜等。
此外,我们还需要准备实验所需的实验器材和试剂,以便进行实验。
实验过程在实验过程中,我们首先进行了碱金属的实验。
我们在实验室里将钾直接投入水中,因为钾与水中的氧气发生反应,会爆炸,所以我们必须将其一个一个的丢入水中,以降低反应的速率,避免产生危险。
在实验中,我们发现钾与水剧烈反应,放出大量氢气,同时燃烧剧烈,并形成碱性溶液。
这充分说明了钾金属的强还原性和活泼性。
接着,我们进行了碱土金属的实验,实验中我们选取了镁、钙、锶、钡等金属作为实验对象。
首先,我们将相应的金属样品分别夹在钳子里,然后点燃它们,这时候,这些金属都会剧烈燃烧,放出许多亮光和热。
这是因为当金属燃烧时,会与空气中的氧气发生化学反应,形成金属氧化物。
此外,镁和钙的燃烧反应十分强烈,而锶和钡的燃烧反应却较为温和,这与其化学性质有关。
实验结果通过实验,我们获得了相关数据和结果。
我们发现钾与水反应时会产生大量的氢气,同时产物为钾氢氧化物、氢氧化钾等。
碱土金属的燃烧反应产生的产物为金属氧化物和氧气。
此外,我们还在实验中观察到了不同金属产生的火焰颜色不同,这是由于各种元素所产生的光谱线的不同。
结论通过这次实验,我们可以得出如下结论。
首先,碱金属具有强还原性和活泼性,能够与水反应并放出大量的氢气;碱土金属一般情况下较为稳定,但在受到热或溶液作用的情况下会燃烧产生光和热;不同金属的燃烧反应产生的产物也不尽相同。
此外,我们还发现不同金属在燃烧反应中所产生的火焰颜色不同,可以用来识别其元素种类。
总之,这次实验对我们了解碱金属和碱土金属的性质和特点有了更加深入和全面的认识,同时也加强了我们对实验安全和操作规范方面的意识。
碱金属和碱土金属实验报告(一)

碱金属和碱土金属实验报告(一)碱金属和碱土金属实验报告实验目的了解碱金属和碱土金属的性质,并研究它们的物理化学特性。
实验器材•碱金属:钠、钾、锂•碱土金属:镁、钙、锶、钡•水槽•火柴•盖玻片•磁力搅拌器实验步骤1.将每种金属放入盖玻片中,标记好。
2.分别在水槽中将金属放入水中,观察它们的反应现象。
3.在碱金属中选取一种,将其加入盛有酒精的烧杯中,点燃观察其反应。
4.在碱土金属中选取一种,将其加入盛有盐酸的烧杯中,加热观察其反应。
5.在碱土金属中选取一种,将其加入热水中,搅拌观察其反应。
实验结果1.碱金属在水中反应,放出氢气和放热现象;碱土金属在水中不易反应。
2.碱金属燃烧时产生黄色火苗,放出氧化物和放热现象。
3.碱土金属和酸反应,放出氢气和放热现象。
4.碱土金属与热水反应,放出氢气。
实验分析1.碱金属和碱土金属的化学性质不同,碱金属更易于反应,碱土金属更稳定;2.碱金属在空气中极易氧化,因此应保管在密闭条件下;3.碱金属和碱土金属与水反应后生成的氢气常常是很剧烈的,因此应该小心操作,以免引起安全事故。
实验结论通过对碱金属和碱土金属的实验观察和分析,得到以下结论: 1. 碱金属和碱土金属的物理性质和化学性质都有明显的差异; 2. 碱金属的反应性更强,碱土金属的稳定性更好; 3. 人们在使用这些金属时应该小心谨慎,遵循操作规程,以免引发安全事故。
实验思考1.在实验中,为什么不能直接将碱金属和碱土金属放入水中?答:因为碱金属和碱土金属与水反应剧烈,易产生爆炸,导致安全事故,所以实验中需要小心操作,将碱金属和碱土金属分别放入盖玻片中,再将盖玻片放入水中。
2.为什么要将碱金属与酒精反应,而不是直接将其点燃?答:因为碱金属可与空气中的氧气反应生成氧化物,极易燃烧,若将其直接点燃,可能引起不可承受之高温,甚至是爆炸。
所以为了安全起见,要将碱金属先与酒精反应,然后再点燃酒精,观察其反应。
3.为什么碱土金属与热水反应,放出氢气?答:碱土金属与热水反应,会发生置换反应,金属中的离子会与水中的氢氧根离子发生反应,放出氢气,同时生成金属氢氧化物。
大学无机化学——碱金属和碱土金属

2 Na2O2 2CO2 2 Na2CO3 O2
Fe2O3 3 Na2O2 2 Na2 FeO4 Na2O Cr2O3 3 Na2O2 2 Na2CrO4 Na2O
还原性
5 Na2O2 2 MnO4 16 H 5O2 2 Mn2 10 Na 8 H 2O BaO2 H 2 SO4 H 2O2 BaSO4
性质 颜色 溶解度 酸碱性 碱金属 均为白色 很大(LiOH除外) 均为碱性 碱土金属 均为白色 较小(Mg(OH)2、 Be(OH)2难溶) 碱性(Be(OH)2除 外)
碱金属的其他性质:白色固体、易吸潮、溶于水放出大量的热
2)原因
溶解度规律: 阴、阳离子半径相差较大的离子型化合物在水中溶解
度较大,相近的溶解度较小,即 “相差溶解” 规律。
金属的氨溶液中含有金属离子和溶剂化自由电子, 这种溶剂化自由电子非常活泼,具有极强的还原能力, 金属的氨溶液:强还原性(低温)、导电性、顺磁性
氨合电子结构示意图
• 由于氨合电子存在, 溶液有导电性和顺磁 性, e(NH3)y- 是很强的还原剂, 用于无机和 有机合成. • 痕量杂质如过渡金属盐,氧化物,氢氧化物 存在或光化作用,能促进碱金属与氨的反应
第12章 碱金属和碱土金属
12-1 金属单质
12-2 含氧化合物
12-3 盐类
Li
Na
K
Rb Cs
Be
Mg
Ca
Sr
Ba
碱金属:IA族的金属单质。 锂、钠、钾、铷、铯、钫
碱土金属:IA族的金属单质。 铍、镁、钙、锶、钡、镭
由于IA族金属的氢氧化物都是强碱, 故称该族元素为碱金属
钙锶钡碱性“ 碱金属氧化物”和土性的 “氧化铝”之间,故称该族元素为碱土金 属
无机化学:碱金属与碱土金属

2 Mg(NO3)2 = 2 MgO + 4 NO2 + O2 4 LiNO3 = 2 Li2O + 4 NO2 + O2 2 NaNO3 = 2 NaNO2 + O2
LiCl·H2O = LiOH + HCl MgCl2·6H2O = Mg(OH)Cl + HCl + 5 H2O Mg(OH)Cl = MgO + HCl
性质 (1)室温下,均能与水和稀酸反应:
Na2O2+2H2O→2NaOH+H2O2 Na2O2+H2SO4→Na2SO4+H2O2 2KO2+2H2O→2KOH+H2O2+O2↑ 2KO2+2H2SO4→2K2SO4+H2O2+O2↑
(2)与CO2的反应:
2Na2O2+2CO2→2NaCO3+O2 ↑
552 1070 4351
564 971 3575
电负性
1.57 1.31 1.00 0.95 0.89
标准电极电势(酸)
-1.85 -2.375 -2.76 -2.89 -2.90
标准电极电势(碱)
-2.28 -2.69 -3.02 -2.99 -2.97
M2+(g)水合热/kJ·mol-1 2494 1921 1577 1443 1305
碱金属与碱土金属
第1节 一般性质 一、所形成的化合物多为离子型化合物(除Li,Be外) 以Be为例: 1、共价性强,BeF2 带有共价 性; 2、水解性,Be2+离子只能在 酸性溶液中存在,否则水解; 3、配合性质,形成的配合物 的数目比其他的元素多; 4、聚合性质,4BeAc2 + H2O = Be4OAc6 + 2HAc
主族金属碱金属,碱土金属实验报告

主族金属碱金属,碱土金属实验报告实验目的:1. 了解主族金属、碱金属和碱土金属的化学性质。
2. 熟悉实验操作过程。
3. 掌握安全实验技能。
实验原理:主族金属:主族金属是指在元素周期表周期表中,第1A-8A族的元素,这些元素通常具有很快的反应性和良好的导电性。
它们通常是纯净金属,在大气中易被氧化,因此实验中一般用封闭容器。
碱金属:碱金属是元素周期表第一列Ia族元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
碱金属具有低密度、柔软、良好的导电性等通用特性。
极易与其他元素化合形成盐和碱性氧化物。
碱金属还有着很强的还原性和活泼性。
碱土金属:碱土金属是元素周期表第二列ⅡA族元素,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
碱土金属的物理和化学性质与碱金属非常相似。
与碱金属相比,碱土金属更多地呈现出“电子Z的增大而大幅度降低成键能力,共价半径迅速增大,以及更高电离能”。
实验步骤:1. 确认实验器具是否齐备完整。
2. 用溴酸钾的火焰颜色实验手册作为比较标准,进行钠、钾、锶、钙、镁、铝金属燃烧实验。
记录每个实验结果。
3. 测定钙、银反应生成的沉淀。
4. 确认锌含量测量样品。
5. 测定钾或锂的电气化学性质。
实验结果:1. 钠、钾、锶、钙和镁金属进行燃烧实验,分别观察到明亮的黄色、紫色、红色、橙色和白色火花。
2. 测定了钙和银反应生成的沉淀,结果显示产生了白色、坚硬的沉淀物。
3. 测定结果表明,盐酸和氧化锌反应,二氧化碳气体被释放并导致溶液呈现棕色或红色。
4. 测定结果显示,由铜氯盐处理的锌棒,一引入棕色气体就失去了它的重量。
5. 测定了钾和锂的电气化学性质,测定结果显示它们都完全被氧化,而且反应速度很快。
通过本实验,我们进一步掌握了主族金属、碱金属和碱土金属的化学性质,熟悉了实验操作过程,并掌握了安全实验技能。
此次实验也使我们了解到了这些元素的广泛应用和重要性。
无机化学-碱金属与碱土金属元素-盐类化合物
Байду номын сангаас
1-1或2-2型 1-2或2-1型 1-3或3-1型 2-3或3-2型
△Gøs界线kJ•mol-1 22.8
30.8
38.5
45.6
3
(2) 半定量规则:
晶格能
△sG
MX(s) M+(aq) + X- (aq)
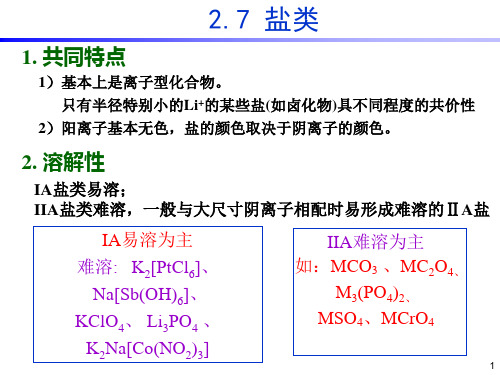
2.7 盐类
1. 共同特点
1)基本上是离子型化合物。 只有半径特别小的Li+的某些盐(如卤化物)具不同程度的共价性
2)阳离子基本无色,盐的颜色取决于阴离子的颜色。
2. 溶解性
IA盐类易溶; IIA盐类难溶,一般与大尺寸阴离子相配时易形成难溶的ⅡA盐
IA易溶为主
难溶: K2[PtCl6]、 Na[Sb(OH)6]、
2
离子晶体盐类溶解性的判断标准
(1) 溶解自由能变: MX(s) = M+(aq) + X- (aq) △sG
以溶解度0.01 mol L-1作为易溶和难溶的“界线”
MX(s) = Mn+(aq) + Xn-(aq) (n=1或2) KSP= [Mn+][Xn-] = (0.01)2 = 1×10-4 则:△Gøs = -RTlnKSP= 22.8 kJ mol-1
法。其基本原理: 先用NH3将食盐水饱和, 然后通入CO2,溶解
度较小的NaHCO3析出:
< 15 oC, 析出
NH3 + NaCl + H2O + CO2 NaHCO3 + NH4Cl
CaCO3 CaO + CO2 NH4Cl + CaO CaCl2 + NH3 + H2O
实验二十:主族金属(碱金属、碱土金属、铝、锡、铅、锑

实验二十:主族金属(碱金属、碱土金属、铝、锡、铅、锑、铋)〔实验目的〕1.比较碱金属、碱土金属的活泼性;2.试验并比较碱土金属、铝、锡、铅、锑、铋的氢氧化物和盐类的溶解性;3.练习焰色反应并熟悉使用金属钠、钾的安全措施。
〔实验原理〕主族金属包括ⅠA、ⅡA、p区位于硼到砹梯形连线的左下方元素。
金属元素的金属性表现在:其单质在能量不高时,易参加化学反应,易呈现低的正氧化态,并形成离子键化合物;标准电极电势是有较负的数值,氧化物的水合物显碱性,或两性偏碱性。
碱金属和碱土金属位于ⅠA和ⅡA族,在同一族中金属活泼性由上而下逐渐增强;在同一周期中从左至右逐渐减弱。
例如碱金属和碱土金属都易和氧化合。
碱金属在室温下能迅速地与空气中的氧反应。
钠、钾在空气中稍微加热即可燃烧生成过氧化物和超氧化物。
碱土金属活泼性略差,室温下这些金属表面会缓慢生成氧化膜。
加热燃烧时除可生成正常氧化物外,还可生成氮化物。
碱金属盐类最大的特点是易溶于水。
少数盐难溶于水:① Li+的难溶盐:LiF,Li2CO3,Li3PO4② K+的难溶盐:K2Na[Co(NO2)6]六亚硝酸根合钴(Ⅲ)酸钠钾(亮黄色);K[B(C6H5)4]四苯基硼酸钠(白色);KHC4H4O6酒石酸氢钾(白色)③ Na+的难溶盐:NaAc·ZnAc2·3UO2Ac2·9H2O醋酸铀酰锌钠(淡黄色);Na[Sb(OH)6]碱土金属盐类的重要特征是它们的难溶性,除氯化物、硝酸盐、硫酸镁、铬酸镁、铬酸钙易溶于水外,其余碳酸盐、硫酸盐、草酸盐、铬酸盐皆难溶。
氢氧化铝是两性氢氧化物,它可溶于过量的碱生成[Al(OH)4]-。
Al3+还能与一些配体形成稳定的配合物,如[AlF6]3-,[Al(C2O4)3]3-和[Al(EDTA)]-等。
锡、铅的氢氧化物都是两性的。
它们的酸碱性递变规律为:酸性增强Sn(OH)4Pb(OH)4 碱性增强Sn(OH)2Pb(OH)2砷、锑、铋的氧化值为+3的氢氧化物有H3AsO3,Sb(OH)3和Bi(OH)3,它们的酸性依次减弱,碱性依次增强。
碱金属和碱土金属

实验项目·碱金属和碱土金属
⑴在检出时,溶液应保持弱碱性,因为在酸性条件下,会产生白色无定形的 六羟基锑酸[HSb(OH)6]沉淀,干扰对 NaSb(OH)6 的判断:
碱金属和碱土金属
一、教学目的
1.比较碱金属、碱土金属的活泼性;
2.试验比较碱土金属氢氧化物和盐类的溶解性;
3.练习焰色反应并熟悉使用金属钾、钠的安全措施;
4.练习焰色反应的操作。
二、实验提要
碱金属、碱土金属分属周期系第ⅠA、ⅡA 族,价电子构型 ns1、ns2,属 s 区元素。其单质是最活泼的金属和还原剂,且从上到下,从碱金属到碱土金属活
表 1 一些常见金属焰色反应的特征颜色
Li
Na
K
Rb
Cs
Ca
Sr
Ba
玫瑰红 黄
紫 紫红 紫红 橙红 洋红 黄绿
纯净化合物放在无色火焰的氧化焰部分加热时,它们可以气化而使火焰染上
特殊的颜色。这是由于原子被激发后,电子从一个能级降到另一个能级时,所发
射出的特征光谱与原子的电子排布有关。不同元素具有不同的特征光谱,借此可
泼性增强。在空气中能迅速地与 O2、CO2、H2O 作用(Rb、Cs 在空气中自燃), 需保存在煤油或液体石蜡中(Be、Mg 由于生成致密氧化膜而除外)。在空气中
燃烧时,锂、碱土金属生成正常氧化物;钠主要生成过氧化物;而钾、铷、铯则
主要生成超氧化物。Na2O2 为淡黄色粉末状物质,与水或稀酸反应生成氢氧化钠 或钠盐,同时产生 H2O2。H2O2 会立即分解放出 O2,所以过氧化钠具有强碱性 和强氧化性。与水相遇,Be、Mg 由于表面形成致密氧化物保护膜而对水稳定, 分别需水蒸气及热水才反应,其它元素都易与冷水反应生成相应氢氧化物,放出
大学无机化学——碱金属和碱土金属

2)其他金属单质的制备
a、Be的制备 由于 BeCl的2 共价性较强,生产过程中需要加入
CaCl2或其他金属氯化物以增加熔盐的导电性
b、 MgCl 2 电解(750C) Mg Cl2
c、Ca、Sr、Ba都可以通过电解其熔融氯化物制备
Cs2O2
MgO2
CaO2
SrO 2
BaO2
Na2O2 MgCl2 (冷浓) MgO2 2NaCl
CaCl2 H2O2 CaO2 2HCl
高压
Sr O2
SrO2
一定温度
Ba O2
BaO2
过氧化物的性质
物理性质:粉末状固体、吸潮性 化学性质:
性质
方程式
与水或稀酸反应 与二氧化碳反应
Na2O2 2H2O H2O2 2NaOH Na2O2 H2SO4 H2O2 Na2SO4
Ca2+ 橙红色 Sr2+ 洋红色 Ba2+ 绿色 Cs+ 蓝色
Li
Na
K
Ca
Sr
Ba
12—1—3 金属单质的制备
常用方法: 1、熔盐电解法——Li、Na
Be、Mg、Ca、Sr、Ba
2、热还原法 ——K、Rb、Cs、Be
1)Na的制备
1、熔融电解法 ——将金属的氯化物熔融电解
CaCl2的作用
离子半径 I1/kJ·mol-1 I2/kJ·mol-1
χ Φθ/V
M+(aq)+e=M(s) M+水化能/kJ·mol-1
Li 2s1 +I 60 520 7298 1.0
-3.045
碱金属与碱土金属总结

【金属单质】Li Na K Rb CsBe Mg Ca Sr Ba1、物理性质①、共性:碱金属与碱土金属的单质都具有银白色的金属光泽,具有良好的导电性和延展性。
②、特性:碱金属a、熔点较低除Li外都在100℃以下(Cs熔点最低放手上就融化)b、沸点熔点的温度间距较大,沸点一般比熔点高700℃以上1c、较软莫氏硬度都小于1,可以用刀子切割d、.密度都娇小属于轻金属碱土金属有2个电子可以参与成键,因而金属键比碱金属的强,碱土金属的熔沸点、硬度、密度都比碱金属高得多。
2、化学性质①、共性:a、碱金属和碱土金属都是非常活泼的金属元素,同族从Li到Cs和从Be到Ba活泼性依次增强。
b、.都有很强的还原性,与许多非金属单质直接反应生成离子型化合物。
在绝大多数化合物中,它们以正离子形式存在。
②、与H2O反应碱金属及Ca Sr Ba同水反应生产氢氧化物和氢气如:2Na+2H2O=2NaOH+H22Ca+2H2O=Ca(OH)2+H2(注:a、Li Ca Sr Ba与水反应较平稳,因为它们的熔点较高,不易融化,与水反应不激烈;另一方面,由于它们的氢氧化物溶解度小,生成的氢氧化物覆盖在金属表面阻碍金属与水接触,从而减缓反应。
b、Be Mg的金属表面可以形成致密的氧化物保护膜,常温下它们对水是稳定的。
c、.其他碱金属与水反应非常剧烈,量大时会发生爆炸。
这些碱金属的熔点很低,与水反应放出的热恋是金属熔化为液态,跟有利于反应的进行;同时它们的氢氧化物溶解度很大,不会对反应起阻碍作用。
)③、与H2反应碱金属及Ca Sr Ba均可直接与H2作用,生成金属氢化物如:H2+Ca=CaH2(423-573K条件下)产物氢化钙是很强的还原剂用途:氢气发生剂、还原剂、干燥剂及还原氧化物金属④、与液氨碱金属及Ca Sr Ba均可溶于液氨中生成蓝色的导电溶液,高溶液中含有金属离子和溶剂化的只有电子,具有极强的还原能力。
3Na+2NH3(l)=Na+(NH3)+e-(NH3)⑤、制备稀有金属或贵金属由于碱金属和一些碱土金属单质都与水激烈反应,所以它们不能在水溶液中做还原剂使用。
大学无机下册第12章 碱金属和碱土金属

2 * 2 2 4 * 4 KK (σ ) ( σ ) ( σ ) ( ) ( π ) 2 s 2 p 2s 2p 2p 2 * 2 2 4 * 3 KK (σ ) ( σ ) ( σ ) ( ) ( π ) 2 s 2 p 2s 2p 2p
1.碱金属氧化物
M+离子半径越小,作用于水分子的电场越强, 水合热越大,水合物越稳定。
碱土金属规律不明显。 6. 水解性
碱金属弱酸盐均水解-碱性 碱土金属:BeCl2· 4H2O BeO+2HCl+3H2O
MgCl2· 6H2O→Mg(OH)Cl → MgO
7. 形成复盐的能力
光卤石类:MCl· MgCl2· 6H2O M=K+、Rb+、Cs+ M2SO4· MSO4· 6H2O M2SO4· M2(SO4)3· 24H2O
⑵与两性金属(Zn、 Al)、某些非金属(B、Si) 及其氧化物反应 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑ Al2O3+2NaOH=2NaAIO2+H2O
Si+2NaOH(浓)+H2O=Na2SiO3+2H2↑
SiO2+2NaOH=Na2SiO3+H2O(玻璃瓶用橡皮塞)
2Na2CO3 + O2↑ 2Na2CrO4 + Na2O
2Na2CrO4+4NaOH
2NaCrO2 + 3Na2O2 + 2H2O
Na2MnO4 (熔矿剂)
碱性条件下为强氧化剂,遇棉花、木炭等爆炸.
⑶ 超氧化物 K (Rb、Cs) + O2
碱金属和碱土金属

除 Be,Mg 之外,均可以和 H2 反应,生成 金属氢化物,例如:
Ca + H2 —— CaH2 产物 CaH2 为灰色离子晶体,其中 H 显-1 价, Ca 显 + 2 价,
活泼金属的氢化物是强还原剂,
除 Be,Mg 之外,均可溶于液氨中形成蓝 色的导电溶液
Na + 2NH3 —— Na+ NH3 + e - NH3
碱金属、碱土金属及其化合物置于高温 火焰中,可以使火焰呈现出特殊的颜色,称 焰色反应,
锂-深红色,钠-黄色,钾-紫色,铷 -紫红色,铯-蓝色,钙-橙红色,锶-洋 红色,钡-绿色,
12-1-3 金属单质的制备
碱金属和碱土金属等活泼金属经常采用熔 盐电解方法和热还原法生产,
碱金属中的 Li 和 Na 常用电解熔融氯化物 的方法大量生产,而 K,Ru,Cs 则采用金属 热还原法制备,
钠 Na
钠长石 NaAlSi3O8
硝石
NaNO3
海水中的 NaCl
盐井中的 NaCl
钠在地壳中的质量分数为 2.3 %
钾K 钾长石 KAlSi3O8 海水中的钾离子 钾在地壳中的质量分数为 2.1 %
铷 Rb 与锂、钾共生 铷在地壳中的质量分数为 9.0 10-3 %
铯 Cs 与钾共生 铯在地壳中的质量分数为 3.0 10-4 %
锶 Sr 碳酸盐及硫酸盐矿物 锶在地壳中的质量分数为 0.037 %
钡 Ba 碳酸盐及硫酸盐矿物 钡在地壳中的质量分数为 0.050 %
12-1 金属单质
12-1-1 物理性质
碱金属和碱土金属单质都具有银白的金属 光泽,具有良好的导电性和延展性,
碱金属的熔点较低,除锂外都在 100 ℃以 下,铯的熔点最低,熔点与沸点差距较大,沸 点一般比熔点高出 700 ℃ 以上,
12-5碱金属和碱土金属 -盐类-新

12—3—1盐的溶解性 1、碱金属盐
碱金属盐类通常易溶于水, 且它们的 离子都是无色,只有少数碱金属盐是难溶 的. 1)Li的盐类 Li+半径小, 极化能力强,其强酸盐易溶于水,
如LiCl、LiNO3, 而其弱酸盐溶解性较差,
如Li2CO3、Li3PO4、LiF。
4
碱金属
盐
化学式
砷酸铀酰钠
NaUO2AsO4
矾类(II)
M(I)2SO4·M(III)(SO4)2·24H2O( M(I)=Na+、K+、Rb+、Cs+, M(III)=Al3+、Cr3+、Fe3+等)
15
12—3—3含氧酸盐的热稳定性
1、硝酸盐的热分解
硝酸盐
分解产物
举例
碱金属的硝酸盐 (较低温度)
MNO2+O2 K、Rb、Cs 的盐分解类似
无机化学多媒体电子教案
第十二章 碱金属和碱土金属元素
第三节 盐类
1
12-3 盐类的性质
绝大多数碱金属、碱土金属盐类的晶体 属于离子晶体,熔、沸点较高。常温下 是固体,熔化时能导电。
铍碱与金易属变形、的碱阴土离金子属的与化无合色物为阴共离价子化形合成物的 化合物是无色或白色;
因碱为金Be属2+半、径碱小土,金电属荷与较有多,色极阴化离力子较形强成。的 化合如物B常eC呈l2阴是离共子价的化颜合色物。:
原因就是它含有氯化镁
MgCl2·6H2O受热 失水并水解,最 后产物为氧化物
>408K MgCl2·6H2O==Mg(OH)Cl+HCl+5H2O
~770K Mg(OH)Cl====MgO+HCl
无水氯化镁 的制备:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验二十二碱金属和碱土金属
[实验目的]
比较碱金属、碱土金属的活泼性。
试验并比较碱土金属氢氧化物和盐类的溶解性。
练习焰色反应并熟悉使用金属钾、钠的安全措施。
[实验用品]
仪器:烧杯、试管、小刀、镊子、坩埚、坩埚钳、离心机
固体药品:钠、钾、镁条、醋酸钠
液体药品:汞、NaCl(1mol·L-1)、KCl(lmol·L-1)、MgC12(0.5mol·L-1)、CaC12(0.5mol·L-1)、BaC12(0.5mol·L-1)、新配制的NaOH(2mol·L-1)、氨水(6mol·L-1)、NH4Cl(饱和)、
Na2CO3(0.5mol·L-1、饱和)、HCl(2mol·L-1)、HAc(2mol·L-1、6mol·L-1)、HNO3(浓)、
Na2SO4(0.5mol·L-1)、CaSO4(饱和)、K2CrO4(0.5mol·L-1)、KSb(OH)6(饱和)、
(NH4)2C2O4(饱和)、NaHC4H4O6(饱和)、AlCl3(0.5mol·L-1)
材料:铂丝(或镍铬丝)、pH试纸、钴玻璃、滤纸
[实验内容]
一、钠、钾、镁的性质
1.钠与空气中氧的作用
用镊子取一小块金属钠(绿豆大),用滤纸吸干其表面的煤油,切去表面的氧化膜,立即置于坩埚中加热。
当钠开始燃烧时,停止加热。
观察反应情况和产物的颜色、状态。
冷却后,往坩埚中加入2ml蒸馏水使产物溶解,然后把溶液转移到一支试管中,用pH试纸测定溶液的酸碱性。
再用2mol·L-1H2SO4酸化,滴加1~2滴0.01mol·L-1KMnO4溶液。
观察紫色是否褪去。
由此说明水溶液是有H2O2,从而推知钠在空气中燃烧是否有Na2O2生成。
写出以上有关反应方程式。
现象和解释
2Na + O2Na2O2黄色粉末
Na2O2 + 2H2O == H2O2++ 2NaOH
5H2O2 + 2MnO4- + 6H+ == 2Mn2+ + 8H2O + 5O2
2、钠、钾、镁与水的作用
用镊子取一小块金属钾和金属钠,用滤纸吸干其表面的煤油,切去表面的氧化膜,立即将它们分别放入盛水的烧杯中。
可将事先准备好的合适漏斗倒扣在烧杯上,以确保安全。
观察两者与水反应的情况,并进行比较。
反应终止后,滴入1~2滴酚酞试剂,检验溶液的酸碱性。
根据反应
进行的剧烈程度,说明钠、钾的金属活泼性。
写出反应式。
现象和解释
Na燃烧为黄光,有气体生成,K燃烧为红光,有气体生成。
溶液呈碱性。
2Na + 2H2O === 2NaOH + H2↑
2K + 2H2O === 2KOH + H2↑
取一小段镁条,用砂纸擦去表面的氧化物,放入一支试管中,加入少量冷水。
观察有无反应。
然后将试管加热,观察反应情况。
加入几滴酚酞检验水溶液的酸碱性,写出反应式。
现象和解释
Mg + 2H2O === Mg(OH)2 + H2↑有气体放出
二、镁、钙、钡的氢氧化物的溶解性
(1)在三支试管中,分别加入0.5ml 0.5mol·L-1MgCl2、CaCl2、BaCl2氯化镁溶液,再各加入0.5ml 2mol·L-1新配制的NaOH溶液。
观察沉淀的生成。
然后把沉淀分成两份,分别加入6mol·L-1盐酸溶液和6mol·L-1氢氧化钠溶液,观察沉淀是否溶解,写出反应方程式。
现象和解释
Mg2+ + 2HO- === Mg(OH)2↓
Ca2+ + 2OH- === Ca(OH)2↓
Ba2+ + 2OH- === Ba(OH)2↓都有白色沉淀生成
Mg(OH)2 + 2H+ === Mg2+ + 2H2O
Mg(OH)2↓、Ca(OH)2↓、Ba(OH)2↓在HCl中可溶,在NaOH中不溶。
(2)在试管中加入0.5ml 0.5mol·L-1氯化镁溶液,再加入等体积0.5mol·L-1NH3.H2O,观察沉淀的颜色和状态。
往有沉淀的度管中加入饱和NH4Cl溶液,又有何现象?为什么?写出反应方程式。
现象和解释
Mg2+ + 2NH3.H2O == Mg(OH)2↓+ 2NH4+
Mg(OH)2 + 2H+ == Mg2+ + 2H2O
Mg(OH)2↓在NH4Cl中可溶,在NaOH中不溶。
三、碱金属、碱士金属元素的焰色反应
取一支铂丝(或镍铬丝),铂丝的尖端弯成小环状,蘸以6mol·L-1盐酸溶液在氧化焰中烧片刻,再浸入盐酸中,再灼烧,如此重复直至火焰无色。
依照此法,分别蘸取1mol·L-1氯化钠、氯化钾、氯化钙、氯化锶、氯化钡溶液在氧化焰中灼烧,观察火焰的颜色。
每进行完一种溶液的焰色反应
后,均需蘸浓盐酸溶液灼烧铂丝(或镍铬丝),烧至火焰无色后,再进行新的溶液的焰色反应。
观察钾盐的焰色时,为消除钠对钾焰色的干扰,一般需用蓝色钴玻璃片滤光后观察。
现象和解释
NaCl(黄)、KCl(浅紫)、CaCl2(洋红)、SrCL2(红)、BaCl2(黄绿)
[实验习题]
1.若实验室中发生镁燃烧的事故,可否用水或二氧化碳来灭火,应用何种方法灭火?
答:不能,因为镁能和它们发生反应。
应该用砂灭火。
