第八章 碱金属和碱土金属
碱金属和碱土金属(课后基础习题)

碱金属和碱土金属1、碱土金属的熔点比碱金属的高,硬度比碱金属的大,试说明其原因。
2、为什么元素铍与其它非金属成键时,化学键带有较大的共价性,而其它碱土元素与非金属所成的键则带有较大的离子性?3、写出BaCl2和CaCl2的水溶液分别加入碳酸铵,接着加入醋酸、再加入铬酸钾时的反应式。
4、在碱金属中Li的电极电势最低,但Li的金属活泼性却最弱。
如何解释?5、金属Na的金属活泼性低于K、Rb、Cs,但却可用金属Na在高温下还原K、Rb、Cs的氯化物制备K、Rb、Cs单质。
为什么?6、简要说明Li+、Na+、K+、Mg2+、Ca2+、Ba2+常见的难溶盐有哪些?7、一固体混合物可能含有MgCO3、Na2SO4、Ba(NO3)2、AgNO3、CuSO4。
混合物投入水中得到无色溶液和白色沉淀,将溶液进行焰色试验,火焰呈黄色,沉淀可溶于稀盐酸并放出气体。
试判断哪些物质肯定存在,哪些物质可能存在,哪些物质肯定不存在,并分析原因。
8、一白色粉末混合物,可能含有KCl、MgSO4、BaCl2、CaCO3。
根据下列实验结果确定其实际组成。
(1)混合物溶于水得无色溶液;(2)对溶液作焰色反应,通过蓝色钴玻璃可观察到紫色;(3)向溶液中加碱,生成白色沉淀。
10、简要回答下列问题:(1)在水中LiF的溶解度小于AgF,而LiI的溶解度大于AgI;(2)同周期的碱土金属比碱金属的熔点高、硬度大;(3)锂的标准电极电势比钠的低,但钠与水反应却比锂与水反应剧烈;(4)在水中的溶解度LiClO4>NaClO4>KClO4;(5)CsF的离子性极强,CsF但的熔点却较低;(6)过氧化钠常用作制氧剂。
11、完成并配平有关的化学反应方程式。
(1)在液氨中金属钠与过量的氧气反应;(2)碳酸氢钙加热分解;(3)金属钠与亚硝酸钠反应;(4)超氧化钾投入水中;(5)氮化镁投入水中;(6)六水合氯化镁加热分解;(7)氢化钠投入水中;(8)金属镁还原四氯化钛;(9)氯化锂溶液中滴加磷酸氢二钠溶液;(10)金属铍溶于烧碱溶液。
碱金属和碱土金属

碱金属和碱土金属碱金属和碱土金属是元素周期表中的两个重要类别。
它们在化学性质、物理性质和应用方面有很多共同之处,但也有一些显著的差异。
本文将介绍碱金属和碱土金属的基本特点、重要性质及其在实际应用中的作用。
一、碱金属碱金属是周期表中位于第一族,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素都是非常活泼的金属,具有强烈的还原性。
它们在常温下存在于固态,是银白色的质地柔软金属,能轻松被切割,并且具有低密度和低熔点。
碱金属具有以下一些重要性质:1. 高反应性:碱金属在常温下与水反应产生大量的氢气和碱溶液,释放出巨大的热量。
这种反应非常剧烈,有时可以引起爆炸。
例如,钠在与水接触时会迅速产生白色火焰和剧烈的燃烧。
因此,碱金属的处理需要极高的小心和专业知识。
2. 高电离能:碱金属的外层电子非常容易被剥离,因此具有很低的电离能。
这使得它们可以很容易地丧失电子形成阳离子,并与其他元素形成化合物。
3. 强烈的还原性:碱金属是非常强大的还原剂,能够夺取其他元素的电子,并参与许多重要反应。
例如,钾在与氧气反应时会猛烈燃烧,产生明亮的火焰。
4. 高热导率:碱金属具有极高的热导率,这使得它们在冷却和传热技术方面非常有用。
铯是所有金属中热导率最高的元素。
碱金属在许多领域具有广泛应用。
它们可用于制造合金、金属薄膜、电池、催化剂等。
其中最常见的应用是用作发光剂和制备碱金属离子的闪烁屏幕。
此外,碱金属离子在生物医学领域中也具有重要应用,例如在MRI(核磁共振成像)中作为对比剂。
二、碱土金属碱土金属是元素周期表中位于第二族,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
与碱金属相比,碱土金属的化学性质相对较为稳定,但仍然具有明显的金属性质。
它们在常温下也是固态,但与碱金属不同的是,碱土金属较硬和坚硬。
碱土金属具有以下一些重要性质:1. 抗氧化性:碱土金属相对于碱金属来说较为惰性,不容易与空气中的氧气发生反应。
无机化学实验报告:碱金属碱土金属铝锡铅锑铋
不再呈现任何离子的特征颜色。 2、用洁净的铂丝蘸取 1 mol·L-1 LiCl、NaCl、KCl、CaCl2、SrCl2、BaCl2 在氧化焰灼烧。
现象:
注意:由于K盐中往往会含有少量的钠盐,实验表明,当K盐中含有 1/105的钠盐时,就会在焰色中只看 到钠的黄色,为了消除钠焰色的干扰,要用一块蓝色钴玻璃片滤去钠黄色光进行观察。
2×10-27
实验指导
◆ 在做沉淀溶解性实验时,可用离酸性溶液中可以代替 H2S,在碱性溶液中可代替 Na2S [(NH4)2S]。
◆
[问题讨论] 1、如何配制 SnCl2 溶液。
2、 PbO2 与浓 HCl 如何反应的? PbO2 具有强氧化性,能氧化 HCl 生成 Cl2,同时 PbCl2 PbO2 + 4HCl = PbCl2↓ + Cl2↑+2H2O (与 MnO2+ 4HCl =MnCl2 + Cl2↑+2H2O△)
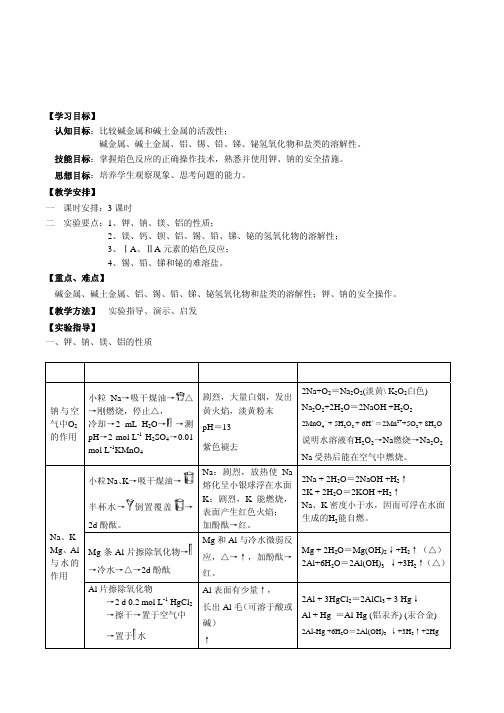
实验八 碱金属、碱土金属、铝、锡、铅、锑、铋
【学习目标】 认知目标:比较碱金属和碱土金属的活泼性; 碱金属、碱土金属、铝、锡、铅、锑、铋氢氧化物和盐类的溶解性。 技能目标:掌握焰色反应的正确操作技术,熟悉并使用钾、钠的安全措施。
思想目标:培养学生观察现象、思考问题的能力。
【教学安排】
一 课时安排:3 课时 二 实验要点:1、钾、钠、镁、铝的性质;
橙黄
热水 (浓 NaAc \ KI \ Na2S2O3 )
7.1×10-9
PbCrO4 黄色
HNO3、NaOH、
2.8×10-13
PbSO4 白色
碱金属碱土金属

碱金属碱土金属
碱金属和碱土金属都是化学元素周期表中的两个重要类别。
碱金属包括锂、钠、钾、铷、铯和钫,而碱土金属包括铍、镁、钙、锶、钡和镭。
这两个元素类别都有许多共同点和不同之处。
首先,碱金属和碱土金属都是典型的金属元素。
它们的原子结构有一个或两个电子轻松地从外层轨道中释放出来,使其成为相对稳定的阳离子。
碱金属和碱土金属的这种特性使得它们在化学反应中表现出非常活泼的性质,特别是在水中。
其中,碱金属时,它们与水反应的产物是碱性化合物和氢气,而碱土金属反应时的产物是氢氧化物或氧化物。
其次,碱金属和碱土金属具有较低的密度。
其中,锂的密度约为0.53克/立方厘米,钙的密度约为1.54克/立方厘米。
由于其低密度和活泼性质,这些元素在工业上有着广泛的应用,包括用于制造轻金属、电池和荧光材料等。
此外,碱金属和碱土金属显示出不同的化学活性。
与碱金属相比,碱土金属更难活泼,因为它们的外层电子数更多,需要更多的能量来释放。
因此,碱金属通常具有更强的还原性和更大的反应活性,而碱土金属则更倾向于形成阳离子化合物而不反应。
最后,碱金属和碱土金属在生命中起着不同的作用。
碱金属在生物体内起着独特的作用,如钾在神经细胞中传递电信号,而铷和钫在细胞膜的稳定性和脂肪酸代谢方面发挥作用。
碱土金属在血液凝固、骨骼健康和身体免疫系统等方面起着重要作用。
总的来说,碱金属和碱土金属虽然有许多共性,但在性质和应用方面也有一些重要的不同。
它们在许多诸如电子学、化学合成、生命科学和材料科学等领域中都扮演着至关重要的角色。
碱金属与碱土金属的区别

碱金属与碱土金属的区别碱金属和碱土金属是化学元素周期表中两个重要的元素家族。
它们在物理性质、化学性质以及在自然界中的分布等方面存在着显著的区别。
本文将详细探讨碱金属和碱土金属的区别。
一、物理性质的区别1. 密度和硬度:碱金属的密度和硬度较低,比较轻盈,容易被切割和压制成各种形状。
而碱土金属的密度和硬度相对较高,比碱金属更坚硬且具有更高的密度。
2. 熔点和沸点:碱金属具有相对较低的熔点和沸点,例如钾的熔点为63.38℃,锂的熔点为180.54℃。
而碱土金属的熔点和沸点相对较高,例如镁的熔点为649℃,钙的熔点为842℃。
3. 导电性:碱金属具有很高的导电性,可以很容易地导电。
碱土金属也具有良好的导电性,但相对于碱金属来说稍逊一筹。
二、化学性质的区别1. 与水反应:碱金属具有与水剧烈反应的性质,生成碱性氢氧化物和氢气。
例如,钠与水反应产生氢气并生成氢氧化钠。
而碱土金属与水反应较为缓慢,生成相应的碱土金属氢氧化物和氢气。
例如,钙与水反应生成氢气并生成氢氧化钙。
2. 氧化性:碱金属具有较强的氧化性,容易损失电子形成正离子。
碱土金属也具有一定的氧化性,但相对于碱金属来说较低。
3. 化合价:碱金属的化合价多为+1,例如钠的氧化状态为+1。
而碱土金属的化合价多为+2,例如镁的氧化状态为+2。
三、自然界中的分布1. 碱金属在自然界中相对较为稀少,主要以盐湖和海水中的含量较高。
其中,氯化钠是最常见的碱金属盐。
2. 碱土金属在自然界中相对较为丰富,分布广泛。
例如,镁和钙广泛存在于岩石、矿石和土壤中。
四、应用领域的区别1. 碱金属应用:碱金属广泛应用于多个领域,包括电池、合金制备、烟火制造、钢铁生产等。
钾化合物还用于肥料的制造。
2. 碱土金属应用:碱土金属在建筑材料、医学、农业等领域中有着重要的应用。
例如,镁合金用于航空和汽车制造,钙化合物可用作水泥生产中的添加剂。
结论总的来说,碱金属和碱土金属在物理性质、化学性质、自然界分布以及应用领域等方面存在显著的区别。
碱金属与碱土金属总结

【金属单质】Li Na K Rb CsBe Mg Ca Sr Ba1、物理性质①、共性:碱金属与碱土金属的单质都具有银白色的金属光泽,具有良好的导电性和延展性。
②、特性:碱金属a、熔点较低除Li外都在100℃以下(Cs熔点最低放手上就融化)b、沸点熔点的温度间距较大,沸点一般比熔点高700℃以上1c、较软莫氏硬度都小于1,可以用刀子切割d、.密度都娇小属于轻金属碱土金属有2个电子可以参与成键,因而金属键比碱金属的强,碱土金属的熔沸点、硬度、密度都比碱金属高得多。
2、化学性质①、共性:a、碱金属和碱土金属都是非常活泼的金属元素,同族从Li到Cs和从Be到Ba活泼性依次增强。
b、.都有很强的还原性,与许多非金属单质直接反应生成离子型化合物。
在绝大多数化合物中,它们以正离子形式存在。
②、与H2O反应碱金属及Ca Sr Ba同水反应生产氢氧化物和氢气如:2Na+2H2O=2NaOH+H22Ca+2H2O=Ca(OH)2+H2(注:a、Li Ca Sr Ba与水反应较平稳,因为它们的熔点较高,不易融化,与水反应不激烈;另一方面,由于它们的氢氧化物溶解度小,生成的氢氧化物覆盖在金属表面阻碍金属与水接触,从而减缓反应。
b、Be Mg的金属表面可以形成致密的氧化物保护膜,常温下它们对水是稳定的。
c、.其他碱金属与水反应非常剧烈,量大时会发生爆炸。
这些碱金属的熔点很低,与水反应放出的热恋是金属熔化为液态,跟有利于反应的进行;同时它们的氢氧化物溶解度很大,不会对反应起阻碍作用。
)③、与H2反应碱金属及Ca Sr Ba均可直接与H2作用,生成金属氢化物如:H2+Ca=CaH2(423-573K条件下)产物氢化钙是很强的还原剂用途:氢气发生剂、还原剂、干燥剂及还原氧化物金属④、与液氨碱金属及Ca Sr Ba均可溶于液氨中生成蓝色的导电溶液,高溶液中含有金属离子和溶剂化的只有电子,具有极强的还原能力。
3Na+2NH3(l)=Na+(NH3)+e-(NH3)⑤、制备稀有金属或贵金属由于碱金属和一些碱土金属单质都与水激烈反应,所以它们不能在水溶液中做还原剂使用。
碱金属碱土金属课件

碱金属和碱土金属的化合物在药物合成中具有重要作用,如锂盐在抑郁症治疗中的应用。
医学成像
某些碱金属和碱土金属的放射性同位素可用作医学成像的示踪剂,如氟-18在正电子发 射断层扫描中的应用。
钾
总结词
中等活跃的碱金属元素
详细描述
钾是碱金属元素中的一种,原子序数为19,原子量为39.098。在标准条件下, 钾是银白色的金属,具有较高的熔点和沸点,与水反应剧烈。
铷
总结词
较为活泼的碱金属元素
详细描述
铷是碱金属元素中的一种,原子序数为37,原子量为85.4678。在标准条件下,铷是银白色的金属, 具有较低的熔点和沸点,与水反应非常剧烈。
碱金属在常温下呈液态的有锂、钠、钾,呈固态的有铯; 碱土金属在常温下都是固态。
熔点与沸点
碱金属的熔点较低,其中钠、钾的熔点在300℃ 01 以下,锂的熔点略高于钠、钾。
碱土金属的熔点较高,如铍、镁、钙的熔点均在 02 1000℃以上。
碱金属的沸点较低,如钠、钾的沸点在800℃左 03 右;而碱土金属的沸点较高,如钙的沸点为
与空气的反 应
碱金属与空气的反 应
碱金属元素暴露在空气中易被氧化, 如钠在空气中会逐渐氧化成氧化钠或 过氧化钠。
碱土金属与空气的反 应
碱土金属元素在空气中也容易被氧化, 如镁在空气中会逐渐氧化成氧化镁。
碱金属和碱土金属的物理性 质
颜色与状态
碱金属单质通常是银白色金属,但铯略带金色;碱土金 属单质则是银白色或灰色。
铯
总结词
最活泼的碱金属元素
详细描述
铯是碱金属元素中的一种,原子序数为55,原子量为 132.90547。在标准条件下,铯是银白色的金属,具有最低 的熔点和沸点,极易与水和氧气反应,甚至在空气中就可以 自燃。
碱金属和碱土金属元素

MCO3 === MO + CO2 Mg、Ca、Sr、Ba的碳酸盐分解温度依次升高。
第十三章、硼族元素
硼族元素
第ⅢA,B、Al、Ga、In、Tl称为硼族。除B 外,其它都是金属,电子价层结构为ns2np1。
硼族元素的通性
硼族元素的单质及其化合物
硼在自然界中主要以硼酸盐形式存在。硼砂 ,Na2B4O7.10H2O,方硼石,2Mg3B8O15.MgCl2等 。铝主要以铝矾土矿形式存在,它在地壳里含量 仅仅次于氧和硅。
• 过氧化物 碱金属和碱土金属,除Be未发现有过氧化物外, 都能生成含有O22-离子的过氧化物。
453-473K
4Na + O2 === 2Na2O
573-673K
2Na2O + O2 === 2Na2O2 Na2O2 + 2H2O === H2O2 + 2NaOH Na2O2 + H2SO4 === H2O2 + Na2SO4 2Na2O2 + CO2 === 2Na2CO3 + O2
• Ga、In、Tl属稀有元素,学生自学了解。
• 单质硼的提取 工业上用浓碱来分解硼镁矿:
Mg2B2O5.H2O + 2NaOH === 2NaBO2 + 2Mg(OH)2 4NaBO2 + CO2 + 10H2O ===
Na2B4O7.10H2O + Na2CO3 Na2B4O7 + H2SO4 + 5H2O === 4H3BO3 + Na2SO4
△
2Al(OH)3 === Al2O3 + 3H2O
Na3AlF6
2Al2O3
===Biblioteka 电解4Al+
第八章主族金属元素(一) 碱金属和碱土金属

1、碱性规律: LiOH NaOH KOH RbOH CsOH 中强碱 强碱 强碱 强碱 强碱 2、代表物质NaOH:又称烧碱、火碱、苛性碱 具有强碱性,除了与非金属及其氧化物作 用外,还 与一些两性金属及其氧化物作用,生成钠盐。
Si+2NaOH+H2O ─→2Na2SiO3+2H2 SiO2+2NaOH ─→Na2SiO3+H2O 2Al+2NaOH+2H2O ─→2NaAlO2+3H2 AL2O3+2NaOH ─→2NaAlO2+H2O
第二节 碱 金 属
Li Na K Rb Cs
一、碱金属元素概述: 1、碱金属是IA族S区元素,包括锂、钠、钾、铷、铯和 钫 2、价电子结构:ns1 3、金属性:同周期元素中,原子半径最大,易失1个电 子,表现出强烈的金属性。本族自上而下原子半径和离 子半径依次增大,其活泼性有规律地增强。
碱金属的基本性质
量以光的形式放出。原子的结构不同,就发出不同波长的光
,所以光的颜色也不同。碱金属和碱土金属等能产生可见光 谱,而且每一种金属原子的光谱线比较简单,所以容易观察 识别。
5、碱金属元素的化合物多为离子型化合物 6、对角线规则:在周期表中某一元素的性质和它右下方的 另一元素相似的现象。 Li Be B C ╲ ╲ ╲ Na Mg Al Si 氢氧化物:锂、镁为中强碱,水溶性小,受热易分 解为氧化物;锂和镁的氟化物、碳酸盐、磷酸盐等都难溶 于水。 Be和Al 的单质及化合物都具有两性特点。
2LiH
500℃-600℃ 2Na + H2 2NaH 2、化性:主要有LiH和NaH,皆为白色粉末,是离子型 化合物,是很强的还原剂: NaH + H2O ─→ NaOH + H2↑ 剧烈反应 4NaH + TiCl4 ─→ Ti + 4NaCl + 2H2 强还原性 4LiH + AlCl3 ─→ Li[AlH4] + 3LiCl 四氢铝锂是白色多孔的轻质粉末状复合氢化物,用于制 备有机试剂、药物、香料。
碱金属碱土金属教学课件

碱金属元素具有较低的原子序数,表现出强烈的金属性,具 有活泼的化学性质;碱土金属元素具有较高的原子序数,表 现出相对较强的非金属性,化学性质相对较稳定。
在周期表中的位置
碱金属元素
包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr),位于 周期表中的第1族(IA族)。
碱土金属元素
水生生物毒性效应
高浓度的碱金属和碱土金 属会对水生生物产生毒性 效应,影响其生长和繁殖 。金属和碱土金属在土壤中积累,会 导致土壤污染,影响农作物的生长和 质量。
这些金属元素会降低土壤中微生物的 活性,影响土壤的生态平衡。
土壤结构破坏
过量的碱金属和碱土金属可能导致土 壤结构破坏,影响土壤的通气性和保 水性。
碱金属碱土金属教学课件
contents
目录
• 碱金属和碱土金属的简介 • 碱金属和碱土金属的物理性质 • 碱金属和碱土金属的化学性质 • 碱金属和碱土金属的化合物 • 碱金属和碱土金属的应用 • 碱金属和碱土金属的环境影响
01
碱金属和碱土金属的 简介
定义与特性
定义
碱金属和碱土金属是元素周期表中的两类元素,位于IA和IIA 族。
热导率
碱金属和碱土金属的热导率较高,这 意味着它们具有良好的热传导性能。 这主要是因为金属中的自由电子可以 有效地传递热量。
03
碱金属和碱土金属的 化学性质
氧化还原反应
总结词
碱金属和碱土金属在氧化还原反应中表现出不同的性质。
详细描述
碱金属元素如锂、钠、钾具有较强的还原性,容易失去电子成为正离子,而碱土金属元素如镁、钙、锶、钡则具 有相对较弱的还原性。在氧化还原反应中,碱金属通常作为还原剂,而碱土金属则可以作为氧化剂或还原剂。
碱金属和碱土金属

碱金属和碱土金属在化学元素周期表中,碱金属和碱土金属是两个重要的元素类别。
它们在自然界中广泛存在,具有独特的化学和物理性质。
本文将深入探讨碱金属和碱土金属的特点、用途以及对环境和人类健康的影响。
一、碱金属碱金属是指位于元素周期表第1A族的锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和铍(Fr)。
它们通常具有相似的特性,并且在自然界中以化合物形式存在。
碱金属的特点如下:1. 金属性质:碱金属是典型的金属元素,具有良好的导电性和导热性。
2. 电子配置:碱金属的电子配置以ns1的形式出现,其外层只有一个s电子,容易失去这个电子形成带正电荷的离子。
3. 低密度:碱金属的密度相对较低,从锂到铯依次递增。
4. 相对活泼:碱金属对水和空气中的氧气具有很高的反应性,它们能够与水反应产生氢气,并在空气中形成氧化物。
碱金属具有广泛的应用领域。
首先,钠和钾是人体必需的微量元素,对维持正常的生理功能至关重要。
其次,碱金属可以用于制备合金、导热材料、催化剂等。
此外,碱金属化合物还被广泛应用于玻璃工业、电池制造、化学实验等领域。
然而,碱金属也存在一些潜在的危害性。
例如,钠和钾金属与水反应时会放出大量的氢气,可能引发火灾。
此外,过量摄入碱金属离子对人体健康有害,可能导致水电解质平衡失调甚至中毒。
二、碱土金属碱土金属是周期表中第2A族的含钙(Ca)、镁(Mg)、锶(Sr)、钡(Ba)和镭(Ra)的元素。
与碱金属相比,碱土金属的化学性质略微稳定。
以下是碱土金属的主要特点:1. 金属性质:碱土金属也是典型的金属元素,具有较好的导电性和导热性。
2. 电子配置:碱土金属的电子配置为ns2,外层具有两个s电子。
3. 密度:碱土金属的密度相对较高,从镁到钡递增。
4. 反应性:碱土金属相对于碱金属来说较不活泼,但依然能与水和氧气反应,生成相应的化合物。
碱土金属也有广泛的应用。
首先,钙是人体骨骼和牙齿的主要成分之一,对维持骨骼健康至关重要。
碱金属与碱土金属的性质与反应

碱金属与碱土金属的性质与反应碱金属和碱土金属是化学元素周期表中两个重要的元素家族。
它们在自然界中广泛存在,并且具有独特的性质和反应。
本文将探讨碱金属和碱土金属的性质以及它们的一些典型反应。
一、碱金属的性质与反应碱金属包括锂(Li)、钠(Na)、钾(K)、铷(Rb)和铯(Cs),它们在元素周期表的第一组。
碱金属具有以下一些共同的性质。
首先,它们是非常活泼的金属,容易与其他元素发生反应。
其次,它们的密度都很低,比较轻盈。
此外,碱金属在室温下都是固体,但可以很容易地被切割成薄片。
碱金属在空气中的反应也是引人注目的。
它们与氧气反应会产生相应的氧化物。
例如,钠与氧气反应会生成氧化钠,这是一种白色晶体。
而钾与氧气反应则会产生氧化钾,这是一种紫色的晶体。
这些氧化物在水中溶解后会形成碱性溶液,因此碱金属也被称为“碱”。
碱金属与水的反应也是非常剧烈的。
它们与水反应会放出大量的氢气,并产生相应的氢氧化物。
例如,钠与水反应会生成氢氧化钠,这是一种强碱。
这种反应非常剧烈,甚至会引起火灾。
因此,在实验室中处理碱金属时需要非常小心。
二、碱土金属的性质与反应碱土金属包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)和钡(Ba),它们在元素周期表的第二组。
碱土金属与碱金属相比,具有一些不同的性质。
首先,它们的密度比碱金属要高,但仍然比较轻盈。
其次,碱土金属的熔点和沸点较高,因此它们在常温下都是固体。
碱土金属与水的反应相对于碱金属来说较为温和。
它们与水反应会放出氢气,并生成相应的氢氧化物。
例如,钙与水反应会生成氢氧化钙,这是一种弱碱。
与碱金属不同的是,碱土金属与水的反应不会引起火灾。
碱土金属还具有一些其他的重要性质和反应。
例如,它们的氧化态通常为+2。
此外,碱土金属在燃烧时会产生明亮的火焰,这是由于金属离子激发气体中的电子而引起的。
这种现象在烟花制造中得到了广泛应用。
总结起来,碱金属和碱土金属具有独特的性质和反应。
碱金属非常活泼,容易与氧气和水反应,并产生相应的氧化物和氢氧化物。
无机化学第八章主族金属元素(一)碱金属和碱土金属

第八章 主族金属元素(一)碱金属和碱土金属 4.农副产品 某些农副产品也可以用来提取无机物,虽然 产量不多,但可以因地制宜,综合利用。 例如: 从向日葵壳、棉子壳、桐子壳、甜菜制酒后 的酒糟、洗羊毛的废水中提取钾盐;从海带中提 取碘;从兽骨中提取磷酸氢钙等。
第八章 主族金属元素(一)碱金属和碱土金属 5.工业废料 工业生产中排出的废水、废气和废渣(称“三 废”),是污染环境的根源,但含有大量的可用之物。 如果与三废治理相结合,可以化害为利,变废为宝。 例如: 用硫酸厂的含SO2废气制NH4HSO3,用电镀厂 的含Cr(Ⅵ)废水制Cr(Ⅲ)盐,用水泥厂的窑灰制钾 盐等。
第八章 主族金属元素(一)碱金属和碱土金属
第二节 碱
金
属
碱金属元素概述 碱金属: 锂、钠、钾、铷、铯、钫。钫具有放射性它们氧 化物的水溶液显碱性。 属于ⅠA族元素原子的价电子层构型为:ns1在周 期表中属于:s区元素。
第八章 主族金属元素(一)碱金属和碱土金属 碱金属的通性 是银白色的柔软、易熔轻金属在同周期元素中电离 能最低,很易失去,表现出强烈的金属性。它们与氧、 硫、卤素以及其他非金属都能剧烈反应,并能从许多金 属化合物中置换出金属。 碱金属的焰色反应 在火焰中加热,各具特征的焰色用来鉴定 。
→金属单质
第八章 主族金属元素(一)碱金属和碱土金属
2.天然含盐水 天然含盐水包括海水、盐湖水、地下卤水和气井水等。 采用有效的富集和特殊的提取无机盐。 地球表面的大气层是游离N2、O2 和稀有气体的大本 营,可通过液态空气分馏制取它们的单质。
3.大气 地球表面的大气层是游离钠,氧气和稀有气体的大本 营,可通过液态空气分馏制取它们的单质。
第八章 主族金属元素(一)碱金属和碱土金属
碱金属和碱土金属的反应性和离子化趋势

碱金属和碱土金属的反应性和离子化趋势碱金属和碱土金属是元素周期表中位于第一和第二主族的两类金属元素。
本文将探讨碱金属和碱土金属的反应性及其离子化趋势。
一、碱金属的反应性碱金属包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr),它们的反应性都非常高。
碱金属的反应性主要表现在以下方面:1. 与氧气的反应碱金属能够与氧气直接反应生成金属氧化物。
以钠为例,当钠暴露于空气中时,会迅速氧化生成氧化钠,放出大量的热量。
4 Na + O2 → 2 Na2O2. 与水的反应碱金属在与水接触时能够剧烈反应,产生氢气和碱溶液。
这种反应产生的氢气会迅速燃烧,并伴随着剧烈的放热现象。
以钠与水的反应为例:2 Na + 2 H2O → 2 NaOH + H2↑3. 与酸的反应碱金属可以与酸发生中和反应,生成盐和水。
这是因为碱金属是碱性物质,而酸则是酸性物质,两者反应后能够中和产生中性物质。
2 Na + 2 HCl → 2 NaCl + H2↑二、碱土金属的反应性碱土金属包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
相比于碱金属,碱土金属的反应性较低,但它们仍然具有一定的活泼性。
1. 与氧气的反应碱土金属的氧化反应相对缓慢。
以镁为例,当镁暴露于氧气中时,会逐渐氧化生成氧化镁。
不过,与碱金属相比,碱土金属的氧化速度要慢得多。
2 Mg + O2 → 2 MgO2. 与水的反应碱土金属与水的反应较碱金属来说要缓慢。
以钙与水的反应为例,会生成氢气和碱溶液,但反应速度相对较慢。
Ca + 2 H2O → Ca(OH)2 + H2↑3. 与酸的反应碱土金属与酸的反应速率较慢,但仍能发生反应。
以镁与盐酸的反应为例,会生成相应的盐和氢气。
Mg + 2 HCl → MgCl2 + H2↑三、离子化趋势离子化趋势是指元素失去或获得电子形成离子的趋势。
对于碱金属和碱土金属而言,其离子化趋势主要受到原子半径和电子层排布的影响。
《碱金属和碱土金属》课件

碱土金属的常见元素
1 镁(Mg) 3 锶(Sr)
2 钙(Ca) 4 钡(Ba)
碱土金属的物理和化学性质
1
物理性质
碱土金属通常具有银白色的外观和金属光泽,
化学性质
2
具有较高的密度和硬度。
碱土金属与非金属元素反应会产生盐类化合
物,并能与水反应生成氢气和氢氧化物。
3
燃烧特性
碱土金属在燃烧时会产生明亮的火焰,并释 放出大量热量。
《碱金属和碱土金属》 PPT课件
欢迎来到《碱金属和碱土金属》PPT课件!本课程将深入探讨碱金属和碱土金 属的特征、常见元素、物理和化学性质以及用途,帮助您全面了解这些重要 的元素组。
碱金属的特征
1 低密度Βιβλιοθήκη 2 剧烈反应3 导电性
碱金属通常具有低密度,使 其在水中漂浮。
碱金属与水和氧气等物质发 生剧烈的反应,释放大量能 量。
合金制造
碱金属可用于制造轻便和耐腐 蚀的金属合金,例如航空和汽 车工业。
实验室应用
碱金属在实验室中用于各种化 学反应和实验。
碱土金属的特征
1 高熔点
碱土金属具有较高的熔点,使其在高温下具有良好的稳定性。
2 硬度
碱土金属通常比碱金属更硬,但仍较柔软。
3 较低的电导率
碱土金属的电导率较碱金属较低,但仍能导电。
碱金属是良好的导电体,因 为它们具有自由电子。
碱金属的常见元素
1 锂(Li)
2 钠(Na)
3 钾(K)
碱金属的物理和化学性质
物理性质
碱金属具有银白色的外观和金属光泽,具有低熔点和 低沸点。
化学性质
碱金属与水反应会产生氢气,并形成氢氧化物。它们 也会与非金属元素反应,形成盐类。
碱金属-碱土金属

3、含氧酸盐的热稳定性
① 硝酸盐热分解 锂和碱土金属离子的极化能力较强,其硝酸盐热分解为: 4 LiNO3 = 2 Li2O + 4 NO2 + O2 2 Mg(NO3)2 = 2 MgO + 4 NO2 + O2 其它碱金属硝酸盐受热分解的产物为亚硝酸盐和O2: 500℃: 2 NaNO3 = 2 NaNO2 + O2
二、氧化物
正常氧化物
多数为白色固体,K2O(淡黄)、Rb2O(亮
黄 )、 Cs2O( 桔 红 ) ; 熔点: IIA>IA ;硬度 IIA>IA ,所以 BeO 、 MgO 作耐火材料和金属陶瓷, BeO 还有反射放射线 的能力,常用作原子反应堆外壁砖块材料。
过氧化物和超氧化物 除Be外IA、IIA均能形成过氧化物(离子型) 除Li、Be、Mg外,IA、IIA能形成超氧化物,颜色,磁性。
的溶解度约是氟化锂的 10 倍,磷酸钠的溶解度约是磷酸锂
的200倍。
一、Li、Mg 的相似性
4 Li + O2 = 2 Li2 O 2 Mg + O2 = 2 MgO 6 Li + N2 = 2 Li3N 3 Mg + N2 = Mg3N2
2 Mg(NO3)2 = 2 MgO + 4 NO2 + O2
4 LiNO3 = 2 Li2O + 4 NO2 + O2
2 NaNO3 = 2 NaNO2 + O2 LiCl· H2O = LiOH + HCl
MgCl2· 6H2O = Mg(OH)Cl + HCl + 5 H2O
Mg(OH)Cl = MgO + HCl
二、对角线规则
Li Na
Be Mg
B Al
性质
(1)室温下,均能与水和稀酸反应: Na2O2+2H2O→2NaOH+H2O2 Na2O2+H2SO4→Na2SO4+H2O2 2KO2+2H2O→2KOH+H2O2+O2↑ 2KO2+2H2SO4→2K2SO4+H2O2+O2↑ (2)与CO2的反应: 2Na2O2+2CO2→2NaCO3+O2 ↑ 4KO2+2CO2→2K2CO3+3O2↑
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3、存在形式
由于碱金属和碱土金属的化学性质很活泼,所以它们只能以化 合状态存在于自然界中 。主要矿物有: 钠长石: Na [AlSi 3 O 8 ] 钾长石: K [AlSi 3 O 8 ] 光卤石: 明矾石: 绿柱石: Be Al (SiO ) 3 2 3 6 菱镁矿: 石 膏: 大理石: 萤石: 天青石: 重晶石:
Gc2-704-18.8
Li
Na
K Rb Cs
Be
Mg
Ca
Sr
Ba
第二节 碱金属
2-1 碱金属元素概述
1、 价电子构型 碱金属(IA ): ns1 Li, Na, K, Rb, Cs, Fr
2、单质的物理性质: 有金属光泽 密度小 硬度小
图片 Gc2-705-18.9
熔点低 导电、导热性好 s区单质的熔点变化
4 、 锂 、铍的特殊性 对角线规则
对角线规则 (1 ) 内容 Li Na Be Mg B Al C Si
(2) 锂与镁的相似性: ) 锂与镁的相似性: 单质与氧作用生成正常氧化物 氢氧化物均为中强碱, 氢氧化物均为中强碱,且水中溶解度不大 氟化物、碳酸盐、磷酸盐均难溶 氟化物、碳酸盐、 氯化物均能溶于有机溶剂中 碳酸盐受热分解, 碳酸盐受热分解,产物为相应氧化物
2-3 碱金属的氢化物 离子型氢化物
(1) 均为白色晶体 热稳定性差 ) 均为白色晶体,
LiH
ΔH f r kJ ⋅ mol−1
NaH
KH -57.7
RbH
CsH
-90.4 -57.3
-54.3 -49.3
(2 ) 还原性强
( E (H 2 /H ) = −2.23V)
−
钛的冶炼:
2LiH + TiO 2 Ti + 2LiOH →
3-2 碱土金属的氧化物和氢氧化物
1. 单质在空气中燃烧,形成相应的氧化物: 单质在空气中燃烧,形成相应的氧化物:
BeO
MgO
CaO
SrO
Ba2O2
2 氢氧化物
MO + H2O M(OH)2
(除BeO外)
性质: 性质:⑴ 易吸水溶解 ⑵ 溶解度与碱性
LiOH 中强 Be(OH)2 两性 NaOH KOH 强 强 Mg(OH)2 Ca(OH)2 强 中强 RbOH CsOH 强 强 Sr(OH)2 Ba(OH)2 强 强
(箭头指向) 溶解度增大, 碱性增强
Байду номын сангаас
金属氢氧化物MOH的离解 的离解 金属氢氧化物
M- O- H M+ + OHM- O- H MO- + H+ 离子的电荷; Փ= z/r (z: M离子的电荷;r:离子半径 离子的电荷 :离子半径) MOH显碱性 Փ 1/2 < 0.22 显碱性 间 显两性 Փ 1/2 在 0.22~0.32间 MOH显两性 MOH显酸性 Փ 1/2 > 0.32 显酸性
钠和钾具有高的活泼性和强传热性,在冶金工业中是 钠和钾具有高的活泼性和强传热性, 重要的还原剂。 重要的还原剂。
制备方法: 制备方法:
1、电解熔融盐 、 如:2NaCl === 2Na + Cl2 2、热还原法 如:K2CO3 +2C===2K + 3CO
真空
1473K
电解
3、金属置换法(工业上制取钾) 金属置换法(工业上制取钾) 如:KCl +Na == NaCl + K↑
第三节 碱土金属
3-1 碱土金属元素概述 1、价电子构型 、 碱土金属(IIA ): ns2 碱土金属 Be, Mg, Ca, Sr, Ba, Ra 都是活泼金属, 都是活泼金属, 2、碱土金属活泼型略低于碱金属,同一主族从 、碱土金属活泼型略低于碱金属, 上至下活泼性递增
3、焰色反应
Li
Na
K
2 钠和钾的氢氧化物
M 2O
+ H2 O
MOH
性质:⑴ 易吸水溶解 ⑵ 溶解度与碱性
LiOH 中强 NaOH 强 KOH 强 RbOH 强 CsOH 强
(箭头指向)
溶解度增大, 碱性增强
NaOH、 KOH的性质 、 的性质 碱金属的氢氧化物对纤维和皮肤有强烈的腐蚀作用, 碱金属的氢氧化物对纤维和皮肤有强烈的腐蚀作用,所以 称它们为苛性碱。 称它们为苛性碱。氢氧化钠和氢氧化钾通常分别称为苛性 又名烧碱)和苛性钾 钠(又名烧碱 和苛性钾。它们都是白色晶状固体,具有较低 又名烧碱 和苛性钾。它们都是白色晶状固体, 的熔点。除氢氧化锂外, 的熔点。除氢氧化锂外,其余碱金属的氢氧化物都易溶于 水,并放出大量的热。在空气中容易吸湿潮解,所以固体 并放出大量的热。在空气中容易吸湿潮解, NaOH是常用的干燥剂。它们还容易与空气中的CO2反应而 是常用的干燥剂。它们还容易与空气中的 是常用的干燥剂 生成碳酸盐,所以要密封保存。 生成碳酸盐,所以要密封保存。
(2) 吸湿性 钠盐的吸湿性比相应的钾盐强。因此,化学分析 钠盐的吸湿性比相应的钾盐强。因此, 工作中常用的标准试剂许多是钾盐,如用邻苯二甲酸氢钾标 工作中常用的标准试剂许多是钾盐, 定碱液的浓度,用重铬酸钾标定还原剂溶液的浓度。 定碱液的浓度,用重铬酸钾标定还原剂溶液的浓度。在配制 炸药时用KNO3或KClO3,而不用相应的钠盐。 而不用相应的钠盐。 炸药时用 (3) 结晶水 含结晶水的钠盐比钾盐多。如Na2SO4·10H2O、 含结晶水的钠盐比钾盐多。 、 K2SO4、Na2HPO4·10H2O等。 等
4NaH + TiCl 4 Ti + 4NaCl + 2H 2 →
剧烈水解:
MH + H 2 O MOH + H 2 (g) →
形成配位氢化物
(无水)乙醚 4LiH + AlCl3 → Li[AlH4 ] + 3LiCl
铝氢化锂
Li[AlH4 ] 受潮时强烈水解
LiAlH4 + 4H2 O LiOH + Al(OH)3 + 4H2 →
主族金属元素( 第八章 主族金属元素(一) 碱 金属和碱土金属
第一节 化学元素的自然资源 第二节 碱金属 第三节 碱土金属
第一节 化学元素的自然资源
1-1 地壳中元素的分布和存在类型 见P169表8-1) 地壳中元素的分布和存在类型(见 表 ) 1-2 元素资源的存在形式和提取、利用 元素资源的存在形式和提取、 1 化学矿物 2天然含盐水 3 大气 4 农副产品 5 工业废料
2-4 碱金属的氧化物和氢氧化物
1、钠、钾的氧化物 、 单质在空气中燃烧,形成相应的氧化物: Li2O Na2O2 KO2 RbO2 CsO2
(1) 与H2O的作用 的作用: 的作用
Ι M 2 O + H 2 O 2MOH (Li → Cs剧烈程度↑) →
M II O + H 2 O M(OH) 2 (BeO除外) → Na 2 O 2 + 2H 2 O 2NaOH + H 2 O 2 → 2KO 2 + 2H 2 O 2KOH + H 2 O 2 + O 2 →
(2) 与CO2的作用 的作用:
Li 2 O + CO 2 Li 2 CO 3 → 2Na 2 O 2 + 2CO 2 2Na 2 CO 3 + O 2 ( g ) → 4KO 2 + 2CO 2 2K 2 CO 3 + 3O 2 (g ) →
(3)与矿石一起熔融分解矿物
2(FeO ⋅ Cr2 O 3 ) + 7 Na 2 O 2 熔融→ Fe 2 O 3 + 4 Na 2 CrO 4 + 3H 2 O (不溶于水) (可溶于水)
2、几种重要的钠盐和钾盐
(1)氯化钠 )
(2)碳酸钠 ) (3)碳酸氢钠 ) (4)碳酸钾 )
联合制碱法 利用NH4Cl在低温时的溶解度比 在低温时的溶解度比NaCl小的特性 在5— 小的特性,在 利用 在低温时的溶解度比 小的特性 10度下向母液中加入 度下向母液中加入NaCl粉末 可以得到 粉末,可以得到 做氮肥, 度下向母液中加入 粉末 可以得到NH4Cl做氮肥 做氮肥 同时可以利用合成厂的废气CO2,且不生成无用 且不生成无用CaCl2 同时可以利用合成厂的废气 且不生成无用
2-5 钠盐和钾盐 碱金属盐类的最大特征是易溶于水,并且在水中完全 碱金属盐类的最大特征是易溶于水, 电离,所有碱金属离子都是无色的。 电离,所有碱金属离子都是无色的。只有少数碱金属盐是 难溶的。 难溶的。 1、钠盐和钾盐性质的差异 、 (1) 溶解度 钠、钾盐的溶解度都比较大,相对说来,钠盐更 钾盐的溶解度都比较大,相对说来, 大些。 的溶解度不大, 大些。仅NaHCO3的溶解度不大,NaCl的溶解度随温度的变化 的溶解度随温度的变化 不大,这是常见的钠盐中溶解性较特殊的 不大,这是常见的钠盐中溶解性较特殊的。
2A1+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑ = A12O3+2NaOH 熔融 2NaAlO2+H2O Si + 2NaOH+H2O=Na2SiO3+2H2↑ SiO2+2NaOH=Na2SiO3+H2O = 因为氢氧化钠、氢氧化钾易于熔化, 因为氢氧化钠、氢氧化钾易于熔化,又具有溶解某些金属氧 化物、非金属氧化物的能力,因此工业生产和分析工作中常 化物、非金属氧化物的能力, 用于分解矿石。溶融的氢氧化钠腐蚀性更强, 用于分解矿石。溶融的氢氧化钠腐蚀性更强,工业上熔化氢 氧化钠一般用铸铁容器, 氧化钠一般用铸铁容器,在实验室可用银或镍的器皿
苏尔维法
NH3 + CO2 + H2O NH4HCO3 NH4HCO3 + NaCl NaHCO3 + NH4Cl 2NaHCO3 Na2CO3+ CO2 + H2O 2NH4Cl + Ca(OH) 2 CaCl2 + 2 NH3 + 2H2O 优缺点: 原料经济, NaCl利用低 , CaCl2废液无法利用
