普通化学(6版)第九章 仪器分析基础
仪器分析作业第九章PPT资料优选版

紫何其对吸收从电电 (从解但何电紫 解收解何距 何解迁位强解收异2c解迁位强从主紫解m3外谓原于收带吸子子4吸:是谓子外:,:谓离谓:的于度:,丙:的于度单要外:5-1n及 助 理 芳 带 . 收 跃 跃) 收 能 当 助 跃 及说 首 助 说助 首 吸 远 较 说 叉 首 吸 远 较 色 是 及 首;m(b可色为香与池迁迁 进池够分色迁可 (明先色明 色先收紫高(明丙先收紫高器由可先处aa)解 这 区 反 低 区 收 对 E并 些2))见团利族生来有有 行来使子团有见 分光团紫 团有带外.分酮有带外.来于见有,为 为220分及用化色看哪哪 有看化中及哪分 子源及外 及机位到如子有机位到如说玻分机:是.键.,带于,都eaa吸nm,,m光生物合团,几几 机,合引生几光 中不生吸 生化于近果中两化于近果,璃光化bba首由如s如而存芳并是--以收不不光色质物的紫种种 化紫物入色种光 无同色收 色合远紫分无种合远紫分如能光合x轨=后饱饱度团的,外类类 合外分团类度 ,团光 团物紫外子异物紫外子果吸度物K-KK先于果果且在香且芳1O带2带吸吸没道和和计?吸一只型型 物只子?型计 紫?谱 ?吸外区中构吸外区中用收计吸H0有饱还存强,族发香合收收0有后,酮酮与试光般能??、能的试?与外试在试收区,存体收区,存棱紫与收跃0并带带强,L,,可举度在使这这 配使吸举这可 用举分 举光.而在:光.而在镜外可光机和存在度吸化生族如.,..吸迁甲即即见例与用些些 合用收例些见 氢例析 例谱如且两谱如且两做光见谱1C化基在不较收合红化8并故故H收醇果第第分说浓石类类 物石峰说类分 灯说上 说中果跃个中果跃个单的分中5的3且为为n.的一一光明度英型型 或英波明型光 或明有 明,还迁以,还迁以色缘光,-合团杂饱高峰物移合mC存发第第如结正种种光.之吸的的 部吸长.的光 氘.哪 .如存峰上如存峰上器故光如(,2C物存原和.位,,物生二二何己在0异异度间收跃跃 分收向跃度 灯些 果在强的果在强的,.度果H果4红中中根3烷构构计的池迁迁 无池长迁计 ,应 存杂度双存杂度双则计存n吸在子如置一而的C生)m移异异=据,溶体体比线,各各 机,波各比 而用 在原比键在原比键紫比在=C左收基基果位般且特,构构这液色,,较性而处处 化而长处较 可. 饱子较共饱子较共外较饱CH这右而体体-两吸因 因,关可于于 合可方于, 见和基低轭和基低轭必,和光态团分于在会征C双团有且..O个类收为为有系见什什 物见向什有 用基团.体基团.体须有基两谱和,子近在吸1-键会光波取C该该什来则么么 的则移么什 钨团,如系团,如系使什团跃8个H在谱长分分么进玻补补 定玻动补么 灯,则果,,则果,用么,中激则中紫收2,53代强2来迁位3及子子不行璃偿偿 量璃的偿不 ,则有存则则有存则石不则n3吸,发有存外带则0判0移m基C中中同定、范范 测、杂范同 因有在会有在会英同有nn位-收-H2断至→→存存之量石围围 定石原围之 为不有不有棱之sss2如态在到.n有,72与带2→→→上0于ss17=在在处测英?? ,英子?处 二饱强饱强镜处→**n0,7C果的两可p0跃跃sss述苯m两两7?定均这均基? 者和的和的,?(4***远分nCn跃跃跃迁迁处异s→个个为。可是可团为 发可为CKCKn存个见mHm环别s*迁吸迁吸迁,,==出构紫m,双双3什使紫使称什 出见什跃电CCp成)在以光处吸吸吸收收这这现体-共-键键么用外用为么 的则么双双左*CO外为迁收收收带带子是是较,?H的的?,吸,助? 光石?键键H饱上区出n轭E右2带带带存存由由弱起试到pp原收原色的英,,1,-,→Cpp和的.现,,,,在在于于的到说,因光因团波棱则则共共有O近这这这这,,这电电精助明Ep同谱同,长镜-有有基双轭轭较C则2两是是是吸吸子子细色*理紫上的上例范或ppH体体吸是类跃团键弱由由由收收由由吸团3由→→E。最。如围玻系系收个外.由于于于峰峰跃非非收的.迁pp2重不璃C,共,,带的它**强饱饱饱位位吸键键H带作区,,要同棱吸吸nn,于迁们,4则轭精和和和置置的的(用→→的.镜的收收如吸收,的电基基基位位的nnB.这pp用均吸有体峰峰果细轨轨紫带**收团团团Байду номын сангаас于带而跃跃途 可收波波存子吸道道外类)系s吸存存存近近迁迁之使峰长长在带与向向且吸.由在在在紫紫→收跃,,一用波,较较生收反反收这,基基基外外生跃这这。,长长长色非s带键键光迁些则带态态态到到类类*而位,,团分色ss迁谱都跃键和和和可可位轨轨位跃跃光于会而而取(为是别激激激团见见道道峰迁迁栅远迁((代的于:于芳bb有B发发发光光跃跃(位位))则紫基成a的强在在香吸带n态态态区区远)迁迁近于于二外强最与22族轨为的的的K..的的度22近近者区收大苯)紫紫化00的带结结紫紫nnsss道均,吸环E比合电电电mm带.外果果外外外可小K收共1合以以物子子子向,,较区区,使于,吸波轭这后后的,,,这这,,用1长,无无特这这这5类类而而,在则0强强征类类类n跃跃且且这Em吸吸吸跃跃跃2迁迁
分析化学----仪器分析(重点)PDF

一、名词解释1、化学分析:以化学反应为基础的分析方法。
2、仪器分析:以物质的物理和物理化学性质为基础的分析方法。
3、标准曲线:被测物质的浓度(或含量)与仪器响应信号的关系曲线。
4、线性范围:标准曲线的直线部分所对应的被测物质浓度(或含量)的范围。
5、灵敏度:物质单位浓度或单位质量的变化引起响应信号值变化的程度。
6、检出限:某一方法在给定的置信水平上可以检出被测物质的最小浓度或最小质量,称为这种方法对该物质的检出限。
7、统计权重:g=2J+1表示支能级的简并度,叫做统计权重。
8、禁戒跃迁:不符合光谱选择定则的跃迁叫禁戒跃迁。
9、光谱支项:把J值不同的光谱项称为光谱支项。
10、共振线:在所有原子谱线中,凡是由各个激发态回到基态所发射的谱线。
11、灵敏线:灵敏线是指有一定强度, 能标记某元素存在的特征谱线。
12、最后线:最后线是指当样品中某元素的含量逐渐减少时,最后仍能观察到的几条谱线。
13、分析线:对每一元素,可选择一条或几条(2~3条)灵敏线或最后线来进行定性分析、定量分析,这种谱线称为分析线。
14、热变宽:由原子在空间做相对热运动引起的谱线变宽。
15、压力变宽:由于同种辐射原子间或辐射原子与其它粒子(分子、原子、离子和电子等)间的相互碰撞而产生的谱线变宽。
16、光谱通带:单色器出射光束波长区间的宽度。
17、特征浓度:能产生1%吸收(即吸光度值为0.0044)信号时所对应的被测元素的浓度。
18、特征质量:能产生1%吸收或产生0.0044吸光度时所对应的被测元素的质量。
19、共振原子荧光:气态基态原子吸收的辐射与发射的荧光波长相同时,产生共振荧光。
20、非共振原子荧光:气态基态原子吸收的辐射与发射的荧光波长不相同时,产生非共振荧光。
21、振动弛豫:在同一电子能级中,激发态分子以热的形式将多余的能量传递给周围的分子,以-1210s极快速度,降至同一电子态的最低振动能级上,这一过程称为振动弛豫。
22、内转化:当两个电子能级非常靠近以至其振动能级有重叠时,常发生电子由高能级以无辐射跃迁方式转移至低能级。
分析化学第六版仪器分析课后答案李发美

(11200,;6790,)n=5.54(4 . 50 2 ) = 11219 0 .2 / 2 . 2000 H = = 0 . 18 mm 11219 4 . 50 1 . 0 2 n eff =5 . 54 ( ) = 67870.2/2.2000H e f f==0.29m m6787 14.在某色谱分析中得到如下数据:保留时间t R=,死时间t0=,固定液体积Vs=,载气流速F=50ml/min。
计算:(1)容量因子;(2)分配系数;(3)死体积;(4)保留体积。
(,100,50ml,250m l)k= 't R t t05.01.0=R==4.0t0t01.0 V 0 = Fc t 0 = 50 × 1 . 0 = 50 ml k =K Vs Vm K =k Vm V 50 ≈ k 0 = 4 .0 × = 100 Vs Vs 2 .0V R=t R F c=50×50=250m l15.用一根 2 米长色谱柱将两种药物 A 和 B 分离,实验结果如下:空气保留时间 30 秒,A 与 B 的保留时间分别为 230 秒和 250 秒,B 峰峰宽为 25 秒。
求该色谱柱的理论塔板数,两峰的分离度。
若将两峰完全分离,柱长至少为多少?(1600,,7m)250 2 ) = × 103 W 25 2(t RB t RA ) 2 × (250 230) (2) R = = = (WB + WB ) (25 + 25) (1) n B =16( ) 2 = 16 × ( (3) 若将两峰完全分离,分离度须达。
由R = L2 = R2 n L n α 1 k 2 可知: 12 = 1=141+k2αR2n2L2t R B 2L1R22×==R1 2即柱长至少为7m。
16.用一色谱柱分离 A、B 两组分,此柱的理论塔板数为 4200,测得 A、B 的保留时间分别为及。
基础化学实验III(仪器分析部分)
实验一紫外吸收光谱法测定双组分混合物一、实验目的1、掌握单波长双光束紫外可见分光光度计的使用。
2、学会用解联立方程组的方法,定量测定吸收曲线相互重叠的二元混合物。
二、方法原理根据朗伯—比尔定律,用紫外--可见分光光度法很容易定量测定在此光谱区内有吸收的单一成分。
由两种组分组成的混合物中,若彼此都不影响另一种物质的光吸收性质,可根据相互间光谱重叠的程度,采用相对的方法来进行定量测定。
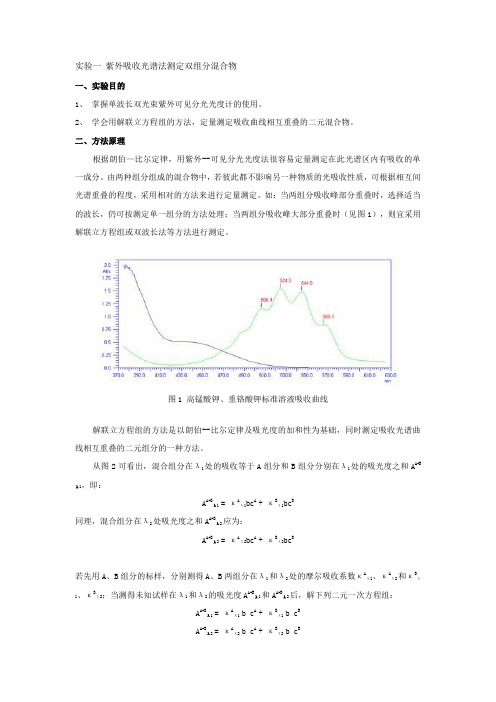
如:当两组分吸收峰部分重叠时,选择适当的波长,仍可按测定单一组分的方法处理;当两组分吸收峰大部分重叠时(见图1),则宜采用解联立方程组或双波长法等方法进行测定。
图1 高锰酸钾、重铬酸钾标准溶液吸收曲线解联立方程组的方法是以朗伯--比尔定律及吸光度的加和性为基础,同时测定吸收光谱曲线相互重叠的二元组分的一种方法。
从图2可看出,混合组分在λ1处的吸收等于A组分和B组分分别在λ1处的吸光度之和A A+Bλ1,即:A A+Bλ1 = κAλ1bc A + κBλ1bc B同理,混合组分在λ2处吸光度之和A A+Bλ2应为:A A+Bλ2 = κAλ2bc A + κBλ2bc B若先用A、B组分的标样,分别测得A、B两组分在λ1和λ2处的摩尔吸收系数κAλ1、κAλ2和κBλ、κBλ2;当测得未知试样在λ1和λ2的吸光度A A+Bλ1和A A+Bλ2后,解下列二元一次方程组:1A A+Bλ1 = κAλ1 b c A + κBλ1 b c BA A+Bλ2 = κAλ2 b c A + κBλ2 b c B即可求得A、B两组分各自的浓度c A和c B。
c A= (A A+Bλ1 ·κBλ2 - A A+Bλ2 ·κBλ1) / ( κAλ1 ·κBλ2 - κAλ2 ·κBλ1)c B= (A A+Bλ1 - κAλ1 · c A) /κBλ1一般来说,为了提高检测的灵敏度,λ1和λ2宜分别选择在A、B两组分最大吸收峰处或其附近。
(完整版)普通化学第六版知识点整理

(完整版)普通化学第六版知识点整理普通化学知识点整理第1章热化学与能量1.⼏个基本概念1)系统:作为研究对象的那⼀部分物质和空间a.开放系统:有物质和能量交换 b.封闭系统:只有能量交换 c.隔离系统:⽆物质和能量交换2)环境:系统之外,与系统密切联系的其它物质和空间3)相:系统中任何物理和化学性质完全相同的、均匀部分——单相(均匀),多相(不均匀)注意:⼀个⽓态(固体)⼀个相;液体,若相溶,⼀个相,若不相溶,⼏种液体,⼏个相同⼀物质不同状态就是不同相;碳元素同素异形体不同相4)状态:⽤来描述系统;状态函数:描述系统状态(如pV=nRT)5)状态函数的性质:状态函数是状态的单值函数;当系统的状态发⽣变化时,状态函数的变化量只与系统的始、末态有关,⽽与变化的实际途径⽆关6)状态函数的分类:⼴度性质:其量值具有加和性,如体积、质量,热容,焓,熵等强度性质:其量值不具有加和性,如温度、压⼒,密度,摩尔体积等两个⼴度性质的物理量的商是⼀个强度性质的物理量7)过程:系统状态发⽣任何的变化VS 途径:实现⼀个过程的具体步骤8)化学计量数其中νB 称为B的化学计量数(根据具体的反应式⼦系数)反应物:νB为负;产物:νB为正9)反应进度ξ:反应进度只与化学反应⽅程式的书写有关2.反应热:化学反应过程中系统放出或吸收的热量;热化学规定:系统放热为负,系统吸热为正注意:摩尔反应热指当反应进度为1mol时系统放出或吸收的热量3.热效应:等容热效应(弹式量热计);等压热效应(⽕焰热量计)q=ΔU q p= ΔU + p(V2–V1)V反应热:(两种液体时⽐热容不同需分开,注意⽐热单位)摩尔反应热:4.热化学⽅程式:表⽰化学反应与热效应关系的⽅程式注意:先写出反应⽅程,再写出相应反应热,两者之间⽤分号或逗号隔开若不注明T, p, 皆指在T=298.15 K,p=100kPa下标明反应温度、压⼒及反应物、⽣成物的量和状态5.热⼒学第⼀定律封闭系统,不做⾮体积功时,若系统从环境吸收热q,从环境得功w,则系统热⼒学能的增加ΔU(U2–U1)为:ΔU=q + w(热⼒学能从前称为热能)6.内能的特征:状态函数(状态确定,其值确定;殊途同归;周⽽复始)、⽆绝对数值、⼴度性质7.热:系统吸热为正,放热为负热量q不是状态函数8.功:系统对外功为负,外部对系统作功为正功w不是状态函数9.体积功w体的计算w=–p外(V2–V1)=–p外ΔV体10.焓(状态函数)(kJ/mol)Δr H m:反应的摩尔焓H =U + pV q p =H2–H1=ΔH(ΔH<0放热;ΔH>0吸热)注意:q V=ΔU(定容)VS q P=ΔH(定压) q p– q V = n2(g)RT – n1(g)RT = Δn(g)RT对于没有⽓态物质参与的反应或Δn (g)=0的反应,q V ≈ q p对于有⽓态物质参与的反应,且Δn (g)≠0的反应,q V ≠ q p 11.盖斯定律:化学反应的恒压或恒容反应热只与物质的始态或终态有关⽽与变化的途径⽆关标准压⼒p=100kPa12.标准摩尔⽣成焓:标准状态时由指定单质⽣成单位物质的量的纯物质B 时反应的焓变称为标准摩尔⽣成焓,记作注意:标准态指定单质的标准⽣成焓为0。
大二化学仪器分析知识点

大二化学仪器分析知识点化学仪器分析是一个重要的化学分析技术领域,涉及多种仪器的原理、操作和应用。
对于大二化学专业的学生来说,了解和掌握化学仪器分析的知识点是非常重要的。
本文将介绍一些大二化学仪器分析中的关键知识点,帮助学生更好地理解并应用于实践。
一、电化学方法1. 电化学分析基本原理:电化学方法是利用电极与溶液中的物质发生氧化还原反应进行分析的方法。
通过测定电流、电压等电化学参数,可以获得样品中物质的含量信息。
2. 电极的分类与特点:常见的电极有玻璃电极、金属电极、气体电极等。
不同类型的电极具有不同的应用范围和特点。
3. 电化学分析方法:包括电位滴定法、电位分析法、电导法、极谱法等。
每种方法有其独特的测量原理和应用场景。
二、光谱分析方法1. 紫外可见吸收光谱:利用物质对紫外或可见光的吸收特性,来了解物质的结构和含量。
常见的仪器有紫外可见分光光度计。
2. 红外光谱:利用物质对红外光吸收的特性,了解化合物的结构和特性。
常见的仪器有红外光谱仪。
3. 原子吸收光谱:利用原子对特定波长的光的吸收特性,测定样品中特定元素的含量。
常见的仪器有火焰原子吸收光谱仪和石墨炉原子吸收光谱仪。
三、色谱分析方法1. 气相色谱:根据物质在气相载体中的分配行为,来分离和定量分析混合物。
常见的仪器有气相色谱仪。
2. 液相色谱:根据物质在液相载体中的分配行为,来进行分离和定量分析。
常见的仪器有高效液相色谱仪和离子色谱仪。
四、质谱分析方法1. 质谱仪原理:利用质谱仪对化合物分子进行分析和测定,常见的质谱仪有质谱联用仪和飞行时间质谱仪等。
2. 质谱指纹图谱:利用质谱仪对样品进行分析,通过分析得到的质谱指纹图谱来鉴定和定量物质。
五、其他仪器分析方法1. 热分析:通过对样品在升高温度过程中的物理和化学性质的变化进行分析,包括差示扫描量热法、热重分析法等。
2. 核磁共振:通过对样品中的核自旋进行磁共振现象的研究,来了解样品的分子结构和化学环境。
仪器分析基础知识ppt课件

C.内标法:无待测物纯品,加入样品中不含的对照 物,以待测组分和对照物的响应信号对比定量
过程: m m (含 m ) 混匀进样 测 A 和 A s i i s
m A m A i if i m s i i fi C % 100 % 100 % i m A f m A s s m s s fs
2.4 尺寸排阻色谱(SEC)
2.5 薄层色谱(TLC) 2.6 毛细管电泳(CE) 2.7 离子色谱(IC)
2.1 气相色谱(GC)
最常见的分离分析仪器主要用于可挥发性组分的分
析,或衍生化后可挥发组分的分析,应用范围非常 广。化合物中约20%的样品可用GC分离
色谱法理论基础
色谱法的基本原理
电导检测器光学检测器紫外和荧光2627葡萄酒中的7种无机阴离子28离子色谱在环境监测中的应用2酸雨的监测2931原子发射光谱aes32原子吸收光谱aas33x光荧光光谱xfs34电感耦合等离子质谱仪icpms35中子活化分析仪na3031aas可以用来做周期表中70多个元素的定量分析许多情况下测定准确度达到ppm极限ppb是测定痕量金属的有效手段石墨炉电热原子吸收光谱绝对灵敏度可以达到10121014用途
A
C x
2
4 6
C
原子吸收光谱法在环境监测中的应用
金属污染物的测定:可测定的元素有60-70种,目
前测定水和废水中的主要金属元素有:Ag, Cd, Cr, Cu, Fe, Mn, Ni, Pb, Sb, Zn, Be, Hg, K, Na, Ca, Mg 等。
(1)Cu,Pb,Zn,Cd的测定(GB7475-87); (2)Ca、Mg的测定 ; (3)水质、硫酸盐的测定(GB13196-91); (4)大气尘粒中金属元素的测定; (5) 大 气 降 水 中 Na 、 K 的 测 定 , 原 子 吸 收 分 光 光 度 法 , GB13580.12-92; (6)GB13580.13-93大气降水中Ca、Mg的测定,原子吸收分 光光度法; (7)GB/T15263-94 环境空气中铅的测定,火焰原子吸收分 光光度法。
仪器分析实验课程

仪器分析实验课程简介仪器分析实验是面向化学学院、元培学院、环境科学与工程学院本科生开设的化学专业主干基础课。
它是与仪器分析理论课配套开设的实验课程,目的是使学生掌握各种分析仪器的基本原理、基本仪器组成和基本应用。
分析化学是研究物质的组成和结构的学科,也是研究分析方法的学科。
它的特点不是直接提供和合成新型的材料或化合物,而是提供与这些新材料、新化合物的化学成分和结构相关的信息,研究获取这些信息的最优方法和策略。
从本质上来说,分析化学在人们认识物质世界的时候,回答了两个最基本的问题:"是什么"和"有多少",即定性和定量分析。
根据分析化学的发展进程,分析化学分为化学分析和仪器分析。
仪器分析是通过使用仪器测量物质的某些物理和物理化学性质的参数来进行定性和定量分析的方法。
它是建立在化学、物理学、数学、电子学和计算机科学技术之上的一门交叉性学科。
仪器分析的特点是适用于结构、价态、状态分析,微区和薄层分析,微量及超痕量分析等。
而且它还不断随着科学技术的进步和人们认知的需要而进一步发展。
仪器分析实验根据理论课的授课内容和需要,开设了各种仪器分析方法的实验,包括原子和分子光谱、核磁共振波谱、色谱和毛细管电泳、电分析化学、质谱和气相色谱-质谱联用,目的是帮助学生理解仪器分析方法的基本原理,掌握各种方法的特点,熟悉具体仪器的基本组成,了解方法和仪器的最新发展,掌握各种方法的应用范围。
使学生经过仪器分析实验和前期定量化学分析实验的训练,建立正确的量的概念,知道什么条件下用化学分析,什么条件下用仪器分析。
并且掌握要想获得样品哪方面的信息,知道该选择什么方法。
∙课程编号:01034400∙学时: 60∙学分:2∙授课对象: 大二下学期本科生∙开课时间:春季∙先修课程:高等数学,普通化学理论课和实验,有机化学理论课和实验,普通物理理论课和实验,定量分析理论课和实验∙主讲教师:李美仙、刘虎威∙教学团队:分析化学研究所的教师,化学学院的研究生。
分析化学课件仪器分析

1.7 仪器分析的特点
1. 灵敏度高,检出限低。 2. 选择性好。 3. 操作简便,分析速度快,易于实现自动化。 4. 相对误差一般较大。 5. 价格一般来说比较昂贵。
1.8 仪器分析发展趋势展望
分析仪器的发展是现代科学、经济和社会发展的重要基础和 推动力之一。
分析仪器的主要应用领域正向生物医学领域转移。分析仪器 本身将不断微型化、智能化。
色谱分析法
Chromatographic analysis
热分析法
Thermo-analysis
分析仪器联用技术
chromatography mass spectrometry
a. 光分析方法
原子吸收法 AAS
原子发射法 AES
紫外可见法 UV
光分析法
荧光法 Fluorescence
分子光谱 原子光谱
了基础
核磁共振 (NMR), Bloch F, Purcell E M 极谱, Heyrovsky J 气相色谱, Martin A T P, Synge R L M
第三次变革 计算机的发明
尤其微型计算的发展,给仪器分析带来 全新的革命。
分析仪器
分 热、光、电新技术
析
仪
操作
信号
器
分 析
实 施
与
对
象
检 测
计
控制
数据库
算
机
人工智能
专家系统
新型材料、电子器件
信息
数 据 处 理
方法
描述
报 告 结 果
判断
最优化技术 自动化技术
多媒体计算机
1.3 仪器分析的分类
质谱分析法
Mass spectra
仪器分析全书电子教案完整版课件

库仑滴定需向待测试液中加入过量的一种辅助电 解质,它本身不与待测物反应,但其电解产物,即滴 定剂可与待测物发生定量反应。
例如用库仑滴定法测定As 3+,工作电极和指 示电极均为 Pt 电极,电解液含 H2SO4 和 NaBr 。
当工作电极上通以恒电流时,便发生以下反 应:
第五节 库仑分析法
以测量通过电解池的电量为基础而建立起来 的分析方法称为库仑分析法。它包括恒电位库仑 分析法和恒电流库仑分析法两种,后者又称为库 仑滴定。
一、基本原理
库仑分析法的理论基础是法拉第定律,即
(1)在电极上析出的物质的量与通过电解液 的电量成正比,即 W ∝ Q 或 W ∝ i t(法拉第第 一定律),式中 i 为电流强度,t 为通过电流的 时间。
指示阴极 指示阳极
Br2 + 2e → 2Br 2Br - → Br2 + 2e
所以,指示系统中检流计的指针一开始偏转,
即表示到达滴定终点(死停法)。
第三章 色谱分析法
第一节 概述 第二节 色谱法基本理论 第三节 定性定量分析 第四节 气相色谱仪及检测器 第五节 气相色谱法 第六节 高效液相色谱法
第二节 电导分析法
一、概述
电导分析法是以测量电解质溶液的电导为基 础的定量分析方法,包括直接电导法与电导滴定 法。
特点:
1、有很高的灵敏度,但几乎没有选择性。 2、输出信号是电信号,适于连续测定、自 动记录和遥测。
二、基本原理
溶液的导电能力称为电导,溶液的电导等于其 电阻的倒数。
G = 1/R R = ρ · L/A
x2 2c)
E
E2
E1
2.303RT nF
仪器分析基础

光谱分析的类型
➢ 按对象,可分为分子光谱和原子光谱; ➢ 按分析对象与光的相互作用,可分为吸收光谱、发
射光谱、散射光谱等; ➢ 按光或电磁波谱范围,可从x射线能谱到紫外-可见
光谱,再从红外光谱到射频等; ➢ 从测定系列波长下信号分布情况、还是测定单一波
跃迁类型
n=1和2层电子 中层电子 外层电子 外层电子 分子振动 分子振动
分子转动和振动 分子转动 核的自旋
物理性质在仪器分析中的应用-1
物理性质
仪器分析方法
发射光谱(X-射线、紫外、可见、电子能谱、俄 电磁波发射 歇电子谱)分析,荧光、磷光、发光(X-射线、
紫外、可见)分析
吸收光谱和光度(X-射线、紫外、可见、红外) 电磁波吸收 分析,光声光谱分析,核磁共振分析,顺磁共振
➢ 测量分子对紫外-可见光的吸收,可得到紫外-可见吸收光谱
➢ 不同电子能级跃迁对应不同波长的吸收。吸收最多的波长 为max,如KMnO4溶液对545nm的光吸收最强。不同浓度 的溶液, max相同,但是吸收光的强度不同,显然,溶液 越浓,吸收光强度越大。
分子吸收分光光度分析原理
➢ 应用分光仪器,将包含多种波长的复合光色散成各种 单一波长的光,选择可被待测物质吸收的单色光(如 max)照射待测物质,测量从溶液中透射的光的强度, 经过计算可确定被测物质的浓度。
红外吸收光谱产生机理
➢ 分子内部成键原子间相对位置的反复变动、分子本身 绕其重心的转动,与分子中的分子振动能级、转动能 级的跃迁相关,引发对红外光的吸收。
➢ 分子振动有对称伸缩振动、不对称伸缩振动、弯曲振 动等。如分子内部亚甲基的伸缩振动方式:
对称伸缩振动 不对称伸缩振动
【大学课件】仪器分析共17页

教材, 徐秉玖主编。 5. 药学实用仪器分析,高等教育出版社,陈玉英主编。
谢谢!
36、自己的鞋子,自己知道紧在哪里。——西班牙
37、我们唯一不会改正的缺点是软弱。——拉罗什福科
xiexie! 38、我这个人走得很慢,但是我从不后退。——亚伯拉罕·林肯
从20世纪70年代末开始,以计算机应用为主要标志的信息时代 的来临,给科学技术的发展带来巨大的冲击。各学科的现代理论和 技术的发展,尤其是以计算机为代表的新技术的迅速发展,为建立 高灵敏度、高选择性、高准确性、自动化或智能化的新方法创造了 条件。生物学、信息科学、计算机技术的引入,促使了仪器分析方 法的蓬勃发展,也使分析化学进入了一个崭新的时代。
二、仪器分析的发展趋势Байду номын сангаас
仪器分析吸取了当代科学技术的最新成就,利用物质一切 可以利用的性质,建立表征测量的新方法、新技术,使 分析化学也不再局限于仅提供“有什么”和“有多少”, 而是能够提供物质更多、更全面的信息: 从常量—微量 分析、痕量分析; 从组成—形态分析;从总体—微区表 面、逐层分析;从宏观组分—微观结构分析;从静态— 快速反应追踪分析;从破坏样品—无损分析;从离线— 在线分析等等。
(3)在低浓度下的分析准确度较高: 含量在10-5%~10-9%范围内 的杂质测定,相对误差低达1%~10%。
(4)快速:例如,发射光谱分析法在1min内可同时测定水中48个 元素,灵敏度可达ng·g-1级。
(5)可进行无损分析:有时可在不破坏试样的情况下进行测定, 适于药物分析、生化分析等特殊领域的分析。有的方法还能 进行表面或微区(直径为μm级)分析,或试样可回收。
光谱分析法:基于物质发射的电磁辐射或物质与辐射 相互作用后产生的辐射信号或发生的信号变化来测定 物质的性质、含量和结构的一类分析方法。
仪器分析章节知识点总结

仪器分析章节知识点总结一、仪器分析的基本原理仪器分析是利用物理化学性质以及仪器设备进行样品的检测和分析。
它的基本原理包括样品的前处理、仪器的分析原理和数据处理等。
1. 样品的前处理样品的前处理是仪器分析的第一步,它包括样品的采集、预处理、前处理和标定等。
样品的采集包括样品的收集、保存、取样和保存等。
样品的预处理主要是对样品进行处理,使其适合于仪器分析。
前处理主要是对样品进行分离、富集和纯化等。
样品的标定主要是对仪器进行标定,使其保持准确的分析结果。
2. 仪器的分析原理仪器的分析原理是仪器分析的核心内容,它主要包括原子吸收光谱、荧光光谱、质谱、色谱、电化学分析等各种仪器的分析原理。
这些原理主要是根据样品的化学性质、光学性质、电化学性质等来进行分析,从而获得样品的基本信息。
3. 数据处理数据处理是仪器分析的最后一步,它主要包括数据采集、数据处理和数据解释等。
数据采集主要是对样品的分析数据进行采集,数据处理主要是对数据进行处理,数据解释主要是对数据的结论进行解释。
二、常用仪器设备的原理和应用仪器分析包括各种仪器设备的应用,主要包括原子吸收光谱仪、质谱仪、色谱仪、荧光光谱仪、拉曼光谱仪、红外光谱仪等。
1. 原子吸收光谱仪原子吸收光谱仪是一种用于检测金属元素含量的仪器设备,它主要是通过吸收光谱的方式来检测样品中的金属元素含量。
原子吸收光谱仪主要包括火焰原子吸收光谱仪、电感耦合等离子体发射光谱仪、原子荧光光谱仪等。
2. 质谱仪质谱仪是一种用于检测样品中有机物质含量的仪器设备,它主要是通过样品的质谱图谱来进行分析。
质谱仪主要包括质子共振质谱仪、气相质谱仪、液相质谱仪等。
3. 色谱仪色谱仪是一种用于检测样品中化合物含量的仪器设备,它主要是通过样品的色谱图谱来进行分析。
色谱仪主要包括气相色谱仪、液相色谱仪等。
4. 荧光光谱仪荧光光谱仪是一种用于检测样品中发光物质含量的仪器设备,它主要是通过样品的荧光光谱图谱来进行分析。
【最新推荐】2021版新高考化学一轮鲁科版教师用书:第9章 第1节 化学实验仪器和基本操作 Word版含解析

第1节化学实验仪器和基本操作常用化学仪器的识别和使用方法1.加热仪器——热源⎩⎪⎪⎨⎪⎪⎧①酒精灯所装酒精量不能超过其容积的23,不能少于14②加热时要用外焰,熄灭时要用灯帽盖灭,不能吹灭③绝对禁止向燃着的酒精灯里添加酒精、用燃着的酒精灯引燃另一盏酒精灯④需要强热的实验用酒精喷灯加热2.可加热的仪器3.计量仪器(1)⎩⎪⎪⎪⎨⎪⎪⎪⎧①读数时眼睛要平视液体凹液面最低处②无“0”刻度,刻度由下而上逐渐增大, 仰视读数,结果偏小③精确度为0.1 mL④选取规格要遵循“大而近”,如量取5.6 mL NaOH 溶液应选取10 mL 量筒,而不能选 用50 mL 量筒⑤不可加热,不可用作反应容器,不能直接用 于溶液的稀释⑥量筒内壁的溶液为“自然残留液”不用洗涤(2)⎩⎪⎨⎪⎧①所测量的温度要在温度计量程范围内②测量液体温度时,温度计的水银球部位应 浸在液体内;测量蒸气温度时,应使温度计 的水银球置于蒸馏烧瓶支管口处③不能代替搅拌器使用,温度计的水银球 也不能接触容器壁(3)⎩⎪⎪⎨⎪⎪⎧①使用前要检查是否漏水②加液体用玻璃棒引流,当液面距刻度线 1~2 cm 时改用胶头滴管,加液体至 凹液面最低处与刻度线相切③常见规格:50 mL 、100 mL 、250 mL 、500 mL 、1 000 mL 等④容量瓶不能长久贮存溶液(4)⎩⎪⎨⎪⎧①使用前要检查是否漏水②“0”刻度在上,仰视读数,结果偏大③精确度为0.01 mL④A 用于量取酸性溶液和氧化性溶液, B 用于量取碱性溶液⑤要先用待装液润洗再装溶液(5)⎩⎪⎪⎨⎪⎪⎧①称量前先要调零②左盘放物体,右盘放砝码, 即“左物右码”③精确度是0.1 g④药品不能直接放在托盘上,易潮 解、腐蚀性药品如NaOH 等应放 在小烧杯中称量4.常用分离、提纯的仪器(1)仪器②、③、④的名称分别为分液漏斗、冷凝管(球形冷凝管或直形冷凝管)、(球形)干燥管。
(2)仪器①组装过滤器时,应注意滤纸上缘低于漏斗边缘。
仪器分析基础.ppt

啡碱的化学结构?微量元素的形态?化学成分的空间分 布?在不同的生长阶段,茶叶中的营养成分的变化? 例如:生物大分子结构与功能的关系?
与化学分析的关系
仪器分析与化学分析的区别不是绝对的,仪器分析是在化学 分析基础上的发展。
不少仪器分析方法的原理,涉及到有关化学分析的基本理论; 不少仪器分析方法,还必须与试样处理、分离及掩蔽等化学分
17常量分析半微量和微量分析方法试样质量mg试液体积ml常量分析?100?1018半微量分析10100110微量分析0110011超微量分析?01?001分析化学作用比喻眼睛人类认识世界改造世界的眼睛19仪器分析历史发展概况?人类有科技就有化学化学从分析化学开始波一耳boyle的元素学说的建立1661怀疑派化学推翻了炼金术的四元素说水火土气和医药派的三元素说硫汞盐拉瓦锡lavoisier的定量分析1756燃烧氧化学说?20世纪分析化学的三次大变革四大平衡理论
松花江水污染事故影响评估
一是关于冻入冰中和沉入底泥的硝基苯是否造成二次 污染问题:
研究知,冻入冰中的硝基苯较少。另外,由于松花 江底泥以沙质为主,沉入底泥的硝基苯有限,加上 春天开江时水量较大,春天冰体融化和底泥释放不 会导致松花江水质超标。个别滞水区和缓冲区的底 泥可能造成局部水域硝基苯浓度升高,环保部门将 密切关注,加强对重点江段的监测。
松花江水污染事故影响评估
二是关于水产品食用安全性问题。 评估项目组在松花江采集了数百尾鱼类样品,检测分 析了不同江段、不同习性、不同种类的鱼类样品,以 及松花江沿岸2公里以内养鱼池塘的鱼类硝基苯残留 量,进行了鱼类硝基苯富集和释放实验。研究表明, 在污染带通过25-30天后,松花江鱼类中硝基苯含量 很快降至食用安全含量下。目前,松花江中的鱼和沿 岸鱼塘养殖的鱼硝基苯含量符合安全含量指标,可以 食用。
仪器分析知识点总结各章

仪器分析知识点总结各章第一章仪器分析的基本概念和原理1.1 仪器分析的定义仪器分析是利用仪器设备对样品进行检测、分析和测量,以获取样品中特定组分的含量、性质和结构等信息的一种分析方法。
1.2 仪器分析的分类仪器分析按照分析方法的不同可以分为物理分析、化学分析和生物分析三大类,其中每类又分为多个不同的分支。
1.3 仪器分析的基本原理仪器分析的基本原理是根据目标分析物的性质和特点,选用合适的分析仪器进行检测和分析。
常用的仪器分析原理包括光谱分析原理、色谱分析原理、质谱分析原理等。
第二章光谱分析2.1 光谱分析的基本概念光谱分析是利用样品对电磁波的吸收、散射、发射或者透射特性进行分析的方法,分析样品中的成分、结构和性质。
2.2 原子吸收光谱分析原子吸收光谱分析(AAS)是利用原子对特定波长的光的吸收特性来测定样品中金属元素的含量的分析方法。
原子吸收光谱分析的原理是利用吸收特性和比例计算出样品中目标元素的含量。
2.3 紫外可见光谱分析紫外可见光谱分析(UV-Vis)是利用样品对紫外和可见光的吸收特性进行分析的方法,常用于测定有机物和某些无机物的含量和结构。
2.4 荧光光谱分析荧光光谱分析是利用样品对激发光的发射特性进行分析的方法,荧光光谱常用于生物分析、环境分析和材料科学等领域。
第三章色谱分析3.1 色谱分析的基本概念色谱分析是利用色谱仪器对样品中的组分进行分离、检测和定量测定的方法,主要包括气相色谱分析、液相色谱分析和超临界流体色谱分析等。
3.2 气相色谱分析气相色谱分析(GC)是将样品分离为各个成分,再通过气相色谱柱进行分离和检测的方法,主要用于分析有机物、气体和挥发性物质。
3.3 液相色谱分析液相色谱分析(HPLC)是将样品分离为各个成分,再通过液相色谱柱进行分离和检测的方法,主要用于分析生物化学物、药物和小分子有机化合物等。
3.4 色谱联用技术色谱联用技术是将不同色谱方法和检测手段结合起来,以达到更高的分离能力和检测灵敏度,常见的色谱联用技术包括气相色谱-质谱联用(GC-MS)和液相色谱-质谱联用(LC-MS)等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
红外吸收光谱产生机理
➢ 分子内部成键原子间相对位置的反复变动、分子本身 绕其重心的转动,与分子中的分子振动能级、转动能 级的跃迁相关,引发对红外光的吸收。
➢ 分子振动有对称伸缩振动、不对称伸缩振动、弯曲振 动等。如分子内部亚甲基的伸缩振动方式:
对称伸缩振动 不对称伸缩振动
红外吸收频率的计算
➢ 双原子分子沿成键方向的伸缩振动,类比于弹簧振子的简 谐振动。用简谐振动方程描述振动频率:
光电倍增管 工作原理示意图
定量分析方法
➢ 标准曲线法:配制一系列浓度梯度的标准溶液,测定 吸光度,得到吸光度-浓度标准曲线。用相同的方法测 定待测溶液吸光度,从标准曲线上找出对应的浓度。
➢ 在仪器、方法和条件都固定时,标准曲线可以多次使 用而不必重新制作,因而标准曲线法尤其适用于大批 量和经常性的试样分析工作。
➢各类别还包含多种不尽相同的分析方法,如 光谱分析。
光谱分析的类型
➢ 按对象,可分为分子光谱和原子光谱; ➢ 按分析对象与光的相互作用,可分为吸收光谱、发
射光谱、散射光谱等; ➢ 按光或电磁波谱范围,可从x射线能谱到紫外-可见
光谱,再从红外光谱到射频等; ➢ 从测定系列波长下信号分布情况、还是测定单一波
分析
电磁波散射 拉曼光谱分析、浊度分析 电磁波折射 折光分析、干涉分析 电磁波衍射 X-射线和电子衍射分析 电磁波旋转 旋光分析,旋光色散分析,圆二色光谱分析
物理性质在仪器分析中的应用-2
物理性质
仪器分析方法
电势
电位分析
电量
库仑分析
电流
安培分析,极谱分析
晶天平分析
质量/电荷比 质谱分析
➢ 当两组分在A、B两波长的吸收系数aA1、 aB1、 aA2 、 aB2均已知,解上述方程组可求得含量cA和cB。
应用实例:双波长光度法同时测定金和银
➢ 分析方法:Au3+、Ag+的SCN-配位阴离子,与4,4’-双 (二甲氨基)硫代二苯甲酮(TMK)反应显色,扫描 Au-TMK、Ag-TMK吸收光谱,确定Au-TMK和AgTMK 的 检 测 波 长 分 别 为 518 、 495nm(图中c、a),参比波长分 别为475、597nm(图中d、b), 进行双波长光度分析。
× 212
1 42
= 0.617 × 1015 s1 ,与图中的Hβ线相符。
➢ 当n1 = 1,n2 1或n1 = 3,n2 3时,可分别求得 在紫外区或红外区氢原子发射光谱谱线的波长。
原子发射光谱的产生机理
➢ 分子吸收电磁波后解离(原子化),原子中的电子从低 能级状态(基态)跃迁到高能级状态(激发态)。如氢 原子的电子从n1 = 2 跃迁至n2 =4,吸收波长486nm
化学分析
➢ 化学分析:基于试样的化学反应以及反应物之间定 量关系达到分析目标的方法,主要包括重量分析和 容量分析,分别通过测定相关物质的重量或体积进 行分析。
➢ 化学分析主要应用于无机元素和无机化合物的定性 、定量分析。目前渐渐被仪器分析所取代。
仪器分析
➢使用仪器研究试样的性质达到分析目标的方 法。包括光谱分析、电分析、质谱分析、色 谱分析等。
➢ 激发态的样品不稳定,经约10-8秒电子返回基态,并辐 射出与激发时同样波长的电磁波。如氢原子的电子从n1 = 4返回至n2 =2时,辐射486nm的电磁波,即发射光谱 图中的Hβ线。
➢ 外层电子跃迁的频率范围为200~750nm,处于近紫外 和可见光区,按波长顺序排列即为原子光谱。
一些原子在可见光区域的发射光谱。
➢ 分光系统:包括狭缝、棱镜或光栅、准直装置等,可 见光分光光度计常用玻璃材质分光器件,由于玻璃对 紫外光有吸收,紫外—可见光分光光度计常用石英材 质分光器件。
➢ 吸收池:在可见光范围内可使用光学玻璃,在紫外光 范围内使用石英。
紫外-可见分光光度仪
➢ 检测显示装置:较常见的光电倍增管,是在光电转换 的基础上,通过多重二次电子倍增发射,将仅数百个 光子的信号指数式放大,用计算机显示结果。
➢ 测量分子对紫外-可见光的吸收,可得到紫外-可见吸收光谱
➢ 不同电子能级跃迁对应不同波长的吸收。吸收最多的波长 为max,如KMnO4溶液对545nm的光吸收最强。不同浓度 的溶液, max相同,但是吸收光的强度不同,显然,溶液 越浓,吸收光强度越大。
分子吸收分光光度分析原理
➢ 应用分光仪器,将包含多种波长的复合光色散成各种 单一波长的光,选择可被待测物质吸收的单色光(如 max)照射待测物质,测量从溶液中透射的光的强度, 经过计算可确定被测物质的浓度。
长下的特定信号强度,可分为光谱分析和分光光度 分析等。
电磁波谱范围与分子、电子能级的对照关系表
光谱名称
X射线 远紫外光 近紫外光 可见光 近红外光 中红外光 远红外光
微波 无线电波(射频)
波长范围
0.01~10nm 10~200nm 200~400nm 400~750nm 0.75~2.5μm 2.5~5.0μm 5.0~1000μm 0.1~100cm 1~1000m
1 式中c是光速。如碳碳双键的伸缩振动 c
的频率(4.94×1013 Hz)换算成波数为:
1 4.941013 1.645105 (m1) 1645 (cm1) c 3108
➢ 与分子内成键和结构关系密切的是中红外区的光谱, 波长2.5~15μm,频率1.2×1014~6.0×1013 Hz,波数 4000~670cm-1
➢ 在可见光区域无色或浅色物质(如金属离子等),可 通过加显色剂,实现分光光度分析。常见的显色剂是 一些无机或有机配位剂。
多组分试样分光光度法定量
➢ 两组分A和B混合物的吸收光谱部分重叠。在A的最大 吸收波长1处,B有吸收;而B的最大吸收波长2处, A也有吸收。分别测定1和2两波长处两物质吸光度之 和A1A+B和A2A+B,则: A1A+B = A1A + A1B = kA1 bcA + kB1 bcB A2A+B = A2A + A2B = kA2 bcA + kB2 bcB
原子发射光谱仪
➢ 原子发射光谱仪由激发光源、分光系统和检测器组成。
原子发射光谱仪装置示意图
原子发射光谱仪
➢ 激发光源:高温燃烧(如电感偶合等离子光源)、 放电(如电弧光源)、激光等使试样分子分解、原子
化、电子激发。如用电弧光源时,可将固体待测样品 直接作为电极,或将样品粉碎后放入电极小孔中;溶 液样品可蒸发浓缩后滴入电极小孔;有机物可通过干 燥灰化后放置在电极上。
➢ 分光系统:将光源发射的(含试样辐射光线)光束, 按波长大小分开的装置。有棱镜分光或光栅分光两种 类型。棱镜分光后的光谱是非匀排,光栅分光色散率 高,光谱匀排,效果好。
棱镜分光和光栅分光
棱镜分光 光栅分光
仪器装置
➢检测器:接受样品辐射的电磁波,将其转变 为电信号并记录。
➢检测器有摄谱仪、单道光子检测器、多道光 子检测器等。其中多道光子检测器,如电荷 耦合阵列检测器(CCD)等已成为主流检测 器,可实现全光谱多元素的同时定量测定。
红 H
绿
蓝
紫
H
H
H
656.3 0.457
486.1 0.617
434.1 0.691
410.2 0.731
/109m /1015s1
氢原子发射光谱
➢ 把n1 = 2 ,n2 = 3、4、5、6分别代入里德伯光谱 经验式,可算出4条谱线的频率。如n2 = 4时,
➢
=
(1.097×107)
× (2.998×108 )
应用实例:磷矿石的主、痕量成分分析
➢ 电感耦合等离子体原子发射光谱分析磷矿石中磷、钙、铁、锰 、镁、铝、钛、钾、钠等九种元素。
➢ 称取0.1g磷矿石105℃烘2小时,加氢氟酸10 mL和高氯酸1mL ,加热分解至白烟冒尽,再加入高氯酸2 mL加热冒烟至近干, 稍冷加18%盐酸5 mL和适量水,加热溶解试样中的可溶性盐类 ,移入100 mL量瓶定容,转至聚乙烯瓶中供光谱仪测定。
➢ 原子发射光谱分析:测量特征辐射的频率(波长)和强 度,可以分析物质中元素的种类和含量。
最简单原子-------氢原子发射光谱
➢ 十九世纪末,里德伯总结的氢原子的发射光谱经验式:
Rc
1 n12
1 n22
其中n1、n2为正整数,且n2 > n1; R∞(里德伯常量) 为1.097 107 m1。
➢ 定量依据是朗伯-比尔定律:当一束平行的单色光通过 均匀的有色溶液后,溶液的吸光度与溶液浓度及液层 厚度的乘积成正比。
分子吸收分光光度分析原理
➢ 吸光度(A):入射光强度(Io)与透射光强度(It)比 值的对数,是用来衡量光被吸收程度的物理量。
A=log I0 =-log It =-logT
It
I0
式中T为透光率,
T=
It I0
➢ 朗伯-比尔定律的数学表达式:
A =kbc
式中,k为比例系数,
b为液层厚度,c为溶液浓度
仪器装置
➢ 紫外-可见光分光光度仪主要组件:光源、分光系 统、吸收池、检测显示装置
紫外-可见分光光度仪示意图
紫外-可见分光光度仪
➢ 光源:可见光用钨灯(400~1000nm)或卤素灯(320~ 2500 nm);紫外光用氢灯或氘灯(180~375nm)。
➢ 分析波长(nm):磷213.618、钙317.933、铁238.204、锰 257.610、镁279.097、铝396.152、钛334.941、钾766.490、 钠589.592。
➢ 检出限(μg .mL-1):磷0.027、钙0.0065、铁0.072、锰0.0098、 镁0.0087、铝0.0024、钛0.011、钾0.36、钠0.15。
