常见元素单质熔沸点
钠的熔点和沸点

钠的熔点和沸点钠是一种常见的金属元素,具有低熔点和沸点。
本文将从钠的熔点和沸点两个方面进行介绍。
一、钠的熔点钠的熔点是指钠从固态向液态转化时所需要的温度。
钠的熔点较低,约为97.8摄氏度(约为370开尔文)。
这意味着当钠的温度超过97.8摄氏度时,钠会由固态转化为液态。
钠的低熔点是由于其金属结构的特点所决定的。
钠的金属结构中,钠原子通过金属键紧密地结合在一起,形成了一个由正离子和自由电子组成的海洋。
在低温下,钠原子之间的振动较小,所以钠呈固态。
当温度升高时,钠原子的振动增强,相互之间的吸引力减弱,最终导致钠的熔化。
二、钠的沸点钠的沸点是指钠从液态向气态转化时所需要的温度。
钠的沸点较高,约为883摄氏度(约为1156开尔文)。
这意味着当钠的温度超过883摄氏度时,钠会由液态转化为气态。
钠的高沸点同样是由于其金属结构所决定的。
在液态钠中,钠原子的振动更加剧烈,相互之间的吸引力减弱,导致钠原子脱离海洋结构,形成自由的钠原子。
当温度升高到一定程度时,钠原子的振动足够强烈,能够克服相互之间的吸引力,从而脱离液态钠,形成气态。
总结起来,钠的熔点较低,约为97.8摄氏度,当温度超过熔点时,钠会由固态转化为液态;钠的沸点较高,约为883摄氏度,当温度超过沸点时,钠会由液态转化为气态。
钠是一种极具活性的金属元素,常用于制备其他化合物或合金。
钠的低熔点和高沸点使得它在高温条件下仍能保持稳定的形态。
钠及其化合物广泛应用于化工、冶金、电子等领域。
钠的熔点和沸点的了解对于研究和应用钠具有重要意义。
钠的熔点和沸点分别为97.8摄氏度和883摄氏度。
钠的低熔点和高沸点是由其金属结构和原子间的相互作用所决定的。
了解钠的熔点和沸点有助于我们更好地理解和应用这一重要的金属元素。
kcl,sio2,干冰,金属铜的熔、沸点顺序 -回复

kcl,sio2,干冰,金属铜的熔、沸点顺序-回复题目: KCl、SiO2、干冰和金属铜的熔点和沸点顺序解析引言:在学习化学的过程中,我们经常会涉及物质的熔点和沸点。
熔点和沸点是用于描述物质在不同温度下状态变化的重要指标。
这些数据对于工业生产、实验设计和化学反应的研究非常关键。
本文将重点讨论四种物质的熔点和沸点顺序,这些物质分别是氯化钾(KCl)、二氧化硅(SiO2)、干冰和金属铜。
一、氯化钾(KCl)氯化钾(化学式KCl)是常见的无机化合物之一。
它是一种白色晶体,在室温下呈固体状态。
氯化钾的熔点是773度C。
在这一温度下,固体氯化钾经过加热转化为液体状态。
然而,氯化钾的沸点较高,约为1420度C,在这一温度下,液体氯化钾蒸发成为气体。
二、二氧化硅(SiO2)二氧化硅(化学式SiO2),也被称为二氧化硅石英是一种常见的无机化合物。
它是地球上最常见的矿物之一,并且广泛应用于工艺和科学领域。
二氧化硅的熔点非常高,约为1713度C。
这意味着在达到或超过这一温度时,固体二氧化硅会开始熔化变为液体状态。
然而,二氧化硅的沸点更高,约为2950度C。
只有在这一温度下,才能将液体二氧化硅转化为气体。
三、干冰(CO2)干冰(化学式CO2)是固体二氧化碳的俗称。
它是一种有趣的化合物,可由液态二氧化碳通过压力和温度变化制备而成。
干冰的熔点非常低,约为-78.5度C。
这表明在达到或超过该温度时,固体干冰会迅速转化为液体状态。
然而,干冰并没有明确的沸点,而是通过升华的方式从固体直接转变为气体。
这意味着当干冰受热时,它会从固体直接转变为气体,而不经过液体状态。
四、金属铜金属铜是我们日常生活中非常常见的金属之一,也是工业和个人使用的重要材料。
金属铜的熔点相对较低,约为1083度C。
一旦超过或达到该温度,固体铜会熔化成为液体。
金属铜的沸点约为2567度C。
只有在高于这一温度下,液体铜才能变为气体。
综上所述,四种物质的熔点和沸点顺序如下:1. 干冰:-78.5度C(熔点),无沸点;2. 氯化钾:773度C(熔点),1420度C(沸点);3. 金属铜:1083度C(熔点),2567度C(沸点);4. 二氧化硅:1713度C(熔点),2950度C(沸点)。
高中化学熔沸点百科、列表、解题思路【精装百科ppt】

熔点(melting point)
熔点是固体将其物态由固态转变(熔化)为液态的温度。进行相反动作(即由液态转为固态)的温度, 称之为凝固点。与沸点不同的是,熔点受压力的影响很小。 晶体融化时的温度叫做熔点。物质有晶体和非晶体,晶体有熔点,而非晶体则没有熔点。晶体又因类 型不同而熔点也不同.一般来说晶体熔点从高到低为,原子晶体>离子晶体>金属晶体>分子晶体。在分子 晶体中又有比较特殊的,如水,氨气等.它们的分子只间因为含有氢键而不符合"同主组元素的氢化物熔点 规律性变化''的规律。 熔点是一种物质的一个物理性质。物质的熔点并不是固定不变的,有两个因素对熔点影响很大。一 是压强,平时所说的物质的熔点,通常是指一个大气压时的情况;如果压强变化,熔点也要发生变化。 熔点随压强的变化有两种不同的情况.对于大多数物质,熔化过程是体积变大的过程,当压强增大时, 这些物质的熔点要升高;对于像水这样的物质,与大多数物质不同,冰熔化成水的过程体积要缩小(金 属铋、锑等也是如此),当压强增大时冰的熔点要降低。另一个就是物质中的杂质,我们平时所说的物 质的熔点,通常是指纯净的物质。但在现实生活中,大部分的物质都是含有其它的物质的,比如在纯净 的液态物质中熔有少量其他物质,或称为杂质,即使数量很少,物质的熔点也会有很大的变化,例如水 中熔有盐,熔点就会明显下降,海水就是熔有盐的水,海水冬天结冰的温度比河水低,就是这个原因。 饱和食盐水的熔点可下降到约-220℃,北方的城市在冬天下大雪时,常常往公路的积雪上撒盐,只要这 时的温度高于-22℃,足够的盐总可以使冰雪熔化,这也是一个利用熔点在日常生活中的应用。 熔点实质上是该物质固、液两相可以共存并处于平衡的温度,以冰熔化成水为例,在一个大气压下冰的 熔点是0℃,而温度为0℃时,冰和水可以共存,如果与外界没有热交换,冰和水共存的状态可以长期保持稳 定。在各种晶体中粒子之间相互作用力不同,因而熔点各不相同。同一种晶体,熔点与压强有关,一般取在 1大气压下物质的熔点为正常熔点。在一定压强下,晶体物质的熔点和凝固点都相同。熔解时体积膨胀的 物质,在压强增加时熔点就要升高。 在有机化学领域中,对于纯粹的有机化合物,一般都有固定熔点。即在一定压力下,固-液两相之 间的变化都是非常敏锐的,初熔至全熔的温度不超过0.5~1℃(熔点范围或称熔距、熔程)。但如混有 杂质则其熔点下降,且熔距也较长。因此熔点测定是辨认物质本性的基本手段,也是纯度测定的重要方 法之一。
钠的熔点和沸点

钠的熔点和沸点钠是一种常见的金属元素,在化学周期表中位于第11组。
钠具有较低的熔点和沸点,这使得它在许多领域中具有重要的应用价值。
让我们来了解钠的熔点。
熔点是指物质从固态转变为液态时所需的温度。
对于钠来说,它的熔点相对较低,约为98摄氏度(摄氏度是国际上常用的温度单位)。
这意味着在接近100摄氏度的温度下,钠会从固态转变为液态。
钠的低熔点使得它成为一种常用的熔剂,可以用来溶解其他物质。
此外,钠的熔点也使得它在一些化学反应中起到重要的催化作用。
接下来,让我们来了解钠的沸点。
沸点是指物质从液态转变为气态时所需的温度。
钠的沸点相对较高,约为883摄氏度。
这意味着只有在接近900摄氏度的高温下,钠才会从液态转变为气态。
由于钠的高沸点,它在高温环境中可以保持液态状态,这使得它在一些特殊的工业过程中得以应用。
此外,钠的高沸点也使得它成为一种重要的冷却介质,可以用来冷却高温设备和反应器。
钠的熔点和沸点的特性使得它在许多领域中具有广泛的应用。
首先,钠在冶金工业中被广泛用于提取其他金属,如铝和镁。
其次,钠还可用作一种重要的合金元素,以提高其他金属的性能和耐腐蚀性。
此外,钠的低熔点和高沸点使得它在核能工业中被广泛应用,用作冷却剂和传热介质。
此外,钠还可以用于制备有机合成反应中的溶剂和催化剂。
然而,尽管钠具有许多重要的应用价值,但它也具有一些安全隐患。
由于钠与空气中的氧气和水反应,会产生剧烈的化学反应,并释放出可燃的氢气。
因此,在处理钠时必须采取严格的安全措施,以防止事故的发生。
钠具有较低的熔点和较高的沸点,使得它在许多领域中具有重要的应用价值。
钠的熔点使其成为一种常用的熔剂和催化剂,而钠的高沸点使其成为一种重要的冷却介质。
然而,钠的应用也存在一些安全隐患,需要注意安全措施。
通过深入了解钠的熔点和沸点,我们可以更好地理解和利用这种重要的金属元素。
高考化学溶沸点比较

主要方法有如下几种(1)由周期表看主族单质的熔、沸点同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。
但碳族元素特殊,即C,Si,Ge,Sn越向下,熔点越低,与金属族相似。
还有ⅢA族的镓熔点比铟、铊低,ⅣA族的锡熔点比铅低。
(2)同周期中的几个区域的熔点规律①高熔点单质 C,Si,B三角形小区域,因其为原子晶体,熔点高。
金刚石和石墨的熔点最高大于3550℃,金属元素的高熔点区在过渡元素的中部和中下部,其最高熔点为钨(3410℃)。
②低熔点单质非金属低熔点单质集中于周期表的右和右上方,另有IA的氢气。
其中稀有气体熔、沸点均为同周期的最低者,而氦是熔点(-272.2℃,26×105Pa)、沸点(268.9℃)最低。
Bi,呈三角(3熔点:金刚石>①②呈固态。
(4①②③晶体的颗粒很小,肉眼观察不到它的几何形状,但仍是晶体,例如白沙糖,很小很小的颗粒,但它是分子晶体,我们常用的食盐,晶体颗粒很小,但它是离子晶体。
还要指明的是有些物质在常温常压下是气体,一但隆温到它成固体时它是晶体了,例如二氧化碳就是这样,它是分子晶体原子晶体:1.相邻原子之间通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体。
2.在原子晶体这类晶体中,晶格上的质点是原子,而原子间是通过共价键结合在一起,这种晶体称为原子晶体。
如金刚石晶体,单质硅,SiO2,碳化硅等均为原子晶体。
3.规律:原子晶体熔沸点的高低与共价键的强弱有关。
一般来说,半径越小形成共价键的键长越短,键能就越大,晶体的熔沸点也就越高。
例如:金刚石(C-C)>二氧化硅(Si-O)>碳化硅(Si-C)晶体硅(Si-Si))金刚石、硅晶体、SiO2、SiC离子晶体:由正、负离子或正、负离子集团按一定比例通过离子键结合形成的晶体称作离子晶体。
离子晶体一般硬而脆,具有较高的熔沸点,熔融或溶解时可以导电。
如强碱(NaOH、KOH、Ba(OH)2)、活泼金属氧化物(Na2O、MgO、Na2O2)、大多数盐类(BeCl₂、Pb(Ac)₂等除外)都是离子晶体。
同主族元素从上到下熔沸点

同主族元素从上到下熔沸点
一、熔沸点规律:
对单质而言:分为金属单质和非金属单质.
金属单质:从上而下,熔沸点依次降低.因为金属键,金属键减小,熔沸点降低.
非金属单质,从上而下,熔沸点依次升高.因为相对分子质量增大,分子间作用力增大,熔沸点升高.
对氢化物而言:从上而下,熔沸点一般是增大的,因为分子间作用力增大.
但是,第二周期的氢化物(如氨气、水、氟化氢因为分子间有氢键)熔沸点比同主族的氢化物熔沸点高的多.
二、氢化物的热稳定性:同主族非金属元素氢化物的热稳定性规律是:从上而下,氢化物热稳定性依次减弱.因为化学键依次减弱.。
单质熔沸点比较

单质熔沸点比较单质是指由同种元素组成的纯净物质,其熔沸点是衡量物质状态转变的重要指标之一。
熔沸点是指物质在标准大气压下从固态转变为液态的温度,或从液态转变为气态的温度。
不同的单质由于其原子或分子之间相互作用的差异,其熔沸点也会有所不同。
我们来看看一些常见的单质的熔沸点。
氢气是最轻的元素,其熔点为-259.2℃,沸点为-252.8℃。
氢气的熔沸点非常低,这是因为氢气的分子之间只有弱的范德华力作用,所以需要很低的温度才能使其凝固或沸腾。
相比之下,氧气的熔点为-218.8℃,沸点为-183℃。
氧气的分子之间有较强的范德华力作用,所以需要较低的温度才能使其凝固或沸腾。
接下来,让我们来看看一些金属元素的熔沸点。
铁是一种常见的金属,其熔点为1538℃,沸点为2861℃。
铁的熔沸点较高,这是因为金属元素之间存在着金属键,需要较高的温度才能破坏金属键使其熔化或沸腾。
相比之下,铝的熔点为660℃,沸点为2467℃。
铝是一种轻金属,其熔沸点较低,这是因为铝的原子之间相互作用较弱。
除了氢气、氧气、铁和铝之外,还有许多其他单质的熔沸点也各不相同。
例如,水的熔点为0℃,沸点为100℃。
水的熔沸点较高,这是因为水分子之间存在着氢键,需要较高的温度才能破坏氢键使水熔化或沸腾。
总的来说,单质的熔沸点与其分子或原子之间的相互作用力有关。
强的相互作用力会导致较高的熔沸点,而弱的相互作用力则会导致较低的熔沸点。
此外,单质的熔沸点也受到外界因素的影响,例如压力的变化会改变物质的熔沸点。
通过对单质的熔沸点的比较,我们可以了解到不同单质之间的物理性质差异。
这些差异不仅反映了单质分子或原子之间的相互作用力的差异,也反映了单质的化学性质和用途的差异。
对于科学研究和工业生产来说,了解单质的熔沸点是非常重要的,可以帮助科学家和工程师更好地理解和应用这些物质。
单质的熔沸点是衡量物质状态转变的重要指标之一。
不同单质由于其分子或原子之间相互作用的差异,其熔沸点也会有所不同。
化学元素周期表熔沸点规律总结

化学元素周期表熔沸点规律总结
高中化学元素周期表熔沸点规律是怎样的?因为熔沸点递变在周期表中并不是完全有规律的,所以希望不要一味追求结论,理解才是最重要的,一旦理
解了判断的原理,元素周期表自然就掌握好了。
元素周期表中熔沸点有什幺规律
首先,判断元素单质的熔沸点要先判断其单质的晶体类型,晶体类型不同,决定其熔沸点的作用也不同。
金属的熔沸点由金属键键能大小决定;分子晶体由分子间作用力的大小决定;离子晶体由离子键键能的大小决定;原子晶体由共价键键能的大小决定。
所以第一主族的碱金属熔沸点是由金属键键能决定,在所带电荷相同的情
况下,原子半径越小,金属键键能越大,所以碱金属的熔沸点递变规律是:从上到下熔沸点依次降低。
第七主族的卤素,其单质是分子晶体,故熔沸点由分子间作用力决定,在分子构成相似的情况下,相对分子质量越大,分子间作用力也越大,所以卤素的熔沸点递变规律是:从上到下熔沸点依次升高。
用这样的方法去判断同主族元素的熔沸点递变规律就行了,因为理解才是最重要的。
同周期的话,不太好说了。
通常会比较同一类型的元素单质熔沸点,比如
说比较na、mg、al的熔沸点,则由金属键键能决定,al所带电荷最多,原子
半径最小,所以金属键最强,故熔沸点是:nah2se>h2s;卤素:
hf>hi>hbr>hcl。
同周期比较的话,是从左至右熔沸点依次升高,因为气态氢
化物的热稳定性是这样递变另外有时还要注意物质的类型,比如让你比较金刚石、钙、氯化氢的熔沸点,只要知道金刚石是原子晶体,熔沸点最高,其。
元素熔沸点表
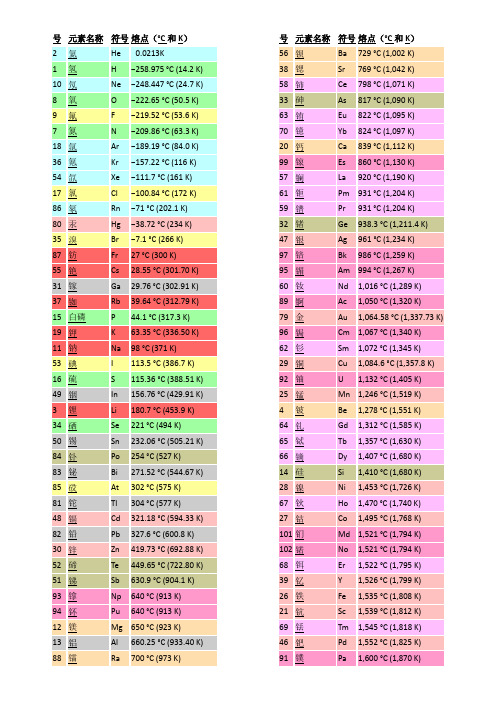
号 名称 45 铑 78 铂 5 硼 93 镎 6 91 镤 92 铀 44 钌 40 锆 77 铱 72 铪 42 钼 41 铌 90 钍 6 43 锝 76 锇 73 钽 75 铼 74 钨
K(热力学温标) 沸点°C(摄氏温标) 3968 4098 4200 4273 3695 3825 3927 4000 4027 4027 4131 4150 4409 4428 4603 4639 4744 4788 4827 4877 5012 5458 5627 5657
10 氖 7 9 氮 氟
18 氩 8 氧 36 氪 54 氙 86 氡 17 氯 118 Uuo 35 溴 53 碘 15 红磷 85 砹 80 汞 16 硫 33 砷 55 铯 87 钫 34 硒 37 铷 97 锫 19 钾 48 镉 11 钠 98 锎 30 锌 84 钋 52 碲 12 镁 70 镱 3 锂 38 锶 81 铊 20 钙 63 铕 83 铋 51 锑
K(热力学温标) 沸点°C(摄氏温标) 2010 2022 2067 2170 2223 2345 2334 2435 2477 2742 2792 2835 2840 2875 2880 2944 2993 3106 3109 3129 3134 3186 3200 3236 3273 3347 3383 3471 3501 3503 3503 3538 3546 3560 3609 3675 3680 3716 3737 3793 1737 1749 1794 1897 1950 2072 2061 2162 2204 2469 2519 2562 2567 2602 2607 2671 2720 2833 2836 2856 2861 2913 2927 2963 3000 3074 3110 3198 3228 3230 3230 3265 3273 3287 3336 3402 3407 3443 3464 3520
元素周期律 熔沸点比较

首先,判断元素单质的熔沸点要先判断其单质的晶体类型,晶体类型不同,决定其熔沸点的作用也不同。
金属的熔沸点由金属键键能大小决定;分子晶体由分子间作用力的大小决定;离子晶体由离子键键能的大小决定;原子晶体由共价键键能的大小决定。
所以第一主族的碱金属熔沸点是由金属键键能决定,在所带电荷相同的情况下,原子半径越小,金属键键能越大,所以碱金属的熔沸点递变规律是:从上到下熔沸点依次降低。
第七主族的卤素,其单质是分子晶体,故熔沸点由分子间作用力决定,在分子构成相似的情况下,相对分子质量越大,分子间作用力也越大,所以卤素的熔沸点递变规律是:从上到下熔沸点依次升高。
用这样的方法去判断同主族元素的熔沸点递变规律就行了,因为理解才是最重要的。
同周期的话,不太好说了。
通常会比较同一类型的元素单质熔沸点,比如说比较Na、Mg、Al的熔沸点,则由金属键键能决定,Al所带电荷最多,原子半径最小,所以金属键最强,故熔沸点是:Na<Mg<Al。
非金属元素一般不会比较它们单质之间的熔沸点,一般比较他们的氢化物的熔沸点。
比较时要注意CH4、NH3、H2O、HF他们的分子间除分子间作用力外,还有氢键,所以同主族氢化物熔沸点他们是最高的,其余的按分子间作用力大小排列。
如氧族元素氢化物的熔沸点是:H2O>H2Te>H2Se>H2S;卤素:HF>HI>HBr>HCl。
同周期比较的话,是从左至右熔沸点依次升高,因为气态氢化物的热稳定性是这样递变的。
另外有时还要注意物质的类型,比如让你比较金刚石、钙、氯化氢的熔沸点,只要知道金刚石是原子晶体,熔沸点最高,其次是金属钙,最后是分子晶体氯化氢。
还有原子晶体的:比较金刚石、晶体硅、碳化硅的熔沸点,那就要看共价键了,原子半径越小,共价键键能越大,故熔沸点:金刚石>碳化硅>晶体硅。
化学学习中物质的熔点、沸点规律

化学学习中物质的熔点、沸点规律晶体纯物质有固定熔点;不纯物质凝固点与成分有关(凝固点不固定)。
非晶体物质,如玻璃、水泥、石蜡、塑料等,受热变软,渐变流动性(软化过程)直至液体,没有熔点。
沸点指液体饱和蒸气压与外界压强相同时的温度,外压力为标准压(1.01×105Pa)时,称正常沸点。
外界压强越低,沸点也越低,因此减压可降低沸点。
沸点时呈气、液平衡状态。
(1)由周期表看主族单质的熔、沸点同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。
但碳族元素特殊,即C,Si,Ge,Sn越向下,熔点越低,与金属族相似。
还有ⅢA族的镓熔点比铟、铊低,ⅣA族的锡熔点比铅低。
(2)同周期中的几个区域的熔点规律①高熔点单质C,Si,B三角形小区域,因其为原子晶体,熔点高。
金刚石和石墨的熔点最高大于3550℃,金属元素的高熔点区在过渡元素的中部和中下部,其最高熔点为钨(3410℃)。
②低熔点单质非金属低熔点单质集中于周期表的右和右上方,另有IA的氢气。
其中稀有气体熔、沸点均为同周期的最低者,而氦是熔点(-272.2℃,26×105Pa)、沸点(268.9℃)最低。
金属的低熔点区有两处:IA、ⅡB族Zn,Cd,Hg及ⅢA族中Al,Ge,Th;ⅣA族的Sn,Pb;ⅤA族的Sb,Bi,呈三角形分布。
最低熔点是Hg(-38.87℃),近常温呈液态的镓(29.78℃)铯(28.4℃),体温即能使其熔化。
(3)从晶体类型看熔、沸点规律原子晶体的熔、沸点高于离子晶体,又高于分子晶体。
金属单质和合金属于金属晶体,其中熔、沸点高的比例数很大(但也有低的)。
在原子晶体中成键元素之间共价键越短的键能越大,则熔点越高。
判断时可由原子半径推导出键长、键能再比较。
如熔点:金刚石>碳化硅>晶体硅分子晶体由分子间作用力而定,其判断思路是:①结构性质相似的物质,相对分子质量大,范德华力大,则熔、沸点也相应高。
元素熔点列表
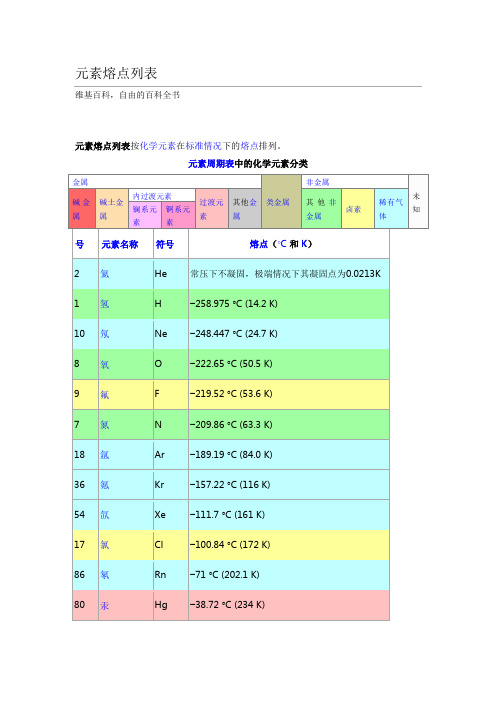
元素熔点列表维基百科,自由的百科全书元素熔点列表按化学元素在标准情况下的熔点排列。
元素周期表中的化学元素分类金属类金属非金属未知碱金属碱土金属内过渡元素过渡元素其他金属其他非金属卤素稀有气体镧系元素锕系元素号元素名称符号熔点(°C和K)2 氦He 常压下不凝固,极端情况下其凝固点为0.0213K 1 氢H −258.975 °C (14.2 K)10 氖Ne −248.447 °C (24.7 K)8 氧O −222.65 °C (50.5 K)9 氟 F −219.52 °C (53.6 K)7 氮N −209.86 °C (63.3 K)18 氩Ar −189.19 °C (84.0 K)36 氪Kr −157.22 °C (116 K)54 氙Xe −111.7 °C (161 K)17 氯Cl −100.84 °C (172 K)86 氡Rn −71 °C (202.1 K)80 汞Hg −38.72 °C (234 K)35 溴Br −7.1 °C (266 K)87 钫Fr 27 °C (300 K)55 铯Cs 28.55 °C (301.70 K)31 镓Ga 29.76 °C (302.91 K)37 铷Rb 39.64 °C (312.79 K)15 白磷P 44.1 °C (317.3 K)19 钾K 63.35 °C (336.50 K)11 钠Na 98 °C (371 K)53 碘I 113.5 °C (386.7 K)16 硫S 115.36 °C (388.51 K)49 铟In 156.76 °C (429.91 K)3 锂Li 180.7 °C (453.9 K) 34 硒Se 221 °C (494 K)50 锡Sn 232.06 °C (505.21 K) 84 钋Po 254 °C (527 K)83 铋Bi 271.52 °C (544.67 K) 85 砹At 302 °C (575 K)81 铊Tl 304 °C (577 K)48 镉Cd 321.18 °C (594.33 K) 82 铅Pb 327.6 °C (600.8 K) 30 锌Zn 419.73 °C (692.88 K) 52 碲Te 449.65 °C (722.80 K) 51 锑Sb 630.9 °C (904.1 K)93 镎Np 640 °C (913 K)94 钚Pu 640 °C (913 K)12 镁Mg 650 °C (923 K)13 铝Al 660.25 °C (933.40 K) 88 镭Ra 700 °C (973 K)56 钡Ba 729 °C (1,002 K)38 锶Sr 769 °C (1,042 K)58 铈Ce 798 °C (1,071 K)33 砷As 817 °C (1,090 K)63 铕Eu 822 °C (1,095 K)70 镱Yb 824 °C (1,097 K)20 钙Ca 839 °C (1,112 K)99 锿Es 860 °C (1,130 K)57 镧La 920 °C (1,190 K)59 镨Pr 931 °C (1,204 K)61 钷Pm 931 °C (1,204 K)32 锗Ge 938.3 °C (1,211.4 K) 47 银Ag 961 °C (1,234 K)97 锫Bk 986 °C (1,259 K)95 镅Am 994 °C (1,267 K)60 钕Nd 1,016 °C (1,289 K)79 金Au 1,064.58 °C (1,337.73 K) 96 锔Cm 1,067 °C (1,340 K)62 钐Sm 1,072 °C (1,345 K)29 铜Cu 1,084.6 °C (1,357.8 K) 92 铀U 1,132 °C (1,405 K)25 锰Mn 1,246 °C (1,519 K)4 铍Be 1,278 °C (1,551 K)64 钆Gd 1,312 °C (1,585 K)65 铽Tb 1,357 °C (1,630 K)66 镝Dy 1,407 °C (1,680 K)14 硅Si 1,410 °C (1,680 K)28 镍Ni 1,453 °C (1,726 K)67 钬Ho 1,470 °C (1,740 K)27 钴Co 1,495 °C (1,768 K)101 钔Md 1,521 °C (1,794 K)102 锘No 1,521 °C (1,794 K)68 铒Er 1,522 °C (1,795 K)39 钇Y 1,526 °C (1,799 K)26 铁Fe 1,535 °C (1,808 K)21 钪Sc 1,539 °C (1,812 K)69 铥Tm 1,545 °C (1,818 K)46 钯Pd 1,552 °C (1,825 K)91 镤Pa 1,600 °C (1,870 K)98 锎Cf 1,652 °C (1,925 K)22 钛Ti 1,660 °C (1,930 K)71 镥Lu 1,663 °C (1,936 K)90 钍Th 1,755 °C (2,028 K)78 铂Pt 1,772 °C (2,045 K)40 锆Zr 1,852 °C (2,125 K)24 铬Cr 1,857 °C (2,130 K)23 钒V 1,902 °C (2,175 K)45 铑Rh 1,966 °C (2,239 K)72 铪Hf 2,227 °C (2,500 K)44 钌Ru 2,250 °C (2,520 K)5 硼 B 2,300 °C (2,570 K)77 铱Ir 2,443 °C (2,716 K)41 铌Nb 2,468 °C (2,741 K)42 钼Mo 2,617 °C (2,890 K)100 镄Fm 2,781 °C (3,054 K)103 铹Lr 2,961 °C (3,234 K)73 钽Ta 2,996 °C (3,269 K)76 锇Os 3,027 °C (3,300 K)75 铼Re 3,180 °C (3,450 K)74 钨W 3,407 °C (3,680 K)6 碳(钻石) C 3,550 °C (3,820 K)6 碳(石墨) C 3,675 °C (3,948 K)6 碳(无定形) C 3,675 °C (3,948 K)元素周期表中的化学元素分类金属类金属非金属未知碱金属碱土金属内过渡元素过渡元素其他金属其他非金属卤素稀有气体镧系元素锕系元素以下元素熔点未知:钅卢、钅杜、钅喜、钅波、钅黑、钅麦、钅达、钅仑、钅哥、Uut、Fl、Uup、Lv、Uus、Uuo[编辑]液态元素最多的区间以下温度范围内,呈液态的元素最多:∙2739 - 2742K (2466 - 2469°C、4471 - 4476°F)——铱的熔点 - 铍的沸点∙2750 - 2792K (2477 - 2518°C、4491 - 4566°F)——铌的熔点 - 铝的沸点两个区间内都为液态的金属包括锕、铝、镅、硼、铈、铬、钴、铜、锔、镝、铒、钆、锗、金、铪、钬、铱、铁、镧、镥、钕、镎、镍、钯、铂、钋、镨、钷、镤、铑、钌、钪、硅、锝、铽、钍、锡、钛、铀、钒、钇和锆。
元素熔点列表

Gd 1,312 °C (1,585 K)
Tb 1,357 °C (1,630 K) Dy 1,407 °C (1,680 K) Si 1,410 °C (1,680 K) Ni 1,453 °C (1,726 K) Ho 1,470 °C (1,740 K) Co 1,495 °C (1,768 K) Md 1,521 °C (1,794 K) No 1,521 °C (1,794 K) Er 1,522 °C (1,795 K) Y 1,526 °C (1,799 K) Fe 1,535 °C (1,808 K) Sc 1,539 °C (1,812 K) Tm 1,545 °C (1,818 K) Pd 1,552 °C (1,825 K) Pa 1,600 °C (1,870 K) Cf 1,652 °C (1,925 K) Ti 1,660 °C (1,930 K) Lu 1,663 °C (1,936 K) Th 1,755 °C (2,028 K) Pt 1,772 °C (2,045 K) Zr 1,852 °C (2,125 K) Cr 1,857 °C (2,130 K) V 1,902 °C (2,175 K) Rh 1,966 °C (2,239 K) Tc 2,200 °C (2,470 K) Hf 2,227 °C (2,500 K) Ru 2,250 °C (2,520 K) B 2,300 °C (2,570 K) Ir 2,443 °C (2,716 K) Nb 2,468 °C (2,741 K) Mo 2,617 °C (2,890 K) Fm 2,781 °C (3,054 K) Lr 2,961 °C (3,234 K) Ta 2,996 °C (3,269 K) Os 3,027 °C (3,300 K) Re 3,180 °C (3,450 K) W 3,407 °C (3,680 K)
卤素单质沸点

卤族元素指周期系ⅦA族元素。
包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)、石田(Ts),简称卤素。
它们在自然界都以典型的盐类存在,是成盐元素。
卤族元素的单质都是双原子分子,它们的物理性质的改变都是很有规律的,随着分子量的增大,卤素分子间的色散力逐渐增强,颜色变深,它们的熔点、沸点、密度、原子体积也依次递增。
卤素都有氧化性,氟单质的氧化性最强。
卤族元素和金属元素构成大量无机盐,此外,在有机合成等领域也发挥着重要的作用。
卤素之间可以形成卤素互化物,它们有的性质类似卤素单质。
氟单质熔点、沸点是-219.7 、-188.1氯单质熔点、沸点是-101.5 、-34.0溴单质熔点、沸点是-7.2 、58.8碘单质熔点、沸点是113.7 、184.3 升华无沸点砹单质熔点、沸点是302、370 放射性氟气常温下为淡黄色的气体,有剧毒。
与水反应立即生成氢氟酸和氧气并发生燃烧,同时能使容器破裂,量多时有爆炸的危险。
氟、氟化氢(氢氟酸)对玻璃都有较强的腐蚀性。
氟是非金属性最强的元素(而且不具有d轨道),只能呈-1价。
单质氟与盐溶液的反应,都是先与水反应,生成的氢氟酸再与盐的反应;通入碱中可能导致爆炸。
水溶液氢氟酸是一种中强酸。
但却是稳定性最强的氢卤酸,因为氟原子含有较大的电子亲和能。
如果皮肤不慎粘到,将一直腐蚀到骨髓。
化学性质活泼,能与几乎所有元素发生反应(除氦、氖等惰性气体)。
氯气常温下为黄绿色气体,可溶于水,1体积水能溶解2体积氯气。
有毒,与水部分发生反应,生成盐酸(HCl)与次氯酸(HClO),次氯酸(HClO)不稳定,分解放出氧气,并生成盐酸,次氯酸氧化性很强,可用于漂白。
氯的水溶液称为氯水,不稳定,受光照会分解成HCl与氧气。
液态氯气称为液氯。
HCl溶液是一种强酸。
氯有多种可变化合价。
氯气对肺部有强烈刺激。
氯可与大多数元素反应。
氯气具有强氧化性氯气与变价金属反应时,生成最高金属氯化物。
液溴,在常温下为深红棕色液体,可溶于水,100克水能溶解约3克溴。
