粒子浓度大小的比较
离子浓度大小的比较方法及规律

离子浓度大小比较的办法和纪律之五兆芳芳创作一、离子浓度大小比较的办法和纪律1、紧抓住两个“微弱”:a弱电解质的电离是微弱的b弱根离子的水解是微弱的.2、酸式酸根离子既能电离又能水解,若电离能力大于水解能力则酸式盐溶液呈酸性,不然呈碱性.罕有呈酸性的是H2PO42-、、HSO3-对应的可溶盐的溶液.3、不合溶液中同一离子浓度大小的比较,要看溶液中其它离子对其产生的影响.如在相同物质的量浓度的下列溶液中:①NH4Cl②NH4HSO4③CH3COONH4④NH3•H2O.c (NH4+)由大到小的顺序为②>①>③>④4、混杂溶液中离子浓度大小的比较,首先要阐发混杂进程中是否产生化学反响,若产生反响,则要进行过量判断(注意混杂后溶液体积的变更);然后再结合电离、水解等因素进行阐发.5、对于等体积、等物质的量浓度的NaX和弱酸HX混杂求各微粒的浓度关系题,要由混杂后溶液的PH大小判断电离和水解的关系.罕有的CH3COOH与CH3COONa等体积、等物质的量浓度混杂、NH3•H2O与NH4Cl等体积、等物质的量浓度的混杂都是电离大于水解.6、三个重要的守恒关系①电荷守恒电解质溶液中,无论存在多少种离子,溶液总呈电中性,即阳离子所带的正电荷总数一定等于阴离子所带的负电荷总数.如Na2CO3溶液:c(Na+)+ c(H+)=cC( HCO3-) +2c( CO32-)+c( OH-) ②物料守恒如Na2CO3溶液,虽CO32-水解生成HCO3-,HCO3-进一步水解成H2CO3,但溶液中n(Na): n(C)=2:1 ,所以有如下关系:c(Na+)=2{c( HCO3-)+c( CO32-)+c( H2CO3)}③质子守恒即水电离出的OH-的量始终等于水电离出的H+的量.如Na2CO3溶液,水电离出的H+一部分与CO32-结分解HCO3-,一部分与CO32-结分解H2CO3,一部分剩余在溶液中,按照c(H+)水=c(OH-)水,有如下关系:c (OH-)=c( HCO3-)+ 2c(H2CO3)+ c(H+)二、技能1、在解题进程中,若看到选项中有“=”,则要考虑3个守恒关系:2、若守恒关系中只有离子,则考虑电荷守恒关系,若守恒关系中同时出现份子和离子,则考虑物料守恒和质子守恒;3、若选项中离子浓度关系以“>”连接,则主要考虑弱电解质的电离、弱根离子的水解以及各离子之间的相互影响等. 7、高频考点离子浓度大小的比较考点近几年以考查两种溶液混杂后离子浓度的大小比较为多,能涉及①酸碱中和反响,如甲酸与氢氧化钠溶液混杂、盐酸与氨水溶液混杂等②弱酸盐与强酸混杂、弱碱盐与强碱混杂,如醋酸钠与盐酸混杂、铵盐与氢氧化钡混杂等.这类题目的做法是先找出反响后的新溶质(往往某一反响物过量而形成多种溶质),再按照溶液体积的变更计较混杂后各新溶质的物质的量浓度,最后对浓度的大小作出比较.8、雾点击穿1、轻忽溶液中水的电离.如硫酸铵溶液中c(H+)>c(NH3•H2O)2、3•H2O等体积混杂充分反响后,溶质为NH3•H2O和的NH4Cl的混杂溶液,产生化学反响生成了新的溶质.3、3•H23•H24Cl的混杂溶液,离子浓度大小顺序为:c (NH4+)>c(Cl-)>c(OH-)>c(H+)4、轻忽二价离子在电荷守恒关系中的系数“2”.如(NH4)2SO4中离子浓度关系为c(NH4+)+ c(H+)=c(SO42-)+ c(OH-)(06四川高考),硫酸根离子浓度前应该有“2”.5、轻忽二元酸第一步电离生成的H+会对第二步的电离产生抑制作用.如已知二元酸H2A在水中的第一步电离是完全的,第二步电离不完全,0.1 mol/L NaHA溶液的PH=2,则0.1 mol/LH2A溶液中氢离子的物质的量浓度 < 0.11 mol/L。
离子浓度大小比较

3.物料守恒: 电解质溶液中由于电离或水解因素,离子会发 生变化变成其它离子或分子等,但离子或分子中某 种特定元素的原子的总数是不会改变的。 如NaHCO3溶液中 c(Na+)=c(HCO3—)+c(CO32—)+c(H2CO3) 4.质子守恒: 例如在Na2CO3溶液中 c(OH—)=c(H+)+2c(H2CO3)+c(HCO3-)
3.将pH=2的盐酸与pH=12的氨水等体积混合,在所得的混 合溶液中,下列关系式正确的是( ) A、c(Cl-)>c(NH4+)>c(OH-)>c(H+) B B、c(NH4+)>c(Cl-)> c(OH-)>c(H+) C、c(Cl-)=c(NH4+)>c(H+)=c(OH-) D、c(NH4+)>c(Cl-)>c(H+)>c(OH-)
【知识回顾】
• 一、强酸与弱酸的比较 二、酸、碱混合后溶液的酸碱性判断 三、电离平衡和水解平衡的比较 四、溶液中的物料守恒和电荷守恒
例1、在相同温度时100 mL 0.01mol/L 的醋酸溶液与10 mL 0.1mol/L的醋酸溶液相 比较, 下列数值前者大于后者的是 A.中和时所需NaOH的量 同 B.电离程度 C.H+的物质的量 D.CH3COOH的物质的量 同
2.把0.02 mol· -1 HAc溶液与0.01 mol· -1NaOH溶液等体 L L 积混合,则混合液中微粒浓度关系正确的是( A D) A、c(Ac-)>c(Na+) B、c(HAc)>c(Ac-) C、2c(H+)=c(Ac-)-c(HAc) D、c(HAc)+c(Ac-)=0.01 mol· -1 L 3.将0.2 mol· -1 CH3COOK 与0.1 mol· -1盐酸等体积混合 L L 后,溶液的pH<7,则溶液中下列微粒的物质的量浓度的 关系正确的是( D ) A、c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) B、c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+) C、c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) D、c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
离子浓度大小的比较

( 2 )水解能力大于电离能力(如NaHCO3 、 Na2HPO4 、NaHS) 练习:试比较NaHCO3溶液中各离子浓度大小。
答案: C(Na+ ) > C(HCO3 –) > C(OH-) > C(H+) > C(CO3 2-) H2CO3?
六、单一正盐(AB型)溶液中离子浓度大小的比 (考虑水解和电离)
5、现有NH4Cl和氨水组成的混合溶液(填“>”、“<”或 “=”) = ①若溶液的pH=7,则该溶液中C(Nt;7,则该溶液中C(NH4+) < C(Cl-); ③若C(NH4+)< C(Cl-),则溶液的pH 7。
变式:NaHCO3溶液
三、质子守恒
在NH4Cl溶液中,存在两个守恒:
由水电离提供的H+与OH-相等(可由电荷守恒及物料守恒推出)。
电荷守恒:c(NH4+)+c(H+)=c(OH-) +c(Cl-) 物料守恒:c(Cl-)=c(NH4+)+c(NH3· 2O) H 两式相加 质子守恒: c(H+) = c(OH-) +c(NH3· 2O) H
4.在Na2CO3溶液中下列关系不正确的是( A ) A. 2c(Na+) = c(CO32-) + c( HCO3-) + c(H2CO3) B. c(Na+) +c(H+)= 2c(CO32-) + c(HCO3-) + c(OH-) C. c(Na+) > c(CO32-) >c(OH-)>c(HCO3-) >c(H+) D.c(OH-)= c(H+)+ c(HCO3-)+2c(H2CO3) 电荷守恒: c(Na+) +c(H+)= 2c(CO32-) + c(HCO3-) + c(OH-) 物料守恒: c(Na+) = 2c(CO32-) +2 c( HCO3-) + 2c(H2CO3) 质子守恒:c(OH-) = c(HCO3-) + c(H+) + 2c(H2CO3)
离子浓度大小比较
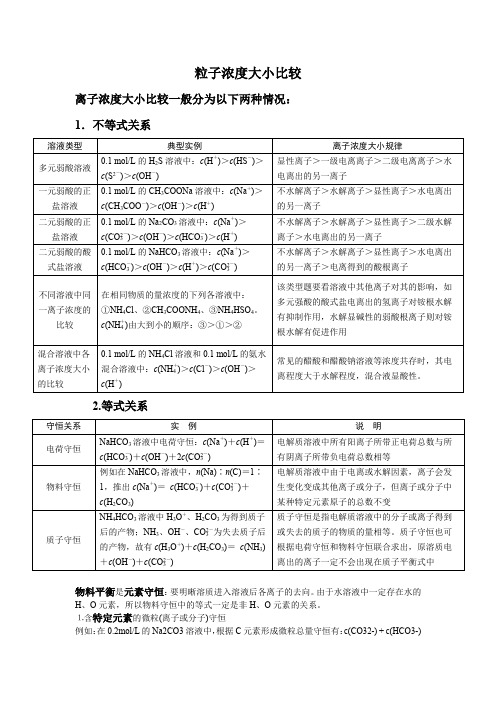
粒子浓度大小比较离子浓度大小比较一般分为以下两种情况:1.不等式关系2.等式关系物料平衡是元素守恒:要明晰溶质进入溶液后各离子的去向。
由于水溶液中一定存在水的H、O元素,所以物料守恒中的等式一定是非H、O元素的关系。
⒈含特定元素的微粒(离子或分子)守恒例如:在0.2mol/L的Na2CO3溶液中,根据C元素形成微粒总量守恒有:c(CO32-) + c(HCO3-)+ c(H2CO3) = 0.2mol/L。
⒉不同元素间形成的特定微粒比守恒例如:在Na2CO3 溶液中,根据Na与C形成微粒的关系有:c(Na+) = 2[c(CO32- ) + c(HCO3- ) + c(H2CO3 )]分析:上述Na2CO3 溶液中,C原子守恒,n(Na) : n(C)恒为2:13.混合溶液中弱电解质及其对应离子总量守恒例如:相同浓度的HAc溶液与NaAc溶液等体积混合后,混合溶液中有:2c(Na+ )=c(Ac-)+c(HAc)分析:上述混合溶液中,虽存在Ac-的水解和HAc的电离,但也仅是Ac-和HAc两种微粒间的转化,其总量不变。
质子守恒规律:水电离的特征是c(H)=c(OH-),只不过有些会水解的盐会导致氢离子、氢氧根可能会有不同的去向,我们需要把它们的去向全部找出来。
例如:NaHCO3溶液,初始H+ 来源于HCO3- 和H2O的电离,c初(H+) = c(CO32- ) + c(OH- );伴随着的水解的发生,一部分H+转化到H2CO3中,因此,c初(H+) = c现(H+) + c(H2CO3 ),从而得出,溶液中离子浓度的关系如下:c(CO32- ) + c(OH- ) = c(H+) +c(H2CO3 )对同一溶液来说:质子守恒=电荷守恒-物料平衡快速书写质子守恒的方法第一步:确定溶液的酸碱性,溶液显酸性,把氢离子浓度写在左边,反之则把氢氧根离子浓度写在左边。
第二步:根据溶液能电离出的离子和溶液中存在的离子,来补全等式右边。
微专题——离子浓度大小比较(教师版)

微专题——离子浓度大小比较知识点一:溶液中的三种守恒:以Na2S和NaHS溶液为例:1、电荷守恒:Na2S水溶液:[Na+]+[H+]=2[S2-]+[HS-]+[OH-]NaHS水溶液:[Na+]+[H+]=2[S2-]+[HS-]+[OH-]意义:溶液呈电中性,因此阴阳离子所带正负电荷总数相等。
写法:将溶液中所有阳离子浓度相加,等于溶液中所有阴离子浓度相加,其中每个离子浓度前的系数等于其所带电荷电量的绝对值。
特点:电荷守恒式只与溶液中离子种类相关,与浓度无关。
2、物料守恒:Na2S水溶液:[Na+]=2([S2-]+[HS-]+[H2S])NaHS水溶液:[Na+]=[S2-]+[HS-]+[H2S]意义:加入的物质中各种原子进入溶液后只是存在形态发生的改变,但数目守恒。
写法:观察加入的物质中非H、O元素的原子比例,将溶液中某原子的所有存在微粒浓度相加表示该原子的总浓度,再根据原加入物质中原子数目之比配平系数。
特点:不能以H、O原子书写物料守恒,因为水中有大量的H、O原子。
3、质子守恒:Na2S水溶液:[OH-]=[HS-]+2[H2S]+[H+]NaHS水溶液:[OH-]+[S2-]=[H2S]+[H+]意义:溶液中各微粒得质子(即H+)总数等于失去的质子总数。
写法:①将电荷守恒与物料守恒联立,约去[Na+]即可得到质子守恒式。
②将溶液中得到质子后形成的微粒浓度乘以得到质子的数目再相加,相当于于得质子总数;所有失去质子后得到的微粒浓度乘以失去的质子数再相加,相当于失去的质子总数;二者相等即可。
物理意义写法:(Na2S为例)得到的质子总数=n(HS -)+2n(H 2S)+n(H +),失去的质子数=n(OH -),二者相等。
再除以溶液体积即可得到质子守恒式知识点二:溶液中离子的浓度大小比较:1、弱酸溶液:0.1mol/L 的HAc 溶液中离子浓度由大到小的排列顺序是:([HAc] >)[H +] >[Ac -] >[OH -]0.1mol/L 的H 2S 溶液中离子浓度由大到小的排列顺序是:([H 2S] >)[H +] >[HS -] >[OH -]>[S 2-](说明:H 2S 的二级电离常数太小,导致[OH -]>[S 2-],如果是碳酸,则是[CO 32-]>[OH -])2、一元弱酸的正盐溶液:0.1mol/L 的CH 3COONa 溶液中离子浓度由大到小的排列顺序是:[Na +] >[Ac -] >[OH -]>[H +]3、二元弱酸的正盐溶液:0.1mol/L 的Na 2CO 3溶液中离子浓度由大到小的排列顺序是:[Na +]>[CO 32-]>[OH -]>[HCO 3-](>[H 2CO 3])>[H +](一步水解后产生等量OH -和HCO 3-,但后者还要水解,浓度会减小,故[OH -]>[HCO 3-],溶液碱性,[H +]最小) (关于碳酸与氢离子浓度大小比较可以由1323[][][]k H HCO H CO +-=进行讨论,常温下k 1数量级是10-7,而[HCO 3-]接近[OH -],一般大于这个值,因此整个分数小于1,故[H 2CO 3])>[H +])4、二元弱酸的酸式盐溶液:0.1mol/L 的NaHCO 3溶液中离子浓度由大到小的排列顺序是:[Na +]>[HCO 3-]>[OH -](>[H 2CO 3])>[H +]>[CO 32-](水解大于电离,故水解产物(H 2CO 3、OH -)浓度大于电离产物(CO 32-、H +)浓度,水也电离,故[H +]>[CO 32-])0.1mol/L 的NaHSO 3溶液中离子浓度由大到小的排列顺序是:[Na +]>[HSO 3-]>[H +]>[SO 32-] >[OH -](>[H 2SO 3])(电离大于水解,因此电离产物(SO 32-与H +)浓度大于水解产物(OH -)浓度,水电离导致,[H 2SO 3]最小)5、常见的混合溶液情况分析:① 混合后若反应,则先弄清反应后溶液中的溶质以及各溶质浓度,计算浓度时不要忘记体积的稀释效果; ② 混合溶液中物料守恒可能等式的一边以具体的浓度出现,要能看出来。
离子浓度大小的比较

离子浓度大小的比较一、离子浓度大小的比较这类问题包括一种物质的溶液和两种物质的溶液。
具体分析问题和解题是要先整体,后局部;先宏观,后微观。
对于一种电解质溶液,先观看,后分析;对于两种电解质混合的溶液,由于反应,则应先计算,后观看。
具体解题思路是:算相关的物质的量,看电离、水解、反应的情况,进行综合分析判断。
例1.明矾溶于水,所得溶液中各种离子的物质的量浓度的关系是( D )A. [K+]>[SO42-]>[Al3+]>[H+]>[OH-]B. [SO42-]>[K+] =[Al3+]>[OH-]>[H+]C. [SO42-]>[K+] =[Al3+]>[H+]>[OH-]D. [SO42-]>[K+]>[Al3+]>[H+]>[OH-](上海高考88.一.9)解析:由KAl(SO4)2·12H2O =K++Al3++2SO42-+12H2O知,[SO42-]最多;由Al3++O Al(OH)3+3H+知,溶液显酸性,[H+]>[OH-];K+不水解,故[K+]>[Al3+],本题3H应选D。
对于这种离子浓度大小的比较,还存在一种小规律,即阴、阳离子交错的比较一定是错的。
用此规律看选项A、B,就知是错的。
例2.将0.2 mol / L的醋酸钾溶液与0.1 mol / L盐酸等体积混合后,溶液中下列粒子的物质的量浓度的关系正确的是(MCE91.30)( D )A. [CH3COO-] =[Cl-] =[H+]>[CH3COOH]B. [CH3COO-] =[Cl-]>[CH3COOH]>[H+]C. [CH3COO-]>[Cl-]>[H+]>[CH3COOH]D. [CH3COO-]>[Cl-]>[CH3COOH]>[H+]解析:由题给反应知,生成0.1 mol / L的氯化钾溶液和0.1 mol / L的醋酸溶液,还剩余0.1 mol / L的醋酸钾溶液。
一些学生会认为醋酸的电离产生醋酸根离子,而醋酸根的水解又产生醋酸,这种循环使其无法判断哪种微粒浓度大。
离子浓度大小的比较方法及规律

离子浓度大小比较的要领战程序之阳早格格创做一、离子浓度大小比较的要领战程序1、紧抓住二个“微小”:a强电解量的电离是微小的b强根离子的火解是微小的.2、酸式酸根离子既能电离又能火解,若电离本领大于火解本领则酸式盐溶液呈酸性,可则呈碱性.罕睹呈酸性的是H2PO42-、、HSO3-对付应的可溶盐的溶液.3、分歧溶液中共一离子浓度大小的比较,要瞅溶液中其余离子对付其爆收的效率.如正在相共物量的量浓度的下列溶液中:①NH4Cl②NH4HSO4③CH3COONH4④NH3•H2O.c (NH4+)由大到小的程序为②>①>③>④4、混同溶液中离子浓度大小的比较,最先要分解混同历程中是可爆收化教反应,若爆收反应,则要举止过量推断(注意混同后溶液体积的变更);而后再分离电离、火解等果素举止分解.5、对付于等体积、等物量的量浓度的NaX战强酸HX混同供各微粒的浓度闭系题,要由混同后溶液的PH大小推断电离战火解的闭系.罕睹的CH3COOH取CH3COONa等体积、等物量的量浓度混同、NH3•H2O取NH4Cl等体积、等物量的量浓度的混同皆是电离大于火解.6、三个要害的守恒闭系①电荷守恒电解量溶液中,无论存留几种离子,溶液总呈电中性,即阳离子所戴的正电荷总数一定等于阳离子所戴的背电荷总数.如Na2CO3溶液:c(Na+)+ c(H+)=cC( HCO3-) +2c( CO32-)+c( OH-) ②物料守恒如Na2CO3溶液,虽CO32-火解死成HCO3-,HCO3-进一步火解成H2CO3,但是溶液中n(Na): n(C)=2:1 ,所以犹如下闭系:c(Na+)=2{c( HCO3-)+c( CO32-)+c( H2CO3)}③量子守恒即火电离出的OH-的量末究等于火电离出的H+的量.如Na2CO3溶液,火电离出的H+一部分取CO32-分离成HCO3-,一部分取CO32-分离成H2CO3,一部分结余正在溶液中,根据c(H+)火=c(OH-)火,犹如下闭系:c (OH-)=c( HCO3-)+ 2c(H2CO3)+ c(H+)二、本领1、正在解题历程中,若瞅到选项中有“=”,则要思量3个守恒闭系:2、若守恒闭系中惟有离子,则思量电荷守恒闭系,若守恒闭系中共时出现分子战离子,则思量物料守恒战量子守恒;3、若选项中离子浓度闭系以“>”连交,则主要思量强电解量的电离、强根离子的火解以及各离子之间的相互效率等. 7、下频考面离子浓度大小的比较考面近几年以考查二种溶液混同后离子浓度的大小比较为多,能波及①酸碱中战反应,如甲酸取氢氧化钠溶液混同、盐酸取氨火溶液混同等②强酸盐取强酸混同、强碱盐取强碱混同,如醋酸钠取盐酸混同、铵盐取氢氧化钡混同等.那类题手段干法是先找出反应后的新溶量(往往某一反应物过量而产死多种溶量),再根据溶液体积的变更估计混同后各新溶量的物量的量浓度,末尾对付浓度的大小做出比较.8、雾面打脱1、轻视溶液中火的电离.如硫酸铵溶液中c(H+)>c(NH3•H2O)2、3•H2O等体积混同充分反应后,溶量为NH3•H2O战的NH4Cl的混同溶液,爆收化教反应死成了新的溶量.3、3•H23•H24Cl的混同溶液,离子浓度大小程序为:c (NH4+)>c(Cl-)>c(OH-)>c(H+)4、轻视二价离子正在电荷守恒闭系中的系数“2”.如(NH4)2SO4中离子浓度闭系为c(NH4+)+ c(H+)=c(SO42-)+ c (OH-)(06四川下考),硫酸根离子浓度前该当有“2”.5、轻视二元酸第一步电离死成的H+会对付第二步的电离爆收压造效率.如已知二元酸H2A正在火中的第一步电离是实足的,第二步电离没有实足,0.1 mol/L NaHA溶液的PH=2,则0.1 mol/LH2A溶液中氢离子的物量的量浓度< 0.11 mol/L。
离子浓度大小的比较

【课堂练习】
1.在0.1mol/L Na2CO3溶液中,下列关系正确的是 A.c(Na+)=2c(CO32-)
( A )
【课堂练习】
3.下列叙述正确的是
( BC )
A. 0.1mol/L氨水中,c(OH-)=c(NH4+)
B. 10mL 0.02mol/L HCl溶液与10mL 0.02mol/L
Ba(OH)2溶液充分混合后溶液体积为20mL,则pH=12
C. 在0.1mol/LCH3COONa溶液中,
c(OH-) =c(CH3COOH)+c(H+)
C.C(CH3COOH)>C(CH3COO-)
D.C(CH3COO-)+C(OH-)=0.2 mol/L
【课堂练习】 • 1、现有NH4Cl和氨水组成的混合溶液C(填“>”、“<” 或“=”) • ①若溶液的pH=7,则该溶液中C(NH4+) = C(Cl-); • ②若溶液的pH>7,则该溶液中C(NH4+) > C(Cl-); < • ③若C(NH4+)< C(Cl-),则溶液的pH 7。 • 2、CH3COOH与CH3COONa等物质的量混合配制成稀 溶液,pH值为4.7,下列说法错误的是( B ) • A、CH3COOH的电离作用大于CH3COONa的水解作用 • B、CH3COONa的水解作用大于CH3COOH的电离作用 • C、CH3COOH的存在抑制了CH3COONa的水解 • D、CH3COONa的存在抑制了CH3COOH的电离
离子浓度的大小比较

考点8 离子浓度的大小比较【考点定位】本考点考查离子浓度的大小比较,根据溶液中存在的电离平衡、水解平衡准确确定溶液中存在的微粒,灵活运用电荷守恒、物料守恒及质子守恒分析。
【精确解读】一、单一溶液中离子浓度大小的比较:点拨:判断多元弱酸溶液中离子浓度大小的一般规律是:(显性离子)>(一级电离离子)>(二级电离离子)>(水电离出的另一离子)点拨:判断一元弱酸的正盐溶液中离子浓度大小的一般规律是:(不水解离子)>(水解离子)>(显性离子)>(水电离出的另一离子)点拨:判断二元弱酸的正盐溶液中离子浓度大小的一般规律是:(不水解离子)>(水解离子)>(显性离子)>(二级水解离子)>(水电离出的另一离子)4.二元弱酸的酸式盐溶液,如0.1mol/L的NaHCO3溶液:点拨:判断二元弱酸的酸式盐溶液中离子浓度大小的一般规律是:(不水解离子)>(水解离子)>(显性离子)>(水电离出的另一离子)>(电离得到的酸根离子)5.不同溶液中同一离子浓度的比较,要看溶液中其它离子对其影响的因素.如在相同物质的量的浓度的下列溶液:①NH4Cl②CH3COONH4③NH4HSO4中c(NH4+)浓度由大到小的顺序是:③>①>②.点拨:该类型题要看溶液中其它离子对的其影响.二、混合溶液中离子浓度大小的比较:1.两种物质混合不反应:如①等物质的量的CH3COOH和CH3COONa混合:CH3COOH的电离作用大于CH3COONa的水解作用,混合后溶液呈酸性,c(CH3COO-)>c(Na+)>c(H+)>c(OH-)②等物质的量的NH4Cl和NH3•H2O混合:和NH3•H2O的电离作用大于NH4Cl的水解作用,混合后溶液呈碱性,c(NH4+)>c(Cl-)>c(OH-)>c(H+)2.两种物质其恰好完全反应:如①10ml 0.1 mol/L NaOH溶液中加入同体积、同浓度HAc溶液混合②100 mL 0.1 mol/L 醋酸与50 mL 0.2mol/L NaOH溶液混合等.3.两种物质反应,其中一种有剩余(1)酸与碱反应型:点拨:在审题时,要关注所给物质的量是“物质的量浓度”还是“pH”,否则会很容易判断错误,解答此类题目时应抓住两溶液混合后剩余的弱酸或弱碱的电离程度和生成盐的水解程度的相对大小.如:0.2 mol/L HCN溶液和0.1 mol/L NaOH溶液等体积混合解析:上述溶液混合后,溶质为HCN和NaCN,由于该题已说明溶液显碱性,所以不能再按照HCN的电离处理,而应按NaCN水解为主.①pH=7型:例:常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )A.c(HCOO-)>c(Na+) B.c(HCOO-)<c(Na+)C.c(HCOO-)=c(Na+) D.无法确定c(HCOO-)与c(Na+)的关系②未指明酸碱的强弱:③pH之和等于14的酸和碱溶液的混合(判断过量)如:①pH=3的CH3COOH与pH=11的NaOH溶液等体积混合,CH3COOH过量,混合后溶液呈酸性;②pH=2的盐酸与pH=12的氨水等体积混合,氨水过量,混合后溶液呈碱性.(2)盐与酸(碱)反应型①弱酸强碱盐与强酸反应后溶液中离子浓度大小的比较例:将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是A.c(Ac-)>c(Cl-)>c(H+)>c(HAc) B.c(Ac-)>c(Cl-)>c(HAc)>c(H+)C.c(Ac-)=c(Cl+)>c(H+)>c(HAc) D.c(Na+)+c(H+)=c(Ac-)+c(Cl-)+c(OH-)②强酸弱碱盐与强碱反应后溶液中离子浓度大小的比较例.0.2mol/L NH4Cl溶液与0.1mol/L NaOH溶液等体积混合后,溶液中下列微粒的物质的量浓度关系正确的是( )A.c(NH4+)=c(Na+)=c(OH-)>c(NH3•H2O) B.c(NH4+)=c(Na+)>c(NH3•H2O)>c(OH-)C.c(NH4+)+c(Na+)+c(H+)=c(Cl-)+c(OH-) D.c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+)4.不同物质同种离子浓度的比较:如NH4Cl、NH4HSO4、CH3COONH4和NH4HCO3中NH4+的比较【精细剖析】一、离子浓度大小比较的解题方法和步骤:1.判断水解、电离哪个为主.(1)盐离子不水解不电离:强酸强碱盐,如NaCl、Na2SO4等.(2)盐离子只水解不电离:强酸弱碱或弱酸强碱形成的正盐,如NH4Cl、Na2CO3等(3)盐离子既水解又电离:多元弱酸形成的酸式盐,以水解为主的有NaHCO3、NaHS、Na2HPO4等;以电离为主的有NaHSO3和NaH2PO4等(4)根据题意判断:如某温度下NaHB强电解质溶液中,当c(H+)>c(OH-)时,以HB-的电离为主;当c(H+)<c(OH-)时,以HB-的水解为主.对于弱酸HX与强碱盐(NaX式)的混合溶液中,当c(H+)>c(OH-)时,以HX的电离为主;当c(H+)<c(OH-)时,以X-的水解为主.对于弱碱ROH与强酸盐(RCl式)的混合溶液中,情况则相反.2.运用盐溶液中的以上三种关系进行综合分析判断,得出正确结论.二、离子浓度大小比较,在分析问题时注意的问题:1.三个观点:(1)全面的观点.探究离子浓度问题,要充分认识电解质在溶液中的表现,全面考虑溶液中各种离子的存在情况及相互关系,比如:在Na2CO3溶液中存在Na2CO3的电离,CO32-的水解、二级水解以及H2O的电离等多个反应,故溶液中微粒有H2O、Na+、CO32-、HCO3-、H2CO3、H+、OH-,忽视任何一个很微弱的反应、很微少的粒子都是不正确的.(2)矛盾的观点.事物是矛盾的统一体,处理矛盾问题时要抓住主要矛盾.在比较离子浓度大小时,若溶液中存在竞争反应时,需要抓住主要矛盾来解决相关问题.如等物质的量的NH4Cl、NH3•H2O共存于溶液中,则溶液中同时存在NH4+水解和NH3•H2O的电离,由于NH3•H2O的电离程度大于NH4+的水解程度,故考虑电离而忽略水解,由此得出离子浓度的大小关系为:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+).在应用此观点时,正确判断矛盾双方的性质是必要的,如一级电离通常大于二级电离,一级水解通常大于二级水解.弱酸及其对应盐、弱碱及其对应盐所形成的缓冲溶液中通常情况是电离强于水解,极少数例外 (如HCN及CN-).(3)联系的观点.事物是相互联系、相互影响,而不是孤立存在的.溶液的离子亦如此,要应用化学原理,准确判断离子之间的相互影响.比如:纯水中由水电离出的H+、OH-满足c(OH-〕=c(H+);若加入碱或酸,则碱或酸电离出的OH-、H+会抑制水的电离,而使c(H+〕水=c(OH-)水但数值减小;若加入可水解的盐,则因弱离子的水解消耗H+或OH-而促进水的电离,c(H+)水与c(OH-)水不再相等.象这样因为某种作用改变离子存在状况的例子很多.2.两种理论:(1)弱电解质的电离平衡理论①弱电解质的电离是微量的,电离消耗及电离产生的粒子是少量的,同时还应考虑水的电离.②多元弱酸的电离是分步的,主要是第一步电离.(2)水解平衡理论①弱酸根离子或弱碱阳离子由于水解而损耗.如NH4Cl溶液中,因NH4+水解损耗,所以c(Cl-)>c(NH4+)②弱酸根离子或弱碱阳离子的水解损失是微量的(双水解除外),因此水解生成的弱电解质及产生的H+(或OH-)也是微量的.但由于水的电离,所以水解后酸性溶液中c(H+)或碱性溶液中的c(OH-)问题大于水解产生的弱电解质的浓度.③多元弱酸根离子的水解是分步的,以第一步水解为主.④强碱弱酸酸式盐溶液中弱酸酸根离子既有电离又有水解,比较离子浓度时首先要认清其阴离子的电离程度和水解程度.a、若溶液显酸性,说明阴离子的电离程度>水解程度.b、若溶液显碱性,说明阴离子的电离程度<水解程度.⑤弱酸、弱碱与其对应盐的混合液(物质的量之比为1:1)a、一般规律是:酸、碱的电离程度>其对应盐的水解程度.CH3COOH~CH3COONa混合液呈酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);NH3•H2O~NH4Cl混合液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+)b、特殊情况:HCN~NaCN混合液呈碱性:c(Na+)>c(CN-)>c(OH-)>c(H+)3.溶液中的几个守恒关系(1)电荷守恒:即所有阳离子所带的正电荷总数与所有阴离子所带的负电荷总数代数和为零.(2)物料守恒(原子守恒):即某种原子在变化过程(水解、电离)中数目不变.(3)质子守恒:即在纯水中加入电解质,最后溶液中[H+]与其它微粒浓度之间的关系式(由电荷守恒及质子守恒推出)。
离子浓度大小比较的方法和规律

离子浓度大小比较的方法和规律
方法和规律1:通过离子的电荷数比较离子浓度。
根据离子浓
度的定义,以及离子在溶液中的电离平衡反应,可以推导出离子浓度与离子的电荷数成正比关系。
即离子的电荷数越大,离子浓度越高。
因此,可以通过比较离子的电荷数来判断离子浓度的大小。
方法和规律2:通过溶液的浓度比较离子浓度。
根据浓度的定义,溶液中溶质的浓度与物质的量成正比。
离子浓度就是溶液中离子的浓度,可以通过比较溶液浓度来推测离子浓度的大小。
方法和规律3:通过电导率比较离子浓度。
电导率是电解质溶
液中电流通过的能力的度量。
溶液中离子的浓度越高,电导率越大。
因此,可以通过测量溶液的电导率来比较离子的浓度大小。
方法和规律4:通过沉淀反应比较离子浓度。
离子溶液中存在
着沉淀反应的特性,在一定条件下会生成可见的沉淀。
一般情况下,离子浓度较高的溶液会更容易发生沉淀反应。
因此,可以通过观察溶液是否生成沉淀来推测离子浓度的大小。
方法和规律5:通过离子的摩尔浓度比较离子浓度。
摩尔浓度
是指单位体积内的溶质物质的物质的量。
因此,可以通过比较离子的摩尔浓度来判断离子的浓度大小。
需要注意的是,离子浓度的大小比较还需要考虑其他因素,如
溶液的温度、溶解度等。
各种方法和规律可以结合使用,综合判断离子浓度的大小。
离子浓度大小的比较

如:0.2mol/LNa2CO3溶液
碳守恒:
C(CO32-)+C(HCO3-)+C(H2CO3)=0.2mol/L
练习:0.1mol/LCH3COONa溶液
醋酸根守恒:
C(CH3COO-)+C(CH3COOH)=C(Na+)=0.1mol/L 8
质 如: Na2CO3溶液
子 守 C(OH-)=C(H+)+C(HCO3-)+2C(H2CO3) 恒
盐的水解应用___离子浓度大小比较
电
如: 0.1mol/LH2S溶液
荷 守
C(H+) = C(OH-)+C(HS-)+2C(S2-)
恒
又如: 0.2mol/LNa2CO3溶液
C(Na+)+C(H+)=2C(CO32-)+C(HCO3-)+C(OH-) 练习: 0.1mol/LCH3COONa溶液
C(Na+)+C(H+)=C(OH-)+C(CH3COO-)
• C.[CH3COO-]>[Cl-]>[H+]>[CH3COOH] D.[CH3COO-]>[Cl-]>[CH3COOH] >[H+]
如: 0.2mol/LCH3COOK与0.1mol/LHCl各1L,混合 后溶液 中离子浓度大小比较为:__________
答案: C(K+)﹥C(CH3COO-)﹥C(Cl-) ﹥C(H+) ﹥C(OH-)
C(NH4+) ﹥C(Cl-) ﹥C(OH-) ﹥C(H+)
• 3、现有NH4Cl和氨水组成的混合溶液 • ①若溶液的pH=7, • 则该溶液中C(NH4+) C(Cl-) • ②若溶液的pH>7, • 则该溶液中C(NH4+) C(Cl-); • ③若C(NH4+)> C(Cl-), • 则溶液的pH 7。 • ④将m mol·L-1的盐酸和n mol·L-1氨水等体
4.2离子浓度大小的比较

CH3COOH
2.重要一元弱碱:NH3H2O 重要一元弱碱:
三、两种溶液混合后离子浓度的关系
1、两种物质混合不反应: 、两种物质混合不反应: 2、两种物质恰好完全反应: 、两种物质恰好完全反应: 3、两种物质反应,其中一种有剩余: 、两种物质反应,其中一种有剩余:
4、未指明酸碱的强弱: 、未指明酸碱的强弱:
1、两种物质混合不反应: 、两种物质混合不反应:
3. 0.1mol/LNa2CO3溶液中各粒子浓度之间的关系: 溶液中各粒子浓度之间的关系: 电荷守恒: 电荷守恒: c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) 物料守恒: 物料守恒: c (Na+) =2 [ c (H2CO3) + c (HCO3-) + c(CO32-) ] c (H2CO3) + c (HCO3-) + c(CO32-) =0.1mol/L 质子守恒: 质子守恒: c (OH-) = c (H+) + c(HCO3-) + 2 c (H2CO3)
1) NH3H2O是弱电解质,在溶液中存在电离平衡: 是弱电解质, 是弱电解质 在溶液中存在电离平衡: NH3H2O NH4+ + OH-
2) 在NH3H2O溶液中存在的主要微粒 溶液中存在的主要微粒 NH3H2O、NH4+、H2O、OH-、H+等 、 、 3)各微粒浓度间的关系:电荷守恒 各微粒浓度间的关系: 各微粒浓度间的关系 a、[NH4+] + [H+] = [OH-] 、
溶液中离子浓度大小的比较

(2)电荷守恒:是指溶液中所有阳离子所Байду номын сангаас
带的正电荷总数等于溶液中所有阴离子所 带的负电荷总数。整个溶液呈电中性。 c(Na+) +c(H+)=c(CH3COO - ) +c(OH-)
(3)水电离的H+ 与OH-守恒(质子守恒):
在纯水中c(H+)=c(OH-) CH3COONa溶液中 c(OH-) =c(H+) + c (CH3COOH)
小结:
电 解 质 溶 液
单 一 溶 液
酸或碱溶液——考虑电离
盐溶液——考虑水解
不反应——同时考虑电离和水解
混 合 溶 液 恰好 生成酸或碱——考虑电离 反应 生成盐——考虑水解 过量——根据过量程度考虑电离
反 应
或水解
练习:在0.1mol/L的H2S溶液中下列 关系式错误的是:( A) A.C(H+)=C(OH-)+C(S2-) +C(HS-) B.C(H+)=C(OH-)+2C(S2-) +C(HS-)
C.C(H+)>C(OH-)+C(S2-) +C(HS-)
D.C(H2S)+C(S2-) +C(HS-)= 0.1mol/L
例2:在NH4Cl溶液中,下列关系正确的是 ( A ) A.C(Cl-) > C(NH4+) > C(H+) > C(OH-)
B. C(NH4+) > C(Cl-) > C(H+) > C(OH-) C. C(Cl-) = C(NH4+) > C(H+) = C(OH-)
高中化学:离子浓度大小的比较

一、知识点1、电解质的电离强电解质如NaCl、HCl、NaOH等在水溶液中是完全电离的,在溶液中不存在电解质分子。
弱电解质在水溶液中是部分发生电离的。
如25℃ 0.1mol·L-1 CH3COOH的溶液中,CH3COOH的电离度只有1.32%,溶液中存在较大量的H2O和CH3COOH分子,少量的、和极少量的。
多元弱酸如H2CO3还要考虑分步电离:;。
2、水的电离水是一种极弱的电解质,它能微弱地电离,生成和,。
在25℃(常温)时,纯水中。
在一定温度下,与的乘积是一个常数:水的离子积,在25℃时,。
在纯水中加入酸或碱,抑制了水的电离,使水的电离度变小,水电离出的和均小于。
在纯水中加入强碱弱酸盐、强酸弱碱盐,促进了水的电离,使水的电离度变大,水电离出的和均大于。
3、盐类水解强酸弱碱盐如NH4Cl、Al2(SO4)3等水解后溶液呈酸性;强碱弱酸盐如CH3COONa、Na2CO3等水解后溶液呈碱性。
多元弱酸盐还要考虑分步水解,如、。
二、四种守恒以0.1mol·L-1 Na2CO3溶液为例,溶液中的大量离子:、,微量离子:、、,大量分子:,微量分子:H2CO3。
1、电荷守恒:电解质溶液中所有阳离子所带的正电荷数与所有阴离子所带的负电荷数相等。
推出:。
2、物料守恒:考虑水解前后碳元素守恒,则:。
3、定组成守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其他离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。
如Na2CO3中,推出:。
4、质子守恒:由水电离出的,得质子守恒关系为:(也可通过电荷守恒与定组成守恒推导)。
三、解题思路1、正确的思路:2、三个思维基点:电离、水解和守恒(电荷守恒、物料守恒及质子守恒)。
灵活运用多种解题方法,如:淘汰法、定理问题定性比(先判断碱酸性)、整体思维法等。
溶液中离子浓度大小的比较方法与技巧

溶液中离子浓度大小的比较1.溶液中离子浓度大小比较的规律1多元弱酸溶液,根据多步电离分析;如H3PO4的溶液中,cH+>cH2PO4->cHPO42->cPO43-;多元弱酸的正盐溶液根据弱酸根的分步水解分析:如Na2CO3溶液中,cNa+>cCO32->cOH->cHCO3-;2不同溶液中同一离子浓度的比较,则要注意分析溶液中其他离子对其的影响;如在①NH4Cl②CH3COONH4③NH4HSO4溶液中,cNH4+浓度的大小为③>①>②;3如果题目中指明溶质只有一种物质该溶质经常是可水解的盐,要首先考虑原有阳离子和阴离子的个数,水解程度如何,水解后溶液显酸性还是显碱性;4如果题目中指明是两种物质,则要考虑两种物质能否发生化学反应,有无剩余,剩余物质是强电解质还是弱电解质;若恰好反应,则按照“溶质是一种物质”进行处理;若是混合溶液,应注意分析其电离、水解的相对强弱,进行综合分析;5若题中全部使用的是“>”或“<”,应主要考虑电解质的强弱、水解的难易、各粒子个数的原有情况和变化情况增多了还是减少了;6对于HA和NaA的混合溶液多元弱酸的酸式盐:NaHA,在比较盐或酸的水解、电离对溶液酸、碱性的影响时,由于溶液中的Na+保持不变,若水解大于电离,则有c HA>c Na+>c A-,显碱性;若电离大于水解,则有c A->c Na+>c HA,显酸性;若电离、水解完全相同或不水解、不电离,则c HA=c Na+=c A-,但无论是水解部分还是电离部分,都只能占c HA或c A-的百分之几到百分之零点几,因此,由它们的酸或盐电离和水解所产生的cH+或cOH-都很小;例1把·L-1的偏铝酸钠溶液和·L-1的盐酸溶液等体积混合,混合溶液中离子浓度由大到小的顺序正确的是A.c Cl->c Al3+>c Na+>c H+>c OH-B.c Cl->c Al3+>c Na+>c OH->c H+C.c Cl->c Na+>c Al3+>c H+>c OH-D.c Na+>c Cl->c Al3+>c OH->c H+解析偏铝酸钠与盐酸混合后,发生反应:NaAlO2+HCl+H2O===NaCl+AlOH3,显然,盐酸过量,过量的盐酸与AlOH3进一步反应:AlOH3+3HCl===AlCl3+3H2O,故反应后,溶液为AlCl3与NaCl的混合溶液,Cl -浓度最大,反应前后不变,故仍然最大,有部分Al存在于没有溶解的AlOH3沉淀中,若Al全部进入溶液中与Na+浓度相同,故cNa+>cAl3+,由于AlCl3水解溶液呈酸性,故cH+>cOH-,故正确答案为C;答案C;例2某二元弱酸简写为H2A溶液,按下式发生一级和二级电离:H2A H++HA-HA-H++A2-已知相同浓度时的H2A的电离比HA-电离容易,设有下列四种溶液:A.·L-1的H2A溶液B.·L-1的NaHA溶液C.·L-1的HCl与·L-1NaHA溶液等体积混合液D.·L-1的NaOH与·L-1的NaHA溶液等体积混合液;据此,填写下列空白填代号:1c H+最大的是_______,最小的是______;2c H2A最大的是______,最小的是______;3c A2-最大的是_______,最小的是______;1A D 2A D 3D A例3把·L-1CH3COOH溶液和·L-1NaOH溶液以等体积混合,若cH+>cOH—,则混合液中粒子浓度关系正确的是A.c CH3COO->c Na+B.c CH3COOH>c CH3COO-C.2c H+=c CH3COO--c CH3COOHD.c CH3COOH+c CH3COO-=·L-1解析AD2.离子浓度大小比较的守恒规律1电荷守恒:在任何溶液中,阴离子所带电荷总数总是等于阳离子所带电荷总数,即溶液呈电中性;如在Na2CO3、NaHCO3溶液中,均存在Na+、、H+、OH-、HCO3-、CO32-离子,它们的浓度不同,但都存在c Na++c H+=c OH-+c HCO3-+2c CO32-的关系;2物料守恒:又可称原子守恒,在电解质溶液中,尽管有些离子能发生水解,但这些离子或离子中所含的原子所含某些原子的总数是始终不变的,是符合原子守恒的;如在K2S溶液中,虽然S2-发生了水解,生成了HS-、H2S,但S原子总数不变,只是S2-以不同形式存在而已,与K+存在如下的守恒关系:c K+=2c S2-+2c HS-+2c H2S;3水的电离守恒质子守恒:根据水的电离:H2O H++OH-,由水电离出的c H+、c OH-始终是相等的,溶液中的H+、OH-离子虽被其他离子结合,以不同形式存在,但其总量仍是相等的;如在K2S溶液中,水电离出的OH-即存在如下关系:c OH-=c H++HS-+2c H2S;3.应用守恒规律的思维方法若粒子间用等号连接,应根据守恒原理,视不同情况,从以下几个方面思考:1若等号一端全部是阴离子或阳离子时,应首先考虑溶液中阴、阳离子的电荷守恒;2若等号一端各项中都含同种元素时,首先应考虑这种元素的原子守恒,即物料守恒;3若等号一端为c H+或c OH-时,应首先考虑是否符合水的电离守恒;4若等号两端既有分子又有离子,则考虑将电荷守恒与物料守恒相加或相减;或利用质子来源进行分析;例4将·L-1的醋酸钠溶液20ml与·L-1盐酸10ml混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是A.cCH3COO->cCl->cH+>cCH3COOH B.cCH3COO->cCl->cCH3COOH>cH+C.cCH3COO-=cCl->cH+>cCH3COOHD.cNa++CH+=cCH3COO-+cCl-+cOH-答案BD;例5·L-1的HCN溶液与·L-1NaCN溶液等体积混合,已知该混合溶液中c Na+>c CN-;用“>”、“<”或“=”符号填写下列空格:1液中c H+c OH-2c HCN c CN-3c HCN+c CN-·L-1;解析HCN在溶液中存在下列电离平衡:HCN H++CN-,NaCN完全电离产生的CN-存在水解平衡:CN-+H2O HCN+OH-,假设均不发生电离和水解,则应存在c Na+=c CN-=cHCN,混合后溶液中c Na+>c CN-,故说明其水解消耗的CN-大于电离产生的CN-,故有c OH->c H+c HCN>c CN-,根据溶液中的“CN”原子守恒,可知混合后,两浓度之和应等于·L-1;答案1<2>3=例61取·L-1的HX溶液与·L-1NaOH溶液等体积混合,测得混合溶液中c Na+>c X-;①混合溶液中c HX c X-②混合溶液中c HX+c X-·L-1忽略体积变化;③混合溶液中由水电离出的c OH-·L-1HX溶液中由水电离出的c H+;2如果取·L-1HX溶液与·L-1NaOH溶液等体积混合,测得混合溶液中pH>7,则说明HX的电离程度______NaX的水解程度;答案1①<②=③>2。
第三课时 离子浓度大小比较

⑶、两种物质反应,其中一种有剩余
将0.4 mol/LNH4Cl溶液和0.2 mol/LNaOH溶液等体积 混合后,溶液中下列关系正确的是( D ) A . c(NH4+)=c(Na+)=c(OH-)>c(NH3· H2O) B. c(NH4+)=c(Na+)>c(NH3· H2O) >c(OH-)>c(H+) C. c(NH4+)>c(Na+)>c(OH-)>c(NH3· H2O)
电 解 质 溶 液
单 一 溶 液
酸或碱溶液——考虑电离
盐溶液——考虑水解 不反应——同时考虑电离和水解
混 合 溶 液
恰好 反应
生成酸或碱——考虑电离 生成盐——考虑水解
反 应
过量—根据过量程度考虑电离或水解
[巩固练习] 1.常温下,将甲酸和氢氧化钠溶液混合,所得 溶液 pH=7,则下列关系正确的是( ) C + A. c(HCOO )>c(Na ) B. B. c(HCOO-)<c(Na+) C. c(HCOO-)=c(Na+) D. 无法确定c(HCOO-)与C(Na+)的关系 2、在0.1 mol/LNaHSO3溶液中存在着微粒浓度的 关系式,正确的是 CD A.c(Na+)>c(HSO3-)> c(SO32-)> c(H+)>c(OH-) B.c(Na+)+c(H+)= c(HSO3-)+ c(SO32-)+c(OH-) C.c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+ c(OH-) D.c(Na+)= c(HSO3-)+c(SO32-)+ c(H2SO3)
离子浓度大小比较

溶液中离子浓度大小比较一、单一溶液1、弱酸溶液中离子浓度大小判断例1:在0.1mol/L的H2S溶液中存在以下二个电离平衡:H2S HS-+H+、HS-S2-+ H+,由于多元弱酸的电离以第一步为主,第二步比第一步弱的多,所以有:C H+>C HS->C HS- >C OH-弱酸、弱碱溶液中离子浓度大小的一般规律为:C(显性离子H+)> C(一级电离离子H+)> C(二级电离离子H+)> C(水电离出的另一离子OH-)2、能水解的盐溶液中离子浓度大小判断例2:在0.1mol/L的NH4Cl溶液中,有NH4Cl==NH4+ + Cl–-、NH4+ + H2O NH4+ +OH –而使NH4+浓度降低且溶液显酸性,则C Cl->C NH4+ 、C H+>C OH- 又因水解程度较小,故C NH4+ >C H+,有C Cl->C NH4+>C H+>C OH-。
再如:在0.1mol/L的CH3COONa溶液中,有C Na+>C CH3COO->C OH- >C H+所以在一元弱酸(碱)盐中,离子浓度大小的一般规律为:C(不水解离子)> C(水解离子)> C(显性离子)> C(水电离出的另一离子OH-)例3:在Na2CO3溶液中, Na2CO3 ==2 Na+ + CO32- 、CO32- +H2O HCO3–+OH–、HCO3- +H2OH2CO3+OH–,CO32-水解使溶液呈现碱性,则C OH->C H+,由于CO32-少部分水解,则C CO32->C HCO3-,HCO3–又发生第二步水解,则C OH->C HCO3-,第二步水解较第一步弱得多,则C HCO3- 与C OH-相差不大,但C H+比C OH-小得多,因此C HCO3->C H+。
则有:C Na+> C CO32- >C OH->C HCO3->C H+ 所以二元弱酸盐溶液中离子浓度的一般关系是:C(不水解离子)> C(水解离子)> C(显性离子OH-)> C(二级水解离子)> C(水电离出的另一离子H+)。
不同类型离子浓度大小的比较

五、两种电解质溶液混合反应型
3、有一种物质剩余型——酸与碱混合
例12、将pH=3旳HCl与pH=11旳氨水等体积混 合后,在所得旳溶液中,下列关系式正确旳是
(D )
A、c(Cl-)>c(NH4+)>c(OH-)>c(H+) B、c(NH4+)>c(Cl-)>c(OH-)= c(H+) C、c(NH4+)>c(Cl-)>c(H+)>c(OH-) D、c(NH4+)>c(Cl-)>c(OH-)>c(H+)
四、溶质单一性
3、盐溶液—— 正盐溶液
例3(双选)、在CH3COONa溶液中,下列关
系式中不正确旳是(AB)
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) B.c(Na+)>c(H+)>c(CH3COO-)>c(OH-) C.c(Na+)=c(CH3COO-)+c(CH3COOH) D.c(OH-)=c(H+)+c(CH3COOH)
物料守恒:
c (Na+ ) = 2 [c (CO32–) + c (HCO3–) + c (H2CO3) ]
推得质子守恒:
c ( OH– ) = c ( H+ ) + c ( HCO3– ) + 2c (H2CO3)
二、电解质溶液中旳守恒关系
措施二:图示法(只合用于单一溶质旳溶液,不合 用于混合溶液,提议同学们掌握措施一) 如:Na2CO3溶液中, 能够用图示分析如下: (结合旳H+ 旳量与失去旳H+旳量一定是相等旳)
二、电解质溶液中旳守恒关系
又如:Na2CO3 溶液
Na2CO3 = 2Na+ +CO32–
离子浓度大小的比较

5. (08 广东卷)盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是(
)C
2 A.在 NaHCO3 溶液中加入与其等物质的量的 NaOH,溶液中的阴离子只有 CO 3 和
OHB.NaHCO3 溶液中:c(H+)+c(H2CO3)=c(OH-) C.10 mL0.10 mol·L-1CH3COOH 溶液加入等物质的量的 NaOH 后,溶液中离子的 浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D.中和体积与 pH 都相同的 HCl 溶液和 CH3COOH 溶液所消耗的 NaOH 物质的量相 同
例5:0.1mol/L的KHCO3溶液的pH值为8,同浓度的 NaAlO2的pH值为11,将两种溶液等体积混合,可能发 产生白色沉淀 生的现象是 ;产生此现象 的原因是 HCO3-+AlO2-+H2O=Al(OH)3+CO32- 。
例6:将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸 10mL混合后,溶液显酸性,则溶液中有关微粒的浓 度大小关系为 cNa+> cAc-> cCl-> cHAc> cH+> cOH- 。
比较盐溶液中离子浓度间的大小关系
(1)一种盐溶液中各种离子浓度的相对大小
①当盐中阴、阳离子等价时 [不水解离子]>[水解的离子]>[水解后呈某性的离子(如H+ 或OH-)]>[显性对应离子如OH-或H+] 实例:a . CH3COONa b . NH4Cl a.[Na+]>[CH3COO-]>[OH-]>[H+] b.[Cl-]>[NH4+]>[H+]>[OH-] ②当盐中阴、阳离子不等价时. 要考虑是否水解,水解分几步.如多元弱酸根的水解,则是“几 价分几步,为主第一步”. 实例 Na2S水解分二步 各种离子浓度大小顺序为: [Na+]>[S2-]>[OH-]>[HS-]>[H+]
离子浓度大小的比较方法及规律

离子浓度大小比较的方法和规律之杨若古兰创作一、离子浓度大小比较的方法和规律1、紧捉住两个“微弱”:a弱电解质的电离是微弱的b 弱根离子的水解是微弱的.2、酸式酸根离子既能电离又能水解,若电离能力大于水解能力则酸式盐溶液呈酸性,否则呈碱性.罕见呈酸性的是H2PO42-、、HSO3-对应的可溶盐的溶液.3、分歧溶液中同一离子浓度大小的比较,要看溶液中其它离子对其发生的影响.如在不异物资的量浓度的以下溶液中:①NH4Cl②NH4HSO4③CH3COONH4④NH3•H2O.c (NH4+)由大到小的顺序为②>①>③>④4、混合溶液中离子浓度大小的比较,首先要分析混合过程中是否发生化学反应,若发生反应,则要进行过量判断(留意混合后溶液体积的变更);然后再结合电离、水解等身分进行分析.5、对于等体积、等物资的量浓度的NaX和弱酸HX混合求各微粒的浓度关系题,要由混合后溶液的PH大小判断电离和水解的关系.罕见的CH3COOH与CH3COONa等体积、等物资的量浓度混合、NH3•H2O与NH4Cl等体积、等物资的量浓度的混合都是电离大于水解.6、三个次要的守恒关系①电荷守恒电解质溶液中,不管存在多少种离子,溶液总呈电中性,即阳离子所带的正电荷总数必定等于阴离子所带的负电荷总数.如Na2CO3溶液:c(Na+)+ c(H+)=cC( HCO3-) +2c( CO32-)+c( OH-) ②物料守恒如Na2CO3溶液,虽CO32-水解生成HCO3-,HCO3-进一步水解成H2CO3,但溶液中n(Na): n(C)=2:1 ,所以有如下关系:c (Na+)=2{c( HCO3-)+c( CO32-)+c( H2CO3)}③质子守恒即水电离出的OH-的量始终等于水电离出的H+的量.如Na2CO3溶液,水电离出的H+一部分与CO32-结合成HCO3-,一部分与CO32-结合成H2CO3,一部分剩余在溶液中,根据c(H+)水=c(OH-)水,有如下关系:c (OH-)=c( HCO3-)+ 2c(H2CO3)+ c(H+)二、技巧1、在解题过程中,若看到选项中有“=”,则要考虑3个守恒关系:2、若守恒关系中只要离子,则考虑电荷守恒关系,若守恒关系中同时出现分子和离子,则考虑物料守恒和质子守恒;3、若选项中离子浓度关系以“>”连接,则次要考虑弱电解质的电离、弱根离子的水解和各离子之间的彼此影响等.7、高频考点离子浓度大小的比较考点近几年以考查两种溶液混合后离子浓度的大小比较为多,能涉及①酸碱中和反应,如甲酸与氢氧化钠溶液混合、盐酸与氨水溶液混合等②弱酸盐与强酸混合、弱碱盐与强碱混合,如醋酸钠与盐酸混合、铵盐与氢氧化钡混合等.这类题目的做法是先找出反应后的新溶质(常常某一反应物过量而构成多种溶质),再根据溶液体积的变更计算混合后各新溶质的物资的量浓度,最初对浓度的大小作出比较.8、雾点击穿1、忽视溶液中水的电离.如硫酸铵溶液中c(H+)>c(NH3•H2O)2、3•H2O等体积混合充分反应后,溶质为NH3•H2O和的NH4Cl的混合溶液,发生化学反应生成了新的溶质.3、3•H23•H24Cl的混合溶液,离子浓度大小顺序为:c (NH4+)>c(Cl-)>c(OH-)>c(H+)4、忽视二价离子在电荷守恒关系中的系数“2”.如(NH4)2SO4中离子浓度关系为c(NH4+)+ c(H+)=c(SO42-)+ c (OH-)(06四川高考),硫酸根离子浓度前应当有“2”.5、忽视二元酸第一步电离生成的H+会对第二步的电离发生按捺感化.如已知二元酸H2A在水中的第一步电离是完整的,第二步电离不完整,0.1 mol/L NaHA溶液的PH=2,则0.1 mol/LH2A溶液中氢离子的物资的量浓度 < 0.11 mol/L。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液中粒子浓度的大小比较
.
麓山国际化学组
陈玉飞
考Hale Waihona Puke 解读:1.了解溶液中电荷守恒、物料守恒 2.了解酸碱中和滴定过程中溶液中粒子浓度大小变化
考情分析:从高考命题的变化趋势来看,溶液中粒子浓度
的大小比较是主流试题。此类题目仍是今后高考命题的热点。这 类题目考查的内容既与盐的水解有关,又与弱电解质的电离平衡 有关,还与酸碱中和滴定相结合。题目不仅偏重考查粒子浓度大 小关系,而且还侧重溶液中各种“守恒”(电荷守恒、物料守恒、 质子守恒)关系的考查,该题型综合性强、难度较大,能够很好 考查学生的分析推理能力,复习备考中应特别关注。
各个击破
【2015江苏化学】室温下,向下列溶液中通入相应的气体至溶 液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微 粒的物质的量浓度关系正确的是( D ) A.向0.10mol· L-1NH4HCO3溶液中通入CO2: c(NH4+)=c(HCO3-)+c(CO32-) B.向0.10mol· L-1NaHSO3溶液中通入NH3: c(Na+)>c(NH4+)>c(SO32-) C.0.10mol· L-1Na2SO3溶液通入SO2: c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] D.0.10mol· L-1CH3COONa溶液中通入HCl: c(Na+)>c(CH3COOH)=c(Cl-)
趁热打铁
强化训练
【2015安徽理综化学】 25℃时,在10mL浓度均为0.1mol/LNaOH和NH3· H2O混合溶液 中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的 是( B ) A.未加盐酸时:c(OH-)>c(Na+)= c(NH3· H2O) B.加入10mL盐酸时:c(NH4+) +c(H+) = c(OH-) C.加入盐酸至溶液pH=7时:c(Cl-) = c(Na+) D.加入20mL盐酸时:c(Cl-) =c(NH4+) +c(Na+)
各个击破
不同溶液中同一离子浓度的比较 浓度均为0.1 mol· L-1的①H2S、 ②NaHS、 ③Na2S、④H2S和NaHS混合液, ③>②>④>① (1)溶液pH从大到小的顺序是___________ ④ > ① >② >③ (2)c(H2S)从大到小的顺序是___________
(2015•福建)节选 (2)25℃,在0.10 mol/L H2S溶液中,通入HCl气体或加入 NaOH固体以调节溶液pH,溶液pH与c(S2﹣)关系如图 (忽略溶液体积的变化、H2S的挥发) ①pH=13时,溶液中的 c(H2S)+c(HS﹣) = 0.043 mol/L
