五元素反向扩散关系PPT图表
PPT元素

点击添加文本 点击添加文本
点击添加标题
点击添加文本 点击添加文本
点击添加文本 点击添加文本
交通障碍警示具象场景PPT图表
点击添加文本 点击添加文本 点击添加文本 点击添加文本 点击添加文本 点击添加文本
点击添加文本 点击添加文本 点击添加文本 点击添加文本
text2
2018/5/28
Target Market
Consumer Promise
AD Goal
Support
Personality
2018/5/28
由表现为立体形态的平行四边形构成的图表
2018/5/28
将一个项目分为3个要素横向排列的图表
Value for object
C:\WINDOWS\Fonts路径下并重启PowerPoint软件。
3、为实现最方便修改,锐普推荐您使用最新的PowerPoint版本如:PowerPoint2007或 2010。 4、PPT制作的专业化要求越来越高,锐普推荐学习一些专业PPT教程如《PPT演义》、 《 PPT动画传奇》 。
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本 点击添加文本 点击添加文本
点击添加文本 点击添加文本
圆球一分为二错位对比关系PPT图表
点击添加文本
text1
点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加标题 点击添加标题 点击添加标题
点击添加文本 点击添加文本
点击添加标题
化学必修一元素转换关系图

高中化学必修一元素转换关系图1、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O 2、铝及其化合物的转化关系NaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂⒃ ⒄ ④ Al Al 2O 3 A l (O H )3 KAl(SO 4)2 AlCl 3① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾⑿①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2△2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2O 3、铁及其化合物的转化关系①Fe 3O 4+4CO△3Fe +4CO 2 ※② 3Fe +4H 2O(g)高温Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑ ④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2O※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3Fe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 FeCl 3 Fe(OH)3 Fe O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾⑿ ⒁ ⒀①Si +O 2△SiO 2②SiO 2+2C 高温 Si +2CO ↑※③SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)④Si +4HF = SiF 4↑+2H 2↑ ⑤SiO 2+CaO高温CaSiO 3※⑥SiO 2+2NaOH = Na 2SiO 3+H 2O SiO 2+CaCO 3高温CaSiO 3+CO 2↑SiO 2+2OH -= SiO 32-+H 2O ※⑦Na 2SiO 3+2HCl = H 2SiO 3↓+2NaCl SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑ SiO 32-+2H += H 2SiO 3↓※⑦Na 2SiO 3+H 2O +CO 2=H 2SiO 3↓+Na 2CO 3或Na 2SiO 3+2H 2O +2CO 2=H 2SiO 3↓+2NaHCO 3SiO 32-+H 2O +CO 2=H 2SiO 3↓+CO 32-或SiO 32-+2H 2O +2CO 2=H 2SiO 3↓+2HCO 3-⑧H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O ⑨H 2SiO 3 △H 2O +SiO 2H 2SiO 3+2OH -= SiO 32-+2H 2O 5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △ Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClONa 2SiO 3 SiF 4 Si SiO 2 H 2SiO 3 CaSiO 3 ①②③ ④ ⑤⑥ ⑦ ⑧⑨ CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 点燃或光照 光照光照①S +O 2 点燃SO 2②2H 2S +SO 2=3S +2H 2O※③SO 2+O 2 催化剂加热 2SO 3 ④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2△2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓) △CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △Cu 2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O7、氮及其化合物的转化关系 ※①N 2+O 22NO※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△CO 2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
人教版高中化学必修一 《元素性质的周期性变化规律》元素周期律PPT课件

第十七页,共五十八页。
Si
P
S
Cl
判 最高价氧
断 依
化物对应 的水化物
酸性:H__C_l_O_4_>_H_2_S_O_4_>_H__3_P_O_4_>_H_2_SiO3
据 的酸性
结论
__S_i_、___P_、__S_、__C_l_的__非__金__属__性__逐__渐__增__强
第十八页,共五十八页。
_色__ __Mg_+_2_H_2_O __==_△=_==__ ___M_g(_O_H_)_2↓__+_H_2↑__
钠、镁均能与水反应,钠比镁活泼,金属性:Na>Mg。
第十页,共五十八页。
2.两性氢氧化物 (1)概念:既能与强酸反应又能与强碱反应,且均生成盐 和水的氢氧化物。 (2)氢氧化铝的两性 ①向AlCl3溶液中加入过量氨水,现象:_____产__生_白__色__沉_,淀 反应方程式:__A_l_C_l_3_+_3_N_H_3_·__H_2_O__=_=_=_=__3_N_H_4_C_l_+_A_l_(_O_H_)_3。↓
结合图1、图2、图3完成下表:
原子 电子 最外层 序数 层数 电子数
1~2 1
3~ 10
_2_
1~2
_1_~__8_
原子半径的 变化(稀有气 体元素除外)
—
由_大__到_小__
最高或最 低化合价
的变化
+1→0
-_4___+_→1__→-_1__+_→5___0
第六页,共五十八页。
原子 序数
11~ 18
第十六页,共五十八页。
4.Si、P、S、Cl的非金属性的递变规律
(完整word版)高中化学元素关系图
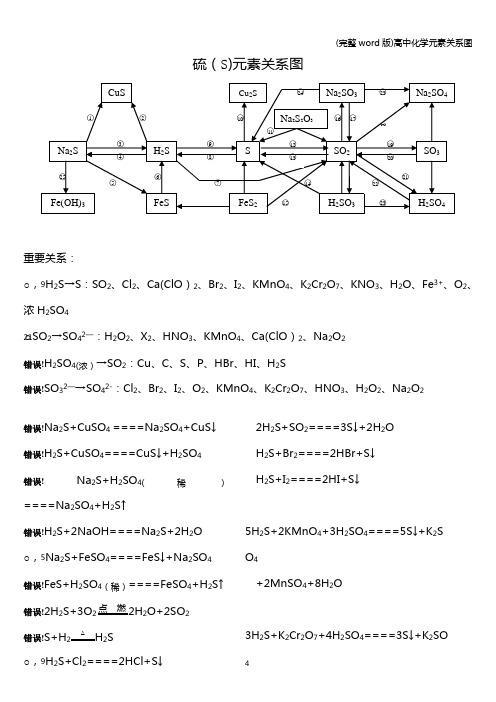
(完整word版)高中化学元素关系图硫(S)元素关系图重要关系:○,9H2S→S:SO2、Cl2、Ca(ClO)2、Br2、I2、KMnO4、K2Cr2O7、KNO3、H2O、Fe3+、O2、浓H2SO4○21SO2→SO42—:H2O2、X2、HNO3、KMnO4、Ca(ClO)2、Na2O2错误!H2SO4(浓)→SO2:Cu、C、S、P、HBr、HI、H2S错误!SO32—→SO42-:Cl2、Br2、I2、O2、KMnO4、K2Cr2O7、HNO3、H2O2、Na2O2错误!Na2S+CuSO4====Na2SO4+CuS↓错误!H2S+CuSO4====CuS↓+H2SO4错误!Na2S+H2SO4(稀)====Na2SO4+H2S↑错误!H2S+2NaOH====Na2S+2H2O○,5Na2S+FeSO4====FeS↓+Na2SO4错误!FeS+H2SO4(稀)====FeSO4+H2S↑错误!2H2S+3O2点燃2H2O+2SO2错误!S+H2△ H2S○,9H2S+Cl2====2HCl+S↓2H2S+SO2====3S↓+2H2OH2S+Br2====2HBr+S↓H2S+I2====2HI+S↓5H2S+2KMnO4+3H2SO4====5S↓+K2S O4+2MnSO4+8H2O3H2S+K2Cr2O7+4H2SO4====3S↓+K2SO 4(完整word版)高中化学元素关系图+Cr2(SO4)3+7H2O3H2S+2HNO3(稀)====3S↓+2NO↑+2H2OH2S+H2O2====S↓+2H2OH2S+2FeCl3====S↓+2FeCl2+2HCl2H2S+O2====2S↓+2H2OH2S+H2SO4(浓)====SO2↑+S↓+2H2O2H2S+Ca(ClO)2====2S↓+CaCl2+2HCl○10S+2Cu△Cu2S错误!Na2S2O3+2HCl====2NaCl+S↓+SO2↑+H2O错误!S+O 点燃SO2错误!3SO2+2Na2S====3S↓+2Na2SO3错误!H2SO3+2H2S====3H2O+3S↓错误!4FeS2+11O高温2Fe2O3+8SO2○,16SO2+2NaOH====Na2SO3+H2O H2O+2Na2CO3+SO2(少量)====Na2SO3+2NaHCO3Na2CO3+SO2(适量)====Ma2SO3+CO2错误!Na2SO3(s)+H2SO4(浓)====Na2SO4+SO2↑+H2O 错误!SO2+Na2O2====Na2SO4SO2+2NaClO+H2O====Na2SO4+2HCl错误!2SO2+O2催化剂450℃2SO3○,205SO3+2P△P2O5+5SO2错误!SO2+H2O2====H2SO4SO2+X2+2H2O====H2SO4+2HX(X=Cl、Br、I)2SO2+O2+2H2O====2H2SO43SO2+2HNO3(稀)+2H2O====2NO+3H2SO45SO2+2KMnO4+2H2O====K2SO4+2M nSO4+2H2SO4错误!2H2SO4(浓)+Cu====CuSO4+SO2↑+2H2O2P+5H2SO4(浓)△2H3PO4+5SO2↑+2H2OC+2H2SO4(浓)△CO2↑+2SO2↑+2H2OS+2H2SO4(浓)△3SO2↑+2H2O2HBr+H2SO4(浓)====Br2+SO2+2H2O 2HI+H2SO4(浓)====I2+SO2+2H2O错误!SO32—+Cl2+H2O====SO42—+2Cl-+2H+2H2SO3+O2====2H2SO42Na2SO3+O2====2Na2SO4错误!Na2SO3+2Na2S+3H2SO4====3S↓+3Na 2SO4+3H2O错误!3Na2S+2FeCl3+H2O====6NaCl+3H2S↑+2Fe(OH)3↓氯(Cl)元素关系图重要关系:错误!HCl→Cl2:MnO2、KMnO4、K2Cr2O7、KClO3、Ca(ClO)2 Cl2→Cl-:H2S、SO2、SO42—、Br-、I-、Fe2+○1Cl2+2FeCl2====2FeCl32Fe+3Cl点燃2FeCl3(冒棕褐色烟)错误!Cl2+Cu点燃CuCl2(冒棕黄色烟)○,3Cl2+2I-====I2+2Cl-错误!Cl2+2Br-====Br2+2Cl—错误!Cl2+SO2+2H2O====2HCl+H2SO4错误!3Cl2+6KOH△KClO3+5KCl+H2O ○,7Cl2+2NaOH====NaCl+NaClO+H2O ○8NaClO+HCl(浓)====Cl2↑+NaOHNaClO+NaCl+H2SO4====Na2SO4+Cl2↑+H2O○9Cl2+H2O====HCl+HClO○102NaCl+2H2O电解Cl2↑+H2↑+2NaOH 2NaCl+MnO2+3H2SO4△2NaHSO4+MnSO4+Cl2↑+2H2O错误!2Na+Cl点燃2NaCl (冒白烟)H2O+Cl2+Na2CO3(足量)====NaCl+NaClO+2NaHCO3Na2CO3+H2O+2Cl2(足量)====2NaCl+2HClO+CO2↑错误!4HCl(浓)+MnO2△MnCl2+2H2O+Cl2↑2KMnO4+16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2OKCr2O7+14HCl(浓)====2KCl+2CrCl3 +3Cl2↑+2H2OKClO3+6HCl(浓)====KCl+3Cl2↑+3H2OCa(ClO)2+4HCl(浓)====CaCl2+2Cl2↑+2H2O ○13Cl2+H2点燃2HClH2S+Cl2====2HCl+SH2+Cl光照2HClNa2SO3+Cl2+H2O====Na2SO4+2HCl 2FeCl2+Cl2====2FeCl3○14HCl+NH3====NH4Cl (冒白烟)错误!NH4Cl△NH3↑+HCl↑错误!HCl+AgNO3====HNO3+AgCl↓错误!HCl+NaOH====NaCl+H2OHCl+NaHCO3====NaCl+CO2↑+H2O 错误!2HClO光照2HCl↑+O2↑错误!Ca(ClO)2+2HCl====CaCl2+2HClO Ca(ClO)2+CO2+H2O====CaCO3+2HClO○,20NaOH+HClO====NaClO+H2O HClO+Na2CO3====NaClO+2NaHCO3○,212Cl2+2Ca (OH)2====CaCl2+Ca(ClO)2+2H2O5Cl2+I2+6H2O====2HIO3+10HCl错误!3Cl2+8NH3====N2+6NH4Cl氧(O)元素关系图错误!2O 3====3O 2 O 3+2KI+H 2O====2KOH+I 2+O 2错误!3O 放 电2O 3错误!O 3+H 2S====H 2O+O 2+S ↓ 错误!2H 2O 通 电2H 2↑+O 2↑2H 2O+2F 2====4HF+O 2错误!O 2+2H 点 燃2H 2OO 2+2Cu+2H 2SO 4====2CuSO 4+2H 2O O 2+2H 2S====2S ↓+2H 2O错误!2H 2O 2 2 2H 2O+O 2↑5H 2O 2+2KMnO 4+3H 2SO 4====K 2SO 4+2MnSO 4+5O 2↑+8H 2O错误!2H 2O 2MnO 22H 2O+O 2↑H 2O 2+H 2S====S ↓+2H 2OH 2O 2+2KI+H 2SO 4====K 2SO 4+I 2+2H 2O H 2O 2+Na 2SO 3====Na 2SO 4+H 2O H 2O 2+2FeSO 4+H 2SO 4====Fe 2(SO 4)3+2H 2O错误!2H 2O+Na 2O 2====2NaOH+H 2O 2BaO 2+H 2SO 4(稀)低 温H 2O 2+BaSO 4↓错误!O 2+2Na 点 燃Na 2O 2错误!2Na 2O 2+2CO 2====2Na 2CO 3+O 2↑2Na 2O 2+2H 2O====4NaOH+O 2↑错误!Na 2O 2+H 2SO 4(稀)====Na 2SO 4+H 2O 2 Na 2O 2+2H 2O 低 温2NaOH+H 2O 2错误!H 2O 2+SO 2====H 2SO 4 错误!Na 2O 2+SO 2====Na 2SO 4氮(N)元素关系图重要关系:○,4H 2O →O 2:F 2、电解错误!H 2O 2→O 2:KMnO 4、MnO 2 错误!H 2O 2→H 2O :I —、S 2—、SO 42-、Fe 2+重要关系:错误!HNO3(稀)→NO:HBr、HI、H2S、SO2、SO32—、Fe2+、Fe、Cu、Ag○,26HNO3(浓)→NO2:HBr、HI、H2S、SO2、SO32—、Fe2+、S、C、P、Cu、Ag错误!Mg3N2+8HCl====3MgCl2+2NH4Cl错误!2NH4Cl+Ca(OH)2△2NH3↑+CaCl2+2H2ONH4Cl△NH3↑+HCl↑2NH4Cl+CaO△CaCl2+2NH3↑+H2O错误!NH3+HCl====NH4Cl错误!NH3·H2O+HCl====NH4Cl+H2O3NH3·H2O+FeCl3====Fe(OH)3↓+3NH4Cl错误!NH4Cl+H2O====NH3·H2O+H2ONH4Cl+NaOH====NH3·H2O+NaCl错误!NH3+H2O====NH3·H2O错误!NH3·H2O △NH3↑+H2O错误!N2+3H高温高压催化剂2NH3错误!4NH3+3O2(纯)点燃2N2+6H2O2NH3+3CuO△N2+3Cu+3H2O错误!Mg3N2+6H2O====2NH3↑+3Mg(OH)2错误!3Mg+N点燃Mg3N2错误!NaNO2+NH4Cl△N2↑+NaCl+2H2O错误!N2+O放电NO错误!6NO+4NH3△5N2+6H2O错误!6NO2+8NH3△7N2+12H2O错误!NO+NO2+2NaOH====2NaNO2+H2O 错误!2NaNO2+2NaI+2H2SO4====2NO↑+I2 +2H2O+2Na2SO42NaNO2+2HCl====2NaCl+NO↑+NO2(完整word版)高中化学元素关系图↑+H2O错误!2NO+O2====2NO2错误!3NO2+H2O====2HNO3+NONO2+2KI+H2O====I2+NO+2KOH错误!8HNO3(稀)+3Cu====3Cu(NO3)2+2NO↑+4H2O Fe+2HNO3(稀)====Fe(NO3)3+NO↑+4H2O2HNO3(稀)+3H2S====3S↓+2NO↑+4H2O3Na2SO3+2HNO3(稀)====3NaSO4+2NO↑+4H2O2H2O+3SO2+2HNO3(稀)====3H2SO4+2NO6KI+8HNO3(稀)====6KNO3+3I2+2NO↑+4H2O3FeCl2+4HNO3====2FeCl3+NO↑+Fe( NO3)2+2H2O错误!2HNO2====H2O+NO↑+NO2↑错误!5NaNO2+2KMnO4+3H2SO4====5NaN O3+K2SO4+2MnSO4+3H2O错误!2NaNO3△2NaNO2+O2↑错误!2NO2+2NaOH====NaNO3+NaNO2+ H2O○,253NO2+H2O====2HNO3+NO错误!4HNO3(浓)+Cu====Cu(NO3)2+2NO2+2H2OC+4HNO3(浓)△CO2↑+4NO2↑+2H2OS+6HNO3(浓)△H2SO4+6NO2↑+2H2OP+5HNO3(浓)△H3PO4+5NO2↑+H2O4HNO见光或受热2H2O+4NO2↑+O2↑错误!2Cu(NO3)2△2CuO+4NO2↑+O2↑○,28HNO3+NaOH====NaNO3+H2O 错误!NaNO3+H2SO4(浓)微热NaHSO4+HNO3↑错误!2HNO3+Cu(OH)2====Cu(NO3)2+2H2O○312HNO3(浓)+Ag====AgNO3+NO2↑+H2O3Ag+4HNO3(稀)====3AgNO3+NO↑+2H2O○,322AgNO3+Cu====Cu(NO3)2+2Ag磷(P)元素关系图错误!4P+5O2点燃2P2O5○22P+3Cl点燃2PCl3○,3PCl3+Cl2====PCl5错误!PCl3+3H2O====H3PO3+3HCl错误!2P+3Ca △Ca3P2错误!2P+3H2△2PH3错误!Ca3P2+6H2O====3Ca(OH)2+3PH3↑错误!PCl5+4H2O====H3PO4+5HCl错误!P2O5+3H2O====2H3PO4错误!Ca(H2PO4)2+H2SO4====2H3PO4+CaSO4错误!2H3PO4+Ca(OH)2====Ca(H2PO4)2+2H2O 错误!Ca(H2PO4)2+Ca(OH)2====2CaHPO4+2H2O错误!2CaHPO4+H3PO4====Ca(H2PO4)2错误!2CaHPO4+Ca(OH)2====Ca3(PO4)2+2H 2O错误!Ca3(PO4)2+H3PO4====3CaHPO4错误!Ca3(PO4)2+3H2SO4====3CaSO4+2H3PO4错误!2H3PO4+3Ca(OH)2====Ca3(PO4)2+3H2O碳(C)元素、硅(Si)元素关系图错误!错误!C+2H2高温CH4○,2CH高温C+2H2错误!CH4+2O点燃CO2+2H2O 错误!2C+O点燃2COC+CO高温2CO2C+SiO高温Si+2CO↑3C+CaO3000℃CaC2+CO↑C+H2O高温H2↑+CO↑C+ZnO高温Zn+CO↑错误!C+O 点燃CO2C+2CuO△2Cu+CO2↑○6CO2+2Mg点燃2MgO+C ○,72C+SiO高温Si+2CO↑错误!2CO+O2点燃2CO2CO+CuO△Cu+CO2CO+H2O催化剂、△CO2+H2 2CO+Fe2O高温2Fe+3CO2错误!CO2+C高温2CO ○,10CO2+Ca(OH)2====CaCO3↓+H2O 错误!CaCO3煅烧CaO+CO2↑CaCO3+2HCl====CaCl2+CO2↑+H2O 错误!CO2+2NaOH====Na2CO3+H2O错误!Na2CO3+2H+====2Na++CO2↑错误!Na2CO3+Ca (OH)2====CaCO3↓+2NaOH错误!CaCO3+CO2+H2O====Ca(HCO3)2错误!Ca(HCO32△CaCO3↓+CO2↑+H2O Ca(HCO3)2+Ca(OH)2====2CaCO3↓+2H2 O错误!Ca(HCO3)2+2NaOH====CaCO3↓+Na2CO3+2H2O错误!Na2CO3+H2O+CO2====2NaHCO3 Na2CO3+HCl====NaHCO3+NaCl错误!2NaHCO3△Na2CO3+H2O+CO2↑○20Na 2CO 3+SiO 高 温Na 2SiO 3+CO 2↑错误!Si+2NaOH+H 2O====Na 2SiO 3+2H 2↑错误!Si+O 2 △ SiO 2错误!SiO 2+2C 高 温Si+2CO ↑ 错误!Si+2F 2====SiF 4Si+4HF====SiF 4+2H 2↑错误!SiO 2+2NaOH====Na 2SiO 3+H 2O 错误!H 2SiO 3 △ H 2O+SiO 2○,27Na 2SiO 3+6HF====2NaF+SiF 4+3H 2O○28Na 2SiO 3+2HCl+H 2O====2NaCl+H 4Si O 4↓错误!H 4SiO 4====H 2SiO 3+H 2O 错误!SiO 2+4HF====SiF 4↑+2H 2O钠(Na)元素关系图错误!2Na+S△ Na 2S错误!2Na+O点 燃Na 2O 2错误!2Na+2H 2O====2NaOH+H 2↑ 错误!4Na+O 2====2Na 2O 错误!2Na+H 高 温2NaH 错误!2NaCl(熔融)电 解2Na+Cl 2↑ 错误!2Na+Cl 点 燃2NaCl○,8 +H 2O+H 2↑错误!NaH+H 2O====NaOH+H 2↑(完整word 版)高中化学元素关系图错误!Na 2O+H 2O====2NaOH○,112Na 2O+O 2 △ 2Na 2O 2○,122Na 2O 2+2H 2O====4NaOH+O 2↑错误!2Na 2O 2+2CO 2====2Na 2CO 3+O 2↑ 错误!2NaOH+CO 2====Na 2CO 3+H 2O 错误!Na 2CO 3+Ca(OH)2====2NaOH+CaCO 3↓错误!Na 2CO 3+2HCl====2NaCl+H 2O+CO 2↑○17NaOH+CO 2====NaHCO 3错误!2NaCl+2H 2O电 解2NaOH+H 2↑+Cl 2↑○19NaOH+HCl====NaCl+H 2O错误!NaCl+NH 3+CO 2=H 2O====NH 4Cl+Na HCO 3错误!NaHCO 3+HCl====NaCl+H 2O+CO 2↑错误!NaHCO 3+NaOH====Na 2CO 3+H 2O错误!Na 2CO 3+CO 2+H 2O====2NaHCO 3铝(Al)元素关系图错误!2Al 2O 3(熔融)电解、冰晶石4Al+3O 2↑○,24Al+3O 2====2Al 2O 3重要关系:错误!Al 3+→Al (OH)3:OH -、NH 3·H 2O 、CO 32-、HCO 3—、S 2-、HS —、ClO —、AlO 2-○11 AlO 2— →Al(OH )3:H +、CO 2、Al 3+、Fe 3+、HCO 3—、NH 4+、HSO 3—、H 2PO 4—、Cl 2、NO 2(完整word版)高中化学元素关系图2Al+Fe2O3高温2Fe+2Al2O34Al+3MnO高温3Mn+2Al2O32Al+WO3高温W+Al2O3错误!2Al+6H+====2Al3++3H2↑2Al+3Hg2+====2Al3++3Hg错误!Al2O3+6H+====2Al3++3H2O错误!Al(OH)3+3H+====Al3++3H2O错误!Al3++3OH-====Al(OH)3↓Al3++3NH3·H2O====Al(OH)3↓+3NH4+2Al3++3CO32—+3H2O====2Al(OH)3↓+3CO2↑Al3++3HCO3—====Al(OH)3↓+3CO2↑2Al3++3S2—+6H2O====2Al(OH)3↓+3H2S↑Al3++3HS-3H2O====Al(OH)3↓+3H2S↑Al3++3ClO-+3H2O====Al(OH)3↓+3HCl OAl3++3AlO2—+6H2O====4Al(OH)3↓○7AlO2-+4H+====Al3++2H2O错误!Al3++4OH-====AlO2—+2H2O错误!2Al+2OH—+2H2O====2AlO2-+3H2↑错误!Al(OH)3+OH-====AlO2—+2H2O 错误!AlO2-+H++H2O====Al(OH)3↓2AlO2-+CO2(少量)+3H2O====2Al(OH)3↓+CO32-AlO2-+CO2(足量)+2H2O====Al(OH)3↓+HCO3-3AlO2-+Fe3++6H2O====3Al(OH)3↓+Fe (OH)3↓AlO2-+HCO3-+H2O====Al(OH)3↓+CO3 2—AlO2-+NH4++2H2O====Al(OH)3↓+NH3·H2OAlO2—+HSO3—+H2O====Al(OH)3↓+SO32—2AlO2-+Cl2+3H2O====2Al(OH)3↓+Cl-+ ClO—2AlO2-\+3NO2+3H2O====2Al (OH)3↓+NO+2NO3-AlO2—H2PO4-+H2O====Al(OH)(完整word版)高中化学元素关系图3↓+HPO42-错误!2Al(OH)3△Al2O3+3H2O错误!Al2O3+2OH-====2AlO2—+H2O 铁(Fe)元素关系图重要关系:错误!Fe→Fe2+:Fe3+、Cu2+、H+、I2○,3Fe2+→Fe3+:Cl2、Br2、O2、H2O2、HNO3、MnO4—错误!Fe3+→Fe2+:Zn、Fe、Cu、I—、H2S、SO2错误!Fe→Fe3+:Cl2、Br2、HNO3、H2SO4(浓)△错误!Fe3+→Fe(OH)3:OH—、S2—、HS-、CO32—、HCO3-、AlO2—、ClO-(完整word版)高中化学元素关系图错误!Fe2++Zn====Fe+Zn2+错误!Fe+Cu2+====Cu+Fe2+Fe+2Fe3+====3Fe2+Fe+2H+====Fe2++H2Fe+I2====Fe2++2I—○32Fe2++Cl2====2Fe3++2Cl—2Fe2++Br2====2Fe3++2Br—4Fe2++O2+4H+====4Fe3++2H2O2Fe2++H2O2+2H+====2Fe3++2H2O5Fe2++MnO4-+8H+====5Fe3++Mn2++ 4H2O3Fe2++NO3-+4H+====3Fe3++NO↑+2H 2O错误!2Fe3++Zn====2Fe2++Zn2+2Fe3++Cu====2Fe2++Cu2+2Fe3++2I-====2Fe2++I22Fe3++H2S====2Fe2++S↓+2H+2Fe3++SO2+2H2O====SO42-+2Fe2++4 H+错误!2Fe3++3Zn====2Fe+3Zn2+○6Fe+NO3—+4H+====Fe3++NO↑+2H2OFe+6H2SO4(浓)△Fe2(SO4)3+3SO2↑+6H2O错误!FeO+2H+====Fe2++H2O○,8Fe(OH)2+2H+====Fe2++2H2O错误!Fe2++2OH-====Fe(OH)2↓错误!Fe3O4+8H+====Fe2++2Fe3++4H2O Fe3O4+8HI====3FeI2+I2+4H2O错误!4Fe(OH)2+O2+2H2O====4Fe(OH)3○123Fe3O4+28HNO3====9Fe (NO3)3+NO↑+14H2O错误!Fe3++3NH3·H2O====Fe(OH)3↓+3NH4+○,14Fe(OH)3+3H+====Fe3++3H2O错误!Fe2O3+6H+====2Fe3++3H2O○,16Fe3++3SCN-====Fe(SCN)3错误!Fe(OH)2隔绝空气、△FeO+H2O○182Fe(OH)3△FeO+H2O错误!Fe2O3+3CO高温2Fe+3CO23Fe3O4+8Al高温9Fe+4Al2O32FeO+Si高温2Fe+SiO2○,206FeO+O2△2Fe3O4○213Fe+2O2点燃Fe3O43Fe+4H2O(g)高温Fe3O4+4H2○,222Fe(过量)+O2高温2FeO (炼钢炉中的反应)错误!Fe+S△FeS错误!FeS2△FeS+S错误!4FeS2+11O高温2Fe2O3+8SO2错误!2Fe2++5ClO-+5H2O====2Fe(OH)3↓+4HClO+Cl-6Fe2++3ClO-+3H2O====2Fe(OH)3↓+4Fe3++3Cl-4Fe2++4Na2O2+6H2O====4Fe(OH)3↓+8Na++O26Fe2++3Na2O2+6H2O====4Fe(OH)3↓+2Fe3++6Na+铜(Cu)元素关系图重要关系:错误!CuO→Cu:H2、CO、NH3、C、CH3CH2OH错误!Cu→Cu2+:O2、HNO3、H2SO4(浓)、H2O2、Fe3+错误!Cu(OH)2→C u2O:CH3CHO、HCHO、H—COOH错误!Cu2(OH)2CO3+4H+====2Cu2++CO2↑+3H2O错误!2Cu+S △Cu2S错误!2Cu+O2+CO2+H2O====Cu2(OH)2CO3错误!CuO+H2△Cu+H2O3CuO+2NH3△N2+3Cu+3H2OCuO+CO△Cu+CO2CuO+CH3CH2OH−→−∆Cu+CH3CHO+H2 O错误!2Cu+O2△2CuO4Cu+2NO2△4CuO+N2错误!Cu2++Zn====Zn2++Cu○,72Cu+O2+2H2SO4(稀)△2CuSO4+2H2O3Cu+8HNO3(稀)====3Cu (NO3)2+2NO↑+4H2OCu+2H2SO4△CuSO4+SO2↑+2H2O Cu+H2O2+H2SO4(稀)====CuSO4+2H2O2FeCl3+Cu====CuCl2+2FeCl2○8Cu2(OH)2CO3△2CuO+H2O+CO2↑错误!4CuO 高温2Cu2O+O2↑错误!Cu(OH)2△CuO+H2O错误!CuO+2H+====Cu2++H2O 错误!Cu2+H2S====CuS↓+2H+错误!3CuS+8HNO3(稀)====3Cu(NO3)2+3S↓+2NO↑+4H2O错误!Cu(OH)2+2H+====Cu2++2H2O错误!Cu2++2OH—====Cu(OH)2↓错误!2Cu (OH)2+R—CHO+NaOH−→−∆R—COO Na+Cu2O↓+3H2O2Cu(OH)2+H-COOH+2NaOH−→−∆Na2CO3 +Cu2O↓+4H2O4Cu(OH)2+H—CHO+2NaOH−→−∆Na2CO3+2Cu2O↓+6H2O错误!Cu(OH)2+4NH3====[Cu(NH3)4](OH)2错误!Cu2O+2H+====Cu+Cu2++H2O高中化学17≡≡种常见气体的实验室制法Cl2:4HCl+MnO2△Cl2+MnCl2+2H2O HCl:2NaCl+H2SO4△Na2SO4+2HClHBr:NaBr+H3PO4△NaH2PO4+HBr HI:KI+H3PO4△KH2PO4+HIO2:2KMnO4△K2MnO4+MnO2+O2 SO2:Na2SO3+H2SO4====Na2SO4+H2O +SO2H2S:FeS+H2SO4====FeSO4+H2SNH3:2NH4Cl+Ca(OH)2△2NH3+CaCl2+2H2ON2:NH4NO2△N2+2H2ONO:3Cu+8HNO3====3Cu(NO3)2+2NO+4H2ONO2:Cu+4HNO3====Cu(NO3)2+2NO2+2H2OCO2:CaCO3+2HCl====CaCl2+CO2+H2O CO:HCOOH△、浓硫酸CO+H2OCH4:CH2COONa+NaOH△、碱石灰Na2CO3+CH4CH2=CH2:C2H5OH浓硫酸、170℃CH2=CH2+H2O CH≡CH:CaC2+2H2O−→−Ca(OH)2+CH≡CHH2:Zn+H2SO4====ZnSO4+H2。
化学必修一元素转换关系图

高中化学必修一元素转换关系图1、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O 2、铝及其化合物的转化关系NaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂⒃ ⒄ ④ Al Al 2O 3 A l (O H )3 KAl(SO 4)2 AlCl 3① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾⑿①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2△2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2O 3、铁及其化合物的转化关系①Fe 3O 4+4CO△3Fe +4CO 2 ※② 3Fe +4H 2O(g)高温Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑ ④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2O※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3Fe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 FeCl 3 Fe(OH)3 Fe O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾⑿ ⒁ ⒀①Si +O 2△SiO 2②SiO 2+2C 高温 Si +2CO ↑※③SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)④Si +4HF = SiF 4↑+2H 2↑ ⑤SiO 2+CaO高温CaSiO 3※⑥SiO 2+2NaOH = Na 2SiO 3+H 2O SiO 2+CaCO 3高温CaSiO 3+CO 2↑SiO 2+2OH -= SiO 32-+H 2O ※⑦Na 2SiO 3+2HCl = H 2SiO 3↓+2NaCl SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑ SiO 32-+2H += H 2SiO 3↓※⑦Na 2SiO 3+H 2O +CO 2=H 2SiO 3↓+Na 2CO 3或Na 2SiO 3+2H 2O +2CO 2=H 2SiO 3↓+2NaHCO 3SiO 32-+H 2O +CO 2=H 2SiO 3↓+CO 32-或SiO 32-+2H 2O +2CO 2=H 2SiO 3↓+2HCO 3-⑧H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O ⑨H 2SiO 3 △H 2O +SiO 2H 2SiO 3+2OH -= SiO 32-+2H 2O 5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △ Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClONa 2SiO 3 SiF 4 Si SiO 2 H 2SiO 3 CaSiO 3 ①②③ ④ ⑤⑥ ⑦ ⑧⑨ CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 点燃或光照 光照光照①S +O 2 点燃SO 2②2H 2S +SO 2=3S +2H 2O※③SO 2+O 2 催化剂加热 2SO 3 ④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2△2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓) △CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △Cu 2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O7、氮及其化合物的转化关系 ※①N 2+O 22NO※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△CO 2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
精美20页逻辑关系设计ppt图表

靶型分割并列关系PPT图表
点击添加文本 点击添加文本
点击添加文本 点击添加文本 点击添加文本 点击添加文本
圆球一分为二错位对比关系PPT图表
点击添加文本
点击添加文本 点击添加文本
text1
text2
点击添加文本
点击添加文本 点击添加文本
精美20页逻辑关系设计ppt图表
A 点击添加标题
点击添加文本 点击添加文本 点击添加文本
点击添加文本 点击添加文本 点击添加文本
二元素循环关系PPT图表
A
点击添加标题
点击添加文本 点击添加文本
B
B 点击添加标题
点击添加文本 点击添加文本 点击添加文本
点击添加文本 点击添加文本 点击添加文本
二元素反向对比关系PPT图表
点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
四元素打包并列关系PPT图表
点击添加标题
点击添加标题
点击添加标题
点击添加标题
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
25 20 15 10 5 0
箭头型时间轴PPT图表
2008
2009
2010
2011
2012
点击添加文本 点击添加文本 点击添加文本 点击添加文本
2013
点击添加文本
点击添加文本 点击添加文本 点击添加文本 点击添加文本
二元素反向移动对比关系PPT图表
元素关系图word

Ag+
AgCl 白
NH3 [Ag(NH3)2] HNO3
-
Br元素
Cl2(g)
Br饱和ClO3-
金属
Δ
MBrn
SO2 +H2O I2(s)
BrO3-
SO42+ Br-
Ag+
AgI↓黄
CN-
[Ag(C N)2]-
I-
Δ、NaBr H3PO4
Br2(l
MnO2 100 c Mn2+ o HBrO4
3+ Cr2O72- Cr
Ni(OH)3 Ni2+ ClO+ OH- H 冷
MnO2 Mn2+
Δ 金属
Cl2过量 P过量
KClO4
MCln PCl5(s) PCl3(l) HCl ↑ H2O 盐酸 MnO2
Δ
335oc
P
KClO3(s)
Cl2(g)
黄绿色气体
H2点燃 NaCO3 H2O HClO3(40%) CaCO3 H2O C2H6 KCl
-
BrO3OHH+
+ BrBrO
+
335℃KClO3 + Br
-
KCl(加热)
ClO3-
Ba(ClO3)2 + H2SO4(浓) 褪色 品红 ClO3OH- H+冷 Mn2+
HClO3(40%) MnO2 Ni(OH)3 I2(或IO3-) Cl2 Ni2+ IHCl
紫色(气体) 紫色 棕或棕红色 棕红色 蓝色
-
BF3 NH3 NH3
MgF2+Cl2+O2 MgO 200~300oC
元素周期律演示PPT人教版

元素周期律演示PPT人教版(优秀课件 )
元素周期律演示PPT人教版(优秀课件 )
2.元素非金属性强弱判断依据:
(1)跟氢气生成气态氢化物的难易程度及氢化物的稳定性。 越易与氢气化合,生成的氢化物也就越稳定,其非金属性
磷蒸气
气态氢化物 SiH4
PH3
的稳定性 很不稳定 不稳定
S
Cl
加热
光照或点燃 爆炸化合
H2S HCl 不很稳定 稳定
最高价氧化 物对应水化
H4SiO4 极弱酸
物的酸性
H3PO4 中强酸
H2SO4 强酸
非金属性 Si < P < S < Cl
元素周期律演示PPT人教版(优秀课件 )
HClO4 最强酸
也就越强 (2)非金属单质间的置换反应(Cl2>I2) (3)最高价氧化物的水化物的酸性强弱。
元素非金属性越强,酸性越强。
元素周期律演示PPT人教版(优秀课件 )
元素周期律演示PPT人教版(优秀课件 )
11-17号元素的性质比较:
1、钠、镁跟水反应 2Na + 2H2O = 2NaOH + H2 Mg + 2H2O = Mg(OH)2 + H2 结论:金属性 Na>Mg
答案:(1)Li;Be;Al;Cl (2)Li,因为氢氧化物显碱性 的元素必为金属元素,锂和铍比较,锂的原子半径大,最外层 电子数少,故氢氧化锂的碱性比氢氧化铍强。又铝的氢氧化物 是两性氢氧化物,故碱性最强的是氢氧化锂。
元素周期律演示PPT人教版(优秀课件 )
元素周期律演示PPT人教版(优秀课件 )
方便使用,等级提升的PPT图标素材

手绘四选项柱状图PPT图表
点击添加文本
点击添加文本 点击添加文本 点击添加文本
25 20 15 10 5 0
四元素打包并列关系PPT图表ຫໍສະໝຸດ 点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本 点击添加文本 点击添加文本
五元素反向扩散关系PPT图表
添 加 标 题
添加标题
三元素交错层叠递进关系PPT图表
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加文本 点击添加文本
点击添加标题 点击添加标题 点击添加标题
点击添加文本 点击添加文本
点击添加标题
三角形叠加扩散关系PPT图表
点击添加标题
点击添加文本 点击添加文本
点击添加标题
点击添加文本 点击添加文本
点击添加标题
点击添加文本 点击添加文本
二元素反向移动对比关系PPT图表
点击添加文本
点击添加文本 点击添加文本 点击添加文本 点击添加文本
点击添加文本
点击添加文本 点击添加文本 点击添加文本 点击添加文本
突破型递进关系PPT图表
添 加 标 题
点击添加文本
点击添加文本 点击添加文本 点击添加文本 点击添加文本
元素化合物的转化关系网络图

元素化合物的转化关系一、常见金属元素(Na 、Al 、Fe 、Cu )单质及其重要化合物。
1、钠及其重要化合物间的转化关系.写出图中标号反应的化学方程式或离子方程式。
①2Na + O 2Na 2O 2(淡黄色)②2Na 2O 2 + 2H 2O = 4NaOH + O 2↑2Na + 2H 2O = 2Na ++ 2OH —+ H 2↑③2Na 2O 2 + 2H 2O = 4NaOH + O 2↑ 2Na 2O 2 + 2H 2O = 4Na ++ 4OH —+ O 2↑ ④2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2⑤2NaCl +2 H 2O2NaOH + H 2↑+ Cl 2↑(氯碱工业)2Cl — +2 H 2O2OH - + H 2↑+ Cl 2↑⑥Na 2CO 3 + H 2O +CO 2= 2NaHCO 3CO 32-+ H 2O +CO 2= 2HCO 3—⑦ 2NaClO + H 2O +CO 2= Na 2CO 3+ HClO 2、铝及其重要化合物间的转化关系。
写出图中标号反应的化学方程式或离子方程式.①4Al + 3O 22Al 2O 32Al + Fe 2O 32Fe + Al 2O 3②2Al + 2NaOH + 2H 2O = 2NaAlO 2 + 3H 2↑2Al +2OH - +2H 2O = 2AlO 2- +3H 2↑③2Al 2O 34Al+3O 2↑ ④Al 2O 3+6HCl = 2AlCl 3+3H 2OAl 2O 3+ 6H + = 2Al 3+ + 3H 2O⑤Al 2O 3 + 2NaOH = 2NaAlO 2 +H 2O Al 2O 3 + 2OH —= 2AlO 2—+ H 2O通电 通电 通电 点燃高温⑥AlCl 3 +3NH 3·H 2O = Al (OH )3↓+ 3NH 4Cl Al 3+ + 3 NH 3·H 2O = Al(OH )3↓+ 3NH 4+ AlCl 3 +3Na OH = Al (OH)3↓+ 3NaCl Al 3+ + 3OH — = Al(OH )3↓⑦Al (OH)3 + NaOH =NaAlO 2 +2 H 2O Al (OH)3 + OH -= AlO 2— +2H 2O ⑧Al 3+ +3 AlO 2— +6H 2O =4Al(OH)3↓ 3、铁及其重要化合物间的转化关系。
扩散关系ppt图表
Text
Text
Text
Text
Text
Text
8 Part Concept
Text Text
Text
Topic 非凡图库: Here
Text
Text
Text
Text
非凡图库:
Text
8 Part Concept
Text Text Text Text
8 Part Concept
Your Text Here Your Text Here
Your Text Here
Your Text Here
28 Point Text
Your Text Here
Your Text Here Your Text Here
Your Text Here
8 Part Concept
Your Text Here
Your Text Here
7 Part Concept
Your Text Here
Your Text Here
Your Text Here
Your Text Here
Your Text Here
Your Text Here
Your Text Here
28 Point Text
Your Text Here
Your Text Here
28 Point Text
Your Text Here Your Text Here
Your Text Here
5 Part Concept
Your Text Here Your Text Here Your Text Here
28 Point Text
Your Text
高中化学苏教版选修三元素性质的递变规律课件25页25张

2 元素性质的递变规律 课件(25张PPT) (共25张PPT)(获奖课件推荐下载)
1.同种元素逐级电离能逐渐升高: 8左右的元素,既有金属性又有非金属性;
精编优质课PPT高中化学苏教版选修三 2.
I1﹤I2﹤I3……﹤In,且在某些电
离能数据间突跃变大。 2 元素性质的递变规律 课件(25张PPT) (共25张PPT)(获奖课件推荐下载)
2 元素性质的递变规律 课件(25张PPT) (共125张PPT)(2获奖课件推荐下载)
精精编编优 优质质课课PPPPTT高高中中化化学学苏苏失教教版版去选选修修第三三 22二.. 电子容易得多,所以Na容易失去一个电子形成+1价离子;
精精编编优 优质质课课PPPPTT高高中中化化学学苏苏M教教版版g选选修修的三三I221.. 和I2相差不多,而I2比I3小很多,所以Mg容易失去两个电 2精元编素优性质质课的PP递T变高规中律化学课苏件子教(版2形5选张修P成P三T)2十. (共225价张PP离T)(获子奖课;件推A荐l下的载)I1、I2、I3相差不多,而I3比I4小很多,所 以A1容易失去三个电子形成+3价离子。 下列哪个系列的排列顺序刚好是电负性减小的顺序( )
全满
C B< Be<C 2S2 Be
O 2S22P4
Ne O< N<F<Ne
精编优质课PPT高中化学苏教版选修三 2.2 元素性质的递变规律 课件(25张PPT) (共25张PPT)(获奖课件推荐下载)
Li
B
2S22P1
精编优质课PPT高中化学苏教版选修三 2.2 元素性质的递变规律 课件(25张PPT) (共25张PPT)(获奖课件推荐下载)
核外电子数 下列哪个系列的排列顺序刚好是电负性减小的顺序( )
元素化合物的转化关系网络图

元素化合物的转化关系之五兆芳芳创作一、罕有金属元素(Na 、Al 、Fe 、Cu )单质及其重要化合物.1、钠及其重要化合物间的转化关系.写出图中标号反响的化学方程式或离子方程式.①2Na + O 2Na 2O 2(淡黄色)②2Na 2O 2 + 2H 2O = 4NaOH + O 2↑2Na + 2H 2O = 2Na ++ 2OH - + H 2↑③2Na 2O 2 + 2H 2O = 4NaOH + O 2↑ 2Na 2O 2 + 2H 2O = 4Na ++ 4OH -+ O 2↑④2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2⑤2NaCl +2 H 2O2NaOH + H 2↑+ Cl 2↑(氯碱产业) 2Cl - +2 H 2O2OH - + H 2↑+ Cl 2↑⑥Na 2CO 3 + H 2O +CO 2= 2NaHCO 3CO 32-+ H 2O +CO 2= 2HCO 3- ⑦ 2NaClO + H 2O +CO 2= Na 2CO 3+ HClO2、铝及其重要化合物间的转化关系.写出图中标号反响的化学方程式或离子方程式. ①4Al + 3O 22Al 2O 32Al + Fe 2O 32Fe + Al 2O 3②2Al + 2NaOH + 2H 2O = 2NaAlO 2 + 3H 2↑2Al +2OH - +2H 2O = 2AlO 2- +3H 2↑③2Al 2O 34Al+3O 2↑ 通电 通电通电点燃高温④Al 2O 3+6HCl = 2AlCl 3+3H 2OAl 2O 3+ 6H + = 2Al 3+ + 3H 2O ⑤Al 2O 3 + 2NaOH = 2NaAlO 2 +H 2O Al 2O 3 + 2OH -= 2AlO 2-+ H 2O ⑥AlCl 3 +3NH 3·H 2O = Al(OH)3↓+ 3NH 4Cl Al 3+ + 3 NH 3·H 2O = Al(OH)3↓+ 3NH 4+AlCl 3 +3Na OH = Al(OH)3↓+ 3NaCl Al 3+ + 3OH - = Al(OH)3↓ ⑦Al(OH)3 + NaOH =NaAlO 2 +2 H 2O Al(OH)3 + OH -= AlO 2- +2H 2O⑧Al 3+ +3 AlO 2- +6H 2O =4Al(OH)3↓3、铁及其重要化合物间的转化关系.写出图中标号反响的化学方程式或离子方程式. ①3 Fe+4H 2O Fe 3O 4 + 4H 2↑3 Fe+2O 2 Fe 3O 4②Fe + 2HCl = FeCl 2 + H 2↑Fe + 2H + = Fe 2+ + H 2↑③2FeCl 3 + Fe = 3FeCl 22Fe 3+ + Fe = 3Fe 2+2FeCl 3 + Cu = 2FeCl 2+ CuCl 22Fe 3+ + Cu = 2Fe 2++Cu 2+④2FeCl 2 + Cl 2 = 2FeCl 32Fe 2+ + Cl 2 = 2Fe 3+ + 2Cl-或O 2高温点燃△⑤4Fe(OH)2 + O2 + 2H 2O = 4Fe(OH)3⑥ 2Fe(OH)3Fe 2O3 + 3H 2O ⑦Fe 2O 3 + 3CO 2Fe + 3CO 2⑧FeCl 3 +3NH 3·H 2O =Fe (OH)3↓+ 3NH 4ClFe 3+ + 3 NH 3·H 2O = Fe (OH)3↓+ 3NH 4+4、铜及其重要化合物间的转化关系.写出图中标号反响的化学方程式或离子方程式.①2Cu + S Cu 2S②Cu+4HNO 3 (浓)= Cu(NO 3)2+ 2H 2O + 2NO 2↑Cu+4H ++2NO 3-= Cu 2++ 2H 2O + 2NO 2↑3Cu+8HNO 3 (稀)= 3Cu(NO 3)2+ 4H 2O + 2NO ↑ 3Cu+8H ++2NO 3-= Cu 2++ 2H 2O + 4NO ↑③Fe + Cu(NO 3)2 = Fe(NO 3)2+ Cu Fe + Cu 2+= Fe 2+ + Cu ④CuCl 2 Cu + Cl 2↑二、罕有非金属元素(H 、C 、N 、O 、Si 、S 、Cl )单质及其重要化合物.1、氯及其重要化合物间的转化关系.写出图中标号反响的化学方程式或离子方程式. ①Cu + Cl 2 CuCl 2②2Fe + 3Cl 2 3FeCl 3③2NaOH+ Cl 2= NaClO + NaCl + H 2O 2OH -+ Cl 2= ClO - + Cl - + H 2O通电△点燃点燃④MnO 2+4HCl(浓)MnCl 2+Cl 2↑+ 2H 2OMnO 2+4H ++2Cl -Mn 2++Cl 2↑+2H 2O⑤2NaCl 2Na+ Cl 2↑⑥Cl 2 + H 2O HCl + HClOCl 2 + H 2O H ++ Cl - + HClO ⑦Ca(ClO)2 + CO 2 + H 2O =CaCO 3 + 2HClO2、硫及其重要化合物间的转化关系.写出图中标号反响的化学方程式或离子方程式. ①Fe + S FeS ②2SO 2+O 22SO 3③Cu+2H 2SO 4 (浓) CuSO 4 +2H 2O+SO 2↑C+2H 2SO 4(浓) 2H 2O+CO 2↑+2SO 2↑④H 2SO 4+Ba(OH)2= Ba SO 4↓+2H 2O 2H ++SO 42-+Ba 2++2OH -= Ba SO 4↓+2H 2O⑤SO 2 +2NaOH = Na 2SO 3 + H 2O SO 2 +2OH -= SO 32-+H 2O ⑥SO 2 +Cl 2+ 2H 2O = H 2SO 4 + 2HCl SO 2 +Cl 2+ 2H 2O = 4H ++SO 42-+ 2Cl -3、氮及其重要化合物间的转化关系.写出图中标号反响的化学方程式或离子方程式. ①2NH 4Cl+Ca(OH)2△ CaCl 2+2H 2O+2NH 3↑②N 2 + 3H 2 催化剂 高温高压2NH 3③4NH 3 +5O 2 4NO + 6H 2O ④3NO 2 + H 2O = 2HNO 3 + NO 通电 催化剂 加热⑤3Cu+8HNO3(稀)= 3Cu(NO3)2+ 4H2O + 2NO↑3Cu+8H++2NO3-= Cu2++ 2H2O + 4NO↑⑥Cu+4HNO3 (浓)= Cu(NO3)2+ 2H2O + 2NO2↑Cu+4H++2NO3-= Cu2++ 2H2O + 2NO2↑⑦8NH3 +6NO2= 7N2 + 12H2O4、碳硅及其重要化合物间的转化关系.写出图中标号反响的化学方程式或离子方程式.① 2Mg + CO②SiO2↑③SiO2 + 2NaOH = Na2SiO3 + H2O④Na2Si O3+ 2HCl = 2NaCl + H2Si O3↓Na2Si O3+ H2O +CO2= H2Si O3↓+Na2CO3⑤2NaHCO2CO3 + H2O +CO2↑NaHCO3+ NaOH = Na2CO3 + H2O HCO3-+ OH-= CO32-+ H2O⑥Ca(HCO3)2 + 2NaOH=CaCO3↓+Na2CO3+ 2H2O。
