《结构化学第六章》
结构化学课件第六章

显然,同前述结果一致
6.2 配体的群轨道
利用Oh群特征标表可知,
6L 6,0,0,2,2
A1g Eg T1u
令 x,y,z 正向的L是σ 1、σ 2、σ 3 ,负向为σ 4、σ 5、σ 6
A1g
1 6
1
2
3
4
5
6
Eg
1 2
1
4F 4Cl 4Br 4NH3 4F
为193,2F 227pm 为230,2Cl 295pm 为240,2Br 318pm 为207, 2NH3 262pm 为208, 2F 195pm
L'
L
L
Cu
L
L
L'
各种对称性场中 d 能级分裂
配
d d 位 场对称性
x2-y2
z2 dxy
dyz
dxz
注
数
2 直 线 形 - 0.628 3 正 三 角 形 0.545 4 正四面体形 - 0.267 4 平面正方形 1.228 6 正八面体形 0.600 5 三角双锥形 - 0.082 5 四 方 锥 形 0.914 7 五角双锥形 0.282
1.028 - 0.628 0.114 - 0.321 0.546 - 0.386 - 0.267 0.178 0.178 - 0.428 0.228 - 0.514 0.600 - 0.400 - 0.400 0.707 - 0.082 - 0.272 0.086 - 0.086 - 0.457 0.493 0.282 - 0.528
1
3
结构化学第六章..

二、d轨道的能级分裂
配体所形成的负电场对中心d电子起作用,消除d轨道的简并。
分裂的根源:(1)d轨道具有明显的角度分布。
(2)d轨道所在的配位场不是球形对称的。
1、正八面体配位场(Oh):
在正八面体配合物中,金属离子位于八面体中心,六 个配位体分别沿着三个坐标轴正负方向接近中央离子。
z y 3 2 4 5 6 1 x
四碘合汞(ll)酸 六氟合硅(IV)酸钾 二硫酸根合钴(II)酸钾 氯化二氨合银(I) 二水合一氯化二氯四氨合铬 (III) 三氯一氨合铂(II)酸钾 三氯五氨一水合钴(III) 四硫氰根· 二氨合铬(Ⅲ)酸铵
五、配合物和配体的分类
MLn 称单核配合物
中心原子(离子)M: MmLn 称多核配合物
M—M 称原子簇合物
配位数 5--三角双锥或四方锥形
配位数 6--八面体或三棱柱
表6.1
配位化合物 配位数 [Hg(NH3)2]2+ [Au(CN)2] [CuCN3]2Ni(CO)4 [Zn(NH3)4]2 [Ni(CN)4]2[PtCl4]2Os(CO)5
-
若干配位化合物所采取的几何构型
几何构型 直线型 直线型 平面三角形 四面体 四面体 平面正方形 平面正方形 三角双锥 对称性 配位化合物 配位数 几何构型 对称性 Dh Dh D3h Td Td D4h D4h D3h [Ni(CN)5]3[SbF5]2[CoF6]3- [Fe(CN)6]3Cr(CO)6 [ZrF7]3Re(S2C2Ph2)3 [Mo(CN)8]45 5 6 6 6 7 6 8 三角双锥 四方锥 八面体 八面体 八面体 五角双锥 三棱柱 十二面体 D3h C4v Oh Oh Oh D5h D3h D2d
结构化学第六章

第六章配位化合物的结构和性质
一.基本概念:
1.配合物、中心原子、配体、单核配合物、多核配合物
2.电价配合物、共价配合物、高自旋配合物和低自旋配合物
3.分子磁矩与未成对电子数的关系
4.晶体场、分裂能、成对能、光谱化学序、强场、弱场、晶体场稳定化能5.姜太勒效应和络合物畸变
6. M中σ型轨道和π型轨道
7. M-L之间的σ键及能级次序
8.羰基配合物中的σ-π键
9.π络合物中的σ-π键
10.电子规则和9n-l规则
二.基本计算和应用:
1.VBT与CFT理论对配合物的结构与性质的解释
2.d电子的排布、影响分裂能的因素
3.稳定化能的计算及应用
4.姜太勒效应
5.过渡金属络合物的颜色
6.络合物的几何构型
7.用分子轨道理论说明配合物的成键情况
8.σ-π型配键
三.重点内容
1.晶体场理论,d电子的排布、影响分裂能的因素,稳定化能的计算及应用2.配位场理论,八面体场的分裂,配位场稳定化能及对化合物性质的影响3.姜太勒效应
4.σ-π型配键及配位化合物的结构
四.自学引导
1.由静电作用模型引出晶体场理论,通过d电子轨道分裂引出分裂能、稳定化能及对配合物的结构与性质的解释
2.由分子轨道理论引出配位场理论,通过八面体场的分裂引出配位场稳定化能、姜太勒效应及对化合物性质的解释
3.通过σ-π型配键引出对过渡金属的配位化合物的结构、性质的解释。
五.作业
6.3,6.4,6.5,6.7,6.12,6.14,6.15,6.20, 6.23。
《结构化学》第六章 金属的结构和性质

6.2 金属单质的晶体结构
金属单质晶体结构比较简单, 这与金属键密切相关: 由 于金属键没有方向性和饱和性,大多数金属元素按照等径 圆球密堆积的几何方式构成金属单质晶体,主要有立方面 心最密堆积、六方最密堆积和立方体心密堆积三种类型.
6.2.1 等径圆球最密堆积与A1、A3型结构
等径圆球以最密集的方式排成一列(密置列),进 而并置成一层(密置层),再叠成两层(密置双层), 都只有一种方式:
非最密堆积方式中最重要的是立方体心堆积A2 , 还有A4和少数的A6、A7、A10、A11、A12等.
A2 立方体心密堆积
布鲁塞尔的原子球博物馆 9个直径18米的球形展厅构成一个立方体心模型
A4 金刚石型结构
A4中原子以四面体键相连. 晶胞中虽然都是同种原子, 但所处的环境不同(球棍图中用两色颜色来区分). 一个浅蓝 色球与一个深蓝色球共同构成一个结构基元.
A1最密堆积形成立方面心(cF)晶胞
ABCABC……堆积怎么会形成立方面心晶胞? 请来个逆向思维:
取一个立方面心晶胞:
体对角线垂直方向就是密置层, 将它们设成3种色彩:
从逆向思维你已明白, 立方面心晶胞确实满足 ABCABC……堆积。
那么, 再把思路正过来: ABCABC……堆积形成立 方面心晶胞也容易理解吧?
晶胞 六方P
四、 金刚石型晶体(A4型)
C原子的配位数为4, 2套等同点 结构基元:2个C 空间点阵型式:立方F 每个晶胞中有8个C原子, 其坐标分别为:
(0,0,0), (1/2,1/2,0),
(1/2,0,1/2),(0,1/2,1/2),
(1/4,1/4,1/4),(1/4,3/4,3/4),
(为看得清楚,绿 球和蓝球层各有3 个球未画出)
结构化学第6章

9
由此图决定 σ在 X , Y , Z 轴上,
3
x z y y
约化 群
4
z y x z y x
5
x
z
y
z
2
Г= A1 + E + T1 = A 1g + E g + T 1u
1
o M
n
Ln
19
12个配体π轨道组成 2T1 + 2T2 的基
T2g 的三基, dxy, dxz, dyz
y z z
x
y
x
3
配体
x
y
5
y
4
z
y z x
1
x
z yx
x z y
2
x
z
y z y 6
x
C3
12 ( x1+y2+x4 +y5 )
C4 , C 2
(x2+y3+y5+x 6)
20
21
T1u 的三基(Px, Py, Pz )
C O
如: d——p,
d——d,
d——π
18
当形成 d—p 时,共有 6 Px, 6Py , 12个AO
O Г12π
E 12
6C4 0
3C42 -4
8C3 6C2’ 0 0 0
i
xn
yn
约化,
Г(O) = 2T1 + 2T2 Г(Oh) = T1u + T2u + T1g + T2g σπ 非键轨道 π
结构化学_第6章_5-6

Pt
解:水是弱场配体,故 Mn(H2O)63+ 为高自旋配位离子 , Mn3+:3d4,电子排布为t2g3eg1, LFSE=0.6∆o 因此处于 eg 轨道上的电子易失去,失去电子后 LFSE 增大为12 ∆o ,这就是Mn(H2O)63+不稳定的原因。另外 ,它还容易发生Jahn-teller畸变。 Cr(H2O)63+ 中的 d 电子排布为 t2g3 , LFSE 为 12∆o 。反键 轨道上无电子是Cr(H2O)63+较稳定的原因。该配合物离 子不发生Jahn-teller畸变。
Pt
Pt
Jahn-Teller效应
d z2
E (Dq) 6.0
d x2 y 2
eg*
0.0
d1
d xy
d xz
d yz
-4.0
t2g
低自旋态,小畸变
Pt
Pt
Jahn-Teller效应
E (Dq)
6.0
d z2
d x2 y 2
eg*
d2
0.0
d xy
d xz
d yz
-4.0
t2g 高自旋态,小畸变
Pt
Pt
Jahn-Teller效应
d z2
E (Dq) 6.0
d x2 y 2
eg*
d6
0.0
d xy
d xz
d yz
-4.0
t2g
高自旋态,小畸变
Pt
Pt
Jahn-Teller效应
d z2
E (Dq)
d x2 y 2
6.0
eg*
0.0
d7
d xy
d xz
2012结构化学06-第六章

齐鲁师范学院齐鲁师范学院齐鲁师范学院结构 化学第六章 价键理论P141结构 化学§6.1 海特勒-伦敦法解 H2 分子6.1.1 氢分子 H2 的 S-eq结构 化学6.1.2 氢分子 H2 薛定谔方程的解一、变分函数的选取 P141§6.1 海特勒-伦敦法解H2分子 §6.2 价键理论大意 §6.3 价键理论对一些简单分子的应用 §6.4 杂化轨道理论 §6.5 定域分子轨道和离域分子轨道—甲烷极限情况: H2 →Ha ( 1 ) + Hb ( 2 ) ψ1(1,2) =φa(1)φb(2) H2 →Ha ( 2 ) + Hb ( 1 ) ψ2(1,2) =φa(2)φb(1) 其中φa和φb均为氢原子1s轨道波函数1 1B-O近似,原子单位。
1 2 1 1 1 1 1 1 1 ˆ H = − ∇1 − ∇2 − − − − + + 2 2 2 ra1 ra2 rb1 rb2 r12 Rφa=πe−r aφb=πe −r bˆ Hψ ( 1, 2 ) = Eψ (1, 2 )1 2变分函数 Φ = c1 ψ 1 (1, 2 ) + c2 ψ 2 ( 1, 2 )3齐鲁师范学院齐鲁师范学院齐鲁师范学院结构 化学二、变分法处理结果Es = H11 + H 12 1 + S12P142Ea = H 11 − H 12 1 − S12结构 化学三、完整波函数描述 (1)自旋波函数P142结构 化学(2)旋轨轨道按照保里原理的要求,得到四个反对称的旋轨轨道( 6.1.12 )( 6.1.13)两个电子的自旋状 态有四种分布情况α (1)α ( 2 ); β (1) β ( 2 ) ( 对称 ) α (1) β ( 2 ) ; α ( 2 ) β ( 1) ( 非对称 )1 ψs = (ψ 1 + ψ 2 ) 2 + 2S12 =( 6.1.14 )1 [ φ a (1)φ b ( 2) + φ a ( 2 )φ b (1) ] 2 + 2S12排斥态构造有对称性 的自旋波函数α (1) β ( 2 ) + α ( 2 ) β (1) ( 对称 ) α (1) β ( 2 ) − α ( 2 ) β (1) ( 反对称 )ψ a (1, 2 )α (1)α ( 2 ) ψ a (1, 2 ) β (1 ) β ( 2 ) ψ a (1, 2 )[ α ( 1) β ( 2 ) + α ( 2 ) β (1) ] ψ s ( 1, 2 )[ α (1) β ( 2 ) − α ( 2 ) β (1) ]排斥态吸引态结论:当两个H原子互相靠近而其电子的自旋方向相反时,吸引态ψa =1 (ψ 1 −ψ 2 ) 2 − 2S12( 6.1.15)1 = [ φ a (1)φ b ( 2 ) − φ a ( 2 )φ b (1) ] 2 − 2S12数据与实验结果有差距,但能定性地说明问题。
结构化学 第六章..

体影响下的能级发生分裂。
电子在分裂了的轨道上的排布状态,决定了配位场的光谱、 磁性、稳定性、几何构型等性质。CFT 可比较满意地解释
上述性质。但这个理论没有考虑中心离子与配体间的共价
作用成份,不能解释羰基、不饱和烯等配合物的成键本质。
Ea=E0+(E0+o)=2E0+
(b) 强场低自旋 O > P
(III) d 电子的排布
—高、低自旋态
例1:[CoF6]3-, Co3+: d 6, O=13000 cm-1, P=21000 cm-1 P > O 弱场高自旋
eg* t2g
t2g4 eg*2
LFSE = - [ 4×( - 4 Dq) + 2×6 Dq] = 4 Dq
设M位于直角坐标系原点, 6个 L 位于坐标轴上。M共有9个价轨道 可参与分别形成或型分子轨道: 型: s px py
pz dx2-y2 dz2
型:dxy dyz dxz
① 中心原子AO对称性分类 型: s ……………..a1g
px py pz ……t1u
dx2-y2 dz2 ………eg
型:dxy dyz dxz ……t2g
Oh群的不可约表示
② 配位体群轨道 6 个 L :每个至少有 1
பைடு நூலகம்
个 型轨道,共有6 个
轨道 ( 一般是配体孤对 电子轨道 ) 。将这 6 个
轨道重新组合成新的
群轨道,使之与M的原 子轨道对称性匹配。
配位体群轨道及其对称性
a1g
1 ( 1 2 3 4 5 6 ) 6
结构化学第六章2解析
以上金属原子,相互通过金属—金属键结合,形成多面体或缺 顶多面体的核心骨干,周围连接配位体的配位化合物。金属— 金属键不同于金属键:前者是以共价键的方式形成,后者是由 一个金属晶粒中数目很多的原子轨道高度离域叠加形成的金属 键。
6.5.1 18电子规则和金属—金属键的键数
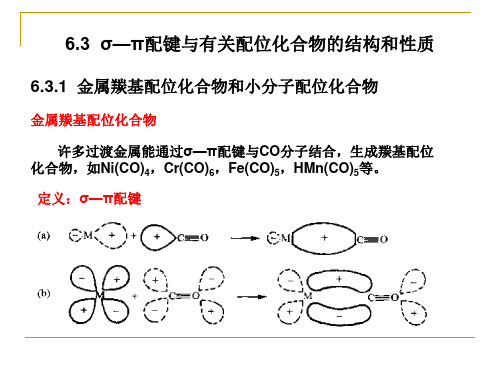
6.3 σ—π配键与有关配位化合物的结构和性质
6.3.1 金属羰基配位化合物和小分子配位化合物
金属羰基配位化合物 许多过渡金属能通过σ—π配键与CO分子结合,生成羰基配位
化合物,如Ni(C。 定义:σ—π配键
在金属羰基配位化合物中,CO以碳原子和金属原子相 连,M—C—O在一直线上。CO分子一方面提供孤对电子给 予中心金属原子的空轨道形成σ配键,如上页图(a)所示 ;另一方面又有空的反键π*轨道可以和金属原子的d轨道形 成π键,这种π键由金属原子单方面提供电子,也称反馈π 键,如上页图(b)所示。这两方面的键合称为σ—π配键。
Mn2(CO)10是典型的双核羰基化合物,其中Mn—Mn直接成键 。每个Mn与5个CO形成八面体构型中的5个配位,第六个配位位置 通过Mn—Mn键相互提供1个电子,使每个Mn原子周围满足18个电 子。为了减少空间阻碍引起的排斥力,羰基基团互相错开。Co(CO)8 的情况和Mn2(CO)10相似。
其他小分子配位化合物
下式计算得到:
b
1 2
18n
g
式中g代表分子中与Mn有关的价电子总数,它包含三部分电子: (i)组成Mn簇合物中n个M原子的价电子数;(ii)配位体提供 给n个M原子的电子数,式中每个配位体提供的电子数列于表6.1 .1中;(iii)若簇合物带有电荷,则包括所带电荷数。
结构化学-第六章

这种作用分为球对称部分和场对称部分,前者对所有的d轨道有 这种作用分为球对称部分和场对称部分,前者对所有的 轨道有 相同的作用,产生能级为E 后者使d轨道发生能级分裂 轨道发生能级分裂, 相同的作用,产生能级为 s;后者使 轨道发生能级分裂,引起 电子排布及其它一系列性质的变化。 电子排布及其它一系列性质的变化。
dz2
2011-1-5
dx2-y2
dxz, dyz, dxy
15
d轨道分裂为 轨道分裂为: 轨道分裂为
t2 (dxy, dxz, dyz ) e (dz2 , dx
2 -y 2)
t2 e
∆t ∆t=晶体场分裂能 =4/9 ∆0
d
四面体场( 四面体场(Td) 自由离子 d轨道 轨道 Ee= -2.67 Dq Et2= 1.78Dq
2011-1-5
∆
eg t2g
2Eeg+3Et2g=0 Eeg - Et2g=10Dq
14
② 四面体场 中心离子位于立方体的中心, 中心离子位于立方体的中心,在立方体的八个角上每隔一个角 上下错开)放一个配体。 (上下错开)放一个配体。 与八面体场相反,dz2,dx2- y2的角度极大值指向立方体的面心; 与八面体场相反, 的角度极大值指向立方体的面心; 的极大值指向立方体四个边线的中心. 而dxy,dxz,dyz的极大值指向立方体四个边线的中心 前者离配体较远,斥力小,轨道能量上升少; 前者离配体较远,斥力小,轨道能量上升少;后者与配体 的斥力大,轨道能量上升多。 的斥力大,轨道能量上升多。
2011-1-5 11
(1) d轨道能级的分裂 轨道能级的分裂 d轨道空间取向不同 , 则在不同对称性的配位体静电场作用下 轨道空间取向不同, 轨道空间取向不同 受到不同的影响,简并的能级发生不同的分裂。 受到不同的影响,简并的能级发生不同的分裂。
结构化学第6章..

△ = 20300 cm-1
改变配体同样的方法测定可得到不同配体的分裂能
-----光谱化学序列
常见的分裂能见下表 某 些 八 面 体 配 合 物 的 △ 值 ( 波 数
) 构型
3d1 3d2 3d3 4d3 3d4 3d5 3d6 4d6 5d6 3d7 3d8 3d9
中央 离子 Ti3+ V3+ Cr3+ Mo3+ Cr2+ Mn2+ Fe 2+ Rh3+ Ir3+ Co2+ Ni2+ Cu2+
二、d轨道的能级分裂
d轨道角度分布图: y
- + + - -
z
+ - -
z
+ -
x
+
y
+
x
dxy
z
+
- + -
dyz
y -
dxz
+ - + x
x
d z2
d
x2 y2
(1)d轨道能级的分裂
配体所形成的负电场对中心d电子起作用,消除d 轨道的简并。这种现象叫d轨道的能级在配位场中 发生了分裂。 分裂的根源:(1)d轨道具有明显的角度分布。(2)d轨 道所在的配位场不是球形对称的。
而由原dxy上的一对电子占据轨道相当于电子由crco的空轨道这样的键叫反馈键反馈键在crco中既有配键又有反馈键这两种键合在一起称为键亦称电子授受键电子授受配键中心金属和配位体之间配键和反馈键的形成是同时进行的而且配键的形成增加了中心原子的负电荷对反馈键的形成更加有利反馈键的形成则可减少中心原子的负电荷对配键的形成更加有利
(2) 对同一的配体, 分裂能随金属原子的不同而异:
结构化学 第六章-1

一频率v处发生共振; 若扫场, 应在同一磁感强度B处发生
共振。但实验发现, 同一种核的共振频率随化学环境而发 生变化。
原因:分子中的核不是裸核,核外电子云在外磁场B中感
应出一个大小与外磁场成正比而方向相反的微弱磁场 B, 作用在核上的有效磁感强度Beff不等于B, 而是
e是玻尔磁子,g是无量纲因子,称为g因子,自由电子
的g因子ge=2.0023。 自旋磁矩在磁场方向的分量:
sz gms e
1 1 ms , 2 2
在磁场中,自旋磁矩与外 磁场作用,不同方向的磁 矩有不同的能量:
S N S N
E B SZ B gmS e B
峰,-CHO质子峰分裂为四重峰。这是由于分子中距离 相近的质子之间核自旋相互作用的结果,称为自旋耦合。
自旋-自旋耦合使核磁共振信号分裂为多重峰 ——自旋
分裂。
=1.7的CH3峰分裂成三重峰, 3个小峰强度之比为1:2:1,峰 间距离为7Hz; =3.4的CH2峰分裂成四重峰,4个小峰强度 比1:3:3:1,峰间距离7Hz。
B
(3)氢键的影响
溶液中溶剂与溶质可以生成氢键,氢键的形成降低了核 外电子云密度,使增大。
羟基氢 信号移 向低场
4. 核的自旋-自旋耦合作用
具有一定化学位移的质子峰并不一定是单峰,往往会分 裂为数个峰,例如乙醛中有- CH3和-CHO两种质子,
只应有两个单峰,但实际上,- CH3 质子峰分裂为二重
当B=1.4092 T时 v=60×106 Hz =60 MHz
扫频式
扫场式。多数仪器采用扫场式。
1H的核磁矩大,核磁能级分裂大,吸收信号强。1H的天然
结构化学前线分子轨道理论

Ni的HOMO:dxz
电负性:Ni 1.8, H 2.15, C 2.6
催化剂镍起了传递电子桥梁作用
➢Ni的dxz与H2的σ*1s对称性匹配,镍的d电子可流向H2 的σ*1s,从而使H2键削弱,使H2拆开变成2H,吸附在 镍上,成为一种过渡状态。 ➢过渡状态的HOMO仍和C2H4的π*2p(LUMO)对称性匹 配,继而又将电子应得以顺利进行。 ➢镍上的电子可由对称性匹配的H2的σ1s流到镍的空d轨 道(如dz2)上而得到补充。
C4H6 ψ2
C2H4+C4H6 → 环已烯
HOMO
LUMO
ψ3
C2H4
HOMO-LUMO对称性匹配,无需光照激发, 加热条件下反应即可发生。
C2H4+C2H4 → 环丁烯 C2H4的HOMO:π2p
C2H4的LUMO:π*2p HOMO-LUMO对称性不匹配,反应不能发生。
C2H4*: (π2p)2(π*2p)0 → (π2p)1(π*2p)1 C2H4*的HOMO:π*2p
C2H4的LUMO:π*2p 在光照条件下,2+2环加成反应C2H4+C2H4 → 环丁烯可顺利发生。
结构化学 —— 第六章 共轭分子的结构
第六章
(2) 前线轨道理论应用实例 乙烯加氢反应及镍的催化作用
HOMO
HOMO
C2H4 + H2 = C2H6
LUMO
LUMO
无论何种方式,HOMO-LUMO对称性不匹配, 反应不能发生。
采用过渡金属作催化剂可使反应顺利进行。
C2H4的LUMO: π*2p
结构化学课件6第六章 配位化合物的结构和性质

八面体场,d轨道分裂成 eg 轨道(dz2 ,dx2-y2), t2g 轨道(dxy ,dxz ,dyz)。 将eg和t2g这两组轨道间的能量差用△o或10Dq来表 示, △o或10 Dq称为分裂能, 根据重心守恒原理, 则
2E(eg)+3E(t2g)=0 E(eg)-E(t2g)=△o 由此解得 E(eg)=0.6△o = 6Dq E(t2g)=-0.4△o =-4Dq
H2[HgI4]
K2[SiF6] K2[Co(SO4)2] [Ag(NH3)2]Cl [CrCl2(NH3)4]· 2H2O Cl· K[PtCl3NH3] [Co(NH3)5H20]Cl3
[Pt(NO2)(NH3)(NH2OH)(Py)]Cl
四碘合汞(ll)酸
六氟合硅(IV)酸钾 二硫酸根合钴(II)酸钾 氯化二氨合银(I) 二水合一氯化二氯四氨合铬(III) 三氯一氨合铂(II)酸钾 三氯五氨一水合钴(III)
K3[Fe(CN)6]
Fe3+:
3d5
µ =2.40
n=1
配合物的空间构型
配合物分子或离子的空间构型与配位数的 多少密切相关。 配位数
4 2 6 4 4 6 2
空间构型 直线形
四面体 平面正方形 八面体
NiCl 2 4
Ni(CN ) 2 4
例
Ag(NH3 ) 2
Fe(CN) 3 6
空间构型 例
[BeX4]2-四面体
Ni2+形成配位数为4的配合物时,既有四面体构型,也有平面正 方形构型的,前者,Ni2+采用的是dsp2杂化,后者,Ni2+采用的 是sp3 杂化。
四 配 位 的 配 平面正方形,μ=0 合 物
四面体,μ=2.83B.M.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
产生磁性的原因: 物质具有不同的磁性,首先是源于物质内部的电子组
态,即电子在原子轨道和分子轨道上的排布情况;其次是 源于化学成分、晶体结构、晶粒组织和内应力等因素,这 些因素引起磁矩排列的情况不同。
.
物质的磁结构分类:
.
6.6.2 顺磁共振
顺磁共振是研究具有未成对电子的物质,如配合物、 自由基和含有奇数电子的分子等顺次性物质结构的一种重 要方法,它又称为电子顺磁共振(EPR)或电子自旋共振 (ESR)。 原理:
.
三种成键方式(自由基反应):
6.5.3 簇合物的催化性能(自学)
.
6.6 物质的磁性和磁共振
磁性是普遍存在的一种物质属性,任何一种物质材料 都有磁性,只不过表现形式和程度有所不同。物质的磁性 常用磁化率х或磁矩μ表示。磁化率是在外磁场H中物质 磁化强度M和磁场强度H的比值:
M/H
Χ是一个无量纲的量。
因子是为了使δ得到一个便于表达的数值。
对于扫频仪器,δ可以如下表达成
Δ是i 无量v纲 v参的,1由0于6 乘10v6因i v子参v,参所以1单0位6为ppm。
.
影响化学位移的因素: (1)核外电子分布 (2)抗磁各向异性效应 (3)溶剂效应和氢键的影响
.
3.磷、砷、锑、铋的三价化合物,如PF3、PCl3、AsCl3、 SbCl3、PR3等也可作为配位体形成σ—π配键。P、As等原子除 有一孤对电子可以作为电子对的供给者,与M形成σ键外,它还 有空的d轨道可和M形成反馈π键,使配位化合物稳定存在,例如 Pd(PF3)4、HCo(PF3)4、Ni(PF3)4、(R3P)4Mo(CO)2等。
.
6.3.2 不饱和烃配位化合物
以不饱和烃为配位体,通过σ—π配键与过渡金属形成的 配位化合物,在石油化工中占有重要地位。
[PtCl3(C2H4)]-的结构
.
C2H4和Pt2+间的键是σ—π配键。C2H4的π分子轨道与 Pt2+的空的dsp2轨道叠加成键,由C2H4提供π电子成σ配键 ,如上图(b)所示;另一方面, Pt2+的充满电子的d轨道( 如dxz)和C2H4的π*轨道叠加成键,由Pt2+提供d电子成π配 键,如上图(a)所示。这样既可防止由于形成σ配键使电荷 过分集中到金属原子上,又促进 成键作用。
当分子片等瓣相似时,它们形成化合物的情况可用相似的 分子轨道等瓣相似连接模型进行分析。这里指的分子片,既可 以是有机分子片,如CH3、CH2、CH等,也可以是含金属原子 的分子片,如Mn(CO)5,Fe(CO)4、Co(CO)3等。
.
将CH4除去一个H原子,得分子片CH3,它的前线轨道如 下图(a)所示;将Mn(CO)6除去一个CO配位体,得分子 片Mn(CO)5,它的前线轨道如下图(b)所示。
B B1 i
i
因核i的化学环境改变,使发生跃迁吸收的外磁场B变为Bi
,这种改变叫作化学位移。
.
对扫场式仪器,质子比的化学位移δi定义为
i
B参 Bi B参
10 6
常用参比化合物为四甲基硅[Si(CH3)4,TMS],TMS中全部质 子都具有相同的化学环境,因而只显示一个质子NMR峰;式中106
6.3 σ—π配键与有关配位化合物的结构和性质
6.3.1 金属羰基配位化合物和小分子配位化合物
金属羰基配位化合物 许多过渡金属能通过σ—π配键与CO分子结合,生成羰基配位
化合物,如Ni(CO)4,Cr(CO)6,Fe(CO)5,HMn(CO)5等。 定义:σ—π配键
.
在金属羰基配位化合物中,CO以碳原子和金属原子相 连,M—C—O在一直线上。CO分子一方面提供孤对电子给 予中心金属原子的空轨道形成σ配键,如上页图(a)所示 ;另一方面又有空的反键π*轨道可以和金属原子的d轨道形 成π键,这种π键由金属原子单方面提供电子,也称反馈π 键,如上页图(b)所示。这两方面的键合称为σ—π配键。
.
6.3.3 环多烯和过渡金属的配位化合物
许多环多烯具有离域π键的结构,离域π键可以作为一个 整体和中心金属原子通过多中心π键形成配位化合物。平面构 型的对称环多烯有:[C3Ph3]+、[C4H4]2-、[C5H5]-、C6H6、 [C7H7]+、[C8H8]2+等,下图示意出它们的结构式和π电子数。
定义: 金属簇合物是金属原子簇化合物的简称,是指含有3个3个
以上金属原子,相互通过金属—金属键结合,形成多面体或缺 顶多面体的核心骨干,周围连接配位体的配位化合物。金属— 金属键不同于金属键:前者是以共价键的方式形成,后者是由 一个金属晶粒中数目很多的原子轨道高度离域叠加形成的金属 键。
6.5.1 18电子规则和金属—金属键的键数
下式计算得到:
b1 2
18n
g
式中g代表分子中与Mn有关的价电子总数,它包含三部分电子: (i)组成Mn簇合物中n个M原子的价电子数;(ii)配位体提供 给n个M原子的电子数,式中每个配位体提供的电子数列于表6.1 .1中;(iii)若簇合物带有电荷,则包括所带电CO)12
定义:
每个过渡金属原子(M)参加成键的价层原子轨道有9个 (5个d轨道、1个s轨道和3个p轨道),在分子中每个过渡金 属原子可以容纳18个价电子以形成稳定的结构,此即18电子 规则。
.
在含有n个金属原子的多核原子簇化合物中,除M本身的价
电子和配位体提供的电子外,金属原子间直接成键,相互提供电
子以满足18电子规则。故Mn中n个金属原子之间互相成键,互相 提供电子。M原子间成键的总数可以用键数(b)表示。b值可按
g 49122 60
b
1 2
18 4
60 6
金属原子簇(Ir4)的键数 为6,形成6个M—M单键, Ir4呈六条边的四面体形。
.
Re4(CO)162-
g 47162262
b1 2
184
625
Re4的键数为5,形成5 个Re—Re单键,Re4呈5条 边的菱形。
.
Os4(CO)16
g 48162 64
Mn2(CO)10是典型的双核羰基化合物,其中Mn—Mn直接成键 。每个Mn与5个CO形成八面体构型中的5个配位,第六个配位位置 通过Mn—Mn键相互提供1个电子,使每个Mn原子周围满足18个电 子。为了减少空间阻碍引起的排斥力,羰基基团互相错开。Co(CO)8 的情况和Mn2(CO)10相似。
.
其他小分子配位化合物 1.N2、NO+、CN-等和CO是等电子分子,由于结构的相似
核和电子一样,也有自旋运动。核自旋由核自旋量子数I 及核自旋磁量子数mI描述。核自旋角动量大小(MN)决定于I 的数值
MN II12h
I的取值:
质量为偶数、质子数为奇数的核,I=1,2,3,…;质 量和质子数均为偶数的核,I=0;质量为奇数的核,I为半整 数。
.
一些原子核的性质
1H核自旋能级与外磁场B的关系 将样品放在频率合适的电磁辐射中,
这样,当电子在两个能级间 发生跃迁的时候就会吸收或放出 一定波长的微波。
电子自旋磁矩在磁感应强度B中能级的分裂
.
表示方法:
(i)吸收量大小的曲线(a) (ii)吸收微分线(b)
.
应用: (1)测定自由基的浓度 (2)测定未成对电子所 处的状态和环境 (3)测定g值,了解配合 物的电子组态
6.6.3 核磁共振
结果:
两方面的电子授受作用正好互相配合,互相促进,其结 果使M—C间的键比共价单键强,而C—O间的键比CO分子中 的键要弱一些,因为反键轨道上有了一定数量的电子。
.
Fe(CO)5和HMn(CO)5的结构
.
金属羰基配位化合物的特点: 每个金属原子的价电子数和它周围配位体提供的价电子数
加在一起满足18电子结构规则。
可观察到核自旋能级间的跃迁,产生共振 吸收谱,称为核磁共振谱(NMR)。
.
核磁共振仪装置示意图
.
6.6.4 化学位移
在一个化合物中,由于1H核所处的化学环境不同,核i感受 的有效磁场Bi与外磁场B略有不同。核i周围的电子对磁场的贡 献是-σiB,σi称为核i的屏蔽常数。
那么,化合物中不同环境的1H核i感受到的有效磁场变为
.
.
6.4 金属—金属四重键
Re2Cl82-的结构
在过渡金属配位化合物中,金属 原子之间可以形成单键、双键、三重 键和四重键。四重键的形成必须有d 轨道参加,所以它只能在过渡金属原 子之间形成。今以K2(Re2Cl8)·2H2O 警惕中的Re2Cl82-离子为例,介绍四 重键的形成状况。
.
Re原子的电子组态为[Xe]5d56s2,除以dsp2杂化轨道和 Cl形成4个键外,尚余4个d轨道(dxy,dxz,dyz,dz2)和4个 价电子。当两个Re原子沿z轴方向接近时,d轨道按下图方式 互相叠加而形成分子轨道。
b
1 2
18
4
64 4
Os4键数为4,呈4条边的四 方形。
.
若干六核簇合物的几何构型
.
三种八面体簇合物的结构和键
.
6.5.2 等瓣相似、等同键数和等同结构
定义: 等瓣相似(isolobal analogy)是指两个或两个以上的分
子片,它们的前线轨道的数目、能级分布、形状、对称性和所 含电子数均相似。
性,它们也可和过渡金属形成配位化合物。
2.NO比CO多一个电子,这个电子处在π*轨道上。当NO和 过渡金属配位时,由于π*参与反馈π键的形成,所以每个NO分 子有3个电子参与成键。例如:V(CO)5NO、Mn(CO)(NO)3、 Fe(CO)2(NO)2等均满足18电子规则。除CO、N2、NO外,O2、 H2、CO2、NO2、CH4、C2H2、C2H4等小分子和过渡金属形成的 配位化合物颇受人们的重视。
