第1课时--物质的量的单位——摩尔PPT课件
合集下载
《物质的量及其单位-摩尔摩尔质量》课件

化学反应过程中物质的量监控
在化学反应过程中,实时监测反应物和生成物的物质的量变化,控制反应进程和产品质量 。
THANKS FOR WATCHING
感谢您的观看
对于某一分子,其摩尔质量在数值上等于该分子的相对分子质量。例如,水分 子的相对分子质量为18,则其摩尔质量也为18g/mol。
摩尔质量在化学方程式计算中应用
计算反应物的质量
计算生成物的质量
在化学反应中,已知反应物的物质的量和 摩尔质量,可以计算反应物的质量。
在化学反应中,已知生成物的物质的量和 摩尔质量,可以计算生成物的质量。
用于计算气体的密度
通过气体摩尔体积和气体的摩尔质量,可以计算出气体的密度。这对于了解气体的物理性质以及进行相关的实验 和计算具有重要意义。
05 溶液浓度表示方法及换算
溶液浓度常见表示方法介绍
质量百分比浓度
表示溶质质量与溶液质量 之比,常用于工业生产中。
体积百分比浓度
表示溶质体积与溶液体积 之比,常用于酒类等液体 溶剂的表示。
摩尔在化学计算中应用
化学反应计量关系
在化学反应中,各反应物和生成 物之间的物质的量之比等于其化 学计量数之比。通过摩尔可以方 便地表示和计算这种计量关系。
溶液浓度计算
溶液的浓度可以用物质的量浓度 来表示,即单位体积溶液中所含 溶质的物质的量。通过摩尔可以 方便地计算溶液的浓度和溶质的
物质的量。
化学方程式计算
不同浓度单位之间的换算
03
在实际应用中,可能需要将不同浓度单位之间进行换算,这时
需要根据具体的换算公式进行计算。
溶液浓度在化学实验和工业生产中应用
化学实验中的应用
在化学实验中,溶液浓度是影响化学反应速率和化学平衡的重要因素之一,因此需要对溶液浓度进行 精确控制。
在化学反应过程中,实时监测反应物和生成物的物质的量变化,控制反应进程和产品质量 。
THANKS FOR WATCHING
感谢您的观看
对于某一分子,其摩尔质量在数值上等于该分子的相对分子质量。例如,水分 子的相对分子质量为18,则其摩尔质量也为18g/mol。
摩尔质量在化学方程式计算中应用
计算反应物的质量
计算生成物的质量
在化学反应中,已知反应物的物质的量和 摩尔质量,可以计算反应物的质量。
在化学反应中,已知生成物的物质的量和 摩尔质量,可以计算生成物的质量。
用于计算气体的密度
通过气体摩尔体积和气体的摩尔质量,可以计算出气体的密度。这对于了解气体的物理性质以及进行相关的实验 和计算具有重要意义。
05 溶液浓度表示方法及换算
溶液浓度常见表示方法介绍
质量百分比浓度
表示溶质质量与溶液质量 之比,常用于工业生产中。
体积百分比浓度
表示溶质体积与溶液体积 之比,常用于酒类等液体 溶剂的表示。
摩尔在化学计算中应用
化学反应计量关系
在化学反应中,各反应物和生成 物之间的物质的量之比等于其化 学计量数之比。通过摩尔可以方 便地表示和计算这种计量关系。
溶液浓度计算
溶液的浓度可以用物质的量浓度 来表示,即单位体积溶液中所含 溶质的物质的量。通过摩尔可以 方便地计算溶液的浓度和溶质的
物质的量。
化学方程式计算
不同浓度单位之间的换算
03
在实际应用中,可能需要将不同浓度单位之间进行换算,这时
需要根据具体的换算公式进行计算。
溶液浓度在化学实验和工业生产中应用
化学实验中的应用
在化学实验中,溶液浓度是影响化学反应速率和化学平衡的重要因素之一,因此需要对溶液浓度进行 精确控制。
《化学中常用的物理量——物质的量》认识化学科学PPT(第1课时物质的量及其单位摩尔质量)

1
12
。
3.相对分子质量:化学式中各原子的相对原子质量的总和,就是相
对分子质量。
知识铺垫
新知预习
自主测试
一、物质的量
1.物质的量
(1)含义:物质的量是一个根本物理量,通过它可以把物质的宏观量
(如质量、体积)与原子、分子或离子等微观粒子的数量联系起来。
(2)符号:n。
(3)单位是摩尔,简称摩;符号是mol。
2
2
探究1
探究2
素养脉络
随堂检测
2.物质的量的标准表示方法
x mol
H2SO4
↓
↓
↓
数值 单位 指定微粒符号或微粒名称
3.摩尔质量与相对原子质量、相对分子质量的比较
摩尔质量(M)
单位物质的量的物
定义
质所具有的质量
相对原子质量
相对分子
质量
一个原子的实际质量 各元素原子的
1
12
与一个 C 质量的 相 相对原子质量
)
A.1 mol氢 B.1.5 mol H2O
C.2 mol铁钉 D.3 mol西瓜
答案:B
解析:物质的量的适用范围是微观粒子。
)
)
知识铺垫
新知预习
自主测试
3.以下说法正确的选项是(
)
A.1 mol H+的质量是1 g
B.NaCl的摩尔质量是58.5 g
C.1 mol H2SO4的质量是98 g·mol-1
值,无单位。
2.使用“物质的量〞时易出现的两个错误
(1)错误一:用物质的量描述宏观物质。
(2)错误二:描述的对象不明确。
①如“1 mol氮〞的表述方法错误,应指明对象,如1 mol N2、1
第1课时 化学入门——化学常用计量(55张PPT)

CuSO4·5H2O―→CuSO4; Na2CO3·10H2O―→Na2CO3
知识点三 物质的量浓度及计算 考点
(2)准确计算溶液的体积
c=
n V
中的V是溶液的体积,不是溶剂的体积,也不是溶质
和溶剂的体积之和,不能用水的体积代替溶液的体积,应
根据V=mρ 计算。 3.两种重要的换算关系
(1)溶解度与质量分数的关系 某温度下饱和溶液质量分数(w)与溶解度(S)的换算公式:w
提醒
知识点三 物质的量浓度及计算 考点
1 L 1 mol·L-1 的氨水中,NH3 的 物质的量并不是 1 mol,而是指溶 液中 NH3、NH3·H2O、NH+ 4 三者的 物质的量之和为 1 mol。
知识点二 气体摩尔体积、阿伏加考点 德罗定律 3.阿伏加德罗定律
概括为:“三同”定“一同”。即同温、同压、同体积的 任何气体,含有相同的分子数(或物质的量相同)。
知识点二 气体摩尔体积、阿伏加考点 德罗定律
4.阿伏加德罗定律的推论 公式
语言叙述
T、p 相同
T、V 相同
VV12=nn12
同温、同压下,气体的体积与其 物质的量 成正比
ρρ12=MM12
同温、同压下,气体的密度与其 摩尔质量 (或相对分子质量)成正比
pp12=nn12
温度、体积相同的气体,其压强与其 物质的量 成正比
知识点二 气体摩尔体积、阿伏加考点 德罗定律
提醒
知识点二 气体摩尔体积、阿伏加考点 德罗定律
同温、同压、同体积的任何气 体的分子数相等,但原子数不一定 相等。
解析:晶体的摩尔质量约为 122 g·mol-1,n=12212g.·2mgol-1= 0.1 mol,故氧原子数目=0.1×(2+1.3)NA=0.33NA,n(H) =0.1 mol×1.3×2=0.26 mol。
【人教版】高中化学必修一:1.2.1《物质的量的单位——摩尔》ppt课件

答案:C
-18-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
知识点1 知识点2 知识点3
Z 知识梳理 HISHI SHULI
象是微观粒子,如原子、分子、离子、中子、质子、电子,也可以 是这些粒子的特定组合,而不能指宏观物体,因此“1 mol鸡蛋”说法 错误。在用“mol”时,要指明粒子的种类,如“1 mol O”表示1 mol氧原 子,“1 mol O2”表示1 mol氧气分子,“1 mol O2-”表示1 mol氧离子,而 不能说“1 mol氧”,因为这里的氧指代不明确。
1
1
联 系
摩尔质量以 g·mol-1 为单位时,在数值上等于其相对分子质量 或相对原子质量;混合物组成一定时,1 mol 混合物的质量在数 值上等于该混合物的平均相对分子质量
-13-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
-11-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
D典例透析 IANLI TOUXI
粒特的别质提量醒(m()1:m)已=知������������A阿; 同伏理加,德若罗已常知数m(、NAN)A和,则摩M尔=质m·量NA(。M),则一个微 (2)高中化学计算主要是以物质的量为中心的计算,学习中要养成
-15-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
-18-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
知识点1 知识点2 知识点3
Z 知识梳理 HISHI SHULI
象是微观粒子,如原子、分子、离子、中子、质子、电子,也可以 是这些粒子的特定组合,而不能指宏观物体,因此“1 mol鸡蛋”说法 错误。在用“mol”时,要指明粒子的种类,如“1 mol O”表示1 mol氧原 子,“1 mol O2”表示1 mol氧气分子,“1 mol O2-”表示1 mol氧离子,而 不能说“1 mol氧”,因为这里的氧指代不明确。
1
1
联 系
摩尔质量以 g·mol-1 为单位时,在数值上等于其相对分子质量 或相对原子质量;混合物组成一定时,1 mol 混合物的质量在数 值上等于该混合物的平均相对分子质量
-13-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
-11-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
D典例透析 IANLI TOUXI
粒特的别质提量醒(m()1:m)已=知������������A阿; 同伏理加,德若罗已常知数m(、NAN)A和,则摩M尔=质m·量NA(。M),则一个微 (2)高中化学计算主要是以物质的量为中心的计算,学习中要养成
-15-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
物质的量ppt课件

铅笔打数 = 铅笔支数 ÷ (12支/打)
以H2O为例,已知H2O的分子数为1.204×1024个,阿伏加德 罗常数约为6.02×1023/mol,计算H2O的物质的量是多少mol?
= 物质的量(n)
粒子数(N) ÷ 阿伏伽德罗常数(NA)
2mol
= 1.204×1024 ÷ 6.02×1023/mol
探究活动
1 mol H2O 约含有6.02×1023个水分子,
质量是18g
1molAl 约含有6.02×1023 个铝原子,
质量是27g
1mol任何粒子集合体都约含6.02×1023个粒子, 那么1mol粒子的质量是多少呢?
探究活动
1mol任何粒子或物质的质量以克为单位时,能得出其数值与该粒子 的相对原子质量或相对分子质量存在什么样的关系?
瓜子包数 = 瓜子质量 ÷ 每包质量
以H2为例,知道H2的质量为20g,H2的摩尔质量是 2g/mol,计算H2的物质的量是多少mol?
= 物质的量(n)
质量(m)
÷ 摩尔质量(M )
10mol
= 20g
÷ 2 g / mol
物质的量( n )、摩尔质量( M )、质量( m)
的关系式 :
n= m
M
= 物质的量( n )、阿伏伽德罗常数( NA )、粒子 n
N
数( N)的关系式 :
NA
物质的量的“四化”
专有化 微观化 具体化
• 专有名词,表述时不可增减字。如不能说成“物质量”或 “物质的数量”等
• 只适用于微观粒子(原子、分子、离子、原子团、电子、
质子、中子 等) • 必须指明具体粒子的种类。如“1 mol O”、“2.5 mol
以H2O为例,已知H2O的分子数为1.204×1024个,阿伏加德 罗常数约为6.02×1023/mol,计算H2O的物质的量是多少mol?
= 物质的量(n)
粒子数(N) ÷ 阿伏伽德罗常数(NA)
2mol
= 1.204×1024 ÷ 6.02×1023/mol
探究活动
1 mol H2O 约含有6.02×1023个水分子,
质量是18g
1molAl 约含有6.02×1023 个铝原子,
质量是27g
1mol任何粒子集合体都约含6.02×1023个粒子, 那么1mol粒子的质量是多少呢?
探究活动
1mol任何粒子或物质的质量以克为单位时,能得出其数值与该粒子 的相对原子质量或相对分子质量存在什么样的关系?
瓜子包数 = 瓜子质量 ÷ 每包质量
以H2为例,知道H2的质量为20g,H2的摩尔质量是 2g/mol,计算H2的物质的量是多少mol?
= 物质的量(n)
质量(m)
÷ 摩尔质量(M )
10mol
= 20g
÷ 2 g / mol
物质的量( n )、摩尔质量( M )、质量( m)
的关系式 :
n= m
M
= 物质的量( n )、阿伏伽德罗常数( NA )、粒子 n
N
数( N)的关系式 :
NA
物质的量的“四化”
专有化 微观化 具体化
• 专有名词,表述时不可增减字。如不能说成“物质量”或 “物质的数量”等
• 只适用于微观粒子(原子、分子、离子、原子团、电子、
质子、中子 等) • 必须指明具体粒子的种类。如“1 mol O”、“2.5 mol
物质的量PPT

1 摩尔(mol)的标准
1971年,在第十四届国际计量大会上
规定:将0.012kg12C中所含有的碳原
子数定为1摩尔(1mol)。
1 摩尔(mol)粒子的粒子数是多少呢?
≈ 6.02×1023
阿伏加德罗常数
符号:NA
1mol任何粒子的粒子数
单位:mol-1
近似值:NA ≈ 6.02×1023 mol-1
1:在0.5mol O2中含有的氧分子数目是多少?
解:O2的分子数为
N
=
n
×
NA
=0.5 mol× 6.02 ×1023mol-1
=
3.01 × 1023
答:O2的分子数为3.01 × 1023个。
2:在0.5mol O2中含有的氧原子数目是多少?
解:O2的氧原子数为
N
=
n
×2 ×
NA
=0.5 mol×2× 6.02 ×1023mol-1
无意义的表示。
③ 物质的量的数值可以是整数,也可
以是小数。
练习:1、把意义大声说出来:
①1molO2,表示: 1mol氧分子
②1molFe,表示:1mol铁原子
③1molH2O,表示:
1mol水分子
2、批判与反思:以下说法是否正确?
①1mol氧
□
②1mol大米
□
×
×
+
③1mol质子(H )
□ ④1mol细菌
1mol粒子的粒子数
‖
=
阿伏加德罗常数
‖
0.012Kg12C中所含原子数
约为
约为
约为
6.02×1023
不能认为1 mol粒子=6.02×1023个
物质的量的单位摩尔-完整版PPT课件
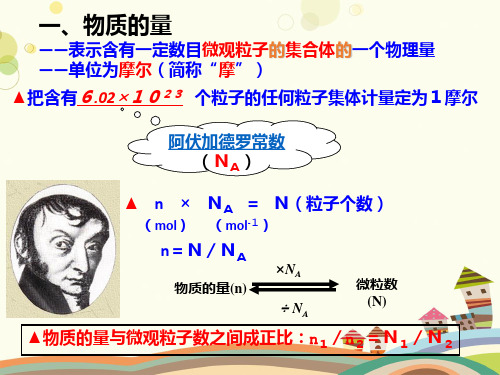
一、物质的量
——表示含有一定数目微观粒子的集合体的一个物理量 ——单位为摩尔(简称“摩”)
▲把含有6.02×1023 个粒子的任何粒子集体计量定为1摩尔
阿伏加德罗常数 (NA)
▲ n × NA = N(粒子个数)
(mol) (mol-1)
n=N/NA
物质的量(n)
×NA
÷ NA
微粒数 (N)
▲物质的量与微观粒子数之间成正比:n1/n2=N1/N2
使用物质的量注意事项:
①物质的量这四个字是一个整体,是一个 专用名词,不得简化或增添任何字。
②物质的量只适用于微观粒子,使用摩作 单位时,所指粒子必须指明粒子的种类, 如原子、分子、离子等。且粒子的种类一 般都要用化学符号表示。
③物质的量计量的是粒子的集合体,不是 单个粒子。
——表示含有一定数目微观粒子的集合体的一个物理量 ——单位为摩尔(简称“摩”)
▲把含有6.02×1023 个粒子的任何粒子集体计量定为1摩尔
阿伏加德罗常数 (NA)
▲ n × NA = N(粒子个数)
(mol) (mol-1)
n=N/NA
物质的量(n)
×NA
÷ NA
微粒数 (N)
▲物质的量与微观粒子数之间成正比:n1/n2=N1/N2
使用物质的量注意事项:
①物质的量这四个字是一个整体,是一个 专用名词,不得简化或增添任何字。
②物质的量只适用于微观粒子,使用摩作 单位时,所指粒子必须指明粒子的种类, 如原子、分子、离子等。且粒子的种类一 般都要用化学符号表示。
③物质的量计量的是粒子的集合体,不是 单个粒子。
高一化学 PPT课件 图文

如果把 6.02×1023 粒米给60亿人吃,每人 每天吃一斤,要吃14万年。所以物质的量只用来 表示原子、分子、离子等微观粒子。
3.物质的量(n)、粒子数(N)与阿伏伽德罗常 数(NA)的关系
n=1mol N≈6.02X1023
NA
n=2mol N≈2X6.02X1023 2NA
n=0.5mol N≈0.5X6.02X1023 0.5NA
(2)9.03×1023个H,其物质的量是多少?
解:
n
(H)
=
N(H) NA
=69.0.023××11002233mol-1=1.5mol
练习:
1. mol C中约含有 6.02 × 1023 个碳原子 2. 0.3 mol H2SO4含有 0.3NA 个硫酸分子
1.806 × 1023
3. 1.204 × 1024个H2O2分子的物质的量 为 2 mol 。
二、配制一定浓度的溶液 主要仪器:容量瓶
标有温度、容积、刻度线
常用规格: 100ml,250ml,500ml,1000ml
注意事项: ①使用前要检漏 ②溶解或稀释不能在容量瓶中进行 ③不能长期存放溶液或进行化学反应 ④不能进行加热 ⑤只能配置容量瓶上规定容积的溶液
【实验1—5】配置100mL 1.00mol/L NaCl溶液
1mol微观粒子的数目是多少?
‖
0.012kg12C中所含有的碳原子数
2.阿伏加德罗常数
(1)标准:1mol任何粒子的粒子数叫做阿伏 加德罗常数
(2)符号:NA (3)单位:mol-1 (4)NA ≈ 6.02 ×1023mol-1
感受阿伏加德罗常数
如果把6.02×1023个直径为2.5cm的硬币排 成一行,可以来回于地球与太阳之间240.8亿次
3.物质的量(n)、粒子数(N)与阿伏伽德罗常 数(NA)的关系
n=1mol N≈6.02X1023
NA
n=2mol N≈2X6.02X1023 2NA
n=0.5mol N≈0.5X6.02X1023 0.5NA
(2)9.03×1023个H,其物质的量是多少?
解:
n
(H)
=
N(H) NA
=69.0.023××11002233mol-1=1.5mol
练习:
1. mol C中约含有 6.02 × 1023 个碳原子 2. 0.3 mol H2SO4含有 0.3NA 个硫酸分子
1.806 × 1023
3. 1.204 × 1024个H2O2分子的物质的量 为 2 mol 。
二、配制一定浓度的溶液 主要仪器:容量瓶
标有温度、容积、刻度线
常用规格: 100ml,250ml,500ml,1000ml
注意事项: ①使用前要检漏 ②溶解或稀释不能在容量瓶中进行 ③不能长期存放溶液或进行化学反应 ④不能进行加热 ⑤只能配置容量瓶上规定容积的溶液
【实验1—5】配置100mL 1.00mol/L NaCl溶液
1mol微观粒子的数目是多少?
‖
0.012kg12C中所含有的碳原子数
2.阿伏加德罗常数
(1)标准:1mol任何粒子的粒子数叫做阿伏 加德罗常数
(2)符号:NA (3)单位:mol-1 (4)NA ≈ 6.02 ×1023mol-1
感受阿伏加德罗常数
如果把6.02×1023个直径为2.5cm的硬币排 成一行,可以来回于地球与太阳之间240.8亿次
第3节 第1课时 物质的量的单位——摩尔(课件)高一化学(人教版2019必修第一册)

探究学习
1.物质的量:是表示含一定数目粒子的集合体的物理量
重 点ቤተ መጻሕፍቲ ባይዱ
理 解
(微观粒子包括:原子.分子.离子.原子团.电子.质子.中子等)
2.符号 : n
3.单位:摩尔(简称摩)
符号:mol
“物质的量”是一个专有名词,由固定字数组成,不能分割、
不能增减。
物质的量的数值可以是整数,也可以是小数。
用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的
重 点
理 解
质量
物质的量=
摩尔质量
m
n
M
m n M
m
M
n
典例精讲
【例3】判断正误
(1)H2O的摩尔质量等于水的相对分子质量。
(
(2)2 mol O2的摩尔质量为64 g/mol。
(
(3)1 mol任何分子含有相同的分子数和相同质量。
(
(4)98 g H2SO4中分子数为6.02×1023。
课本P55
【解】Na2CO3的相对分子质量为106,摩尔质量为
106g • mol-1
m(Na2CO3)
nINa2CO3)=
M(Na2CO3)
26.5 g
=
106 g • mo -1
= 0.25 mol
答:26.5gNa2CO3的物质的量是 0.25 mol。
课堂思考
请你总结!
化学方程式表示哪些含义?
名称、符号或化学式。若用中文,则必须指明微粒的种类。
典例精讲
【例1】判断下列说法是否正确,并加以说明理由
1、1 mol 苹果
2、3 mol O
3、1 mol 氧
4、2 mol H2O
物质的量完整课件(共39张PPT)

0.2
0.2
0.1
二、摩尔质量
1. 1mol物质的质量 2. 1mol 任何粒子或物质的质量以克为单位时,其数值都与该粒子的相对原子质 量或相对分
子质量相等。
3. 2. 摩尔质量 4. 〔1〕定义:单位物质的量的物质所具有的质量叫做摩尔质量,符号为M。 5. 〔2〕单位:g/mol 6. 〔3〕数值:数值等于该粒子的相对分子〔原子〕质量。
;分子数是
1.204 ×1024
。
〔6〕SO4- 摩尔质量是
,物质的量是
。
96 g/mol
9.6g
3. 物质的质量〔m),物质的量(n),摩尔质量(M)三者之间的关系
n m M
m n N
M
NA
【例题6】24.5gH2SO4 的物质的量是多少?
n (H 2 S4 O )M m ( (H H 2 2 S S4 4 O ) O ) 92 g 8 ./5 4 m g o 0 .2 lm 5ol
〔2〕标准状况下〔0℃,101kPa), 1mol 任何 气体的体积都约占22.4 L/mol。
25℃,101kPa时,气体摩尔体积约为24.5L/mol。
〔3〕计算公式:
V V 注意:
m
n ①22.4L/mol 使用条件:适用气体,且一般指标准状况,即0℃、101kPa。
②
适用对象:必须是气态物质,单一或混合气体均可用。
溶质的单位 溶液的单位
单位
公式
物质的量浓度
溶质的质量分数
mol
g
L
g
mol·L-1
CB
溶质的物质的(n量B) 溶液的体(积 V)
-
wB溶 溶质 液的 的((m m 质 质 B))量 1量 0% 0
人教版高中化学必修一课件第一课时物质的量.ppt

解:1个硫酸分子中含有4个O,O的 质量是:
m(O)= n(O) ×M(O)
=2 mol×4×16g/mol = 128g 答:氧元素的质量为128g.
[例题] 0.5molX物质,质量为16g,求X的摩尔质 量是多少?
解: M(X)= m(X)÷n(X)
=16g ÷0.5mol
= 32g/mol
空白演示
在此输入您的封面副标题
§1.2化学计量在实验中的应用
第一课时 物质的量的单位---摩尔
打
定义:表示一定数 量物质的集合体
一打铅笔
物质的量(摩尔) 定义:表示一定数 量粒子的集合体
一个分子(很小, 不方便表示)
一“堆”分 子
(可以看见)
一、物质的量
定义:表示含有一定数目粒子的集合体的一 个物理量,符号为n。
6.02 × 1023
18g
从上表可以看出,1mol任何粒子或物质所具 有的质量有什么特点呢?
摩尔质量
定义:单位物质的量的物质所具有的质量
符号:M,常用单位为:g/mol(或g·mol-1)。
数值:等于物质或粒子的式量(相对原子质量或相对分
子质量)。摩尔质量M=源自m 物质的质量 n 物质的量
公式变形:
3、下列说法中,不正确的是( A )
A.1 mol任何物质都含有6.02×1023个原子
B. 0.012kg 12C约含有6.02×1023个碳原子
C. 0.2 mol H2O所含的H原子数为0.4 NA D. 使用摩尔这一单位时必须指明微粒的名
称
1mol的物质中含有粒子数相同, 那1mol不同物质的质量相同吗?
1molO2中含O2分子6.02×1023个 2molO2中含O2分子__2_×__6_._0_2_×__1_0_23__个 那么3molN2含N2分子_3_×_6_._0_2_×__1_0_23___个
m(O)= n(O) ×M(O)
=2 mol×4×16g/mol = 128g 答:氧元素的质量为128g.
[例题] 0.5molX物质,质量为16g,求X的摩尔质 量是多少?
解: M(X)= m(X)÷n(X)
=16g ÷0.5mol
= 32g/mol
空白演示
在此输入您的封面副标题
§1.2化学计量在实验中的应用
第一课时 物质的量的单位---摩尔
打
定义:表示一定数 量物质的集合体
一打铅笔
物质的量(摩尔) 定义:表示一定数 量粒子的集合体
一个分子(很小, 不方便表示)
一“堆”分 子
(可以看见)
一、物质的量
定义:表示含有一定数目粒子的集合体的一 个物理量,符号为n。
6.02 × 1023
18g
从上表可以看出,1mol任何粒子或物质所具 有的质量有什么特点呢?
摩尔质量
定义:单位物质的量的物质所具有的质量
符号:M,常用单位为:g/mol(或g·mol-1)。
数值:等于物质或粒子的式量(相对原子质量或相对分
子质量)。摩尔质量M=源自m 物质的质量 n 物质的量
公式变形:
3、下列说法中,不正确的是( A )
A.1 mol任何物质都含有6.02×1023个原子
B. 0.012kg 12C约含有6.02×1023个碳原子
C. 0.2 mol H2O所含的H原子数为0.4 NA D. 使用摩尔这一单位时必须指明微粒的名
称
1mol的物质中含有粒子数相同, 那1mol不同物质的质量相同吗?
1molO2中含O2分子6.02×1023个 2molO2中含O2分子__2_×__6_._0_2_×__1_0_23__个 那么3molN2含N2分子_3_×_6_._0_2_×__1_0_23___个
摩尔-PPT课件

尝试应用 3.下列关于摩尔质量的说法中正确的是( A.氢的摩尔质量是1 g· mol-1 B.1 mol N2的摩尔质量是28 g C.水的摩尔质量是18 g D.NO的摩尔质量是62 g· mol-1 解析:A错,未指明该物质是氢分子还是氢原子;B错, 1 mol N2的质量是28 g;C错,摩尔质量的单位应为g· mol-1。 答案:D )
综合拓展 二、物质的量、物质的质量、微粒个数之间的关系
计算关系 式(公式)
N n= N A
主要应用
注意事项
m n= M
在n、N和NA中,已 求n或N时:概念性问 知任意两项求第三 题用NA;数字性问题 用6.02×1023 mol-1 项 M的单位取g·mol-1时, 在M、n和m中,已 m的单位取g;M的单 知任意两项求第三 位取kg·mol-1时,m的 项 单位取kg 在m、M、NA和N中, 与N有关的问题莫忽视 已知任意三项求第 微粒的组成和种类 四项
NA
综合拓展 一、物质的量及单位——摩尔
1.物质的量是国际单位制中的七个基本物理量之一,
“物质的量”四个字是一个整体概念、不能拆开,也不 能添字。如不能说成“物质量”或“物质的质量”等。 2.摩尔是物质的量的单位,以摩尔为单位度量的对 象是微观粒子,如原子、分子、离子、中子、质子、电
子,也可以是这些离子的特定组合,如构成NaCl晶体的
基本单元是Na+和Cl-,则每摩尔NaCl晶体含1 mol Na+ 和1 mol Cl-。
3.阿伏加德罗常数 阿伏加德罗常数是一个有单位(mol-1)的物理 量,而不是一个数。用NA表示。 物质的量与粒子数之间可通过阿伏加德罗常数
这个桥梁建立关系:
物质所含的粒子数N 物质的量(n)= NA
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、物质的量(n) 表示含有一定数目粒子的集合体的物理量。符号 为n。 单位为“摩尔”,符号为mol。 【注意】物质的量是一个专有名词,由四个字组成, 是一个整体,不能分割,也不可加字、减字;粒子 指微观的分子、原子、离子、电子、质子、中子、 原子团等;粒子要指明,一般用化学式表示。
国际单位制(SI)的七个基本物理量
物理量 长度 质量 时间 电流
热力学温度 物质的量 发光强度
单位名称 米
千克 秒
安[培] 开[尔文] 摩[尔] 坎[德拉]
单位符号 m kg s A K
mol cd
【练一练】
A 下列说法中正确的是( ) A.物质的量适用于计量分子、原子、离子等粒子 B.物质的量就是物质的质量 C.摩尔是表示粒子多少的一种物理量 D.摩尔是表示物质质量的单位
2.下列说法中正确的是( B ) A.1mol任何物质均含有6.02 ×1023个原子 B. 阿 伏 加 德 罗 常 数 就 是 1mol 粒 子 数 的 集 体 , 0.012kg 12 C约含有6.02 ×1023个12 C C.摩尔是一个基本的物理量 D.1mol水中含有2mol氢和1mol氧 【提示】构成物质的微粒有很多种,不单单只是原 子。描述物质的量时应具体,不能模糊。
Al
4.485× 10-23g
H2
3.294× 10-24g
H2O
2.990× 10-23g
物质的量 1mol
1mol
1mol 1mol
相对分子或
16
27
2
18
原子质量
1mol微粒
的质量
16g
27g
2g
18g
1mol任何粒子或物质的质量以克为单位时,其数值都等于该
物质的相对分子质量或相对原子质量。
二、摩尔质量 定义:每摩尔物质具有的质量。符号:M 单位:克/摩 符号:g/mol 或 g·mol-1 数值:等于该物质的相对分子质量或相对原子质量。
(单位:个/mol)
【想一想】
以上三者有怎样的联系呢?
【练一练】
在0.5 mol O2中含有的氧原子数目是多少?
解:每个O2分子中含有两个氧原子,氧原子数为 N(O)= n(O2)×2×NA =0.5 mol×2×6.02×1023 mol-1 = 6.02×1023 答:O2中含有的氧原子数为6.02×1023个。
对NA的认识: 1.将6.02×1023个一角硬币排起来,可来 回地球和太阳间400亿次之多。 2.如果把 6.02×1023粒米给全球60亿人吃,每人每 天吃一斤,要吃14万年。所以物质的量只能用来表 示原子、分子、离子等微观粒子的数量。
微粒数
物质的量
= (单位:mol)n
(单位:个) N
NA 阿伏加德罗常数
(1) n N
NA
(2) M m
n
已知任意两项就可以求得第三项。 已知任意两项就可以求得第三项。
(3) mM n NA N 。
M
NA
通过这个桥梁可间接进行m与N之间的换算。
1.下列关于物质的量的说法中正确的是( C ) A.物质的量是物质数量的单位 B.物质的量实际上表示物质的质量 C.物质的量实际上表示含有一定数目的粒子集体 D.物质的量就是物质的数量
第二节 化学计量在实验中的应用
第1课时 物质的量的单位——摩尔
看Flash,思考:物质由哪些微粒组成?该如何称量?
1.了解物质的量、摩尔质量和阿伏加德罗常数。(重点) 2.掌握物质的量与微观粒子之间的关系。
订书钉
铅笔是一打一打的 订书钉是一排一排的 曲别针是100只装一盒
【想一想】 根据上面的图例,联系生活中的计量方法,请思 考下面的问题: 对于细小的物品,用打、排、盒等来计量有哪些 好处?打、排、盒和只有怎样的数量关系?
1.不同的物质可能有不同的计量方法。(方便) 1打等于12支,100只为1盒
2.不同的计量方法之间是能相互转化的。(联系) 3.外观越小的物质,用集团来计量越方便。(迁移)
能总结,会归纳,也是一种学习哦!
化学反应是原子、离子或分子之间按一定的数目 关系进行的。对于原子、离子和分子等我们不仅 直接用肉眼看不到,而且难以称量。用什么方法 来计量原子、离子或分子(外观较小)呢?
物质的质量 (g) 公式:物质的量 (mol)=
摩尔质量 (g/mol)
M=m÷n
我知道计 算公式了。
【练一练】
下列说法正确的是( C ) A.Na的摩尔质量为23g B.Na的摩尔质量为23 C.Na的摩尔质量为23g·mol-1 D.Na的摩尔质量为2.3×10-2kg·3.下列叙述中正确的是 ( D ) A. CO2的摩尔质量为44g B. 1 mol CO2 的质量为44g·mol-1 C. CO2的摩尔质量等于CO2的相对分子质量 D. NA个CO2的质量与CO2的相对分子质量在数值上相 同
4.说出下列语句的含义。 (1)1mol H 表示1mol的氢原子 (2)3mol H2 表示3mol的氢气分子 (3) 1mol CO2 表示1mol二氧化碳分子
物质的量的表示方法: 物质的量的多少(mol)+能表示微观粒子的符号
5. 4.9 克H2SO4含有多少个硫酸分子? 解:硫酸的相对分子质量是98,
所以硫酸的摩尔质量是98g·mol-1。
n (H2SO4) =
984g.9·mgol-1= 0.05 mol
【思考与交流】
1mol不同物质含有的微粒数相等,那么1mol不同 物质的质量是否也相同呢? 【提示】不一定相同。因为每一个微粒的质量不 一定相等,当6.02×1023个微粒放在一起,质量 当然可能不一样了。
【想一想】
1mol微粒的质量有什么规律?
一个分子或 原子的质量
O
2.657× 10-23g
【提示】物质的量是物理量,摩尔是物质的量的单 位。物质的量是整体,不能拆开理解。
【想一想】 1.质量的单位是千克,1千克=1 000克,物质的量 的单位是摩尔,1mol含有多少个微粒? 【提示】国际上规定,1mol粒子集合体所含的粒子 数与0.012 kg 12C中所含的碳原子数相同。
2.0.012 kg12C中所含的碳原子数到底有多少个? 【提示】这是个定值,称为阿伏加德罗常数, 符号 为NA,通常用 6.02×1023 mol-1表示。
