纯蒸汽系统用户需求手册
纯蒸汽发生器用户需求
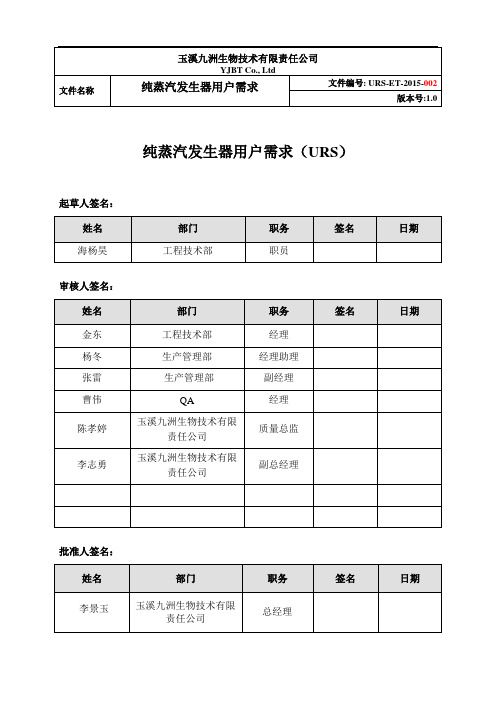
纯蒸汽发生器用户需求(URS)起草人签名:审核人签名:批准人签名:目录1 目的 (3)2 范围 (3)3 缩写列表 (3)4 法规和标准 (4)5 项目介绍 (4)5.1项目描述 (4)5.2工艺/流程描述 (4)6 物料 (5)7 用户及系统要求 (5)7.1性能要求 (5)7.2设备主体要求: (6)7.3设备运行监测及自动控制要求: (8)7.4安全与环保要求: (9)7.5计量要求 (9)7.6文件要求 (9)7.7验证/确认要求 (10)7.8培训验收 (10)7.9供应商对项目要求的确认 (10)8 附件 (10)9 记录 (11)1目的本用户需求文件旨在从项目和设备的角度阐述用户的需求,总括了用户对该项目的质量要求(GMP),描述了用户对该设备工作过程及功能的期望。
主要包括了相关法规符合度和用户的具体需求,这份文件是构建项目和系统的文件体系的基础,同时也是系统设计、订货和验证的可接受标准依据。
供应商应在规定的时间内完成并达到本用户需求的设计目标和可接受的质量标准。
2范围本文件的范围涉及到了对纯蒸汽发生器的设计、制造、材料、运输、包装、检查、测试、调试、运行、操作、维护、验证、文件和交付的说明和最低要求,供应商应以URS作为详细设计以及报价的基础。
供应商应对设备供应负责,同时配合用户完成IQ/OQ/PQ。
供应商在设计、制造、组装时必须要按照URS来执行。
设备应能够满足本文件所提要求。
供应商所提供文件应不少于本文中所列文件内容。
供应范围内应包含用户人员培训。
供应商需提供技术服务协议方案。
用户接受IQ/OQ/PQ 前,供应商应对所提供设备负有责任。
文件中“必须”条款,需供应商制造时必须达到部分,不可用其它技术代替。
“期望”条款,需供应商制造时可选用不同的技术,但最终需符合用户的需求。
3缩写列表4法规和标准4.1 《药品生产质量管理规范》2010年版。
4.2 国家现行相关行业标准及规范:➢《药品生产质量管理规范》(2010版)➢《中国药典》(2010版)➢《ISPE制药工程基本指南》第六卷、第九卷和第十卷关于注射用水系统设计、施工、仪表和控制、调试和验证的相关内容➢GAMP5《良好自动化生产实践指南》(第5版)➢中国药品生产验证指南5项目介绍5.1 项目描述本次需购买的纯蒸汽发生器用于玉溪九洲生物技术有限责任公司生产车间纯蒸汽供应保障。
纯蒸汽发生器URS

宏济堂阿胶药业纯蒸汽发生器系统用户需求User Requirement Specifications版次:A编号:URS-003生效日期:审核批准注:本文件所描述为纯蒸汽发生器系统的工艺技术要求,请文件审核和批准人员仔细阅读每一页后,将意见和建议单独附页在本文件后,在本页签名即代表已审阅并批准本文件的每一页。
目录1、简介 (2)项目介绍 (2)目的 2文件概述 (2)2项目标准 (2)术语 2参考书目 (2)332.总则 (3)设计依据 (3)质量 (3)产量 (4)总体要求 (4)2.5安全要求 (4)3.项目需求 (4)工艺控制 (4)仪器仪表 (6)纯蒸汽发生器控制系统 (7)4.服务要求 (8)4.1包装运输要求 (8)4.2备品零件要求 (8)4.3安装 (8)4.2噪音水平 (8)5.维修 (9)6.验证和文件 (10)6.1验证 (10)6.2 FAT要求 (10)6.3文件 (12)7.服务和培训 (14)8.其他要求 (14)1、简介1.1 项目介绍该项目为**********药业的纯蒸汽发生器,纯蒸汽主要用于产品、设备、物料的灭菌和消毒等,该项目要求最终纯蒸汽质量稳定并且符合中国药典2010版质量标准。
除GMP法规外,还须满足中国环境保护法规、ISO14001,压力容器和特种设备的制造符合中国国家制造标准。
本URS为用户需要采购的纯蒸汽发生器系统各项要求进行描述。
供给商按照此文件进行设计、制造、检查和测试、包装、交付、安装调试、验收、培训和验证,并提供文件等。
供给商应保证该设备符合本文件要求及相关标准和标准。
●本文旨在描述用户对纯蒸汽发生器系统设计的要求。
●本文旨在为供给商提供设计所需要的信息。
●在这个项目中,供给商须提供全新的设计、制造、安装、验证、运行和维护的纯蒸汽发生器设备,并能产出符合所有相关法规、药典的要求的纯蒸汽。
●纯蒸汽发生器设备的设计、制造和安装必须满足现场建筑物、安全和环境法规的执行要求。
纯蒸汽发生器用户需求说明书

纯蒸汽发生器用户需求说明书1目的1.1纯蒸汽发生器用户需求标准,为采购提供相关的技术参数和要求。
为投标方提供准确参数。
1.2本URS旨在从项目和系统的角度阐述用户的需求,包括了用户对该项目的质量要求,描述了用户对该设备的工作过程及功能的期望。
主要包括相关法规符合度和用户的具体要求,这份文件是构建项目和系统文件体系的基础,同时也是系统设计和验证的可接受标准的依据。
设备生产供应商在规定的时间内完成,并达到本用户需求的设计目标和可接受的质量标准。
1.3在本URS中用户仅提出技术和设备基本要求,并未涵盖和限制投标方设备具有更高的设计与制造标准,使设备功能和性能得到更加完善、更优异的设备配置、更智能化控制系统;投标方应在满足本URS的前提下,投标方因在满足本URS的前提下提供能够达到的更高标准、性能及相关服务;投标方的设备应满足中国有关设计、制造、安全、环保等规范和国家强制性标准要求,如遇与投标方所执行标准发生矛盾时,应按照最高标准执行或国家强制性标准执行。
2范围2.2投标方需提供二次设计服务,本工程从二次设计、制造、安装、自控等整套系统属于交钥匙工程。
2.3二次设计依据设计院的详细设计图纸,以及用户的技术要求和工艺特点进行设计。
2.4投标方的二次设计必须使得整套系统符合CGMPs最新标准。
2.5整套系统应具备电子数据,电子签名,审计追踪功能3缩略语列表4适用的设备规范和标准4・1设备规范除本URS特殊要求外,还需电气及控制应符合IEC标准符合机械设备GB-52261-2002机械安全,机械电气设备第一部分:通用技术条件符合GB/T5226.1-2002、GB/T5226.1-2002,机械安全机械电气设备标准.符合GB150-1998钢制压力容器设计制造标准符合GB151-1999管壳式换热器标准符合GB/T4272-1992设备与管道保温技术通则符合JB4730压力容器无损检测标准符合HG20584-1998钢制化工容器制造技术要求符合压力容器安全技术监察规程符合中国安全环保标准(USP)符合国家计量标准或ISO标准参考ISPE工程指南第4卷-水和蒸汽系统4.2法规标准该设备应符合中国GMP(2010年修订)标准,同时参照欧盟GMP和美国FDA的cGMP要求。
纯蒸汽系统用户需求管理守则
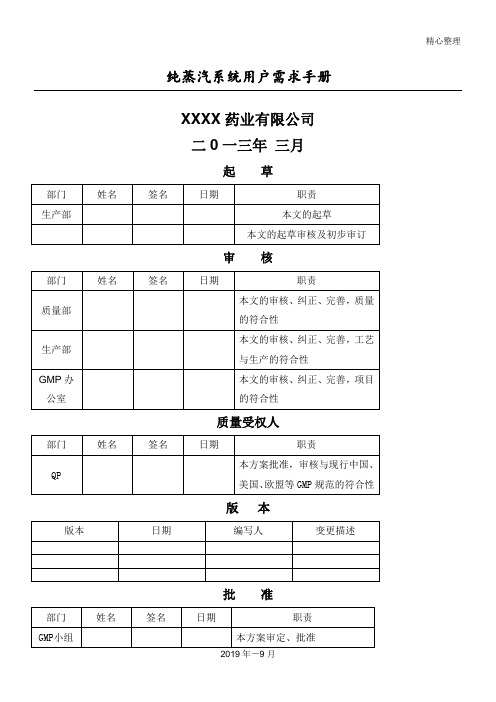
精心整理纯蒸汽系统用户需求手册
XXXX药业有限公司
二0一三年三月
起草
版本
批准
1.目的
2. 范围
3.设备标准
4.一般描述
5.工艺要求
5.1 产能:
5.2 水质要求
6.URS要求确认
6.1 总体要求
6.2 纯蒸汽发生器
6.3 分配系统
6.4 管件、阀门
6.5
6.6
6.7
6.8
6.9 文件
1.目的
该文件旨在从项目和系统的角度阐述用户的需求,主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。
本文件的解释权由XXXX药业有限公司综合车间负责。
2.范围
本文件的范围涉及到了XXXX药业有限公司对此设备的最低要求,供应商应将URS作为详细设计以及报价的基础。
供应商在设计、制造、组装、调试时必须要按照URS来执行。
本URS将作为合同的
附件及设备验收的依据。
3.设备标准
设备将符合以下国内指南/标准:
《机械设备安装工程施工及验收通用规范》;
《中华人民共和国药品管理法实施条例》;
《药品生产质量管理规范》(简称GMP2010年版);
《中国药典》2010版;国家相关EHS方面法规;
4. 一般描述。
药厂制水纯蒸汽URS

纯蒸汽发生器用户需求User Requirement Specifications编号:生效日期:XXX有限公司注:本文件描述为纯蒸汽发生器的工艺技术要求,请文件审核和批准人员仔细阅读,将意见和建议单独用颜色批注在当页,在本页签名即代表已审阅并批准本文件的每一页。
目录1.综述 (4)1.1目的 (4)1.2适用范围 (4)2.产品符合的标准及质量要求 (4)3.双方职责要求 (4)3.1供应商职责 (4)3.2XXX有限公司职责 (5)4.设备的系统要求 (6)4.1总体要求 (6)4.2具体要求 (6)4.2.1机械部分设计要求 (6)4.2.2 管道部分设计要求 (7)4.2.3 设备配置要求 (7)4.2.4 控制系统配置要求 (8)4.2.5电气要求 (10)4.2.6 EHS要求 (10)4.2.7 文件要求 (10)5.变更控制 (12)6投标其它要求 (12)6.1详述文件 (12)6.2测试 (12)6.3维护 (12)6.4培训 (13)6.5其它 (13)7.术语 (13)8.参考文献 (14)1.综述该项目为XXX有限公司纯蒸汽制备项目,纯蒸汽主要用于工艺管道、设备在线灭菌、脉动灭菌等,该项目要求最终纯蒸汽冷凝水质量稳定并且符合中国药典2010版质量标准。
系统本身符合中国最新版GMP。
1.1目的该文件的目的是为纯蒸汽发生器建立用户需求,明确纯蒸汽发生器验收可接收标准及所有设备的设计、制造、材质、控制方式、消毒方式、安装检查、包装及交付使用等具体要求,提出最低的质量要求及可接受标准,但不局限于以下。
该URS在移交给供应商之后,将意味着所有指定的要求被涵盖在供应商的供应范围之内,并作为后期验证的基础及依据。
1.2适用范围该URS仅适用于XXX有限公司榄香烯脂质体制剂项目。
此文件包含了纯蒸汽发生器制造必需的工艺,以及验证、文件系统、安装、运输等相关内容,并且将作为设备招标、采购、设计、构造、安装和确认过程中的参考文件。
纯蒸汽系统用户需求手册
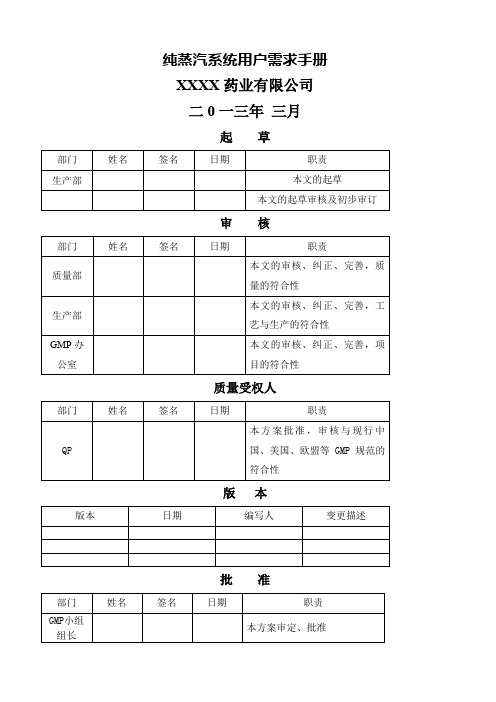
纯蒸汽系统用户需求手册XXXX药业有限公司二0一三年三月起草审核质量受权人版本批准目录1.目的2. 范围3.设备标准4.一般描述5.工艺要求5.1 产能:5.2 水质要求6.URS要求确认6.1 总体要求6.2 纯蒸汽发生器6.3 分配系统6.4 管件、阀门6.5 仪器、仪表6.6 材质要求6.7 控制系统6.8 其它要求6.9 文件纯蒸汽系统用户需求手册1.目的该文件旨在从项目和系统的角度阐述用户的需求,主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。
本文件的解释权由XXXX药业有限公司综合车间负责。
2.范围本文件的范围涉及到了XXXX药业有限公司对此设备的最低要求,供应商应将URS作为详细设计以及报价的基础。
供应商在设计、制造、组装、调试时必须要按照URS来执行。
本URS 将作为合同的附件及设备验收的依据。
3.设备标准设备将符合以下国内指南/标准:《机械设备安装工程施工及验收通用规范》;《中华人民共和国药品管理法实施条例》;《药品生产质量管理规范》(简称GMP2010年版);《中国药典》2010版;国家相关EHS方面法规;4. 一般描述本纯蒸汽系统主要包括纯蒸汽的制备、分配系统。
主要工艺流程:纯化水→预热器→蒸发器→纯蒸汽过滤器→干燥纯蒸汽→纯蒸汽使用点。
设备的操作可以进行自动和手动操作,设备运行稳定、安全。
5. 工艺要求:1.产能:>500 Kg/h2.要求:纯蒸汽温度: 137 (℃)纯蒸汽的冷凝水质量要求应符合中国药典(2010年版)注射用水的要求,其中关键标准为:电导率:≤0.8μS/cm (25℃)细菌内毒素:≤0.125EU/ml总有机碳含量(TOC) : ≤150 ppb原水为纯化水,符合2010版中国药典标准。
6.URS要求确认:应符合以下规定,但并不限于以下规定。
6.1 总体要求6. 2 纯蒸汽发生器6. 3 分配系统6. 4 管件、阀门6. 5 仪器、仪表6. 6 材质要求6. 7 控制系统6. 8 其它要求6. 9 文件。
【精品】纯蒸汽发生器urs(可编辑

纯蒸汽发生器U R S------------------------------------------作者------------------------------------------日期……………………………………………………………最新资料推荐…………………………………………………宏济堂阿胶药业纯蒸汽发生器系统用户需求User Requirement Specifications版次:A编号:URS-003生效日期:审核批准注:本文件所描述为纯蒸汽发生器系统的工艺技术要求,请文件审核和批准人员仔细阅读每一页后,将意见和建议单独附页在本文件后,在本页签名即代表已审阅并批准本文件的每一页。
目录1、简介 (2)1.1项目介绍 (2)1.2目的 (3)1.3文件概述 (3)1.4供应范围 (3)1.4项目标准 (3)1.5术语 (3)1.6参考书目 (2)1.7参考书目 (3)1.8对公用工程的要求 (3)2.总则 (5)2.1设计依据 (5)2.2质量 (6)2.3产量 (4)2.4总体要求 (4)2.5安全要求 (4)3.项目需求 (4)3.1工艺控制 (4)3.2仪器仪表 (6)3.3纯蒸汽发生器控制系统 (7)4.服务要求 (8)4.1包装运输要求 (8)4.2备品零件要求 (8)4.3安装 (8)4.2噪音水平 (8)5.维修 (9)6.验证和文件 (10)6.1验证 (10)6.2 FAT要求 (10)6.3文件 (12)7.服务和培训 (14)8.其他要求 (14)1、简介1.1 项目介绍该项目为**********药业的纯蒸汽发生器,纯蒸汽主要用于产品、设备、物料的灭菌和消毒等,该项目要求最终纯蒸汽质量稳定并且符合中国药典2010版质量标准。
除GMP法规外,还须满足中国环境保护法规、ISO14001,压力容器和特种设备的制造符合中国国家制造标准。
1.2目的本URS为用户需要采购的纯蒸汽发生器系统各项要求进行描述。
纯蒸汽发生器URS

精品文档宏济堂阿胶药业纯蒸汽发生器系统用户需求User Requirement Specifications版次:A编号:URS-003生效日期:审核批准注:本文件所描述为纯蒸汽发生器系统的工艺技术要求,请文件审核和批准人员仔细阅读每一页后,将意见和建议单独附页在本文件后,在本页签名即代表已审阅并批准本文件的每一页。
目录1、简介 (2)1.1项目介绍 (2)1.2目的 (2)1.3文件概述 (2)1.4供应范围 (2)1.4项目标准 (2)1.5术语 (2)1.6参考书目 (2)1.7参考书目 (3)1.8对公用工程的要求 (3)2.总则 (3)2.1设计依据 (3)2.2质量 (3)2.3产量 (4)2.4总体要求 (4)2.5安全要求 (4)3.项目需求 (4)3.1工艺控制 (4)3.2仪器仪表 (6)3.3纯蒸汽发生器控制系统 (7)4.服务要求 (8)4.1包装运输要求 (8)4.2备品零件要求 (8)4.3安装 (8)4.2噪音水平 (8)5.维修 (9)6.验证和文件 (10)6.1验证 (10)6.2 FAT要求 (10)6.3文件 (12)7.服务和培训 (14)8.其他要求 (14)1、简介1.1 项目介绍该项目为**********药业的纯蒸汽发生器,纯蒸汽主要用于产品、设备、物料的灭菌和消毒等,该项目要求最终纯蒸汽质量稳定并且符合中国药典2010版质量标准。
除GMP法规外,还须满足中国环境保护法规、ISO14001,压力容器和特种设备的制造符合中国国家制造标准。
1.2目的本URS为用户需要采购的纯蒸汽发生器系统各项要求进行描述。
供应商按照此文件进行设计、制造、检查和测试、包装、交付、安装调试、验收、培训和验证,并提供文件等。
供应商应保证该设备符合本文件要求及相关标准和规范。
1.3文件概述●本文旨在描述用户对纯蒸汽发生器系统设计的要求。
●本文旨在为供应商提供设计所需要的信息。
纯蒸汽系统用户需求管理守则

精心整理纯蒸汽系统用户需求手册
XXXX药业有限公司
二0一三年三月
起草
版本
批准
1.目的
2. 范围
3.设备标准
4.一般描述
5.工艺要求
5.1 产能:
5.2 水质要求
6.URS要求确认
6.1 总体要求
6.2 纯蒸汽发生器
6.3 分配系统
6.4 管件、阀门
6.5
6.6
6.7
6.8
6.9 文件
1.目的
该文件旨在从项目和系统的角度阐述用户的需求,主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。
本文件的解释权由XXXX药业有限公司综合车间负责。
2.范围
本文件的范围涉及到了XXXX药业有限公司对此设备的最低要求,供应商应将URS作为详细设计以及报价的基础。
供应商在设计、制造、组装、调试时必须要按照URS来执行。
本URS将作为合同的
附件及设备验收的依据。
3.设备标准
设备将符合以下国内指南/标准:
《机械设备安装工程施工及验收通用规范》;
《中华人民共和国药品管理法实施条例》;
《药品生产质量管理规范》(简称GMP2010年版);
《中国药典》2010版;国家相关EHS方面法规;
4. 一般描述。
纯蒸汽系统用户需求手册

纯蒸汽系统用户需求手册XXXX药业有限公司二0一三年三月起草审核质量受权人版本批准目录1.目的2. 范围3.设备标准4.一般描述5.工艺要求5.1 产能:5.2 水质要求6.URS要求确认6.1 总体要求6.2 纯蒸汽发生器6.3 分配系统6.4 管件、阀门6.5 仪器、仪表6.6 材质要求6.7 控制系统6.8 其它要求6.9 文件纯蒸汽系统用户需求手册1.目的该文件旨在从项目和系统的角度阐述用户的需求,主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。
本文件的解释权由XXXX药业有限公司综合车间负责。
2.范围本文件的范围涉及到了XXXX药业有限公司对此设备的最低要求,供应商应将URS作为详细设计以及报价的基础。
供应商在设计、制造、组装、调试时必须要按照URS来执行。
本URS将作为合同的附件及设备验收的依据。
3.设备标准设备将符合以下国内指南/标准:《机械设备安装工程施工及验收通用规范》;《中华人民共和国药品管理法实施条例》;《药品生产质量管理规范》(简称GMP2010年版);《中国药典》2010版;国家相关EHS方面法规;4. 一般描述本纯蒸汽系统主要包括纯蒸汽的制备、分配系统。
主要工艺流程:纯化水→预热器→蒸发器→纯蒸汽过滤器→干燥纯蒸汽→纯蒸汽使用点。
设备的操作可以进行自动和手动操作,设备运行稳定、安全。
5. 工艺要求:1.产能:>500 Kg/h2.要求:纯蒸汽温度: 137 (℃)纯蒸汽的冷凝水质量要求应符合中国药典(2010年版)注射用水的要求,其中关键标准为:电导率:≤0.8μS/cm (25℃)细菌内毒素:≤0.125EU/ml总有机碳含量(TOC) : ≤150 ppb原水为纯化水,符合2010版中国药典标准。
6.URS要求确认:应符合以下规定,但并不限于以下规定。
6.1 总体要求6. 2 纯蒸汽发生器6. 3 分配系统6. 4 管件、阀门6. 5 仪器、仪表6. 6 材质要求6. 7 控制系统6. 8 其它要求6. 9 文件。
纯蒸汽系统用户需求手册
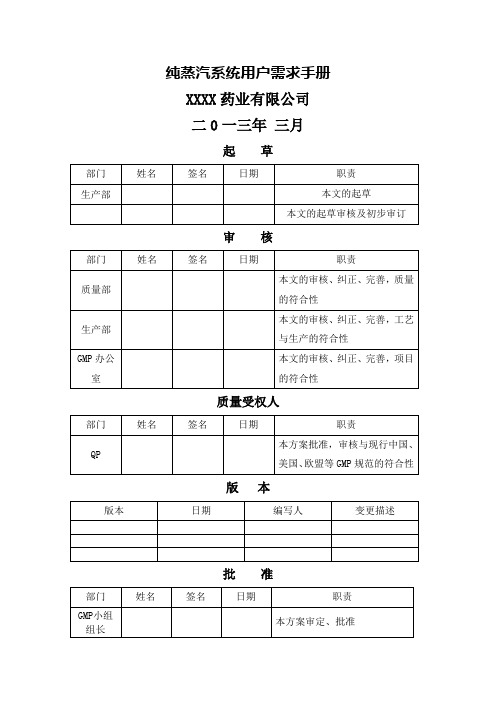
纯蒸汽系统用户需求手册XXXX药业有限公司二0一三年三月起草审核质量受权人版本批准目录1.目的2. 范围3.设备标准4.一般描述5.工艺要求5.1 产能:5.2 水质要求6.URS要求确认6.1 总体要求6.2 纯蒸汽发生器6.3 分配系统6.4 管件、阀门6.5 仪器、仪表6.6 材质要求6.7 控制系统6.8 其它要求6.9 文件纯蒸汽系统用户需求手册1.目的该文件旨在从项目和系统的角度阐述用户的需求,主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。
本文件的解释权由XXXX药业有限公司综合车间负责。
2.范围本文件的范围涉及到了XXXX药业有限公司对此设备的最低要求,供应商应将URS作为详细设计以及报价的基础。
供应商在设计、制造、组装、调试时必须要按照URS来执行。
本URS将作为合同的附件及设备验收的依据。
3.设备标准设备将符合以下国内指南/标准:《机械设备安装工程施工及验收通用规范》;《中华人民共和国药品管理法实施条例》;《药品生产质量管理规范》(简称GMP2010年版);《中国药典》2010版;国家相关EHS方面法规;4. 一般描述本纯蒸汽系统主要包括纯蒸汽的制备、分配系统。
主要工艺流程:纯化水→预热器→蒸发器→纯蒸汽过滤器→干燥纯蒸汽→纯蒸汽使用点。
设备的操作可以进行自动和手动操作,设备运行稳定、安全。
5. 工艺要求:1.产能:>500 Kg/h2.要求:纯蒸汽温度: 137 (℃)纯蒸汽的冷凝水质量要求应符合中国药典(2010年版)注射用水的要求,其中关键标准为:电导率:≤0.8μS/cm (25℃)细菌内毒素:≤ 0.125EU/ml总有机碳含量(TOC) : ≤ 150 ppb原水为纯化水,符合2010版中国药典标准。
6.URS要求确认:应符合以下规定,但并不限于以下规定。
纯蒸汽发生器URS

宏济堂阿胶药业纯蒸汽发生器系统用户需求User Requirement Specifications版次:A编号:URS-003生效日期:审核批准注:本文件所描述为纯蒸汽发生器系统的工艺技术要求,请文件审核和批准人员仔细阅读每一页后,将意见和建议单独附页在本文件后,在本页签名即代表已审阅并批准本文件的每一页。
目录1、简介 (2)1.1 项目介绍 (2)1.2 目的 (2)1.3 文件概述 (2)1.4 供应范围 (2)1.4 项目标准 (2)1.5 术语 (2)1.6 参考书目 (2)1.7 参考书目 (3)1.8 对公用工程的要求 (3)2. 总则 (3)2.1 设计依据 (3)2.2 质量 (3)2.3 产量 (4)2.4 总体要求 (4)2.5 安全要求 (4)3. 项目需求 (4)3.1 工艺控制 (4)3.2 仪器仪表 (6)3.3 纯蒸汽发生器控制系统 (7)4. 服务要求 (8)4.1 包装运输要求 (8)4.2 备品零件要求 (8)4.3 安装 (8)4.2 噪音水平 (8)5. 维修 (9)6. 验证和文件 (10)6.1 验证 (10)6.2 FAT 要求 (10)6.3 文件 (12)7. 服务和培训 (14)8. 其他要求 (14)1、简介1.1项目介绍该项目为 ********** 药业的纯蒸汽发生器, 纯蒸汽主要用于产品、 设备、 物料的灭菌和 消毒等,该项目要求最终纯蒸汽质量稳定并且符合中国药典2010版质量标准。
除 GMF 法规夕卜,还须满足中国环境保护法规、IS014001,压力容器和特种设备的制造符合中国国家制造 标准。
1.2 目的本URS 为用户需要采购的纯蒸汽发生器系统各项要求进行描述。
供应商按照此文件进行设计、制造、检查和测试、包装、交付、安装调试、验收、培训和验证,并提供文件等。
供 应商应保证该设备符合本文件要求及相关标准和规范。
1.3 文件概述本文旨在描述用户对纯蒸汽发生器系统设计的要求。
纯蒸汽发生器用户需求
纯蒸汽发生器用户需求目录1. 目的 (1)2. 适用范围 (1)3. 法律法规和国家标准 (1)4. 缩语 (1)5. 概述 (2)6. 用户要求(URS) (2)1.目的该文件旨在用户对纯蒸汽发生器的设计、材质、制造、控制、检查和测试、调试、文件、包装和交付的说明和最低要求,是构建起此设备和系统的文件体系的基础,同时也是设计和验证的可接受标准的依据。
供应商收到本URS,将表明所有的要求应在其技术文件(报价)中体现。
2.适用范围本URS中所描述纯蒸汽发生器仅适用于XXXX生产线。
3.法律法规和国家标准本文件要求的法规规范包括但不限于以下列出的文件,且所列文件版本均以现行版为准。
3.1 与GMP相关的法规要求:⏹中国2010版GMP相关规范文件⏹FDA 21 CFR Part 210&211相关规范文件⏹GAMP 5相关规范文件⏹ISPE制药工程指南相关规范文件⏹ASME BPE相关规范文件3.2 与工程相关的法规要求:⏹机械设备均应符合中国有关机械标准或用户接受的国际标准;⏹电器设备应符合IEC标准或用户接受的国际标准;⏹EHS、GEP、GDP等规范⏹GB-12265-90 机械防护安全要求气密性试验⏹GB 50093-2002自动化仪表工程施工及验收规范⏹GB 50236-1998现场设备、工业管道焊接工程施工及验收规范⏹GB5226 -2008机械电气安全机械电气设备⏹GBJ131-90《自动化仪表安装工程质量检验评定标准》⏹GB/T 13306-2011 标牌⏹GB/T 191-2008包装储运图示标志⏹JB/T20093-2007制药机械行业标准⏹TJ36-79工业企业设计卫生标准4.缩语[所有用户要求中出现的缩写]下表列出本文件中包含的所有缩写。
5.概述本URS中所描述纯蒸汽发生器符合中国2010版GMP及相关规范、标准要求,实际要求不限于此文件定义的内容。
6.用户要求(URS)6.1.设计要求6.2.功能技术要求6.3.文件要求[根据FAT、SAT、IQ、OQ、PQ验证文件,相关图纸、技术说明等提出要求]6.4.供应商要求[根据供应商资质等提出要求]6.5.安全要求[根据消防、人员健康、高温管道等提出要求]6.6.售后服务和维修要求[根据产品使用年限、维修内容等提出要求]。
纯蒸汽系统用户需求手册

纯蒸汽系统用户需求手册XXXX药业有限公司二0一三年三月起草审核质量受权人版本批准目录1.目的2. 范围3.设备标准4.一般描述5.工艺要求5.1 产能:5.2 水质要求6.URS要求确认6.1 总体要求6.2 纯蒸汽发生器6.3 分配系统6.4 管件、阀门6.5 仪器、仪表6.6 材质要求6.7 控制系统6.8 其它要求6.9 文件纯蒸汽系统用户需求手册1.目的该文件旨在从项目和系统的角度阐述用户的需求,主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。
本文件的解释权由XXXX药业有限公司综合车间负责。
2.范围本文件的范围涉及到了XXXX药业有限公司对此设备的最低要求,供应商应将URS作为详细设计以及报价的基础。
供应商在设计、制造、组装、调试时必须要按照URS来执行。
本URS将作为合同的附件及设备验收的依据。
3.设备标准设备将符合以下国内指南/标准:《机械设备安装工程施工及验收通用规范》;《中华人民共和国药品管理法实施条例》;《药品生产质量管理规范》(简称GMP2010年版);《中国药典》2010版;国家相关EHS方面法规;4. 一般描述本纯蒸汽系统主要包括纯蒸汽的制备、分配系统。
主要工艺流程:纯化水→预热器→蒸发器→纯蒸汽过滤器→干燥纯蒸汽→纯蒸汽使用点。
设备的操作可以进行自动和手动操作,设备运行稳定、安全。
5. 工艺要求:1.产能:>500 Kg/h2.要求:纯蒸汽温度: 137 (℃)纯蒸汽的冷凝水质量要求应符合中国药典(2010年版)注射用水的要求,其中关键标准为:电导率:≤0.8μS/cm (25℃)细菌内毒素:≤0.125EU/ml总有机碳含量(TOC) : ≤150 ppb原水为纯化水,符合2010版中国药典标准。
6.URS要求确认:应符合以下规定,但并不限于以下规定。
6.1 总体要求6. 2 纯蒸汽发生器6. 3 分配系统6. 4 管件、阀门6. 5 仪器、仪表6. 6 材质要求6. 7 控制系统6. 8 其它要求6. 9 文件。
纯蒸汽发生器用户需求教材
纯蒸汽发生器用户需求(URS)起草人签名:审核人签名:批准人签名:目录1 目的 (3)2 范围 (3)3 缩写列表 (3)4 法规和标准 (4)5 项目介绍 (4)5.1项目描述 (4)5.2工艺/流程描述 (4)6 物料 (5)7 用户及系统要求 (5)7.1性能要求 (5)7.2设备主体要求: (6)7.3设备运行监测及自动控制要求: (8)7.4安全与环保要求: (9)7.5计量要求 (9)7.6文件要求 (9)7.7验证/确认要求 (10)7.8培训验收 (10)7.9供应商对项目要求的确认 (10)8 附件 (10)9 记录 (11)1目的本用户需求文件旨在从项目和设备的角度阐述用户的需求,总括了用户对该项目的质量要求(GMP),描述了用户对该设备工作过程及功能的期望。
主要包括了相关法规符合度和用户的具体需求,这份文件是构建项目和系统的文件体系的基础,同时也是系统设计、订货和验证的可接受标准依据。
供应商应在规定的时间内完成并达到本用户需求的设计目标和可接受的质量标准。
2范围本文件的范围涉及到了对纯蒸汽发生器的设计、制造、材料、运输、包装、检查、测试、调试、运行、操作、维护、验证、文件和交付的说明和最低要求,供应商应以URS作为详细设计以及报价的基础。
供应商应对设备供应负责,同时配合用户完成IQ/OQ/PQ。
供应商在设计、制造、组装时必须要按照URS来执行。
设备应能够满足本文件所提要求。
供应商所提供文件应不少于本文中所列文件内容。
供应范围内应包含用户人员培训。
供应商需提供技术服务协议方案。
用户接受IQ/OQ/PQ 前,供应商应对所提供设备负有责任。
文件中“必须”条款,需供应商制造时必须达到部分,不可用其它技术代替。
“期望”条款,需供应商制造时可选用不同的技术,但最终需符合用户的需求。
3缩写列表4法规和标准4.1 《药品生产质量管理规范》2010年版。
4.2 国家现行相关行业标准及规范:《药品生产质量管理规范》(2010版)《中国药典》(2010版)《ISPE制药工程基本指南》第六卷、第九卷和第十卷关于注射用水系统设计、施工、仪表和控制、调试和验证的相关内容GAMP5《良好自动化生产实践指南》(第5版)中国药品生产验证指南5项目介绍5.1 项目描述本次需购买的纯蒸汽发生器用于玉溪九洲生物技术有限责任公司生产车间纯蒸汽供应保障。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
纯蒸汽系统用户需求手册
XXXX药业有限公司
二0 一三年三月
质量受权人
目录
1.目的
2.范围
3.设备标准
4.一般扌田述
5.工艺要求
5.1产能:
5.2水质要求
6.URS要求确认
6.1总体要求
6.2纯蒸汽发生器
6.3分配系统
6.4管件、阀门
6.5仪器、仪表
6.6材质要求
6.7控制系统
6.8其它要求
6.9文件
纯蒸汽系统用户需求手册
1. 目的
该文件旨在从项目和系统的角度阐述用户的需求,主要包括相关法规符合度和用户的具体需求,这份文件是构建起项目和系统的文件体系的基础,同时也是系统设计和验证的可接受标准的依据。
本文件的解释权由XXXX药业有限公司综合车间负责。
2. 范围
本文件的范围涉及到了XXXX9业有限公司对此设备的最低要求,供应商应将UR作为详细设计以及报价的基础。
供应商在设计、制造、组装、调试时必须要按照UR来执行。
本UR将作为合同的附件及设备验收的依据。
3. 设备标准
设备将符合以下国内指南/ 标准:
《机械设备安装工程施工及验收通用规范》;
《中华人民共和国药品管理法实施条例》;
《药品生产质量管理规范》(简称GMP201年版);
《中国药典》2010版;国家相关EHS方面法规;
4. 一般描述
本纯蒸汽系统主要包括纯蒸汽的制备、分配系统。
主要工艺流程:纯化水一预热器一蒸发器一纯蒸汽过滤器一干燥纯蒸汽一纯蒸汽使用点。
设备的操作可以进行自动和手动操作,设备运行稳定、安全。
5. 工艺要求:
1. 产能:>500 Kg/h
2. 要求:
纯蒸汽温度:137 (C)
纯蒸汽的冷凝水质量要求应符合中国药典(2010年版)注射用水的要求,其中关键标准为:
电导率:w 0.8 卩S/cm (25 C)
细菌内毒素:w 0.125EU/ml
总有机碳含量(TOC) : w 150 ppb
原水为纯化水,符合2010版中国药典标准。
6. URS要求确认:
应符合以下规定,但并不限于以下规定
6. 4管件、阀门
6. 6材质要求
6. 9文件。
