电脑联用测定无机盐溶解热
实验1 溶解热的测定 操作步骤

实验1 溶解热的测定注意事项:1.本实验应确保样品充分溶解,因此实验前必须充分研磨样品。
已进行研磨和烘干处理的样品位于靠窗口的烘箱中。
实验中每位同学使用完样品后必须及时研磨好足够的样品,并放入靠窗口的烘箱进行烘干处理,以备下一位同学使用。
2.硝酸钾加入快慢的控制,是实验成败的关键。
加得太快,会使温差过大,体系与环境的热交换加快,测得的溶解热偏低,另外加样太快会致使磁子陷住不能正常搅拌。
加得太慢,一旦温度升到一个较高的值,即使加入所有硝酸钾也无法使温差回到零度以下,导致实验失败。
一般ΔT控制在-0.3℃左右为宜,最低不要超过-0.5℃,但要始终为负值。
实验中要时刻注意温差的变化,掌握好加料的时间和量。
在每组实验完后,温差回升到0℃以上,此时升温较快,需要及时加入较多的硝酸钾,否则温差可能再无法回到负值。
3.实验时需控制合适的搅拌速度。
搅拌太快,会以功的形式向系统中引入能量;搅拌太慢,会因水的传热性差而导致Q s值偏低,而且硝酸钾难以完全溶解,若实验结束发现有未溶解的硝酸钾,应重做实验。
4.数据采集过程中,切记不要进行任何其它操作,否则需要重新采集数据。
5.将仪器放置在无强电磁场干扰的区域内。
6.不要将仪器放置在通风的环境中,尽量保持仪器附近的气流稳定。
实验步骤:1.称硝酸钾26 g。
(已进行研磨和烘干处理),放入干燥器中。
2.将8个称量瓶编号。
在台称上称量,依次加入约2.5、1.5、2.5、3.0、3.5、4.0、4.0、和4.5 g硝酸钾,再用分析天平称出准确数据,把称量瓶依次放入干燥器中待用。
3.量取200 mL去离子水于保温杯内,打开反应热测量数据采集接口装置的电源,将温度传感器擦干置于空气中,预热3 min,但不要打开恒流源及搅拌器电源。
4.4个菜单项:1)参数矫正;2)开始实验;3)数据处理;4)退出。
1)参数矫正参数矫正菜单中有‘电压参数矫正’和‘电流参数矫正’两个子菜单项,电压参数和电流参数一般情况下不需矫正。
溶解热的测定物理化学实验

遵守处理规范
严格按照废弃物处理规范进行处 理,确保废弃物得到安全、环保
的处理。
关注环保要求
在实验过程中,应关注环保要求, 尽量减少实验对环境的污染。
06 实验总结与展望
本次实验收获总结
掌握了溶解热的测定方法
通过本次实验,我们熟练掌握了使用量热计测定物质溶解热的方 法,了解了实验原理和操作技巧。
拓展应用范围
我们可以将溶解热的测定方法应用于其他物质,比较不同物质之间 的溶解热差异,为材料科学、化学工程等领域的研究提供参考。
开发新型量热计
随着科技的发展,我们可以尝试开发更加精确、快速、便捷的量热计, 提高溶解热测定的效率和准确性。
提高实验准确性和可靠性的建议
精确控制实验条件
在实验过程中,我们应严格控制实 验条件,如温度、压力、物质纯度
分析了实验数据
我们成功获得了实验数据,并通过对数据的分析,得出了有关物质 溶解热的结论。
培养了实验技能
在实验过程中,我们提高了自己的实验操作能力、数据处理能力和 分析问题的能力。
对未来研究方向的展望
深入研究溶解热理论
我们可以进一步研究溶解热的理论模型,探索影响溶解热的因素, 为相关领域的研究提供理论支持。
04 实验结果与讨论
溶解热测定结果展示
溶解热数据表格
列出了不同物质在不同温度下的溶解 热数值,直观地展示了溶解热与物质 种类、温度等因素的关系。
溶解热曲线图
通过绘制溶解热随温度变化的曲线图 ,可以更加清晰地看出溶解热随温度 的变化趋势,便于进行数据分析和比 较。
结果误差分析
实验操作误差
由于实验过程中操作不当或仪器精度限制等原因,可能导致实验结果存在一定 的误差。例如,温度测量不准确、样品质量称量误差等都会对实验结果产生影 响。
物化实验思考题答案

本学期物化实验要做十五个,实验室地点和实验思考题答案如下:计算机联用测定无机盐溶解热实验4楼2051温度和浓度对溶解热有无影响?溶解热指在一定温度及压力下(通常是温度为298K,压力为100kPa的标准状态),一摩尔的溶质溶解在大体积的溶剂时所发出或吸收的热量。
在等压状态下,溶解热等同于焓值的变化,因此也被称为溶解焓。
焓是只是温度的函数因此温度对溶解热有关,浓度无关。
2本实验为什么要测量体系的热熔?减少由体系吸收热量儿产生的误差。
3可否用本实验仪器用于测其他反应(中和热)?可以。
金属钝化曲线测定实验4楼2011、参见实验原理。
2、研究电极与辅助电极组成电解池,测定极化电流值;研究电极与参比电极组成原电池,测定极化过程中研究电极的电势变化值(因为此原电池通过的电流极小,故参比电极的电极电势变化极小,测得的电势变化值即为研究电极的电势变化值)。
在恒电位仪中,电位是自变量,电流是因变量。
3、B点为活性溶解区转化为钝化过渡区的转折点,阳极开始钝化;C点为由钝化过渡区转入钝化稳定区的转折点,阳极进入维钝状态;D点开始为超钝化现象,随着电势的增加,钝化的金属表面发生了另一种电化学反应(O2的析出)。
4、由金属钝化曲线示意图可知,若用恒电流法测量时,同一电流对应着若干个电极电势值。
测量过程中随着电流值的增加只能测得AB段,而测不到BCD段。
电流超过B点后电位产生突跃,故得不到完整的曲线。
溶液表面张力测定实验4楼105提示:毛细管尖端若不与液面相切插入一定深度,会引起表面张力测定值偏小。
5. 哪些因素影响表面张力测定的结果?如何减小或消除这些因素对实验的影响?提示:温度、气泡逸出速度、毛细管是否干净及毛细管的尖端是否与液面相切会影响测定结果。
减小或消除这些因素引起误差的措施是:恒温、控制气泡逸出速率恒定、毛细管干净以及毛细管与液面相切。
6.毛细管尖端为何必须调节得恰与液面相切? 如果毛细管端口插入液面有一定深度,对实验数据有何影响?答:如果将毛细管末端插入到溶液内部,毛细管内会有一段水柱,产生压力Pˊ,则测定管中的压力Pr会变小,△pmax会变大,测量结果偏大。
实验三溶解热的测定

实验三溶解热的测定1 实验目的及要求1.了解电热补偿法测定热效应的基本原理。
2.通过用电热补偿法测定硝酸钾在水中的积分溶解热,并用作图法求出硝酸钾在水中的微分冲淡热,积分冲淡热和微分溶解热。
2实验原理1)物质溶解于溶剂过程的热效应称为溶解热。
它有积分溶解热和微分溶解热两种。
前者指在定温定压下把1摩尔溶质溶解在n摩尔的溶剂中时所产生的热效应,由于过程中溶液的浓度逐渐改变,因此也称为变浓溶解热以Q表示。
后者指在定温定压下把1摩尔溶质溶解在无限量的某一定浓度的溶液中所产生的热效应。
由于在溶解过程中溶液浓度可实际上视为不变,因此也称为定浓溶解热,以表示。
把溶剂加到溶液中使之稀释,其热效应称为冲淡热。
它有积分(或变浓)冲淡热和微分(或定浓)冲淡热两种。
通常都以对含有1摩尔溶质的溶液的冲淡情况而言。
前者系指在定温定压下把原为含1摩尔溶质和n01摩尔溶剂的溶液冲淡到含溶剂为n02时的热效应,亦即为某两浓度的积分溶解热之差,以Q d表示。
后者系1摩尔溶剂加到某一浓度的无限量溶液中所产生的热效应,以2)积分溶解热由实验直接测定,其它三种热效应则可通过Q s~n0曲线求得:设纯溶剂、纯溶质的摩尔焓分别为和,溶液中溶剂和溶质的偏摩尔焓分别为和,对于n1摩尔溶剂和n2摩尔溶质所组成的体系而言,在溶剂和溶质未混合前(4.1)当混合成溶液后(4.2)因此溶解过程的热效应为(4.3)式中△H1为溶剂在指定浓度溶液中溶质与纯溶质摩尔焓的差。
即为微分溶解热。
根据积分溶解热的定义:(4.4)所以在Q s~n01图上,不同Q s点的切线斜率为对应于该浓度溶液的微分冲淡热,即该切线在纵坐标的截距OC,即为相应于该浓度溶液的微分溶解热.而在含有1摩尔溶质的溶液中加入溶剂使溶剂量由n02摩尔增至n01摩尔过程的积分冲淡热Q d=(Q s)n01一(Q s)n02= BG—EG。
3)本实验测硝酸钾溶解在水中的溶解热,是一个溶解过程中温度随反应的进行而降低的吸热反应。
溶解热的测定预习报告
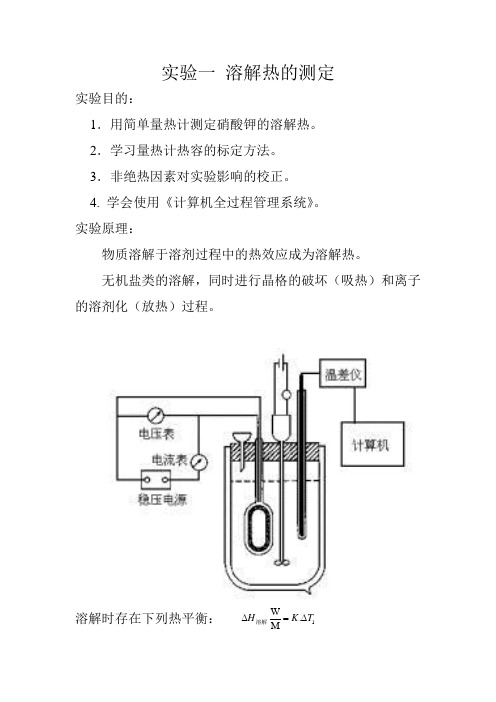
实验一 溶解热的测定实验目的:1.用简单量热计测定硝酸钾的溶解热。
2.学习量热计热容的标定方法。
3.非绝热因素对实验影响的校正。
4. 学会使用《计算机全过程管理系统》。
实验原理:物质溶解于溶剂过程中的热效应成为溶解热。
无机盐类的溶解,同时进行晶格的破坏(吸热)和离子的溶剂化(放热)过程。
溶解时存在下列热平衡: 1.M W T K H ∆=∆溶解溶解完成后,采用电标定,用电加热器,则存在下列热平衡: 结合上面两式: 1.由于在此两过程中,体系温度变化小,一般在1度左右。
必须使用贝克曼温度计或精密电子温差仪,才能读到千分位,达到实验的要求。
2.也可以使用热敏电阻作为测温元件,它作为直流电桥的一个臂。
热敏电阻因温度变化而电阻发生变化,电桥即有电势输出。
用自动平衡记录仪记录,或经放大后由计算机采集,用无纸记录仪记录。
仪器与试剂500 ml 杜瓦瓶,装配有加热电炉丝和固体试样加料漏斗;2.T K IVt ∆=21T T IVt W M H ∆∆∆=溶解贝克曼温度计或精密温差仪或测温热电阻(配置电桥);电磁(或电动)搅拌仪;直流稳压电源(0~30V,0~2A);直流电流表(0.5级,0~1.5A);直流电压表(0.5级,0~10V);500ml量筒;停表(用记录仪记录不需要)记录仪;分析纯硝酸钾实验步骤:1.杜瓦瓶中用量筒加450 ml水(蒸馏水),装置好量热计,开启搅拌。
调节输出为0,开启记录仪,记录体系温度稳定过程。
2. 分析天平称取硝酸钾(前先碾成细粉,约3.3g),在量热计温度稳定3~5分钟后,从加料漏斗加入,记录仪记录过程温度变化。
注意,加料漏斗加料前后应加盖,以减少体系与环境的热交换。
3. 待温度没有明显变化后约3分钟停止记录。
4. 电标定过程与上述溶解过程类似操作,即分为标定前期、标定期和标定后期。
电标定时加热电压约6~8V,电流约0.6~0.8A(此项调节应在实验前进行,控制加热功率,使体系在2~3分钟内升高约1度)。
溶解热的测定

溶解热的测定同组实验者:实验日期:5.7提交报告日期:5.14带班助教姓名:一、引言(实验目的/原理)具体操作变动点:①由实验开始前并没有调节水的温度使之尽可能接近室温,而是通过水温不变说明溶剂和外界环境不存在热交换。
②实验过程中并没有严格保证体系稳定后继续记录4分钟或八分钟,而是在观察到数据平衡后即可进行下一步实验。
二、实验操作2.1 实验药品、仪器型号及测试装置示意图仪器:保温瓶(750ml)*1、磁力搅拌器、热敏电阻测温装置*1、加热器、直流稳压稳流电源、万用电表、秒表、容量瓶(500ml)、温度计、研体、称量瓶、分析天平。
药品:KNO3(AR)。
2.2 实验条件室内温度:18.9℃湿度:30% 压力:100.95kPa2.3 实验操作步骤及方法要点1.搭装置,要求装置绝热性能良好。
2.连电路,将加热电源、保温瓶内加热电阻、万用表串联起来。
加热电源先不要开。
3.用去离子水冲洗保温瓶,然后量取500 mL去离子水注入保温瓶中。
开动搅拌器。
用惠斯通电桥将M400软件第一路值调到0(让当前温度对应0)左右,待温度基本稳定后,记录约4 min。
4.打开电源开关,设定电源输出的电压值(20 V以上)和电流值(0.95 A)。
5.按下电源的“输出”按键,开始加热,电流以万用表上的值为准,温度上升至2时(以无纸记录仪上显示的数值为准)停止加热。
待温度稳定后再记录一段时间。
注意加热会有余温。
6.在保温瓶中加入5 g研细的KNO3。
由于KNO3溶解吸热,温度降低,待温度稳定后再记录8 min 左右。
本实验采用称量瓶装样品,直接倒入。
由减量法求出样品质量,归零。
7.按下电源的“输出”按键,开始加热,同时打开秒表计时。
输出电压升至多少时停止加热,应根据下次加入KNO3的量估算(以尽量减小和外界的热交换带来误差)。
停止加热,同时停止计时,记下加热时间。
待温度稳定后再记录一段时间。
8.按上述步骤依次加入约6 g、7 g、8 g、8 g、7 g和6 gKNO3。
溶解热的测定实验操作流程

溶解热的测定实验操作流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!溶解热的测定实验操作流程如下:1. 准备实验仪器和药品:量热计、温度计、搅拌器、电子天平、硝酸钾(分析纯)、蒸馏水等。
溶解热的测定

实验课程名称:物理化学实验实验日期:实验人:班级:指导教师:室温:18.1℃【实验目的】1.用简单量热计测定硝酸钾的溶解热。
2.学习量热计热熔的标定方法。
3.非绝热因素对实验影响的校正。
4.学会使用《计算机全过程管理系统》【实验原理】无机盐类的溶解往往同时进行着两个过程:一是晶格破坏,为吸热过程;二是离子的溶剂化,为放热过程。
溶解热是这两种热效应的总和。
最终是吸热还是放热,则由这两种热效应的相对大小来决定,将杜瓦瓶看做绝热体系,当盐溶于水中时,有热平衡:△H溶解W/M=K△T1(K为量热计热容)电标定时用电加热器加热,有平衡:IVt=K△T2由此得△H溶解=M/W IVt △T1/△T2在此两过程中,体系温度变化小,需使用精密电子温差仪。
溶解热测定装配图1.磁力搅拌器;2.搅拌磁子;3.杜瓦瓶;4.漏斗;5.传感器;温度仪.【仪器与药品】500ml杜瓦瓶,装配有加热电炉丝和固体试样加料漏斗;精密温差仪;电磁搅拌仪;直流稳压电源;直流电流表;500mL量筒;记录仪;分析纯硝酸钾。
【实验步骤】1、杜瓦瓶中加500mL水,装好量热计,开启搅拌,调节输出为0,开启记录仪,记录体系温度稳定过程。
2、称取硝酸钾细粉3.3g,在量热计稳定3分钟后,从加料漏斗加料,记录仪记录过程温度变化。
加料前后漏斗加盖。
3、待温度没有明显变化后3分钟停止记录。
4、电标定过程,分为标定前期,标定期和标定后期。
标定时加热电压约6v,电流约0.6A,记录好通电到断电的加热时间,当体系升温幅度将近溶解降温幅度时,断开电源,记录继续,直到温度上升趋势与标定前期相似为止。
【数据记录与处理】一.溶解过程温度变化:时间(分) 温差.05 0.000.22 0.000.38 0.000.55 0.001.72 0.000.88 0.0011.05 0.0021.22 0.0041.38 0.0041.55 0.0031.72 0.0061.88 0.0052.05 0.0072.22 0.0082.38 0.0082.55 0.0102.72 0.0092.88 0.0103.05 0.0103.22 -0.0213.38 -0.1953.55 -0.4203.72 -0.4853.88 -0.5084.05 -0.5114.22 -0.5104.38 -0.5084.55 -0.5074.72 -0.5064.88 -0.5055.05 -0.5045.22 -0.5025.38 -0.5015.55 -0.4995.72 -0.4975.88 -0.4966.05 -0.4956.22 -0.4946.38 -0.4936.55 -0.4926.72 -0.4906.88 -0.4887.05 -0.4867.22 -0.4857.38 -0.4847.55 -0.4837.72 -0.4827.88 -0.4808.05 -0.4798.22 -0.476溶解前0-3分08秒,溶解中3分08秒-3分50秒,溶解后3分50秒-8分17秒.开始3分钟左右加硝酸钾.....溶解过程温差:0.528二.电标定过程温度变化:时间(分) 温差.05 0.000.22 0.000.38 0.001.55 0.002.72 0.004.88 0.0051.05 0.0061.22 0.0071.38 0.0081.55 0.0091.72 0.0101.88 0.0102.05 0.0112.22 0.0122.38 0.0132.55 0.0142.72 0.0162.88 0.0163.05 0.0183.22 0.0263.38 0.0213.55 0.0273.72 0.0343.88 0.0444.05 0.0574.22 0.0714.38 0.0874.55 0.1034.88 0.1395.05 0.158 5.22 0.175 5.38 0.194 5.55 0.214 5.72 0.2325.88 0.2496.05 0.268 6.22 0.290 6.38 0.305 6.55 0.325 6.72 0.3456.88 0.3667.05 0.387 7.22 0.408 7.38 0.427 7.55 0.445 7.72 0.4627.88 0.4868.05 0.486 8.22 0.497 8.38 0.507 8.55 0.516 8.72 0.5238.88 0.5309.05 0.537 9.22 0.542 9.38 0.548 9.55 0.552 9.72 0.5579.88 0.56110.05 0.565 10.22 0.569 10.38 0.572 10.55 0.577 10.72 0.58010.88 0.58511.05 0.586 11.22 0.589 11.38 0.592 11.55 0.594 11.72 0.597 11.88 0.59912.22 0.60412.38 0.60712.55 0.60912.72 0.61112.88 0.61313.05 0.61513.22 0.61713.38 0.62013.55 0.62113.72 0.62313.88 0.62814.05 0.62514.22 0.62814.38 0.63014.55 0.63114.72 0.63314.88 0.63515.05 0.63615.22 0.63715.38 0.63815.55 0.64015.72 0.64215.88 0.643电标定过程温差:0.506据有关资料,硝酸钾的溶解热在浓度0.073附近,温度在12.5---25℃,可用下式表示:△H溶解=34.99-0.157(t-25)Kj.mol-1即实验理论值为△H溶解理=34.99-0.157*(18.1-25)=36.0733实验值△H溶解实=I.V.t.DT2/DT1ML/m/1000=1.15*5.96*300*0.506/0.528*101.102/3 .3/1000=60.3709误差=(60.3709-36.0733)/36.0733=67.36%六、注意事项1、仪器要先预热,以保证系统的稳定性。
物理化学实验报告 溶解热的测定

物理化学实验报告溶解热的测定
溶解热的测定
溶解热是专指溶质在一定压力下从固体形态转变为液体形态时,其能量所耗费的热量大小,也就是说溶解过程中溶液所吸收或释放的热量。
本次实验以NaCl为溶质,采用盐酸与碳酸钠溶液混合液体的方式,来测定它在溶解过程中的溶解热。
实验环境、设备及试剂
本实验室使用的温度测定设备为“风冷式热量卡尔托热量计”,溶质的试剂为氯化钠。
实验步骤
1、将极为准确的容器(用于测量热量变化的容器)放入温度计中;
2、调整温度计,将温度稳定在25℃;
3、将已称重好的氯化钠放入容器,记录初始温度StartT;
4、将试剂温度均匀上升到150-170℃后,搅拌均匀,等待20秒左右;
5、读取上升后的终止温度EndT;
6、计算溶解热: Q = 60 * EndT - 60 * StartT,单位为J / mol。
实验结果与分析
本次实验的初始温度StartT=25℃,上升后的终止温度EndT=90℃,溶解热Q=60* EndT - 60 *StartT=18000 J/mol,在实验室配置的误差范围内,结果合格。
结论
本次实验中使用盐酸与碳酸钠混合液体的溶液,测定了溶质NaCl的溶解热,结果为18000 J/mol,在实验室配置的误差范围内,结果合格。
【毕业论文】溶解热的测定

补充实验一 溶解热的测定一、目的1、了解电热补偿法测定热效应的基本原理及仪器使用。
2、测定硝酸钾在水中的积分溶解热,并用作图法求得其微分稀释热、积分稀释热和微分溶解热。
3、初步了解计算机采集处理实验数据、控制化学实验的方法和途径。
二、基本原理1、物质溶解于溶剂过程的热效应称为溶解热。
它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。
前者是1 mol 溶质溶解在n 0 mol 溶剂中时所产生的热效应,以Q s 表示。
后者是1 mol 溶质溶解在无限量某一定浓度溶液中时所产生的热效应,即0,,s T p n Q n ∂⎛⎫ ⎪∂⎝⎭。
溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
前者是把原含1 mol 溶质和n 01 mol 溶剂的溶液稀释到含溶剂n 02 mol 时所产生的热效应,以Q d 表示,显然,Q d = Q s ,n02 – Q s ,n01。
后者是1 mol 溶剂加到无限量某一定浓度溶液中时所产生的热效应,即0,,s T p nQ n ⎛⎫∂ ⎪∂⎝⎭。
2、积分溶解热由实验直接测定,其它三种热效应则需通过作图来求:设纯溶剂、纯溶质的摩尔焓分别为H *m ,A 和H *m ,B ,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为H m ,A 和H m ,B ,若由n A mol 溶剂和n B mol 溶质混合形成溶液,则混合前的总焓为 H = n A H *m ,A + n B H *m ,B混合后的总焓为 H ΄ = n A H m ,A + n B H m ,B此混合(即溶解)过程的焓变为 ΔH = H ΄ – H = n A (H m ,A – H *m ,A )+ n B (H m ,B – H *m ,B ) = n A ΔH m ,A + n B ΔH m ,B根据定义,ΔH m ,A 即为该浓度溶液的微分稀释热,ΔH m ,B 即为该浓度溶液的微分溶解热,积分溶解热则为: ,,0,,A s m A m B m A m BB B n H Q H H n H H n n ∆==∆+∆=∆+∆ 故在Q s ~ n 0图上,某点切线的斜率即为该浓度溶液的微分稀释热,截距即为该浓度溶液的微分溶解热。
物理化学实验溶解热的测定

下一内容
回主目录
返回
物理化学实验—溶解热的测定
二、三人同时操作。1人采零,按锁定;1人点“开始计时” ,同时记下“标准北京时间”;1人加料。
上一内容
下一内容
回主目录
返回
物理化学实验—溶解热的测定
注意
软件操作中 串口设置为:COM1
在温差=-0.001时,加入下一个样品
上一内容
下一内容
(Ⅱ-2-16)
本实验采用电热补偿法,测定KNO3在水溶液中的积分溶 解热,并通过图解法求出其它三种热效应。
上一内容 下一内容 回主目录
返回
物理化学实验—溶解热的测定
四、仪器药品
微型计算机
SWC-RJ溶解热测定装置 WLS-2型可调式恒流电源(1A,0V~ 15V) 速度可调磁力搅拌器 1.仪器
含溶剂为n02时的热效应,亦即为某两浓度溶液的积分溶解热之差,以
Qd
表示。
微分冲淡热:在恒温恒压下,一摩尔溶剂加入某一确定浓度的无限量的 Q 溶液中产生的热效应,以 Q
n 1 T , P ,n2 表示,简写为
n 1 n2
。
上一内容
2.每次样品的加入。
3.搅拌速度宜快。
注意
上一内容
下一内容
回主目录
返回
物理化学实验—溶解热的测定
六、注意事项
1.实验过程中要求I、V值恒定,故应随时注意调节。 2.搅拌速度宜快。
3.固体KNO3易吸水,故称量和加样动作应迅速。固体KNO3在实验前务
必研磨成粉状,并在110℃烘干。 4.量热器绝热性能与盖上各孔隙密封程度有关,实验过程中要注意盖好 ,减少热损失。 5.记下每次加入样品的时间(时,分,秒)
物化实验报告:溶解热的测定-KCl、KNO3

物化实验报告:溶解热的测定-KCl、KNO3华南师范大学实验报告课程名称 物理化学实验 实验项目 溶解热的测定【实验目的】1.用量热计简单测定硝酸钾在水中的溶解热。
2.掌握贝克曼温度计的调节和使用。
【实验原理】盐类的溶解往往同时进行着两个过程:一是晶格破坏,为吸热过程;二是离子的溶剂化,为放热过程。
溶解热是这两种热效应的总和。
最终是吸热还是放热,则由这两种热效应的相对大小来决定。
本实验在定压、不做非体积功的绝热体系中进行时,体系的总焓保持不变,根据热平衡,即可计算过程所涉及的热效应。
T C C W C W W M H m sol ∆⋅++-=∆][322111)( (3.1)式中: m Sol H ∆为盐在溶液温度和浓度下的积分溶解热,单位:kJ ·mo1–1;1W 为溶质的质量,单位:kg ;T ∆为溶解过程的真实温差,单位:K ;2W 为水的质量,单位:kg ;M 为溶质的摩尔质量,单位:kg ·mo1–1;21C C 、分别为溶质和水的比热,单位:11--⋅K kg kJ ;温度3C 为量热计的热容(指除溶液外,使体系升高1℃所需要的热量) ,单位:kJ 。
图3.1溶解热测定装配图实验测得W 1、W 2、ΔT 及量热计的热容后,即可按(3.1)式算出熔解热m Sol H 。
【仪器与药品 】溶解热测量装置一套(如图3.1所示);500ml 量筒一个;KCl(A.R.) ;KNO 3(A.R.)【实验步骤】1.量热计热容的测定:本实验采用氯化钾在水中的溶解热来标定量热计热容3C 。
为此,先在干净的量热计中装入500m1蒸馏水,将与贝克曼温度计接好的传感器插入量热计中,放在磁力搅拌器上,启动搅拌器, 保持60-90转/分钟的搅拌速度,此时,数字显示应在室温附近,至温度变化基本稳定后,每分钟准确记录读数一次,连续8次后,打开量热计盖,立即将称量好的10克氯化钾(准确至0.01克)迅速加入量热计中,盖上盖,继续搅拌,每分钟记录一次读数,读取12次即可停止。
溶解热测定实验报告

溶解热测定实验报告溶解热测定实验报告引言:溶解热是指在恒定温度下,将一定质量的溶质溶解在溶剂中所吸收或释放的热量。
溶解热的测定对于理解物质的溶解过程、研究物质的溶解性质以及工业生产中的溶解过程控制等方面具有重要意义。
本实验旨在通过测定氯化铵在水中的溶解热,探究溶解热的测定方法和影响因素。
实验原理:溶解热的测定方法有多种,其中最常用的是容量法和热量计法。
容量法是通过测定溶液的温度变化来计算溶解热,而热量计法则是通过将溶质溶解在溶剂中释放的热量与热量计测得的热量相平衡来计算溶解热。
实验步骤:1.首先,准备好所需的实验器材,包括热量计、量筒、温度计等。
2.称取一定质量的氯化铵固体,放入热量计中。
3.用量筒量取一定体积的水,并将水加入热量计中,使氯化铵完全溶解。
4.记录下溶解过程中的温度变化,并观察是否有放热或吸热现象。
5.根据实验数据,计算出氯化铵在水中的溶解热。
实验结果与讨论:在实验过程中,我们观察到氯化铵溶解的过程中有放热现象,即溶解过程是放热反应。
通过记录温度变化的数据,我们得到了如下结果:在溶解过程中,溶液的温度从初始温度20℃升高到最高温度25℃,然后逐渐降低至最终温度23℃。
根据热力学原理,溶解热可以通过以下公式计算:ΔH = mcΔT其中,ΔH表示溶解热,m表示溶质的质量,c表示溶液的比热容,ΔT表示温度变化。
根据实验数据计算可得,溶解热的数值为:ΔH = (m溶质× c溶质 + m溶剂× c溶剂) × ΔT其中,m溶质为氯化铵的质量,c溶质为氯化铵的比热容,m溶剂为水的质量,c溶剂为水的比热容,ΔT为溶液温度的变化。
通过实验数据计算,我们得到氯化铵在水中的溶解热为X J/g。
实验误差与改进:在实验过程中,由于实验器材的精度和环境条件的影响,可能会导致实验结果存在一定的误差。
为了减小误差,我们可以采取以下改进措施:1.提高实验器材的精度,如使用更精确的量筒和温度计。
溶解热的测定

实验三溶解热的测定1引言物质溶于溶剂中,一般伴随有热效应的发生。
盐类的溶解通常包含着几个同时进行的过程:晶格的破坏、离子或分子的溶剂化、分子电离(对电解质而言)等。
热效应的大小和符号决定于溶剂及溶质的性质和它们的相对量。
在热化学中,关于溶解过程的热效应,需要了解以下几个基本概念。
溶解热在恒温恒压下,溶质B 溶于溶剂A(或溶于某浓度溶液)中产生的热效应,用 表示。
摩尔积分溶解热在恒温恒压下,1mol 溶质溶解于一定量的溶剂中形成一定浓度的溶液,整个过程产生的热效应。
用 表示。
sol sol m B HH n ∆∆=(1)式中, 为溶解于溶剂A 中的溶质B 的物质的量。
摩尔微分溶解热在恒温恒压下,1mol 溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以表示,简写为。
稀释热在恒温恒压下,一定量的溶剂A 加到某浓度的溶液中使之稀释,所产生的热效应。
摩尔积分稀释热在恒温恒压下,在含有1mol 溶质的溶液中加入一定量的溶剂,使之稀释成另一浓度的溶液,这个过程产生的热效应,以 表示。
21dil m sol m sol m H H H ∆=∆-∆(2)式中, 、 为两种浓度的摩尔积分溶解热。
摩尔微分稀释热在恒温恒压下,1mol 溶剂加入到某一浓度无限量的溶液中所发生的热效应,以表示,简写为。
在恒温恒压下,对于指定的溶剂A 和溶质B ,溶解热的大小取决于A 和B 的物质的量即 (3)由(3)式可推导得:,,,,()()B Asol sol sol A T P n B T P n A BH HH n n n n ∂∆∂∆∆=+∂∂(4)或,,,,()()B A sol sol A sol m T P n T P n B A BHH n H n n n ∂∆∂∆∆=+∂∂(5)令 ,(5)改写为:0,,,,()()B Asol sol sol m T P n T P n A BH HH n n n ∂∆∂∆∆=+∂∂(6)(6)式中的可由实验测定,由实验中所用的溶质和溶剂的物质的量计算得到。
计算机联用测定无机盐溶解热实验报告

计算机联用测定无机盐溶解热实验报告计算机联用测定无机盐溶解热实验报告引言:无机盐的溶解热是指在标准状态下,将一定质量的无机盐溶解在溶剂中所释放或吸收的热量。
溶解热是无机化学中重要的物理量之一,对于理解溶解过程和热力学性质具有重要意义。
本实验旨在通过计算机联用测定的方法,测定无机盐的溶解热,并探究其与溶解度之间的关系。
实验原理:根据热力学第一定律,物质的内能变化等于吸热与放热的代数和。
在无机盐溶解过程中,溶解热可以表示为:ΔH = Q/m其中,ΔH为溶解热,Q为释放或吸收的热量,m为溶解物质的质量。
实验步骤:1. 准备工作:根据实验要求,称取一定质量的无机盐样品。
2. 实验装置:将称取好的无机盐样品放置于热量计中,保持实验装置的密封性。
3. 计算机联用测定:通过计算机软件控制热量计,记录溶解过程中释放或吸收的热量。
4. 数据处理:根据实验数据计算无机盐的溶解热。
实验结果与讨论:通过实验测定得到的无机盐溶解热数据如下:无机盐 | 溶解热(kJ/mol)-----------------------盐酸 | -75.3硫酸 | -89.2硝酸 | -56.7氯化钠 | 3.8硫酸铜 | -44.6从实验结果可以看出,不同无机盐的溶解热存在较大的差异。
其中,盐酸和硫酸的溶解热较大,分别为-75.3 kJ/mol和-89.2 kJ/mol,表明这两种无机盐的溶解过程是放热反应。
而硝酸的溶解热为-56.7 kJ/mol,也属于放热反应。
相比之下,氯化钠的溶解热仅为3.8 kJ/mol,而硫酸铜的溶解热为-44.6 kJ/mol,表明这两种无机盐的溶解过程是吸热反应。
进一步分析发现,溶解热与溶解度之间存在一定的关系。
溶解度是指单位溶剂中溶质的溶解质量,通常用摩尔溶解度表示。
根据溶解热与溶解度之间的关系,可以得到以下结论:1. 溶解热与溶解度成正比关系:溶解热越大,溶解度越大。
例如,盐酸和硫酸的溶解热较大,对应的溶解度也较大。
计算机联用测定无机盐溶解热实验报告

计算机联用测定无机盐溶解热实验报告
实验目的:
本次实验的目的是通过计算机联用的方法测定无机盐在水中的溶解热,并掌握实验方法及数据处理方法。
实验原理:
盐在水中溶解时会放出或吸收热量,这个热量变化可以用实验方法测量出来。
在这个实验中,我们使用的是计算机联用的方法来测定无机盐溶解热。
实验步骤:
1. 进行实验前准备工作,包括清洗实验仪器和准备实验用水。
2. 在实验室控制温度下,将预先称量好的盐溶解于水中。
3. 使用热测量仪器对溶解过程中温度变化进行监测。
4. 将实验数据通过计算机联用的方法处理,并获得溶解热值。
实验结果分析:
通过本次实验,我们掌握了以计算机联用的方法来测定无机盐在水中的溶解热的实验方法。
在实验过程中,我们发现不同的无机盐的溶解热值是不同的,这是因为每种无机盐的分子结构和化学键有所不同,所以溶解热的数值也会有所不同。
同时,本次实验还有一些注意事项,如在实验过程中控制实验室温度的稳定性,以及溶解过程中避免液体的蒸发等等。
这些都需要我们在实际操作中加以注意。
结论:
综上所述,本次实验成功地利用了计算机联用的方法测定了不同无机盐在水中的溶解热,并掌握了实验方法及数据处理方法。
通过实验,我们深入了解了无机盐的分子结构及化学键对其溶解
热的影响,同时也了解了实验操作上的一些细节问题,对我们今后的实验操作具有很大的帮助。
计算机联用测定无机盐溶解热

计算机联用测定无机盐溶解热一 实验目的1. 用量热计测定KCl 的积分溶解热。
2. 掌握量热实验中温差校正方法以及与计算机联用测量溶解过程动态曲线的方法。
二 实验原理盐类的溶解过程通常包含着两个同时进行的过程:晶格的破坏和离子的溶剂化。
前者为吸热过程,后者为放热过程。
溶解热是这两种热效应的总和。
因此,盐溶解过程最终是吸热或放热,是由这两个热效应的相对大小所决定的。
常用的积分溶解热是指等温等压下,将1摩尔溶质溶解于一定量溶剂中形成一定浓度溶液的热效应。
溶解热的测定可以在具有良好绝热层的量热计中进行的。
在恒压条件下,由于量热计为绝热系统,溶解过程所吸收的热或放出的热全部由系统温度的变化反映出来。
为求KCl 溶解过程的热效应,进而求得积分溶解热(即焓变∆H ),可以根据盖斯(Γecc )定律将实际溶解过程设计成两步进行,如图2-1。
图2-1 KCl 溶解过程的图解由图可知,恒压下焓变∆H 为两个过程焓变∆H 1和∆H 2 之和,即:(2-1)21H H H ∆+∆=∆因为量热计为绝热系统,1H Q P ∆=所以在t 1温度下溶解的恒压热效应∆H 为 :(2-2) )()(12212t t K t t K H H −−=−=∆=∆式中K 是量热计与KCl 水溶液所组成的系统的总热容量,(t 2-t 1 )为KCl 溶解过程系统的温度变化值。
溶解t ∆设将质量为m 的KCl 溶解于一定体积的水中,KCl 的摩尔质量为M ,则在此浓度下KCl 的积分溶解热为: 溶解t mKM m M H H ∆−=⋅∆=∆m sol (2-3) K 值可由电热法求取。
即在同一实验中用电加热提供一定的热量Q ,测得温升为,则。
若电热丝电阻为R ,电流强度为I ,通电时间为加热t ∆Q t K =∆⋅加热 τ,则:(2-4) τR I t K 2=∆⋅加热所以 加热t R I K ∆=τ2 (2-5) 由于实验中搅拌操作提供了一定热量,而且系统也并不是严格绝热的,因此在盐溶解的过程或电加热过程中都会引入微小的额外温差。
实验一溶解热的测定

实验一 溶解热的测定一、目的1、了解电热补偿法测定热效应的基本原理及仪器使用。
2、测定硝酸钾在水中的积分溶解热,并用作图法求得其微分稀释热、积分稀释热和微分溶解热。
3、初步了解计算机采集处理实验数据、控制化学实验的方法和途径。
二、基本原理1、物质溶解于溶剂过程的热效应称为溶解热。
它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。
前者是1 mol 溶质溶解在n 0 mol 溶剂中时所产生的热效应,以Q s 表示。
后者是1 mol 溶质溶解在无限量某一定浓度溶液中时所产生的热效应,即0,,s T p n Q n ∂⎛⎫⎪∂⎝⎭。
溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
前者是把原含1 mol 溶质和n 01 mol 溶剂的溶液稀释到含溶剂n 02 mol 时所产生的热效应,以Q d 表示,显然,Q d = Q s ,n02 – Q s ,n01。
后者是1 mol 溶剂加到无限量某一定浓度溶液中时所产生的热效应,即0,,s T p nQ n ⎛⎫∂⎪∂⎝⎭。
2、积分溶解热由实验直接测定,其它三种热效应则需通过作图来求:设纯溶剂、纯溶质的摩尔焓分别为H *m ,A 和H *m ,B ,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为H m ,A 和H m ,B ,若由n A mol 溶剂和n B mol 溶质混合形成溶液,则混合前的总焓为 H = n A H *m ,A + n B H *m ,B 混合后的总焓为 H ΄ = n A H m ,A + n B H m ,B此混合(即溶解)过程的焓变为 ΔH = H ΄ – H = n A (H m ,A – H *m ,A )+ n B (H m ,B – H *m ,B ) = n A ΔH m ,A + n B ΔH m ,B根据定义,ΔH m ,A 即为该浓度溶液的微分稀释热,ΔH m ,B 即为该浓度溶液的微分溶解热,积分溶解热则为: ,,0,,As m A m Bm AmBB Bn H Q H H n HHn n ∆==∆+∆=∆+∆ 故在Q s ~ n 0图上,某点切线的斜率即为该浓度溶液的微分稀释热,截距即为该浓度溶液的微分溶解热。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
度 tH 与 tG之差。
本实验用半导体温度计测温, 并将电讯号直接输入信号处理器与计
算机组成在线检测系统,所有的测量均可由计算机完成,并能屏幕显示
溶解过程的温度~时间动态曲线。计算机在线检测控制原理见图
2-3。
图 2-3
计算机在线检测控制示意图
三 试剂与仪器
试剂:干燥过的分析纯 KCl 。 仪器: 量热计, 磁力搅拌器, 直流稳压电源, 电流表, 信号处理器, 电脑,天平。 实验装置见图 2-4。
图 2-4 溶解热测定装置 1-保温杯; 2-加盐口 3-电热丝加热管; 4-半导体温度计; 5-直流电源; 6-电流表;
7-开关; 8-磁搅拌子; 9-磁力搅拌器
,点击“加入” 。选择“自动运行”后
退出。
5.在“同时测量参数”中,左侧“温度” “电压”“电流”三项皆选
中;右侧只选中温度的动态曲线显示。然后选择“自动存盘”
成两步进行,如图 2-1。
图 2-1 KCl 溶解过程的图解
由图可知,恒压下焓变 ?H 为两个过程焓变 ?H1和?H2 之和,即: ?H = ?H1 + ?H 2 (2-1)
行校正,去掉由于搅拌和散热等所引起的温度变化值。为简便起见,设
加热集中在加热前后的平均温度 tE (即 tB 和 tC 的中点)下瞬间完成,
求得: 量热计热容 K= I 2 Rτ /?t 热
=1.124 2 × 4.83 KCl 摩尔溶解热 :
× 3/10.0786 =1.025kJ /K
?sol Hm = - KM ?t 溶 / m= - 1.025 × 74.56 - 1×.15(6) / 4.76
=18.56 kJ / mol
2、1mol KCl 溶于 200mol 水中的摩尔溶解热数据如下:
和 KCl 应各取多少?(已知保温杯的有效容积为
225 mL)
3. 为什么要用作图法求得 ?t 溶解 与 ?t加热 ?如何求得?
4. 本实验如何测定系统的总热容量 是否可以?
K?若用先加热后加盐的方法
5. 在标定系统热容过程中, 如果加热电流过大或加热时间过长, 是
否会影响实验结果的准确性?液相反应的热效应, 动力学研究。
也可进行反应
; ca88 https:// ca88 ;
; ca88诗歌 https:///aomenkaixuanmenguanwangshige ca88诗歌 ;
查了一下,没有任何遗漏,也没有被翻转的迹象。事实上,除了他之前描述的一些奇怪的图画之外,没有那么多有价值的东西。重新包装后,他忍不住想起赵祥祥的忏悔。平心而论,进入环沿有很多好处。过早假装成标签并不是件好事。他在首都的目的是学习新的法律并找到更多的 物品来补充神灵。目前,他不想参与腾海岛与首都之间的斗争。当然,他也知道有些事情是无法避免的,但前提是他们有足够的力量来确保他们不被轻易操纵。来到案子后,他坐下来。他把夏剑从剑鞘中拉出来,用荧光的玉色看着刀片。他从仪式上拿出一块精美的天鹅绒,仔细擦了擦。 这把剑是乐器。杀死敌人后,没有血也没有灰尘。一般情况下,不需要进行特殊清洁。这种行为实际上是与剑交流的一种方式。与他战争结束后,他觉得他的精神已经升华,人与剑之间有着微妙的牵连。此刻想要呼吸几次,我觉得这把剑就像生命一样。通过他的呼吸,它保持了一个美妙 的节奏。它似乎是由他的思想驱动,并将飞走。他不知道这种感觉来自哪里,但据他的老师说,当人和剑完全融合在一起时,会有各种各样的神奇外表,例如刀片上出现的剑的名字,刀片变得更加敏锐。甚至在天空中飞翔等等。只是因为他认为不会有这样的一天,因为这把剑毕竟不是一 种自我牺牲。毕竟,在心理上存在这样的差距,但在这个阶段没有必要考虑这一点。此刻,直到一天结束,这个时候人才的帮助处理了蟑螂的尸体,他们准备回到空中。
热电流值显示。 900 秒后自动停止加热。
9. 20 分钟后,实验自动结束。注:若采样前未点击“自动存盘”
,
此时在“周期采样”中点击“保存数据” (自己设文件名)
10. 切换到“数据处理” ,点击“读入数据” ,打开刚才保存的文件, 切换到“数据表格” 。每一分钟记录一个数据点。
五 数据处理
1. 作盐溶解过程和电加热过程温度~时间图, ?t溶解 与 ?t 加热 。
三、数据处理示例
1、室温 18.2℃
电热丝电阻 R =4.83Ω
测得: KCl 质量 m=18.01- 13.25=4.76g
加热电流 I =1.124 A
加热时间
τ =300 s
盐溶解温差 ?t 溶=1.122 - 2.278= - 1.156 K
加热升温
?t 热=2.920 - 1.134= 1.786 K
。
6. 启动磁力搅拌器并调节转速至中等速度,然后点击“开始采样” 并切换到“动态曲线” 。
7. 单击鼠标右键,选择“设置绘图范围” 状态。
,将各项调整至最佳观察
8. 待采样时间将至 300 秒时,切换到 “周期采样” 观察时间表, 300 秒时将 KCl 快速从加盐口倒入,塞好瓶口,再切换到“动态曲线”继续 观察。 600 秒时自动进入加热状态,此时电流表与电脑显示窗口均有加
t/ ℃
10.0 15.0 20.0 25.0 30.0
?sol Hm / kJxmol -1 19.98 19.09 18.30 17.56 16.84
四、思考题解答要点
1、与溶质、溶剂性质、溶解温度及浓度有关。本实验对应的溶解温 度即盐溶解前的水温。
2、水为 225mL ,则 KCl 为 4.65 g。
在 tE 前后由搅拌或散热而引起的温度变化率即为
AB 线和 CD 线的斜
率。所以将 AB 、CD 直线分别外推到与 tE 对应时间的垂直线上,得到
G、H 两交点。显然 GN 与 PH 所对应的温度差即为 tE 前后因搅拌和散
热所引起温度变化的校正值。 真实的 ? t 加热应为 H 与 G 两点所对应的温
3、参见教材实验原理部分。 4、电热法。不可以,因为要求的是量热计与盐溶液的热容量,而不
是量热计与水的热
容量。
5、本题应具体计算各项误差。
?(?H) /?H=?K /K+? (?t
溶) ?t 溶+?m/m
其中 ?K /K =2?I/ I +?R/R +?t/t +? (?t
热)/? t 热
∵?R /R =0.01/5 = 0.002 ,当 ?m =0.01 g 时, ?m/m 也仅为 0.002,
在岐山的背后,在遥远的鞍山山脉,有一个高寒的雪峰站在天空下,就像一个嵌在天空和地球上的轮廓,只能看到寂寞而高亢的姿势,让人屏住呼吸。在当地的原住民语言中,这个雪峰被称为“格雷戈里”,意思是“孤独的天堂女神”。当卫报之家的军队尚未踏上这片土地时,副监 护人杨功看到了孤独的山峰直立在海上山中,他脱口而出“谁是天通寿的朋友?”穿越万里的第一个高峰“。这是天下人民到来后唯一没有改名的山峰。它仍然被称为女神峰。有一个夏季和夏季的灯塔,有传言说那里那是一场篝火,甚至当地人都能看到它。当张宇正在看的时候,他的脚 步声开始响起,赵翔接过来和他并肩站在一起。他看着他面前的风景。他说感慨地说:“当关正在这里守护时,他说,'日月,瑞光已经出国了,而首都瑞光也是以它命名的。”张玉道:“杜甫远程领域的人们说道。福瑞市就在这里。那些住在这里的人,穷人可以得到足够的食物和饮料 ,富人可以享受到最后的结局。“赵相成叹了口气说:”我希望如此,对,张少浪,你到了首都后,你能拥有吗?一个住宿的地方?“张玉道:“我从未来通过首都,没有熟悉的地方。”赵向成从袖口拿了一个名字,递给他。他说:“这个城市南部有一个安镇住所。这是我巡逻的行业。 如果你什么都不说,安全是无辜的。你抱着我。着名的职位将会在那里,会有会招待你的人。“张宇接过来说:“那我就是不尊重。”赵向成笑道:“小事。”这三艘战舰充满了风帆。好的,速度非常快,看到瑞光市后不久,就进入了香港水域以外的城市。目前,港口停泊着数百艘大小 船只。白色的风帆是树木丛生的,人声和海鸥的声音远近。在内陆水道开通之前,它是杜甫的第一个军事港口,有七个码头,可以容纳四十艘船并同时停放。现在从腾海群岛和内陆河流运输的货物大多聚集在这里。挥动口号后,脊柱被引到其中一个码头。
输出的电压稳定,稳压电源不要关掉。
2、加盐管的口要用滤纸擦干,以防止盐粒粘住而不溶解在水中。 3、搅拌转速在实验过程中应保持恒定,转速要适当,保证氯化钾在 半分钟内溶解。 4、若实验进行到 600 秒时不自动加热或 900 秒时不停止加热,则可 能是未输入相对开始时间或未输入相对结束时间。 5、记录数据时,只需记每分种时的温度与电流值,电压值可不记录。
计算机联用测定无机盐溶解热
一 实验目的
1. 用量热计测定 KCl 的积分溶解热。
2. 掌握量热实验中温差校正方法以及与计算机联用测量溶解过程 动态曲线的方法。
二 实验原理
盐类的溶解过程通常包含着两个同时进行的过程: 晶格的破坏和离
子的溶剂化。前者为吸热过程,后者为放热过程。溶解热是这两种热效
应的总和。因此,盐溶解过程最终是吸热或放热,是由这两个热效应的
∴ 不必用分析天平称量 KCl
五、 进一步讨论
1. 系统的总热容量 K 除用电加热方法标定外,还可以采用化学标 定法,即在量热计中进行一个已知热效应的化学反应,如强酸与强碱的
中和反应, 可按已知的中和热与测得的温升求得 K 值。同样也可用已知
积分溶解热的某物质作为标准,测量其溶解前后的温差求得
K 值。
实验指导参考
一、教学要点
1、溶解过程温度~时间图;用绝热量热计测量某温度下溶质溶于水
变为同温度下溶
液的热效应。
2、量热计热容的测量有电标定法与化学标定法,本实验用电标定的 原理与方法。
3、作图法进行热漏校正以得出真实的Δ
t。通过校正,使过程模拟为
瞬时绝热完成。 4、实验监控仪的使用方法。
