聚合物胶束
载药聚合物胶束制备方法的研究进展-1
载药聚合物胶束制备方法的研究进展中国药科大学药剂学 张振海 吕慧侠聚合物胶束是两亲性的高分子物质在水中自发形成的一种自组装结构。
与小分子表面活性剂类似,当嵌段或接枝共聚物在水中的浓度达到一定程度后,分子中的疏水段和亲水段就会发生微相分离,自动地形成疏水段向内,亲水段向外的具有典型核—壳结构的胶束,疏水性药物则依靠胶束内核间的疏水性相互作用而进入胶束内部。
聚合物胶束按照溶剂不同可分为水溶性胶束和有机溶剂胶束,按小分子表面活性剂的说法,前者为常规胶束, 后者为反向胶束。
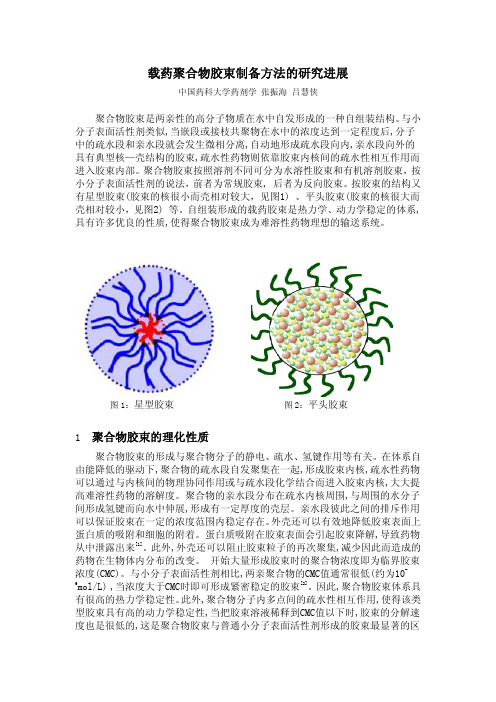
按胶束的结构又有星型胶束(胶束的核很小而壳相对较大,见图1) 、平头胶束(胶束的核很大而壳相对较小,见图2) 等。
自组装形成的载药胶束是热力学、动力学稳定的体系,具有许多优良的性质,使得聚合物胶束成为难溶性药物理想的输送系统。
图1:星型胶束 图2:平头胶束1 聚合物胶束的理化性质聚合物胶束的形成与聚合物分子的静电、疏水、氢键作用等有关。
在体系自由能降低的驱动下,聚合物的疏水段自发聚集在一起,形成胶束内核,疏水性药物可以通过与内核间的物理协同作用或与疏水段化学结合而进入胶束内核,大大提高难溶性药物的溶解度。
聚合物的亲水段分布在疏水内核周围,与周围的水分子间形成氢键而向水中伸展,形成有一定厚度的壳层。
亲水段彼此之间的排斥作用可以保证胶束在一定的浓度范围内稳定存在。
外壳还可以有效地降低胶束表面上蛋白质的吸附和细胞的附着。
蛋白质吸附在胶束表面会引起胶束降解,导致药物从中泄露出来[1]。
此外,外壳还可以阻止胶束粒子的再次聚集,减少因此而造成的药物在生物体内分布的改变。
开始大量形成胶束时的聚合物浓度即为临界胶束浓度(CMC)。
与小分子表面活性剂相比,两亲聚合物的CMC值通常很低(约为10-6mol/L) ,当浓度大于CMC时即可形成紧密稳定的胶束[2]。
因此,聚合物胶束体系具有很高的热力学稳定性。
此外,聚合物分子内多点间的疏水性相互作用,使得该类型胶束具有高的动力学稳定性,当把胶束溶液稀释到CMC值以下时,胶束的分解速度也是很低的,这是聚合物胶束与普通小分子表面活性剂形成的胶束最显著的区别。
药物纳米载体 聚合物胶束的研究进展

1、化学反应法
化学反应法是指通过化学反应将药物分子嵌入到聚合物链中,从而形成聚合 物胶束。该方法常用的反应包括酯化反应、酰胺化反应和醚化反应等。这些反应 可以在适当的条件下将药物分子嵌入到聚合物链中,并形成稳定的聚合物胶束。
2、界面聚合法
界面聚合法是一种在水溶液中制备聚合物胶束的方法。该方法通过将药物分 子添加到聚合物单体的水溶液中,然后在油水界面上进行聚合反应。随着聚合反 应的进行,聚合物胶束逐渐形成并从水溶液中分离出来。
的动力学行为来了解其结构和性质的 方法。该方法可以通过分析聚合物胶束在溶液中的扩散系数、布朗运动等参数来 推算出其分子量和尺寸等参数。
三、药物纳米载体——聚合物胶 束的应用前景
随着药物纳米载体——聚合物胶束的不断发展,其应用前景也越来越广泛。 未来,药物纳米载体——聚合物胶束有望在药物递送、疫苗递送、组织工程等领 域得到广泛应用。
1、光谱分析法
光谱分析法是一种通过分析光谱数据来研究聚合物胶束的方法。该方法可以 通过测量光谱吸收峰的位置和形状等参数来推算出聚合物胶束的分子量和尺寸等 参数。
2、电镜观察法
电镜观察法是一种通过观察聚合物胶束的形态和尺寸来研究其结构的方法。 该方法可以通过将聚合物胶束制成薄膜或涂层,然后在扫描电镜或透射电镜下进 行观察,从而获得聚合物胶束的形态和尺寸等信息。
3、自组装法
自组装法是一种通过分子自组装形成聚合物胶束的方法。该方法通过将药物 分子和聚合物分子在水溶液中混合,然后通过调节溶液的pH值、温度等参数,使 得药物分子和聚合物分子自组装形成聚合物胶束。
二、药物纳米载体——聚合物胶 束的研究方法
研究药物纳米载体——聚合物胶束的方法主要包括光谱分析法、电镜观察法、 动力学方法等。
靶向聚合物胶束

2.胶束的制备
材料选择 制备方法
胶束的材料——理想要求
拥有合适尺寸,大小从10到100 nm; 体内及体外具有高度的稳定性; 所用的嵌段共聚物具有较低的临界胶束浓
度CMC和高度的动力学稳定性; 能够在体内存在较长时间,且最终可以生
物分解,无毒性。
胶束的材料——亲水端
与外环境直接接触 影响被包封药物分布及药代动力学参数
利用或逃避网状内皮系统( RES) 摄取的被动靶向肿瘤
通过EPR效应靶向肿瘤 肿瘤特异性靶向 通过肿瘤血管系统靶向肿瘤 其他靶向策略
逃避网状内皮系统( RES)摄取
原理:
胶束进入系 大小
统
表面性质
特征:
被RES摄取
逃避摄取,靶向 其他部位
1. 粒径<100nm
2. 通过接枝或嵌段共聚物的亲水区和疏水 区形成的核
聚环氧乙烷-b-聚己内酯胶束
Poly(ethylene oxide)-b-poly(ε-caprolactone) Micelles
靶向修饰基团:
arginine-glycine-aspartic acid (RGD) Peptides
作用目标:
小鼠黑素瘤细胞(实验室体外培养)
合成步骤 物性测量 细胞吸收程度 体外实验观察结果
肉豆蔻酸(C14 )
低
硬脂酸(C18 )
稳定性
二十四烷酸(C24 )
高
胶束的材料——疏水端
脂肪族类:聚丙交酯(PLLA),聚乙交酯(PGA), 聚己内酯(PCL),聚乳酸,乙醇酸酯(PLGA)
氨基酸类:聚天冬氨酸(PAsp ),聚卞基天冬氨酸( PBLA), 聚谷氨酸(PGlu)
脂肪族聚酯:易于水解,产物无毒、良好的生物兼容性; 氨基酸类: 作为核片段,易于化学修饰并且可利用物理协同
聚合物胶束-20080925

EPR效应(enhanced permeability and retention effect) 增强的渗透性和滞留效应,使高分子载体系统具有一定的被动靶向性. EPR效应是借助于实体瘤部位血管内皮渗透性的增强,以及缺乏足够的 淋巴管,导致药物无法被重新吸收入循环系统,使得药物滞留于肿瘤 部位,从而提高药物在靶部位的浓度,增强对肿瘤细胞的杀伤作用, 同时大大降低对正常组织的毒副作用。
聚合物胶束与其他药物载体的区别
与脂质体或微粒相比更小的粒径,只有胶 束内部疏水区而缺少胶束内部含水区,外 表面链段的保护作用。
聚合物胶束形成的热力学过程与小分子 表面活性剂胶束相同,自组装形成胶束 的主要策动力是系统自由能的降低,疏 水链段形成内核,从而脱离与水性环境 的接触,亲水链段形成表面与水接触。
图1.常用的形成疏水内核区段的化学结构:聚酯,聚氨基酸。
形成胶束所用的嵌段共聚物的合成方法有:阴 离子聚合,开环聚合。 改变聚合物胶束的生理特性可以通过改变不同 性质嵌段的分子大小和它们在共聚物中所占比 例来控制。 在接枝共聚物中,由大量的疏水链连接在亲水 的主链上。
micelle morphology
聚离子复合物胶束(polyion complex micelles,PIC)药物分子与疏水嵌段携带相反电 性,通过静电作用相连。
包载和转运各种荷电的小分子药物、多肽和DNA等
聚合物胶束递送系统
水难溶药物的增溶剂
现有的增溶剂: 聚氧乙稀蓖麻油(Cremophor® EL):紫杉醇和环胞素A的 增溶剂,过敏反应,高脂血症,神经毒性,P糖蛋白的逆转。 吐温80、去氧胆酸钠:用来增溶胺碘酮和两性霉素B,溶血。
C Zhang et al, Biomaterials 2008,29:1233. C Zhang et al, European Journal of Pharmaceutical Sciences 2008, 33: 415 C Zhang et al, Colloids and Surfaces B: Biointerfaces 2004,39,69. C Zhang et al, Carbohydrate Polymers 2003:54,137.
MePEG_PLA聚合物胶束的制备表征及细胞摄取机理初步研究_

2 MePEG-PLA 聚合物胶束的制备及表征2.1 引言聚合物胶束作为抗肿瘤药物载体是目前研究的热点。
聚乙二醇(PEG)是一种无毒、亲水、非免疫原性的聚合物,是FDA批准使用的非离子水溶性聚合物,常用于各种纳米粒的修饰,经PEG修饰的纳米粒能有效地避免与免疫球蛋白作用,阻碍载体与吞噬细胞粘合,延长载体的体内循环时间[87]。
疏水段聚乳酸(PLA)由于它的生物可降解性及代谢产物对人体没有毒害而被广泛使用,它与PEG一起构成的二嵌段两性聚合物能载一些难溶性的抗肿瘤药物。
载药聚合物胶束最简单的制备方法是将固体药物用与水混溶的有机溶剂溶解,取少量注入含有胶束的水溶液中。
通常为了提高载药量,因此先将药物和聚合物溶解在适当的有机溶剂中,然后缓慢加水,残留有机溶剂可通过透析或挥发法除去,也可将药物和聚合物溶于有机溶剂中,蒸除有机溶剂后,将形成的混合物薄膜重新分散在水相介质中,或将药物和聚合物通过共价键偶联,制备载药聚合物胶束。
本章通过FT-IR、1H-NMR、GPC等手段对聚合物进行了表征。
然后分别利用成膜法和自乳化溶剂蒸发法制备载紫杉醇的聚合物,并采用自乳化溶剂蒸发法制备了荧光标记的聚合物胶束,通过透析、超滤等手段除去游离的荧光小分子。
利用透射电镜、激光散射粒度仪对所制备了聚合物胶束进行了形态表征,为聚合物胶束在给药系统的应用提供了基本的依据。
2.2 实验部分2.2.1 实验仪器及试剂2.2.1.1 主要仪器分析天平BS110S 北京Satrorius仪器系统有限公司旋转蒸发仪RE-52 上海亚荣生化仪器厂超滤离心管35 kDa 美国Millipore公司FT-IR 光谱仪VERTEX70 德国Bruker 公司透射电子显微镜TECNAI G2-20 荷兰FEI公司核磁共振仪A V400 瑞士Bruker公司荧光分光光度计F4500 日本分光(JASCO)公司激光衍射粒度分析仪Nano-ZS90 英国Malvern仪器公司高效液相色谱仪Agilent美国Agilent公司2.2.1.2 主要试剂MePEG5000-PLA(50:50)山东岱罡公司紫杉醇(99.45%) 泰华天然生物制药有限公司芘(>97%) 瑞士Sigma-Aldrich 公司尼罗红荧光染料(>99%) 美国Sigma公司2.2.2 实验方法2.2.2.1 MePEG-PLA聚合物的表征(1)傅利叶红外(FT-IR)光谱分析取适量MePEG-PLA,用KBr压片,在4000~400 cm-1范围内其红外吸收光谱。
载药聚合物胶束的优势、应用及挑战

载药聚合物胶束的优势、应用及挑战本文以氨基酸衍生物为材料合成的聚合物胶束的形态、类型、粒径、载药量为基础,简单综述了胶束的载药的特点及应用,讨论了肿瘤给药时在血液中不稳定、容易外渗和蓄积、生物利用度低的现象,为胶束的深入研究提供参考依据。
标签:聚合物胶束;载药量;药物释放;肿瘤靶向聚合物胶束是由两亲性聚合物在水溶液中自发形成的一种自组装结构,具有载药范围广、载药量高、体内滞留时间长、稳定性好、毒副作用少、控制药物释放和肿瘤靶向给药等特点,在抗癌药物中具有显著的优势,是一个很有前景的靶向给药和药物控释载体。
1 聚合物胶束简介聚合物胶束分为嵌段聚合物胶束、接枝共聚物胶束、聚电解质胶束和非共价键胶束,可形成球状、圆柱状、螺旋状和层状等不同结构,不同形态形成与胶束的自由能有关。
通常疏水性药物可采用透析法等物理方法进入胶束的疏水内核,也可通过配位作用、化合结合、静电作用等方式进入胶束的内核,形成载药胶束。
这种聚合物载药胶束具有较小的粒径,能够通过EPR效应实现对肿瘤部位的被动靶向作用,而具有主动靶向性及刺激响应高分子胶束可提高药物的生物利用度、降低药物毒副作用。
聚合物膠束自组装受pH影响,如聚天冬氨酸、聚谷氨酸或聚赖氨酸。
2 药物传输药物与共聚物的缔结可通过非共价结合与共价结合两种方式。
非共价结合包括疏水作用、静电作用以及金属离子配位聚合,结合方式不同胶束载药量各异,如含Na胶束、含H胶束、苯二氮卓类胶束、CDDP缔结胶束载药量分别为56.8%、40.6%、1.1%、30%。
诸多研究报道了药物与共聚物通过水解的酰胺/酯键或敏感型键共价结合,如DOX通过酰胺键与PEG-PAsp共聚物缔结,约50%的PAsp 侧羧基偶联DOX [1]。
在正常的生理环境中,载药胶束呈现出最小的药物释放,而pH敏感的药物释放曲线能否达到病灶部位取决于胶束的微观结构。
多种方法可以有效包裹药物到胶束内壳中,但是不同的载药方式意味着被包封的药物可以表现出不同的体内药物动力学。
聚合物胶束的稳定性及影响因素

Vol.48No.12(2017)ZHEJIANG CHEMICAL INDUSTRY 收稿日期:2017-03-22基金项目:国家自然科学基金(C10114240)资助。
作者简介:潘攀(1988-),男,硕士研究生,研究方向:药物输送载体在体内微环境下的稳定性研究。
*通讯作者:易喻,E-mail:490377299@ 。
聚合物胶束的稳定性及影响因素潘攀,张浩,易喻*(浙江工业大学药学院,化学工程学院,浙江杭州310014)摘要:由两亲性大分子自行组装形成的聚合物胶束被广泛地应用于抗肿瘤药物的靶向输送,但是聚合物胶束纳米载药系统面临着困境,即胶束进入人体内后其稳定性大大减弱,导致药物的提前释放从而失去了靶向作用。
因此阐明影响聚合物胶束稳定性因素是进一步设计和制备物理稳定的聚合物胶束药物输送载体的基础。
本文从热力学和动力学角度概述聚合物胶束稳定性的影响因素,并进一步探讨了其作为重要的药物输送载体在人体血液循环系统中受到血液微环境等不利因素的影响。
关键词:聚合物胶束;两亲性嵌段共聚物;药物输送载体文章编号:1006-4184(2017)12-000愿-040引言恶性肿瘤是危害我国人民健康最严重的疾病,每年有约200万人死于恶性肿瘤,并仍然呈现逐年上升的趋势。
由于大部分化疗药物的疏水性结构造成其在临床使用上具有很大弊端,因此如何克服抗癌药物在临床使用上的缺点逐渐成为当下研究热点[1]。
聚合物纳米胶束由于其亲水外壳-疏水内核的结构可以对疏水性的抗癌药物进行包封装载,一方面可以增大药物在体内的水溶性,另一方面减小药物对人体的毒副作用[2]。
目前聚合物胶束药物载体与其它纳米药物面临同样的困境,即在一定程度上可以减轻毒副作用,但是疗效较原药并没有显著的提高。
可能的原因是胶束在血液循环系统的快速解离导致了药物的提前释放从而失去了靶向性,造成胶束化药物体内疗效不高。
因此,阐明体内和体外环境下影响聚合物胶束稳定性的因素,将为进一步设计物理性质稳定的聚合物胶束进而获得高效胶束型纳米药物提供重要理论基础。
新型给药系统:聚合物胶束与泡囊

9束与泡囊
六、聚合物胶束的制备方法
聚合物胶束的制备一般分直接溶解法和透析法两种。水溶性 较好的材料(如pluronics类)可直接溶解于水(可加热溶解) ,浓度超过溶解度后即可形成透明的聚合物胶束溶液。水溶性 差的材料必须同时使用有机溶剂,先在有机溶剂(或含水的混 合溶剂)中溶解,再透析除去有机溶剂,可制得聚合物胶束。
泡囊的大小通常在几十纳米至几 十微米。由于具有较大的中空亲水区 ,对水溶性药物的包封率高,在壳层 的疏水区也可以包载疏水药物,但载 药量较小。
7束与泡囊
脂质体与聚合物泡囊均 可由“成膜”和“水化”两步形成 ,如右上图。
两者的主要区别取决于
双亲性材料的分子量,见右 下图。分子量小于100者不 能形成聚集体 (n.a.); 100~1000之间形成脂质体; 1000以上则形成聚合物泡囊 。而且,随着材料分子量增 大,聚集体的稳定性增大至 一定值,膜的流动性和透过 性降低。故聚合物泡囊的稳 定性明显高于脂质体,而膜 的透过性较低(缓释性更高 )。
万倍。近年来,聚合物胶束用作载体成为给药系统研究的热点
,可以用于提高药物稳定性,延缓释放,提高药效,降低毒性 ,和具有靶向性。如将P388白血病大鼠用阿霉素及其聚合物胶 束进行药理对照实验,阿霉素中毒剂量是30 mg/kg,而其聚合 物胶束是600 mg/kg,即胶束使其毒性大为降低。用聚乙二醇/ 磷脂酰乙醇胺聚合物胶束(低浓度时很稳定,粒径7~35 nm)
6束与泡囊
通常结构相似的表面活性剂,其烃基的碳 链增长,CMC值明显降低;非离子型表面活性 剂的CMC比离子型的小得多(约1:100),而 非离子型表面活性剂胶束的分子缔合数却大得 多(可达数千)。
药学中常用的低分子表面活性剂对难溶药 物的增溶效果较好,但其CMC值较高,不能用 作药物载体,因为经稀释的胶束不稳定(如在 静注后受血容量的影响会解缔合),故作为给 药系统的载体,必须使用两亲性聚合物作材料 。
胶束聚合物释药机制

胶束聚合物释药机制
在载药过程中,药物被包裹在胶束聚合物中。
胶束聚合物由两个主要的组成部分组成:核和壳。
核是聚合物链的聚合中心,壳则由表面活性剂组成,使核与溶液中的药物分子相互作用。
药物在溶液中与表面活性剂相互作用,形成静电挤压力,使药物分子进入聚合物核中。
另外,壳上的功能基团也可以与药物分子发生化学键结合,进一步增强药物的包封效果。
在释放过程中,胶束聚合物被释放到目标区域。
胶束聚合物的释放可以通过两种方式实现:被动释放和刺激释放。
被动释放是指在没有外部刺激的情况下,胶束聚合物中的药物自然地从载体中释放出来。
这种方式主要取决于胶束聚合物中的聚合物链与药物分子之间的物理吸附力和表面张力。
刺激释放是指通过外部刺激来促进药物释放。
外部刺激包括温度、pH 值、光照、电场等。
这些刺激能够改变胶束聚合物中的物理和化学性质,从而引起药物的释放。
例如,当温度改变时,胶束聚合物的结构可能发生改变,导致药物的释放。
另外,当环境pH值改变时,胶束聚合物也可能发生结构变化,从而影响药物的释放。
胶束聚合物释药机制的优势在于其能够实现药物的定向释放和缓控释放。
通过调节胶束聚合物的结构和外部刺激条件,可以实现药物的定向释放到特定组织或器官,从而减少不良反应和提高治疗效果。
此外,胶束聚合物还能够实现药物的缓控释放,使药物在体内缓慢释放,延长药效。
总之,胶束聚合物释药机制是一种可控的药物释放方法。
通过调节胶束聚合物的结构和外部刺激条件,可以实现药物的定向释放和缓控释放,具有广阔的应用前景。
新型给药系统聚合物胶束与泡囊

所谓“自组装”,即在水溶 液中双亲性分子的疏水段被水分 子排斥而聚集,从而自动形成亲 水段向外的缔合结构。
4
泡囊通常由非离子型表面活性剂 形成,具有封闭的双层结构,壳层内 外均是亲水基团(右图用圆圈表示), 空的中心可容纳水性介质,夹在两层 亲水基团中间的是疏水基团,双分子 层单室泡囊示意图见右上。
6
双亲性嵌段共聚物在溶液 中可以自发形成胶束,亦可形 成共聚物泡囊,其中决定性因 素是亲水段(如POE或PEG) 在分子中所占的体积比(fOE)。
fOE<0.2时疏水段很长, 易聚集成疏水核心而成实心球 形大胶,束形,成锥fOE形>0分.5子时(亲右水图段右很 上),也形成球形胶束。
当fOE 在0.2~0.42时, (见右上图的左)可形成壳层 结构,即聚合物泡囊( 右中 图的左)。
2
由磷脂类和胆固醇的双分子层组成的脂质体,其膜具有类 似生物膜结构成为药物的优良载体。其主要特点是具有靶向性、 缓释性、细胞亲和性和组织相容性。
脂质体存在的问题主要是不太稳定,包括药物易渗漏、磷 脂易受氧化和降解等。近年发展成泡囊(niosomes,亦称囊泡
或类脂质体)及聚合物泡囊(polymer vesicles 或 polymersomes) ,它们作为药物载体与脂质体的体内外性质
载药聚合物胶束制备方法与聚合物胶束类似,有的很简单, 将材料(如表面活性剂)先在水中溶解、分散,再加入疏水性 药物的适当溶液搅拌即成。此外有以下方法。
靶向聚合物胶束

目录
靶向聚合物胶束
聚合物胶束
靶向策略
分类
制备
原理
分类
聚合物胶束
胶束分类 制备方法
胶束的分类
聚合物胶束
按溶剂
结构
水相胶束 (常规)
有机溶剂胶 束(反相)
星型胶束
平头胶束
常见聚合物胶束组成形式
两段聚合物胶束 三段聚合物胶束 接枝聚合物胶束
2.胶束的制备
材料选择 制备方法
胶束的材料——理想要求
拥有合适尺寸,大小从10到100 nm; 体内及体外具有高度的稳定性; 所用的嵌段共聚物具有较低的临界胶束浓 度CMC和高度的动力学稳定性; 能够在体内存在较长时间,且最终可以生 物分解,无毒性。
胶束的材料——亲水端
与外环境直接接触 影响被包封药物分布及药代动力学参数
低
稳定性
硬脂酸(C18 )
二十四烷酸(C24 )
高
胶束的材料——疏水端
脂肪族类:聚丙交酯(PLLA),聚乙交酯(PGA), 聚己内酯(PCL),聚乳酸,乙醇酸酯(PLGA) 氨基酸类:聚天冬氨酸(PAsp ),聚卞基天冬氨酸( PBLA), 聚谷氨酸(PGlu)
脂肪族聚酯:易于水解,产物无毒、良好的生物兼容性; 氨基酸类: 作为核片段,易于化学修饰并且可利用物理协同 作用和化学方法包封药物
靶向聚合物胶束引言现代生物技术发展日新月异新兴的研究成果大量涌现靶向聚合物药物载体靶向聚合物胶束聚合物胶束靶向策略制备原理分类分类目录聚合物胶束制备方法胶束的分类聚合物胶束按溶剂结构水相胶束常规有机溶剂胶束反相星型胶束平头胶束常见聚合物胶束组成形式接枝聚合物胶束2
靶向聚合物胶束
聚合物胶束ppt课件

1.天然乳化剂
• 如多糖类的阿拉伯胶、西黄蓍胶及明胶、白蛋 白和酪蛋白、大豆磷脂、卵磷脂及胆固醇等。
•优点是无毒、廉价,缺点是一般都存在批间差 异,对大量生产很不利。其产品的差异可能在生 产的当时不显著,但几个月之后就明显了,有许 多都可能受微生物的污染(包括致病菌和非致病 菌)。
脂质体与泡囊
2.合成乳化剂
离子型 非离子型
• 纳米乳常用非离子型乳化剂,如脂肪酸山梨坦 (亲油性)、聚山梨酯(亲水性)、聚氧乙烯脂 肪酸酯(亲水性)、聚氧乙烯脂肪醇醚类、聚 氧乙烯聚氧丙烯共聚物类、蔗糖脂肪酸酯类和 单硬脂酸甘油酯等。非离子型的乳化剂口服一 般没有毒性,静脉给药有一定毒性。
2.合成乳化剂
• 合成乳化剂一般都有轻微的溶血作用,其溶血 作用的顺序为:聚氧乙烯脂肪醇醚类>聚氧乙 烯脂肪酸酯类>聚山梨酯类;聚山梨酯类中, 溶血作用的顺序为:聚山梨酯20 >聚山梨酯 60>聚山梨酯40>聚山梨酯80.
3. 助乳化剂
• 助乳化剂可调节乳化剂的HLB值,并形成更小
的乳滴。助乳化剂应为药用短链醇或适宜HLB
值的非离子表面活性剂。常用的有正丁醇、乙 二醇、乙醇、丙二醇、甘油、聚甘油酯等。
三、聚合物胶束的制备
(一)形成机理 1.与表面活性剂分子缔合形成胶束的机理相似, 但是由于聚合物在水中形成胶束的临界浓度小, 且其疏水核心更稳定,故聚合物胶束可以经稀 释而不易解聚合。 2.因而可以用作药物载体。
五、亚纳米乳的制备 • 亚纳米乳常作为胃肠道给药的载体,其
特点包括:提高药物稳定性、降低毒副
作用、提高体内及经皮吸收、使药物缓
胶束聚合物释药机制

胶束聚合物释药机制
胶束聚合物释药机制是指将药物装载在胶束聚合物基质中,并通过控
制胶束聚合物的结构和性质来实现药物的缓慢释放。
胶束聚合物释药的机
制主要包括以下几个方面:
1.控制释放速度:胶束聚合物中药物的释放速度可以通过调节聚合物
的结构和物理化学性质来控制。
例如,聚合物的交联度和孔隙度可以影响
药物在胶束聚合物中的扩散速率,从而影响药物的释放速度。
2.控制释放位置:胶束聚合物的表面可以与药物分子相互作用,从而
实现药物的定位释放。
例如,通过在胶束聚合物表面修饰适当的化学基团,可以实现药物的定向释放。
3.控制药物的稳定性:药物在胶束聚合物中受到保护,可以避免药物
的降解和失活,在一定程度上实现药物的长效释放。
4.控制药物的溶解度:药物在胶束聚合物中的溶解度也可以通过调节
聚合物的结构和物理化学性质来控制。
例如,通过改变聚合物中亲水基团
和疏水基团的比例,可以影响药物在胶束聚合物中的溶解度和释放速度。
聚合胶束的5种物理载药

聚合胶束的5种物理载药聚合胶束是一种可行的药物载体,结构简单,能够提高药物的生物利用度和治疗效果。
胶束的负荷量比其他载体高,所以胶束药剂主要用于癌症治疗、传染病防治、细胞毒性药物保护等领域。
根据物理载药方式的不同,聚合胶束的载药可分为以下五种类型。
1. 物价吸附载药物价吸附是将药物通过物理作用吸附在聚合物胶束表面的过程。
在这种载药方式下,药物不会进入胶束内部,而是均匀分布在聚合胶束的表面。
这种载药方式特点是载药效率较低,但对于一些需求较低的药物可行,因为药物的生物利用率会提高。
2. 交联载药聚合物在交联的时候会形成空心结构,称为胶束内部。
药物在交联的时候进入胶束内部,由于胶束内部是水系环境,药物通常比较稳定。
这种载药方式下,药物负荷量高,可以满足高等生物体内的药物需要。
3. 包封载药包封载药是将药物通过物理屏障封装在聚合胶束中。
这种载药方式能够有效保护药物在外界环境下的稳定性,同时也能够有效避免药物自我解离。
包封载药优点是药物的生物利用率高,且能提高药物在特殊环境中的适应性。
4. 磁性载药磁性载药是将药物通过磁性纳米粒子负载在聚合胶束中。
这种载药方式下,药物负荷量高,能够有效提高药物在细菌、癌细胞等目标组织中的浓度。
而且,由于磁性的特殊性,磁性载药可适用于通过定位操纵药物释放的治疗方法。
5. 生物响应性载药生物响应性载药是将药物通过聚合胶束的生物响应性作用负载在聚合胶束中。
聚合胶束在特定条件下开裂,释放药物。
生物响应性载药的优点是在特定治疗环境下容易控制药物的释放量,提高治疗效果。
综上所述,聚合胶束的载药方式多样,可以根据不同的药物需求采取相应的载药方法。
随着科技的不断发展,聚合胶束作为一种新型药物载体,必将为药物输送领域带来新的变革。
动态交联聚离子胶束

动态交联聚离子胶束
动态交联聚离子胶束是一种新型的聚合物胶束,它通过动态交联键的形成和断裂,实现了胶束的可调控性。
与传统的静态交联聚合物相比,动态交联聚离子胶束具有更高的可调控性、更优异的力学性能和更好的溶解性。
动态交联聚离子胶束的制备方法通常包括两步:首先,通过共价键或离子键将聚合物链组装成胶束;其次,通过动态交联键的形成和断裂,实现胶束的可调控性。
动态交联键通常是指可逆的化学键,如氢键、配位键、酰胺键等。
这些键的形成和断裂通常需要较低的能量,可以在较宽的温度范围内进行调控。
动态交联聚离子胶束的动态交联键可以通过多种方式进行调控,如温度、pH值、光照等。
这些调控方式可以改变动态交联键的断裂和重组速率,从而实现胶束的可调控性。
例如,通过改变温度,可以改变氢键的断裂和重组速率,从而实现胶束的可调控性。
动态交联聚离子胶束在涂料、胶粘剂、化妆品、药物传递等领域具有广泛的应用前景。
由于其可调控性,动态交联聚离子胶束可以根据需要调整胶束的性质,如粘度、强度、溶解性等。
此外,动态交联聚离子胶束还具有优异的力学性能,如高弹性、高韧性等。
动态交联聚离子胶束的制备和应用是一个复杂的过程,需要深入的研究和理解动态交联键的调控机制。
目前,动态交联聚离子胶束的研究还处于起步阶段,有许多新的发现和应用前景等待我们去探索。
总之,动态交联聚离子胶束是一种新型的聚合物胶束,它通过动态交联键的形成和断裂,实现了胶束的可调控性。
动态交联聚离子胶束具有较高的可调控性、优异的力学性能和良好的溶解性,在涂料、胶粘剂、化妆品、药物传递等领域具有广泛的应用前景。
c4d 胶束结构

c4d 胶束结构
C4D(四链道)是一种聚合物体系,通常用于研究胶束结构。
在C4D 系统中,聚合物分子由四条长链组成,这四条链相互连接形成一个四方形的结构。
这种结构使得聚合物分子具有较高的分子量和复杂的空间结构,能够形成胶束结构。
胶束是由表面活性剂等分子在溶液中自组装形成的微米级别的聚集体。
在C4D系统中,聚合物分子的四链道结构可以通过表面活性剂与水分子的相互作用,形成类似胶束的结构。
这种结构在某些条件下可能具有特殊的性质和应用,例如在药物输送、纳米材料合成等领域。
总的来说,C4D胶束结构是一种特殊的聚合物结构,通过自组装形成的胶束结构,具有一定的研究和应用价值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.合成乳化剂
? 合成乳化剂一般都有轻微的溶血作用,其溶血 作用的顺序为:聚氧乙烯脂肪醇醚类>聚氧乙 烯脂肪酸酯类>聚山梨酯类;聚山梨酯类中, 溶血作用的顺序为:聚山梨酯 20 >聚山梨酯 60>聚山梨酯 40>聚山梨酯 80.
3. 助乳化剂
? 助乳化剂可 调节乳化剂的 HLB值,并形成更小 的乳滴。助乳化剂应为药用短链醇或适宜 HLB 值的非离子表面活性剂。常用的有正丁醇、乙 二醇、乙醇、丙二醇、甘油、聚甘油酯等。
2.制备纳米乳的步骤
(1)确定处方: 处方中的必需成分通常是 油、水、 乳化剂 和助乳化剂 。当油、乳化剂和助乳化剂确定 了之后,可通过 三相图找出纳米乳区域,从而确定 它们的用量。
(2)配制纳米乳: 由相图确定处方后,将各成分按 比例混合即可制得纳米乳,且与各成分加入的次序 无关。通常制备 W/O型纳米乳比 O/W型纳米乳容易。
? 如果药物或其他成分易于氧化,则制备的各步 都在氮气下进行,如有成分对热不稳定,则采 用无菌操作。
影响亚纳米乳形成的因素:
1.稳定剂的影响:
? 稳定剂可增大膜的强度、使药物的溶解度增大、 使亚纳米乳的 ξ电位绝对值升高,有利于亚纳 米乳的稳定。
2.混合乳化剂的影响
? 单独使用一种乳化剂时,不能得到稳定的乳剂, 使用两种或两种以上的乳化剂可在油 -水界面形 成复合凝聚膜,进而提高乳剂的稳定性。
(6)其它 复乳法、冷冻干燥法、 pH 梯度法、前 体脂质体法等。
4. 脂质体的载药
“主动载药 ”,即通过脂质体内外水相的不同 离子或化合物梯度进行载药,主要有 K+-Na+ 梯度和H+梯度(即pH 梯度)等。
传统上,人们采用最多的方法是“ 被动载药 ” 法。所谓“被动载药”,即首先将药物溶于水 相或有机相 (脂溶性药物 )中,然后按所选择的 脂质体制备方法制备含药脂质体。
? 脂质体(liposomes) 是由磷脂和胆固醇组成, 具有类似生物膜双分子层结构的封闭囊状体。
单室脂质体
(单层磷脂双分子层膜)
大单室脂质体
LUVs (0.1-1μm)
小单室脂质体
SUVs (0.02-0.08μm)
多室脂质体(1-5 μm)
MLVs( 多层磷脂双分子层膜)
SUV 20-100nm
对于脂溶性的、与磷脂膜亲和力高的药物, “被动载药”法较为适用。而对于两亲性 药物,其油水分配系数受介质的 pH 值和
离子强度的影响较大,包封条件的较小变 化,就有可能使包封率有较大的变化,首 选“主动载药” 方法。
5. 脂质体的修饰
长循环脂质体 免疫脂质体 糖基脂质体 温度敏感脂质体 pH 敏感脂质体 磁性脂质体 声波敏感脂质体
第五节 聚合物胶束、纳米乳、 亚纳米乳的制备技术
一、定义
? 聚合物胶束 (polymeric micelles)是由合成的 两亲性嵌段共聚物在水中自组装形成的一种 热力学稳定的胶体溶液。
一、定义
?纳米乳 (nanoemulsion) 是粒径为 10~100nm 的 乳滴分散在另一种液体中形成的胶体分散系 统,其乳滴多为球形,大小比较均匀,透明 或半透明,经热压灭菌或离心也不能使之分 层,通常属热力学稳定系统。
摄取, 从而使脂质体清除速率减慢,血液中驻留 时间延长,使药物作用时间延长
(2)温度敏感脂质体,又称热敏脂质体 由Tc稍高于体温的脂质组成的脂质体,其药物 的释放对温度具有敏感性。热敏脂质体的特点 是在受热时,可将包封药物释放至无内吞作用 的靶细胞,这种热释放取决于脂质体的 Tc。
(3)pH 敏感脂质体,又称为酸敏感脂质体 若干动物和人体肿瘤间质液的 pH 比正常组织 低,设想组成的脂质体能在低 pH 范围内释放 药物,因而设计了 pH 敏感脂质体。对 pH 敏感 的类脂有 N-十六酰L-高半胱氨酸 (PHC) 和游离 的高半胱氨酸。
4) 在体内使药物具有定向分布的靶向性特征, 包括:被动靶向、物理和化学靶向、转移靶 向、主动靶向;
2. 脂质体的作用特点
5)药物包裹在脂质体中是非共价键结合,因此 易与载体分离,进入体内可以在指定部位完 全释放出来;
6)药物被包封于脂质体中,能够降低药物毒性, 增强药理作用。
7)脂质体制剂能够降低药物的消除速率,延长 药物作用时间,起到缓释、增加药物的体内 外稳定性的作用。
稳定的聚合物胶束, PEG 段分子量通常要求 在1000-15000 之间,疏水段与此相当或稍小
二、常用载体材料
纳米乳和亚微乳的制备材料:
乳化剂 助乳化剂
选用乳化剂的原则: (1)要考虑乳化剂使纳米乳稳定的乳化性能, (2)要考虑毒性、对微生物的稳定性和价格等。
1.天然乳化剂
? 如多糖类的阿拉伯胶、西黄蓍胶及明胶、白蛋 白和酪蛋白、大豆磷脂、卵磷脂及胆固醇等。
(1)长循环脂质体或空间稳定脂质体 被神经节苷酯( GM1 )、磷脂酰肌醇( PI )、聚 乙二醇( PEG )、聚丙烯酰胺( PPA )、聚乙烯 吡咯烷酮( PVP )等在脂质体表面高度修饰,交
错重叠覆盖在脂质体表面,形成致密的构象云。 这种立体保护作用取决于聚合物的柔性,位阻保 护脂质体不被血液中的 调理素 (opsonin )识别、
2.其他方法:光子相关光谱法和计算机调 控的 激光测定法等。
(二)药物的含量
? 纳米乳和亚纳米乳中药物含量的测定一 般采用溶剂提取法。
? 溶剂的选择原则是:应最大限度地溶解 药物,而最小限度地溶解其他材料,溶 剂本身不应干扰测定。
(三)稳定性
? 纳米乳通常是热力学稳定系统,有些纳米乳在 贮存过程中也会改变,即粒径变大,个别的甚 至也会分层。
五、亚纳米乳的制备
? 亚纳米乳常作为胃肠道给药的载体,其 特点包括:提高药物稳定性、降低毒副 作用、提高体内及经皮吸收、使药物缓 释、控释或具有靶向性。
(一)亚纳米乳的制备与影响因素
? 一般亚纳米乳要使用 两步高压乳匀机 将粗乳捣 碎,并滤去粗乳滴与碎片,使纳米乳的粒径控 制在比微血管(内径 4μm左右)小的程度。
LUV 100-500nm
MLV 0.1-5 ?m
2. 脂质体的作用特点
1) 制备工艺简单,一般药物都较容易包封在脂 质体中;
2) 水溶性及脂溶性药物都可包裹在同一脂质体 中,药物的包封率主要与药物本身的油水分 配系数及膜材的性质有关;
3) 脂质体本身对人体毒性小,并且脂质体对人 体无免疫抑制作用;
(2)逆相蒸发法 系将磷脂等脂溶性成分溶于有机 溶剂,如氯仿、二氯甲烷中,再按一定比例与含 药的缓冲液混合、乳化,然后减压蒸去有机溶剂 即可形成脂质体。该法适合于水溶性药物、大分 子活性物质,如胰岛素等的脂质体制备,可提高 包封率。
(3)注入法 有乙醚注入法和乙醇注入法。“乙醇 注入法”是将磷脂等膜材料溶于乙醇中,在搅拌 下慢慢注入于 55-65℃含药或不含药的水性介质中, 蒸去乙醇,继续搅拌 1—2h,即可形成脂质体。
(二)自乳化
? 自乳化药物传递系统(self-emulsifying drug delivery systems,SEDDs) 自身包含 一种乳化液,在胃肠道内与体液相遇, 可自动乳化形成纳米乳(O/W) 。
(三)修饰纳米乳
? 用聚乙二醇( PEG)修饰的纳米乳可增加表面的 亲水性,减少被巨噬细胞的吞噬,明显延长在血 液循环系统中滞留的时间 ,称为长循环纳米乳。
?优点是无毒、廉价, 缺点是一般都存在批间差 异,对大量生产很不利。其产品的差异可能在生 产的当时不显著,但几个月之后就明显了,有许 多都可能受微生物的污染(包括致病菌和非致病 菌)。
2.合成乳化剂
离子型 非离子型
? 纳米乳常用非离子型乳化剂,如脂肪酸山梨坦 (亲油性)、聚山梨酯 (亲水性)、聚氧乙烯脂 肪酸酯(亲水性)、聚氧乙烯脂肪醇醚类、聚 氧乙烯聚氧丙烯共聚物类、蔗糖脂肪酸酯类和 单硬脂酸甘油酯等。非离子型的乳化剂口服一 般没有毒性,静脉给药有一定毒性。
3. 脂质体的制备
脂质体的制备方法有多种,根据药物的性质 或研究需要来进行选择。
(1)薄膜分散法 这是一种经典的制备方法,它 可形成多室脂质体,经超声处理后得到小单室 脂质体。此法优点是操作简便,脂质体结构典 型,但包封率较低。
将磷脂、胆固醇等类脂质及脂溶性药物溶于 氯仿中,然后将氯仿溶液在烧瓶中旋转蒸发, 使其在内壁上形成一薄膜;将水溶性药物溶于 磷酸盐缓冲溶液中,加入烧瓶中不断搅拌,即 得脂质体。
(4)光敏脂质体 光敏脂质体是将光敏物质的药物包裹在脂质体 内用来进行光学治疗。当在一定波长的光照射 时,脂质体膜与囊泡物质间或脂质体之间发生 融合作用而释放药物。制备了含胡萝卜素或全 反视黄醇的光敏脂质体,光照后可发生不可逆 光反应,从而影响膜的流动性,增加其通透性。
(5)免疫脂质体 掺入抗体形成被抗体修饰的具有免疫活性的脂质 体称为免疫脂质体
四、纳米乳的制备
(一)纳米乳的形成条件与制备步骤
1.纳米乳的形成条件
(1)需要大量乳化剂: 纳米乳中乳化剂的用量一 般为油量的 20%~30% ,而普通乳中乳化剂多低于油 量的 10%。
(2)需要加入助乳化剂: 助乳化剂可插入到乳化 剂界面膜中,形成复合凝聚膜,提高膜的牢固性和 柔韧性,又可增大乳化剂的溶解度,进一步降低界 面张力,有利于纳米乳的稳定。
(二)常用的附加剂
? 附加剂用于调节生理所需的pH值和张力。
pH调节剂:盐酸、氢氧化钠 等张调节剂:甘油 稳定剂:油酸及其钠盐、胆酸、脱氧胆酸及其钠盐 抗氧剂及还原剂:维生素 E或抗坏血酸
