药品不良反应监测与报告PPT课件
合集下载
药品不良反应报告与监测管理培训PPT

ADR报告与监测
.
织金县妇幼保健院
04:ADR监测上报
报告组成
3
过程描述
三个项目
ADR报告与监测
.
织金县妇幼保健院
04:ADR监测上报
报告组成
3
过程描述
两个尽可能
ADR报告与监测
.
织金县妇幼保健院
04:ADR监测上报
报告组报告与监测
.
织金县妇幼保健院
02:ADR监测背景
ADR报告与监测
.
织金县妇幼保健院
02:ADR监测背景
ADR报告与监测
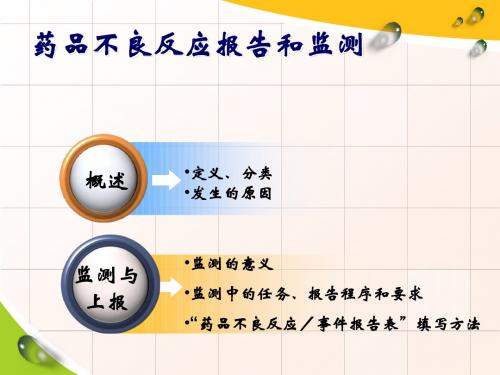
提高安全用药水平,更好地保障公众用药安全。药品上市后安全监管的重要支撑,其目的是及时发现和控制药品安全风险。科学分析评价,根据评价结果,及时发布药品安全警示信息。2020年发布注销安乃近注射液等品种药品注册证书公告共3期,发布药品说明书修订公告共47期。 分析药品与不良反应/事件的关联性,提取药品安全性风险信息,根据风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入安全性信息,更新药品如何安全使用的信息等。当药品的获益不再大于风险时,药品也会撤市。能及时了解药品不良反应发生的表现、程度,并最大限度地加以避免,也是保证患者用药安全的重要措施。 根据WHO统计∶全球每年住院患者中就有10%~20%发生药品不良反应,其中,5%因严重ADR而死亡
报告时限制
ADR报告与监测
.
织金县妇幼保健院
04:ADR监测上报
报告组成
ADR报告与监测
.
织金县妇幼保健院
04:ADR监测上报
报告组成
ADR报告与监测
.
织金县妇幼保健院
04:ADR监测上报
.
织金县妇幼保健院
04:ADR监测上报
报告组成
3
过程描述
三个项目
ADR报告与监测
.
织金县妇幼保健院
04:ADR监测上报
报告组成
3
过程描述
两个尽可能
ADR报告与监测
.
织金县妇幼保健院
04:ADR监测上报
报告组报告与监测
.
织金县妇幼保健院
02:ADR监测背景
ADR报告与监测
.
织金县妇幼保健院
02:ADR监测背景
ADR报告与监测
提高安全用药水平,更好地保障公众用药安全。药品上市后安全监管的重要支撑,其目的是及时发现和控制药品安全风险。科学分析评价,根据评价结果,及时发布药品安全警示信息。2020年发布注销安乃近注射液等品种药品注册证书公告共3期,发布药品说明书修订公告共47期。 分析药品与不良反应/事件的关联性,提取药品安全性风险信息,根据风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入安全性信息,更新药品如何安全使用的信息等。当药品的获益不再大于风险时,药品也会撤市。能及时了解药品不良反应发生的表现、程度,并最大限度地加以避免,也是保证患者用药安全的重要措施。 根据WHO统计∶全球每年住院患者中就有10%~20%发生药品不良反应,其中,5%因严重ADR而死亡
报告时限制
ADR报告与监测
.
织金县妇幼保健院
04:ADR监测上报
报告组成
ADR报告与监测
.
织金县妇幼保健院
04:ADR监测上报
报告组成
ADR报告与监测
.
织金县妇幼保健院
04:ADR监测上报
药物不良反应PPT课件

临床试验优化
改进临床试验设计和方法,提高药物不良反应研究的可靠性和可重 复性。
药物不良反应与疾病预后的关系研究
药物不良反应与疾病进展
01
研究药物不良反应对疾病进展的影响,为临床决策提供依据。
药物不良反应与患者生活质量
02
评估药物不良反应对患者生活质量的影响,促进药物的合理使
用。
药物不良反应与患者心理状态
药物不良反应的影响因素
药物因素
用药方式
不同药物的化学结构、药理作用、剂 量等都可能影响不良反应的发生率。
用药方式如口服、注射、吸入等也可 能影响不良反应的发生。
机体因素
年龄、性别、遗传背景、生理状态、 病理状态等个体差异都会影响药物在 体内的代谢和排泄,从而影响不良反 应的发生。
药物不良反应与基因多态性
药物不良反应ppt课件
contents
目录
• 药物不良反应概述 • 常见药物不良反应及案例分析 • 药物不良反应的机制与影响因素 • 药物不良反应的应对与处理 • 药物不良反应的预防与管理 • 未来展望与研究方向
01 药物不良反应概述
定义与分类
定义
药物不良反应是指在正常用法和 用量下,出现与治疗目的无关的 有害反应。
药物不良反应的发现
在药物治疗过程中,应密切关注患者的 反应,留意是否有任何异常症状或体征 的出现。
VS
及时报告
一旦发现可疑的药物不良反应,应及时向 医生或药师报告,以便及时采取措施。
药物不良反应的评估与诊断
评估严重性
对药物不良反应的严重性进行评估,判断是否需要停药或采取其他紧急措施。
诊断与鉴别诊断
基因多态性是指个体间基因序列的差异,这种差异可能导致不同个体对药物的反应 不同。
改进临床试验设计和方法,提高药物不良反应研究的可靠性和可重 复性。
药物不良反应与疾病预后的关系研究
药物不良反应与疾病进展
01
研究药物不良反应对疾病进展的影响,为临床决策提供依据。
药物不良反应与患者生活质量
02
评估药物不良反应对患者生活质量的影响,促进药物的合理使
用。
药物不良反应与患者心理状态
药物不良反应的影响因素
药物因素
用药方式
不同药物的化学结构、药理作用、剂 量等都可能影响不良反应的发生率。
用药方式如口服、注射、吸入等也可 能影响不良反应的发生。
机体因素
年龄、性别、遗传背景、生理状态、 病理状态等个体差异都会影响药物在 体内的代谢和排泄,从而影响不良反 应的发生。
药物不良反应与基因多态性
药物不良反应ppt课件
contents
目录
• 药物不良反应概述 • 常见药物不良反应及案例分析 • 药物不良反应的机制与影响因素 • 药物不良反应的应对与处理 • 药物不良反应的预防与管理 • 未来展望与研究方向
01 药物不良反应概述
定义与分类
定义
药物不良反应是指在正常用法和 用量下,出现与治疗目的无关的 有害反应。
药物不良反应的发现
在药物治疗过程中,应密切关注患者的 反应,留意是否有任何异常症状或体征 的出现。
VS
及时报告
一旦发现可疑的药物不良反应,应及时向 医生或药师报告,以便及时采取措施。
药物不良反应的评估与诊断
评估严重性
对药物不良反应的严重性进行评估,判断是否需要停药或采取其他紧急措施。
诊断与鉴别诊断
基因多态性是指个体间基因序列的差异,这种差异可能导致不同个体对药物的反应 不同。
药品不良反应监测与报告75页PPT

•பைடு நூலகம்
29、在一切能够接受法律支配的人类 的状态 中,哪 里没有 法律, 那里就 没有自 由。— —洛克
•
30、风俗可以造就法律,也可以废除 法律。 ——塞·约翰逊
46、我们若已接受最坏的,就再没有什么损失。——卡耐基 47、书到用时方恨少、事非经过不知难。——陆游 48、书籍把我们引入最美好的社会,使我们认识各个时代的伟大智者。——史美尔斯 49、熟读唐诗三百首,不会作诗也会吟。——孙洙 50、谁和我一样用功,谁就会和我一样成功。——莫扎特
药品不良反应监测与报告
•
26、我们像鹰一样,生来就是自由的 ,但是 为了生 存,我 们不得 不为自 己编织 一个笼 子,然 后把自 己关在 里面。 ——博 莱索
•
27、法律如果不讲道理,即使延续时 间再长 ,也还 是没有 制约力 的。— —爱·科 克
•
28、好法律是由坏风俗创造出来的。 ——马 克罗维 乌斯
最新药品不良反应及不良反应报告.课件ppt

药品不良反应发生的可能原因
一,药品方面的原因 1)药理作用:很多药品在应用一段时间后,由于
其药理作用,可导致一些不良反应, 例如,长期 大量使用糖皮质激素能使毛细血管变性出血,以 致皮肤、粘膜出现瘀点,瘀斑,同时出现类肾腺 上皮质功能亢进症。 2)药物的杂质:药物生产中可能混入微量高分子 杂质,亦常渗入赋形剂等,如胶囊的染料常会引 起固定性皮疹。青霉素过敏反应是因制品中含微 量青霉素烯酸、青霉素噻唑酸及青霉素聚合物等 物质引起的。
第六十条 医疗机构有下列情形之一的,由所在地卫生行 政部门给予警告,责令限期改正;逾期不改的,处三万元以 下的罚款。情节严重并造成严重后果的,由所在地卫生行政 部门对相关责任人给予行政处分:
(一)无专职或者兼职人员负责本单位药品不良反应监
测工作的;
(二)未按照要求开展药品不良反应或者群体不良事件
减药或停药也可引起不良反应,例如治疗严重皮疹,停 用糖皮质激素或减药过速时,会产生反跳现象。 许多因素可增加ADR的发生,如联合用药、年龄、怀孕、某些 疾病、遗传因素。
药品不良反应的分类
按药理作用的关系:可分为A型、B型、 C型;
按严重程度分级:可分为轻、中、重度三 级;
按发生机制:
可分为A (Augmemed)、 B (Bugs) C (Chemical)、 D
(Delivery), E (Exit), F (Familial),G (Genetoxicity)、H (Hypersensitivity), U (Unclassified)。
药品不良反应的分类
A型(量变型异常):剂量相关的不良反应
是由药品的药理作用增强所致,通常包括副作用、 毒性作用、后遗效应、继发反应等。
药品不良事件发生的可能原因
药品不良反应监测报告制度PPT课件

监督管理
为完成不良反应监测任务,每个临床医疗科室 每月上报可疑不良反应例数不低于(1例/20张 使用床位)标准,(不足1例的多月累积计 算)。低于规定最低上报例数的医疗科室给予 处罚,每少报1份罚科室200元。药剂科每月公 布各临床医疗科室可疑不良反应上报情况,并 按上述处罚办法报财务科。
药品不良反应上报数量和质量纳入医院绩效考 核的内容。
3、药剂科每季度对本院药品不良反应上报情 况进行汇总、分析、评价、总结,提出改进建 议,交医务科审核,并将有关情况在药讯上公 示。
监督管理
发现了可疑严重药品不良反应或药害事件,应 报告而未能在规定时间内报告者、未按规定报 送者、隐瞒可疑药品不良反应资料者,由医院 药事管理与药物治疗学委员会确定责任人,给 予罚款500元处理;造成严重后果的,要依据 法规追究相关人员的责任。
2、组织落实食品药品监督管理局有关药品不良反应监 测工作任务。
3、组织药品不良反应的宣传、教育与培训工作,督促 临床医师、护师、药师填写药品不良反应报告表,指 导合理用药。
4、制订相应的考核措施,确保药品不良反应、药害事 故报告和监测工作的落实。
5、协调全院药品不良反应与药害事故工作的其他重要 事宜。
药品不良反应的报告程序
1、医师、护士或药师等一旦发现可疑的药品 不良反应,应当立即报告患者的主管医师、并 通告药剂科。
2、各临床科室联络员负责本科室的药品不良 反应的搜集、汇总、上报,监督协调医护人员 不良反应的报告。
药品不良反应的报告程序
3、各临床科室医生、护士应重视药品不良反应与药品 损害事件报告和监测工作,
药品群体不良事件报告和监测
药品群体不良事件,是指同一药品在使 用过程中,在相对集中的时间、区域内, 对一定数量人群的身体健康或者生命安 全造成损害或者威胁,需要予以紧急处 置的事件。
药品不良反应报告和监测检查和和检查中发现的问题ppt课件

核实、分析、评价、管理和维护、数据、 技术指导等。 • 相关专业背景。 • 接受过ADR培训,具备分析评价能力。 • 相关部门人员接受过培训,熟悉位报告程 序及要求。
企业提供资料清单
• ADR监测专职人员职责描述、 专业背景、培训记录等。
• ADR报告相关部门人员培训记 录。
9
序号 检查项目
检查内容
文件清单
是否符合
2.1.1是否配备ADR监测联系人、ADR监测部门负责人、1名ADR 监测专职人员?
□是□否
2.1配备专职人员开展药品不 2.1.2市场等部门的是否配备人员监测ADR? 良反应报告和监测工作。 2.1.3是否有ADR监测人员联系方式登记表,是否能够联系?
□是□否 □是□否
2.1.4 是否有相关监测人员的聘书及资质证明(内容参考2.3)? □是□否
• 立即开展调查,在7日内完成调查报告。
• 迅速开展自查,分析事件发生原因,必要时暂 停生产、销售、使用和召回相关药品,并报所
在地省级药品监督管理部门。
• 药品群体不良事件列表,包括药品名
21
项目 编号 4.1.1 4.1.2 4.1.3 4.1.4 4.1.4 4.1.5 4.2.1
4.4.3
4.5.2
4.5.3
不符合 次数 3 1 2 3 3 6 2
1
2
2
具体内容
未主动收集ADR信息。 企业员工不了解药品安全信息的收集途径。 药品安全性信息来源不全面。 无开展文献检索的记录。 未开展文献检索与报告工作,也无相关记录。 未收集到个例ADR报告。 未收集新的、严重、一般报告,也无内部简表。 企业相关人员对关联性评价的评判标准还不够了 解。 获知一般ADR,未按时限要求通过国家ADR监测系 统上报。 获知死亡病例,未通过国家ADR监测系统上报。
企业提供资料清单
• ADR监测专职人员职责描述、 专业背景、培训记录等。
• ADR报告相关部门人员培训记 录。
9
序号 检查项目
检查内容
文件清单
是否符合
2.1.1是否配备ADR监测联系人、ADR监测部门负责人、1名ADR 监测专职人员?
□是□否
2.1配备专职人员开展药品不 2.1.2市场等部门的是否配备人员监测ADR? 良反应报告和监测工作。 2.1.3是否有ADR监测人员联系方式登记表,是否能够联系?
□是□否 □是□否
2.1.4 是否有相关监测人员的聘书及资质证明(内容参考2.3)? □是□否
• 立即开展调查,在7日内完成调查报告。
• 迅速开展自查,分析事件发生原因,必要时暂 停生产、销售、使用和召回相关药品,并报所
在地省级药品监督管理部门。
• 药品群体不良事件列表,包括药品名
21
项目 编号 4.1.1 4.1.2 4.1.3 4.1.4 4.1.4 4.1.5 4.2.1
4.4.3
4.5.2
4.5.3
不符合 次数 3 1 2 3 3 6 2
1
2
2
具体内容
未主动收集ADR信息。 企业员工不了解药品安全信息的收集途径。 药品安全性信息来源不全面。 无开展文献检索的记录。 未开展文献检索与报告工作,也无相关记录。 未收集到个例ADR报告。 未收集新的、严重、一般报告,也无内部简表。 企业相关人员对关联性评价的评判标准还不够了 解。 获知一般ADR,未按时限要求通过国家ADR监测系 统上报。 获知死亡病例,未通过国家ADR监测系统上报。
药品不良反应报告及检测管理办法》ppt课件模板

2007年 美国14种小儿感冒止咳药安全性问题
2007年 硫酸普洛宁(凯希)事件
2007年 抑肽酶可增加患者的死亡风险
2007年 骁悉可能增加流产和先天性畸形,引起白质脑病
2008年 输美肝素中查出“多硫酸软骨”素
2010年 西布曲明
On the evening of July 24, 2021
表明,用于感冒咳嗽药中含苯丙醇胺(简
称PPA,下同)的药品制剂,服用后易出
现严重不良反应,如过敏、心律失常、 高
血压、急性肾衰、失眠等症状。美国食品
与药品管理局近期也有同样报道,甚至发
生出血性中风的病例,这些情况已显示该
药品制剂存在不安全问题。
On the evening of July 24, 2021
药品不良反应原因
/
7
/
2
6
研究时间短(Too
B
short)
病例少(Too few)
A
上市前 研究局
限性
试验对象年龄范 C 围窄(Too
medium-aged )
E
目的单纯(Too restricted)
D 用药条件控制较严
(Too
homogeneous
)
On the evening of July 24, 2021
基本概念
Courseware template
/
7
/
2
6
• 药品不良反应 是指合格药品在正常用法用
量下出现的与用药目的无关的有害反应。
• 新的药品不良反应 是指药品说明书中未载 明的不良反应。
On the evening of July 24, 2021
2
《药品不良反应》PPT课件

➢ 4. 判断结果:80例中发生≥2例的概率P(≥2)<0.01, 拒绝H0,接受H1,认为注射该疫苗后某反应率高于一般情 况。
精品文档
➢ 四、病例-对照研究(case-control study)
➢ 病例对照研究是从不良事件的发生去推断病因, 即由果至因的一种回顾研究。它从发生不良事件 的患者中选择一组人作为病例组,从未出现不良 事件的用药者中选择一组人作为对照组,然后比 较两组用药情况,以分析药品与不良事件间是否 存在联系以及联系的性质和强度。
过敏反应。
药物变态反应的共同特点: ①有的病人血内可发现抗体,并可在皮试时引起
阳性反应; ②药物不同,但症状相同,最常见者为发热、皮
疹,一般不严重,但也可引起过敏性休克或其 他严重反应; ③反应的发生与剂量无明显相关,常用量或极少 量(如皮试)都可发生; ④病人出现该药的变态反应前常有与该药的接触 史; ⑤过敏体质者较易发生。
明显减慢、半衰期延长
精品文档
➢ (三)用药方面: ➢ 1.药物相互作用(Drug interaction)是指并用或
先后应用两种以上药物,在体内发生药效或毒性的 变化.
➢ 用药种类越多,不良反应发生率越高.
➢ 因为(1)各药均有本身的不良反应存在,可相加;
➢
(2)药物间存在相互作用
➢ 药效学:例如使用排钾利尿药、糖皮质激素的患 者血钾水平偏低,心脏对洋地黄类药物更敏感, 易引起心率失常;又如癫痫病人用抗癫痫药物预 防发作期间,因利血平可降低惊厥阀,若同用, 易使癫痫发作。
精品文档
➢ 例2,1970年Herbert医生发现,1966-1969年的 4年间该地就有8例15-22岁的女青年患阴道腺癌 是一种罕见的癌瘤,当地资料显示:阴道癌占 女性生殖系统癌的2%,而腺癌又仅占其中5%10%,发生年龄多在50岁以上,常见为鳞状上皮 细胞癌。Herbert医生从这些阴道腺癌突然呈现 时间和地区的高度聚集性及发病年龄早的现象 中,考虑有可能有另一种致癌物质存在,于是 对病因提出下列4种假说:
药品不良反应监测报告培训 PPT

药品不良反应的机理
1
2
3
是由药物的药理作用增 强所致,主要包括:
副作用 毒性作用 后遗效应 继发反应
与正常药理作用完全无 关的一种异常反应,主 要包括:
特异性遗传素质反应 药物过敏反应
一般在长期用药后出现, 潜伏期较长,没有时确 的时间关系,难以预测。 例如:
已烯雌酚致阴道腺癌
药品不良反应的发生率
药品不良反应监测报告
药品不良反应的概念
概念
药品不良反应(ADR)
合格药品在正常用法用量下出 现的与用药目的无关的或意外 的有害反应。源自释义对ADR的正确认识
1 排除了药品质量问题(伪劣药品) 2 排除了药物滥用(吸毒) 3 排除了药物超量误用 4 排除了医疗事故 5 排除了医疗差错
开展药品不良反应监测的意义
部长 陈竺
二○一一年五月四日
药品不良反应报告和监测管理办法
第十三条 药品生产、经营企业和医疗机构应当 建立药品不良反应报告和监测管理制度。药品生 产企业应当设立专门机构并配备专职人员,药品 经营企业和医疗机构应当设立或者指定机构并配 备专(兼)职人员,承担本单位的药品不良反应 报告和监测工作。 第十九条 药品生产、经营企业和医疗机构应当 主动收集药品不良反应,获知或者发现药品不良 反应后应当详细记录、分析和处理,填写《药品 不良反应/事件报告表》(见附表1)并报告。
药品不良反应报告和监测管理办法
第二十一条 药品生产、经营企业和医疗机构发 现或者获知新的、严重的药品不良反应应当在15 日内报告,其中死亡病例须立即报告;其他药品 不良反应应当在30日内报告。有随访信息的,应 当及时报告。 第六十七条 本办法自2011年7月1日起施行。国 家食品药品监督管理局和卫生部于2004年3月4日 公布的《药品不良反应报告和监测管理办法》( 国家食品药品监督管理局令第7号)同时废止。 规范不良反应上报制度,其目的是为了修改完善 说明书内容,制定适合我国人民的药品说明书。
药品不良反应与检测报告ppt课件
② 2004年 罗非昔布事件 • 默克公司进行为期三年研究发现,万络会 使心脏病发作和中风危险性增加1倍, 2004年9月30日默克公司宣布10月1日起 全球撤回万络
③2006年 鱼腥草注射液 • SFDA于2006年接到众多因使用鱼腥草素钠 注射液发生不良反应事件,经SFDA专家组 调查结果表明静脉使用血腥草,不良反应 发生率高,SFDA修改鱼腥草注射的为肌肉 注射。
(二)药品不良反应分类
⑦ G类(genetotoxcity,基因毒性反应):能引起人类基 因损伤的ADR,如致畸、致癌等 。
⑧
H类(hypersensitivity,过敏反应):该类反应不是 药理学可预测的,且与剂量无关,必须停药。 如过敏性皮疹、光敏性皮炎等。
环丙沙星光敏性皮炎
(二)药品不良反应分类
剂量不相关
药物变态反应 特异质反应
无清晰时间联系 致癌、致畸.
(二)药品不良反应分类
① A类(augmented,扩大反应):药物对人体呈剂量 相关的反应,它可根据药物或赋形剂的药理学和 作用模式来预知,停药或减量可以部分或完全改善。 停药或减量后症状很快减轻或消失,发生率高,但死亡 率低。 通常包括副作用、毒性作用、后遗效应、继发反应等。
(二)药品不良反应分类
② B类(bugs,药物反应):由药物促进某些微生物生长 引起的ADR,这类反应可以预测,它与A类反应的 区别在于B类反应主要针对微生物。
(二)药品不良反应分类
③ C类(chemical,化学反应):该类反应取决于赋形物 或药物的化学性质,化学刺激是其基本形式,这类 反应的严重程度主要取决于药物浓度。 如静脉炎、注射部位局部疼痛外渗反应等 。
机体方面
种族
药物代 谢酶
药品不良反应监测与报告课件

加强药品不良反应监测与报告的宣传教育 ,提高公众对药品安全的认识和意识,鼓 励公众积极参与药品安全监管。
药品不良反应监测与报告可以 为药品研发和上市审批提供重 要参考,促进药品研发和上市 审批的科学性和规范性。
国内外现状与法律法规
国际现状
法律法规
国际上许多国家和地区已经建立了完 善的药品不良反应监测与报告制度, 形成了较为完善的法律法规和技术规 范体系。
国内外均有相关法律法规对药品不良 反应监测与报告进行规范,如《药品 管理法》、《药品不良反应报告和监 测管理办法》等。
国内现状
我国已经建立了较为完善的药品不良 反应监测与报告制度,相关法律法规 和技术规范不断完善,监测体系逐步 健全。
02
药品不良反应的识别与评估
常见不良反应的症状与表现
消化系统反应
如恶心、呕吐、腹 泻、胃痛等。
心血管系统反应
如心悸、血压升高 或降低等。
皮肤过敏反应
如皮疹、瘙痒、红 肿等。
呼吸系统反应
如哮喘、咳嗽、呼 吸困难等。
神经系统反应
如头痛、眩晕、失 眠、幻觉等。
不良反应的评估标准与流程
01
02
03
评估标准
根据不良反应的严重程度 、持续时间、对患者健康 的影响等因素进行评估。
报告流程
患者或医护人员发现不良 反应后应及时报告,相关 部门对报告进行核实、调 查和分析。
监测系统
建立药品不良反应监测系 统,定期收集和分析不良 反应数据,及时发现和评 估风险。
分析不良反应发生的风 险因素,如患者年龄、
性别、遗传因素等。
案例分析结论与建议
结论
该患者的不良反应属于氟喹诺酮类药物已知风险,与药品使用存在因果关系。
第四章__药物不良反应监测 PPT课件

3.全国药物不良反应监测体系初步形成
• 1989年,卫生部药品不良反应监察中心,省市不良反应监 测中心,地市级、基层单位成立了监测机构。形成初具规 模的药物不良反应监测系统。 • 1998年,国家药品监督管理局成立
• 1999年,国家药品监督管理局药品评价中心成立
• 2002年,我国31个省、自治区、直辖市和解放军全部组建 成立了药品不良反应监测中心。
7.加强宣传培训,开展项目研究 应监测技术性强
药物不良反
8.加强信息评价、反馈,实现服务功能 分析评价方法,提高分析评价水平 9.启动医疗器械不良事件监测工作
改进
(三)我国药物不良反应监测工作展望
• 1.完善药物不良反应监测体系,加强依法行政工作 • 2.建立健全药物不良反应监测技术体系,提高监测水平 • 3.加强药物不良反应分析评价和药物流行病学调研工作 • 4.开展对中药的药物不良反应监测和安全性研究 • 5.继续做好宣传和协调工作,推动药物不良反应监测工 作不断发展。
三、药物不良反应的临床表现
1.过渡作用 使用推荐剂量时出现的过强的药理作用。可由 于机体对药物的高敏感性引起。如:镇静药物引起的嗜睡、 降压药物引起的血压过低等。
2.首剂效应 某些药物在首剂使用时,机体对药物的作用尚 未适应,机体对药物的反应较为强烈,多为一过性。 3.副作用 是在正常剂量内伴随治疗作用出现的其他不利作 用。如:激素引起的钠水潴留。 4.毒性反应 是指药物引起机体的生理生化机能异常和组织 结构的变化。通常毒性反应发生在、超过治疗量并长时间使 用的药物,以及药理作用较强、治疗窗较窄的药物。大剂量 使用时几乎每个患者都会出现性质相同的中毒症状。肝肾功 能受损的人、老人、儿童易发生毒性反应。 急性毒性反应 (发生在用药后较短时间内)
医疗机构药品不良反应监测与上报ppt课件

我国药品不良反应监测现状
个人
各
市
中
心 经营企业
生产企业
医疗机构
SFDA 国家中心
WHO
我国药品不良反应监测现状
600000 500000
病例报告增长情况
547000
400000 300000
369000
200000 100000
0
173000
3600 500 600 4700 7700 170003680070500
教学课时:一课时。
一日三餐,定时定量,
的可能原因 给药方法 小提示84:将应聘者的简历与面试记录、别人的参考意见以及对比表一同妥善保存。
2.3.6妥善对待应聘者
其他因素
药品不良事件的可能原因
1.药理作用
药 物 因
2.药物相互作用 3.药物的理化性质、副产物、分解产
物、代谢产物的作用 4.药物赋形剂、溶剂、染色剂等附加
素
剂的影响
5.药物杂质的影响
合并用药种类与ADR发生率之间对应关系
40%
45%
ADR发生率
24%
7% 4.20%
5种
6-10种
11-15种 16-20种 21种以上
药品不良事件的可能原因
1.年龄
机
2.性别
体 因
3.遗传和种族
素
4.病理状态
5.食物、营养状态
药品不良事件的可能原因
1.给药途径
给
2.给药间隔和时辰
己烯雌酚-阴道腺癌
药品不良反应的发生率
十分常见:≥1/10 常见:≥1/100~<1/10 偶见:≥1/1000~<1/100 罕见:≥1/10000 ~<1/1000 十分罕见:<1/10000
药品不良反应的报告和处置 ppt课件

六、药品不良反应信息管理
(一)药品不良反应信息分析与反馈
各级药品不良反应监测机构对收到的药品不良反应报 告和监测资料进行统计和分析,并以适当形式反馈。
国家药品不良反应监测中心根据对药品不良反应报告
和监测资料的综合分析和评价结果,及时发布药品不 良反应警示信息
六、药品不良反应信息管理
(二)药品不良反应信息发布
2. 药品不良反应监测的主要方法
(1)自发呈报(spontaneous reporting)
英国黄卡系统(Yellow Card System) 美国的Medwatch系统
(2)强制报告
英国的绿表制度
(3)处方事件的监测(Prescription Event Monitoring, PEM
报告一次。
四、药品不良反应的报告和处置
2. 报告程序和要求
国产药品的定期安全性更新报告向药品生产企业所在地省级药品不良反应 监测机构提交。 进口药品(包括进口分包装药品)的定期安全性更新报告向国家药品不良 反应监测中心提交。
省级药品不良反应监测机构对收到的定期安全性更新报告进行汇总、分析
和评价,于每年4月1日前将上一年度定期安全性更新报告统计情况和分析 评价结果报省级药品监督管理部门和国家药品不良反应监测中心。
品监督管理局、
卫生部颁布了 《药品不良反 应监测管理办 法》(试行)
品监督管理局
和卫生部共同 颁布《药品不 良反应报告和
监测管理办法》
二、我国药品不良反应报告与监测制度
(二)我国药品不良反应监测制度的特点
我国药品不良反应监测实行强制性报告为主,自发报 告为辅的报告制度。
国家实行药品不良反应报告制度。 药品生产企业(包括进口药品的境外制药厂商)、药品经营企 业、医疗机构应当按照规定报告所发现的药品不良反应。 国家鼓励公民、法人和其他组织报告药品不良反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
h
12
二.药品上市前安全性研究的重要性 和局限性
药品临床前毒理学研究的重要性的意义在 于通过受试药的毒理学试验。确定受试药 的剂量与毒性作用相关性以及药物安全剂 量范围,认识药物毒性作用的靶器官和靶 组织,以确定药物作用的选择性,观察药 物毒性作用的发生,临床特征及发展过程 是否可逆,以判定药物毒性的性质,这些 研究结果是预防药品临床应用安全性的重 要依据。
h
3
《药品不良反应监测管理办法》
中国政府、卫生部、国家药品监督管理局, 在1999年国药管安401号文件中明确规定, 为加强上市的药品安全监管,保障人体用 药安全有效,出台了《药品不良反应监测 管理办法》,第一章:总则。第二章:机 构和职责。
h
4
《药品不良反应监测管理办法》
第三章:报告程序和要求,第 12条规定国家对 药品不良反应实行逐级、定期报告制度,严重 或罕见的药品不良反应需随时报告,必要时可 以越级报告。第13条规定:药品不良反应的报 告范围。①上市5年以内的药品和列为国家重 点监测的药品,报告该药品引起的所有可疑不 良反应。②上市5年以上的药品,主要报告该 药品引起的严重、罕见或新的不良反应。
h
8
转变观念,提高认识,努力做好药 品不良反应监测
1989年我国组建国家药品不良反应监测中心, 这个机构的设置。为广泛收集本辖区内药 品不良反应病例报告和开展本地区药品不 良反应监测工作和交流发挥了积极作用。
h
9
实施药品不良反应报告制度的意义
在谈实施药品不良反应报告制度的意义问题时, 应先了解哪些是固有习惯意识,哪些是偏见。
氨基比林 退热、止痛 粒细胞缺乏
硫代硫酸 治疗类风湿、 肝、肾、骨
钠金
哮喘
髓损害
死亡儿童大 于585人
超过100人
半数人死亡 超过1万人 之多
死亡超过 2082万人
约用药1/3 人
h
14
16种本世纪国外发生的重大要害事件
年代 地区 药物 用途
毒性表现 受害人数
1935 年— 1970年 1937年
药品不良反应监测与 பைடு நூலகம்告
h
1
药品不良反应定义
主要是指合格的药品在正常用法用量下出 现的与用药目的无关的意外的有害反应。
药品是人们防病治病,调节生理功能,提 高健康水平的重要武器,它与人民大众的 生活水平、生命质量以及社会发展密切相 关。对已上市的药品的安全性有效性的再 评价和不良反应监测,近年来日益受到人 们的关注。
h
13
16种本世纪国外发生的重大要害事 件
年代
地区
药物
用途
毒性表现 受害人数
1890年— 1950年
1900年— 1949年
1930年— 1960年
1922年— 1970年
1940年
欧、美、 甘汞 亚
欧、美 蛋白银
通便、驱虫、 汞中毒 制牙粉
消毒、抗炎 银质沉着症
各国
醋酸铊 头癣(脱发用)铊中毒
各国 各国
1953年
欧、美 二硝基 减肥 酚
美国
黄胺酏 抗菌消炎
含丙二 醇
欧、美 非那西 止痛、退
加
汀
热
1954年 法国
二磺, 治疗疥、
二已基 粉刺
锡
h
白内障
约万人失
明、死亡 9人
二甘醇损 358人中 害肝肾 毒、107
人死亡
肾脏损害 肾病2000
溶血
人、死亡
500人
神经毒性、中毒270
脑炎、失 人、死亡
明
110人 15
第四章:奖励和处罚。
h
5
《药品不良反应监测管理办法》
第五章:附则28条规定用语的含义是:
①、药品不良反应,主要是指合格的药品在正常 用法用量下出现的与用药目的无关的或意外的有 害反应。
②、上市药品,是指经国家药品监督管理部门审 批准并发给生产(或试生产)批准文号或进口药 品注册证的药品制剂。
16种本世纪国外发生的重大要害事件
h
2
目前临床上还存在着大量的不合理用药现
象。特别是抗生素解热镇痛药,肾上腺皮 质激素品种滥用更是让人担忧。据WHO资 料统计抗生素不合理使用在美国达41%,澳 大利亚达48%,泰国达91%,我国不合理用
药的发生率从回顾性病例分析得到的数字 约为住院病人19.6—20%,即有20%—25%的
病人存在不合理用药现象,造成了临床上 医源性疾病和药源性疾病时有发生。
h
7
转变观念,提高认识,努力做好药 品不良反应监测
我国的药品不良反应监测工作起于80年代。 1983年卫生部组织有关专家起草《药品毒副
反应》的报告制度,属于政府文件。
1984年我国药品管理法颁布,1985年实施, 规定药品管理部门,卫生行政,药品生产 企业,药品经营企业和医疗单位要经常考 察并组织调查药品的质量、疗效和不良反 应。
10
2. 药品不良反应就是医疗事故的偏见
也有相当一部分人认为,药品不良反应就等于
医疗事故,是医生责任心不强或失误造成的,所 以出现药品不良反应之后,医生害怕因医疗事故 承担责任,或隐瞒遮掩,或推向疾病本身,不敢 报告也不想报告,担心自己的威信受到影响,医 院的形象受到破坏(实际上,药品不良反应不是 医疗事故,在描述不良反应概念时)已说明与医 疗事故不同。
③、可疑不良反应,是指怀疑而未确定的不良反 应。
h
6
第五章:附则28条规定用语的含 义是:
④、新的药品不良反应,是指药品使用说明书或 有关文献资料上未收载的不良反应。
⑤、医疗预防保健机构,是指从事预防、诊断、 治疗疾病活动并使用药品的医疗机构,卫生防疫 站机构和保健机构。
⑥、药品不良反应报告的内容和统计资料是加强 药品监督管理,指导合理用药的依据,不是医疗 纠纷、医疗诉讼和处理药品质量事故的依据。
1. 药品不良反应必须与药品质量有关的偏见 相当一部分人认为,包括医务人员在内的认识, 发生药品不良反应一定是药品的质量有问题,无 论医生和患者,对药品不良反应的出现,第一印 象是由药品不合格所致,把责任推向企业,而生 产企业面对发生的药品不良反应以为就是自己的 产品有质量问题,因而不敢正视它。
h
h
11
3. 药品不良反应是个体差异与医疗行为无关的偏 见。
病人到医院看病发生了不良反应,常被认为
是个体差异,如过敏是变态反应,是过敏体质, 是疾病的转归,病人用药后致死、致残是自身的 原因,与医疗行为无关,与药品无连,用不着报 告。还有许多类似的偏见,从而引发了各种各样 的由于认识不一致或处理不当导致的由正常ADR 发展成医疗纠纷。
