多次跨膜
细胞生物学 名词解释 第五章 物质的跨膜运输

维持细胞内较低的Ca2+浓度
钙泵作用机制
原理与钠钾泵相似,Ca2+泵含有10个α螺旋,Ca2+泵处于非磷酸化状态时,2个α螺旋中断形成胞质侧结合2个Ca2+的空穴,ATP在胞质侧与其结合位点结合,水解使相邻结构域Asp磷酸化,导致跨膜螺旋重排,破坏了Ca2+结合位点并释放Ca2+到膜的另一侧。每分解一个ATP,泵出2个Ca2+,将Ca2+输出细胞或泵入内质网腔中储存起来
膜转运蛋白分为两类:载体蛋白和通道蛋白
载体蛋白
多次跨膜蛋白,能与特定的溶质分子结合,通过改变构象介导跨膜转运,有专一性,介导被动运输,也可以介导主动运输
通道蛋白
3种类型:离子通道、孔蛋白、水孔蛋白
形成选择性和门控性跨膜通道。
离子通道
亲水性跨膜通道,允许适当大小的离子顺浓度梯度通过
离子通道的特征:转运速率高,没有饱和值,并非连续性开放而是门控(可开/关控制其活性)、选择性。
胞吐作用
exocytosis
细胞内合成的生物分子(蛋白质和脂质等)和代谢物以分泌泡的形式与质膜融合,将内容物释放到细胞表面或胞外的过程。分为组成型和调节性胞吐途径
胞吞作用
endocytosis
通过质膜内陷形成膜泡,将细胞外或细胞质膜表面的物质包裹到膜泡内并转运到细胞内以维持细胞正常的代谢活动。(胞饮和吞噬作用)。
细胞生物学
第五章物质的跨膜运输
简单扩散、被动运输(协助扩散)、主动运输、胞吞胞吐中文英Fra bibliotek/备注解释
被动运输
指溶质顺着电化学梯度或浓度梯度,在膜转运蛋白协助下的跨膜转运方式,又叫协助扩散。不需要能量。
简单扩散
小分子的热运动使分子以扩散的方式,从膜的一侧沿浓度梯度降低的方向进入另一侧,也叫自由扩散(无需能量和转运蛋白协助)
细胞生物学-物质的跨膜运输(翟中和第四版)-含注释!!!
动物、植物细胞主动运输比较
三、ABC 超家族
• ABC 超家族也是一 类ATP 驱动泵 • 广泛分布于从细菌 到人类各种生物中, 是最大的一类转运 蛋白 • 通过ATP 分子的结 合与水解完成小分 子物质的跨膜转运
(一)ABC转运蛋白的结构与工作模式
• 4 个“核心”结构域
– 2 个跨膜结构域,分别含6 个跨
H+/K+ ATPase Control of acid secretion in the stomach
二、V 型质子泵和 F 型质子泵
• V 型质子泵广泛存在 于动物细胞的胞内体 膜、溶酶体膜,破骨 细胞和某些肾小管细 胞的质膜,以及植物、 酵母及其他真菌细胞 的液泡膜上 (V 为 vesicle) • 转运 H+ 过程中不形成 磷酸化的中间体
导兴奋)
B. 配体门通道(胞外配体)
(突触后膜接收乙酰胆碱的
受体)
C. 配体门通道(胞内配体)
D. 应力激活通道(内耳的 听毛细胞)
含羞草“害羞”的机制
• 估计细胞膜上与物质转运有关的蛋白占核基因编码蛋白的 15~30%,细 胞用在物质转运方面的能量达细胞总消耗能量的2/3。
• 两类主要转运蛋白:
P型泵的主要特点:都是跨膜蛋白,并且是由一条多肽完成 所有与运输有关的功能,包括ATP的水解、磷酸化和离子 的跨膜运输。
Na+-K+ATP酶的分子结构:
α β 两种亚基组成的二聚体。
α 亚基具有ATP酶的活性;
β 亚基是具有组织特异性的糖蛋白。
(一)Na+-K+ 泵(Na+-K+ ATPase)
Figure 11-14 Molecular Biology of the Cell (© Garland Science 2008)
动物细胞的结构与功能
细胞是机体的基本结构和功能单位。机体 内所有的生理功能和生化反应都是在细胞及 其产生的物质基础上进行的。因此了解细胞 的结构和功能,对于机体各系统、器官的生 理功能的进一步学习具有重要作用。
一、动物细胞的结构
细胞膜的基本结构
物质 的
跨膜 运输
二、细胞膜的物质转运功能
被动运输
简单扩散
通道蛋白(channel protein)是横跨质膜的亲水性通 道,允许大小和电荷适宜的离子顺梯度通过,又称为离子通 道蛋白,通过门控介导溶质的被动跨膜运输。
电压门通道
配体门通道
压力激活通道
N型乙酰胆碱受体 由4种不同的亚单位组成的5聚体,总分子量约为290kd。当受体结合配 体乙酰胆碱时,引起通道构象改变,通道瞬间开启,膜外Na+内流,膜内K+ 外流。使该处质膜去极化,引起肌细胞动作电位,肌肉收缩。
2、由间隙连接完成的跨膜信号传递
如:由间隙连接组成电突触,快速实现 细胞间信号通讯 ,无须依赖神经递质或信息 物质即可将一些细胞的电兴奋活动传递到相 邻的细胞。
3、由其它受体完成的跨膜信号传递
化学感受器中的G蛋白 气味分子与化学感受器中的G蛋白偶联型受体结合,可
激活腺苷酸环化酶,产生cAMP,开启cAMP门控阳离子通道, 引起钠离子内流,膜去极化,产生神经冲动,最终形成嗅觉 或味觉。
相关概念
❖
静息时,细胞膜内外两侧维持内负外正的稳定
状态,称为极化。
❖ 当细胞受刺激时,膜内电位向负值减小方向变 化,称变化,称为超 极化。
❖ 当神经纤维受到阈刺激时,膜上Na+通道开放, Na+内流,膜发生去极化反应,静息电位有所减小, 当静息电位减小到某一临界数值时,膜对Na+的通 透性突然增大,Na+迅速内流,出现动作电位的上 升相。这个临界点时的跨膜电位数值称为阈电位。
(便宜+排版)通道蛋白和载体蛋白的异同

通道蛋白和载体蛋白的区别1 载体蛋白载体蛋白是几乎所有类型的生物膜上普遍存在的多次跨膜蛋白分子。
每种载体蛋白能与特定的溶质分子结合,通过一系列构象的改变介导溶质分子跨膜转运,相关模型见下图:该图中膜上的载体蛋白以两种构象状态存在:状态A时溶质结合位点在膜外侧暴露;状态B时,同样的溶质结合位点在膜内侧暴露。
该模型认为,两种构象状态的改变是随机发生的。
假如溶质浓度在膜的外侧高,则状态A→状态B的转变比状态B→状态A的转变更常发生,因此溶质顺浓度梯度进入细胞。
换句话说,物质究竟向哪个方向运输,取决于该物质在膜两侧的浓度差。
除了被动运输,载体蛋白还介导逆浓度梯度的主动运输。
由于运输过程向着被运输物质的自由能增加的方向进行,所以该过程不能自发进行,需要提供能量才能完成。
一些离子(如Na+、K+等)在细胞内外存在着显著的差异,并且细胞能够维持这种恒定的离子梯度差,正是相关载体蛋白(如Na+,K+—ATP酶等)介导的主动运输的结果。
载体蛋白相当于结合在细胞膜上的酶,有特异性结合位点,可与底物(溶质)发生暂时的、可逆性的结合和分离,且一种特异性载体只转运一种类型的分子或离子;转运过程类似于酶与底物作用的饱和动力学曲线;既可以被底物类似物竞争性抑制,又可以被痕量的某种成分(抑制剂)非竞争性抑制以及对PH的依赖性等,因此有人将载体蛋白称为通透酶(permease)。
与酶不同的是载体蛋白可以改变过程的平衡点,加快物质沿着自由能减少的方向跨膜运输的速率;此外与酶的不同是载体蛋白对转运的溶质不做任何共价修饰[1]。
2 通道蛋白通道蛋白是一类跨越细胞膜双分子层的蛋白质,它所介导的被动运输不需要溶质分子与其结合,而是横跨膜形成亲水通道,允许大小适宜的分子和带电离子通过。
通道蛋白可以是单体蛋白,也可以是多亚基组成的蛋白,他们都是通过疏水的氨基酸链进行重排,形成水性通道。
某些通道蛋白在革兰氏阴性细菌的外膜、线粒体或叶绿体的外膜上形非选择性的通道。
细胞生物学名词解释

名词解释(完整版)U4-细胞膜的分子结构与特性1、膜流(membrane flow):膜性转运小泡穿梭于细胞内膜和细胞膜之间进行物质转运的过程中,膜脂和膜蛋白等膜的主要成分也在各膜性细胞器之间进行转移和重组,形成膜流。
2、膜整合蛋白(integral protein):又可称为膜内在蛋白或跨膜蛋白。
指单位膜中分布的一类蛋白质,其为兼性分子,它们的多肽链可横穿膜一次或多次,同时也可以由1条或几条多肽链构成。
其主要有单次跨膜、多次跨膜和多亚基跨膜蛋白等类型。
3、膜脂(membrane lipid):组成生物膜的基本成分,包括磷脂、胆固醇和糖脂,是兼性分子(双亲媒性分子),极性头部亲水,非极性尾部疏水。
4、膜蛋白(membrane protein):能直接或间接地与生物膜的脂双层结合的蛋白质通称为膜蛋白。
主要类型有镶嵌蛋白(膜整合蛋白)、脂锚定蛋白和周围蛋白(膜外在蛋白)三种。
5、载体蛋白(carrier protein):几乎存在与所有类型的生物膜上,是多次跨膜的蛋白质,能与特定的溶质分子或离子结合,通过一系列构象改变实现对这些物资的穿模运输。
U5-细胞膜与物质转运6、ATP驱动泵(ATP-driven pump):是一种ATP酶,都是跨膜蛋白,在膜的胞质侧具有一个或多个与ATP结合的位点,能水解ATP,利用ATP水解释放的能量逆浓度梯度或或电化学梯度转运离子和小分子,保证了大多数离子的跨膜浓度差。
7、胞吞作用(exocytosis):又称内吞作用,是细胞膜内陷,将细胞外的大分子或颗粒物质包围形成小泡,转运到细胞内的过程,包括吞噬、胞饮和受体介导的胞吞。
8、穿膜运输(transmembrane transport):蛋白质穿过细胞器的膜从细胞质基质进入细胞器内的运输方式称为穿膜运输。
9、受体介导的胞吞(receptor mediated endocytosis):细胞通过受体介导,有选择地高效的摄取细胞外特定的大分子的过程。
第 章 物质的跨膜运输

§4.1物质的跨膜运输概述一、细胞内外离子浓度差异1.现象:细胞内外离子浓度的差异性离子类型细胞内浓度(mmol/L)细胞外浓度(mmol/L)Na+低高K+高低Ca2+低高Cl-低高2.原因(1)脂双层的不透性除脂溶性分子与不带电的小分子外,脂双层对离子和绝大多数分子而言都是高度不透的,这些物质的跨膜运输需要膜转运蛋白参与。
(2)膜转运蛋白的活性膜转运蛋白包括:载体蛋白、通道蛋白二、载体蛋白1.载体蛋白的概念载体蛋白是指一类普遍存在的多次跨膜蛋白,又称通透酶。
通过与底物的特异性结合而改变构象,从而介导该物质跨膜运输。
2.载体蛋白的特点载体蛋白既可以参与被动运输,又可以参与主动运输。
其作用特点与酶类似,具有特异性与饱和性,不同之处在于载体蛋白不对底物进行共价修饰。
三、通道蛋白1.通道蛋白的概念通道蛋白是指一类普遍存在的多次跨膜蛋白。
其多次跨膜结构域可以构成亲水性通道,从而介导大小适合的分子或离子以被动运输的方式跨膜运输。
2.通道蛋白的特点通道蛋白只参与被动运输,其能量来源于膜内外物质的浓度梯度或电化学梯度。
3.通道蛋白的分类:离子通道、孔蛋白、水孔蛋白(1)离子通道离子通道是指,能够对离子进行选择性跨膜运输的跨膜蛋白,其能量源于膜内外离子的浓度梯度或电化学梯度。
离子通道决定生物膜对离子的通透性,并与离子泵一起,调节膜内外的离子浓度。
离子通道的特点:高效性、选择性(门控系统)、无饱和性①电压门控通道:通过膜电位的改变而激活或关闭,从而调控离子的跨膜运输。
如:含羞草叶子的闭合。
外界应力刺激含羞草感觉细胞,从而引起感觉细胞表面应力激活通道开启,导致膜电位发生改变。
进而导致电压门控通道开启,产生电信号。
电信号作用于叶片基部的特化细胞令其失水,导致叶片闭合。
②配体门控通道:通过与细胞内或细胞外的配体特异性结合改变构象而激活或关闭,从而调控离子的跨膜运输。
如:神经突触中的乙酰胆碱的释放与接收。
③应力激活通道:通过感受应力来改变构象而激活或关闭,从而调控离子的跨膜运输。
跨膜蛋白结构与功能之间的关系解析

跨膜蛋白结构与功能之间的关系解析蛋白质是生命体内最基本的分子之一,扮演着重要的运输、信号传导和结构支持等多种功能。
在细胞膜中,跨膜蛋白质起着关键的作用。
跨膜蛋白质是指横跨细胞膜的蛋白质,既可能在细胞膜中完全嵌入,也可能只是一部分埋藏在细胞膜内。
跨膜蛋白质的结构与其功能之间有着重要的关系,本文将对这一关系进行分析与解析。
首先,跨膜蛋白质的结构对其功能具有重要影响。
根据其穿越细胞膜的方式,跨膜蛋白质可分为单次跨膜蛋白和多次跨膜蛋白。
单次跨膜蛋白质是指只有一个穿越细胞膜的氨基酸序列,而多次跨膜蛋白质则有多个穿越细胞膜的氨基酸序列。
对于单次跨膜蛋白质而言,其常见的结构形式包括α螺旋和β折叠。
其中,α螺旋结构是指蛋白质链以螺旋状结构穿越细胞膜,类似于一根中空的管道。
这种结构对于离子通道、载体蛋白和受体蛋白等功能性蛋白具有重要意义。
例如,K+离子通道是一种单次跨膜蛋白质,其α螺旋结构能够形成离子通道,通过调控细胞内外的K+离子浓度差,实现细胞内外物质的平衡。
β折叠结构则是指蛋白质链在跨膜区域形成折叠,可以构成离子通道以及靶向信号传导的结构。
例如,G蛋白偶联受体(GPCR)是一种典型的单次跨膜蛋白质,其β折叠结构可以与多种信号分子结合,从而调节细胞内的生理反应。
对于多次跨膜蛋白质而言,其结构形式不仅包括α螺旋和β折叠,还包括类似于结构域的不同区块。
根据不同区块的组合方式,多次跨膜蛋白质可分为三种主要结构:α螺旋束、β片状结构和α/β结构。
这些不同的结构形式为跨膜蛋白质提供了不同的功能特性。
例如,传统的多次跨膜蛋白质ATPase就具有α螺旋束和β片状结构的典型组合方式,能够通过ATP水解释放能量,驱动特定的离子跨细胞膜运输。
此外,多次跨膜蛋白质还具有多种功能,如载体蛋白、受体蛋白和酶蛋白等。
这些功能是通过跨膜蛋白质的特定结构实现的。
其次,跨膜蛋白质的功能对其结构也起着重要的影响。
跨膜蛋白质在细胞膜中不仅仅作为一种分子通道存在,更是细胞内外信号传导的重要介质。
细胞生物学名词解释

Ch1-31.细胞生物学:研究细胞基本生命活动规律的科学,它从显微、亚显微与分子水平研究细胞结构与功能,细胞增殖、分化、衰老与凋亡,信号转导,基因表达与调控,起源与进化等。
2.细胞学说:一切动植物都是由细胞组成的,细胞是一切动植物的基本单位。
基本内容:①细胞是有机体,一切动植物都是由细胞发育而来,并由细胞和细胞产物所构成。
②每个细胞作为一个相对独立的单位,既有它自己的生命,又对与其他细胞共同组成的整体的生命有所助益。
③新的细胞可以通过自己存在的细胞繁殖产生。
(细胞只能来自细胞)3.原生质:构成细胞中的所有生命物质,由蛋白质、核酸等生物大分子和水、无机盐、糖类、脂类等生物小分子组成。
4.细胞膜:由磷脂双分子和镶嵌蛋白质构成的富有弹性的半透性膜,具有流动性和不对称性。
5.中膜体:又称间体或质膜体,由细胞质内陷形成,在G+更明显,有拟线粒体之称,可能起DNA复制起点的作用。
6.细胞器:细胞内具有特定形态和功能的显微或亚显微结构。
7.荚膜:位于细胞壁表面的一层松散的黏液物质,主要由葡萄糖和葡萄糖醛酸组成。
8.芽孢:内生孢子,是对不良环境有强抵抗力的休眠体,含水量较丰富的致密体。
9.中心质:蓝藻细胞中央遗传物质DNA所在部位,相当于细菌的核区。
10.细胞体积守恒定律:器官的大小主要决定于细胞的数量,与细胞的数量成正比,而与细胞的大小无关。
11.病毒:迄今发现的最小最简单的,活细胞体内寄生的非细胞生命体,仅有一种核酸和蛋白质构成的核酸-蛋白质复合体。
12.亚病毒:仅由一个有感染性的RNA构成。
13.阮病毒:仅由有感染性的蛋白质构成。
14.分辨率:分开两个质点间的最小距离。
D=0.61λ/N*sin(α/2) N介质折射率α-物镜镜口角15.光学显微镜:光学放大系统,照明系统,机械和支架系统。
0.2μm16.相差显微镜:把光程差转换成振幅差,可用于观察未染色的活细胞。
17.微分干涉显微镜:以平面偏振光为光源,光线经棱镜折射后分成两束,在不同时间经过样品相邻部位,再经另一棱镜将其会和,将厚度差转化成明暗区别,立体感强。
第五章物质的跨膜运输翟中和细胞生物学

开放状态,那么足够小得和带有适当电荷得分子或离子就能 通过。
2、 载体蛋白:只容许与载体蛋白上结合部位相适合得溶质
分子通过,而且载体蛋白每次转运都发生自身构象得改变。
二、被动运输与主动运输
物质得跨膜运输就是细胞维持正常生命活动得基础之一 ● 被动运输(passive transport) ● 主动运输(active transport)
第五章物质的跨膜运输翟中和细胞 生物学
一、脂双层得不透性和膜转运蛋白
载体蛋白 通道蛋白 通道蛋白与载体蛋白得异同
㈠、载体蛋白
结构:多次跨膜得整合性膜蛋白
机制:通过构象得改变介导与之结合得溶质分子得跨膜转运
特征:
如同酶具有特异性结合位点,具有高度得选择性 一次只能与膜一侧得一种溶质结合,经构象变化转运溶质 转运过程具有类似于酶与底物作用得饱和动力学特征 与酶不同对转运得溶质分子不作任何得共价修饰
㈡、通道蛋白
通道蛋白得结构 通道蛋白得特征 通道蛋白得类型
结构
通道蛋白形成跨膜得离子选择性通道。 对离子得选择性依赖于通道得直径和形状 以及通道内衬带电荷氨基酸得分布。 她所介导得被动运输不需要与溶质子结 合,只有大小和电荷适宜得离子才能通过。
特征
具有极高得转运速率 驱动带电荷离子得跨膜转运动力来自溶质得浓度梯
因此,人们推测水得跨膜转运除了简单扩散外, 还存在某种特殊得机制, 并提出了水通道得概念。
1988年Agre在分离纯化红细胞膜上得Rh血型抗原时,发现 了 一 个 疏 水 性 跨 膜 蛋 白 , 称 为 CHIP28 (Channel-Forming integral membrane protein)。1991年得到CHIP28得cDNA序 列,Agre将CHIP28得mRNA注入非洲爪蟾得卵母细胞中,在低渗 溶液中,卵母细胞迅速膨胀,并于5分钟内破裂,纯化得CHIP28置 入脂质体,也会得到同样得结果。细胞得这种吸水膨胀现象会被 Hg2+抑制,而这就是已知得抑制水通透得处理措施。这一发现揭 示了细胞膜上确实存在水通道,Agre因此而与离子通道得研究者 共享2003年得诺贝尔化学奖。
细胞生物名词解释总汇

细胞生物名词解释总汇细胞生物名词解释总汇1.拟核(nucleoid):在原核细胞内,仅含有一DNA区域,不被摸包绕该区域称之为拟核。
拟核内仅含有一条不予蛋白质结合的裸露DNA环。
2.核糖体(ribosome):(1)亦称核蛋白体,电镜下呈颗粒状。
(2)蛋白质的合成机器。
(3)由RNA和蛋白质组成。
(4)以RNA为骨架将蛋白质串联起来,决定蛋白质的定位。
(5)多聚核糖体提高pro.翻译效率。
3.单位膜(unit membrane):指电镜下地生物膜内外两层致密的深色带和中间的浅色带结构。
4.生物膜(biology membrane):围绕细胞膜或细胞器的脂双层膜。
由磷脂双分子层结合蛋白质和胆固醇糖脂构成。
起渗透屏障,物质转运和信号传导的作用,是细胞膜的膜系统与脂膜的总称。
5.细胞膜(cell membrane):包围在细胞质表面的一层膜,又称质膜(plasma membrane)6.胞质溶胶(cytosol):细胞质中除了细胞器和细胞骨架结构外其余的则为均质半透明的可溶性的细胞质溶胶。
7.细胞生物学(cell biology):从细胞的显微,亚显微和分子三个水平对细胞的各种生命活动展开研究的科学。
8.真核细胞的区隔化(compartment talization):极大提高细胞整体的代谢水平和功能效率。
(1)是细胞内不同生理生化反应过程彼此独立,互不干扰的在特定区域进行。
(2)增大细胞有限空间的膜面积。
9.整合蛋白(integral protein):又称内在膜蛋白(跨膜蛋白),两亲性分子,气主体部分穿过细胞膜脂双层,分为再次跨膜,多次跨膜和多亚基跨膜。
10.兼性分子(amphipathic molecule):有一个亲水的极性末端和一个疏水的非极性末端的分子,既具有亲水性,又具有疏水性。
在水溶液中自动聚拢,使亲水的头部暴露在外面与水接触,疏水的尾部埋在里面避开水相。
11.液晶态(liquid-crystal state):作为生物膜主体的脂质双分子层,既具有固体排列的有序性,又具有液体的流动性。
翟中和-物质的跨膜运输

一、膜转运蛋白和小分子物质跨膜运输脂双层的不透性和膜转运蛋白脂双层对绝大多数极性分子、离子以及细胞代谢产物的通透性都极低,形成了细胞的渗透屏障。
膜转运蛋白分为两种:载体蛋白和通道蛋白。
载体蛋白及其功能载体蛋白几乎在所有类型的生物膜上,属于多次跨膜蛋白。
每种载体蛋白能与特定的溶质分子结合,通过一系列构象改变介导溶质分子的跨膜转运载体蛋白具有与底物特异性结合的位点,所以每种载体蛋白对底物具有高度选择性,通常只转运一种类型的分子。
通道蛋白及其功能通道蛋白有三种:离子通道、孔蛋白和水孔蛋白(AQP)。
大多数通道蛋白以离子通道居多。
通道蛋白形成选择性和门控性跨膜运输。
孔蛋白存在于格兰仕阴性菌的外模和线粒体以及叶绿体的外模上,跨膜区域由β折叠片层形成柱状亲水性通道。
孔蛋白选择性很低,而且能通过较大的分子。
离子通道—因为对离子的选择性取决于通道的直径、形状以及通道内带电荷氨基酸的分布,所以离子通道介导被动运输时不需要与溶质分子结合,只有大小和电荷适宜的离子才能通过。
离子通道三个特征:1.具有极高的转运速率,比已知的任何一种载体蛋白的最高转运速率还要高。
2.离子通道没有饱和值,即使在很高的离子浓度下它们通过的离子量依然没有最大值。
3.离子通道并非连续性开放而是门控的,即通道的开启或关闭受膜电位变化、化学信号或压力刺激的调控。
因此离子通道可分为:电压门通道、配体们通道和应力激活通道。
电压门通道---带电荷的蛋白质结构域会随跨膜电位梯度的改变而发生相应的移动,从而使离子通道开启或关闭。
配体们通道---细胞内外的某些小分子配体与通道蛋白结合继而引起通道蛋白构象改变,从而使离子通道开启或关闭。
应力激活通道---通道蛋白感应应力而改变构象,从而开启通道形生离子流,产生电信号。
小分子物质的跨膜运输类型1、简单扩散小分子物质以热自由运动的方式顺着电化学梯度或浓度直接通过脂双层进出细胞,不需要细胞提供能量,也无需膜转运蛋白的协助。
动物细胞膜的结构和功能

结构特点:具有跨 膜结构域和亲水性 氨基酸组成的肽链
镶嵌蛋白:是细胞膜上的跨膜蛋白,具有多种功能,如物质运输、信号转导等。
结构特点:镶嵌蛋白由多个跨膜结构域组成,每个结构域由疏水氨基酸组成的α-螺 旋,形成两层平行的脂质双分子层。
作用:镶嵌蛋白在细胞膜上起到重要的结构支撑作用,同时参与细胞内外物质的运输 和信号转导。
动物细胞膜上的通道蛋白则可以控制离子和水分子的跨膜运输,调节细胞膜电位和细胞内外的 渗透压,从而影响细胞的兴奋性和收缩性。
动物细胞膜的信息传递功能对于维持细胞正常生理活动和机体稳态具有重要意义,如神经传导、 免疫反应等。
细胞膜具有识别 作用,能够识别 自身和异物的分 子特征
细胞膜上的受体 可以与特定的信 号分子结合,传 递信息,调节细 胞功能
动物细胞膜的功能还包括维持细胞的形态、保护细胞免受外界环境的损伤、参与细胞 的分裂和分化等。
动物细胞膜的功能是多方面的,对于维持动物机体的正常生理功能至关重要。
定义:动物细胞膜 具有选择透过性, 即只允许某些物质 进出细胞
机制:细胞膜上的 载体蛋白和通道蛋 白选择性地进行物 质转运
作用:维持细胞内 环境的稳定,对细 胞的生命活动至关 重要
主动运输是指 细胞膜通过消 耗能量将物质 从低浓度区域 转运到高浓度 区域的过程。
被动运输则是 顺浓度梯度进 行的,不需要
消耗能量。
细胞膜上的载 体蛋白和通道 蛋白参与了物 质运输的过程。
动物细胞膜的功能之一是信息传递,通过膜上的受体和通道蛋白传递信号,调节细胞活动。
等,将信号传递到 细胞内部。
添加 标题
细胞膜的受体:细胞膜上存在多种受体, 可以识别和结合相应的信号分子,参与细 胞间的信息交流和相互作用。
hek293细胞表达的多次跨膜全长cd20蛋白

hek293细胞表达的多次跨膜全长cd20蛋白文章标题:探究hek293细胞表达的多次跨膜全长cd20蛋白在生物医学领域,hek293细胞表达的多次跨膜全长cd20蛋白在免疫学和肿瘤治疗方面具有重要的意义。
本文将从多个角度对这一主题展开深入探讨,旨在帮助读者全面了解这一重要蛋白的作用及其在医学领域的潜在应用价值。
一、hek293细胞表达的多次跨膜全长cd20蛋白的概念解释先来了解一下hek293细胞表达的多次跨膜全长cd20蛋白的基本概念。
hek293细胞是一种常用的哺乳动物细胞系,而cd20蛋白则是一种跨膜蛋白,在B细胞的生物学过程中扮演着重要角色。
当这两者结合在一起时,产生了一种具有潜在生物学和药物应用意义的新型蛋白。
二、hek293细胞表达的多次跨膜全长cd20蛋白的生物学功能这一部分将重点探讨hek293细胞表达的多次跨膜全长cd20蛋白在生物学上的功能。
从分子水平到细胞和组织水平,我们将全面解析这种蛋白在调节免疫系统、细胞信号传导和肿瘤生长等方面的作用机制,以及其对疾病发生发展的影响。
三、hek293细胞表达的多次跨膜全长cd20蛋白在肿瘤治疗中的应用在此部分,我们将深入探讨hek293细胞表达的多次跨膜全长cd20蛋白在肿瘤治疗中的潜在应用价值。
包括针对B细胞恶性肿瘤的靶向治疗、免疫细胞疗法以及基因工程疗法等方面的应用前景,以及相关的临床研究和治疗效果。
四、个人观点和总结我将共享自己对hek293细胞表达的多次跨膜全长cd20蛋白的个人观点和理解,总结全文的主要观点和内容,以便读者能全面、深刻和灵活地理解这一重要主题。
以上是本文的大致框架,接下来将逐步深入探讨和撰写每一部分内容,旨在为读者呈现一篇高质量、深度和广度兼具的中文文章。
愿通过本文的阅读,读者对hek293细胞表达的多次跨膜全长cd20蛋白有更全面的了解和认识。
hek293细胞表达的多次跨膜全长cd20蛋白在免疫学和肿瘤治疗中的作用备受关注。
医学细胞生物学重点

医学名词解释3

三、名词解释1.细胞膜流动镶嵌模型:在单位膜模型的基础上,一个反映生物膜特性的分子结构理论。
该模型强调膜的流动性和膜蛋白分布的不对称性,以及蛋白质与膜脂的镶嵌关系。
2.外周蛋白:是指以弱的静电键结合于脂分子的头部极性区或跨膜蛋白膜区域的蛋白。
外周蛋白是水溶性的,可用离子溶液分离提取。
3.脂质体:脂质分子在水中聚拢成双分子层后,其游离端往往有自动闭合的趋势,形成一种自我封闭而稳定的中空结构,称为脂质体。
这种人工条件下自发形成的脂质体,与真正的细胞膜的脂双层有许多共同的特点,可进行大量的生物膜功能的体外实验性研究。
4.血影:指红细胞丢失细胞质后剩余的质部分。
将红细胞经低渗处理后,质膜会破裂,释放出血红蛋白和其他胞内可溶性蛋白,这时红细胞的质膜与膜骨架蛋白组成的结构使红细胞仍然保持原来的形状和大小,这种结构称为红细胞血影。
5.跃迁温度:脂质由固态转变为液态相对应的温度称为跃迁温度。
6.简单扩散:小分子的热运动使疏水的小分子或小的不带电荷的极性分子沿着浓度降低的方向自由跨膜运输。
不需要细胞提供能量和膜蛋白的协助。
7.耦联运输:也称协同运输,是指一种物质以被动运输方式进行,所产生的势能推动另一种物质进行主动运输的过程。
8.受体介导的胞吞作用:被转运的大分子与细胞表面的特异性受体结合,经过有被小窝的内化而摄取物质的形式,是一种选择性的浓缩机制。
四、简答题1.为什么离子通道常为多次跨膜蛋白?答:因为离子通道是细胞膜上供不同离子通过的特异性蛋白、为使特异性离子能顺利通过,通过脂质双分子层的离子通道内部为亲水性,为形成这个封闭的亲水环境,常需要多次跨膜以保证内部亲水而外部疏水,从而能以稳定的形式存在。
2.简述膜蛋白的种类及其各自的特点,答:包括跨膜蛋白、外周蛋白、脂锚定蛋白跨膜蛋白:两性分子,跨膜结构域多为1至多个疏水的α螺旋,与膜的结合紧密,只有用去垢剂才能从膜上洗涤下来。
脂锚定蛋白:共价键结合于脂分子,埋入膜脂双层的内部,只有用去垢剂才能从膜上洗涤下来。
物质的跨膜运输
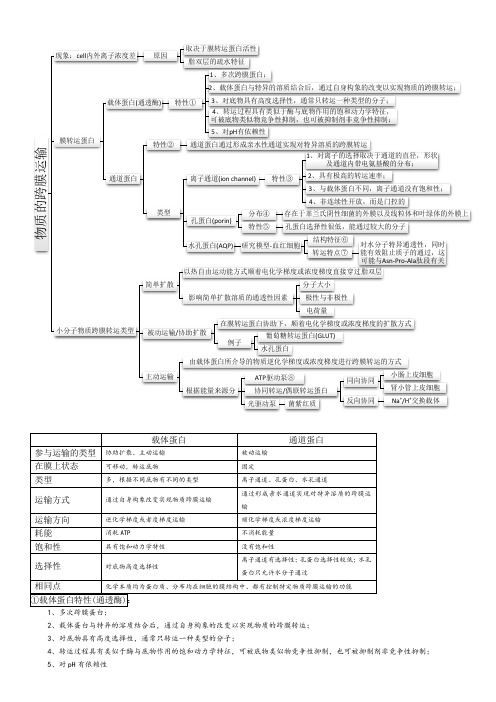
物质的跨膜运输现象:cell 内外离子浓度差原因取决于膜转运蛋白活性脂双层的疏水特征膜转运蛋白载体蛋白(通透酶)特性①1、多次跨膜蛋白;2、载体蛋白与特异的溶质结合后,通过自身构象的改变以实现物质的跨膜转运;3、对底物具有高度选择性,通常只转运一种类型的分子;4、转运过程具有类似于酶与底物作用的饱和动力学特征,可被底物类似物竞争性抑制,也可被抑制剂非竞争性抑制;5、对pH 有依赖性通道蛋白特性②通道蛋白通过形成亲水性通道实现对特异溶质的跨膜转运类型离子通道(ion channel)特性③1、对离子的选择取决于通道的直径,形状及通道内带电氨基酸的分布;2、具有极高的转运速率;3、与载体蛋白不同,离子通道没有饱和性;4、非连续性开放,而是门控的孔蛋白(porin)分布④存在于革兰氏阴性细菌的外膜以及线粒体和叶绿体的外膜上特性⑤孔蛋白选择性很低,能通过较大的分子水孔蛋白(AQP)研究模型-血红细胞结构特征⑥转运特点⑦对水分子特异通透性,同时能有效阻止质子的通过,这可能与Asn-Pro-Ala 肽段有关小分子物质跨膜转运类型简单扩散以热自由运动能方式顺着电化学梯度或浓度梯度直接穿过脂双层影响简单扩散溶质的通透性因素分子大小极性与非极性电荷量被动运输/协助扩散在膜转运蛋白协助下,顺着电化学梯度或浓度梯度的扩散方式例子葡萄糖转运蛋白(GLUT)水孔蛋白主动运输由载体蛋白所介导的物质逆化学梯度或浓度梯度进行跨膜转运的方式根据能量来源分ATP 驱动泵⑧协同转运/偶联转运蛋白同向协同小肠上皮细胞肾小管上皮细胞反向协同Na +/H +交换载体光驱动泵菌紫红质载体蛋白通道蛋白参与运输的类型 协助扩散、主动运输 被动运输 在膜上状态 可移动,转运底物固定类型 多,根据不同底物有不同的类型 离子通道、孔蛋白、水孔通道运输方式 通过自身构象改变实现物质跨膜运输 通过形成亲水通道实现对特异溶质的跨膜运输运输方向 逆化学梯度或者度梯度运输 顺化学梯度或浓度梯度运输 耗能 消耗ATP不消耗能量 饱和性 具有饱和动力学特性 没有饱和性选择性 对底物高度选择性离子通道有选择性;孔蛋白选择性较低;水孔蛋白只允许水分子通过相同点化学本质均为蛋白质、分布均在细胞的膜结构中、都有控制特定物质跨膜运输的功能①载体蛋白特性(通透酶):1、多次跨膜蛋白;2、载体蛋白与特异的溶质结合后,通过自身构象的改变以实现物质的跨膜转运;3、对底物具有高度选择性,通常只转运一种类型的分子;4、转运过程具有类似于酶与底物作用的饱和动力学特征,可被底物类似物竞争性抑制,也可被抑制剂非竞争性抑制;5、对pH 有依赖性通道蛋白通过形成亲水性通道实现对特异溶质的跨膜转运。
细胞生物学物质的跨膜运输

细胞生物学物质的跨膜运输物质跨膜转运主要有3种途径:被动运输、主动运输、胞吞与胞吐作用(膜泡运输)。
第一节膜转运蛋白与小分子物质的跨膜运输一、脂双层的不透性和膜转运蛋白细胞膜上存在2类主要的转运蛋白,即:载体蛋白(carrier protein)和通道蛋白(channel protein)。
载体蛋白和通道蛋白识别转运物质的方式不同:载体蛋白只允许与其结合部位相适合的溶质分子通过,而且每次转运都发生自身构象的改变;通道蛋白主要根据溶质大小和电荷进行辨别,通道开放时,足够小和带适当电荷的溶质就能通过。
(一)载体蛋白及其功能载体蛋白为多次跨膜蛋白,又称做载体(carrier)、通透酶和转运器(transporter),能够与特定溶质结合,通过自身构象的变化,将与它结合的溶质转移到膜的另一侧。
载体蛋白既可以执行被动运输、也可执行主动运输的功能。
(二)通道蛋白及其功能通道蛋白有3种类型:离子通道、孔蛋白、水孔蛋白(AQP)。
只介导被动运输。
1. 选择性离子通道,具有如下显着特征:离子选择性(相对的)转运离子速率高没有饱和值大多数具门控性分为:电压门通道、配体门通道、应力激活通道电位门通道举例:电位门通道(voltage gated channel)是对细胞内或细胞外特异离子浓度发生变化时,或对其他刺激引起膜电位变化时,致使其构象变化,“门”打开。
如:神经肌肉接点由Ach门控通道开放而出现终板电位时,这个电位改变可使相邻的肌细胞膜中存在的电位门Na+通道和K+通道相继激活(即通道开放),引起肌细胞动作电位;动作电位传至肌质网,Ca2+通道打开引起Ca2+外流,引发肌肉收缩。
配体门通道举例——乙酰胆碱门通道N型乙酰胆碱受体是目前了解较多的一类配体门通道。
它是由4种不同的亚单位组成的5聚体,总分子量约为290kd。
亚单位通过氢键等非共价键,形成一个结构为α2βγδ的梅花状通道样结构,其中的两个α亚单位是同两分子Ach相结合的部位。
跨膜糖蛋白的类型

跨膜糖蛋白的类型
跨膜糖蛋白是一类重要的膜蛋白,它们穿越细胞膜的脂质双分子层,并在膜外侧或膜内侧具有糖基化修饰。
这些蛋白在细胞信号传导、物质运输、细胞黏附等生物过程中发挥关键作用。
跨膜糖蛋白的类型多种多样,下面将详细介绍几种主要的类型。
首先,根据糖蛋白的跨膜次数,可以将其分为单次跨膜糖蛋白和多次跨膜糖蛋白。
单次跨膜糖蛋白只穿越细胞膜一次,其糖基化修饰通常位于膜外侧,如许多受体蛋白和黏附分子。
而多次跨膜糖蛋白则多次穿越细胞膜,形成多个跨膜结构域,如某些离子通道和转运蛋白。
其次,根据糖蛋白的结构特点,可以将其分为I型、II型和III型跨膜糖蛋白。
I型跨膜糖蛋白的N端位于膜外侧,C端位于膜内侧,其糖基化修饰主要位于N端。
这类蛋白在细胞膜上广泛分布,参与多种生物过程。
II型跨膜糖蛋白的N端位于膜内侧,C端位于膜外侧,其糖基化修饰也主要位于C端。
这类蛋白在细胞膜上的分布相对较少,但同样具有重要功能。
III型跨膜糖蛋白的糖基化修饰则位于膜中间的某个位置,其具体的生物学功能还在研究中。
此外,根据糖蛋白的功能,还可以将其分为受体型跨膜糖蛋白、酶型跨膜糖蛋白和转运型跨膜糖蛋白等。
受体型跨膜糖蛋白主要作为信号分子的受体,参与细胞信号传导;酶型跨膜糖蛋白则具有催化功能,参与细胞内的代谢过程;转运型跨膜糖蛋白则负责物质在细胞膜上的运输。
总之,跨膜糖蛋白的类型多种多样,它们在细胞生物学中扮演着重要的角色。
对跨膜糖蛋白的深入研究将有助于我们更好地理解细胞的生命活动和疾病的发生发展机制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
粗面内质网的功能——蛋白质转运粗面内质网的主要功能是帮助膜结合核糖体合成的蛋白质转运。
膜结合核糖体上合成的蛋白质与游离核糖体上合成的蛋白质去向是不同的,表9-5列出了这两类核糖体合成的某些蛋白。
表9-5 真核细胞中膜结合核糖体和游离核糖体合成的某些蛋白由于粗面内质网上合成的蛋白质包括膜蛋白、内膜结构的腔池蛋白和分泌到细胞外的蛋白,所以必须有极好的运输机制进行分选定位,这就是信号肽假说。
■信号序列的发现和证实● 微粒体实验在George Palade用离心技术分离到有核糖体结合的微粒体,即发现膜结合核糖体(membrane-bounded ribosome)之后,科学家推测:膜结合核糖体合成的蛋白质首先要进入内质网的腔,然后通过选择性的分泌过程输出到细胞外,而游离核糖体上合成的蛋白质则留在细胞内使用。
为了研究内质网上合成的蛋白质是否进入了内质网的腔,Colvin Redman 和David Sabatini用分离的RER小泡(微粒体)进行无细胞系统的蛋白质合成,证明了膜结合核糖体上合成的蛋白质进入了微粒体的腔。
如何利用微粒体在无细胞蛋白质合成系统中的合成实验证明膜结合核糖体合成的蛋白质进入了微粒体的腔● Günter Blobel等的建议为什么有些核糖体合成蛋白质时不同内质网结合,有些正在合成蛋白质的核糖体要同内质网结合,并将合成的蛋白质插入内质网?对此,美国洛克菲勒大学的Günter Blobel、David Sabatini 和Bernhard Dobberstein 等于1971年提出两点建议:①分泌蛋白的N-端含有一段特别的信号序列(signal sequence),可将多肽和核糖体引导到ER膜上;②多肽通过ER膜上的水性通道进入ER的腔中,并推测多肽是在合成的同时转移的。
● 信号序列存在的直接证据1972年,César Milstein和他的同事用无细胞系统研究免疫球蛋白(IgG)轻链合成时获得了信号序列存在的直接证据,证明Blobel等的建议是正确的。
他们用分离纯化的核糖体在无细胞体系中用编码免疫球蛋白轻链的mRNA指导合成多肽,发现合成的多肽比分泌到细胞外的成熟的免疫球蛋白在N端有一段多出的肽链,它有20个氨基酸,他们推测,这段肽具有信号作用,使IgG得以通过粗面内质网并继而分泌到细胞外。
● 信号序列的进一步证实G.Blobel、B.Dobberstein、P.Walter和他们的同事在上述发现的基础上用分离的微粒体和无细胞体系进行了大量的实验,进一步证实了信号序列的存在及其作用。
加与不加RER小泡,产物不同当将分泌蛋白的mRNA在无细胞体系中进行翻译时,如果不加粗面内质网(微粒体),获得的翻译产物比从细胞中分泌出来的蛋白要长,若添加RER小泡,翻译的产物长度与从活细胞分泌的蛋白相同。
因此推测信号序列在引导蛋白进入内质网后被切除了,所以成熟的蛋白的N-端没有信号序列(图9-16)。
图9-16 信号序列在分泌蛋白质运输中的作用(a)在不含RER小泡的无细胞体系中翻译分泌蛋白,其N-端有信号序列,故比从细胞中分泌出来的相同蛋白质肽链长;(b)在加有RER小泡的无细胞体系中翻译分泌蛋白,信号序列在RER小泡中被切除,得到的产物与从细胞中合成分泌的相同。
蛋白水解酶水解实验在分泌蛋白进行体外翻译的无细胞系统中(含有RER小泡)加入蛋白水解酶,并不能使新生肽水解。
但同时加入去垢剂,则能将蛋白质水解,提示新生肽链是边合成边运输的,因为去垢剂能够破坏内质网的膜,使合成的蛋白质暴露于蛋白水解酶遭到降解。
若无去垢剂,多肽在合成的同时就向内质网转运,所以不受蛋白水解酶的影响。
多聚核糖体的离体翻译从骨髓瘤分离多聚核糖体,用去垢剂处理,使之与内质网膜分离后,继续在无细胞体系(不含RER小泡)中进行翻译,发现:短时间温育,即可得到成熟的分泌蛋白(无信号序列),而长时间的温育,得到的产物N-端有信号序列,这一结果证明了信号序列的功能。
为什么说多聚核糖体是研究内质网帮助蛋白质运输的好材料?■信号序列的一般特征及早期信号假说● 信号序列的一般特征G.Blobel、B.Dobberstein、P.Walter和他们的同事在研究中还发现信号序列具有一些共同的特性:长度一般为15~35个氨基酸残基,N-末端含有1个或多个带正电荷的氨基酸,其后是6~12个连续的疏水残基;在蛋白质合成中将核糖体引导到内质网,进入内质网后通常被切除(图9-17)。
图9-17 ER跨膜可切除信号的一般结构● 早期的信号假说1975年,G.Blobel和 B.Dobberstein 根据对信号序列的研究成果,正式提出了信号假说(signal hypothesis),要点是:(1)分泌蛋白的合成始于细胞质中的游离核糖体;(2)合成的N-端信号序列露出核糖体后,靠自由碰撞与内质网膜接触,然后靠N-端信号序列的疏水性插入内质网的膜;(3)蛋白质继续合成,并以袢环形式穿过内质网的膜;(4)如果合成的是分泌的蛋白,除了信号序列被信号肽酶切除外,全部进入内质网的腔,若是膜蛋白,则由一个或多个停止转移信号将蛋白质锚定在内质网膜上。
● 信号假说证明:基因重组实验信号假说提出后得到许多实验的支持,其中最有力的一项实验结果是杂合蛋白研究的结果。
黑猩猩的α-球蛋白是一种在游离核糖体上合成并存在于胞质溶胶中的可溶性蛋白,科学家在编码该蛋白的基因上接上一段编码E.coli分泌蛋白β-半乳糖透性酶(β-lactamase)的信号序列DNA,然后将该基因加入到无细胞的转录和翻译体系中,并加入从狗组织中分离的ER膜,研究结果发现,杂合蛋白出现在ER腔中,而且信号序列被切除了。
这一研究结果不仅证实了信号假说的正确性,也揭示了信号序列的一个重要特性:信号序列没有特异性,并且原核生物的信号序列在真核生物中也是有效的。
● Blobel 于1972年提出信号序列的建议、1975年正式提出信号假说,揭示了细胞中不同蛋白质在合成后是如何找到自己的工作岗位的秘密,发现了蛋白质与生具来的“地址签”。
这一发现开辟了一个全新的医学、细胞生物学和生物技术学的研究领域,基于他的贡献,使他获得了1999年诺贝尔医学奖。
■新蛋白复合物的发现与信号假说的补充● 信号识别颗粒(signal recognition partical,SRP)1981年,发现了信号识别颗粒(signal recognition partical,SRP),是一种核糖核酸蛋白复合体,沉降系数为11S,含有分子量为72kd、68kDa、54kDa、19kDa、14kDa及9kDa的6条多肽和一个7S(长约300个核苷酸)的scRNA(图9-18),它的作用是识别信号序列,并将核糖体引导到内质网上。
图9-18 信号识别颗粒(SRP)的组成● 停靠蛋白(docking protein,DP)即SRP在内质网膜上的受体蛋白,它能够与结合有信号序列的SRP牢牢地结合,使正在合成蛋白质的核糖体停靠到内质网上来。
■蛋白质共翻译转运的机理:信号假说● 新信号假说的基本内容补充修改后的信号假说比早期的信号假说更为合理,这一假说的核心内容是:核糖体同内质网的结合受制于mRNA中特定的密码序列(可以翻译成信号肽),具有这种密码序列的新生肽才能连同核糖体一起附着到内质网膜的特定部位。
因此,核糖体同内质网的结合是功能性结合,具有功能性和暂时性,并受时间和空间的限制。
正是由于这种结合保证了新合成蛋白的矢量释放。
信号序列的两个基本作用是:①通过与SRP的识别和结合,引导核糖体与内质网结合;②通过信号序列的疏水性,引导新生肽跨膜转运。
图9-19是修改后的信号假说的主要内容。
图9-19膜结合核糖体体的蛋白质合成与转运● SRP、SRP受体功能的离体鉴定任何假说都要经受得起实验的检验。
假说中的SRP、SRP受体的功能都已有体外实验的证明。
请你设计一个离体实验证明SRP和SRP受体的功能。
● 信号肽跨膜的能量来源研究证明SRP受体和SRP都是G蛋白,它们不仅将合成蛋白质的核糖体引导到内质网,而且通过GTP-GDP的交换,将内质网膜中的易位子(translocon)通道打开,让信号序列与之结合(图9-20)。
GTP 水解作为信号序列转运的能量来源。
■膜蛋白的共翻译转运机理在粗面内质网上合成的蛋白质有两类:分泌蛋白和膜蛋白,膜蛋白的共翻译转运较为复杂,首先它要靠疏水区滞留在内质网上,另外膜蛋白分单次跨膜和多次跨膜;还有膜蛋白在膜上的定向问题,即羧基端和氨基端位于内质网膜的内侧(内质网腔面)还是外侧(胞质溶胶一侧),还是位于同一侧。
● 起始转移信号(start-transfer signal)蛋白质氨基末端的信号序列除了作为信号被SRP识别外,还具有起始穿膜转移的作用。
在蛋白质共翻译转运过程中,信号序列的N-端始终朝向内质网的外侧,插入蛋白质转运通道后与通道内的信号序列结合位点(受体)结合,其后的肽序列是以袢环的形式通过运输通道。
[医学教育网搜集整理]● 内含信号序列(internal signal sequence)与单次跨膜蛋白内含信号序列又称内含信号肽(internal signal peptides),它不位于N-末端,但具信号序列的作用,故称为内含信号序列。
它可作为蛋白质共翻译转移的信号被SRP识别,同时它也是起始转移信号。
由于内含信号序列是不可切除的,又是疏水性,所以它是膜蛋白的一部分,如果共翻译转运蛋白质中只有一个内含信号序列,那么合成的蛋白就是单次跨膜蛋白(图9-21)。
图9-21 内含信号序列与单次跨膜蛋白的整合内含信号序列首先作为信号序列与SRP一起将核糖体附着到内质网,然后作为起始转移信号与蛋白质转运通道结合引导新生肽的转移。
在与转运通道结合过程中,始终保持具有较多正电荷氨基酸的一端朝向胞质溶胶一侧,由于它不能被切除,所以合成的是膜蛋白。
(a)内含信号序列作为起始转移信号,在保持信号序列中具有较多正电荷氨基酸一端朝向胞质溶胶面的情况下与羧基端的臂形成环,插入到转运通道中。
(b)作用方式与(a)相同,只是内含信号序列中含较多正电荷一端与氨基端相反,所以要进行调整,在跨膜时保持正电荷一端朝向胞质溶胶面。
● 停止转移肽(stop-transfer peptide)与单次跨膜蛋白单次跨膜蛋白的形成除了与含有内含信号序列有关外,终止转移肽也与单次跨膜蛋白的形成相关。
因停止转移信号的作用而形成单次跨膜的蛋白,那么该蛋白在结构上只有一个停止转移信号序列,没有内含转移信号,但在N-端有一个信号序列作为转移起始信号(图9-22)。
图9-22 终止转移信号与单次跨膜蛋白的形成该蛋白在N-末端信号序列的作用下进行共翻译转运,当停止转移信号进入通道后,与通道内的结合位点相互作用,使通道转运蛋白失活,从而停止蛋白质的转运。
