机能实验报告-休克
机能实验休克

昆明医科大学机能学实验报告呼吸调节、呼吸功能不全及治疗一、实验目的1.观察豚鼠的正常呼吸频率、幅度、膈肌放电、动脉血氧分压及呼吸运动的调节,2.复制豚鼠哮喘模型,观察呼吸衰竭时动物呼吸频率、幅度、动脉血氧分压及膈肌放电的变化;探讨呼吸衰竭的发生机制。
3.观察不同药物的治疗效果并分析其作用机制。
二、实验原理呼吸衰竭外呼吸功能严重障碍,导致PaO2降低伴有或不伴有PaCO2增高的病理过程。
诊断呼衰的主要血气标准是PaO2低于60mmHg,伴有或不伴有PaCO2高于50mmHg,其病因为:神经系统疾患,胸廓疾病,肺的病变。
本实验通过各种药物的对比,讨论豚鼠呼吸衰竭的机制。
三、实验仪器设备仪器:Medlab生物信号采集处理系统,血气分析仪,豚鼠手术台,手术器械一套,呼吸换能器,动静脉留置针(22~24G),小动物器官插管,超声雾化器一套试剂及药品:肝素钠注射液,25%乌拉坦,3ml/ml组胺,尼可刹米注射液(0.375/1.5ml),地塞米松(5mg/ml),氨茶碱注射液(2ml:0.25g),沙丁胺醇气雾剂(14g:28mg)四、实验方法与步骤1.称重、麻醉、固定动物称重、腹腔麻醉(25%乌拉坦5~6ml/kg),固定于手术台2.颈总动脉穿刺及气管插管分离颈总动脉放置留置针以备取血,颈部气管插管接呼吸换能器3.记录膈肌放电将两颗银针插入豚鼠任意一侧(右侧优先)肋间肌中,针柄与传导电极两红色支相连,黑色支夹于皮肤4.记录正常各项生理指标打开Medlab信号采集系统,记录正常呼吸频率、深度及膈肌放电等情况,取血测定气血指标(PaO2、PaCO2)5.观察呼吸调节分别吸入氮气和5%~10% 二氧化碳后观察呼吸运动的改变6.复制及性哮喘性呼吸衰竭病理模型吸入雾化组胺制作急性哮喘性呼吸衰竭病理模型,待豚鼠呼吸出现频率明显减慢、幅度降低、膈肌放电异常时,记录上述各项指标的变化,取血作血气分析结果记录7.治疗分组经豚鼠头静脉注射给药进行治疗:A组(空白对照组):5、10、15min后分别取血作血气分析结果记录五、实验结果正常:吸入CO₂和N2:吸入组胺:呼吸衰竭给地塞米松前:给地塞米松后:实验数据填入下表:8六、分析与讨论1、当缺氧和CO2浓度增高时呼吸运动有何变化?缺氧时:PaO2下降:I PaO2于60~100mmHg时,肺气量无明显变化II PaO2<60时,可刺激颈动脉体和颈动脉体的外周化学感受器,冲动传入延髓,反射性第引起呼吸加快加深III PaO2=30mmHg时,肺通气量最大IV PaO2<30mmHg时,缺氧对呼吸中枢的直接抑制作用超过PaO2降低对外周感受器的兴奋作用,反应中枢性呼吸衰竭,表现为呼吸抑制)CO2浓度增高时:PaCO2升高I PaCO2 >50mmHg,刺激中枢化学感受器,呼吸中枢兴奋,使呼吸加深加快II PaCO2>80mmHg,直接抑制呼吸中枢,此时呼吸运动主要靠动脉血低氧分压对血管化学感受器的刺激得以维持)2、呼吸衰竭诊断标准是什么?阻塞性呼吸功能不全的发生机制?呼吸衰竭指呼吸功能严重障碍,导致PaO2降低的伴有或不伴有PaCO2增高的病理过程,其诊断标准是:PaO2低于60mmHg,伴有或不伴有PaCO2高于50mmHg阻塞性通气不足指气道狭窄或阻塞所致的通气障碍,正常人气道阻力位0.1~0.3KPa·s/L。
休克机能实验报告

一、实验目的1. 建立失血性休克动物模型,观察休克过程中机体各系统机能变化。
2. 探讨不同治疗方案对失血性休克的治疗效果及机制。
3. 了解休克早期治疗原则及临床应用。
二、实验材料与方法1. 实验动物:健康成年SD大鼠30只,体重200-250g,雌雄不限。
2. 实验器材:手术显微镜、手术刀、手术剪、镊子、缝合针、缝合线、玻璃分针、股动脉插管、股静脉插管、尿道插管、体温计、生理盐水、肝素、阿拉明、多巴胺等。
3. 实验方法:(1)动物分组:将30只大鼠随机分为3组,每组10只。
分别为对照组、休克组、治疗组。
(2)建立失血性休克模型:对休克组大鼠进行麻醉,切开股动脉,用玻璃分针分离股动静脉与股神经,股静脉插管,结扎远心端,近心端插入静脉留置针,推注肝素。
然后快速放血,使大鼠失血量为自身血量的30%。
对照组大鼠仅进行麻醉和股动脉插管操作,不放血。
治疗组大鼠在休克发生后,立即给予阿拉明或多巴胺治疗。
(3)观察指标:1)血压:用压力换能器连续监测大鼠的血压变化。
2)心率:用听诊器听诊大鼠的心率变化。
3)呼吸频率:观察大鼠的呼吸频率变化。
4)血氧饱和度:用血氧饱和度仪监测大鼠的血氧饱和度。
5)体温:用体温计监测大鼠的体温变化。
6)动脉血气分析:检测动脉血pH、PaO2、PaCO2等指标。
三、实验结果1. 对照组大鼠血压、心率、呼吸频率、血氧饱和度、体温等指标均正常。
2. 休克组大鼠在失血后,血压、心率、呼吸频率、血氧饱和度、体温等指标均显著降低,与正常对照组相比差异具有统计学意义(P<0.05)。
3. 治疗组大鼠在给予阿拉明或多巴胺治疗后,血压、心率、呼吸频率、血氧饱和度、体温等指标逐渐恢复正常,与休克组相比差异具有统计学意义(P<0.05)。
四、讨论1. 本实验成功建立了失血性休克动物模型,观察了休克过程中机体各系统机能变化,为临床研究提供了实验基础。
2. 休克是机体对有效循环血量减少、组织灌注不足、细胞代谢紊乱的一种全身性应激反应。
休克_实验报告

1. 了解休克的定义、分类及病理生理变化。
2. 掌握失血性休克模型的建立方法。
3. 观察失血性休克对机体的影响,包括心、肺、肝、肾等器官的功能变化。
4. 探讨失血性休克的治疗方法及其疗效。
二、实验材料1. 实验动物:家兔3只,体重2.5kg左右。
2. 实验器材:手术器械、生理盐水、肝素、无创血压计、心电图机、显微镜等。
3. 实验药品:戊巴比妥钠、肾上腺素、去甲肾上腺素、多巴胺等。
三、实验方法1. 家兔麻醉:将家兔置于实验台上,采用戊巴比妥钠进行麻醉,剂量为40mg/kg,静脉注射。
2. 建立失血性休克模型:将麻醉后的家兔仰卧固定,剪去腹部手术野被毛,暴露腹主动脉,用无创动脉夹阻断血流,剪断腹主动脉,收集血液,造成失血性休克。
3. 观察指标:(1)血压:采用无创血压计测量失血前后及治疗后的血压变化。
(2)心电图:采用心电图机记录失血前后及治疗后的心电图变化。
(3)血液指标:采集血液,检测血红蛋白、红细胞计数、白细胞计数、血小板计数等指标。
(4)器官功能:观察心、肺、肝、肾等器官的功能变化,包括呼吸频率、心率、肝肾功能等。
4. 治疗方法:(1)补充血容量:给予生理盐水静脉注射,维持血容量。
(2)血管活性药物:给予去甲肾上腺素、多巴胺等血管活性药物,维持血压。
(3)肾上腺素:给予肾上腺素,增强心肌收缩力,改善心功能。
1. 血压:失血后血压明显下降,治疗后血压逐渐恢复正常。
2. 心电图:失血后出现心律失常,治疗后心律失常得到改善。
3. 血液指标:血红蛋白、红细胞计数、白细胞计数、血小板计数等指标在失血后明显下降,治疗后逐渐恢复正常。
4. 器官功能:失血后心、肺、肝、肾等器官功能受损,治疗后器官功能逐渐恢复正常。
五、讨论1. 休克是机体在急性循环障碍时出现的一系列病理生理反应,包括心、肺、肝、肾等器官的功能受损。
失血性休克是休克常见类型之一,主要由失血引起。
2. 在本实验中,通过建立失血性休克模型,观察了失血对机体的影响,包括血压、心电图、血液指标、器官功能等方面的变化。
病理生理休克实验报告(3篇)

第1篇一、实验目的1. 了解休克的基本概念、病因和病理生理变化;2. 观察休克早期、中期和晚期的临床表现;3. 掌握休克的治疗原则和方法。
二、实验材料1. 实验动物:家兔;2. 实验仪器:生理记录仪、血压计、心电图机、实验台等;3. 实验试剂:生理盐水、肝素钠、肾上腺素、阿托品等。
三、实验方法1. 实验动物分组:将实验动物随机分为三组,分别为正常组、失血性休克组和抢救组。
2. 失血性休克模型制备:(1)正常组:家兔给予生理盐水灌胃,观察生理指标变化;(2)失血性休克组:家兔给予肝素钠抗凝,然后进行失血,直至血压降至正常值的50%;(3)抢救组:在失血性休克组的基础上,给予肾上腺素和阿托品进行抢救。
3. 观察指标:(1)血压:记录各组动物血压变化;(2)心率:记录各组动物心率变化;(3)心电图:观察各组动物心电图变化;(4)呼吸:观察各组动物呼吸频率和深度变化;(5)瞳孔:观察各组动物瞳孔变化。
4. 数据处理:采用统计学方法对实验数据进行处理和分析。
四、实验结果1. 失血性休克组:(1)血压:失血后血压明显下降,低于正常组;(2)心率:失血后心率加快;(3)心电图:出现ST段抬高、T波倒置等变化;(4)呼吸:呼吸频率和深度增加;(5)瞳孔:瞳孔缩小。
2. 抢救组:(1)血压:给予肾上腺素和阿托品后,血压逐渐回升至正常水平;(2)心率:心率逐渐恢复正常;(3)心电图:ST段抬高、T波倒置等变化逐渐消失;(4)呼吸:呼吸频率和深度恢复正常;(5)瞳孔:瞳孔恢复正常。
五、实验讨论1. 休克是一种严重的生命威胁性疾病,其病因多样,如失血、感染、创伤等。
休克的主要病理生理变化为有效循环血量减少,导致组织灌流不足、代谢紊乱和器官功能障碍。
2. 实验结果表明,失血性休克组动物血压、心率、心电图、呼吸和瞳孔等指标均出现明显异常,提示休克的发生。
而抢救组动物在给予肾上腺素和阿托品后,各项指标逐渐恢复正常,说明休克可以通过及时抢救得到有效治疗。
机能综合实验报告——失血性休克

机能综合实验报告——失血性休克失血性休克是指失血导致循环血量不足,导致心排血量下降,组织灌注不足,出现严重低血压和组织器官衰竭的一种疾病状态。
本次实验的目的主要是通过建立实验动物的失血性休克模型,观察动物体征变化并进行相应的生理指标测量,探究失血性休克的机制,为临床治疗提供一定的参考和指导。
一、实验方法1.1 实验动物选用成年雄性Wistar大鼠,体重250-300g。
1.2 实验设备和试剂心电图机、血流量测定仪、氧化还原酶计、血红蛋白测定仪、动脉粘滞度测定仪、无菌手术器械、路易斯溶液、大鼠丙泊酚、肌肉松弛剂、凝血酶纤维蛋白原复合物、氯化钠、生理盐水等。
1.3.1 麻醉和手术操作首先对大鼠进行预处理,让大鼠在实验环境下适应2-3天。
在实验当天,将大鼠移至操作台上,静脉内注射丙泊酚10mg/kg和肌肉松弛剂2mg/kg,用无菌手术器械对大鼠进行一定长度的剖腹手术,将管腔暴露。
随后使用针头伏特法将大鼠肝门中央静脉插入隆突下动脉,连接血流量测定仪。
1.3.2 失血处理分别抽取50ml的血液(Wistar大鼠血容量占体重的7-8%),使大鼠处于失血状态。
失血量控制在10ml左右,出现严重的低血压和心率下降的情况即停止失血。
1.3.3 观察和测量动物失血后,可以通过血流量的变化观察血管收缩和扩张的情况,心电图的变化观察心脏功能的变化。
同时,用氧化还原酶计、血红蛋白测定仪等仪器测量相应生理指标。
1、预处理:让大鼠在实验环境下适应2-3天。
2、麻醉和手术:将大鼠移至操作台上,静脉内注射丙泊酚10mg/kg和肌肉松弛剂2mg/kg。
对大鼠进行剖腹手术,将管腔暴露。
4、观察和测量:用血流量测定仪等仪器观察和测量相应生理指标。
二、实验结果2.1 生理指标变化实验结果显示,大鼠失血后,心率呈下降趋势,收缩压、舒张压和平均动脉压呈现显著的下降趋势,心排血量下降明显。
氧化还原酶计、血红蛋白测定仪等指标也均表现出异常变化。
医学机能实验技术实验知识:休克

休克正常生理状态下,人和哺乳动物血压恒定在一定范围内,而这种相对恒定的血压维持主要是神经和体液调节的结果。
①心脏受心迷走神经和心交感神经双重支配。
前者对心脏起抑制作用,后者起兴奋作用,都是通过其末梢所释放的递质与心肌细胞相应受体结合而发挥作用。
①绝大多数血管主要受交感神经的单一支配;其末梢所释放的递质与血管平滑肌细胞膜相应受体结合,使血管收缩,故通常称之为交感缩血管纤维。
①调节心血管活动的基本中枢在延髓。
机体许多感受器受到刺激时,冲动传入中枢,均可反射地引起心血管活动的变化,其中颈动脉窦、主动脉弓压力感受器的降压反射经常反馈血压的变动,在维持动脉血压相对恒定方面发挥重要作用。
①去甲肾上腺素(noradrenaline,NA;norepinephrine,NE)是去甲肾上腺素能神经末梢释放的主要递质,肾上腺髓质亦少量分泌。
主要作用是激动α受体,对心脏β1受体作用弱,对β2受体几乎无作用。
肾上腺素(adrenaline,epinephrine)是肾上腺髓质的主要激素,主要作用是激动α受体和β受体。
异丙肾上腺素(isoprenaline,isoproterenol)是人工合成品,化学结构是去甲肾上腺素氨基上的氢原子被异丙基所取代,是经典的β1受体和β2受体激动剂。
多巴胺(dopa分钟e,DA)主要激动α、β受体和外周的多巴胺受体。
酚妥拉明(phentola 分钟e)主要作用是阻断α受体。
普萘洛尔是β受体阻断剂。
休克是机体在各种强烈致病因素作用下,引起有效循环血量急剧减少,组织血液灌流量严重不足,以致细胞损伤、各重要生命器官功能代谢严重障碍的全身性病理过程。
引起休克的原因很多,分类方法也不一。
一般按病因可分为失血性休克、失液性休克、创伤性休克、感染性休克、过敏性休克、心源性休克等。
尽管导致休克的原因很多,但通过血容量减少、血管床容积增大和心输出量急剧降低三个起始环节,引起有效循环血量的减少,组织灌注量的减少是休克发生的共同病变基础。
机能综合实验报告失血性休克

机能综合实验报告失血性休克一、实验目的通过模拟失血性休克这种常见危重病情,了解休克的相关知识,熟悉休克时机体各系统生理功能变化,掌握休克的监测、抢救措施和护理技巧等基本知识和技能。
二、实验原理失血性休克是指因大量失血造成心脏无法维持血液循环所形成的一种危重急症,是失血后机体对风险因素的一种自保反应。
失血性休克的发生,必须存在某种形式的有效循环血量严重不足,主要表现为低血容量、低血压和组织缺氧等。
机体对失血休克的反应即是消化道道、皮肤脉管收缩、淋巴系统流速下降、交感神经系统生物反应降低,以利用有限的血容量为机体的重要器官供应足够的氧气和营养。
当出现失血休克时,必须尽快进行抢救,以保证机体各系统生理功能得以维持,及时防止危及生命的情况的发生。
三、实验器材及药品1. 实验仪器及设备:生命体征监护仪、氧气瓶及氧气面罩、Ⅲ 型汇流管等。
2. 实验药品及溶液:生理盐水、血液置换液及血液净化液等。
四、实验过程1. 了解实验仪器及设备的使用方法、药品及溶液的配制方法。
2. 请实验被试躺在床上,坚持卧床休息。
3. 用生命体征监护仪记录患者心率、呼吸频率、血压、体重等指标,并设置报警上下限。
4. 为患者取血检查,模拟患者失血量,测量本次失血量,并记录血红蛋白、血细胞比容等5. 开始进行失血性休克模拟实验。
通过静脉输液吊盐水和生理盐水来控制患者的血容量,进一步降低患者的血容量,使失血量达到实验设置的程度。
6. 在休克过程中,监测患者生命体征的变化,如心率、呼吸、血压等。
当患者发生失去反应时,应立即进行紧急抢救。
7. 进行抢救措施,包括输液、打氧气等,及时恢复患者的生命体征状态。
8. 护理措施,如保温、检查压疮等。
五、实验结果与分析1. 实验过程中,患者逐渐进入失血休克状态,生命体征逐渐变差,如心率增快并出现心律不齐,血压下降,呼吸困难等。
3. 实验结果还表明,在失血性休克中应该根据患者的情况及时采取抢救措施,如输液、打氧气,及时恢复患者的生命体征状态。
机能综合实验报告失血性休克

机能综合实验报告失血性休克一、实验目的1.了解失血性休克的机制和病理生理变化;2.掌握对失血性休克的处理方法;3.建立对实验动物失血性休克模型的制备方法。
二、实验原理失血性休克是由于大量失血导致有效循环血容量减少,心排血量降低而引起的一种严重的循环功能障碍综合征。
在休克发生过程中,机体会发生一系列病理生理变化,包括心排血量减少、心率加快、血压下降、组织缺血、代谢紊乱等。
失血性休克的处理方法主要包括保持呼吸道通畅、控制出血、输血及补充液体。
三、实验器材和试剂1.实验动物:健康成年小鼠;2. 失血性休克模型制备器材:手术刀、医用剪刀、无菌棉签、灭菌贴、100 ml注射器、1 ml注射器、生理盐水;3.计量仪器:注射器、电子天平;4.进行实验的环境:温度适宜的实验室。
四、实验步骤1.处理实验动物:按照实验伦理规定,将实验动物进行饲养,并训练适应环境;2.模型制备:使用手术刀和医用剪刀,在小鼠的背部对称剪切部分,大约剪除小鼠总血量的20%;3.观察指标记录:在实验过程中,记录实验动物的心率、血压、呼吸等指标。
五、实验结果分析在制备失血性休克模型后,我们对实验动物的生理指标进行了观察和记录。
结果显示,剪切失血后,实验动物的心率明显加快,血压迅速下降,呼吸急促。
这些指标的异常变化与失血性休克的病理生理改变相对应,证明了失血性休克模型制备成功。
六、实验讨论失血性休克是一种常见且危险的疾病,对其的处理方法非常重要。
在实验中,我们使用了剪切法制备了失血性休克模型,并记录了相关的生理指标。
实验结果表明,剪切失血后,实验动物出现了典型的失血性休克病理生理变化,验证了所制备的休克模型的可靠性。
然而,在实际应用中,剪切法制备失血性休克模型并不是最常用的方法。
通常,我们会选择钢针法或切割法来制备失血性休克模型,这些方法更加可控、准确,且操作简便。
因此,在下一步的实验中,我们将尝试其他更先进的制备方法,以提高实验结果的可靠性和准确性。
机能实验失血性休克及其抢救

2. 纠正酸中毒和电解质紊乱
3. 合理使用血管活性药物
[实验步骤]: 家兔、称重、麻醉、固定
膀胱插管
气管插管
充生理盐水
右侧颈外静脉插管
充满肝素
左侧颈总动脉插管
全身血液肝素化 耳缘1ml/Kg 连接BL-420生物机能实验系统
少量失血(少于10%, 约10ml) 大量失血(20%-30%, BP30-40mmHg)
1.少量失血家兔是否发生休克? 2.休克不同时期,会右哪些症状出现?
治疗:1.NE 0.2 ml 溶于10ml NS 滴注(5min) 2.快速回输血液
[观察指标]:
不同处理因素下实验结果
BP
(mmHg)
实验前 小量失血 大量失血 NE 输血
呼吸
(次/分)
尿量 耳朵ቤተ መጻሕፍቲ ባይዱ膜血管
(滴/分) 温度/颜色
[实验注意]:
1. 动静脉插管不要堵塞,固定 2. 三通管方向
[思考]:
失血性休克及其抢救
机能实验中心
[实验目的]:
1.复制失血性休克模型,观察休克发生发展 过程中血压和微循环血流等的变化
2.设计抢救方案,加深对于“休克发病的关 键不在于血压,而在于血流”的理论认识
[实验动物]: 家兔
[实验原理]:
休克的概念
.
(Concept of shock)
多种原因引起的有效循环血量 减少,使组织微循环灌流量严重不 足,以致细胞损伤、各重要器官功 能代谢严重障碍的全身性病理过程。
病因分类
❖ 失血性休克 (Hemorrhagic shock) ❖ 创伤性休克 (Traumatic shock) ❖ 烧伤性休克 (Burn shock) ❖ 感染性休克 (Infective shock) ❖ 心源性休克 (Cardiogenic shock) ❖ 过敏性休克 (Anaphylactic shock) ❖ 神经源性休克 (Neurogenic shock)
机能学实验-失血性休克实验报告

机能学实验-失血性休克实验报告失血性休克是一种常见而且危险的情况。
它通常是由于出血或其他原因而导致体内血容量降低引起的,会使血压下降,血流量降低,导致组织缺氧等一系列生理反应。
本次实验旨在模拟失血性休克情况,观察猪肠的微循环变化,以探究失血性休克对生理状态的影响以及可能的治疗手段。
实验操作步骤:1. 杀猪,取出猪肠,清洗干净。
将猪肠放置于显微镜下,调节显微镜,观察猪肠微循环情况,记录基础状态下的血压和心率。
2. 将空气吸入注射器中,插入針头,注入猪肠中。
同时,监测猪肠微循环情况、血压和心率。
3. 在注射逐渐递增过程中,一旦猪肠微循环开始出现异常,即认定休克状态出现。
记录此时的血压和心率。
4. 将逐渐注入的空气清空,继续观察猪肠微循环情况,直到其恢复到基础状态。
实验结果分析:在注射空气逐渐递增过程中,随着空气的注入,血压和心率开始下降,且猪肠微循环出现明显的缺血情况。
出现休克状态后,血压和心率进一步下降,猪肠微循环更加严重缺氧,直到缺氧达到顶峰后,逐渐恢复到基础状态。
从实验结果可以看出,失血性休克对生理状态产生了很大的影响。
如果不及时处理,可能会导致生命危险。
因此,针对失血性休克的治疗非常重要。
在实验中,我们可以观察到猪肠微循环的变化,从而了解失血性休克对器官组织的影响。
同时,我们也可以尝试不同的治疗手段来缓解休克状态,以找到最佳的治疗方案。
例如,给予输液来恢复体液水平、输血来增加血容量、使用肾上腺素等药物来升高血压等等。
总结:失血性休克是一种危险的疾病,需要及时应对。
机能学实验可以有效的模拟失血性休克情况,通过观察器官微循环的变化,以探究失血性休克对生理状态的影响,为寻找治疗方案提供基础依据。
此外,通过实验,我们还可以更好地理解生理学知识,深入了解机体的运作机制。
休克实验报告分析

一、实验背景休克是机体在受到各种内外因素刺激后,由于循环功能障碍,导致组织器官血液灌流不足,引起全身代谢紊乱和功能障碍的一种病理生理状态。
休克是临床常见的危重症之一,其发病率和死亡率较高。
为了深入了解休克的发病机制、诊断和治疗,本研究采用动物实验模型,观察失血性休克的发生、发展过程,并探讨其治疗策略。
二、实验方法1. 实验动物:选用健康成年家兔,体重2.0-2.5kg,雌雄不限。
2. 实验分组:将家兔随机分为对照组、失血性休克组、治疗组(阿拉明组、多巴胺组)。
3. 实验操作:(1)对照组:仅进行麻醉和固定操作。
(2)失血性休克组:麻醉后,经耳缘静脉注射50U/ml肝素,待肝素起效后,采用股动脉插管抽取一定量的血液,造成失血性休克模型。
(3)治疗组:阿拉明组:在失血性休克模型建立后,给予阿拉明治疗。
多巴胺组:在失血性休克模型建立后,给予多巴胺治疗。
4. 观察指标:(1)血压、心率、呼吸等生命体征。
(2)动脉血气分析、乳酸、尿素氮等生化指标。
(3)组织灌流情况。
(4)脏器功能变化。
三、实验结果1. 生命体征变化:失血性休克组动物血压、心率明显降低,呼吸浅快,与对照组相比差异显著(P<0.05)。
治疗组动物血压、心率较失血性休克组明显升高,呼吸平稳,与对照组相比差异显著(P<0.05)。
2. 生化指标变化:失血性休克组动物动脉血氧分压、二氧化碳分压降低,乳酸、尿素氮升高,与对照组相比差异显著(P<0.05)。
治疗组动物动脉血氧分压、二氧化碳分压较失血性休克组明显升高,乳酸、尿素氮降低,与对照组相比差异显著(P<0.05)。
3. 组织灌流情况:失血性休克组动物皮肤、黏膜苍白,四肢厥冷,组织灌流不足。
治疗组动物皮肤、黏膜色泽逐渐恢复正常,四肢温暖,组织灌流得到改善。
4. 脏器功能变化:失血性休克组动物肝脏、肾脏、心脏等器官功能受损,与对照组相比差异显著(P<0.05)。
治疗组动物器官功能较失血性休克组明显改善,与对照组相比差异显著(P<0.05)。
机能综合实验报告失血性休克

一、实验名称——动脉血压调节与失血性休克(二)二、实验目得1.建立失血性休克得动物模型并观察失血性休克过程中心脏、肾及微循环得变化2.了解抢救失血性休克时扩容血容量得意义,在扩容基础上得应用不同得血管活性药物治疗失血性休克,并进行疗效比较。
3.观察肠系膜微循环,了解休克得机理。
三、合作同学朱骞、徐灵驰、陈霁云、胡蝶四、实验原理1.失血性休克得原理微循环障碍致微循环动脉血灌流不足,重要得生命器官因缺氧而发生功能与代谢障碍,就是各型休克得共同规律。
休克时微循环得变化,大致可分为三期,即微循环缺血期、微循环淤血期与微循环凝血期。
1)正常情况⑴动静脉吻合支就是关闭得。
⑵只有20%毛细血管轮流开放,有血液灌流。
⑶毛细血管开放与关闭受毛细血管前括约肌得舒张与收缩得调节。
2)微循环缺血期⑴交感神经兴奋与肾上腺素、去甲肾上腺素分泌增多,小动脉、微动脉、后微动脉,毛细血管前括约肌收缩。
⑵动静脉吻合支开放,血液由微动脉直接流入小静脉。
⑶毛细血管血液灌流不足,组织缺氧。
3)微循环淤血期⑴小动脉与微动脉收缩,动静脉吻合支仍处于开放状态,进入毛细血管得血液仍很少。
⑵由于组织缺氧,组织胺、缓激肽、氢离子等舒血管物质增多,后微动脉与毛细血管前括约肌舒张,毛细血管开放,血管容积扩大,进入毛细血管内得血液流动很慢。
⑶由于交感神经兴奋,肾上腺素与去甲肾上腺素分泌增多,使微静脉与小静脉收缩,毛细血管后阻力增加,结果毛细血管扩张淤血。
4)微循环凝血期⑴由于组织严重缺氧、酸中毒,毛细血管壁受损害与通透性升高,毛细血管内血液浓缩,血流淤滞;另外血凝固性升高,结果在微循环内产生播散性血管内凝血。
⑵由于微血栓形成,更加重组织缺氧与代谢障碍,细胞内溶酶体破裂,组织细胞坏死,引起各器官严重功能障碍。
⑶由于凝血,凝血因子与血小板大量被消耗,纤维蛋白降解产物增多,又使血液凝固性降低;血管壁又受损害,继而发生广泛性出血。
2.阿拉明与多巴胺治疗失血性休克得机理阿拉明就是α受体激动剂,具有显著地收缩血管得作用,能够快速升高血压;小剂量得多巴胺能够扩张血管。
机能学实验休克实验报告

一、实验目的1. 复制失血性休克模型,观察休克早期大鼠机体的机能变化。
2. 探讨休克的发病机制。
3. 了解休克早期的治疗原则。
二、实验动物与材料实验动物:300g左右SD大鼠,雌雄不限。
实验材料:1. 戊巴比妥钠(2%)2. 硫化钠(8%)3. 利多卡因4. 肝素(50U/ml)5. 碘伏6. 生理盐水7. 尿液计滴器8. 动脉血压计9. 温度计三、实验步骤1. 称重麻醉固定:大鼠称重后,腹腔注射40mg/kg 2%戊巴比妥钠溶液进行全麻。
待麻醉生效后,用8%硫化钠脱去一侧耳廓被毛,将大鼠仰卧位固定于鼠恒温实验台上,减去股部手术野被毛。
2. 动静脉插管:- 碘伏消毒手术野,切开股动脉搏动处皮肤组织。
- 止血钳分离股血管神经鞘,暴露神经血管后,用利多卡因擦拭。
- 用玻璃分针分离股动静脉与股神经。
- 股静脉插管,结扎远心端,近心端插入静脉留置针,打结固定。
- 2.5ml/kg经股静脉推注50U/ml肝素。
- 股动脉插管连接压力换能器。
3. 尿道插管:- 选取硬膜外导管前端约七厘米与尿液计滴器相连。
- 碘伏消毒会阴处,将导管沿尿道插入约4cm。
4. 肛温测量:- 用液体石蜡涂抹动物肛温仪前端。
- 插入大鼠肛门内。
5. 失血诱导:- 用动脉血压计测量大鼠血压。
- 在股动脉插管处,用止血钳夹闭股动脉,使大鼠失血。
- 观察大鼠血压变化,当血压下降至40mmHg以下时,松开止血钳,使大鼠恢复血液供应。
6. 观察指标:- 观察大鼠血压、心率、呼吸频率、肛温等生理指标的变化。
- 观察大鼠皮肤、黏膜颜色、精神状态等变化。
7. 治疗:- 根据观察到的休克早期表现,给予相应治疗。
- 可采用扩容、血管活性药物等治疗措施。
四、实验结果1. 血压:大鼠失血后,血压迅速下降,最低可达40mmHg以下。
2. 心率:大鼠失血后,心率加快。
3. 呼吸频率:大鼠失血后,呼吸频率加快。
4. 肛温:大鼠失血后,肛温逐渐下降。
5. 皮肤、黏膜颜色:大鼠失血后,皮肤、黏膜颜色苍白。
机能学实验报告(失血性休克)

\失血性休克的实验治疗一、实验目的1.观察家兔失血性休克对机体的机能变化及微循环变化2.探讨不同治疗方案对失血性休克的作用及机制二、实验原理1.失血性休克的原理:微循环障碍致微循环动脉血灌流不足,重要的生命器官因缺氧而发生功能和代谢障碍,是各型休克的共同规律。
休克时微循环的变化大致可分为以下三期,即微循环缺氧期、微循环淤血期和微循环凝血期。
(1)正常情况:①动静脉吻合支是关闭的②只有20%毛细血管轮流开放,有血液灌流③毛细血管开放与关闭受毛细血管前括约肌的收缩和舒张调节;(2)微循环缺氧期:①交感神经兴奋和肾上腺素、去甲肾上腺素分泌增多,小动脉,微动脉,后微动脉,毛细血管前括约肌收缩②动静脉吻合支开放③毛细血管血液灌流不足;(3)微循环淤血期①进入毛细血管的血液仍很少②毛细血管开放,血管床容积扩大,进入毛细血管内的血液流动很慢③毛细血管扩张淤血;(4)微循环凝血期①血管内淤血②广泛血栓形成。
2.阿拉明和多巴胺治疗失血性休克原理:阿拉明是α受体激动剂,具有明显的收缩血管作用。
小计量的多巴胺能够扩血管。
三、实验仪器设备大动物手术器械,输血输液装置,呼吸血压描记装置,气管插管,动脉插管,静脉插管,注射器若干,生理盐水,肝素,多巴胺及阿拉明。
四、实验方法与步骤1.动物称重与固定:将麻醉好的兔子称重后,仰卧位固定于动物手术台上。
2.备皮:剪去颈部、腹股沟手术部位的毛。
3.颈部手术:①行气管插管并连接呼吸换能器,记录呼吸;②行颈总动脉插管并连接压力换能器,记录动脉血压;③行颈外静脉插管并连接输液装置,输液用。
4.股部手术:于右侧腹股沟动脉搏动明显处沿动脉走向切开皮肤4—5cm,分离股动脉,夹上动脉夹。
5.观察与记录实验过程中动态观察记录的指标包括:一般情况,皮肤黏膜颜色、血压、心率和呼吸。
(1)放血前:手术完毕,观察与记录上述指标作为实验作为对照。
在颈静脉注射肝素,1ml/kg;(2)放血造成休克:①松开股动脉夹,用注射器抽血并观察血压变化,直至血压维持在平均45mmHg,并维持15min②测量放血量;(3)抢救:根据放血量取等量生理盐水注射,注射完后再注射生理盐水15ml+0.5ml/kg阿拉明,注射完后即为抢救即刻,记录上述指标。
机能实验休克与抗休克
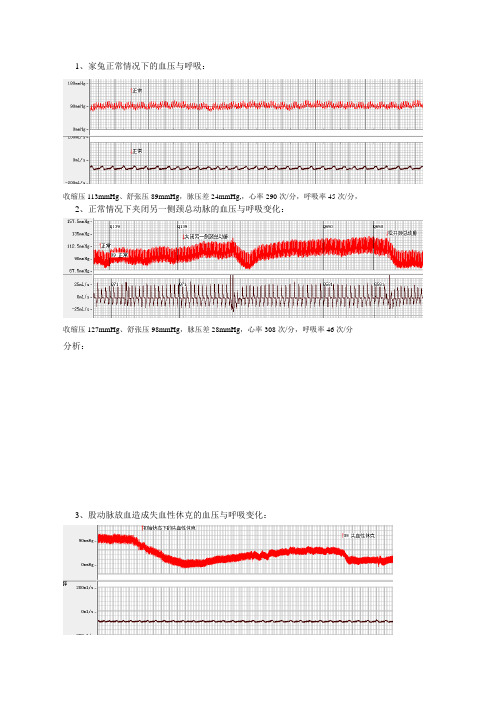
1、家兔正常情况下的血压与呼吸:
收缩压113mmHg、舒张压89mmHg,脉压差24mmHg,,心率290次/分,呼吸率45次/分,
2、正常情况下夹闭另一侧颈总动脉的血压与呼吸变化:
收缩压127mmHg、舒张压98mmHg,脉压差28mmHg,心率308次/分,呼吸率46次/分分析:
3、股动脉放血造成失血性休克的血压与呼吸变化:
收缩压40mmHg、舒张压16mmHg,脉压差24mmHg,心率231次/分,呼吸率53次/分分析:
4、失血性休克状态下夹闭另一侧颈总动脉的血压与呼吸变化:
收缩压42mmHg、舒张压14mmHg,脉压差28mmHg,心率217次/分,呼吸率74次/分分析:
5、回输50%血液后给予酚妥拉明试剂后的血压与呼吸变化:
输血给药前:收缩压43mmHg、舒张压15mmHg,脉压差28mmHg,心率217次/分,呼吸率74次/分输血给药后:收缩压82mmHg、舒张压44mmHg,脉压差28mmHg,心率236次/分,呼吸率86次/分分析:
6、抢救之后的血压与呼吸:
抢救后20min:收缩压82mmHg、舒张压50mmHg,脉压差32mmHg,心率240次/分,呼吸率82次/分分析:。
休克实验报告

家兔失血性休克及其抢救实验人员5人第2组班一、实验目的1. 复制家兔失血性休克模型,观察少量失血和大量失血对家兔动脉血压、心率、皮肤和粘膜颜色的影响。
探讨其发生机制。
2. 用颈外静脉输血和输液的方法抢救失血性休克,观察抢救过程中家兔动脉血压、心率、皮肤和粘膜颜色的变化。
二、实验材料和方法实验器械:兔手术台,常规手术器械,注射器,动脉夹,动脉插管,电刺激连线,血压换能器,三通管,铁架台,棉线,纱布实验仪器:电脑,RM6240生物信号采集系统实验药品:20%氨基甲酸乙酯,肝素,生理盐水0.1ml/10g三、实验对象家兔1只由浙江中医药大学动物实验中心提供四、实验步骤1、仪器调试:首先打开电脑,选择MedLab生物信号处理系统;从第1、2、3通道中选择1个通道,记录动脉血压(记录平均动脉血压、收缩压、舒张压和脉压)。
其次将血压换能器连接线与相应的通道相连,检查换能器是否正常,加肝素溶液排除空泡,先清零,血压0mmH2、家兔称重、麻醉和固定取家兔一只,称重:2.8Kg ,用20%氨基甲酸乙酯以5ml /Kg(体重), 耳缘静脉缓慢注射麻醉, 共注射14ml, 至呼吸深而慢、反射迟钝(角膜反射、夹肢反射)为止。
把兔子以背位固定法固定。
3、麻醉起效后手术颈部手术——左颈总动脉、右颈外静脉、右颈总动脉插管(1)颈部备皮,作颈部,正中3~5cm切口,左右颈总动脉分离,穿线标记,备用。
(2)左颈总动脉插管术---测血压动脉插管及换能器肝素化,左颈总动脉远心端结扎,近心端动脉夹夹闭,动脉前壁倒“V”切口动脉插管插入,结扎固定。
放开动脉夹记录正常动脉血压(平均血压、脉压差、心率)。
(3)右颈外静脉插管术—输血输液排掉输液管中的空气。
右颈静脉近心端动脉夹夹闭,远心端结扎,静脉前壁倒“V”切口,输液管插入,固定。
缓慢输液,保持通畅。
(4). 右颈总动脉插管术——失血造模用肝素抗凝剂排掉50ml注射器(其中保留少许肝素液)和动脉插管中空气,右颈总动脉远心端结扎,近心端动脉夹夹闭,动脉前壁倒“V”切口动脉插管插入,结扎固定。
机能实验报告-休克

机能实验报告-休克医科大学机能学实验报告实验日期:2015年6月17日带教教师:小组成员:专业班级:预防医学一大班失血性休克的实验治疗(多巴胺组)一、实验目的1. 复制失血性休克的动物模型2. 观察失血性休克时和抢救过程中动物的功能代谢变化及微循环改变3.探讨不同治疗方案对失血性休克的作用及机制二、实验原理休克是多种原因引起的,包括大出血、创伤、中毒、烧伤、窒息、感染、过敏、心脏泵功能衰竭等,以机体微循环功能紊乱为主要特征,并可导致多器官功能衰竭等严重后果的全身性病理过程。
失血导致血容量减少,是休克常见的病因。
休克的发生与否取决于失血量和失血速度,当血量锐减,如外伤引起的出血、消化性溃疡出血、食管曲张静脉破裂、妇产科疾病所引起的出血等,超过总血量的25%~30%,超出机体代偿的能力,即可引起心排血量和平均动脉压下降而发生休克。
根据失血性休克过程中微循环的改变,将休克分为三期:休克早期(休克代偿期或微循环缺血性缺氧期)、休克中期(可逆性失代偿期或微循环瘀血性缺氧期)、休克晚期(不可逆性失代偿期或微循环衰竭期)。
但依失血程度及速度的不同,各期持续时间、机体的功能代谢变化及临床表现均有所不同。
对失血性休克的治疗,首先强调的是止血和补充血容量,以提高有效循环血量、心排血量,改善组织灌流;其次根据休克的不同发展阶段合理应用血管活性药物,改善微循环,必要是可予抗炎等治疗。
三、实验仪器设备兔手术台,生物信号采集处理系统,大动物手术器械,输血输液装置,呼吸血压描记装置,气管插管,动静脉插管,呼吸换能器,注射器(5ml,10ml,50ml),多巴胺,间羟胺,生理盐水,肝素钠注射液溶液呼吸换能器四、实验方法与步骤(1)麻醉称重:家兔称重后自耳缘静脉缓慢注射25%乌拉坦溶液麻醉(4ml/kg)。
(2)气管插管:沿颈部正中线作一长5—7厘米的皮肤切口,用止血钳由颈部正中线将肌肉结缔组织分离,暴露出气管。
在气管下方用镊子穿一线,在甲状软骨下1-2厘米处的气管上作一倒T形切口,将气管插管朝心脏方向插入气管,用线结扎,并将多余的线系在气管插管的分叉处固定,以免滑脱。
机能实验:失血性休克

实验失血性休克前言:这次实验课的内容是休克。
首先,我们来简单复习一下休克的基本内容。
首先要知道什麽是休克?休克就是多种原因引起的急性循环障碍,使全身组织血液灌流量严重不足,导致细胞损伤,各重要生命器官发生严重障碍的全身性病理过程。
我们今天实验课复制的家兔休克模型是属于失血性休克。
休克发生的机制是什麽呢?目前公认的是微循环障碍学说,根据休克过程中微循环的改变,把休克分为三期:休克早期(微循环缺血期、缺血性缺氧期);休克期(微循环淤血期、淤血性缺氧期);休克晚期(DIC或多器官功能衰竭)。
同学们在实验过程中要思考一下我们复制的休克模型处在哪一期?除了观察血压以外,你能不能提出一些观测的指标,来说明家兔处在休克的哪一期?不管是哪一种类型的休克,到了休克期,都存在有效循环血容量的严重不足和微循环功能的障碍,而且这两者可以相互促进,形成恶性循环。
所以在抢救休克时,首先要扩充血容量,在此基础上改善微循环的状态。
主要措施包括:充分补充血容量和适当选用血管活性药物。
在这次实验里,扩容的方法是:回输血液和生理盐水;观察了两种血管活性药物:多巴胺(普萘洛尔)和阿拉明(间羟胺)。
同学们回忆一下这两种药物各自属于哪一类的受体激动剂,用于抢救休克的机理是什麽?实验目的:1.学会复制失血性休克的模型;2.了解抢救休克时扩容及应用血管活性药物的意义。
实验步骤:1.称重:2.固定:背位交叉固定先用塑料绳系4个活扣,分别套在家兔的四肢上,上肢套在腕关节以上,下肢套在踝关节以上。
2个同学,1个抓住两上肢,1个抓住两下肢,把兔子翻过来,使它腹面朝上,先把下肢固定在兔台底端的金属框上,再把捆绑两前肢的塑料绳在背位交叉后分别压住对侧的前肢,然后固定在兔台两侧的金属框上,最后用兔头固定器固定头部,适当调整一下固定器的高度,使家兔的颈部保持平直,有利于手术操作。
以下步骤中,3、4、5步是同时进行的。
3.剪毛:手术部位是颈部和一侧腹股沟,把这两个部位的毛剪干净。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
机能实验报告-休克医科大学机能学实验报告实验日期:2015年6月17日带教教师:小组成员:专业班级:预防医学一大班失血性休克的实验治疗(多巴胺组)一、实验目的1. 复制失血性休克的动物模型2. 观察失血性休克时和抢救过程中动物的功能代谢变化及微循环改变3.探讨不同治疗方案对失血性休克的作用及机制二、实验原理休克是多种原因引起的,包括大出血、创伤、中毒、烧伤、窒息、感染、过敏、心脏泵功能衰竭等,以机体微循环功能紊乱为主要特征,并可导致多器官功能衰竭等严重后果的全身性病理过程。
失血导致血容量减少,是休克常见的病因。
休克的发生与否取决于失血量和失血速度,当血量锐减,如外伤引起的出血、消化性溃疡出血、食管曲张静脉破裂、妇产科疾病所引起的出血等,超过总血量的25%~30%,超出机体代偿的能力,即可引起心排血量和平均动脉压下降而发生休克。
根据失血性休克过程中微循环的改变,将休克分为三期:休克早期(休克代偿期或微循环缺血性缺氧期)、休克中期(可逆性失代偿期或微循环瘀血性缺氧期)、休克晚期(不可逆性失代偿期或微循环衰竭期)。
但依失血程度及速度的不同,各期持续时间、机体的功能代谢变化及临床表现均有所不同。
对失血性休克的治疗,首先强调的是止血和补充血容量,以提高有效循环血量、心排血量,改善组织灌流;其次根据休克的不同发展阶段合理应用血管活性药物,改善微循环,必要是可予抗炎等治疗。
三、实验仪器设备兔手术台,生物信号采集处理系统,大动物手术器械,输血输液装置,呼吸血压描记装置,气管插管,动静脉插管,呼吸换能器,注射器(5ml,10ml,50ml),多巴胺,间羟胺,生理盐水,肝素钠注射液溶液呼吸换能器四、实验方法与步骤(1)麻醉称重:家兔称重后自耳缘静脉缓慢注射25%乌拉坦溶液麻醉(4ml/kg)。
(2)气管插管:沿颈部正中线作一长5—7厘米的皮肤切口,用止血钳由颈部正中线将肌肉结缔组织分离,暴露出气管。
在气管下方用镊子穿一线,在甲状软骨下1-2厘米处的气管上作一倒T形切口,将气管插管朝心脏方向插入气管,用线结扎,并将多余的线系在气管插管的分叉处固定,以免滑脱。
(3)颈总动脉插管:颈总动脉插管的目的在于监测血压。
先将已分离的颈总动脉远心段用线结扎,再用动脉夹夹住近心端。
于两者之间另穿一线备用。
在两线之间靠近心端上1/3处,用眼科剪在动脉上作一斜形切口,向心脏方向插入动脉插管,用备用线将插管尖端固定于动脉管内,并结扎固定以防插管脱落。
注意插管与血管方向一致,防止扭转或插管尖端刺破动脉管壁。
(4)颈静脉插管:方法与颈总动脉插管类似,先用动脉夹阻断近心端,再结扎远心端,在靠近远心端剪一个“V”形缺口。
目的在于后面抢救时需从颈静脉给药。
(5)耳缘静脉注射肝素:剂量1ml/kg,目的是为了抗凝。
(6)股动脉插管:股动脉插管的目的在于放血、复制休克的动物模型。
右侧股三角区剪毛,在触及股动脉搏动处沿动脉走向做长约3cm的切口;游离股动脉,经动脉插入导管(插管前管内充满肝素钠溶液),将血管导管连接到三通管上以备作取血用。
(7)观察动物复制休克模型前动物的各项生理指标:包括一般情况,皮肤黏膜颜色、血压、心率和呼吸。
(8)复制休克的动物模型:于复制动物模型前先确认拟给药的静脉通路是否畅通。
打开股动脉插管与注射器相连的侧管,使血液从股动脉流入注射器内,一直放血到平均动脉压为45mmHg时,调节注射器内放出的血量及速度,是血压稳定在低水平(MAP为45mmHg)。
停止放血,如果血压回升,就再放血;血压到达45mmHg时开始计时,使血压恒定维持在45mmHg左右15min。
(9)观察休克时机体各生理指标的变化:血压恒定维持在45mmHg左右15min后,观察失血期间动物各项生理指标以及动物的肠系膜微循环的变化。
(10)抢救:血压维持的时间到15min后,停止放血。
首先将与失血量相等量的生理盐水倒入输液瓶中,快速经静脉回输,再输入含有多巴胺(0.2mg/kg)的生理盐水15ml,滴速:90-120滴/min。
于所有抢救用生理盐水和药物输入完毕后,即刻、15min和30min分别记录各项指标。
30min后复查动物一般情况以及各项生理指标是否恢复正常。
五、实验结果(电子版实验结果粘贴)家兔失血性休克对机体的影响组别MAP 脉压差HR(次/R(次/分、深皮肤粘膜颜色分)度)休克前98 20 254 66 0.49 粉红色休克46. 11 252 70 0.18 苍白治疗组(即刻) A组D组9944.539.2242.3181.17205.0175.76、0.2563.31、0.65青紫青紫治疗组(15min) A组D组9676.83827.63180211.0167 、0.2569.77 、0.99青紫发绀青紫发绀治疗组(30min) A组D组6787.14428.11180211.2875.11 、0.3356.22 、0.86粉红色六、分析与讨论1、家兔失血性休克时机体各器官系统变化的机制?答:家兔失血性休克时主要涉及到循环系统、呼吸系统和皮肤黏膜颜色的变化。
(1)循环系统的变化:①平均动脉压的变化(98mmHg→46mmHg):从正常情况转变到休克状态,平均动脉压降低。
机制如下:机体从正常状态转变为休克状态,回心血量减少,心排出量减少,每搏输出量降低,导致平均动脉压降低;②脉压差下降(20mmHg→11mmHg ):机体从正常状态转变为休克状态,回心血量减少,心排出量减少,每搏输出量降低,收缩压下降,舒张压变化不明显,而脉压差=收缩压-舒张压,进而导致脉压差下降;③心率加快(254次∕分→252次∕分):机体从正常状态转变为休克状态,心脏尚有足够的血液供应,在回心血量增加的基础上,交感神经兴奋和儿茶酚胺的增多可使心率加快;由于心率变化为先快后慢,实验中测得心率为252次∕分。
(2)呼吸系统的变化:机体从正常状态转变为休克状态,呼吸频率加快(66次∕分→70次∕分),呼吸深度变浅(0.49mV→0.18mV)。
机制如下:①休克早期,由于失血,刺激交感神经释放去甲肾上腺素,肺部微循环微动脉、后微动脉和毛细血管前括约肌收缩比微静脉强度更大,使肺毛细血管处于“少灌多流”状态,使得血液与肺泡氧交换不充分,血氧分压降低,二氧化碳潴留,刺激外周化学感受器,使呼吸加深加快,呼吸深度变浅。
②大量失血,交感神经兴奋,毛细血管收缩,外周组织缺血缺氧,毛细血管内气体交换加强,血氧分压降低,使颈动脉体缺氧性兴奋,呼吸频率加快,呼吸深度变浅。
大量失血后,肺动脉压降低,通气血流比值降低,肺泡无效腔增大,使肺代偿性通气减弱。
综合考虑:大量失血时,神经—体液调节较为敏感,主要是交感神经起作用,引起呼吸的加深加快。
(3)皮肤、黏膜颜色变化:皮肤黏膜由粉红色变为苍白色。
原因如下:由于交感肾上腺髓质系统兴奋,外周血管收缩,作用于汗腺,汗腺分泌增多,导致皮肤灌流减少,皮肤变为苍白色。
2、抢救后家兔机体各器官系统变化的机制?(1)循环系统的变化:①平均动脉压的变化(46mmHg→87.1mmHg):平均动脉压升高。
机制如下:抢救后,交感肾上腺髓质系统兴奋性下降,回心血量增多,心排出量增加,每搏输出量增加,导致平均动脉压升高;②脉压差增高(11mmHg→28.11mmHg):抢救后,回心血量增加,心排出量增加,每搏输出量增加,收缩压升高,舒张压变化不明显,而脉压差=收缩压-舒张压,进而导致脉压差升高;③心率减慢(252次∕分→211.28次∕分):抢救后,交感肾上腺髓质系统兴奋性下降,儿茶酚胺的分泌减少,可使心率减慢;(2)呼吸系统的变化:抢救后,呼吸频率减慢(70次∕分→56.22次∕分),呼吸深度变深(0.18mV→0.86mV)。
机制如下:①交感神经释放去甲肾上腺素减少,肺部微循环微动脉、后微动脉和毛细血管前括约肌收缩比微静脉强度小,使得血液与肺泡氧交换频繁,血氧分压升高,刺激外周化学感受器减弱,使呼吸频率减慢,呼吸深度变深。
②交感神经兴奋性降低,毛细血管扩张,毛细血管内气体交换减慢,血氧分压升高,使颈动脉体缺氧性兴奋降低,呼吸频率减慢,呼吸深度变深。
(3)皮肤、黏膜颜色变化:抢救后,皮肤黏膜由苍白色变为青紫色、发绀。
原因如下:抢救后,交感肾上腺髓质兴奋性降低,外周血管扩张,外周循环血液流速缓慢,流经毛细血管时间延长,淤滞,使毛细血管内血液与组织气体交换减慢,血液含氧降低,还原血红蛋白增多,皮肤变为青紫色,甚至会出现发绀的现象。
治疗30分钟后,皮肤粘膜渐渐开始恢复为正常,粉红色。
3、比较多巴胺与阿拉明的抢救效果,并分析其原因?答:多巴胺和阿拉明对失血性休克都有不错的抢救效果,根据心电图的分析可以看出阿拉明在抢救后,血压快速升高后迅速降低,多巴胺在抢救时,虽然血压升高不如阿拉明抢救明显,但是药效后血压下降将较慢,所以多巴胺的抢救效果更加明显,两种药物均属于神经递质类药物,根据两种药物作用的受体类型、受体作用部位和受体分布的不同导致效果不同,具体分析如下:(1)多巴胺作用于D1-R、β1—R、α—R 受体,主要作用于D1-R受体,该受体主要分布于肾血管上,使得尿量增加,作用于冠状动脉,使得冠状动脉扩张,增加血流量;作用于β1—R受体,该受体主要分布器官是心,使得心肌收缩力增加,心率加快,作用于α—R受体,该受体分布于血管平滑肌上,使得血管平滑肌收缩血压升高。
(2)阿拉明作用于β1—R、α—R受体,主要作用于α—R受体,使得血管收缩、外周阻力升高,使得血压升高,作用于β1—R受体,使得儿茶酚胺分泌增多,收缩血管升高血压,但是其作用一般较弱。
综上所述,多巴胺的抢救效果更加明显。
七、结论1. 家兔快速(15min)大量失血超过机体总血量的25%~30%后,可造成失血性休克,但通过代偿反应可以在短时间内使血压适当回升。
2.休克是一种非常严重的病理过程,对机体循环系统、呼吸系统等多种系统有严重影响,易导致机体死亡。
3.阿拉明和多巴胺都可治疗休克,但多巴胺的治疗效果更佳。
