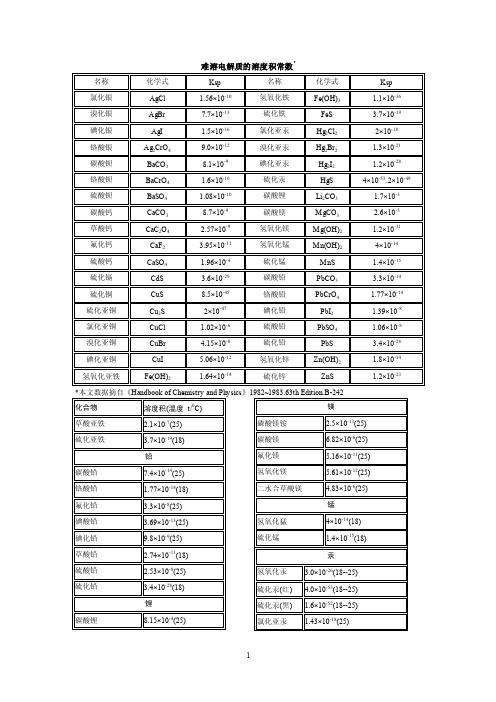
难溶电解质的标准溶度积常数表
难溶电解质的溶度积常数
亚砷酸(H3AsO3) 25 正硼酸(H3BO3) 20 碳酸(H2CO3) 25
25
5.1×10-10 9.29 5.4×10-10 9.27 1 4.5×10-7 6.35 2 4.7×10-11 10.33
焦磷酸(H4P2O7) 20 25 25 25
1 1.2×10 0.91 2 7.9×10 2.10 3 2.0×10 6.70 4 4.8×10 9.32
氢氧化汞 硫化汞(红) 硫化汞(黑) 氯化亚汞
3.0×10-26(18--25) 4.0×10-53(18--25) 1.6×10-52(18--25) 1.43×10-18(25)
1
碘化亚汞 溴化亚汞
硫化镍(a) (ß) (r)
5.2×10-29(25) 6.4×10-23(25)
镍 3.2×10-19(18--25) 1.0×10-24(18--25) 2.0×10-26(18--25)
难 溶电 解质的 溶度 积常数 *
名称
化学式
Ksp
名称
化学式
Ksp
氯化银 溴化银
AgCl AgBr
1.56×10-10 7.7×10-13
氢氧化铁 硫化铁
Fe(OH)3 FeS
1.1×10-36 3.7×10-19
碘化银 铬酸银 碳酸钡 铬酸钡 硫酸钡 碳酸钙 草酸钙 氟化钙 硫酸钙 硫化镉 硫化铜 硫化亚铜 氯化亚铜 溴化亚铜
50g(NH4)2SO4 溶于 100ml 热水,冷却后过滤
溶解 69.5gFeSO4·7H2O 于适量水中,加入 5ml18mol·L-1 H2SO,用水稀释至 1L,置入小铁钉数枚
溶解 12.2g 锑粉于 50ml 浓 HNO3 微热,使锑粉全部作用成白色粉末, 用倾析法洗涤数次,然后加入 50ml6mol·L-1NaOH 溶解,稀释至 1L
难溶电解质的溶度积常数

难溶电解质的溶度积常数(K sp )(13年新课标Ⅰ)11.已知K sp(AgCl)=1.56×10-10,K sp(AgBr)=7.7×10-13,K sp[Ag 2(CrO 4)]=9.0×10-12,某溶液中含有Cl - 、Br -和CrO 42-,浓度均为0.010mol/L ,向该溶液中逐滴加入0.010mol/L 的AgNO 3溶液时,三种阴离子产生沉淀的先后顺序为A .Cl --、Br -、CrO 42-B .CrO 42-、Br -、Cl -C .Br -、Cl -、CrO 42-D .Br -、CrO 42-、Cl -(13年新课标Ⅱ)13.室温时,M(OH)2(s) M 2+(aq)+2OH -(aq)K sp=a , c(M 2+)=b mol·L -1时,溶液的pH 等于A .11()2b g aB .11()2a gb C .14+11()2a g b D .14+ 11()2b g a 基于这两道高考题的迁移提升训练:1.25 ℃时,向含有Cl -和I -的溶液中加入足量AgNO 3溶液,只生成AgI 沉淀,下列关系式一定正确的是A .25 ℃时,Ksp(AgI)> Ksp(AgCl)B .原溶液中,>C .原溶液中,c (Cl -)<c (I -)D .原溶液中,c (Cl -)>c (I -)2.已知:25 ℃时,K sp [Mg(OH)2]=5.6×10-12K sp [Zn(OH)2]=1.0×10-17K sp[Ca(OH)2]=4.0×10-6离子浓度小于10-5mol/L时,认为该离子不存在。
则:(1)25 ℃时,Ca(OH)2溶于水,形成的饱和溶液的物质的量浓度为。
(2)25 ℃时,欲使0.1 mol/L ZnCl2溶液中的Zn2+沉淀完全,需调节溶液的pH至少为。
(3)向含有Mg2+和Zn2+混合溶液中加入一定浓度的NaOH溶液,两种沉淀同时存在时,溶液中=。
难溶盐溶度积的测定

电导法测定PbSO 4的溶度积张玉 吴玲一、实验目的(1)掌握电导法测定难溶盐溶解度的原理和方法; (2)掌握电导率仪的使用方法; (3)注意有毒物质的排放。
二、基本原理难溶电解质在水中会建立一种特殊的动态平衡。
尽管难溶电解质无法溶解, 但仍有一部分阴阳离子进入溶液, 当这两个过程的速率相等时, 难溶电解质的溶解就达到平衡状态, 这样的平衡状态叫沉淀溶解平衡, 其平衡常数叫溶度积。
在一定温度下, 一种难溶电解质的饱和溶液中形成一种多相离子平衡, 可表示为:AmBn( s) ↔ nAm+ ( aq) + mBn- ( aq) K sp= αn (Am+ ) αm ( Bn- )K sp 称为溶度积常数, 简称溶度积。
若能测出难溶电解质的饱和溶液中相应离子浓度, 就可计算出溶度积。
难溶盐的饱和溶液浓度很低,可以把浓度当做活度处理,即c ≈α,所以:K sp= cn (Am+ ) cm ( Bn- )难溶盐PbSO 4在其饱和溶液中存在如下溶解平衡:PbSO 4(s )↔Pb 2+(aq )+ SO 42-(aq )其溶度积为:K sp= c (Pb 2+ ) c (SO 42-)=c (PbSO 4)本实验采用电导法测定PbSO 4的溶度积,惠斯顿电桥G K G ALL A G cell ⨯=⨯=⇒⨯=κκ 由电导率仪测出:O H pbso pbso 244κκκ-=溶液由离子独立移动定律,查表计算:)]21()21([2)(24244-∞+∞∞+=≈so pb pbso m m m pbso λλλλ44)(3pbso pbsom m ol C λκ=⋅- 或 441000)(3pbso pbso dm mol C λκ⋅=⋅-所以:K sp=c 2(mol.m -3)因温度对溶液的电导有影响,本实验在恒温下测定。
电导测定不仅可以用来测定硫酸铅、硫酸钡、氯化银、碘酸银等难溶盐的溶解度,还可以测定弱电解质的电离度和电离常数,盐的水解度等。
第8章 难溶电解质的沉淀溶解平衡1-溶度积常数

国
O
O
C
M
国
大
学
中
O
O
C
M
国
大
学
中
O
O
C
O
O
C
M
国
大
学
中
<0.1g /100g H2O
中
C
O
M
O
大
学
国
中
C
O
M
O
大
学
国
中
C
O
M
O
大
学
国
中
C
O
M
O
大
学
国
中
中
中
中
中
中
中
国
国
国
国
国
国
大
大
大
大
大
大
学
M
O
O
C
学
学
学
学
学
M
M
M
M
M
O
O
O
O
O
O
O
O
O
O
C
C
C
C
C
水是最常见的溶剂,任何物质在水中都有一定的溶解度,
国
中
难溶电解质
AB型:
C
M
O
O
C
M
O
O
C
M
O
O
C
M
O
O
C
O
M
O
M
O
O
C
θ 较大者,其 S 较大;
对组成类型相同的难溶电解质,sp
大
难溶电解质的溶度积

难溶电解质的溶度积溶度积严格地说,在水中绝对不溶的物质是不存在的。
通常将溶解度小于0.01 g/L的物质称为难溶电解质。
例如,在一定温度下,将过量AgCl固体投入水中,Ag+和Cl-离子在水分子的作用下会不断离开固体表面而进入溶液,形成水合离子,这是AgCl的溶解过程。
同时,已溶解的Ag+和 Cl-离子又会因固体表面的异号电荷离子的吸引而回到固体表面,这就是AgCl的沉淀过程。
当沉淀与溶解两过程达到平衡时,此时的状态称为沉淀溶解平衡。
溶解AgCl(s) ==== Ag+ + Cl-(未溶解固体) 沉淀 (已溶解的水合离子)根据平衡原理,其平衡常数可表示为但因c(AgCl)为常数,a(Ag+) = c(Ag+), a(Cl-) = c(Cl-)故上式可写成∴ a(Ag+) ´ a(Cl-) = c(Ag+) ´ c(Cl-) = K Ө = Ksp Ө即为多相离子平衡的平衡常数,称为溶度积常数(可简称溶度积)。
对于一般的难溶电解质AmBn的沉淀溶解平衡AmBn(s) ==== mAn+ + nBm-Ksp=c^m(An+)×c^n(Bm-)上式的意义是:在一定温度下,难溶电解质饱和溶液中各离子浓度幂的乘积为一常数。
严格地说,应该用溶解平衡时各离子活度幂的乘积来表示。
但由于难溶电解质的溶解度很小,溶液的浓度很稀。
一般计算中,可用浓度代替活度。
Ksp的大小反映了难溶电解质溶解能力的大小。
Ksp越小,则该难溶电解质的溶解度越小。
Ksp的物理意义;(1)Ksp的大小只与此时温度有关,而与难溶电解质的质量无关;(2)表达式中的浓度是沉淀溶解达平衡时离子的浓度,此时的溶液是饱和或准饱和溶液;(3)由Ksp的大小可以比较同种类型难溶电解质的溶解度的大小;不同类型的难溶电解质不能用Ksp比较溶解度的大小。
编辑本段溶解度和溶度积的相互换算Ksp与S均可判断溶解度大小,二者有无关系?根据溶度积常数关系式,可以进行溶度积和溶解度之间的计算。
难溶电解质溶度积常数

第三章第四节难溶电解质的溶解平衡—难溶电解质的溶度积常数【学习目标】1.正确理解和掌握溶度积K sp的概念,熟知溶度积常数的应用2.能应用溶度积常数K sp进行相关的计算。
【学习重、难点】能应用溶度积常数K sp进行相关的计算。
【知识梳理】一、难溶电解质的溶度积常数(K sp)1.概念:一定温度下,难溶电解质在溶液中达到沉淀溶解平衡状态时,各离子浓度保持不变,该沉淀溶解平衡的平衡常数称之为溶度积常数,简称,用表示。
2.表达式:对于沉淀溶解平衡M m A n mM n+(aq)+nA m-(aq),参照电离平衡原理得平衡常数:K sp =3.影响因素:(1)K sp只与难溶电解质的性质和有关,而与沉淀的量和溶液中的离子浓度无关。
并且溶液中的离子浓度的变化能使平衡移动,并不改变K sp。
(2)对于大部分溶解平衡,升高温度,平衡向移动,K sp,Ca(OH)2除外。
4.意义:K sp反映了难溶电解质在水中的溶解能力,当化学式所表示的阴、阳离子个数比相同时,K sp越大的难溶电解质在水中的溶解能力相对越强,溶解度。
但对化学式所表示的组成中阴、阳离子个数比不相同的电解质,则不能直接由它们的溶度积来比较溶解能力的大小,必须通过具体计算确定。
下表是几种难溶电解质的溶度积以及溶解能力的比较:沉淀溶解平衡K sp(18~25℃)溶解能力比较AgCl(s)Cl-(aq)+Ag+(aq) 1.8×10-10mol2. L-2AgCl> AgBr > AgI AgBr(s)Br-(aq)+Ag+(aq) 5.0×10-13mol2.L-2AgI(s)I-(aq)+Ag+(aq)8.3×10-17mol2.L-2Mg(OH)2(s)Mg 2+(aq)+2OH-(aq)1.8×10-11mol3.L-3Mg(OH)2> Cu(OH)2Cu(OH)2(s)Cu 2+(aq)+2OH-(aq)2.2×10-20mol3.L-35.应用—溶度积规则:比较K sp与溶液中有关离子浓度幂的乘积(离子积Q c)判断难溶电解质在给定条件下沉淀能否生成或溶解。
常用溶度积常数

溶度积定义对于物质 AnBm(s)=n Am+(aq)+ mBn-(aq), 溶度积(Ksp)=(C(Am+) )^n ( C(mBn-))^m溶度积的应用很广泛。
在定性分析中,利用金属硫化物、氢氧化物、碳酸盐等溶度积的差异分离金属离子。
若往氯化铅饱和溶液中加入氯化钾时,溶液中Cl-浓度增大,Pb2+和Cl-的浓度系数次方之积较氯化铅的溶度积大,这时将有部分离子发生Pb2++2Cl- --→PbCl2的反应,将过剩的PbCl2沉淀出来,直至两种离子的浓度系数次方之积等于氯化铅的溶度积为止。
因此,为使溶解度小的物质完全沉淀,需要加入含有共同离子的电解质。
人教版化学选修4化学反应原理第三章沉淀的溶解平衡涉及溶度积的计算溶解度与溶度积的关系溶解度和溶度积的互相换算:两者都可以用来表示难溶电解质的溶解性。
溶度积是微溶解的固相与溶液中相应离子达到平衡时的离子浓度的乘积,只与温度有关。
溶解度不仅与温度有关,还与系统的组成,PH的改变,配合物的生成等因素有关。
只有同一类型的难溶电解质才能通过溶度积比较其溶解度(mol/l)的相对大小。
大多数实际溶解度S比由c计算得到的要大。
溶度积规则与离子积的关系离子积IP(ion product):任一条件下离子浓度幂的乘积。
Ksp表示难溶电解质的饱和溶液中离子浓度幂的乘积,仅是IP的一个特例。
数值分析1. IP=Ksp 表示溶液是饱和的。
这时溶液中的沉淀与溶解达到动态平衡,既无沉淀析出又无沉淀溶解。
2. IP<Ksp 表示溶液是不饱和的。
溶液无沉淀析出,若加入难溶电解质,则会继续溶解。
3. IP>Ksp 表示溶液为过饱和。
溶液会有沉淀析出常用溶度积常数。
溶度积与溶度积规则

溶度积与溶度积规则一、溶度积定义:在一定条件下,难溶强电解质)(s B A n m 溶于水形成饱和溶液时,在溶液中达到沉淀溶解平衡状态(动态平衡),各离子浓度保持不变(或一定),其离子浓度幂的乘积为一个常数,这个常数称之为溶度积常数,简称溶度积,用K SP 表示。
二、溶度积表达式:)(s B A n m )()(aq nB aq mA m n -++n m m n sp B c A c K )()(-+⋅= (适用对象:饱和溶液)① sp K 只与温度有关,而与沉淀的量和溶液中的离子的浓度无关。
② 一般来说,对同种类型难溶电解质(如AgCl 、AgBr 、AgI 、4BaSO ),sp K 越小,其溶解度越小,越易转化为沉淀。
不同类型难溶电解质,不能根据sp K 比较溶解度的大小。
三、溶度积规则—离子积在一定条件下,对于难溶强电解质)(s B A n m )()(aq nB aq mA m n -++在任一时刻都有nm m n c B c A c Q )()(-+⋅= (适用对象:任一时刻的溶液)可通过比较溶度积与溶液中有关离子浓度幂的乘积----离子积(c Q )的相对大小判断难溶电解质在给定条件下的沉淀生成或溶解情况:sp c K Q >,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡; sp c K Q =,溶液为饱和溶液,沉淀与溶解处于平衡状态;sp c K Q <,溶液未饱和,向沉淀溶解的方向进行,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。
化学上通常认为残留在溶液中的离子浓度小于L mol 5101-⨯时,沉淀就达完全(2011年浙江)13、海水中含有丰富的镁资源。
某同学设计了从模拟海水中制备MgO 的实验方案:模拟海水中的离子浓度(L mol ⋅)+Na+2Mg+2Ca -Cl-3HCO439.0 050.0 011.0 560.0 001.0溶液NaOH Lmol mL 0.10.13.8250.10=pH C L 模拟海水过滤 ①滤液M沉淀物X.11=pH NaOH 调到固体加过滤 ②滤液N沉淀物YMgO注:溶液中某种离子的浓度小于511.010mol L --⨯⋅,可认为该离子不存在;实验过程中,假设溶液体积不变。
难溶电解质溶度积常数

第三章第四节难溶电解质的溶解平衡—难溶电解质的溶度积常数【学习目标】1.正确理解和掌握溶度积K sp的概念,熟知溶度积常数的应用2.能应用溶度积常数K sp进行相关的计算。
【学习重、难点】能应用溶度积常数K sp进行相关的计算。
【知识梳理】一、难溶电解质的溶度积常数(K sp)1.概念:一定温度下,难溶电解质在溶液中达到沉淀溶解平衡状态时,各离子浓度保持不变,该沉淀溶解平衡的平衡常数称之为溶度积常数,简称,用表示。
2.表达式:对于沉淀溶解平衡M m A n mM n+(aq)+nA m-(aq),参照电离平衡原理得平衡常数:K sp =3.影响因素:(1)K sp只与难溶电解质的性质和有关,而与沉淀的量和溶液中的离子浓度无关。
并且溶液中的离子浓度的变化能使平衡移动,并不改变K sp。
(2)对于大部分溶解平衡,升高温度,平衡向移动,K sp,Ca(OH)2除外。
4.意义:K sp反映了难溶电解质在水中的溶解能力,当化学式所表示的阴、阳离子个数比相同时,K sp越大的难溶电解质在水中的溶解能力相对越强,溶解度。
但对化学式所表示的组成中阴、阳离子个数比不相同的电解质,则不能直接由它们的溶度积来比较溶解能力的大小,必须通过具体计算确定。
下表是几种难溶电解质的溶度积以及溶解能力的比较:沉淀溶解平衡K sp(18~25℃)溶解能力比较AgCl(s)Cl-(aq)+Ag+(aq) 1.8×10-10mol2. L-2AgCl> AgBr > AgI AgBr(s)Br-(aq)+Ag+(aq) 5.0×10-13mol2.L-2AgI(s)I-(aq)+Ag+(aq)8.3×10-17mol2.L-2Mg(OH)2(s)Mg 2+(aq)+2OH-(aq)1.8×10-11mol3.L-3Mg(OH)2> Cu(OH)2Cu(OH)2(s)Cu 2+(aq)+2OH-(aq)2.2×10-20mol3.L-35.应用—溶度积规则:比较K sp与溶液中有关离子浓度幂的乘积(离子积Q c)判断难溶电解质在给定条件下沉淀能否生成或溶解。
各难溶电解质溶度积
KIO4 AgC2H3O2 AgBrO3 AgBrO3 AgBr AgBr Ag2CO3 AgCl AgCl AgCl AgCl AgCl Ag2CrO4 Ag2CrO4 Ag2(CN)2 Ag2Cr2O7 AgOH AgIO3 AgI AgI AgNO2 Ag2C2O4 Ag2SO4 Ag2S AgSCN AgSCN SrCO3 SrCrO4 SrF2 SrC2O4 SrSO4 SrSO4 TlBr TlCl Tl2SO4 TlSCN Sn(OH)2 Sn(OH)2
49
1.3×10–21 2×10–18 1.2×10–28 6×10–7; 6.5×10–7 5.48×10
–16
18° C 1.4×10–24 18° C-25° 10–27 C 18° C-25° –21 10 C 18° C 25° C 3.8×10–4 1.05×10
–2
高碘酸钾 乙酸银 溴酸银 溴酸银 溴化银 溴化银 碳酸银 氯化银 氯化银 氯化银 氯化银 氯化银 铬酸银 铬酸银 氰化银 重铬酸银 氢氧化银 碘酸银 碘化银 碘化银 亚硝酸银 草酸银 硫酸银 硫化银 硫氰化银 硫氰化银 碳酸锶 铬酸锶 氟化锶 草酸锶 硫酸锶 硫酸锶 溴化铊 氯化铊 硫酸铊 硫氰化铊 氢氧化锡 氢氧化锡
–9
5.61×10–8 2.77×10–7 2.81×10–7 4×10 2.65×10–4 3.6×10
–4 –6
25° C; 2.25×10–4 18° C-25° 1×10–26 C 25° C 5.45×10 10–28
–27
; 1.4×
硫化锡 氢氧化锌 二水合草酸锌 硫化锌
SnS Zn(OH)2 ZnC2O4 ZnS
P C, L C, L C, L
溶度积常数及其应用

【例题1】下列对沉淀溶解平衡的描述正确的是 A. 反应开始时溶液中个离子浓度相等 B. 沉淀溶解达到平衡时,沉淀的速率和溶解的速 率相等 C. 沉淀溶解达到平衡时,溶液中溶质的离子浓度 相等,且保持不变 D. 沉淀溶解达到平衡时,如果再加入难溶性的该 沉淀物,将促进溶解
答案:B
已知Ag2SO4的Ksp 为2.0×10-5,将适量Ag2SO4固体溶于 100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变 化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034mol· -1)。 L 若t1时刻在上述体系中加入100mL0.020mol· -1Na2SO4 溶液, L 下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间 变化关系的是
答案:C
下列说法正确的是 A.沉淀物X为CaCO3 B.滤液M中存在Mg2+,不存在Ca2+ C.滤液N中存在Mg2+、Ca2+ D.步骤②中若改为加入4.2 g NaOH固 体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
答案:A
【例题3】某温度下,Fe(OH)3(s)与Cu(OH)2分别在溶液 中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度 的变化如上图所示。据图分析,下列判断错误的是 A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2] B. 加适量NH4Cl固体可使溶液由a 点变到b点 C. c、d两点代表的溶液中c(H+)与 c(OH-)乘积相等 D.Fe(OH)3、Cu(OH)2分别在b、c 两点代表的溶液中达到饱和
二、判断沉淀生成与否的原则——溶度积规则 方法:比较Qc(离子积)与Ksp(溶度积)的大小
Qc>Ksp,溶液过饱和,既有沉淀析出,直到溶液 饱和,达到新的平衡; Qc=Ksp,溶液饱和,沉淀与溶解处于平衡状态; Qc<Ksp,溶液未饱和无沉淀析出,若加入过量难 溶电解质,难溶电解质溶解直至溶液饱和。
溶度积

溶度积自然界没有绝对不溶解的物质,许多通常认为不溶于水的物质也有微弱溶解于水的倾向,例如难溶盐氯化银在水中存在沉淀与溶解平衡。
在一定温度下,Ag+浓度和Cl-浓度的乘积为一定值。
如果对一般难溶盐强电解质在水中同样存在A mB n=mA++nB-在一定温度下,则K ap=[A+]m [B-]n式中Ksp为常数,它反映了物质的溶解能力,故称溶度积常数,简称溶度积。
其意义:在难溶强电解质饱和溶液中,组成该物质的各离子浓度的系数次方之积,在一定温度下为该物质固有的常数。
所谓难溶强电解质,可以是盐,亦可以是碱。
严格说,Kap应是难溶电解质在其饱和溶液中离子活度的系数次方之积,称为活度积。
因难溶电解质其溶度积很小,离子浓度近似地等于活度。
任何难溶电解质,不管它的溶解度多么小,在其饱和溶液中总有与其达成平衡的离子。
任何沉淀反应,无论它进行得多么完全,溶液中仍依然存在组成它的离子,而且其离子浓度系数次方之积必为常数。
只不过随难溶电解质的溶解能力的差异,Ksp 值有所不同。
溶度积可由该难溶电解质的溶解度求得。
例如,设氯化铅在水中的溶解度为s(mol·L-1),该盐在饱和溶液中完全电离(s)Pb2+(aq)+2Cl-(aq)PbClPb2+的浓度为s,Cl-的浓度为2s,故Ksp=〔Pb2+〕〔Cl-〕2=s(2s)2=4s3(mol3·L-3)溶度积的应用很广泛。
在定性分析中,利用金属硫化物、氢氧化物、碳酸盐等溶度积的差异分离金属离子。
若往氯化铅饱和溶液中加入氯化钾时,溶液中Cl-浓度增大,Pb2+和Cl-的浓度系数次方之积较氯化铅的溶度积大,这时将有部分离子发生Pb2++2Cl---→PbCl2的反应,将过剩的PbCl2沉淀出来,直至两种离子的浓度系数次方之积等于氯化铅的溶度积为止。
因此,为使溶解度小的物质完全沉淀,需要加入含有共同离子的电解质。
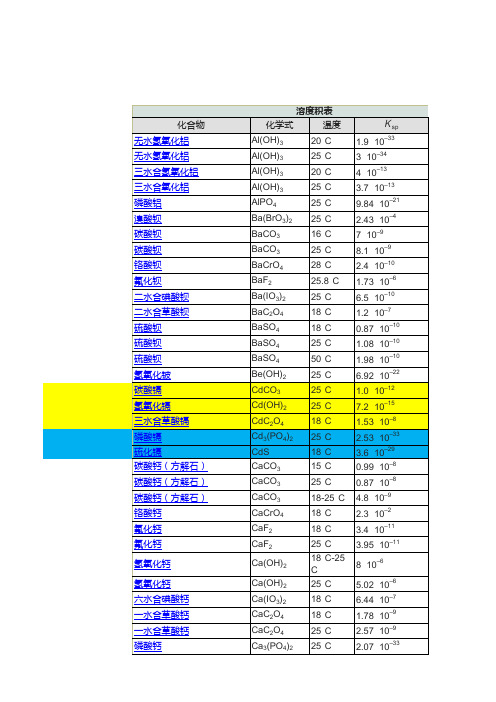
一些常见的难溶电解质的Ksp值见下表。
难溶电解质的溶度积常数25℃。
难溶电解质的溶解平衡(内容全面)

固体物质的溶解度(S)与溶解性的关系
溶解性 难溶 微溶 可溶 易溶
0.01g 0.01 g<S<1 g __ 1g<S<___ 10g S>10 g S的范围 S<____ 小于0.01克 的电解质称为难溶 习惯上,将溶解度___________ 电解质。难溶电解质的溶解度尽管很小,但不 会等于0 ,没有绝对不溶的物质。
AgNO3 AgBr Ag2SO4 Ag2S BaCl2
溶解度/g 1.5×10-4
222 8.4×10-6 0.796 1.3×10-16 35.7 表3-4
化学式 Ba(OH)2
BaSO4 Ca(OH)2 CaSO4 Mg(OH)2 Fe(OH)3
溶解度/g 3.89
2.4×10-4 0.165 0.21 9×10-4 3×10-9
AgCl在水中溶解平衡
Ag+
Cl溶解 沉淀
一方面在水分子的作用下, 少量Ag+和 Cl-脱离AgCl 的表面溶入水中,另一方 面,溶液中的Ag+和 Cl受AgCl表面阴、阳离子的 吸引,回到AgCl表面析出 沉淀。在一定温度下,当 沉淀溶解和生成的速率相 等时,得到AgCl的饱和溶 液,即建立下列动态平衡
动:动态平衡,溶解速率和沉淀速率不等于零 相等 等:溶解速率和沉淀速率_____
保持不变 定:平衡状态时,溶液中的离子浓度_________ 发生移动 变:当改变外界条件时,溶解平衡__________
请写出CaCO3、Mg(OH)2的溶解平衡表达式 CaCO3(s) ⇌ Ca2+(aq)+CO32-(aq) Mg(OH)2(s) ⇌ Mg2+(aq)+2OH-(aq)
几种电解质的溶解度(20℃)
1.分析表3-4所提供的或从有关书籍、网站上查找的更多电解质 在水中溶解度的数据,在溶解度的大小、易溶和难溶界限等方 面你能得到哪些有关信息?谈谈你对书后所附部分酸、碱和盐 的溶解性表中“溶”与“不溶”的理解。 2.根据你对溶解度及反应限度、化学平衡原理的认识,说明生成 沉淀的离子反应是否能真正进行到底。
难溶强电解质

平衡移动方向 2H+ + 2Cl-
2HCl
2H2O
Mg(OH)2
Mg2+ + 2OH- +
平衡移动方向 2NH4+ + 2Cl-
2NH4Cl
2H2O
编辑ppt
(2)碳酸盐沉淀的溶解
CaCO3(s)
Ca2+ + CO3 2-
+
平衡移动方向
H+ + Cl- HCl
HCO3- H+ CO2 + H2O
编辑ppt
S=[CrO42-]=Ksp(Ag2CrO4)/[Ag+]2 =(1.12×10-12/0.102)mol·L-1 =1.12×10-10mol·L-1
编辑ppt
(2)在0.10 mol·L-1 Na2CrO4溶液中的溶解度 在有 CrO42-离子存在的溶液中,沉淀溶解达到平衡时, 设Ag2CrO4的溶解度为S,则
(3)金属硫化物沉淀的溶解
ZnS(s)
Zn2+ + S 2-
平衡移动方向
+ H+ + Cl- HCl
H+
HS-
H2S
编辑ppt
(4) PbSO4沉淀的溶解
PbSO4(s) 平衡移动方向
Pb2+ + SO4 2-
+ 2Ac- + 2NH4+
2NH4Ac
Pb(Ac)2
编辑ppt
(5) 形成难解离的配离子
编辑ppt
解: (1) 溶液等体积混合后,
[Ca2+] =0.010mol·L-1, [C2O42-]=0.010mol·L-1 ,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
×10-9
硫化钴
α-CoS
×10-21
碳酸锶
SrCO3
×10-10
β-CoS
×10-25
草酸镁
MgC2O42)
×10-5
硫化镍
α-NiS
×10-19
草酸钙
CaC2O4·H2O
×10-9
β-NiS
×10-24
草酸钡
BaC2O4
×10-7
-NiS
×10-25
草酸锶
SrC2O4·H2O2)
×10-5
溴化亚铜
CuBr
×10-9
铬酸锶
SrCrO4
×10-5
溴化银
AgBr
×10-13
铬酸钡
BaCrO42)
×10-10
溴化亚汞
Hg2Br2
×10-23
铬酸铅
PbCrO4
×10-13
二溴化铅
PbBr2
×10-5
铬酸银
Ag2CrO4
×10-12
碘化银
AgI
×10-17
重铬酸银
Ag2Cr2O7
×10-7
碘化亚铜
CuI
×10-12
硫化亚锰
MnS2)
×10-15
碘化亚汞
Hg2I2
×10-29
氢氧化钴
Co(OH)3
×10-44
硫化铅
PbS
×10-28
氢氧化亚钴
Co(OH)2(粉红)
2×10-16
硫化亚锡
SnS
×10-25
Co(OH)2(新↓)
×10-15
三硫化二砷
As2S32)
×10-22
氯化氧铋
BiOCl
×10-31
二氯化铅
PbCl2
×10-5
氢氧化亚锰
Mn(OH)2
×10-13
氯化亚铜
CuCl
×10-6
氢氧化亚铁
Fe(OH)2
×10-16
氯化银
AgCl
×10-10
氢氧化铁
Fe(OH)3
4×10-38
氯化亚汞
Hg2Cl2
×10-18
碳酸钡
BaCO3
×10-9
二碘化铅
PbI2
×10-9
铬酸钙
CaCrO4
×10-4
硫化锌
α-ZnS
×10-24
硫酸铅
PbSO4
×10-8
β-ZnS
×10-22
硫酸银
Ag2SO4
×10-5
硫化镉
CdS
×10-27
亚硫酸银
Ag2SO3
×10-14
硫化汞
HgS(红)
×10-53
硫酸亚汞
Hg2SO4
×10-7
HgS(黑)
×10-52
碳酸镁
MgCO3
×10-8
硫化亚铁FeSBiblioteka ×10-18碳酸钙
难溶电解质的标准溶度积常数表
难溶电解质的标准溶度积常数(18~25℃)
难溶电解质
溶度积
难溶电解质
溶度积
名称
化学式
名称
化学式
氟化钙
CaF2
×10-9
氢氧化锌
Zn(OH)2
×10-17
氟化锶
SrF2
×10-9
氢氧化镉
Cd(OH)2(新↓)
×10-14
氟化钡
BaF2
×10-6
氢氧化铬
Cr(OH)3
×10-31
三硫化二锑
Sb2S32)
×10-93
碱式氯化铅
PbOHCl
×10-14
三硫化二铋
Bi2S32)
1×10-97
氢氧化镍
Ni(OH)2
×10-15
硫化亚铜
Cu2S
×10-48
硫酸钙
CaSO4
×10-6
硫化铜
CuS
×10-36
硫酸锶
SrSO4
×10-8
硫化银
Ag2S
×10-50
硫酸钡
BaSO4
×10-10
×10-16
氢氧化铜
Cu(OH)2
×10-20
碘酸铜
Cu(IO3)2
×10-8
氢氧化银
AgOH
×10-8
1) 数据摘自Dean .,Lange,s Handbook of Chemistry,14thed.,,New York:McGraw Hill,1992。
2) 数据摘自《化学便览》基础编(Ⅱ),(改订二版),日本化学会编,丸善株式会社,昭和50年。
氢氧化铝
Al(OH)3(无定形)
×10-33
草酸亚铁
FeC2O4·2H2O
×10-7
氢氧化镁
Mg(OH)2
×10-11
草酸铅
PbC2O4
×10-10
氢氧化钙
Ca(OH)2
×10-6
六氰合铁(Ⅱ)酸铁铁(Ⅲ)
Fe4[Fe(CN)6]3
×10-41
氢氧化亚铜
CuOH
×10-14
六氰合铁(Ⅱ)酸铜(Ⅱ)
Cu2[Fe(CN)6]
