高中化学知识点框架图
高中化学基础知识网络图

高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)第三部分:元素化合物转化关系有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )高分子化合物链烃(脂肪烃)环烃饱和链烃 烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2)OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料 合成橡胶 合成纤维有机化合物。
高中化学基础知识网络图完整版

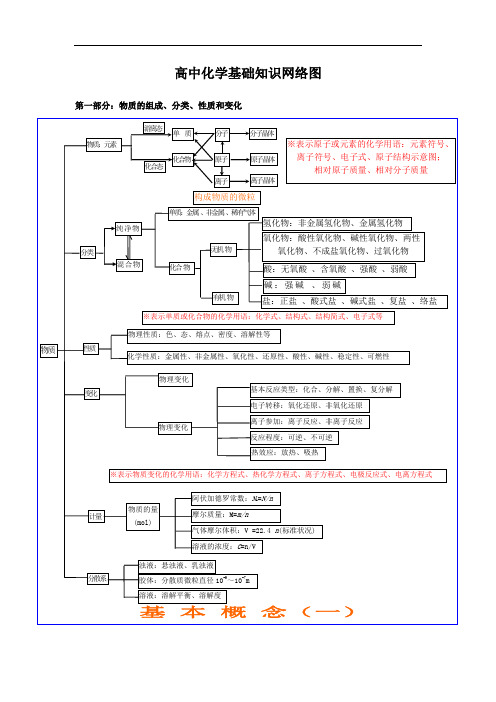
高中化学识网络图第一部分:物质的组成、分类、性质和变化游离态分子分子晶体单质物质:元素※表示原子或元素的化学用语:元素符号、化合物原子原子晶体离子符号、电子式、原子结构示意图;化合态相对原子质量、相对分子质量离子离子晶体构成物质的微粒单质:金属、非金属、稀有气体纯净物分类无机物混合物化合物氢化物:非金属氢化物、金属氢化物氧化物:酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物、过氧化物酸:无氧酸、含氧酸、强酸、弱酸碱:强碱、弱碱有机物盐:正盐、酸式盐、碱式盐、复盐、络盐※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等物质性质化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化基本反应类型:化合、分解、置换、复分解变化电子转移:氧化还原、非氧化还原离子参加:离子反应、非离子反应物理变化反应程度:可逆、不可逆热效应:放热、吸热※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式阿伏加德罗常数:N A=N/n物质的量计量摩尔质量: M=(mol)m/n气体摩尔体积: V =22.4n (标准状况)溶液的浓度: =n/VC浊液:悬浊液、乳浊液分散系胶体:分散质微粒直径10-9~10-7 m溶液:溶解平衡、溶解度基本概念(一)色、态、味溶解度、熔点、沸点密度、硬度、导电性导热性、塑性物理性质游离态单质宏观元素化合物组成化合态大多数有机物稀有气体分子晶体分子酸气态及挥发性物质原子晶体原石墨(混合晶体)子微观金属晶体大多数盐离强碱离子晶体子碱性氧化物部分过氧化物金属性、非金属性氧化性、还原性酸性、碱性稳定性、可燃性金属化学性质非金属单质纯净物稀有气体化合物分类无机物有机物性质氢化物金属氢化物酸性物质非金属氢化物碱性成盐氧化物两性氧化物特殊变化不成盐氧化物含氧酸、无氧酸酸强酸、弱酸强碱、弱碱碱可溶碱、难容碱正盐酸式盐盐碱式盐复盐;络盐潮解、分馏混合物有机、无机升华、萃取物理变化化学变化化合、分解、置换、复分解风化、干馏氧化还原;非氧化还原溶解、盐析裂化、裂解分子、离子基本概念(二)吸热、放热可逆、不可逆第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)物质结构分子 中子质量数同位素原子分 分 分原子核核电荷数元素化 子 子 子 核外电子性学 的的 间质子规形极作质键运 层 排 原子序数变 律成性用力 动 )布化( 状 规 范 态律德 ( 元 共 离 金华 分素 价 子 属 极 非 力 周 键键键)特期性 极殊 最 次 各 能律分 性性外 外 层 量子分层 层 最 最 共 离 金子不 不 多 低价 子 属表现形式超 超 容 原化 化 单电过 过 纳 理合 合 质影 子 8182n元 物物及云个个 2素合 响 个周 金物 实 期 理 质律性质表晶示元 元元核方素 编 素 素 外体归 决结构简图法周 制 周 性 电类纳 定期 期 质 子型表表 律 的 排的周 布电子式结期周构金 分 原 离性 期性 属 子 子 子晶 晶 晶 晶体体体体横:周期 元素种类 起止序号n=1 2 短周期1~2n=2 8 3~10元素性质n=3 8 11~ 18周 原n=41819~36期子表长周期结n=5 18 37~54位构n=6 3255~86置n=7 21 不完全周期 87~111纵:族主族:Ⅰ A ~Ⅶ A 副族:Ⅲ B ~Ⅶ B 、Ⅰ B ⅡB Ⅷ族0 族比较类型离子晶体原子晶体分子晶体构成晶体微粒阴、阳离子原子分子形成晶体作用力离子键共价键范德华力熔沸点较高很高低物硬度硬而脆大小导电性熔融.导电绝缘体 (半导体 )不良理不良水溶液性传热性不良不良不良质延展性不良不良不良溶解性易溶于极性溶剂不溶于任何溶剂相似相溶典型实例NaCl ,KBr 单质:金刚石、 SiC、单质:H2、O2 Si、 SiO2化合物:冰、干冰化表示方法: v A =△c A /△t 单位: mol/L · s(min 或 h )学反是平均速率,均取正值应速特点率同一反应选用不同的物质表示速率,数值可能不同各物质表示的速率比等于该反应方程式的系数比计算化学化影响因素反应学平速反应用衡率应和化的合学选成择氨适化于条学件平衡化学平衡、化学反应速率内因 (主 )外因(辅)可逆反应化学平衡建立的条件: v 正 =v 逆≠0化学平衡的特征(平衡标志的判断)影响化学平衡因素反应物的结构、性质浓度压强温度催化剂其他条件光、超声波、激光、放射线⋯定各成分百分含量保持不变等v 正 =v 逆≠ 0动动态平衡变条件改变,平衡状态改变浓度平衡移动原理压强(勒沙特列原理 )温度强电解质(完全电离) ABA -+B -(已电离的弱电解质分子数电电离平衡 AB- -电离度的定义(电离度 α=×100%)弱 部A +B弱电解质的分子总数解 电 分电离度平衡的移动质解 电化质离水的离子积 K W =1× 10-14(25℃ )合物)水的电离平衡 H 2O +-H +OH溶液的酸碱性: PH=-log[H+ ]实质 装置发生条件表示方式-离子方程式离子反应非氧化还原常见类型氧化还原类型盐类的水解规律(酸碱性性判断)影响因素复分解反应 水解反应络合反应置换反应溶液中氧化还原反应化 能学 的原电池能转化学能电解池与 换电 :非电 解 质原理蓄电池应用电源 干电池高能电池电能氯碱工业(电解饱和食盐水) 原理 电镀应用电解精练(精练铜)电冶炼金属(冶炼铝)电解 质 溶 液比较 装置原电池 能量转换 化学能→电能(实质) (两极分别发生氧化还原反应产生电流)装置特点外电路无电源;两极为活泼性不同(或其中之一为能导电的非金属)的金属电极名称 负极(-)——较活泼正极(+)较不活泼电子流向e负极(-)→正极(+)氧化负极: M - ne → M n+活泼金属失去电子被氧化、被溶解、被腐蚀。
高中化学全套思维导图(高清版)

高中化学全套思维导图(高清版)第一章:物质的组成与结构1. 物质的分类纯净物:单质、化合物混合物:溶液、胶体、悬浊液2. 原子结构原子核:质子、中子电子:电子云、能级3. 元素周期表周期律:周期、族元素周期表的排列:原子序数、电子排布第二章:化学键与化学反应1. 化学键离子键:离子化合物共价键:共价化合物金属键:金属单质2. 化学反应反应类型:合成反应、分解反应、置换反应、复分解反应化学方程式:平衡、反应物、物第三章:溶液与胶体1. 溶液溶质、溶剂溶液的浓度:摩尔浓度、质量浓度、体积浓度2. 胶体胶体粒子:分散相、分散介质胶体的性质:丁达尔效应、布朗运动第四章:酸碱反应与盐类1. 酸碱反应酸、碱的定义中和反应:酸碱反应、盐和水2. 盐类盐的分类:正盐、酸式盐、碱式盐盐的水解:酸碱盐、盐的水解平衡第五章:氧化还原反应1. 氧化还原反应氧化剂、还原剂氧化还原反应的配平2. 电化学原电池:电极反应、电池反应电解质:电解质溶液、电解反应第六章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第七章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第八章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第九章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第十章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用第十一章:物质的量与物质的量浓度1. 物质的量物质的量的定义:摩尔物质的量的计算:摩尔质量、物质的量浓度2. 摩尔体积摩尔体积的定义:摩尔体积摩尔体积的计算:气体摩尔体积、液体摩尔体积、固体摩尔体积第十二章:化学反应速率与化学平衡1. 化学反应速率化学反应速率的定义:速率影响化学反应速率的因素:温度、浓度、催化剂、表面积2. 化学平衡化学平衡的定义:平衡状态化学平衡的建立:平衡常数、平衡反应物和物的浓度第十三章:氧化还原反应与电化学1. 氧化还原反应氧化还原反应的定义:氧化剂、还原剂氧化还原反应的类型:单一置换反应、复分解反应、合成反应、分解反应2. 电化学电化学的定义:电流、电极电化学反应:原电池、电解池第十四章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第十五章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第十六章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第十七章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第十八章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用第十九章:物质的组成与结构1. 物质的分类纯净物:单质、化合物混合物:溶液、胶体、悬浊液2. 原子结构原子核:质子、中子电子:电子云、能级3. 元素周期表周期律:周期、族元素周期表的排列:原子序数、电子排布第二十章:化学键与化学反应1. 化学键离子键:离子化合物共价键:共价化合物金属键:金属单质2. 化学反应反应类型:合成反应、分解反应、置换反应、复分解反应化学方程式:平衡、反应物、物第二十一章:溶液与胶体1. 溶液溶质、溶剂溶液的浓度:摩尔浓度、质量浓度、体积浓度2. 胶体胶体粒子:分散相、分散介质胶体的性质:丁达尔效应、布朗运动第二十二章:酸碱反应与盐类1. 酸碱反应酸、碱的定义中和反应:酸碱反应、盐和水2. 盐类盐的分类:正盐、酸式盐、碱式盐盐的水解:酸碱盐、盐的水解平衡第二十三章:氧化还原反应1. 氧化还原反应氧化剂、还原剂氧化还原反应的配平2. 电化学原电池:电极反应、电池反应电解质:电解质溶液、电解反应第二十四章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第二十五章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第二十六章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第二十七章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第二十八章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用。
(完整)高中化学知识结构图
决 定
外 电 子
表 律 的排
结
周布
构
期周
离 子
性期 性
晶
体
横:周期 元素种类
起止序号
n=1
2
1~2
n=2
8
短周期
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
n=5
18 长周期
37~54
期 表 位
子 结 构
n=6
32
55~86
置
n=7
21 不完全周期 87~111
纵:族
主族:ⅠA~ⅦA
副族:ⅢB~ⅦB、ⅠB ⅡB
原子晶体 石墨(混合晶体)
金属晶体 大多数盐
强 碱 离子晶体 碱性氧化物 部分过氧化物
物理性质 宏观
化学性质 纯净物
单质 化合物
非金属 稀有气体
组成
分类
性质
物质 分 子
变化
原 子 微观
离 子
无机物 氢化物
氧化物
有机物
金属氢化物
酸性
非金属氢化物
碱性
成盐氧化物
两性
特殊
不成盐氧化物
含氧酸、无氧酸
酸
强酸、弱酸
电离度平衡的移动
质离 ) 水的电离平衡 H2O H++OH-
水的离子积 KW=1×10-14(25℃) 溶液的酸碱性:PH=-log[H+]
装置
离子反应
实质
发生条件 表示方式-离子方程式
盐类的水解
常见类型
非氧化还原
复分解反应 水解反应 络合反应
类型 规律(酸碱性性判断) 影响因素
高中化学基础知识网络图完整版
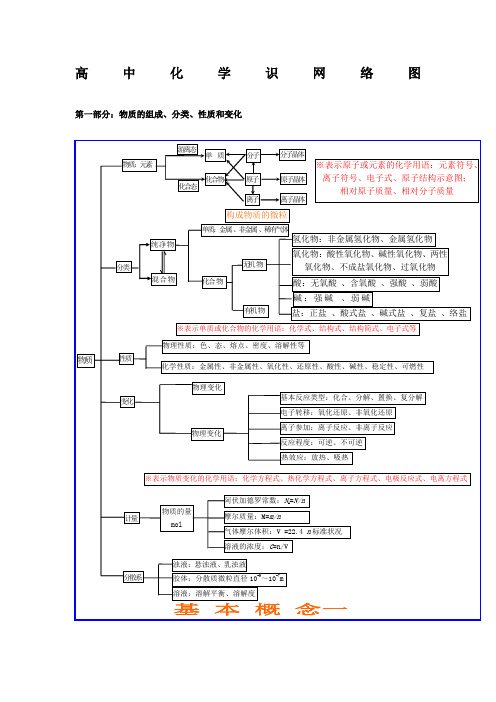
高中化学识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论物质结构、化学反应速率、化学平衡、电解质溶液第三部分:元素化合物转化关系有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸官能团:—NH 2和—COOH高分子化合物链烃脂肪烃环烃饱和链烃 烷烃:C n H 2n+2n ≥1R —CH 3不饱和链烃 烯烃:C n H 2n n ≥2 R —CH=CH 2二烯烃:C n H 2n-2n ≥4R —CH=CH —CH=CH 2 炔烃:C n H 2n-2n ≥2 R —C ≡CH环烷烃C n H 2n n ≥3芳香烃苯和苯的同系物C n H 2n-6n ≥6天然高分子:橡胶聚异戊二烯、多糖、蛋白质R卤代烃官能团:—X :饱和一卤代烃C n H 2n+1Xn ≥1R —X 醇 官能团:—OH :饱和一元醇C n H 2n+1OHn ≥1R —OH 醚 C n H 2n+2O n ≥2R —O —R 酚苯酚官能团:—OHC n H 2n-6O n ≥2OH羧酸 官能团:—COOH :饱和一元羧酸 C n H 2n+1O 2 n ≥1R —COOH醛 官能团:—CHOC n H 2n O n ≥1R —CHO 酮 官能团:—CO —C n H 2n O n ≥3R —CO —R ’酯 官能团:—COO —R :饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 n ≥2R —COOR ’ 硝基化合物官能团—NO 2R —NO 2 胺官能团—NH 2R —NH 2单糖:葡萄糖、果糖C 6H 12O 6互为同分异构二糖:蔗糖、麦芽糖C 12H 22O 11互为同分异构 多糖:淀粉、纤维素C 6H 12O 6n n 值不同合成高分子合成塑料合成橡胶 合成纤维有机化合物。
高三化学知识点框架图

高三化学知识点框架图一、基本概念与原理1. 物质的组成- 原子与分子- 元素与化合物- 同位素与同素异形体2. 物质的分类- 纯净物与混合物- 酸碱盐与氧化物3. 化学反应的基本原理- 质量守恒定律- 能量守恒定律- 化学反应的四种类型:合成、分解、置换、还原4. 化学计量- 摩尔概念- 气体定律- 溶液的浓度表示二、无机化学1. 元素周期律与周期表- 元素周期律- 周期表的结构与应用2. 重要元素及其化合物- 主族元素:碱金属、卤素- 过渡元素:铁、铜、锌3. 酸碱与盐- 酸碱理论:阿伦尼乌斯、布朗斯特-劳里 - 酸碱中和反应- 盐的水解平衡4. 氧化还原反应- 氧化还原反应的识别- 氧化数的计算- 电化学原理:伏打电堆、电解三、有机化学1. 有机化合物的基本概念- 有机化合物的特征- 碳的杂化轨道理论2. 烃类化合物- 饱和烃:烷烃、环烷烃- 不饱和烃:烯烃、炔烃- 芳香烃3. 官能团化学- 醇、酚- 醛、酮- 羧酸、酯4. 聚合反应与高分子化合物- 加聚反应与缩聚反应- 塑料、橡胶、纤维四、物理化学1. 热力学- 热力学第一定律- 热力学第二定律- 化学反应的热效应2. 动力学- 反应速率的概念- 反应速率定律- 催化剂的作用3. 平衡化学- 化学平衡常数- 弱电解质的电离平衡- 沉淀溶解平衡4. 分析化学- 定性分析与定量分析- 光谱分析:红外、紫外、核磁共振 - 色谱分析:气相色谱、液相色谱五、实验技能与安全1. 常见化学实验操作- 溶液的配制- 酸碱滴定- 萃取与分液2. 实验安全与事故处理- 实验室安全规则- 化学品的分类与标识- 常见事故的应急处理通过上述框架图的梳理,学生可以系统地掌握高三化学的核心知识点,为高考化学的复习和备考打下坚实的基础。
每个部分都需要深入理解并能够熟练应用,以确保在解决实际问题时能够灵活运用所学知识。
同时,实验技能的培养和安全意识的加强也是化学学习中不可或缺的部分。
高中化学知识点总结含知识框架图

必修1知识点1 认识化学科学考点1 化学科学考点2 物理变化与化学变化考点3 化学反应基本类型知识点2 物质的量及其计算考点1 物质的量考点2 气体摩尔体积考点3 阿伏加德罗定律及推论知识点3 常用仪器和基本操作考点1 常用仪器形状、名称和使用考点2 化学实验基本操作知识点4 化学实验安全常识考点1 药品的安全存放考点2 化学实验安全常识和操作知识点5 配制一定物质的量浓度的溶液考点1 一定物质的量浓度的配制考点2 配制一定物质的量浓度误差分析考点3 物质的量浓度与溶质质量分数的换算知识点6 常见物质的检验、分离和提纯考点1 常见气体、离子的检验考点2 物质分离和提纯知识点7 化学实验设计考点1 化学实验方案设计的基本要求考点2 物质检验的实验设计知识点8 分散系考点1 胶体的性质及应用考点2 有关溶解度的计算知识点9 离子反应考点1 电解质与电离考点2 离子方程式的书写及正误判断考点3 离子共存知识点10 氧化还原反应考点1 氧化还原反应的概念考点2 氧化性、还原性强弱的判断考点3 氧化还原反应的规律考点4 氧化还原反应方程式的配平考点5 氧化还原反应的计算知识点11 钠及其化合物考点1 钠考点2 氧化钠与过氧化钠考点3 碳酸钠与碳酸氢钠考点4 碱金属元素知识点12 镁及其化合物考点1 镁及其化合物考点2 海水中提取镁知识点13 铝及其化合物考点1 铝考点2 铝的化合物考点3 铝的冶炼知识点14 铁及其化合物考点1 铁考点2 铁的冶炼考点3 铁的化合物知识点15 铜及其化合物考点1 铜及其冶炼考点2 铜的化合物知识点16 氯及其化合物考点1 氯气的性质考点2 氯气的制法考点3 卤素知识点17 氮及其化合物考点1 氮气的性质及用途考点2 氮的氧化物的性质考点3 氨气的性质及制法考点4 铵盐的性质考点5 硝酸的性质知识点18 硫及其化合物考点1 硫的存在及性质考点2 硫的氧化物考点3 硫酸的性质考点4 硫酸的工业制备知识点19 硅及其化合物考点1 硅的性质及制法考点2 二氧化硅和硅酸盐性质考点3 硅酸盐工业必修2知识点1 物质结构基础考点1 原子结构考点2 元素周期律考点3 元素周期表考点4 化学键知识点2 化学能与热能考点1 反应热考点2 燃烧热和中和热考点3 热化学方程式考点4 盖斯定律知识点3 化学能与电能考点1 原电池工作原理考点2 常见的化学电源考点3 金属的腐蚀与防护考点4 电能转化为化学能——电解知识点4 化学反应速率和限度考点1 化学反应速率考点2 影响化学反应速率的因素考点3 化学反应限度与化学平衡知识点5 有机物基础知识考点1 有机物的结构特点和性质考点2 同系物和同分异构体知识点6 烃的分类考点1 甲烷的结构和性质考点2 烷烃的结构和性质考点3 乙烯和烯烃考点4 苯及其同系物知识点7 化石燃料的综合利用考点1 石油的炼制考点2 煤的综合利用知识点8 烃的衍生物的分类考点1 乙醇的结构和性质考点2 乙酸的结构与性质考点3 酯和油脂的结构与性质考点4 糖类的结构与性质考点5 蛋白质的结构与性质知识点9 有机高分子材料考点1 有机高分子化合物考点2 三大合成材料知识点10 资源的综合利用和环境保护考点1 自然资源的开发和利用考点2 环境污染及保护选修1 化学与生活知识点1 化学与健康考点1 糖类考点2 油脂考点3 氨基酸与蛋白质考点4 维生素和微量元素考点5 饮食中食物及食品添加剂考点6 常见药物的成分及疗效知识点2 生活中的材料考点1 金属与合金考点2 金属的腐蚀和防护考点3 玻璃、陶瓷和水泥考点4 塑料、纤维和橡胶知识点3 化学与环境保护考点1 大气污染及治理考点2 水污染及其污水处理考点3 土壤污染与垃圾资源化选修2 化学与技术知识点1 化学与资源开发利用考点1 接触法制硫酸考点2 纯碱的生产考点3 化石燃料的综合利用考点4 海水的综合利用知识点2 化学与材料的制造、应用考点1 金属材料考点2 无机非金属材料考点3 高分子化合物与材料知识点3 化学与工农业生产考点1 获取洁净的水考点2 人工固氮技术——合成氨考点3 化肥与农药考点4 精细化学品选修3 物质结构与性质知识点1 原子结构与元素的性质考点1 原子结构的构造原理考点2 原子结构与元素的性质知识点2 化学键与物质的性质考点1 共价键考点2 分子的立体结构知识点3 分子间作用力与物质的性质考点1 键的极性与分子的极性考点2 分子间作用力知识点4 晶体类型考点1 分子晶体与原子晶体考点2 金属晶体考点3 离子晶体选修4 化学反应原理知识点1 化学反应的热效应考点1 化学反应的焓变考点2 热化学方程式考点3 盖斯定律考点4 反应焓变与标准摩尔生成焓知识点2 原电池原理及其应用考点1 原电池的工作原理考点2 化学电源考点3 金属的腐蚀及防护知识点3 电解的原理及其应用考点1 电解的工作原理考点2 电解的应用——电镀、电解精炼、电冶金考点3 氯碱工业知识点4 化学反应速率和化学平衡考点1 化学反应速率考点2 影响化学反应速率的因素考点3 化学反应进行的方向考点4 化学平衡考点5 影响化学平衡的因素考点6 合成氨的适宜条件及选择依据知识点5 溶液中的离子平衡考点1 弱电解质的电离考点2 水的电离和溶液的酸碱性考点3 盐类水解的规律考点4 盐类水解的应用考点5 沉淀溶解平衡选修5 有机化学基础知识点1 有机化合物的组成与结构考点1 有机化合物的分类考点2 同分异构体考点3 有机化合物的命名考点4 有机物常用分离、提纯的方法考点5 有机物分子式的确定知识点2 烃的性质考点1 烷烃考点2 烯烃考点3 炔烃考点4 芳香烃知识点3 烃的衍生物的性质考点1 卤代烃考点2 乙醇和醇类考点3 苯酚和酚类考点4 乙醛和醛类考点5 羧酸和酯考点6 有机合成知识点4 糖类、氨基酸和蛋白质考点1 糖类考点2 蛋白质和核酸知识点5 合成高分子化合物考点1 合成高分子化合物的基本方法考点2 高分子材料选修6 实验化学知识点1 化学实验基础考点1 物质的分离和提纯考点2 物质的检验与鉴别考点3 物质的制备和合成方法考点4 中和滴定法测定食醋中的醋酸的含量知识点2 化学实验探索考点1 常见性质实验方案的设计考点2 化学实验设计与评价高中化学知识框架一、化学基本概念和基本理论(一)物质的分类(二)组成原子的粒子间的关系核电荷数(Z)=核内质子数=核外电子数质量数(A)=质子数(Z)+中子数(N)(三)元素周期律与周期表(四)化学键与分子结构(五)晶体类型与性质(六)化学反应类型(七)氧化还原反应的有关概念的相互关系(口诀:升失氧化还原剂,降得还原氧化剂)(八)离子反应(九)化学反应中的能量变化(十)溶液与胶体(十一)化学反应速率(十二)化学平衡1、化学平衡化学平衡常数的计算:对于可逆化学反应m A+n B⇋pC+qD在一定温度下达到化学平衡时,其平衡常数表达式为:在书写平衡常数表达式时,要注意以下问题:②化学平衡常数表达式与化学方程式的书写方式有关。
高中化学基础知识网络图完整版

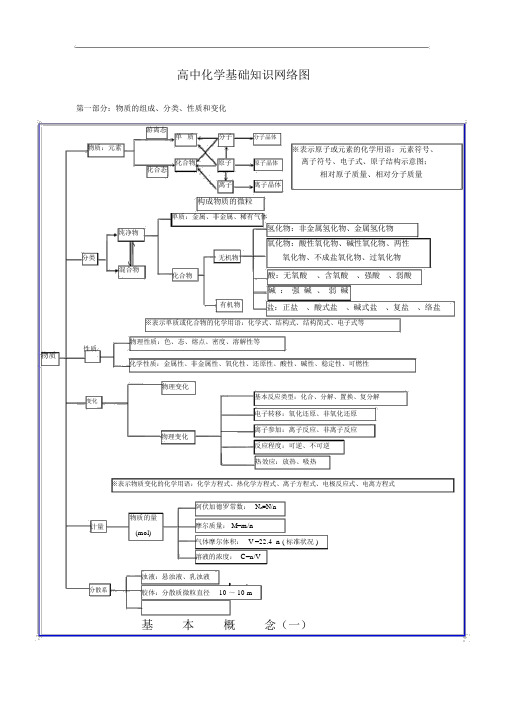
高中化学识网络图第一部分:物质的组成、分类、性质和变化游离态单质分子分子晶体物质:元素化合物原子原子晶体化合态离子离子晶体构成物质的微粒单质:金属、非金属、稀有气体※表示原子或元素的化学用语:元素符号、离子符号、电子式、原子结构示意图;相对原子质量、相对分子质量纯净物氢化物:非金属氢化物、金属氢化物氧化物:酸性氧化物、碱性氧化物、两性分类无机物氧化物、不成盐氧化物、过氧化物混合物化合物酸:无氧酸、含氧酸、强酸、弱酸碱:强碱、弱碱有机物盐:正盐、酸式盐、碱式盐、复盐、络盐※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等物质性质化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化变化基本反应类型:化合、分解、置换、复分解电子转移:氧化还原、非氧化还原离子参加:离子反应、非离子反应物理变化反应程度:可逆、不可逆热效应:放热、吸热※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式计量分散系阿伏加德罗常数:NA=N/n 物质的量摩尔质量:M=m/n(mol) 气体摩尔体积:V =22.4 n ( 标准状况 ) 溶液的浓度: C=n/V浊液:悬浊液、乳浊液-9-7胶体:分散质微粒直径10 ~10 m 基本概念(一)色、态、味溶解度、熔点、沸点密度、硬度、导电性导热性、塑性物理性质游离态单质宏观元素化合物组金属性、非金属性氧化性、还原性酸性、碱性稳定性、可燃性金属化学性质单质非金属纯净物稀有气体化合物分类化合态大多数有机物稀有气体分子晶体分子酸气态及挥发性物质原子晶体原石墨(混合晶体)子金属晶体大多数盐离强碱离子晶体子碱性氧化物部分过氧化物微观性质无机物有机物金属氢化物酸性氢化物物质非金属氢化物碱性成盐氧化物两性氧化物特殊变化不成盐氧化物含氧酸、无氧酸酸强酸、弱酸强碱、弱碱碱可溶碱、难容碱正盐酸式盐盐碱式盐复盐;络盐潮解、分馏混合物有机、无机升华、萃取物理变化化学变化化合、分解、置换、复分解风化、干馏氧化还原;非氧化还原溶解、盐析裂化、裂解分子、离子基本概念(二)吸热、放热可逆、不可逆第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)物质结构分子原子分分分核外电子原子核化子子子学的的间(键形极作运排成性用分动力层布状()规范态律共离金德价子属极非华键键键力特性极最次各能)殊分性外外层量性子分共离金层层最最子不不多低价子属超超容原化化单电过过纳理合合质子影818 2n物物及云响个2 合个个金物理性质中子质子质量数同位素核电荷数元素性质规律原子序数变化元素周期律表现形式元素周实期质律表元元元核晶示方素编素归素外体决制类结构简图法周周纳性定电型表期期质子表律 的 排的 电子式结周布 构 期 周金 分 原 离 性 期性 属 子 子 子晶晶晶晶横:周期 元素种类体 体 体 体 起止序号n=1 21~ 2n=2 8短周期3~10元素性质 n=3 8 11~18周 原 n=4 18 19~36 期 子表 n=5 18 长周期37~54 结位 构 n=6 32 55~86 置n=721 不完全周期 87~111纵:族 主族:ⅠA ~Ⅶ A副族 :ⅢB ~Ⅶ B 、Ⅰ B Ⅱ B Ⅷ族0 族比较类型构成晶体微粒形成晶体作用力熔沸点硬度物理导电性性传热性质延展性溶解性典型实例离子晶体原子晶体分子晶体阴、阳离子原子分子离子键共价键范德华力较高很高低硬而脆大小熔融 .导电绝缘体 (半导体 ) 不良不良水溶液不良不良不良不良不良不良易溶于极性溶剂不溶于任何溶剂相似相溶NaCl , KBr单质:金刚石、 SiC、单质:H2、O2Si、 SiO2 化合物:冰、干冰化化学化学反学应反平速应衡化表示方法学反应速特点率计算影响因素应用:vA =△cA /△t 单位: mol/L ·s(min 或 h )是平均速率,均取正值同一反应选用不同的物质表示速率,数值可能不同各物质表示的速率比等于该反应方程式的系数比内因 (主 ) 反应物的结构、性质浓度压强率和的合选成择氨适于化条学件平衡外因(辅)可逆反应化学平衡建立的条件: v 正=v逆≠ 0化学平衡的特征(平衡标志的判断)温度催化剂其他条件光、超声波、激光、放射线⋯定各成分百分含量保持不变等v 正 =v 逆≠ 0动动态平衡变条件改变,平衡状态改变化学平衡、化学反应速率浓度平衡移动原理影响化学平衡因素压强(勒沙特列原理)温度强电解质(完全电离 ) AB A -+B -已电离的弱电解质分子数(电电离平衡 AB - +B- 电离度的定义 (电离度 α= 弱电解质的分子总数×100%)弱 部 A 解 电 分 电离度平衡的移动质解 电化质 离 -14合水的离子积 ℃ ))K W =1×10 (25物 水的电离平衡 H 2O + +OH - +H 溶液的酸碱性: PH=-log[H]实质装置发生条件表示方式-离子方程式离子反应非氧化还原 常见类型氧化还原类型盐类的水解规律(酸碱性性判断) 影响因素复分解反应水解反应络合反应置换反应溶液中氧化还原反应原理 蓄电池 化 能 应用 电源 干电池 高能电池 学 的原电池能 转 化学能电解池 电能与换 原理 氯碱工业(电解饱和食盐水)电:电镀应用非电解精练(精练铜) 电解 电冶炼金属(冶炼铝)质电 解 质 溶 液比较 装置能量转换 (实质) 装置特点电极名称电子流向电极反应--原电池 电解池化学能→电能 电能→化学能(两极分别发生氧化还原反应产生电流) (在电流作用下两极分别发生氧化还原反应)外电路无电源;两极为活泼性不同外电路必须有直流电源;两极材料均(或其中之一为能导电的非金属)的金属 能导电即可负极(-)——较活泼 阴极——连接电源负极正极(+)较不活泼 阳极——连接电源正极 e e e负极(-)→正极(+) 电源负极→阴极 电源正极→阳极氧化 n + + 还原 n + 还原活泼金属失去电子 + ne →M负极: M -ne → M 阴极: 2H +2e →H 2 ↑或 M被氧化、被溶解、被腐蚀。
(完整)高中化学知识结构图.doc
2n
物
物
及
云
素
响
个
2
合
个
个
实
周
物
金
期
理
质
律
性
质
表
元
元
元
核
晶
示
方
素
编素
归
素
外
体
决
制
类
结构简图
法
周
周纳
性
定
电
型
表
期
期
质
子
表
律
的
排
的
电子式
结
周
布
构
期
周
金
分
原
离
性
期
性
属
子
子
子
晶
晶
晶
晶
横:周期
元素种类
体
体
体
体
起止序号
n=1
2
短周期
1~2
n=2
8
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
期
子
等于 反 方程式的系数比
化
内因(主)
反 物的 构、性
学
化
影响因素
度
反
学
学
平
反
用
速
衡
率
温度
和
的 合
外因( )
化
成
催化
氨
其他条件
光、超声
适
化
于
波、激光、放射 ⋯
条
可逆反
高中化学知识架构图

高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)第三部分:元素化合物转化关系第四部分:有机化学有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )高分子化合物链烃(脂肪烃)环烃饱和链烃烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2)OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料 合成橡胶 合成纤维有机化合物。
高中化学基础知识网络图完整版
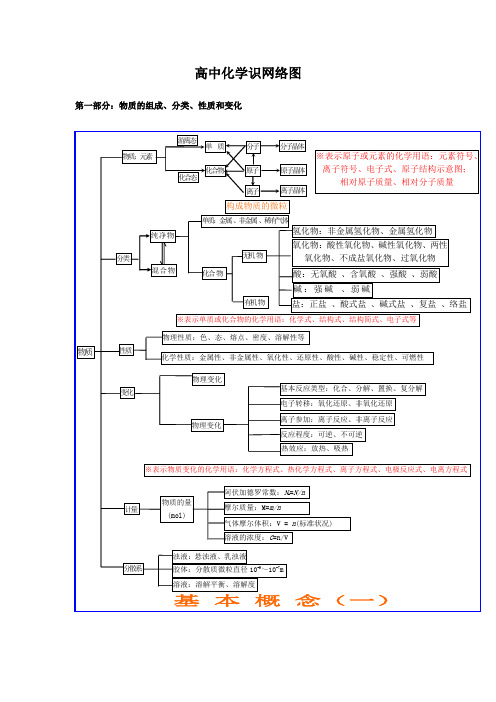
高中化学识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)第三部分:元素化合物转化关系有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )高分子化合物链烃(脂肪烃)环烃饱和链烃 烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2)OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料 合成橡胶 合成纤维有机化合物。
