电极反应规律及离子放电顺序
电化学中电极反应式的书写技巧

电化学中电极反应式的书写技巧电化学中电极反应式的书写技巧电化学中电极反应式的书写不仅是电化学教学的重点和难点,更是高考的热点题型之一,其中,燃料电池电极反应式以及可充电电池电极反应式的书写又是电极反应式书写中的难点。
下面笔者就如何正确书写电极反应式进行了较为详尽的归纳,旨在“抛砖引玉”。
一、原电池中电极反应式的书写1、先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失。
2、注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。
若不共存,则该电解质溶液中的阴离子应写入负极反应式;若正极上的反应物质是O2,且电解质溶液为中性或碱性,则水必须写入正极反应式中,且O2生成OH-,若电解质溶液为酸性,则H+必须写入正极反应式中,O2生成水。
3、正负极反应式相加得到电池反应的总反应式。
若已知电池反应的总反应式,可先写出较易书写的书写电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的书写电极反应式,即得到较难写出的书写电极反应式。
例1、有人设计以Pt和Zn为电极材料,埋入人体内作为作为某种心脏病人的心脏起搏器的能源。
它依靠跟人体内体液中含有一定浓度的溶解氧、H+和Zn2+进行工作,试写出该电池的两极反应式。
解析:金属铂是相对惰性的,金属锌是相对活泼的,所以锌是负极,Zn失电子成为Zn2+,而不是ZnO或Zn(OH)2,因为题目已告诉H+参与作用。
正极上O2得电子成为负二价氧,在H+作用下肯定不是O2-、OH-等形式,而只能是产物水,体液内的H+得电子生成H2似乎不可能。
故发生以下电极反应:负极:2Zn-4e-= 2Zn2+,正极:O2 + 4H+ + 4e- = 2H2O 。
例2、用金属铂片插入KOH溶液中作电极,在两极上分别通入甲烷和氧气,形成甲烷—氧气燃料电池,该电池反应的离子方程式为:CH4+2O2+2OH-=CO32-+3H2O,试写出该电池的两极反应式。
解析:从总反应式看,O2得电子参与正极反应,在碱性性溶液中,O2得电子生成OH-,故正极反应式为:2O2+4H2O+8e- =8OH-。
电极反应式的书写原则

有关电极反应式的书写原则一、加和性原则根据得失电子守恒,总反应式应为两极反应式之和,若已知一个电极反应式,可用总式减去已知的电极反应式,得另一电极反应式;反之,如果已知两个电极反应式,则它们之和就是总反应式。
例1熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气体为阴极助燃气,制得在650℃下工作的燃料电池,完成有关的电极反应式:阳极反应式:2CO+2CO32---==== 4CO2+4e---阴极反应式:_______________________,总反应式:________________________。
解析:在解题时,习惯上总是按题号顺序从前到后依次进行解答,但此题会遇到很大的困难,这是不妨打破常规,进行逆向思维。
先写出难度较小的总反应式,再写出阴极反应式。
由题意可知阳极气和阴极气反应生成CO2,而CO2又不与Li2CO3和Na2CO3的熔融盐混合物反应,所以总反应式为2CO+O2=== 2CO2,同时又知阳极反应式,根据加和性原则可得阴极反应式:2CO+O2=== 2CO2(2CO+2CO32---==== 4CO2+4e---)O2+4e---+2CO2====2CO32---二、是否共存原则电极反应式的书写必须考虑介质环境,物质得失电子后在不同的介质环境中所存在的形式不同。
例2 已知原电池总反应式为CH4+2O2===CO2+2H2O,(1)电解质溶液为KOH时,(2)电解质溶液为H2SO4时,分别写出该原电池的电极反应式。
解析:根据原电池总反应式可知,在反应中CH4被氧化,O2被还原,则CH4应在负极参加反应,O2应在正极参加反应。
又根据是否共存原则,碱性溶液中CO2不可能存在,也不可能有H+参加反应,故负极反应式:CH4—8e---+10OH---==== CO32---+ 7H2O,正极反应式:O2+2H2O+4e---====4OH---。
电解池2(放电顺序1、2)

另一类为活性电极(除铂、金以及在电解 时很容易钝化的铅、铬外的金属),若活性 电极为阴极也只起导体的作用;若为阳极, 则发生氧化反应的往往是电极本身。
练习:书写电解下列溶液的电极反应和总反应。 H2S HI HBr HCl CuCl2 FeBr3 FeCl3 H2O
电解其本身
HNO3 H2SO4 H2CO3 HF KOH Ca(OH)2 NaOH Ba(OH)2 K2SO4 Ca(NO3)2 Na2CO3 Ba(NO3)2 总结:含氧酸、 强碱、活泼的金属含氧 酸盐 溶液的电解实质是电解水。
CuSO4 AgNO3 Fe(NO3)3 NaCl KBr CaCl2 MgCl2 AlCl3
有水参与
关于两电解池串联 标出各电极名称, 当产生64g铜时,判断各电 极的产物有多少克? 4 3 2 1 1、阴极,铜:64g 2、阳极,氯气:71g H2SO4 CuCl2 3、阴极,氢气:2g 4、阳极,氧气:16g
第二课时
一 电解原理
放电:阴离子失去电子或阳离子得到电子 的过程叫放电。
练习:写出电解氯化铜两极发生的反应方程式和
总方程式?
阴极: 阳极:
Cu2+ +
2e— = Cu
2Cl- - 2e— = Cl2
通电
总反应: CuCl2 == Cu + Cl2
2.电解原理 2+ Cl-放电,而不是H+和OH-? 问:为什么Cu 、
有两个图(如下图所示),都分别盛有食盐 水和酚酞混合液,在下列两个装置中观察到变红 现象的区域是 甲 丁 ,并写出各极的反应式。
甲:2H++2e-=H2↑ 乙:Fe-2e-=Fe2+ 丙: 2Zn-4e-=2Zn2+ 丁:
电化学知识点概述(离子放电顺序)

电化学知识点概述张银发电化学知识是高中化学中一个重要的知识点,也是高考中一个重要考点,现将电化学常见知识点归纳如下。
1. 金属的电化学腐蚀由原电池反应可知,在电化学腐蚀中较活泼金属被氧化腐蚀掉。
钢铁的电化学腐蚀有2种:1)析氢腐蚀在酸性溶液中发生负极(Fe):正极(C):2)吸氧腐蚀在中性或酸性极弱的溶液中发生负极(Fe):正极(C):结合生成铁锈的成分为。
钢铁的腐蚀以吸氧腐蚀为主。
为防止金属的腐蚀常采用以下措施:(1)改变金属的结构,如铁中加入Cr或Ni制成不锈钢;(2)涂保护层,如搪瓷、喷漆、刷铝粉、镀锌制成白铁皮、镀锡制成马口铁等;(3)连接活泼金属法,即牺牲阳极的阴极保护法,如闸门、轮船连上锌块或锌皮等。
2. 电极产物的判断原电池:正极发生还原反应,负极发生氧化反应电解池:阳极发生氧化反应,阴极发生还原反应1)在原电池中如果负极为活泼金属,则活泼金属被氧化腐蚀掉,如果是惰性电极如Pt或石墨,则看电解质溶液与正、负极上所填充的物质。
例1 电子表和电子计算器的电池是微型银-锌电池。
其电极分别用组成,电解质溶液是KOH溶液,总的反应式为。
试回答:(1)电池工作时负极上的反应方程式是_____________________,负极附近溶液的pH_____________(填“上升、下降、不变”)。
(2)正极上发生的电极反应是___________。
答案:(1)(2)2)对于电解池中电极产物的判断,首先要看溶液中的离子种类及电极材料。
(1)阳极产物判断首先看电极,如果是活性电极(金属活动顺序表Ag以前),则电极材料失电子,电极被溶解,溶液中的阴离子不失电子。
如果是惰性电极(Pt、Au、石墨),则要再看溶液中的离子的失电子能力,此时根据阴离子放电先后顺序加以判断。
阴离子放电先后顺序为。
(2)阴极产物的判断直接根据阳离子放电顺序进行判断,阳离子放电先后顺序为、例如用石墨棒作电极电解溶液,电池反应式为,若改为铜棒作电极电解溶液,其电池反应式为(3)注意原电池与电解池的区发与联系在书写有关电池反应式时,首先要分清原电池与电解池,二者最关键的区别是看电池有无外加电源:有,为电解池;无,则为原电池。
电极反应的书写技巧(最全最新)

专项突破---电极反应式书写技巧电化学中电极反应式的书写基本是高考的必考题型之一,如何解决这一难题,应尊遵循以下思路:(1)明确写的是何种电极的反应式(2)明确该电极的放电微粒和放电后的产物:在确定放电微粒时要严格遵循题目要求。
(3)利用化合价的变化确定得失电子数(4)先利用电荷守恒,后利用原子守恒并结合电解质溶液的环境(酸性、碱性、中性等)确定电极反应式中的所缺微粒。
(一)原电池中电极反应式的书写1、先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失。
2、注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。
若不共存,则该电解质溶液中的阴离子应写入负极反应式;若正极上的反应物质是O2,且电解质溶液为中性或碱性,则水必须写入正极反应式中,且O2生成OH-,若电解质溶液为酸性,则H+必须写入正极反应式中,O2生成水。
3、正负极电极反应式在得失电子数目相同时相加得到电池反应的总反应式。
若已知电池反应的总反应式,可先写出较易书写的书写电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的书写电极反应式,即得到较难写出的书写电极反应式。
【典型例题】用金属铂片插入KOH溶液中作电极,在两极上分别通入甲烷和氧气,形成甲烷—氧气燃料电池,该电池反应的离子方程式为:CH4+2O2+2OH-=CO32-+3H2O,试写出该电池的两极反应式。
解析:从总反应式看,O2得电子参与正极反应,在碱性性溶液中,O2得电子生成OH-,故正极反应式为:2O2+4H2O+8e- =8OH-。
负极上的反应式则可用总反应式减去正极反应式(电子守恒)得CH4+10OH--8e-= CO32-+7H2O。
【专题练习】燃料电池是燃料(如CO,H2,CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是稀硫酸溶液,在甲烷燃料电池中:负极反应式为,正极反应式为:。
(二)、电解池中电极反应式的书写1、首先看阳极材料,若阳极是活泼电极(金属活动顺序表Ag以前的金属,金属活动顺序由强到弱:钾〉钙〉钠〉镁〉铝〉铍〉锰〉锌〉铁〉钴〉镍〉锡〉铅〉(氢)〉铜〉汞〉银〉铂〉金。
电极方程式书写(阴、阳两极物质的放电顺序)

2.关于弱电解释H2O的处理
①CuSO4 ②H2SO4 ③NaOH
总方程式OH-的处理 阴极方程式H+的处理 总方程式OH-的处理
注意:电解质环境对电极方程式书写的影响
二.复原问题
复原原则:出去什么补什么,出去多少补多少 题干:电解CuSO4 1.溶质CuSO4足量,加入CuO
2.溶质CuSO4少量 ①阴极:Cu2+放电完毕,H+放电 加入:CuO和H2O ②若电解消耗CuO和H2O=1:1,则加入Cu(OH)2
电解H2SO4溶液、NaOH溶液?PH?
相当于电解水,
阳极:4OH--4e-=2H2O+O2↑(碱) (或 2H2O-4e-=4H++O2↑水 )放氧生酸
阴极:4H++4e-=2H2↑(酸) (或4H2O+4e-=2H2↑+4OH-水)放氢生碱
总反应: 注意反应条件:通电(电解)
电解
2H2O 2H2↑+O2↑
五.典型例题2
21.某同学按下图所示的装置进行电解实验。下 列说法正确的是( ) A.电解过程中,铜电极上有H2产生 B.电解初期,总反应方程式为: Cu+H2SO4==CuSO4+H2↑ C.电解一定时间后,石墨电极上有气体放出 D.整个电解过程中,H+的浓度不断增大
1.整理 ①电极方程式的书写
三.转移电子数确定方法
电解质溶液复原:用惰性电极电解CuSO4溶液时 ①若加入1molCuO ,转移 mole②若加入1molCu(OH)2 ,转移 mole③若加入1molCu2(OH)2CO3 ,转移 mole-
4e- ~ 1O2~ 2Cu~ 4H+;
四.电解池的设计
电解原理

e-
阳极
与电源负极相连,电子流出,发生还原反应 阳极: 与电源正极相连,电子流入,发生氧化反应
5、电极反应式: 阴极: Cu2+ +2e- =Cu
还原反应
阳极: 2Cl- -2e- =Cl2↑ 氧化反应
总反应: 通电 CuCl2
阳、氧、正
Cu+ Cl2↑
闭合回路
6、阴阳离子移动: 阴离子 阴极 阳极
第二单元
电解池的工作原理与应用
电解原理
一、电解原理
1、电解:使电流通过电解质溶液而在阴、 阳两极引起氧化还原反应的过程。
理解:电解质溶液导电的过程就是电解 2、电解池: 电能转化为化学能的装置 3、形成电解池的条件
⑴与电源相连的两个电极 e- ⑵电解质溶液或熔化的 电解质 阴极 ⑶形成闭合回路 4、电极的判断 阴极:
原电池与电解池的比较
内容 原电池 电解池 阴极 阳极 电极名称 正极
负极
电极反应 还原 氧化 反应 反应 电子移动 先从负极→ 导线→正极 方向 能量转变 将化学能转 化为电能
氧化 还原 反应 反应 负极→导线→阴极 阳极→导线→正极 将电能转化 为化学能
巩固练习: 1.在电解水时,常加入一些稀硫酸,其目的是 A.使溶液酸性增强 B.使溶液中离子浓度增大 C.加快电解的速率 D.使溶液的氧化性增强
A.
71 161
×100%
B.
w w 36a
71 w
×100%
C.161( w 18 a ) %
7100 w
D. ( w 36 a ) ×100% 161
6.用两支惰性电极插入50mLAgNO3溶液中,通
电电解。当电解液的PH值从6.0(CH+=10-6
高中化学电解反应知识点总结!

高中化学电解反应知识点总结!一、电解的原理1.电解定义在电流作用下,电解质在两个电极上分别发生氧化反应和还原反应的过程。
2.能量转化形式电能转化为化学能。
3.电解池(1)构成条件①有与电源相连的两个电极。
②电解质溶液(或熔融盐)。
③形成闭合回路。
(2)电极名称及电极反应式(如图)(3)电子和离子的移动方向特别注意:电解时,在外电路中有电子通过,而在溶液中是依靠离子定向移动形成电流,即电子本身不会通过电解质溶液。
4.分析电解过程的思维程序(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液中的H+和OH-)。
(3)然后排出阴、阳两极的放电顺序阴极:阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。
阳极:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子。
(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
(5)最后写出电解反应的总化学方程式或离子方程式。
【注意点】1.做到“三看”,正确书写电极反应式(1)一看电极材料,若是金属(Au、Pt除外)作阳极,金属一定被电解(注Fe生成Fe2+)。
(2)二看介质,介质是否参与电极反应。
(3)三看电解质状态,若是熔融状态,就是金属的电冶炼。
2.规避“三个”失分点(1)书写电解池中电极反应式时,要以实际放电的离子表示,但书写总电解反应方程式时,弱电解质要写成分子式。
(2)要确保两极电子转移数目相同,且应注明条件“电解”。
(3)电解水溶液时,应注意放电顺序中H+、OH-之后的离子一般不参与放电。
2二、电解原理的应用1.电解饱和食盐水(1)电极反应阳极反应式:2Cl--2e-=Cl2↑(氧化反应)阴极反应式:2H++2e-=H2↑(还原反应)(2)总反应方程式2NaCl+2H2O2NaOH+H2↑+Cl2↑离子反应方程式:2Cl-+2H2O2OH-+H2↑+Cl2↑(3)应用:氯碱工业制烧碱、氯气和氢气。
电解规律
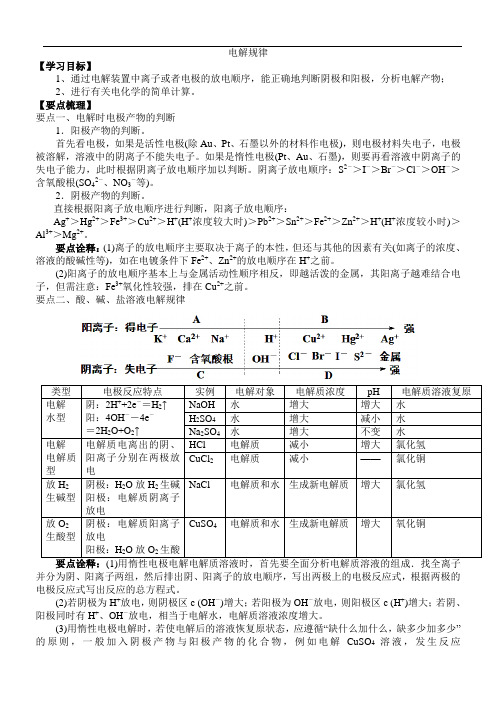
电解规律【学习目标】1、通过电解装置中离子或者电极的放电顺序,能正确地判断阴极和阳极,分析电解产物;2、进行有关电化学的简单计算。
【要点梳理】要点一、电解时电极产物的判断1.阳极产物的判断。
首先看电极,如果是活性电极(除Au、Pt、石墨以外的材料作电极),则电极材料失电子,电极被溶解,溶液中的阴离子不能失电子。
如果是惰性电极(Pt、Au、石墨),则要再看溶液中阴离子的失电子能力,此时根据阴离子放电顺序加以判断。
阴离子放电顺序:S2->I->Br->Cl->OH->含氧酸根(SO42-、NO3-等)。
2.阴极产物的判断。
直接根据阳离子放电顺序进行判断,阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(H+浓度较大时)>Pb2+>Sn2+>Fe2+>Zn2+>H+(H+浓度较小时)>Al3+>Mg2+。
要点诠释:(1)离子的放电顺序主要取决于离子的本性,但还与其他的因素有关(如离子的浓度、溶液的酸碱性等),如在电镀条件下Fe2+、Zn2+的放电顺序在H+之前。
(2)阳离子的放电顺序基本上与金属活动性顺序相反,即越活泼的金属,其阳离子越难结合电子,但需注意:Fe3+氧化性较强,排在Cu2+之前。
要点二、酸、碱、盐溶液电解规律类型电极反应特点实例电解对象电解质浓度pH 电解质溶液复原电解水型阴:2H++2e-=H2↑阳:4OH--4e-=2H2O+O2↑NaOH 水增大增大水H2SO4水增大减小水Na2SO4水增大不变水电解电解质型电解质电离出的阴、阳离子分别在两极放电HCl 电解质减小增大氯化氢CuCl2电解质减小——氯化铜放H2生碱型阴极:H2O放H2生碱阳极:电解质阴离子放电NaCl 电解质和水生成新电解质增大氯化氢放O2生酸型阴极:电解质阳离子放电阳极:H2O放O2生酸CuSO4电解质和水生成新电解质增大氧化铜并分为阴、阳离子两组,然后排出阴、阳离子的放电顺序,写出两极上的电极反应式,根据两极的电极反应式写出反应的总方程式。
人教版高中化学选修4-化学反应原理:象限法理解电解池的放电顺序

总反应式:CuCl2
Cu+Cl2 ↑
知识点探索---以惰性电极电解的基本类型
Ⅱ
Ⅰ
Ag+>Hg2+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+
S2->I->Br->Cl->OH->SO42->NO3->F-
知识点探索---以惰性电极电解的基本类型
Ⅱ
Ⅰ
Ag+>Hg2+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+
S2->I->Br->Cl->OH->SO42->NO3->F-
Ⅲ
Ⅳ
思考:
1、由Ⅱ 、 Ⅳ象限的离子组成的电解质
溶液,如CuSO4、AgNO3,在电解时阴、阳离 子分别应该是哪些离子放电?
Ⅲ
Ⅳ
思考:
1、由Ⅰ 、Ⅲ象限的离子组成的电解质溶 液,如NaCl、KBr,在电解时阴、阳离子分别 应该是哪些离子放电?
2、试写出其电极反应式和总反应式。
电解池电极反应式
以惰性电极电解的类型及电极反应式:
Ⅱ
Ⅰ
Ag+>Hg2+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+
Ⅲ
Ⅳ
知识点探索---以惰性电极电解的基本类型
Ⅱ
Ⅰ
Ag+>Hg2+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+
电化学中电极反应式的书写技巧

技法点拨电化学中电极反应式的书写技巧■付延芳高考试题年年新,但在新情境中却会发现有些内容是惊人的相似,抓住这些核心主干知识的考查规律是高考获取高分的秘籍,但是对高考数据分析却发现,学生丢分点拉开差距的并不是那些偏难的内容,恰恰是这些中等难度高频出现的知识点,例如氧化还原反应规律的考查。
探索那些大家必须掌握的高频率高考热点,大道至简,有好的思维模式和突破思路,将大大降低这些考点的难度,提高正确率,今天我们通过氧化还原反应的电化学中电极反应式的书写规律来管中窥豹,旨在“抛砖引玉”。
还原产物CH 4两个半反应:失电子得电子CH -4-8e -+10OH -=CO 2-3+7H 2O2O 2+4H 2O+8e -=8OH --++首先,电化学中电极反应式的书写和氧化还原离子方程式的书写规律是一致的,遵循原子守恒、电荷守恒、得失电子守恒。
它是一个完整的氧化还原反应同时在两极发生完成的,可以按照上图思维框架来着笔半反应方程式的书写。
同时在书写半反应时要考虑介质环境,这是在配平半反应时所必需的。
一般而言,根据酸性或碱性环境水溶液的判断,要H 2O/OH-或者H 2O/H +来调配才能满足电子、原子和电荷三大守恒关系;根据熔融盐或熔融氧化物等电解质环境,可以用熔融盐或熔融氧化物中的离子等来配平,如Li+、CO 32-、O 2-等。
下面将在规律总结的同时加以说明。
一、原电池中电极反应式的书写先确定原电池的正负极,列出正负极上的反应物质(氧化剂和还原剂),并标出相同数目电子的得失。
然后在主要参与物质氧化剂和还原剂以及得失电子的基础上,通过观察来增加其他物质或离子来配平。
分析历年高考题阅卷统计数据不难发现,细节决定成败,学生丢分点往往是在不起眼的符号“+”和“-”上,其实我认为这恰恰是老师的疏忽所在,如果让学生死记“+”和“-”,肯定要颠三倒四,但是如果讲讲中国汉字的学问,讲讲符号无非是为了理解的方便,从字面上就不难理解“-”为失,“+”为得,那么在书写时准确率就会达到100%,通过这个简单的符号“+”和“-”在高考中得分率并不高,我们就更应该通过推理而不是记忆来学好化学。
电解时离子放电顺序

电解时离子放电顺序 Prepared on 22 November 2020电解时离子放电顺序一、放电的概念放电:阴离子失去电子而阳离子得到电子的过程叫放电。
二、离子放电顺序1、决定离子放电顺序的因素:①离子得失电子的能力②离子的浓度③电极材料多种阴阳离子分别移向阴极阳极时,优先放电的是:氧化性、还原性强的离子2、电极反应(1)阴极:(阳离子得电子)Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+(2)阳极:(阴离子失电子)若阳极是活泼金属(金属活动顺序表Ag以前),溶液中的阴离子一律不放电,而是电极材料失电子。
注:电解题优先看阳极材料若阳极是惰性(Pt、Au、石墨),则放电顺序如下:S2->I->Br->Cl->OH->含氧酸根离子3、电解规律(用惰性电极电解时)⑴、电解含氧酸、强碱溶液、活泼金属的含氧酸盐溶液时,实质上是电解水。
如电解H2SO4、HNO3、NaOH、Na2SO4等溶液时其电极反应式为:阳极: 4OH--4e-=2H2O +O2↑阴极: 4H+ +4e-=2H2 ↑总反应:2H2O = O2↑ +2H2↑电解后溶液中溶质的质量分数增大,若要恢复原来的浓度,只需加入一定量的水即可。
⑵、电解无氧酸溶液(氢氟酸除外)、不活泼金属的无氧酸盐溶液时,实质上是电解质本身被电解。
如电解盐酸、CuCl2溶液等时。
电解盐酸阳极: 2Cl -- 2e-=Cl2↑阴极: 2H+ +2e-= H2 ↑总反应:2HCl = Cl2↑ + H2↑电解后溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量的溶质(通入一定量的HCl气体)。
⑶、电解不活泼金属的含氧酸盐时,电解质和水都有一部分被电解,如电解CuSO4溶液、AgNO3溶液等。
原电池中电极反应式的书写规则与化学考试注意事项

原电池中电极反应式的书写规则与化学考试注意事项一、原电池中电极反应式的书写1 、先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失。
2、注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。
若不共存,则该电解质溶液中的阴离子应写入负极反应式;若正极上的反应物质是O2,且电解质溶液为中性或碱性,则水必须写入正极反应式中,且O2生成OH-,若电解质溶液为酸性,则H+必须写入正极反应式中,O2生成水。
3、正负极反应式相加得到电池反应的总反应式。
若已知电池反应的总反应式,可先写出较易书写的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的电极反应式,即得到较难写出的电极反应式。
例1、有人设计以Pt 和Zn为电极材料,埋入人体内作为作为某种心脏病人的心脏起搏器的能源。
它依靠跟人体内体液中含有一定浓度的溶解氧、H+ 和Zn2+ 进行工作,试写出该电池的两极反应式。
解析:金属铂是相对惰性的,金属锌是相对活泼的,所以锌是负极,Zn失电子成为Zn2+,而不是ZnO或Zn(OH)2,因为题目已告诉H+参与作用。
正极上O2得电子成为负二价氧,在H+作用下肯定不是O2-、OH-等形式,而只能是产物水,体液内的H+得电子生成H2似乎不可能。
故发生以下电极反应:负极:2Zn -4e-= 2Zn2+正极:O2 + 4H+ + 4e- = 2H2O 。
二、电解池中电极反应式的书写1、首先看阳极材料,如果阳极是活泼电极(金属活动顺序表Ag 以前),则应是阳极失电子,阳极不断溶解,溶液中的阴离子不能失电子。
2、如果阳极是惰性电极(Pt 、Au、石墨),则应是电解质溶液中的离子放电,应根据离子的放电顺序进行书写电极反应式阳极(惰性电极)发生氧化反应,阴离子失去电子被氧化的顺序为:S2->SO32->I->Br ->Cl->OH->水电离的OH->含氧酸根离子>F-。
阴极发生还原反应,阳离子得到电子被还原的顺序为:Ag+>Hg2+>Fe3+>Cu2+>(酸电离出的H+)>Pb2+>Sn2+>Fe2+>Zn2+>(水电离出的H+)>Al3+>Mg2+>Na+>Ca2+>K+。
电解池阴阳极的放电顺序

电解池阴阳极的放电顺序
电解池阴阳极的放电顺序为:电解池阴极为阳离子放电,得电子能力强先放电;电解池阳极为阴离子放电或电极放电,失电子能力强先放电。
若阳极是活泼金属(金属活动顺序表Ag以前),溶液中的阴离子一律不放电,而是电极材料失电子。
若为惰性电极,则两极按照下列顺序放电:
-电解水型;
-电解电解质型:电解质电离出的阴、阳离子分别在两极放电;
-放氢气生碱型:阴极:水放氢气生碱;阳极:电解质阴离子放电;
-放氧气生酸型:阴极:电解质阳离子放电;阳极:水放氧气生酸。
若想了解更详细的内容,可参考相关专业书籍或网站。
放电顺序与电极反应pH变化

电解质溶液电解时(均为惰性电极),pH 变化情况,电解液复原所需加入物质及电解类型阴离子放电顺序为:S 2->I ->Br ->Cl ->OH ->含氧酸根离子阳离子放电顺序一般为:Ag +>Hg 2+>Fe 3+>Cu 2+>H +(酸)>Fe 2+>Zn 2+>H +(盐溶液)(1)酸性电解质溶液环境下电极反应式:O 2+4H ++4e -=2H 2O (2)碱性电解质溶液环境下电极反应式:O 2+2H 2O+4e -=4OH -(3)固体电解质(高温下能传导O 2-)环境下电极反应式:O 2+4e -=2O 2- (4)熔融碳酸盐(如:熔融K2CO3)环境下电极反应式:O2+2CO2+4e -=2CO -23电解类型电解水型电解质分解型放氢生碱型放氧生酸型电解质类型 含氧酸、强碱、活泼金属的含氧酸盐(如NaOH 、H 2SO 4、K 2SO 4等) 无氧酸(除HF 外)、不活泼金属的无氧酸盐(氟化物除外)的电解,如HCl 、CuCl 2等 活泼金属的无氧酸盐(氟化物除外)溶液的电解,如NaCl 、MgBr 2 不活泼金属的含氧酸盐溶液的电解,如CuSO 4、AgNO 3等电极反应 阴极:4H ++4e -=2H 2↑阳极:4OH --4e -=O 2↑+2H 2O阴极:Cu 2++2e -=Cu 阳极:2Cl --2e -=Cl 2↑阴极:2H ++2e -=H 2↑ 阳极:2Cl --2e -=Cl 2↑阴极:2Cu 2++4e -=Cu阳极:4OH --4e -=O 2↑+2H 2O总反应2H 2O电解2H 2↑+O 2↑ CuCl 2电解Cu+Cl 2↑2NaCl+2H 2O电解2NaOH+H 2↑+Cl 2↑2CuSO 4+2H 2O电解2Cu+O 2↑+2H 2SO 4 电解产物阴极产物:H 2; 阳极产物:O 2阴极产物:酸为H 2,盐为金属;阳极产物:卤素等非金属单质阴极产物:碱和H 2; 阳极产物:卤素等非金属单质阴极产物:析出不活泼金属单质;阳极产物是该盐对应的含氧酸和氧气pH 变化原来酸性的溶液pH 变小,原来碱性的溶液pH 变大,强酸(含氧酸)强碱的正盐溶液pH 不变。
2总复习:电解池(一)—电解原理和规律

电解池(一)电解原理和规律电解池1.能量转化:将电能转变为化学能的装置。
电解:电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程。
电解是最强有力的氧化还原手段。
2.电解池的构造和阴阳极的判断(1)电解池的构造(2)阴阳极的判断3、放电顺序:阳极:看_____电子能力①金属材料作电极时:(根据金属活动性)金属失电子被氧化成阳离子进入溶液,阴离子不容易在电极上放电。
②用惰性电极(Pt、Au、石墨、钛等)时:F- <含氧酸根< OH- <Cl- <Br-<I-< S2-阴极:看_____电子能力Na+ < Al3+ < Fe2+ < H+ < Cu2+ < Fe3+ < Ag+放电的顺序取决于:离子的本性、离子浓度、电极材料Na+ < Al3+ < Fe2+ < H+ < Cu2+ < Fe3+ < Ag+F- <含氧酸根SO42-< OH- <Cl- <Br-<I-< S2-<金属说明:①阴阳离子在两极上放电顺序复杂,与离子性质、溶液浓度、电流强度、电极材料等都有关,不应将放电顺序绝对化,以上仅是一般规律。
②电解过程中析出的物质的量(或析出物质的质量):在电解若干串联电解池中的溶液时,各阴极或阳极所通过的电量相等,析出物质的量取决于电路中通过的电量。
电解举例电极反应溶液变化溶液复原总结:1、阳极产物:____________________________________2、阴极产物:_____________________________________阴极:发生___________反应的电极。
与电源________相连的电极。
阳极:发生____________反应的电极。
与电源__________相连的电极。
放电:离子在电极失去或得到电子,发生__________反应的过程。
电极反应规律及离子放电顺序

电极反应规律及离子放电顺序
1.两极的电极反应规律(阳氧阴还)
(1)阴极:得电子,还原反应
①(一般)电极本身不参加反应
②一定是电解质溶液中阳离子“争”得电子,
(2)阳极:失电子,氧化反应
①若为金属(非惰性)电极,电极失电子
②若为惰性电极,电解质溶液中阴离子“争”失电子
2.离子放电顺序(不考虑浓度等其他因素)
放电:阳离子得电子而阴离子失电的过程。
上述顺序基本上与金属活动顺序一致,即越活泼的金属,其阳离子越难结合电子,但Fe3+氧化性较强,排在Cu2+之前。
(2)阴离子放电顺序。
21-22版:4.3.2 酸、碱、盐溶液的电解规律(步步高)

第2课时酸、碱、盐溶液的电解规律学习目标 1.熟知电解池中的电极反应规律(放电先后顺序),会书写其电极反应式。
2.理解并掌握酸、碱、盐溶液的电解规律和电解产物的判断方法。
一、电解池中的电极反应规律1.有下列两组离子:①Cu2+、Na+、H+、Ag+;②Cl-、I-、SO2-4、OH-。
(1)电解时,哪一组离子移向阳极?放电的先后顺序是什么?答案②;放电的先后顺序是I->Cl->OH->SO2-4。
(2)电解时,哪一组离子移向阴极?放电的先后顺序是什么?答案①;放电先后顺序是Ag+>Cu2+>H+>Na+。
2.下列电解池中的电解质溶液为NaCl和CuSO4的混合溶液。
(1)图中电解质溶液中含有的离子有哪些?答案Na+、Cl-、Cu2+、SO2-4、H+、OH-。
(2)写出A、B均为惰性电极碳棒时的电极反应式。
答案①阳极:2Cl--2e-===Cl2↑;②阴极:Cu2++2e-===Cu。
(3)写出A为铜棒,B为碳棒时的电极反应式。
答案①阳极:Cu-2e-===Cu2+;②阴极:Cu2++2e-===Cu。
电解池中的电极反应规律(1)阴极:无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子。
阳离子放电顺序:Ag+>Cu2+>H+>Pb2+>Fe2+>Zn2+……(2)阳极:溶液中还原性强的阴离子失去电子被氧化,或者电极材料本身失去电子被氧化而溶入溶液中。
其放电顺序:活性金属阳极>S2->I->Cl->OH->含氧酸根。
深度思考根据电解池中的电极反应规律,分析判断:(1)电解质溶液电解时,其阳极产物可能是什么?提示若为活性电极,电极材料失去电子而溶解,阳极产物为其阳离子;若为惰性电极,则非金属阴离子或OH-放电,阳极产物为非金属单质。
(2)电解质溶液电解时,其阴极产物可能是什么?提示阴极产物可能是金属单质或氢气。
