高等热力学课件第1章流体pVT关系1
合集下载
第一章气体的pVT关系-PPT精品

pB yBpp
B
B
上一内容 下一内容 回主目录
返回
2019/12/3
§1.2 理想气体混合物
• 理想气体混合物中某一组分 的分压力等于这个组分以同 混合物相同的温度和体积单 独存在时的压力。
pO2 yO2 p
pyO2pyN2p
上一内容 下一内容 回主目录
pN2 yN2 p
§1.2 理想气体混合物
nnO2 1 mo3 l.49mol yO2 0.29
VnpRT 5255 m 3
0.08m 53
上一内容 下一内容 回主目录
返回
2019/12/3
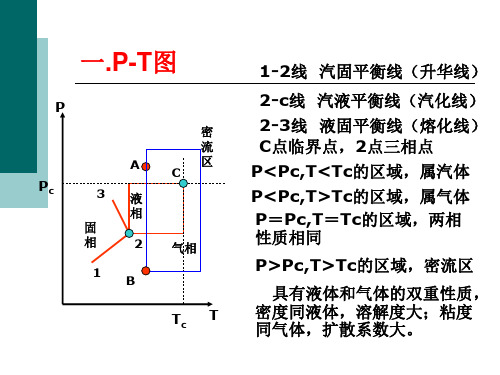
§1.3 气体的液化及临界参数
上一内容 下一内容 回主目录
返回
2019/12/3
§1.2 理想气体混合物
• 理想气体混合物的总体积等于 等于各个组分 以同混合物相同的温度和压力单独存在时的分 体积之和。
VVO2 VN2
V
O
2
V
N
2
上一内容 下一内容 回主目录
返回
2019/12/3
§1.2 理想气体混合物
例. 空气中氧气的体积分数为0.29,求 101.325kPa、25℃时的1m3空气中氧气的 摩尔分数、分压力、分体积,并求若想 得到1摩尔纯氧气,至少需多少体积的空 气。(将空气近似看成理想气体)
2019/12/3
§1.1 理想气体的状态方程
例:计算25℃,101325Pa时空气的密度。
(空气的分子量为29) 解:
V nR pT 8.31 15 2071 .1335 2 25 5 mom l3
4.0 87mom l3
d 空 = V 气 n M 4.8 0 2 79 g m 3 1.k 1m g 8 35
高等热力学课件第1章流体pVT关系

3
等温与绝热
可用于描述理想气体的扩张和压缩过程,探索其热力学性质。
流体的比热容和焓
比热容
衡量流体在吸收或释放热量时的 温度变化。
焓
描述了系统的内能和对外界做功 的总和性 质和能量转化。
麦克斯韦方程和吉布斯-杜亨方程
1 麦克斯韦方程
热力学函数之间的偏导数关系,揭示了系统 的性质。
理想气体与实际气体
1 理想气体
遵循理想气体定律,分子之间无相互作用。
2 实际气体
分子之间有相互作用,需要使用状态方程来描述。
3 真实气体状态方程
包括艾伦-富根方程和范德华方程。
等温过程和绝热过程
1
等温过程
温度保持不变,内能转化为热量与环境交换。
2
绝热过程
热量不从或不向环境交换,内能转化为功或由功转化为内能。
2 吉布斯-杜亨方程
描述了多组分体系的平衡条件。
相图和临界点
相图
展示了物质在不同温度和压 力条件下的各种相态。
临界点
温度和压力达到临界值时, 物质不再存在液态和气态之 分。
临界温度和临界压力
定义了物质转变为超临界流 体的条件。
流体在工程中的应用
1 流体动力学
用于设计飞行器、汽车和船只的空气动力学 和水动力学。
2 能源转换
涉及流体的燃烧、蒸汽发电和涡轮机等领域。
3 化工过程
4 环境工程
流体在化学工程中的传热、传质和反应过程。
涉及水力学、水污染和废水处理等流体问题。
高等热力学课件第1章流 体pVT关系
流体力学的核心概念之一是流体的pVT关系。通过深入研究这些关系,我们可 以更好地理解流体的特性和行为。
流体的性质
《流体的PVT关系 》课件

流量计
用于测量流体的流 量。
搅拌器
用于混合流体。
实验步骤与操作方法
准备实验设备与器材,确保其完好无损。
01
按照实验要求,向储液罐中加入适量的流 体,并搅拌均匀。
03
02
将压力表、温度计、流量计等测量仪器连接 到实验设备上。
04
启动实验设备,观察并记录压力、温度和 流量等参数的变化。
在实验过程中,保持环境温度和压力恒定 ,以减小误差。
03
pvt关系的表现形式
压力与体积的关系
压力与体积的负相关关系
在恒温条件下,流体的压力增大,体积将减小;压力减小,体积将增大。这是因 为压力的增加会导致流体分子间的平均距离减小,从而体积减小。
等温压缩系数
描述压力变化时体积变化的程度。等温压缩系数越大,表示压力变化引起的体积 变02
气体定律
气体在一定条件下遵循pvt关系,如理想气体定律和范德华方程等。这 些定律可以帮助我们预测和解释气体在不同压力、温度和体积下的行为 。
流体的压缩性
流体的压缩性是指流体在压力变化下体积的变化程度。通过pvt关系, 我们可以了解流体的压缩性,进而研究流体在管道中的流动特性。
压力对pvt关系的影响
总结词
压力是影响流体pvt关系的另一个重要因素 。
详细描述
在高压下,流体的分子间的距离变小,相互 作用力增强,导致流体的密度和粘度增加。 同时,压力的变化也可能影响流体的蒸气压
和溶解度等物性参数。
物质种类对pvt关系的影响
要点一
总结词
要点二
详细描述
不同物质具有不同的分子结构和相互作用力,因此其pvt关 系也不同。
不同物质的pvt关系曲线存在差异,这是因为不同物质的分 子间相互作用力和分子结构不同。此外,同一种物质在不 同温度和压力下的pvt关系也可能存在差异。
化工热力学-流体的 p-V-T 关系

Z
Z
Z
1
q
Z
或
Z
0.026196
Z
Z
0.026196
1.026196 Z 6.6060 0.026196
将 Z= 代入上式右边,迭代计算后得到收敛值Z=0.04331。
V l ZRT 0.043318.314350 133.3 cm3mol1
p
0.9457
为了比较计算结果,在例2/5-1的情况下,运用四种立方型状态 方程所计算得到的V v及V l 值列表如下:
第二章 流体的 p-V-T 关系
(一)纯流体的三维相图
自由度与相律
(二)纯流体的二维相图
异戊烷的p-V图
p-T相图
T-V图
(三)纯流体 pVT 行为的模型化
→ 什么是状态方程?
f p,V,T 0
dV
V T
p
dT
V p
T
dp
V=V(T,p)
p=p(T,V )
(四)理想气体
只有在Zc相等的条件下,对比态原理才能成立
以ω为第三参数的对应状态原理
Z f pr ,Tr ,
偏心因子
Pitzer: 物质对比饱和蒸汽压的对数,与对比温度的倒数呈 下列线性关系
log
prS
a 1
1 Tr
prS
pS pc
球形分子虽然临界参数相差很大,但在Tr=0.7时,对比蒸气压 logprS = -1 。
ZC 3/8 1/3 1/3 0.30740
临界压缩因子Zc
VDW: 3/8 RK/SRK: 1/3 PR: 0.3047
立方型状态方程的数值求解
p
RT
V b
V
流体的PVT关系PPT课件
3. 81型
在55型方程的基础上增加了常数B4,这样就得到了我 们讲义P12式(2-33),此式称为81型M-H方程。
优点: a:计算精度高,误差:气相1%,液相<5% b:常数易确定,只需两点实测数据(临界点,常压下数 据)
c:可用于极性气体PTV性质计算 d:可用于VLE和液相性质的计算
问题:对液相极性物质计算误差大,最大误差达16% 参考文献:化工学报, (1). 1981
实际气体的等温线
将范德华方程整理后得到: P(V-b)V2=RTV2-a(V-b) PV3-(bP+RT)V2+aV+ab=0
由这个方程可以看出,当温度不变时,是一个关于V的 三次方程,其解有三种情况:
P
• 三个不等的实根。 • 三个相等的实根 • 一个实根,两个虚根
L
DH
V
• R-K Equation (1949年,Redlich and Kwong)
b 0.08664RTc Pc
a(T) a(Tc)(T) 0.42748R2Tc2 (T)
Pc
(T) 0.5 1 m'(1 Tr0.5)
m' 0.481.574 - 0.1752
R-K Eq经过修改后,应用范围扩宽。 SRK Eq:可用于两相PVT性质的计算,对烃类计算,其 精确度很高。
关于两常数(立方型)状态方程,除了我们介绍的 范德华、R-K、SRK Eq以外,还有许多方程,包括我们 讲义上的P-R Eq和P-T Eq
Tr1 =T1/TcH2
Pr1=P1/PcH2
对于N2
状态点记为2,P2 V2 T2
Tr2 =T2/TcN2
Pr2=P2/PcN2
当Tr1=Tr2 ,Pr1=Pr2 时,此时就称这两种流体处
化工热力学讲义-1-第二章-流体的p-V-T关系

状态方程是描述流体状态参数之间关系的数学表达式,对 于不同的流体和不同的条件,状态方程的形式也会有所不 同。常见的状态方程有理想气体状态方程、范德华方程、 维里方程等。
理想气体与实际气体差异
理想气体
理想气体是一种假设的流体模型,其分子间无相互作用力,分子本身无体积。理想气体的p-v-t关系符合 理想气体状态方程,因此在一些简单的计算和理论分析中,可以使用理想气体模型进行近似处理。
范德华方程的适用范围
范德华方程适用于中等压力、中等温度的气体,对于高压、低温或高温条件下的气体,其精度可能 有所下降。
范德华方程的参数
范德华方程中包含三个参数,分别是气体的摩尔体积、临界温度和临界压力,这些参数可以通过实 验测定得到。
维里方程
维里方程的形式和意义
维里方程是另一个用于描述真 实气体行为的状态方程,它通 过引入维里系数来考虑气体分 子间的相互作用力。
体积
体积是指流体所占据的空间大小,也是流体状态的重要参数之一。体积的大小与流体的密度 和数量有关,常用的体积单位有立方米(m³)、立方厘米(cm³)、升(L)等。
温度
温度是表示物体冷热程度的物理量,是流体状态的重要参数之一。在化工热力学中,常用的 温度单位有摄氏度(℃)、华氏度(℉)、开尔文度(K)等。
温度降低,气体分子的热运动减缓,分子间的相互作用力增强,实际气体与 理想气体的偏差增大,压缩因子增大。
膨胀系数及变化规律
80%
膨胀系数的定义
表示流体体积随温度或压力变化程 度的物理量。
100%
等压膨胀系数
在恒定压力下,流体体积随温度升 高而增大的程度。一般随温度升高 而增大。
80%
等温膨胀系数
在恒定温度下,流体体积随压力升 高而减小的程度。一般随压力升高 而减小。
理想气体与实际气体差异
理想气体
理想气体是一种假设的流体模型,其分子间无相互作用力,分子本身无体积。理想气体的p-v-t关系符合 理想气体状态方程,因此在一些简单的计算和理论分析中,可以使用理想气体模型进行近似处理。
范德华方程的适用范围
范德华方程适用于中等压力、中等温度的气体,对于高压、低温或高温条件下的气体,其精度可能 有所下降。
范德华方程的参数
范德华方程中包含三个参数,分别是气体的摩尔体积、临界温度和临界压力,这些参数可以通过实 验测定得到。
维里方程
维里方程的形式和意义
维里方程是另一个用于描述真 实气体行为的状态方程,它通 过引入维里系数来考虑气体分 子间的相互作用力。
体积
体积是指流体所占据的空间大小,也是流体状态的重要参数之一。体积的大小与流体的密度 和数量有关,常用的体积单位有立方米(m³)、立方厘米(cm³)、升(L)等。
温度
温度是表示物体冷热程度的物理量,是流体状态的重要参数之一。在化工热力学中,常用的 温度单位有摄氏度(℃)、华氏度(℉)、开尔文度(K)等。
温度降低,气体分子的热运动减缓,分子间的相互作用力增强,实际气体与 理想气体的偏差增大,压缩因子增大。
膨胀系数及变化规律
80%
膨胀系数的定义
表示流体体积随温度或压力变化程 度的物理量。
100%
等压膨胀系数
在恒定压力下,流体体积随温度升 高而增大的程度。一般随温度升高 而增大。
80%
等温膨胀系数
在恒定温度下,流体体积随压力升 高而减小的程度。一般随压力升高 而减小。
化工热力学讲义-1-第二章-流体的p-V-T关系

101 .33 48.99 51.66% 101 .33
②RK方程计算
RT a p 0.5 V b T V V b
求式中a、b: 查表得:
pC 3.394MPa,
TC 126.2K
0.42748 2TC2.5 0.42748 8.3142 126.2 2.5 R a 1.55766 6 pC 3.394 10
二、研究方法 热力学研究方法:分为宏观研究方法和微观研究方法。本书就工 程应用而言,主要介绍的是宏观研究方法。
宏观研究方法特点:
①将大量分子组成的体系视为一个整体,研究大量分子中发 生的平均变化,用宏观物理量来描述体系的状态; ②采取对大量宏观现象的直接观察与实验,总结出具有普遍性的 规律;
第二章 流体的P-V-T关系
RTC 27R 2TC2 a 最后: ,b 64 pC 8 pC
Van der Waals方程准确度不高,无很大实用价值,但建立方程的理论 和方法对以后立方型方程的发展产生了重大影响。目前工程上广泛采用 的立方型方程基本上都是从该方程衍生出来的。
二、Ridlich-Kwang方程(1949年) R-K方程形式如下:
结论:在高压低温下,理想气体状态方程误差很大,RK方 程亦有相当误差,SRK计算精确度较好。
2.2.1理想气体状态方程 状态方程如下:
PV RT
式中:V为摩尔体积 理想气体并不存在,它是极低压力和较高温度下各种真实气体的 极限情况,任何真实气体状态方程当 P 0 或者 V 时, 都应还原成理想气体状态方程。 不考虑分子大小、形状,以及相互之间作用力。
2.2.2立方型(两常数)状态方程 所谓立方型状态方程是因为方程可展开为体积(或密度)的三次多项式。 一、Van der Waals方程(1873年)
化工热力学-流体PVT关系

6
1
3
8
V
T
额外的思考题
在pVT相图上,固液共存区域……
理想气体pVT相图大概是什么样
2.2流体的状态方程式(EOS)
2.2流体的状态方程式(EOS)
2.2流体的状态方程式(EOS)
2.2.1理想气体EOS
低压工程 近似计算 极限状态 可以还原 没有数据 猜测初值
实用性
校验性
辅助性
2.2流体的状态方程式(EOS)
vdW
RK
SRK
G PR
2.2流体的状态方程式(EOS)
2.2.3立方型方程
vdW
RK
SRK
G PR
Redlich-Kwong 气相 × 液相 × 气液平衡
2.2流体的状态方程式(EOS)
2.2.3立方型方程
vdW
较RK方程的改良:
RK
SRK
G PR
大大提高纯物质气液平衡, 能用于混合物的气液平衡
2.2流体的状态方程式(EOS)
2.2.3立方型方程
vdW
较SRK方程的改良:
RK
SRK
PR
应用范围扩大,对于烃 类精确度很高。
2.2流体的状态方程式(EOS)
2.2.3立方型方程
2.2流体的状态方程式(EOS)
2.2.3立方型方程
例题,马本 P19 例题2-4
2.3对应态原理的应用
通过大量的实验发现,许多物质的气体当接 近临界点时,都显示出相似的性质,因而引 出了对比参数的概念。 Tr Pr Vr
2.2流体的状态方程式(EOS)
2.2.2 virial方程
2.2流体的状态方程式(EOS)
2.2流体的状态方程式(EOS)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
这些立方型状态方程中的参数基本上可用临界性质表示, 但也包括对温度和其他性质如压缩因子Z或偏心因子的修 正,这些方程的改进大都是经验的或者任意的。
近来一些统计力学理论已用于改进立方型状态方程。
四、液体
对于液体,虽然在理论上和关联方面已做了很多工作,但 了解仍然比气体少得多。
有一些经验关联式专门用于液体密度的计算,如 Hankinson 和Thomson提出的饱和液体密度计算关联式是 典型代表;
Ursell:1927年 维里方程的进一步理论发展; Mayer:1937年 维里方程的进一步理论发展
三、立方型状态方程
1873年van der Waals(范德华) 首次提出了能表达从气 态到液态连续性的状态方程 :
RT a pV bV2
对van der Walls方程作了很多改进,其中比较成功地改进 包括Redlich和Kwong改进的RK方程、Soave的进一步改进 (Soave方程,1972年),Peng和Robinson(1976年)
计算精度。 (2) 可以用于液体p V T 性质计算。如在饱和液体密度的计
算中更准确。
Peng-Robinson方程(简称PR方程)
方程形式: pV R TbVVba TbVb
方程参数:
a T a T 0 . 4 5 7 2 4 R 2 T c 2 /p c T
b0.07780RTc/pc
极低的压力下真实气体非常接近理想气体
许多实际物质的性质可以通过与理想气体的偏差,这 也是热力学研究的一个重要方法。如压缩因子Z,剩余 性质MR
此外,实际气体与理想气体之间的另一个重要差别是 它们的热行为。如
C i pg fT C p fT ,p
二、分子间作用力
分子的大小、形状和结构确定了它们之间的力和最终的 pVT行为。引力使分子结合在一起,斥力使分子分开。前者 在分子距离大时起作用,后者在近距离范围内有影响。 根据分子的电性质,分子可以分为三种: (1)电中性和对称性,通常为非极性分子 (2)电中性而非对称性,即具有偶极距,称为极性分子; (3)有剩余价,可产生缔合和氢键。 在所有分子中都存在斥力和引力,但在缔合和极性分子中, 它们以不寻常的形式出现。 目前pVT关系和方程最成功地描述非极性物质的行为,包括 重要的烃类。
或者 液相
Z
1
q
Z
Z Z
bp
RT
q aT
bRT
1,0 RK R,K S 1 2,1 2 PR
VbVbVb R a T b T pV p
或者 ZZZ 1q Z
多参数状态方程
多参数状态方程特点: (1)与简单的状态方程相比,多参数状态方程可以
在更宽的T、p范围内准确地描述不同物系的p-V-T 关系 (2)但方程形式复杂,计算难度和工作量都较大。 如BWR、BWRS、MH方程
(2)维里系数:从位能函数可以计算维里系数,特别是第 二维里系数;
(3)混合物:采用Prausinitz提出的临界参数及B、C的混合 规则
(4)二聚作用 pVT行为与理想性的负偏差,有时是因为分子的缔合引起的, 其中二聚作用是最为普遍的。
关于二聚等的非理想性见第二章
维里方程意义
(1) 高阶维里系数的缺乏限制了维里方程的使用范围。 (2) 但绝不能忽略维里方程的理论价值。
氢键
➢例如氟化氢 H F H F H - F
(T)1k(1Tr0.5)2
k 0 .3 7 4 6 1 .5 4 2 2 6 0 .2 6 9 9 2 2
a( T )=f (Tc,pc,T, ω)
方程使用情况:
(1)RK方程和RKS方程在计算临界压缩因子Zc和 液体密度时都会出现较大的偏差,PR方程弥补这一 明显的不足;
(2)它在计算饱和蒸气压、饱和液体密度等方面有 更好的准确度;
(2)方程利用统计力学分析分子间的作用力,具有坚实的理论基础 。
方程形式:
压力形式: ZpV1B pC p2D p3
R T
体积形式:
BC Z1VV2
D V3
密度形式: Z 1 B C 2 D 3
维里系数:B ( B ) C (C ) D ( D ) ……分别称为第二、第三、第四……维 里(virial)系数。
纯物质的p –V图
二、立方型状态方程的通用形式
方程形式 归纳立方型状态方程,可以将其表示为如下的形式:
方程参数: pVRTb(Vab()T (V)b)
参数ε和σ为纯数据,对, 所有的物质均相同;对于不同的方 程数据不同;
参数b是物质的参数,对于不同的状态方程会有不同的温度 函数。
立方型方程形式简单,方程中一般只有两个参数,参数可 用纯物质临界性质和偏心因子计算,有时也与温度有关。
b yibi
也可以:
a
y i y j a ij
b
y i y j bij
a ij 0.5 a i a j 1 C ij
bij 0.5 bi b j 1 D ij
Soave-Redlish-Kwang 方程(简称RKS方程)
使用情况和意义 (1) RKS方程提高了对极性物质及含有氢键物质的p –V –T
B bp RT
方程的计算过程
① 设初值Z(一般取Z=1); ② 将Z值代入式(2),计算h; ③ 将h值代入式(1)计算Z值; ④ 比较前后两次计算的Z值,若误差已达到允许范围,迭代结束;否则 返回步骤②再进行运算。 用图表示为:
Z 初 值 ( 一 般 1 ) 式 ( 2 ) h 式 ( 1 ) Z Z 1 - Z 0 Z = Z n p V T Yes No
一些复杂的方程,如PR方程、BWR方程、Harmens- Knapp方程,可作为较好的液体密度表达式。
特别值得推荐的是ASOG和UNIFAC方法,通过流体的分
子结构去预测液体的混合物行为。
基团贡献法
维里方程
基本概念: (1)“维里”(virial)这个词是从拉丁文演变而来的,它的原意是 “力”的意思。
nn1
意义:引入h后,使迭代过程简单,便于直接三次方程求解。但需要注意的是
该迭代方法不能用于饱和液相摩尔体积根的计算。
Z
(1)
Z(0)
h(0)
(2)
h
液体或者气体体积求解
针对液体或者气体体积可以写出了不同的迭代形式,分别 求出液体或者气体的体积。
汽相: V R p T ba p T V V b V b b
方程求解
立方型状态方程是一个关于V的三次方程,其等温线如下图,根据不同 的情况,其解有三种情况:
•T>Tc时,一个实根,两个虚根
•T=Tc时有三个相等的实根 •T<Tc时,有三个不等的实根。 •当p=ps时,最大的根为饱和气体 体积,最小的根为饱和液体体积。p 中间根无意义。
•当p≠ps时,只有一个根有意义,
式中,ω为偏心因子
R-K Eq中 a=f (Tc,pc) SRK Eq中 a( T )=f (Tc,pc,T, ω)
Tr 0.7
1.0 1.2 1.4 1.6 1.8
1 Tr
-1
lg
p
s r
-2
-3
1 2
Ar,Kr,Xe
非球形分子1
非球形分子2
四、RKS方程(混合规则)
一般:
a
yi yjaij
分子极性
极性:当一个键的电中心与其质量中心不重合时,就产生 偶极距。极性是以偶极距的大小来定义的。偶极距的单位 为Debye。
极性分子特点:极性分子与非极性分子相比,具有较大的 黏度和较高的沸点、熔点;极性分子还更能溶解于水。特 别重要的是极性分子表现出更大的超额热力学性质。
分子之间的作用力可以使用位能函数来描述。例如
(3)是工程相平衡计算中最常用的方程之一。
RK方程和RKS方程 的迭代形式
方程提出
若已知体系的温度T和压力p,要计算体积V,提出了便于
计算机迭代计算的方程形式。
方程形式: Z1 1hB A1 hh 1
方程参数:
h b B VZ
2
ap AR2T2.5
RK方 程
ap AR2T2
( RKS方 程 )
常用方程: ➢ van der Waals ➢ RK方程 ➢ RKS方程 ➢ PR方程
一、参数a和b的估算:
(1)从流体的p-V-T实验数据拟合得到
(2)利用
p V
T TC
0
2p
V
2
T TC
0
这些参数还用于许多性质计算,
如密度、蒸气压、逸度等。
因此,用这些数据拟合参数,
以适用于某些性质。
四、Soave-Redlish-Kwang 方程(简称RKS方程)
方程形式: pVRTbVaVTb
方程参数:a T a T 0 . 4 2 7 8 R 2 T c 2 /p c T
b0.08664R T c/pc
(T)1m(1Tr0.5)2
m 0 .4 8 0 1 .5 7 4 0 .1 7 62
流体的p –V -T关系
主要内容
流体pVT关系发展概况 维里方程 立方型状态方程 流体的非理想性 混合物的pVT行为 总结
流体的p –V –T关系的发展概况
一、理想气体
1662年 Boyle定律
pV常数
1834年 理想气体状态方程
pV RT
二、维里方程
Z1B pC p2 1V B V C 2 Onnes:1901年以一种经验的关系式开发出了维 里方程;
其他状态方程
还有一些对应状态原理的方法,如Pitzer压缩因子图、各 种普遍化状态方程、Lee-Kesler方程。及一些给予统计力 学的方程如微扰-硬球方程。
Lee-Kesler方程
近来一些统计力学理论已用于改进立方型状态方程。
四、液体
对于液体,虽然在理论上和关联方面已做了很多工作,但 了解仍然比气体少得多。
有一些经验关联式专门用于液体密度的计算,如 Hankinson 和Thomson提出的饱和液体密度计算关联式是 典型代表;
Ursell:1927年 维里方程的进一步理论发展; Mayer:1937年 维里方程的进一步理论发展
三、立方型状态方程
1873年van der Waals(范德华) 首次提出了能表达从气 态到液态连续性的状态方程 :
RT a pV bV2
对van der Walls方程作了很多改进,其中比较成功地改进 包括Redlich和Kwong改进的RK方程、Soave的进一步改进 (Soave方程,1972年),Peng和Robinson(1976年)
计算精度。 (2) 可以用于液体p V T 性质计算。如在饱和液体密度的计
算中更准确。
Peng-Robinson方程(简称PR方程)
方程形式: pV R TbVVba TbVb
方程参数:
a T a T 0 . 4 5 7 2 4 R 2 T c 2 /p c T
b0.07780RTc/pc
极低的压力下真实气体非常接近理想气体
许多实际物质的性质可以通过与理想气体的偏差,这 也是热力学研究的一个重要方法。如压缩因子Z,剩余 性质MR
此外,实际气体与理想气体之间的另一个重要差别是 它们的热行为。如
C i pg fT C p fT ,p
二、分子间作用力
分子的大小、形状和结构确定了它们之间的力和最终的 pVT行为。引力使分子结合在一起,斥力使分子分开。前者 在分子距离大时起作用,后者在近距离范围内有影响。 根据分子的电性质,分子可以分为三种: (1)电中性和对称性,通常为非极性分子 (2)电中性而非对称性,即具有偶极距,称为极性分子; (3)有剩余价,可产生缔合和氢键。 在所有分子中都存在斥力和引力,但在缔合和极性分子中, 它们以不寻常的形式出现。 目前pVT关系和方程最成功地描述非极性物质的行为,包括 重要的烃类。
或者 液相
Z
1
q
Z
Z Z
bp
RT
q aT
bRT
1,0 RK R,K S 1 2,1 2 PR
VbVbVb R a T b T pV p
或者 ZZZ 1q Z
多参数状态方程
多参数状态方程特点: (1)与简单的状态方程相比,多参数状态方程可以
在更宽的T、p范围内准确地描述不同物系的p-V-T 关系 (2)但方程形式复杂,计算难度和工作量都较大。 如BWR、BWRS、MH方程
(2)维里系数:从位能函数可以计算维里系数,特别是第 二维里系数;
(3)混合物:采用Prausinitz提出的临界参数及B、C的混合 规则
(4)二聚作用 pVT行为与理想性的负偏差,有时是因为分子的缔合引起的, 其中二聚作用是最为普遍的。
关于二聚等的非理想性见第二章
维里方程意义
(1) 高阶维里系数的缺乏限制了维里方程的使用范围。 (2) 但绝不能忽略维里方程的理论价值。
氢键
➢例如氟化氢 H F H F H - F
(T)1k(1Tr0.5)2
k 0 .3 7 4 6 1 .5 4 2 2 6 0 .2 6 9 9 2 2
a( T )=f (Tc,pc,T, ω)
方程使用情况:
(1)RK方程和RKS方程在计算临界压缩因子Zc和 液体密度时都会出现较大的偏差,PR方程弥补这一 明显的不足;
(2)它在计算饱和蒸气压、饱和液体密度等方面有 更好的准确度;
(2)方程利用统计力学分析分子间的作用力,具有坚实的理论基础 。
方程形式:
压力形式: ZpV1B pC p2D p3
R T
体积形式:
BC Z1VV2
D V3
密度形式: Z 1 B C 2 D 3
维里系数:B ( B ) C (C ) D ( D ) ……分别称为第二、第三、第四……维 里(virial)系数。
纯物质的p –V图
二、立方型状态方程的通用形式
方程形式 归纳立方型状态方程,可以将其表示为如下的形式:
方程参数: pVRTb(Vab()T (V)b)
参数ε和σ为纯数据,对, 所有的物质均相同;对于不同的方 程数据不同;
参数b是物质的参数,对于不同的状态方程会有不同的温度 函数。
立方型方程形式简单,方程中一般只有两个参数,参数可 用纯物质临界性质和偏心因子计算,有时也与温度有关。
b yibi
也可以:
a
y i y j a ij
b
y i y j bij
a ij 0.5 a i a j 1 C ij
bij 0.5 bi b j 1 D ij
Soave-Redlish-Kwang 方程(简称RKS方程)
使用情况和意义 (1) RKS方程提高了对极性物质及含有氢键物质的p –V –T
B bp RT
方程的计算过程
① 设初值Z(一般取Z=1); ② 将Z值代入式(2),计算h; ③ 将h值代入式(1)计算Z值; ④ 比较前后两次计算的Z值,若误差已达到允许范围,迭代结束;否则 返回步骤②再进行运算。 用图表示为:
Z 初 值 ( 一 般 1 ) 式 ( 2 ) h 式 ( 1 ) Z Z 1 - Z 0 Z = Z n p V T Yes No
一些复杂的方程,如PR方程、BWR方程、Harmens- Knapp方程,可作为较好的液体密度表达式。
特别值得推荐的是ASOG和UNIFAC方法,通过流体的分
子结构去预测液体的混合物行为。
基团贡献法
维里方程
基本概念: (1)“维里”(virial)这个词是从拉丁文演变而来的,它的原意是 “力”的意思。
nn1
意义:引入h后,使迭代过程简单,便于直接三次方程求解。但需要注意的是
该迭代方法不能用于饱和液相摩尔体积根的计算。
Z
(1)
Z(0)
h(0)
(2)
h
液体或者气体体积求解
针对液体或者气体体积可以写出了不同的迭代形式,分别 求出液体或者气体的体积。
汽相: V R p T ba p T V V b V b b
方程求解
立方型状态方程是一个关于V的三次方程,其等温线如下图,根据不同 的情况,其解有三种情况:
•T>Tc时,一个实根,两个虚根
•T=Tc时有三个相等的实根 •T<Tc时,有三个不等的实根。 •当p=ps时,最大的根为饱和气体 体积,最小的根为饱和液体体积。p 中间根无意义。
•当p≠ps时,只有一个根有意义,
式中,ω为偏心因子
R-K Eq中 a=f (Tc,pc) SRK Eq中 a( T )=f (Tc,pc,T, ω)
Tr 0.7
1.0 1.2 1.4 1.6 1.8
1 Tr
-1
lg
p
s r
-2
-3
1 2
Ar,Kr,Xe
非球形分子1
非球形分子2
四、RKS方程(混合规则)
一般:
a
yi yjaij
分子极性
极性:当一个键的电中心与其质量中心不重合时,就产生 偶极距。极性是以偶极距的大小来定义的。偶极距的单位 为Debye。
极性分子特点:极性分子与非极性分子相比,具有较大的 黏度和较高的沸点、熔点;极性分子还更能溶解于水。特 别重要的是极性分子表现出更大的超额热力学性质。
分子之间的作用力可以使用位能函数来描述。例如
(3)是工程相平衡计算中最常用的方程之一。
RK方程和RKS方程 的迭代形式
方程提出
若已知体系的温度T和压力p,要计算体积V,提出了便于
计算机迭代计算的方程形式。
方程形式: Z1 1hB A1 hh 1
方程参数:
h b B VZ
2
ap AR2T2.5
RK方 程
ap AR2T2
( RKS方 程 )
常用方程: ➢ van der Waals ➢ RK方程 ➢ RKS方程 ➢ PR方程
一、参数a和b的估算:
(1)从流体的p-V-T实验数据拟合得到
(2)利用
p V
T TC
0
2p
V
2
T TC
0
这些参数还用于许多性质计算,
如密度、蒸气压、逸度等。
因此,用这些数据拟合参数,
以适用于某些性质。
四、Soave-Redlish-Kwang 方程(简称RKS方程)
方程形式: pVRTbVaVTb
方程参数:a T a T 0 . 4 2 7 8 R 2 T c 2 /p c T
b0.08664R T c/pc
(T)1m(1Tr0.5)2
m 0 .4 8 0 1 .5 7 4 0 .1 7 62
流体的p –V -T关系
主要内容
流体pVT关系发展概况 维里方程 立方型状态方程 流体的非理想性 混合物的pVT行为 总结
流体的p –V –T关系的发展概况
一、理想气体
1662年 Boyle定律
pV常数
1834年 理想气体状态方程
pV RT
二、维里方程
Z1B pC p2 1V B V C 2 Onnes:1901年以一种经验的关系式开发出了维 里方程;
其他状态方程
还有一些对应状态原理的方法,如Pitzer压缩因子图、各 种普遍化状态方程、Lee-Kesler方程。及一些给予统计力 学的方程如微扰-硬球方程。
Lee-Kesler方程
