钝化金属有哪些
什么是钝化

什么是钝化钝化是一种化学表面处理过程,通过在金属表面形成一层保护性的氧化膜,减少金属与环境中的化学反应,从而提高金属的耐腐蚀性能。
钝化的原理是将金属与一种氧化剂接触,在一定条件下形成一层氧化膜,这层氧化膜能够保护金属不被腐蚀。
钝化的过程可以通过多种方法实现,常见的方法包括酸洗钝化、电化学钝化和热处理钝化。
酸洗钝化是将金属浸入一种酸溶液中,利用酸的腐蚀性将金属表面的杂质去除,然后通过控制酸洗过程中的时间和温度,形成一层致密的氧化膜。
电化学钝化是将金属制件作为阳极,将其浸入含有一定浓度的酸性或碱性电解液中,通过外加电压的作用,在阳极表面形成一层氧化膜。
热处理钝化是在一定温度下将金属加热,使其与空气中的氧发生反应,形成一层氧化膜。
钝化能够有效地提高金属的抗腐蚀性能,延长其使用寿命。
在大气环境中,钝化层能够阻止空气中的氧、水蒸气等物质进一步腐蚀金属。
在酸性或碱性环境中,钝化层能够阻止酸碱物质与金属发生反应。
钝化还可以改善金属的表面性能,如摩擦性能、耐磨性能等。
不同金属钝化的方法和效果也有所不同。
常见的钝化金属包括不锈钢、铝、镀锌钢等。
不锈钢的钝化是指在不锈钢表面形成一层致密的铬氧化物膜,这种氧化膜具有很好的耐腐蚀性能。
铝的钝化是指在铝表面形成一层氧化膜,这种氧化膜能够阻止铝与空气中的氧发生反应。
镀锌钢的钝化是指在锌表面形成一层锌氧化物膜,这种氧化膜能够提高锌的抗腐蚀性能。
钝化在工业生产中广泛应用。
例如,在汽车行业,钝化可以提高部件的耐腐蚀性能,延长汽车的使用寿命。
在航空航天领域,钝化可以保护飞机的金属结构不受腐蚀影响,提高其安全性。
在建筑领域,钝化可以保护钢结构不受大气环境的腐蚀,延长建筑物的寿命。
然而,钝化也存在一些问题。
首先,钝化过程中使用的酸碱溶液会产生废液,对环境造成污染。
其次,钝化膜的厚度会影响金属的力学性能,过厚的钝化膜可能导致金属强度减小。
此外,钝化只能保护金属表面,对于金属内部的腐蚀不起作用。
研究生-第五章 金属的钝化

cp , p , F tp , b , icp
钝态越稳定
11
5.3 影响钝化的因素
二、阴极过程对钝化的影响
阴极反应对实测钝化曲线的影响 1. 氧化剂的氧化性弱 不锈钢+H2SO4(无O2)
2. 氧化剂较弱
不锈钢+H2SO4(含O2) 3. 中等强度氧化剂 中等浓度的HNO3 4. 氧化剂过强或介质中含活性离子 发烟HNO3 思考:自钝化体系是哪一种?
实验测定:环状阳极极化曲线
测定过程:
19
5.4 钝化曲线上的三个重要参数
讨论:利用b和 pp判断 体系是否发生点蚀
pp
金属不发生点蚀 原有小孔继续发展 ,但不产生新蚀点 金属表面出现新蚀点
pp b
b
20
5.4 钝化曲线上的三个重要参数
b和 pp:反映金属耐点蚀或缝隙腐蚀特征电位 b:反映钝化膜破坏难易 ,评价膜的保护性、稳定性
3. CD区:稳定钝化区
金属表面生成稳定钝化保护膜
2M 3H 2O M 2O3 6H 6e
p : 维钝电位
i p : 维钝电流密度
4. DE区:过钝化区
M 2O3 4H 2O M 2O7 2 8H 6e
或:
4OH O2 2 H 2O 4e
4
5.1 钝化作用
两种钝化的本质: 一致
钝化特征: (1)金属发生钝化时,电极电位正移 (2)钝化时,只是金属表面状态发生变化,整体性质不变 (3)钝化发生后,腐蚀速度出现大幅度降低 研究钝化现象的意义: 利用钝化现象控制金属的腐蚀 Ex: 钢铁表面钝化处理、冶炼时加入易钝化合金元素 有时要避免钝化的出现 Ex: 化学电源
浓硝酸钝化的金属

浓硝酸钝化的金属
浓硝酸钝化,也称为硝酸钝化,是一种能够改善金属表面性能的化学处理方法。
在浓硝酸中,金属表面会形成一层致密的氧化物膜,称为钝化膜。
这种膜能够有效的
防止金属表面进一步氧化,从而起到防腐、防锈的作用。
硝酸钝化可应用于各种金属材料,包括钢、铜、铝、镁等。
钢件经过硝酸钝化处理后,表面形成的氧化膜可以提高其耐蚀性、耐磨性、耐热性和防腐性。
钢件经硝酸钝化处理后,还可以提高其涂层的附着性和抗剥落性。
铜件经硝酸钝化处理后,获得了更好的導熱、導電、耐久性和美观外观。
铝件经硝酸钝化处理后,能提高其附着性、耐擦洗性和耐腐蚀
性。
硝酸钝化的方法一般包括浸泡法和喷涂法两种:
1. 浸泡法:将金属件完全浸入浓硝酸中,经过一定的时间,金属表面会形成一层钝
化膜。
浸泡时间、温度和硝酸浓度是影响钝化效果的重要因素。
2. 喷涂法:将硝酸溶液喷涂在金属件表面上,形成钝化膜。
喷涂法比浸泡法更加灵活,可以对特定部位进行钝化处理。
需要注意的是,浓硝酸是一种剧毒、强腐蚀性的化学品,钝化过程中应严格遵守安全
操作规程,注意个人防护措施。
第四章钝化

Fe、Ni、Cr、Mo、Al等在稀硫酸中均可发 生因阳极极化引起的钝化
钝化的定义
钝化就是指热力学不稳定的金属或合金由于阳极过 程受阻而引起金属腐蚀速度下降的现象。(或由于 阳极过程受阻而引起金属耐蚀性提高的现象。) 钝化是金属表面状态的突变,金属的本质没有变化 金属钝化后所处的状态称作钝态(Passive State) ,而 钝态金属所具有的性质称之为钝性。
EF与致钝电位EPP的关系: 二者很接近,但并不相同。两者之间可相差百分 之几伏,所以有时可把EPP近似地看作EF 因为: ①EF是钝化膜活化的电位,而EPP是产生钝化的电位; ②EF是在断电后测得的,而EPP是在通电下测得的,故 包含有钝化膜的电阻降和膜孔隙中溶液的浓度极化。
2)破裂电位Eb、保护电位EP及亚稳孔出现电位Em
过钝化区:金属 高价离子溶解, 钝化膜破坏,及 析氧反应 钝化区:形成钝化 膜电位维持在钝化 区可保护金属—— 电化学阳极保护
活化区:阳极金属 溶解(低价离子)
E Etp
•四个特性区 • 四个特性区 • 四个特性电位: • 四个特性电位 过钝化区 E0、 Epp、Ep、Etp • 两个特性电流:
4.2金属钝化的特性曲线
图4-3 可钝化金属的典型阳极极化曲线
A~B区:活性溶解区。金 属处于活性溶解状态,按 正常的阳极溶解规律溶 解,溶解速度受活化极化 控制。金属以低价的形式 溶解为水化离子。 M → Mn+ + ne E↑,i↑,基本服从Tafel规 律。 对于铁来说,即为: Fe → Fe2+ + 2e
C点:对应的电位称E维;电流i维 D点:过钝化电位Etp
D~E区:过钝化区 (Transpassive Potential) 。 电流再次随电极电位的升高而 增加,这是由于氧化膜进一步 氧化生成更高价的可溶性氧化 物。钝化膜被破坏,腐蚀重新 加剧。 E↑ , i ↑ M203+4H20→M20-7+8H++6e 如不锈钢中的六价铬离子的形 成即属此情况,它是由于钝化 膜被破坏,因而使金属的溶解 速度上升。
金属的钝化

金属的钝化有的金属(或合金)由于受某些氧化剂作用后其表面状况发生了改变,使金属(或合金)的化学活动性大大降低,耐腐蚀性大大增强,这种现象称为金属的钝化。
例如:Fe可与稀HNO3反应而溶解,但是,如果把Fe浸在密度大于1.25 g/cm3的浓HNO3中,铁却钝化而不溶。
Fe在浓HNO3中钝化后,不仅在稀HNO3中也不能再溶解,而且不能从铜盐(如CuSO4)溶液中置换出铜。
不仅铁,其它多种金属也可以发生钝化。
例如:Cr、Ni、Co、Mo、Al、Ta、Nb和W 等,其中最易钝化的金属是Cr、Mo、Al、Ni。
不仅硝酸,其它强氧化剂如浓H2SO4、氯酸、碘酸、重铬酸钾、高锰酸钾等,都可以使某些金属钝化,甚至空气中的氧气也能使有的金属(如Al、Cr等)钝化。
有许多因素能破坏钝化状态,或者阻止金属钝态生成。
将溶液加热或加入活性离子如Cl—、Br—、I—等和还原性气体如H2(特别在加热时)都能使钝态金属活化。
为什么金属会发生钝化现象?现在大多认为金属的钝化是由于金属跟介质作用而生成了一层极薄的肉眼看不见的保护膜的结果。
这层薄膜最经常的是金属的氧化物。
如铁与浓HNO3作用,铁表面被氧化成结构较复杂,组成为Fe8O11的氧化物。
这层氧化膜厚度是30×10-10~40×10-10m ,化学性质很不活泼,将Fe表面和介质完全隔绝,从而使铁处于钝态。
某些金属的钝化也可由阳极氧化来实现。
阳极氧化是将金属制件作阳极利用电解法使其表面上形成氧化物薄膜的过程。
像Al、Mg、Cu、钢等制件都可用此法钝化。
为了提高某些金属的抗蚀性能(有时同时增加美观),可采用化学方法或阳极氧化方法,使金属钝化。
金属的钝化在机械制造,仪器制造、武器、飞机及某些金属日常用品的制造中,以在某些金属制件表面生成防锈层或同时还有装饰性的覆盖层而广泛地被采用。
选自《中学生化学报》作者:阿元林、梁冬梅。
金属钝化
金属的钝化在现代工业生产中,我们常常会遇到金属钝化现象。
一些较活泼的金属,在某些特定的环境介质中,会呈现惰性状态。
如金属的电极电位因外加阳极电流或局部阳极电流而向正方向移动,当超过一定数值后,金属的溶解速度反而剧烈地减小了,铁和不锈钢在硫酸中进行阳极极化时便观察到此现象。
金属阳极溶解过程中的这种“反常”现象称为金属的钝化过程。
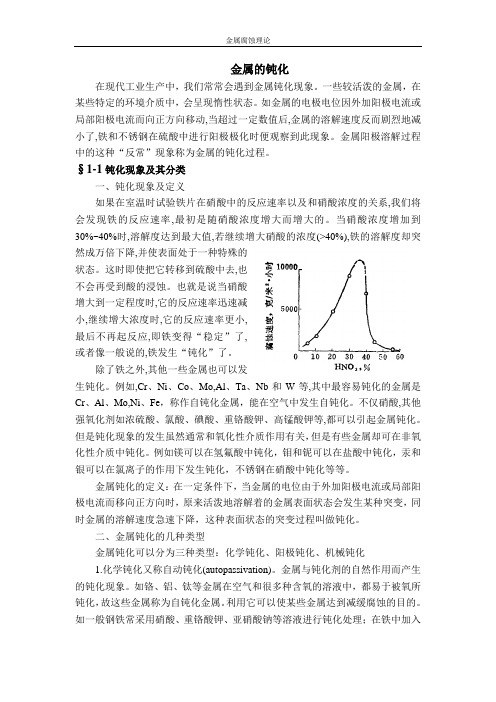
§1-1钝化现象及其分类一、钝化现象及定义如果在室温时试验铁片在硝酸中的反应速率以及和硝酸浓度的关系,我们将会发现铁的反应速率,最初是随硝酸浓度增大而增大的。
当硝酸浓度增加到30%~40%时,溶解度达到最大值,若继续增大硝酸的浓度(>40%),铁的溶解度却突然成万倍下降,并使表面处于一种特殊的状态。
这时即使把它转移到硫酸中去,也不会再受到酸的浸蚀。
也就是说当硝酸增大到一定程度时,它的反应速率迅速减小,继续增大浓度时,它的反应速率更小,最后不再起反应,即铁变得“稳定”了,或者像一般说的,铁发生“钝化”了。
除了铁之外,其他一些金属也可以发生钝化。
例如,Cr、Ni、Co、Mo,Al、Ta、Nb和W等,其中最容易钝化的金属是Cr、Al、Mo,Ni、Fe,称作自钝化金属,能在空气中发生自钝化。
不仅硝酸,其他强氧化剂如浓硫酸、氯酸、碘酸、重铬酸钾、高锰酸钾等,都可以引起金属钝化。
但是钝化现象的发生虽然通常和氧化性介质作用有关,但是有些金属却可在非氧化性介质中钝化。
例如镁可以在氢氟酸中钝化,钼和铌可以在盐酸中钝化,汞和银可以在氯离子的作用下发生钝化,不锈钢在硝酸中钝化等等。
金属钝化的定义:在一定条件下,当金属的电位由于外加阳极电流或局部阳极电流而移向正方向时,原来活泼地溶解着的金属表面状态会发生某种突变,同时金属的溶解速度急速下降,这种表面状态的突变过程叫做钝化。
二、金属钝化的几种类型金属钝化可以分为三种类型:化学钝化、阳极钝化、机械钝化1.化学钝化又称自动钝化(autopassivation)。
第5章金属的钝化

第5章金属的钝化铁、铝等金属在稀HNO3或稀H2SO4中能很快腐蚀,但是在浓HNO3或浓H2SO4中腐蚀现象几乎完全停止。
1836年斯柯比(Schobein)称金属在浓HNO3或浓H2SO4中获得的耐蚀状态为钝态。
从此,人们对金属的钝化进行了广泛的研究。
现今钝化在控制金属腐蚀和提高金属材料的耐蚀性方面占有十分重要的地位。
经钝化的铁重新放入稀HNO3中也不会再溶解,因为铁处于钝态。
金属或合金受一些因素影响,化学稳定性明显增强的现象,称为金属的钝化(Passivation of metals)。
由某些钝化剂(氧化剂)所引起的金属钝化,称为化学钝化。
如浓HNO3、浓H2SO4、HClO3、K2Cr2O7、KMnO4和O2等氧化剂都可使金属钝化。
此外,用电化学方法也可使金属钝化,如将铁置于H2SO4溶液中作为阳极,用外加的直流电使铁的电位升高到一定数值(即阳极极化),也能使铁的表面生成钝化膜。
由阳极极化引起的金属钝化现象,叫电化学钝化或阳极钝化。
研究钝化现象有很大的实际意义。
金属处于钝化状态能显著降低金属的自溶解和阳极溶解速度,保护金属防止腐蚀,但有时为了保证金属能正常参与反应而溶解,又必须防止钝化,如化学电源中电极的钝化常常带来有害的后果,使最大输出电流密度以及活性物质的利用率降低。
所以,长期以来,对钝化现象的研究受到很大的重视。
5.1 金属的钝化现象5.1.1 金属钝化的两种方式—化学钝化与电化学钝化1.化学钝化如果把一块铁片放在HNO3中,并考察铁片的溶解速度与HNO3浓度的关系(如图5.1所示),可以发现铁在稀硝酸中剧烈地溶解,并且铁的溶解速度随着HNO3浓度的增大而迅速增大。
当HNO3的浓度增加到30~40%时,铁的腐蚀速度达到最大值,若继续增加HNO3浓度超过40%,则铁的溶解速度就突然下降到原来的的1/4000,这一现象称为钝化。
如果继续增大HNO3浓度到90%以上,腐蚀速度又有较快的上升(在95%HNO3中铁的腐蚀速度约为90%HNO3中的10倍),这一现象称为过钝化。
第 4 章 金属的钝化

金 Cr、Al、Ti等金属在空气中和许多氧化性的溶液中都易被钝化,
称之为“自钝化”金属
中国民航大学 理学院 2012-6-15 6
2. 电化学钝化:采用外加阳极电 流的方法,使金属由活化状态 转变为钝化状态
不含Cl-的电解质溶液中,阳极极
阴、阳极极化曲线有一个交点
E
交点位于钝化区
金属在该介质中自动进入钝态
Ep 极极化曲线交于过钝化区 钝化膜被溶解
ip
ipp
i
钝化金属在氧化能力不同的 介质中的钝化行为
中国民航大学 理学院 2012-6-15 21
成相膜理论
◦ 理论要点:金属与介质作用,在金属表面生成一层固态产 物独立相(成相膜)。成相膜非常薄,但是结构致密(孔 隙率小)、覆盖度良好,把金属与溶解机械地隔开,使溶 解速度大大降低。腐蚀体系能形成固态产物是钝化的先决 条件。 ◦ 实验证据:某些金属上能观察到膜的存在,并已测定了某 些钝态有实际意义的金属表面膜的厚度和组成。
中国民航大学 理学院
2012-6-15
16
自钝化体系:不依靠外加阳极极化金属就能自动进 入钝化状态的腐蚀体系(金属材料+环境)
◦ 自钝化是可贵的性质
◦ 是腐蚀介质中氧化剂的还原促进金属钝化 ◦ 自钝化与金属的本性有关,还与氧化剂的性质和浓度有关
中国民航大学 理学院
2012-6-15
17
自钝化的必要条件
Fe在浓硝酸的钝化膜厚度约为2.5~3.0nm,碳钢约为 9~10nm,不锈钢的最薄,但最致密,保护性最好 Al在空气中氧化生成的钝化膜厚度约为2~3nm
6金属的钝化

电流密度i(mA/cm2) 800
600
B
400
钝化体系的阳极极化曲线
(Fe在10% H2SO4中)
A~D,电位增加 腐蚀速度减小
E
200
A
-250
0 +250
| 1|
+500 2
C
+750 |3|
D
+1000 +1250 +1500 +1750 +2000 电位(mv)
4
|
5
|
钝化体系的极化曲线
(4)交点在过钝化区
当去极化剂是特别强的氧化剂时,在自然腐
蚀状态金属发生过钝化。
返回
6.2实现自钝化的途径
自钝化条件:
E+>Ep;
≥ (ic)Ep ip
影响阳极极化曲线
E
ia
●
Ep
|ic|
lgi
ip (ic)Ep
使真实阳极极化曲线向左、向下移动。
(1)提高金属材料的钝化性能。
(2)加入阳极性缓蚀剂,抑制阳极反应,使ip降低。
B
i致 i
阳极保护
用阳极钝化方法达到减小金属腐蚀的目的,这
种防护技术叫做阳极保护。 阳极保护的适用条件是:
(1)具有活态—钝态转变。 (2)阳极极化时必须使金属的电位正移到稳定
钝化区内。
★阳极保护是危险性保护
钝化体系的类型
腐蚀体系的稳定状态取决于真实阴极 极化曲线和真实阳极极化曲线的交点。根 据交点位置不同,体系可有四种类型。
第六章 金属的钝化
钝化现象
• 研究钝化现象的意义 • 钝化现象的实验规律 • 金属钝化的定义
钝化体系的极化曲线
金属钝化

2、机械应力引起钝化膜的破坏
(1)膜本身的介电性质 如:高场强诱发产生的电致伸缩作用 ;
(2)机械性质 如:膜的内应力 、机械碰撞 。
六、过钝化
金属在强的氧化介质中或者电位明显 提高(增大)时,保护膜(钝化膜)转变 成为易溶解而无保护性的高价氧化物,又 发生腐蚀溶解的现象被称为过钝化。 低电位区活性溶解时,以低价转入溶液:
Fe—Fe2++2e E=-0.44伏 Cr-Cr3++ 3e E=-0.74伏
电位升高,阳极表面形成不溶性的Fe3O4 Cr2O3 + 4H2O — Cr2O72— 十 8H 十 6e Fe3O4十8H+一 3Fe3+十4H2O十e
可变价的金属,易于过钝化溶解 ;低价 的氧化物比高价氧化物相对稳定,一般高价 氧化物容易溶解。
2OH一十Me——Me O十H2O十2e 2OH一十Me——Me(HO)2十2e
Fe3O4十8H+一 3Fe3+十4H2O十e Fe 2+——Fe 3+
Fe—Fe2++2e
典型金属阳极极化曲线
三、钝化理论
金属由活性状态变为钝态是一个很复杂的 过程;至今尚未形成一个完整的理论,目前比 较能被大家所接受理论是成相膜理论和吸附膜 理论。
1、当Cl—与其他阴离子共存时,Cl—在许多 阴离子竞相吸附过程中能被优先吸附,使 组成膜的氧化物变成可溶性盐;
2、吸附的Cl离子进入晶格代替膜中水分子、 OH一或O2-,并占据了它们的位置。
3、吸附Cl—以后,由于负电荷的场作用, 将影响电极反应的活化能,可以加速金属 的阳极溶解。
阴离子浓度和电位对金属表面状态的影响
※成相膜理论认为:金属在溶解过程中,表面 上生成一层致密的、覆盖性良好的固体产物。 这些反应产物可视为独立的相(成相膜),它 把金属表面和溶液机械的隔离开来,使金属的 溶解速度降低,即转变成不溶解的纯态。
浓硫酸中钝化的金属

浓硫酸中钝化的金属浓硫酸是一种常见的有害化学物质,具有强酸性和腐蚀性。
因此,许多金属在浓硫酸中容易被钝化,即形成一层氧化物或硫酸盐的保护层,从而降低了金属的反应性和腐蚀性。
钝化处理可以提高金属的耐蚀性和使用寿命,被广泛应用于各个领域。
其中,不锈钢是一种常见的钝化金属。
不锈钢由铁、铬、镍等元素组成,其中的铬元素起着关键的钝化作用。
当不锈钢与浓硫酸接触时,铬元素会与硫酸反应生成一层致密的氧化铬(passivation)层,阻止硫酸对金属的进一步腐蚀。
这层致密的氧化铬层可以保护不锈钢不受浓硫酸的侵蚀,延长其使用寿命。
铝也是一种常见的被浓硫酸钝化的金属。
铝与浓硫酸反应时,会生成一层致密的氧化铝层,阻止硫酸对铝的腐蚀。
这层氧化铝层具有很好的耐蚀性和耐热性,使得铝在浓硫酸环境下具有较好的稳定性。
除了不锈钢和铝,镍、钛、锌等金属也可以通过浓硫酸钝化来提高其耐蚀性。
这些金属在浓硫酸中会形成致密的氧化物或硫酸盐层,从而降低了其与浓硫酸的反应性。
钝化处理后的金属在浓硫酸环境中能够更好地保持其原有性能,延长使用寿命。
钝化金属的方法有多种,常见的方法包括化学钝化和电化学钝化。
化学钝化是在浓硫酸中加入一些特定的化学物质,使金属表面生成致密的氧化层或硫酸盐层。
电化学钝化则是利用电流在浓硫酸中对金属进行钝化处理,使金属表面形成致密的氧化层或硫酸盐层。
这些钝化方法在工业生产中得到了广泛应用,能够提高金属的防腐蚀性能。
总的来说,浓硫酸中钝化的金属在工业生产和实验室中扮演着重要的角色。
通过钝化处理,金属的耐蚀性和使用寿命得到了显著提高,从而减少了设备的维护和更换成本。
钝化金属的方法多种多样,可以根据具体需求选择适合的钝化方法。
在实际应用中,还需要注意钝化处理的工艺参数和环境条件,以确保钝化效果的稳定性和可靠性。
浓硫酸中钝化的金属具有重要的应用价值和意义。
钝化处理可以提高金属的耐蚀性和使用寿命,被广泛应用于各个领域。
通过选择适当的钝化方法和优化钝化工艺,可以更好地保护金属免受浓硫酸的侵蚀,延长其使用寿命,提高生产效率和安全性。
重金属钝化技术

重金属钝化技术1. 引言重金属是指密度大于5克/立方厘米的金属元素,包括铅、汞、铬、镉等。
这些重金属在自然界中广泛存在,但高浓度的重金属对环境和人体健康都具有严重的危害。
为了减少重金属的毒性和生态风险,重金属钝化技术逐渐应用于工业制造和环境保护领域。
本文将详细介绍重金属钝化技术的原理、应用、优势和发展趋势。
2. 重金属钝化技术原理重金属钝化技术是通过改变金属表面的化学性质,形成稳定的钝化膜来降低重金属的反应活性和溶解度,从而减少对环境和人体的危害。
钝化膜可以通过以下几种方式形成:2.1. 化学钝化化学钝化是在金属表面形成一层化学活性较低的氧化膜,常见的方法有酸洗、阳极氧化和化学沉积。
其中,酸洗是最常用的方法,通过将金属浸入酸性溶液中,使金属表面与溶液中的氧化物发生反应,生成稳定的氧化膜。
2.2. 电化学钝化电化学钝化是利用外加电场使金属表面发生氧化还原反应,形成致密的氧化膜。
常见的方法有阳极极化和阳极保护。
阳极极化是通过将金属作为阳极,在电解液中施加电压,使金属表面发生氧化反应,形成氧化膜。
阳极保护是在金属表面涂覆一层具有良好保护性能的保护剂,保护剂能提供额外的电子,使金属表面形成稳定的氧化膜。
2.3. 蒸镀钝化蒸镀钝化是一种将其他金属或合金物质覆盖在金属表面,形成钝化膜的方法。
常见的蒸镀钝化方法有镀锌、镀铝、镀铬等,这些材料能够有效地阻隔重金属与环境的接触,减少金属的溶解和反应。
3. 重金属钝化技术应用重金属钝化技术在工业制造和环境保护领域具有广泛的应用,主要应用于以下几个方面:3.1. 金属制造在金属制造过程中,重金属钝化技术可以提高金属的耐腐蚀性能,延长金属的使用寿命。
例如,将钢材进行镀锌处理可以防止钢材锈蚀,提高钢材的耐腐蚀性能和机械强度;将铝材进行阳极氧化处理可以增加铝材的硬度和耐磨性。
3.2. 电子行业在电子行业中,重金属钝化技术可以提高电子元件的稳定性和可靠性。
例如,通过化学钝化处理可以降低电子元件表面的电阻和导电损耗,提高元件的电气性能;通过电化学钝化处理可以增加电子元件的耐热性,抑制介电损耗。
铜及铜合金的钝化

铜及铜合金的钝化一、引言铜及铜合金在我国工业领域中具有广泛的应用,如电气、电子、化工、航空等领域。
铜及铜合金具有良好的导电、导热、耐腐蚀等性能,然而在某些环境下,铜及铜合金表面易发生钝化现象。
本文将对铜及铜合金的钝化现象进行详细探讨,分析其机理及应用,以期为铜及铜合金的防护提供理论依据。
二、铜及铜合金的钝化现象1.钝化定义钝化是指金属表面在特定环境条件下,由活泼状态转变为稳定状态的过程。
铜及铜合金在接触大气、水、酸碱等介质时,其表面可能发生化学反应,形成一层致密的氧化膜,这种现象称为钝化。
2.钝化机理铜及铜合金钝化的机理主要包括以下几个方面:(1)金属表面氧化:在特定环境下,铜及铜合金表面与氧气、水分子等发生反应,形成氧化物或氢氧化物。
(2)氧化膜生长:氧化物或氢氧化物不断在金属表面沉积,形成一层致密的氧化膜。
(3)氧化膜保护:氧化膜能够阻止内部金属继续与外部介质发生反应,使金属表面处于稳定状态。
三、铜及铜合金钝化的影响因素1.合金成分铜合金中不同元素的含量对钝化性能有显著影响。
例如,铜锌合金(黄铜)在锌含量较高时,容易发生钝化。
2.环境条件环境中的氧气、水分、酸碱度等条件对铜及铜合金的钝化有重要影响。
在潮湿空气中,铜及铜合金容易发生钝化;而在干燥空气中,钝化速度较慢。
3.表面处理铜及铜合金表面处理方式对其钝化性能也有很大影响。
如抛光、喷涂等表面处理方法可以提高铜及铜合金的钝化性能。
四、铜及铜合金钝化的应用1.防腐蚀领域铜及铜合金在腐蚀环境下,通过钝化处理,可以延长其使用寿命,提高防腐蚀性能。
如在海洋工程、化工设备等领域,采用钝化处理的铜及铜合金材料能够抵抗海水、酸碱等介质的腐蚀。
2.电子元器件领域铜及铜合金在电子元器件中具有广泛应用,如散热器、连接器等。
通过钝化处理,可以提高铜及铜合金表面的导电、导热性能,降低接触电阻,延长元器件使用寿命。
3.建筑装饰领域铜及铜合金在建筑装饰行业中具有较高价值,如铜门、铜窗、铜装饰品等。
金属的钝化

二、吸附理论
主要观点
钝化是由于金属表面或部分表面生成一层氧或
含氧粒子的吸附层
Ex: 氧原子、OH-、O-
谢谢
特殊的阳极过程
1. AB区:金属活性溶解区
金属按正常的溶解规律溶解
2. BC区:活化-钝化过渡区
表面生成过渡性氧化物
3. CD区:稳定钝化区
金属表面生成稳定钝化保护膜
4. DE区:过钝化区
各区及各特征点含义
5. 2 钝化理论
一、成相膜理论
主要观点:
钝化是由于金属表面生成了致密、覆盖性良好的钝化膜
钝化剂:能使金属发生钝化的物质
Ex : 浓HNO3 、K2 Cr2 O 7、KMnO 4、O 2等
自钝化金属:易被空气中或溶液中O2化的金属Ex : Cr、Al、Ti
2. 电化学钝化(阳极钝化)
外加阳极电流使金属阳极极化而钝化
Ex:18-8S-S在30%硫酸中会剧烈溶解,若使之阳极极
化至阳极电位为 -0.1V(SCE)后,不锈钢的溶解速度
降至原来的几万分之一,且在 :-0.1-+1.2V之间保
持不变。
两种钝化的本质: 一致
钝化特征:
(1)金属发生钝化时,电极电位正移
(2)钝化时,只是金属表面状态发生变化,整体
性质不变
(3)钝化发生后,腐蚀速度出现大幅度降低
研究钝化现象的意义:
利用钝化现象控制金属的腐蚀
5. 2 阳极钝化曲线
金属的钝化
主要内容
钝化方法、钝化理论、阳极钝化曲
线、
阳极保护方法及阳极保护原理、主要
控制参数、使用范围
5.1 钝化现象
一、钝化定义
举例:铁+硝酸(不同浓度)
哪些金属会钝化【大全】

中学化学中一般铁和铝我们知道,铁、铝在稀HNO3或稀H2SO4中能很快溶解,但在浓HNO3或浓H2SO4中溶解现象几乎完全停止了,碳钢通常很容易生锈,若在钢中加入适量的Ni、Cr,就成为不锈钢了。
金属或合金受一些因素影响,化学稳定性明显增强的现象,称为钝化。
由某些钝化剂(化学药品)所引起的金属钝化现象,称为化学钝化。
如浓HNO3、浓H2SO4、HClO3、K2Cr2O7、KMnO4等氧化剂都可使金属钝化。
金属钝化后,其电极电势向正方向移动,使其失去了原有的特性,如钝化了的铁在铜盐中不能将铜置换出。
此外,用电化学方法也可使金属钝化,如将Fe置于H2SO4溶液中作为阳极,用外加电流使阳极极化,采用一定仪器使铁电位升高一定程度,Fe就钝化了。
由阳极极化引起的金属钝化现象,叫阳极钝化或电化学钝化。
金属处于钝化状态能保护金属防止腐蚀,但有时为了保证金属能正常参与反应而溶解,又必须防止钝化,如电镀和化学电源等。
金属是如何钝化的呢?其钝化机理是怎样的?首先要清楚,钝化现象是金属相和溶液相所引起的,还是由界面现象所引起的。
有人曾研究过机械性刮磨对处在钝化状态的金属的影响。
实验表明,测量时不断刮磨金属表面,则金属的电势剧烈向负方向移动,也就是修整金属表面可引起处在钝态金属的活化。
即证明钝化现象是一种界面现象。
它是在一定条件下,金属与介质相互接触的界面上发生变化的。
电化学钝化是阳极极化时,金属的电位发生变化而在电极表面上形成金属氧化物或盐类。
这些物质紧密地覆盖在金属表面上成为钝化膜而导致金属钝化,化学钝化则是像浓HNO3等氧化剂直接对金属的作用而在表面形成氧化膜,或加入易钝化的金属如Cr、Ni等而引起的。
化学钝化时,加入的氧化剂浓度还不应小于某一临界值,不然不但不会导致钝态,反将引起金属更快的溶解。
金属表面的钝化膜是什么结构,是独立相膜还是吸附性膜呢?目前主要有两种学说,即成相膜理论和吸附理论。
成相膜理论认为,当金属溶解时,处在钝化条件下,在表面生成紧密的、复盖性良好的固态物质,这种物质形成独立的相,称为钝化膜或称成相膜,此膜将金属表面和溶液机械地隔离开,使金属的溶解速度大大降低,而呈钝态。
浓硫酸的钝化反应

浓硫酸是一种高浓度的硫酸,其钝化反应是指在浓硫酸中将金属表面进行改性处理,以提高金属的耐腐蚀性。
通常使用浓硫酸进行钝化处理的金属包括铜、铝、钢、镍、锌等。
浓硫酸钝化反应的机理是在金属表面形成一层致密的硫化物膜,该膜能够有效地隔绝金属与外界的接触,从而保护金属不受腐蚀。
浓硫酸钝化反应的具体过程如下:
1.将金属表面清洗干净,去除杂质和油污。
2.将浓硫酸稀释至相应浓度,将金属放入浓硫酸溶液中。
3.在适当的温度和时间内进行处理。
一般情况下,浓硫酸钝化反应的温度在60-80°C之间,时间在30-60分钟左右。
4.将金属从浓硫酸溶液中取出,用水清洗干净。
5.将金属进行干燥处理,保证其表面干燥。
通常情况下,浓硫酸钝化反应能够有效地提高金属的耐腐蚀性,使其在腐蚀性环境中更加耐用。
但是,浓硫酸钝化反应也存在一定的局限性,只能用于处理一些特定的金属,并且在处理过程中需要注意安全问题。
浓硫酸的钝化反应是指浓硫酸可以通过化学反应将一些活性金属表面的活性物质钝化。
这种反应常见于钢铁工业中,主要用于去除钢铁表面的氧化膜。
浓硫酸可以与氧化膜中的氧化铁反应生成硫铁酸盐,同时去除钢铁表面的氧化膜。
这种反应的反应式为:
4 FeO + 4 H2SO4 + O2 → 2 Fe2(SO4)3 + 2 H2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应方程式:
4Al+12HNO3(浓)=2Al2O3+12NO2↑+6H2O
4Fe+12HNO3(浓)=2Fe2O3+12NO2↑+6H2O
2Al+3H2SO4(浓)=Al2O3+3SO2↑+3H2O
2Fe+3H2SO4(浓)=Fe2O3+3SO2↑+3H2O
金属被钝化后表面会变暗
钝化只有2种金属和2个浓酸吗?
不仅铁和铝,其它多种金属也可以发生钝化。例如,Cr,Ni,Co,Mo,Ta,Nb和W等,其中最容易钝化的金属是Cr,Mo,Al,Ni。
不仅浓硝酸和浓硫酸,其它强氧化剂如氯酸、碘酸、重铬酸钾、高锰酸钾等,都可以引起某些金属的钝化甚至空气中的氧气也能使有的金属(如铝、铬等)钝化。
什么叫金属钝化?
某些金属经化学方法处理(如用强氧化剂或经阳极氧化处理),由活泼态转变为不活泼态的过程。处理后的表面形成微密而坚韧的氧化膜薄层,不易腐蚀。如铁、铝能溶于稀硝酸,但用冷浓硝酸浸泡后则钝化而难与稀硝酸反应,再浸入CuSO4溶液也不会置换出铜。此外镍、铬、钴、铋等金属可变为钝态。但钝化是有条件的,如Ni、Fe钝化后可耐受氧化性强酸却不能耐受盐酸。
铬、铝、钛等金属在空气中和很多种含氧的溶液中都易于被氧所钝化,故被称之为“自钝化金属”。铁、镍、铬、钼.钛等金属均可发生因阳极极化而引起的电化学钝化。
浓硫酸、浓硝酸能使哪些金属钝化?
浓硫酸和浓硝酸在常温下可以使铝、铁、铬钝化,原理都是生成致密的氧化膜,阻隔了进一步的反应 ,在加热的情况下铝、铁与浓硫酸、浓硝酸要反应。
2、金属钝化膜通常可用热、稀强酸除去。如硫酸,硝酸等。
钝化金属有哪些?
中学只介绍铁、铝遇浓硫酸、浓硝酸发生钝化,其实其它一些金属也可以
金属钝化的实质是金属被浓硫酸、浓硝酸氧化,表面生成一层致密的氧化膜,这种氧化膜不溶于浓硫酸、浓硝酸,因为浓硫酸、浓硝酸电离出的氢离子比较少。当稀释或加热时,这层氧化膜会被破坏。
1)铝铁钝化(化学钝化,电化学钝化)生成什么样的氧化物?
2)铝铁氧化(化学氧化,阳极氧化)生成什么样的氧化物?
3)几种不同的工艺生成的氧化物一样么?
4)铝在经浓硝酸钝化后,怎样去除表面钝化膜?放入碱中行不?
1、金属钝化机理不同,生成的钝化膜的成份也不同。可能为氧化物或者盐类。这里应该明确的一点就是,中学所学习的铁铝遇冷浓硫酸,冷浓硝酸的钝化,是生成了一层致密的氧化铁,氧化铝薄膜。这层氧化膜具有特殊的晶体结构,不同于通常所说的铁铝的氧化物。举例来说宝石(刚玉)的化学成份是氧化铝,氢氧化铝分解得到的也是氧化铝,但二者的晶体结构是不同的,性质上也表现出明显差异。
实现金属自钝化,介质中氧化剂满足什么条件?
金属钝化的实质是在金属表面形成一层很薄的致密氧化膜,自钝化是通过介质的氧化行为实现的,对介质的要求就是一般不能含有氯离子,因为氯离子具有孔蚀效应,同时为了防止过腐蚀和氢脆,要求不能是混合氧化剂·
一般具有强氧化性的浓硫酸,浓硝酸,酸性高锰酸钾,酸性重铬酸钾等均可。
