原电池的定义原电池反应的本质构成原电池的条件
原电池知识点

原电池知识点1、原电池定义:将化学能转化为电能的装置(发生自发的氧化还原反应)。
2、原电池工作原理:负极反应:Zn−2e−=Zn2+正极反应:2H++2e−=H2↑总反应:Zn+2H+=Zn2++H2↑3、原电池组成条件:(1)电极为导体且活泼性不同(负极:较活泼的金属;正极:较不活泼的金属或石墨);(2)两个电极接触(导线连接或直接接触);(3)两个相互连接的电极插入电解质溶液构成闭合回路;(4)能发生自发的氧化还原反应。
4、电极反应:负极发生氧化反应,电极反应式:较活泼金属-ne-=金属阳离子。
负极现象:负极溶解,负极质量减少。
正极发生还原反应,电极反应式:溶液中阳离子+ne-=单质。
正极现象:一般有气体放出或正极质量增加。
5、原电池正负极的判断方法:(1)依据原电池两极的材料:较活泼的金属作负极(K、Ca、Na太活泼,不能作电极);较不活泼金属或可导电非金属(石墨)、氧化物(MnO2)等作正极。
(2)根据电流方向或电子流向:(外电路)的电流由正极流向负极;电子则由负极经外电路流向原电池的正极。
(3)根据内电路离子的迁移方向:阳离子流向原电池正极,阴离子流向原电池负极。
(正正负负)(4)根据原电池中的反应类型:负极:较活泼金属、失电子、电子流出、电流流入、氧化反应;正极:较不活泼金属或石墨、得电子、电子流入、电流流出、还原反应。
(5)根据电极现象:负极:电极溶解或质量减轻;正极:电极上产生气泡或质量增加。
6、原电池的应用:(1)加快化学反应速率,如粗锌制氢气速率比纯锌制氢气快;(2)比较金属活动性强弱;(3)设计原电池;(4)金属的腐蚀。
1。
(完整word版)高中化学原电池知识点总结
(完满word 版)高中化学原电池知识点总结 1 / 1
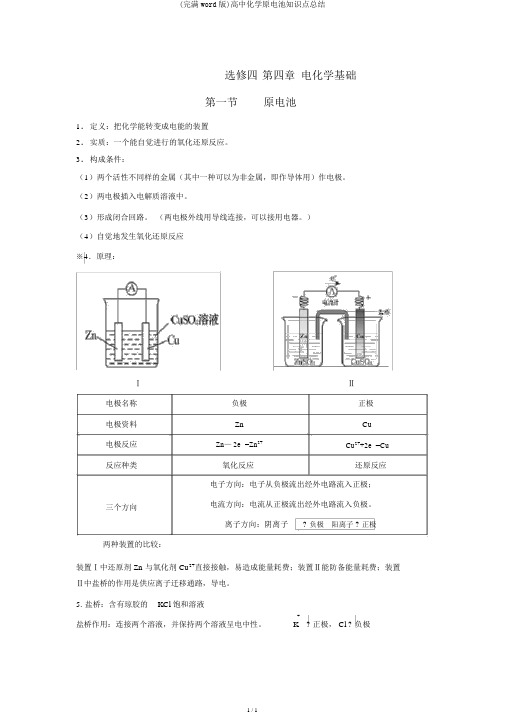
选修四 第四章 电化学基础
第一节 原电池
1.定义:把化学能转变成电能的装置
2.实质:一个能自觉进行的氧化还原反应。
3.构成条件:
( 1)两个活性不同样的金属(其中一种可以为非金属,即作导体用)作电极。
( 2)两电极插入电解质溶液中。
( 3)形成闭合回路。
(两电极外线用导线连接,可以接用电器。
)
( 4)自觉地发生氧化还原反应
※ 4.原理:
Ⅰ
Ⅱ 电极名称
负极 正极 电极资料
Zn Cu 电极反应
Zn — 2e - =Zn 2+ Cu 2++2e - =Cu 反应种类
氧化反应 还原反应 电子方向:电子从负极流出经外电路流入正极;
三个方向 电流方向:电流从正极流出经外电路流入负极。
离子方向:阴离子
? 负极 阳离子 ? 正极 两种装置的比较:
装置Ⅰ中还原剂 Zn 与氧化剂 Cu 2+直接接触,易造成能量耗费;装置Ⅱ能防备能量耗费;装置Ⅱ中盐桥的作用是供应离子迁移通路,导电。
5. 盐桥:含有琼胶的 KCl 饱和溶液
盐桥作用:连接两个溶液,并保持两个溶液呈电中性。
+ - ? 负极
K ? 正极, Cl。
构成原电池的三个条件

构成原电池的三个条件
构成原电池的三个条件
电池是一种将化学能转化为电能的装置,它由正极、负极和电解质三
部分组成。
构成原电池的三个条件是:正负两极的金属活度差异、正
负两极之间的电解液、连接正负两极的导线。
一、金属活度差异
金属活度是指金属在某一温度下与溶液中离子交换反应发生程度的大小。
不同金属的活度不同,因此在不同金属之间可以形成不同电势差。
在原电池中,通过将两种不同活度的金属放入相同浓度的溶液中,利
用其自身产生的电势差使得自由电子从高位移动到低位,从而产生了
电流。
二、电解液
在原电池中,需要一个能够传递离子并保持稳定性的介质来连接正负
两极。
这个介质通常被称为“电解液”。
它可以是固态或液态,在液
态情况下通常是溶解在水或有机溶剂中。
当两种不同金属放入相同浓
度的溶液中时,会形成一个由离子组成的电解液,这个电解液可以传
递离子,并在正负两极之间形成电势差。
三、导线
导线是将正极和负极连接在一起的一个金属杆或线。
当两种不同金属通过导线连接在一起时,由于它们之间的活度差异,自由电子会从高位移动到低位,从而产生了电流。
这个电流可以用来驱动其他设备或充电。
总结
构成原电池的三个条件是:金属活度差异、电解液和导线。
当两种不同金属放入相同浓度的溶液中时,会形成一个由离子组成的电解液,这个电解液可以传递离子,并在正负两极之间形成电势差。
通过将正负两极连接起来,并将其与其他设备或充电器连接起来,就可以利用原电池产生的电流来驱动其他设备或充电了。
原电池知识点

第四章电化学基础第一节原电池原电池及其工作原理1.概念和反应本质原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应。
2.构成条件(1)一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。
(2)二看两电极:一般是活泼性不同的两电极。
(3)三看是否形成闭合回路,形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液中。
3.工作原理(以铜—锌原电池为例)负极正极续表易错警示原电池工作原理中四个常见失分点的规避(1)只有放热的氧化还原反应才能设计成原电池,将化学能转化为电能。
(2)电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路。
(3)无论在原电池还是在电解池中,电子均不能通过电解质溶液,溶液中的离子不能通过盐桥。
(4)原电池的负极失去电子的总数等于正极得到电子的总数。
原电池正负极的判断方法说明:(1)活泼性强的金属不一定作负极,但在负极的电极上一定发生氧化反应。
(2)溶液中的离子不能通过盐桥。
(3)负极本身不一定参加反应,如燃料电池中,作为负极的材料不参加反应,只起到了导电的作用。
原电池原理的四大应用1.比较金属活泼性强弱两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
2.加快氧化还原反应的速率一个自发进行的氧化还原反应,设计成原电池时反应速率加快。
例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液能使产生H2的反应速率加快。
3.设计制作化学电源(1)必须是能自发进行且放热的氧化还原反应。
(2)正、负极材料的选择:根据氧化还原关系找出正、负极材料,一般选择活泼性较强的金属作为负极;活泼性较弱的金属或可导电的非金属(如石墨等)作为正极。
(3)电解质溶液的选择:电解质溶液一般要能够与负极发生反应,或者电解质溶液中溶解的其他物质能与负极发生反应(如溶解于溶液中的空气)。
但如果氧化反应和还原反应分别在两个容器中进行(中间连接盐桥),则两个容器中的电解质溶液选择与电极材料相同的阳离子,这样可减少离子极化作用,便于电子和离子的移动,如在Cu-Zn构成的原电池中,负极Zn浸泡在含有Zn2+的电解质溶液中,而正极Cu浸泡在含有Cu2+的电解质溶液中。
《原电池原理及组成》教学设计

原电池原理【情景导入】电能是现代社会中应用最广泛,使用最方便、污染最小的一种二次能源,又称电力。
例如,小到日常生活中使用的手提电脑、手机、相机、摄像机……大到火箭上天、神州六号宇宙飞船遨游太空,这一切都依赖于电池的应用。
那么,同学们一定想知道电池的结构、它的工作原理。
电池是怎样把化学能转变为电能的呢?今天我们用化学知识来揭开电池这个谜。
【投影】【板书】活动一、化学能与电能的转化【思考】阅读教材P39页“资料卡片”,思考什么是一次能源和二次能源?填写下表内容。
【交流投影】分类 定义实例一次能源直接从自然界取得的能源 流水、风力、化石能源、天然铀矿等 二次能源一次能源经加工、转换得到的能源电力、蒸汽等。
其中电能是应用最广泛,使用最方便,污染最小的能源。
【讨论1】(1)根据教材P40页图2-8,分析思考火电站的工作原理及如何实现能量转化的? 【交流1】①火力发电(火电)是通过化石燃料(如煤、石油、天然气)燃烧,使化学能转变为热能,加热水使之汽化为蒸汽以推动蒸汽轮机,然后带动发电机发电。
【交流2】②燃煤发电是从煤中的化学能开始的一系列能量转换过程,该过程可表示为:【板书】化学能――→燃烧热能――→蒸汽机械能――→发电机电能 其中,燃烧(氧化还原反应)是使化学能转换为电能的关键。
【交流3】③能量转化装置:燃烧炉→ 蒸汽机 →电机,说明化学能可通过氧化还原反应直接转化成电能。
【讨论2】(2)火力发电有哪些优点和缺点?【交流1】优点:(1)我国煤炭资源丰富;(2)电能清洁、安全,又快捷方便。
【交流2】缺点:(1)排出大量的温室气体CO 2;(2)有些废气可能导致酸雨,如SO 2;(3)消耗大量的不可再生能源;(4)能量转化率低;(5)产生大量的废渣、废水。
【小结】按照人类对能源的利用及性质,能源还可以进行哪些分类? 【交流】 能源类别 定义 按利用历史 按性质 举例 一次能源直接从自然界常规能源可再生能源水能实验步骤现象锌片逐渐溶解,表面有气泡;铜片表面无气泡锌片逐渐溶解,铜片表面有气泡,电流表指针发生偏转两锌片逐渐溶解且表面都有气泡,电流表指针不偏转无现象解释或说明锌与稀硫酸发生置换反应产生H2,而铜则不能锌与稀硫酸反应,但氢气在铜片上产生,导线中有电流锌与稀硫酸反应产生氢气,但导线中无电流乙醇是非电解质,与Zn、Cu都不反应【小结】根据上述实验探究,思考原电池的定义、构成条件、工作原理分别是什么?【交流1】(1)原电池的概念是将化学能转化为电能的装置;原电池的反应本质是氧化还原反应。
高中化学选择性必修一教案讲义:原电池的工作原理(教师版)

原电池的工作原理01目标任务课程标准学习目标1.能分析、解释原电池的工作原理,能设计简单的原电池。
2.能正确判断原电池的电极并书写电极反应式。
3.认识化学能转化成电能的实际意义及其重要应用。
1.能从宏观与微观相结合的角度认识原电池的构成条件及工作原理。
2.能利用原电池的理论模型,建立对原电池装置的系统分析的思维模板,并能解决相关实际问题。
02预习导学自主梳理一、原电池工作原理1.概念:将转化为的装置,称为原电池,其反应实质是自发的氧化还原反应。
2.锌铜原电池工作原理装置与现象锌片,铜片上有,电流表指针发生电极名称Zn电极—负极Cu电极—正极得失电子失电子得电子电子流向反应类型反应反应电极反应式Zn-2e-===Zn2+Cu2++2e-===Cu 总反应式Zn+Cu2+===Zn2++Cu3.盐桥(1)成分:含有琼胶的KCl饱和溶液。
(2)离子移动方向:Cl-移向极区,K+移向极区。
4.原电池的构成条件二、原电池的设计1.原电池的组成:原电池是由两个组成,如锌铜原电池是锌半电池和铜半电池通过连接。
2.原电池设计关键(1)外电路负极(的物质)――→e -导线正极(较稳定的金属或能导电的非金属)。
(2)内电路将两极浸入溶液中,使阴、阳离子做。
阴离子移向极,阳离子移向极。
【答案】一、1.化学能电能2.逐渐溶解红色物质析出偏转流出流入氧化还原3.(2)负正4.负电解质闭合氧化还原二、1.半电池盐桥2.(1)还原性较强(2)电解质定向移动负正预习检测1.在如图所示的水果(柠檬)电池中,测得Y 的电势更高,若X 为铁,则Y 不可能是A .锌B .石墨C .银D .铜【答案】A【解析】测得Y 的电势更高,Y 电极为正极,因此Y 的金属活动性弱于铁,故Y 不可能为锌,故选A 。
2.某同学设计的原电池装置如图,下列说法错误的是A .电池总反应为322Cu 2FeCl =CuCl 2FeCl ++B .Cu 极为负极C .3Fe +移向Cu 极D .电流从C 极流向Cu 极【答案】C【解析】A .该反应的总反应方程式为Cu +2FeCl 3CuCl 2+2FeCl 2,A 正确;B .该电池中Cu 失电子,做负极,B 正确;C .原电池中,阳离子应该移向正极,Cu 为负极,C 错误;D .电流由正极流向负极,该原电池中Cu 为负极,C 为正极,D 正确;故选C 。
原电池知识点

1、定义:将化学能直接转变成电能的装置。
2、构成原电池的条件:①电解质溶液②两个导体做电极③形成闭合回路(或在溶液中接触)④有能自发进行的氧化还原反应3、原理本质:氧化还原反应4、原电池电极的判断(1)由组成原电池的两极材料判断:一般来说,较活泼的或能和电解质溶液反应的金属为负极,较不活泼的金属或能导电的非金属为正极。
但具体情况还要看电解质溶液,如镁、铝电极在稀硫酸在中构成原电池,镁为负极,铝为正极;但镁、铝电极在氢氧化钠溶液中形成原电池时,由于是铝和氢氧化钠溶液发生反应,失去电子,因此铝为负极,镁为正极。
(2)根据外电路电流的方向或电子的流向判断:在原电池的外电路,电流由正极流向负极,电子由负极流向正极。
(3)根据内电路离子的移动方向判断:在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。
(4)根据原电池两极发生的化学反应判断:原电池中,负极总是发生氧化反应,正极总是发生还原反应。
因此可以根据总化学方程式中化合价的升降来判断。
(5)根据电极质量的变化判断:原电池工作后,若某一极质量增加,说明溶液中的阳离子在该电极得电子,该电极为正极,活泼性较弱;如果某一电极质量减轻,说明该电极溶解,电极为负极,活泼性较强。
(6)根据电极上产生的气体判断:原电池工作后,如果一电极上产生气体,通常是因为该电极发生了析出氢的反应,说明该电极为正极,活动性较弱。
(7)根据某电极附近pH的变化判断哪极的pH增大了,说明该电极为正极,金属活动性较弱。
5、盐桥盐桥的作用仅仅是导电【相当于导线的作用】,将两个烧杯形成闭合回路,否则就相当于断开,而盐桥的导电是利用了其中的阴阳离子的定向移动。
锌铜电池,电解质溶液锌端硫酸锌,铜端硫酸铜,即两端不一样,所以产生电势差,于是,电子从负极Zn失去,沿着导线移向正极而,即外面的导线中,电子即负电荷从Zn到Cu,中间有盐桥连接,即盐桥中的负电荷即阴离子应该从CuSO4的一端沿着盐桥移向ZnSO4的一端,或者说,盐桥中的正电荷即阳离子就从 ZnSO4的一端沿着盐桥移向CuSO4的一端,总之,要保证两端烧杯中的正负电荷要守恒。
高中化学《原电池》优质课教学设计、教案

-===Zn2+ 2e -===Cu 装置举例 第四章电化学基础第 一 节 原 电 池【教学目标】 1、理解原电池的工作原理和构成原电池的条件。
(重点)2、掌握原电池正、负极的判断及电极反应式的书写。
(难点)3、原电池原理的应用。
(重点)【教学重点、难点】1. 通过设计铜锌原电池两种方案的对比,加深原电池原理的理解。
(重点)2. 正确书写电极反应与电池反应方程式。
(难点)3. 会设计简单原电池。
(重点)【教学设计过程】一、单液原电池提问 1:复习原电池的定义。
提问 2:以铜、锌原电池为例,练习电极反应式书写和原电池的工作原理。
二、双液原电池提问 3:双液原电池的定义,原电池的构成条件。
1. 原理(以铜、锌原电池为例)原电池是利用氧化还原反应原理将化学能转化为电能的装置。
2. 电极反应锌片负极,发生氧化反应电极反应式:Zn -2e铜片正极,发生还原反应电极反应式:Cu2++ 总电极反应式为:Cu2++Zn===Cu +Zn2+3. 构成条件条件两个活泼性不同的电极,较活泼的做负极电解质溶液形成闭合回路能自发地发生氧化还原反应【思考与交流】:对比单液原电池和双液原电池的原理和优缺点。
三 原电池正、负极的判断方法 【问题导思】①原电池中,电子流出的极是正极还是负极?②若某电极在反应过程中增重,是原电池的正极还是负极?【小结】原电池正、负极的判断方法有哪些?1.由组成原电池的两极材料判断较活泼的金属为负极,较不活泼的金属或能导电的非金属为正极。
2.根据电流方向或电子流向判断外电路中,电流由正极流向负极,电子由负极流向正极。
3.根据原电池电解质溶液中离子的移动方向判断在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。
4.根据原电池中两极发生的反应判断原电池中,负极总是发生氧化反应,正极总是发生还原反应。
若给出一个总方程式,则可根据化合价升降来判断。
5.根据电极质量的变化判断原电池工作后,某一电极质量增加,说明溶液中的阳离子在该电极上放电,该极为正极,活泼性较弱;反之,如果某一电极质量减轻,则该电极溶解,为负极,活泼性较强。
新版高中化学通过讲义:原电池的工作原理

实验探究——锌铜原电池一、原电池的基本概念1.概念:原电池是将化学能转化为电能的装置。
2.本质:氧化反应和还原反应分别在两个不同的区域进行。
3.电极:(1)负极:________电子,发生________反应;(2)正极:________电子,发生________反应。
4.构成原电池的条件: (1)自发进行的氧化还原反应; (2)两个活动性不同的电极; (3)电解质溶液(或熔融电解质);第24讲 原电池的工作原理知识导航知识精讲实验装置实验操作 实验现象 实验结论将锌片和铜片插入盛有稀硫酸的烧杯中 锌片上有气泡冒出,铜片上无现象 装置中有电流产生,化学能转化为电能 用导线连接锌片和铜片 铜片上有气泡冒出 用导线在锌片和铜片之间串联一个电流表电流表指针发生偏转(4)形成闭合回路。
【答案】失去氧化得到还原二、锌铜原电池的工作原理工作原理(反应方程式)负极(Zn)正极(Cu)总反应离子方程式:。
电子移动方向由极经导线流向极(电流方向相反)。
离子移动方向阳离子向极移动,阴离子向极移动。
【答案】Zn - 2e- === Zn2+2H+ + 2e- === H2↑ Zn + 2H+ === Zn2+ + H2↑ 负正正负三、盐桥的作用(1)形成闭合回路;(2)平衡电荷,使溶液呈电中性;(3)避免电极与电解质溶液直接反应,减少电流的衰减,提高原电池的工作效率。
四、原电池的应用1.比较金属活动性两种金属分别作原电池的两极时,一般作负极的金属比正极的金属活泼。
2.加快氧化还原反应的速率一个氧化还原反应,构成原电池时的反应速率比直接接触的反应速率快。
3.设计原电池理论上,任何一个自发的氧化还原反应,都可以设计成原电池。
利用原电池原理设计和制造原电池,可以将化学能直接转化为电能。
题型一:原电池的工作原理对点训练【变1-1】(2021·大安市第一中学校高二开学考试)原电池构成是有条件的,关于如图所示装置的叙述,错误的是A.Cu是负极,其质量逐渐减小B.H+向铁电极移动C.Cu片上有红棕色气体产生D.Fe电极上发生还原反应【答案】C【分析】由于铁在常温下遇到浓硝酸发生钝化,故铁和铜插入到浓硝酸中,反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,故铜做负极,电极反应为:Cu-2e-=Cu2+,铁作正极,电极反应为:NO+4H++2e-=2NO2↑+2H2O,据此分析解题。
知识讲解_原电池_基础

原电池编稿:张灿丽审稿:曹玉婷【学习目标】1、了解常见化学能与电能转化方式及应用;2、掌握原电池的组成及反应原理;3、认识常见的几种化学电源和开发利用新型电池的意义。
【要点梳理】要点一、原电池的工作原理1、原电池的定义燃煤发电的能量转换过程是,该过程虽然实现化学能与电能的转化,但是过程繁琐、复杂且能耗较大。
在此过程中,燃烧(氧化还原反应)是使化学能转换为电能的关键。
因此,需要设计一种装置使氧化还原反应释放的能量直接转变为电能,原电池就是这样的装置。
将化学能转变为电能的装置叫做原电池。
【高清课堂:化学能与电能(一)—初探原电池ID:370200#原电池原理】2、原电池的工作原理实验1、如下图,把一锌片和一铜片插入稀H2SO4中。
现象:Zn片上有气泡出现。
反应:Zn+H2SO4=ZnSO4+H2↑。
Zn失电子生成Zn2+,H+得电子生成H2。
实验2、把上图中的Zn、Cu用一导线连接起来,中间接一电流计G。
现象:Zn片逐渐溶解,Cu片上有气泡出现,电流计G指针发生偏转。
结论:Zn反应生成Zn2+而溶解,Cu片上有H2产生,有电流产生。
该实验中,产生了电流,就构成了原电池。
要点诠释:原电池工作原理相当于将氧化还原反应中电子通过用电器转移,产生电能,因此原电池的作用为将化学能转化成电能。
【高清课堂:化学能与电能(一)—初探原电池ID:370200#原电池构成条件】要点二、原电池的组成条件组成原电池必须具备三个条件:(1)提供两个活泼性不同的电极,分别作负极和正极。
要点诠释:a、负极:活泼性强的金属,该金属失电子,发生氧化反应。
b、正极:活泼性弱的金属或非金属(常用碳棒、石墨),该电极上得电子,发生还原反应。
c、得失电子的反应为电极反应,上述原电池中的电极反应为:负极:Zn-2e-=Zn2+正极:2H++2e-=H2↑,总反应:Zn+H2SO4=ZnSO4+H2↑(2)两个电极必须直接和电解质溶液接触,电解质溶液中阴离子向负极方向移动,阳离子向正极方向移动,阴阳离子定向移动成内电路。
贾凡尼效应(原电池效应)

贾凡尼效应又原电池效应一.有关原电池的基本概念:1.原电池的定义:原电池是一种能将化学能直接转变成电能的装置。
2.构成原电池的一般条件:(1)有相连的、活动性不同的两个电极(金属或非金属导体);(2)两电极和电解质溶液相接触;(3)构成闭合回路,两极上发生氧化还原反应。
负极上发生氧化反应,电子流出(电流流入)正极上发生还原反应,电子流入(电流流出)3.原电池的电极反应式和化学方程式的书写。
二.原电池原理的应用:1.几种重要的化学电源干电池、铅蓄电池、锂电池、燃料电池等2.金属的腐蚀与防护金属腐蚀是指金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程。
形成原电池可加快金属的腐蚀过程。
相反,利用电化学反应使金属钝化而受到保护,或利用原电池反应将需保护的金属作为电池的正极而受到保护。
三. 原电池正、负极的判断:(1)由组成原电池的电极材料来判断:都是金属,活泼的为负极;金属和非金属,金属为负极,非金属为正极(2)根据电流方向或电子流动方向来判断:电流方向:正极到负极;电子流动方向:负极到正极(3)根据原电池电解质溶液中离子迁移方向来判断:阳离子移向正极,阴离子移向负极(4)根据两极发生的反应(或现象)来判断:负极发生氧化反应,正极发生还原反应AlphaSTAR(沉银技术)工艺直接影响印制线路板本调查共有93家厂商(包括64家PWB制造厂商和29家装配厂商)参与,根据他们的反馈,造成缺陷或报废有6个主要的原因:贾凡尼效应、腐蚀、露铜、离子污染、微空洞、可焊性很明显,因为印制线路板完成装配后不能重工,所以因微空洞而报废所造成的成本损失最高。
虽然其中有八个PWB 制造厂商因为客户退件而注意到了该缺陷,但是此类缺陷主要还是由装配厂商提出。
可焊性问题根本没有被PWB制造厂商报告过,只有三家装配厂商误将发生在内部有大散热槽/面的高纵横比(HAR) 厚板上的”缩锡”问题(是指在波峰焊后焊锡只填充到孔深度的一半)归咎于沉银层。
2015年高考化学原电池和电解池讲义
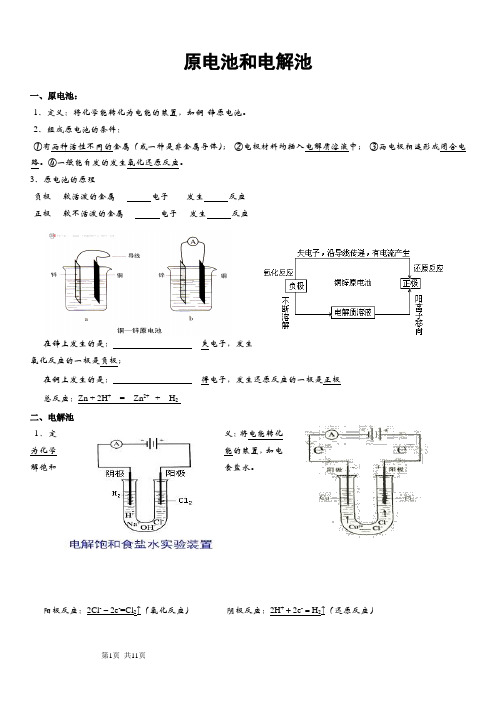
原电池和电解池一、原电池:1、定义:将化学能转化为电能的装置,如铜-锌原电池。
2、组成原电池的条件:①有两种活性不同的金属(或一种是非金属导体);②电极材料均插入电解质溶液中;③两电极相连形成闭合电路。
④一般能自发的发生氧化还原反应。
3、原电池的原理负极----较活泼的金属---- 电子------发生反应正极----较不活泼的金属---- 电子----发生反应在锌上发生的是:失电子,发生氧化反应的一极是负极;在铜上发生的是:得电子,发生还原反应的一极是正极总反应:Zn + 2H+= Zn2+ + H2二、电解池1.定义:将电能转化为化学能的装置,如电解饱和食盐水。
阳极反应:2Cl--2e-=Cl2↑(氧化反应)阴极反应:2H++2e-=H2↑(还原反应)总反应:2NaCl+2H2O2NaOH+H2↑+Cl2↑注意:①电流必须是直流②熔融态的电解质也能被电解③阴极上放电的先后顺序是:Ag+>Hg2+>Fe3+>Cu2+>(H+)>Fe2+>Zn2+;阳极上放电的先后顺序是:活泼金属电极›S2->I->Br->Cl->OH ->(F-、NO3-、SO42-等)(惰性电极)④用石墨、金、铂等还原性很弱的材料制做的电极叫做惰性电极,理由是它们在一般的通电条件下不发生化学反应。
用铁、锌、铜、银等还原性较强的材料制做的电极又叫做活性电极,它们做电解池的阳极时,先于其他物质发生氧化反应。
电解的电极反应式的书写思路与步骤:分电极(判断正负极)-----析溶液(分析电解质溶液中含有哪些离子)---判流向(判断电子流动方向、离子移动方向)-----断微粒(确定在两极上反应的是什么微粒)----写电极(书写电极反应方程式)---写方程(书写电解质电解的化学方程式或离子方程式)1)电解时溶液pH值的变化规律电解质溶液在电解过程中,有时溶液pH值会发生变化。
判断电解质溶液的pH值变化,有时可以从电解产物上去看。
①若电解时阴极上产生H2,阳极上无O2产生,电解后溶液pH值增大;②若阴极上无H2,阳极上产生O2,则电解后溶液pH值减小;③若阴极上有H2,阳极上有O2,且V(H2)=2V(O2),则有三种情况:a 如果原溶液为中性溶液,则电解后pH值不变;b 如果原溶液是酸溶液,则pH值变小;c 如果原溶液为碱溶液,则pH值变大;④若阴极上无H2,阳极上无O2产生,电解后溶液的pH可能也会发生变化。
原电池的原理

原电池是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.又称非蓄电池,是电化电池的一种,其电化反应不能逆转,即是只能将化学能转换为电能,简单说就即是不能重新储存电力,与蓄电池相对。
原电池是将化学能转变成电能的装置。
所以,根据定义,普通的干电池、燃料电池都可以称为原电池。
组成原电池的基本条件:1、将两种活泼性不同的金属(或导电单质)(Pt和石墨为惰性电极,即本身不会得失电子)(一种是相对较活泼金属一种是相对较不活泼金属)2、用导线连接后插入电解质溶液中,形成闭合回路。
3、要发生自发的氧化还原反应。
原电池工作原理原电原电池池是将一个能自发进行的氧化还原反应的氧化反应和还原反应分别在原电池的负极和正极上发生,从而在外电路中产生电流。
原电池的电极的判断:负极:电子流出的一极;化合价升高的一极;发生氧化反应的一极;活泼性相对较强金属的一极。
正极:电子流入的一极;化合价降低的一极;发生还原反应的一极;相对不活泼的金属或其它导体的一极。
在原电池中,外电路为电子导电,电解质溶液中为离子导电。
原电池的判定:(1)先分析有无外接电路,有外接电源的为电解池,无外接电源的可能为原电池;然后依据原电池的形成条件分析判断,主要是“四看”:看电极——两极为金属或导电单质且存在活泼性差异(燃料电池的电极一般为惰性电极);看溶液——两极插入电解质中;看回路——形成闭合回路或两极直接接触;看本质——有无氧化还原反应。
(2)多池相连,但无外接电源时,两极活泼性差异最大的一池为原电池,其他各池可看做电解池。
原电池应用(1)制造各类电池原电原电池池,一种将活性物质中化学能通过氧化还原反应直接转换成电能输出的装置。
又称化学电池。
由于各种型号的原电池氧化还原反应的可逆性很差,放完电后,不能重复使用,故又称一次电池。
它通常由正电极、负电极、电解质、隔离物和壳体构成,可制成各种形状和不同尺寸,使用方便。
广泛用于工农业、国防工业和通信、照明、医疗等部门,并成为日常生活中收音机、录音机、照相机、计算器、电子表、玩具、助听器等常用电器的电源。
构成原电池的四个条件

构成原电池的四个条件好嘞,今天咱们聊聊构成原电池的四个条件。
这可是个有趣的话题,咱们就像在泡一壶好茶,慢慢品味,嘿嘿。
原电池呢,简单来说,就是能把化学能转化为电能的小玩意儿,咱们身边的很多东西都跟它息息相关,像手机、手电筒什么的,没有它们可真不方便啊。
那构成原电池的条件到底是什么呢?来,咱们一块儿来捋一捋。
原电池得有两个电极,没错,就是阴极和阳极。
就像一对好兄弟,一个负责“吸引”,一个负责“放电”。
想象一下,如果这两个小家伙不在,那原电池就像个没头苍蝇,根本没法工作。
这两个电极呢,通常是用金属制成的,像铜、锌这些大家伙。
你说,它们可都是有故事的角色,各自都有自己的性格特点。
比如说,锌可是个喜欢“牺牲”的家伙,愿意把电子送出去,默默无闻,但也正是因为它,电流才能流动,真是个无私的英雄!接下来呢,原电池少不了电解质。
这家伙就像是个调皮的中介,负责在阳极和阴极之间传递“信息”。
电解质可以是液体也可以是固体,常见的有盐水、酸液等,咱们可以把它想象成一条河,电流就是在河里游来游去的小鱼儿。
没有了电解质,这小鱼儿可就没地方可去了,电流也就断了,原电池也就不干活了,真是让人伤脑筋啊。
然后,咱们得提到一个神秘的东西——化学反应。
没错,这可是原电池的灵魂所在。
想象一下,阴极和阳极就像是在舞会上的舞者,得靠着电解质的引导,才能翩翩起舞。
化学反应让电子从一个电极跳到另一个电极,整个过程就像是一场热闹的派对,能量不断地在电极间传递。
如果没有反应,电极们就像闷在家里的大叔大妈,愣是动不了,原电池就成了个摆设,别提多可惜了。
原电池的工作环境也很重要。
就像一个人的心情,周围的环境好,工作也会更顺心。
温度、压力这些因素可不能忽视,适合的环境能让化学反应更活跃,电流流动得更顺畅。
太冷或太热,都是对原电池的“折磨”。
想象一下,夏天的西瓜和冬天的火锅,大家都喜欢对吧?其实电池也有它自己的“喜好”,得让它在最舒服的环境中工作,才能发挥出最佳的效果。
原电池的形成条件

原电池的形成条件是利用两个电极之间金属性的不同,产生电势差,从而使电子的流动,产生电流.又称非蓄电池,是电化电池的一种,其电化反应不能逆转,即是只能将化学能转换为电能,简单说就即是不能重新储存电力,与蓄电池相对。
定义在高中阶段来说,原电池是将化学能直接转化为电能的一种装置。
其原理也是通过化学反应(在正负极发生不同的氧化还原反应)使闭合电路中产生电子流,从而产生电流的。
其中在正极发生还原反应,负极发生氧化反应。
概述原电池是将化学能转变成电能的装置。
所以,根据定义,普通的干电池、燃料电池都可以称为原电池。
组成原电池的基本条件:1.将两种活泼性不同的金属(或导电单质)(Pt和石墨为惰性电极,即本身不会得失电子)(一种是相对较活泼金属一种是相对较不活泼金属)2.用导线连接后插入电解质溶液中,形成闭合回路。
3.要发生自发的氧化还原反应。
原电池工...原电池的工作原理原电池反应属于放热的氧化还原反应,但区别于一般的氧化还原反应的是,电子转移不是通过氧化剂和还原剂之间的有效碰撞完成的,而是还原剂在负极上失电子发生氧化反应,电子通过外电路输送到正极上,氧化剂在正极上得电子发生还原反应,从而完成还原剂和氧化剂之间电子的转移。
两极之间溶液中离子的定向移动和外部导线中电子的定向移动构成了闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流,实现化学能向电能的转化。
从能量转化角度看,原电池是将化学能转化为电能的装置;从化学反应角度看,原电池的原理是氧化还原反应中的还原剂失去的电子经导线传递给氧化剂,使氧化还原反应分别在两个电极上进行。
原电池的构成条件有三个:(1)电极材料由两种金属活动性不同的金属或由金属与其他导电的材料(非金属或某些氧化物等)组成。
(2)两电极必须浸泡在电解质溶液中。
(3)两电极之间有导线连接,形成闭合回路。
只要具备以上三个条件就可构成原电池。
而化学电源因为要求可以提供持续而稳定的电流,所以除了必须具备原电池的三个构成条件之外,还要求有自发进行的氧化还原反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电流方向 电流流入
现象
被溶解消耗
正极
较不活泼金属或石墨 得电子 电子流入 还原反应 阳离子流向 电流流出 质量增重或放出气体
再探原电池
一、设计原电池
1、选择合适的化学反应
2e-
HCl(aq) + NaOH(aq) = NaCl(aq) + H2O(l) △H < 0 Zn(s) + CuSO4高(a温q) = ZnSO4(aq) + Cu(s) △H < 0
C(s) Z+nC-O22e(-g=) Zn2+ 2CO(g) △HC>u20+ + 2e- = Cu
2、设计合理的原电池装置
Zn(s) +【C设uS计O要4(点aq】) = ZnSO4(aq) + CAu(s) △H < 0
1、正负极、内电路、外电 e-
e-
路各需要哪些仪器和药品?
Zn
Cu
2、如何判断化学能转化为 负极
正极
了电能?
硫酸铜
二、体验原电池
【实验 ·探究】
A
【温馨提示】
Zn
Cu
硫酸铜
1、使用温度计测量反应前后 硫酸铜溶液的温度;
2、观察锌片、铜片、电流表和温 度计的变化并如实记录;
预期现象 锌片溶解
铜片上附着生成的铜
电流表指针偏转
实验现象 锌片上附着生成的铜 溶液的温度升高 铜片上附着生成的铜 电流表指针偏转
原电池的定义:
将化学能转化为电能的装置叫做原电池。
原电池反应的本质: 氧化还原反应
构成原电池的条件:
①电解质溶液 ②两个活泼性不同的导体做电极 ③形成闭合回路 ④有能自发进行的氧化还原反应
4.原电池正负极判断方法
负极
电极材料 较活泼的金属
得失电子 失电子
电子流向 电子流出Fra bibliotek反应类型 氧化反应
离子流向 阴离子流向
A
A
Zn
Cu C
Cu
ZnSO4溶液 H2SO4溶液 FeCl3溶液 CuCl2溶液
在化学电源应用:
牛 皮 纸
我们的骄傲…
国内新能源汽车的先行者
2009年2月 安徽奇瑞电动汽车下线
【交流 ·研讨】 为什么会出现这些现象?如何改进原电池装置呢?
让锌片与硫酸铜不直接接触
A
A
Zn
Cu
硫酸铜
改进
Zn
Cu
? ZnSO4溶液 CuSO4溶液
【观察与思考】
盐桥有什么作用? 平衡电荷、构成离子通路 盐桥中的阴阳离子是怎么移动的?
【思考与交流 】
A
A
Zn
Cu
Zn
Cu
改进
硫酸铜
ZnSO4溶液 CuSO4溶液
改进后的原电池装置还有什么优点?
【优点1】改进后的原电池装置提高了能量转换率 【优点2】改进后的原电池装置化学能不会自动释放 【启示】氧化剂和还原剂不直接接触也能发生反应
三、应用原电池
试一试:请把下面两个反应设计成双液原电池,画
出示意图并写出正负极电极反应式
Zn + H2SO4 = ZnSO4 + H2 2FeCl3 + Cu= 2FeCl2 + CuCl2
