2006级分析化学期末试卷A卷及解答
2006分析化学试题A卷参考答案及评分标准

2006分析化学A 卷参考答案一、填空题(6~8题各2分,其余每空1分,共20分)1、 定性分析、定量分析和结构分;常量分析;微量分析。
2、 C B ×M(2NaOH)/1000;a×M(2K 3PO 4)/M(3K 2O)。
3、强碱滴定弱酸;酚酞。
4、直接滴定法、间接滴定法、返滴定法和置换滴定法;所使用的参比溶液的不同,普通光度法一般以试剂空白为参比,而示差法则以浓度稍低于待测溶液的标准溶液作为参比溶液。
5、 有2(个)滴定突跃;pH =4;甲基橙;pH=9;酚酞。
6、 [NH 3]+[OH -]+[HPO 42-]+2[PO 43-]=[H+]+[H 3PO 4]7、酸度约1mol/LH 2SO 4、温度75~85℃、自动催化反应、自身指示剂8、在一定温度和入射光的照射下,b=1cm ,浓度为1mol/L 的吸光物质所产生的吸光度。
二、单项选择题(每题答对一个得2分,共30分)1、A2、D3、D4、A5、A6、D7、D8、C9、C 10、D 11、C 12、C 13、C 14、D 15、C三、判断题(正确的打“√”,错误的打“×”每空1分,共18分)1、×2、×3、×4、×5、√6、×7、×8、×9、×10、√ 11、× 12、× 13、× 14、√ 15、× 16、×17、 A :√ B : ×四、计算题(每题8分,共32分)1、解24.3110000.664%ω⨯⨯=⨯4.100.01000(Mg )=25.001.500250.02分 65.3913.401000 5.842%ω⨯⨯=⨯0.01000(Zn )=25.001.500250.03分 63.55100010.13%ω⨯⨯=⨯(37.30-13.40)0.01000(Cu )=25.001.500250.03分 2、解:40.002.525.0010000.07143ω⨯⨯⨯=⨯0.02000(Ca )=25.007.000250.02分 试样2的实验数据由小到在为:25.70,27.11,27.52,27.54, 27.54,27.56, 27.58,实验数据25.70为可疑值,因为0.9527.1125.70(25.70)27.5825.700.75Q Q -=-=> 1分所以,该数据应舍去。
分析化学试卷A卷2006-2007( 二)及答案

2006——2007 (二)期分析化学试卷(A卷)班级:工艺______ 姓名:________ 学号:____ 得分:_________一、填空题(每空一分,共20分)1、定量分析的方法,根据反应类型的不同,可分为____________、______________、______________与_____________四种。
2、HCl标准溶液通常采用______法制备,以________基准试剂标定。
3、NaOH标准溶液应采用______法制备,标定时以________为指示剂。
4、酸碱缓冲溶液是一种对溶液的______起稳定作用,能对抗外来酸、____或_____而使其PH值不易发生变化的溶液。
5、配位滴定法是__________为基础的滴定分析法。
本法中应用最广泛的配位剂是以______为代表的氨羧配位剂。
6、配位滴定法中的标准溶液EDTA,化学名称为__________________。
7、滴定分析又称容量分析,是将一种已知_________试剂溶液滴加到一定量__________溶液中,直到所加试剂与待测物质定量反应为止。
8、高锰酸钾法是以高锰酸钾为________的氧化还原滴定法,滴定中确定终点的指示剂属______指示剂。
9、滴定分析中,已知准确浓度的试剂称为标准溶液,它的配制一般有两种方法,分别为_____和_______。
二、选择题(每题2分,共40分)1、系统误差的性质是()。
A、随机产生;B、呈正态分布;C、难以测定;D、影响分析结果的准确度。
2、下列数据中具有三位有效数字的有()。
A、0.35;B、9.90;C、1.235;D、52;3、控制碱式滴定管正确的操作方法为()。
A、左手捏挤于玻璃珠中部偏上方胶管;B、左手捏挤于玻璃珠稍下处;C、右手捏挤于玻璃珠稍中部偏上方胶管;D、右手捏挤于玻璃珠稍上处;4、用250ml容量瓶配得的溶液,其体积应记录为()。
A、250ml;B、250.0ml;C、250.00ml;D、250.000ml。
《分析化学》期末考试试卷(A)及答案

适用专业:注意:请将所有答案填到答题纸上。
一、单项选择题(每小题1分,共25分)1.10mL移液管移取的体积应记录为()mL。
A.10 B.10.0 C.10.00 D.10.0002.0.010450有效数字的位数为()位。
A.三B.四C.五D.六3.分析结果的精密度通常用()表示。
A.绝对误差B.相对误差C.绝对偏差D.相对偏差4.分析测定中出现的下列情况,不属于系统误差的是()。
A.滴定时有液滴溅出锥形瓶B.滴定管读数时最后一位估计不准C.砝码未校正D.试剂中含有微量的干扰离子5.分析测定中可通过()减少偶然误差。
A.仪器校正B.增加平行实验的次数C.空白实验D.对照实验6.在定量分析中,要求测定结果的误差()。
A.等于零B.愈小愈好C.在允许的误差范围之内D.没有要求7.将0.6345修约成三位有效数字,正确的结果是()。
A.0.635 B.0.634C.0.64 D.0.68.下列仪器不属于量器的是()。
A.滴定管B.量筒C.烧杯D.移液管9.酚酞指示剂加入食醋溶液中呈()色。
A.红B.无C.黄D.橙10.()用符号ρ表示。
A.质量浓度B.物质的量浓度C.体积分数D.质量分数11.甲基橙指示剂的pH变色范围是()。
A.3.1~4.4B.4.4~6.2 C.3.0~4.6 D.8.0~10.0 12.相对平均偏差常保留()位有效数字。
A.两B.三C.四位D.没有什么要求13.下列物质为基准物质的是()A.浓盐酸B.氢氧化钠C.高锰酸钾D.氯化钠14.双氧水的含量测定属于()滴定法。
A.酸碱B.氧化还原C.沉淀D.配位15.碘量法常使用()作指示剂。
A.甲基橙B.铬黑TC.淀粉D.荧光黄16.EBT是()的英文缩写。
A.铬黑T B.氯化钠C.乙二胺四乙酸D.硝酸银17.标定氢氧化钠标准溶液常用的基准物质是()。
A.无水碳酸钠B.硼砂C.草酸钠D.邻苯二甲酸氢钾18.以荧光黄为指示剂测定氯化钠试样的含量,终点颜色由黄绿色转变为()。
(完整word版)分析化学期末考试试卷AB(带答案)

试卷一一、选择题:(每题2 分,共40 分)(说明:将认为正确答案的字母填写在每小题后面的括号内)1. 在定量分析中,精密度和准确度之间的关系是:()A.精密度高,准确度必然高;B. 精密度是保证准确度的前提;B.准确度是保证精密度的前提。
2. 若HAc的pKa=4.74,则Ka值为:()A. 2×10-5;B. 1.8×10-5;C. 2.0×10-5;D. 1.82×10-5。
3. 浓度相同的下列物质水溶液pH最高的是:()A.NaCl; B. NaHCO3;C. NH4Cl;D. Na2CO3。
4. 强酸滴定弱碱,以下指示剂不适用的是:()A.甲基橙;B. 甲基红;C. 酚酞;D. 溴酚蓝(pKa=4.0)。
5. 若S1,S2,S3依次为CaC2O4在纯水中、Na2C2O4稀溶液中、稀HCl溶液中的溶解度那么:()A. S3>S2>S1;B. S1>S2>S3;C. S3>S1>S2;D. S1>S3>S2。
6 下列情况引起随机误差的是:()A.使用不纯的Na2CO3来标定HCl溶液;B.在称量分析中,杂质与被测成分共沉淀;C.滴定分析中,终点与等量点不一致;D.在获得测量值时,最后一位数字估测不准。
7. 下列物质中可用直接法配制标液的是:()A. 固体NaOH;B. 固体K2Cr2O7;C. 固体Na2S2O3•5H2O;D. 浓HCl 。
8. H2PO4-的共轭碱是:()A. PO43-;B. HPO42-;C. H2PO4-;D. H3PO4。
9. 用重量法测定样品中SiO2含量时能引起系统误差的是:()A.称量样品时天平零点稍有变动;B. 析出硅酸沉淀时酸度控制稍有差别;C.加动物胶凝聚时的温度稍有差别;D. 硅酸的溶解损失。
10. 浓度相同的下列物质水溶液pH最高的是:()A.NaCl; B. NaHCO3;C. NH4Cl;D. Na2CO3。
分析近三年试题
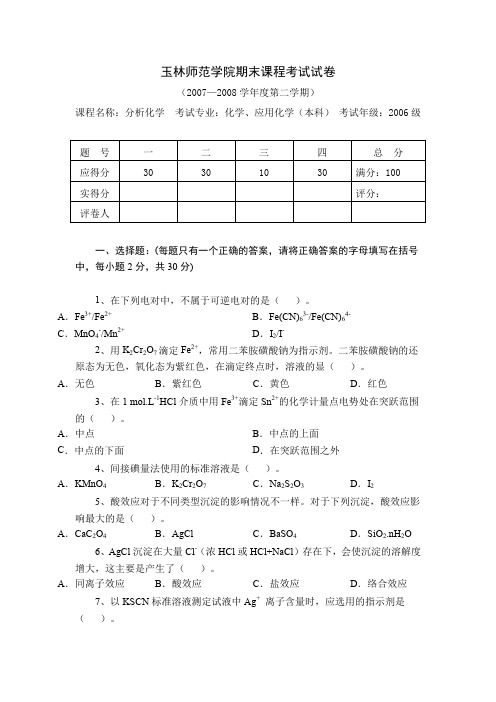
玉林师范学院期末课程考试试卷(2007—2008学年度第二学期)课程名称:分析化学考试专业:化学、应用化学(本科)考试年级:2006级一、选择题:(每题只有一个正确的答案,请将正确答案的字母填写在括号中,每小题2分,共30分)1、在下列电对中,不属于可逆电对的是()。
A.Fe3+/Fe2+B.Fe(CN)63-/Fe(CN)64-C.MnO4-/Mn2+D.I2/I-2、用K2Cr2O7滴定Fe2+,常用二苯胺磺酸钠为指示剂。
二苯胺磺酸钠的还原态为无色,氧化态为紫红色,在滴定终点时,溶液的显()。
A.无色B.紫红色C.黄色D.红色3、在1 mol.L-1HCl介质中用Fe3+滴定Sn2+的化学计量点电势处在突跃范围的()。
A.中点B.中点的上面C.中点的下面D.在突跃范围之外4、间接碘量法使用的标准溶液是()。
A.KMnO4B.K2Cr2O7C.Na2S2O3D.I25、酸效应对于不同类型沉淀的影响情况不一样。
对于下列沉淀,酸效应影响最大的是()。
A.CaC2O4B.AgCl C.BaSO4D.SiO2.nH2O6、AgCl沉淀在大量Cl-(浓HCl或HCl+NaCl)存在下,会使沉淀的溶解度增大,这主要是产生了()。
A.同离子效应B.酸效应C.盐效应D.络合效应7、以KSCN标准溶液测定试液中Ag+离子含量时,应选用的指示剂是()。
A.铬酸钾B.铁铵矾C.荧光黄D.甲基橙8、在摩尔法中,通过计算,指示剂K2CrO4浓度应为1.2×10-2 mol.L-1,而在实际滴定中一般为5×10-3mol.L-1,此时滴定终点会出现在()。
A.化学计量点前B.化学计量点后C.化学计量点时D.无法判断9、在朗伯-比尔定律A=Kbc中,若b的单位用cm,c的单位用g.L-1时,常数K用a表示,称为吸光系数,则a的单位是()。
A.L.mol-1.cm-1B.mol.cm.L-1C.L.g-1.cm-1D.g.cm.L-110、KMnO4的浓度是1.0×10-3 mol.L-1时,吸收了545 nm波长下的25%入射光,其吸光度是()。
武汉大学2005-2006学年度第一学期《分析化学》期末考试答案

有效数字不对总共扣0.5分一、填空(每空1分,共35分)1.(1)[H+]+[H3PO4]= [OH-]+[NH3] +[HPO42-]+2[PO43-] (2)[H+]+[HAc]=[H2BO3-]+[OH-]2.不变,减小4.t检验法;F检验法5.1.92;6.226.0.68V;1.06V;0.86-1.26V7.黄;红8.99:19.直接滴定;反滴定;置换滴定;间接滴定8.I2 + 2S2O32-=2I- + S4O62-10.吸收光谱曲线;最大吸收波长;λmax11.光源;单色器;吸收池;检测部分12.S;M/ε;无关;有关13.水或H2O14.采样与制样,称样;样品分解;分离与测定;结果计算和数据处理(无称样,答4个也算全对)二、简答题1.能用于直接配制或标定标准溶液的物质;是一种已知准确浓度的的溶液。
2.酸碱指示剂变色是随着酸度的变化,指示剂结合或离解出H+,结构发生变化,从而发生颜色改变;络合指示剂与金属离子络合前后颜色不同,游离的试剂为一种颜色,与金属离子形成络合物又一种颜色;氧化还原指示剂变色分为几种情况:一种是随氧化还原电位变化的试剂,在氧化态和还原态,结构不同,各有不同颜色,如二苯胺磺酸钠,还原态无色,氧化态紫红色;另一种自身指示剂,如高锰酸钾;还有显色指示剂如I2,与淀粉显兰色。
沉淀滴定指示剂,是根据溶度积大小,在化学计量点被测物质沉淀基本完全后,指示剂与被测离子形成有色沉淀或有色络合物指示终点。
还有吸附指示剂,吸附在沉淀表面后发生颜色变化。
3.络合滴定过程中,随着络合物的生成,不断有H+释放出,使体系酸度增大,会降低络合物的条件稳定常数,使滴定突跃减小;也会使指示剂变色范围改变,导致测定误差大。
所以,要加入缓冲溶液控制溶液pH;还用于控制金属离子的水解。
4.测量波长选具有最大光吸收,干扰最小;吸光度读数在0.2-0.8范围,最好接近0.4343;选择适当参比溶液。
5.蒸馏,挥发,萃取,沉淀,离子交换,薄层色谱,纸色谱,电泳,毛细管电泳,气浮分离法,超临界流体萃取,反相分配色谱,超临界流体色谱;膜分离;固相微萃取等(答8个得满分,少一个扣0.5分)三、分析方法设计(共15分,写在答题纸上)1.设计测定含有中性杂质的Na2CO3与Na3PO4混合物中二组分质量分数的分析方案。
分析化学期末试卷[1]
![分析化学期末试卷[1]](https://img.taocdn.com/s3/m/bcabd5e24afe04a1b071def0.png)
分析化学(一)期末考试试卷(A)(闭卷120分钟)学号姓名专业年级重修标记□一、填空题( 共5题10分)1. 用重量法测定As2O3的含量时,将As2O3溶于NaOH溶液,处理为AsO43-,然后形成Ag3AsO4沉淀,过滤,洗涤,将沉淀溶于HNO3后,再以AgCl形式沉淀和称重,则换算因数表示为________________。
2. 某显色剂R与金属离子M和N分别形成有色络合物MR和NR,在某一波长测得MR 和NR的总吸光度A为0.630。
已知在此波长下MR 的透射比为30%, 则NR的吸光度为_________。
3 某人用HCl标准溶液来标定含CO32-的NaOH溶液(以甲基橙作指示剂),然后用NaOH 溶液去测定某试样中HAc,得到的w(HAc)将会_______。
又若用以测定HCl-NH4Cl溶液中的w(HCl),其结果会_________。
(填偏高、偏低或无影响)4. 以下滴定应采用的滴定方式分别是:(填A,B ,C ,D)(1) 佛尔哈德法测定Cl- ____(2) 甲醛法测定NH4+ ____(3) KMnO4法测定Ca2+ ____(4) 莫尔法测定Cl- ____(A)直接法(B)回滴法(C)置换法(D)间接法5.测得某溶液pH值为2.007,该值具有______位有效数字,氢离子活度应表示为______________。
二、选择题( 共10题20分)1. 下列有关总体平均值的表述中正确的是----------------------------------------------------()(1)随机变量有向某个中心值集中的趋势(2)无限多次测定的平均值既为总体平均值(3) 总体平均值就是真值(4) 正态分布的总体平均值为零(A )1,2 (B)3,4 (C)1,3 (D)2,42.用PbS 作共沉淀载体,可从海水中富集金。
现配制了每升含0.2µgAu 3+的溶液10L,加入足量的Pb 2+,在一定条件下,通入H 2S,经处理测得1.7µgAu 。
历届无机及分析化学统考试题

附录一历届无机及分析化学统考试题农业系2006级专业无机及分析化学试题(A)一、填空题:(20分,每空1分)1、0.1mol/L NH4Ac溶液的pH值是。
(HAc与NH3²H2O的解离常数相近,均为1.76³10-5)。
2、酸的浓度是指和酸的浓度之和;酸的强度是指因不同而有强酸和弱酸之分;酸度是指。
3、在下列平衡体系中:3H2(g)+N2(g)=2NH3(g)Δr Hθ(反应热)=-92.2KJ/mol(1)增加H2的浓度或分压,平衡向移动;(2)减小NH3的浓度或分压,平衡向移动;(3)增加体系总压力,平衡向移动;(4)升高体系温度,平衡向移动。
4、Na2[Cr(CO)5]命名为。
5、3.136÷24.05+195.81³3.583³10-4-0.00095=。
6、佛尔哈德法是以为指示剂的银量法,莫尔法是以为指示剂的银量法。
7、透光率为65%,吸光度为。
8、用强碱标准溶液直接滴定弱酸,可以准确滴定的条件是。
9、配位反应中EDTA的副反应主要有效应和干扰(共存)离子效应;金属离子的副反应主要有效应和效应。
10、由不同波长的光组合而成的光称;单一波长的光为。
二、选择题:将答案号填入下表(20分,每题2分)1、标准生成焓为零的物质为( )A. Cl2(l)B. Br2(g)C. N2(g)D.I2(g)2、醋酸铵在水中存在着如下平衡:NH3+H2O=NH4++ OH- ---K1HAc+H2O=Ac- + H3O+---K2NH4+ + Ac- =HAc+ NH3 ----K32H2O=H3O+ + OH- ---K4以上四个反应平衡常数之间的关系是( )A. K3=K1K2K4B. K4=K1K2K3C. K3K2=K1K4D. K3K4=K1K23、下列关于催化剂作用的叙述中错误的为( )A.可以加速某些反应的进行B.可以抑制某些反应的进行C.可以使正逆反应速度以相等的速度加快D.可以改变反应进行的方向4、欲配制pH=6.50的缓冲溶液,用下列何种酸最好( )A.(CH3)2AsO2H (K a=6.40³10-7)B.ClCH2COOH (K a=1.40³10-3)C.CH3COOH (K a=1.76³10-5)D. HCOOH (K a=1.77³10-4)5、下列电极反应,其它条件不变时,将有关离子浓度减半,电极电势增大的是( )+2e-=2I- C. Fe3++e-=Fe2+A. Cu2++2e-=CuB. I2D. Sn4++2e-=Sn2+6、用电子分析天平(精度为0.1mg)准确称取碳酸钙0.12~0.15克,用(1+1)盐酸溶解后,定容100毫升。
期末考试试卷A

2005 —2006 学年第一学期化学系化学专业《分析化学A》试卷A班级学号姓名一、单项选择题(在每小题的四个备选答案中,选出一个最佳答案,共15小题,每小题2分,共30分)1、下列滴定分析操作中会产生系统误差的是……………………()A、指示剂选择不当B、样品溶解不完全C、所用蒸馏水质量不高D、称量时天平平衡点有±0.1mg的波动2、分析SiO2的质量分数得到两个数据:35.01%,35.42%,按有效数字运算规则,其平均值为………………………………………………()A、35.215%B、35.22%C、35.2%D、35%3、用邻苯二甲酸氢钾为基准物质标定0.1000mol·L-1NaOH溶液时,欲使滴定时消耗NaOH溶液20~30mL,应称取基准物质为…………()(邻苯二甲酸氢钾的分子量Mr=201.2)A、0.2gB、0.2~0.4gC、0.4~0.6gD、0.4~0.8g4、用NaOH标准溶液滴定0.10 mol·L-1HCl和0.10mol·L-1H3PO4混合液,在滴定曲线上出现的突跃为……………………………………()A、1个B、2个C、3个D、4个5、用0.1mol·L-1NaOH标准溶液滴定0.1mol·L-1HCl溶液的pH突跃范围为4.30~9.70,若用1.0mol·L-1NaOH标准溶液滴定1.0mol·L-1HCl 溶液的pH突跃范围为………………………………………………()A、2.30~9.70 B、3.30~10.70C、4.30~10.70D、5.30~8.706、某碱液25.00mL,以0.1000mol·L-1HCl标准溶液滴定至酚酞褪色,用去15.28mL,再滴加入甲基橙继续滴定,又耗去HCl6.50mL,此碱液的组成是……………………………………………………………………()(A)Na2CO3(B)NaHCO3(C)NaOH+NaHCO3(D)NaOH+Na2CO37、用EDTA直接滴定有色金属离子,终点所呈现的颜色是………()A、指示剂与金属离子络合物的颜色B、游离指示剂的颜色C、EDTA与金属离子络合物的颜色D、上述B与C的混合色8、络合滴定中酸效应曲线是根据下面哪种关系进行绘制的………()A、pH-lgK MYB、pH-lgK′MYC、pH-lgα(M)D、pH-V EDTA9、当两电对的电子转移数均为2时,为使反应的完全程度达到99.9%,两电对的条件电位至少应大于………………………………………()A、0.09VB、0.18VC、0.27VD、0.36V10、在用K2Cr2O7法测定Fe2+时,加入H3PO4的目的主要是……()A、提高酸度,使滴定反应趋于完全B、有利于形成Hg2Cl2白色丝状沉淀C、提高Fe3+/Fe2+电对的电位,使二苯胺磺酸钠在突跃范围内变色D、降低Fe3+/Fe2+电对的电位,使二苯胺磺酸钠在突跃范围内变色11、下列试样中的氯在不另加试剂的情况下,可用莫尔法直接测定的是………………………………………………………………………()A、FeCl3B、BaCl2C、NaCl+Na2SD、NaCl+Na2SO412、用重量法测定试样中的砷,首先使其形成Ag3AsO4沉淀,然后转化为AgCl,并以此为称量形式,则用As2O3表示的换算因数为……()A、Mr(As2O3)/Mr(AgCl) B、2Mr(As2O3)/3Mr(AgCl)C、3Mr(AgCl)/Mr(As2O3)D、Mr(As2O3)/6Mr(AgCl)13、用(NH4)2C2O4沉淀Ca2+时,若试液中含有Mg2+,为了提高Ca2C2O4沉淀的纯度,应采取的措施是…………………………………………()A、缩短陈化时间,并再沉淀一次B、在加热情况下,慢慢滴加稀(NH4)2C2O4C、采用均匀沉淀法,并延长陈化时间D、沉淀时加强搅拌,并增加洗涤次数14、以下说法错误的是………………………………………………()A、摩尔吸光系数ε随浓度增大而增大B、吸光度A随浓度增大而增大C、透射比T随浓度增大而减小D、透射比T随比色皿加厚而减小15、一有色溶液对某波长光的吸收遵循朗伯-比尔定律,当选用2.0cm的比色皿时,测定的透光度为T,若改用 1.0cm的比色皿,则吸光度应为………………………………………………………………………()A、2TB、T1/2C、T2D、T/2二、填空题(本大题20空 ,每空1分,共20分)1、分析某试样允许测定的相对误差为1%,若试样称取量为2g左右,则应称至小数点后位,记录应保留位有效数字。
05-06学年中国药科大学第一学期分析化学期末试卷(AB卷)

05-06学年中国药科大学第一学期分析化学期末试卷(AB卷)中国药科大学分析化学(一)期末试卷(A 卷)得分评卷人一、填空题(每空╳分,共30 分)1、定量分析中,___________ 误差影响测定结果的准确度,___________ 误差影响测定结果的精密度。
2、0.05020是___________位有效数字,2.30 x 10 -4 是___________位有效数字。
3、滴定分析的化学反应必须具备的条件是___________、___________、___________。
4、C mol/L的Ag(NH3)2 + 溶液的质量平衡式是___________ 。
5、酸碱指示剂的变色范围大约是___________个pH 单位,变色范围与pKHIn 的关系是___________。
6、已知MNaOH=40.00g/mol,0.60g/LNNaOH溶液的pH=___________。
7、根据酸碱质子理论,___________为碱,___________为酸。
8、配位滴定中,准确滴定的条件为___________.9、直接碘量法要求溶液的pH值___________,间接碘量法要求溶液的酸度是___________。
10、影响沉淀的主要因素是___________、___________。
11、永停滴定法中使用的电极是___________,是以___________判断终点。
12、E-V 曲线及ΔE/ΔV –V曲线中___________对应的是化学计量点的体积。
13、玻璃电极转换系数S 的表示形式是___________。
14、Lambert-Beer 定律是描述___________与___________和___________的关系,它的数学表达形式是___________。
15、可见紫外分光光度计的光源,可见光区用___________,吸收池可用___________材料的吸收池,紫外光区光源用___________,吸收池必须用___________材料的吸收池。
分析化学a考试题及答案解析

分析化学a考试题及答案解析一、选择题(每题3分,共30分)1. 下列哪种物质不属于分析化学研究范畴?A. 离子B. 分子C. 原子D. 恒星答案:D2. 色谱法中,固定相和流动相的作用是什么?A. 固定相用于分离,流动相用于洗脱B. 固定相用于洗脱,流动相用于分离C. 固定相和流动相都用于分离D. 固定相和流动相都用于洗脱答案:A3. 质谱分析中,质荷比(m/z)表示的是:A. 质量与电荷的比值B. 电荷与质量的比值C. 质量与电荷的乘积D. 电荷与质量的乘积答案:A4. 酸碱滴定中,滴定终点的判断依据是:A. 溶液的pH值B. 溶液的颜色变化C. 溶液的电导率变化D. 溶液的密度变化答案:B5. 在原子吸收光谱分析中,基体效应是指:A. 样品基体对分析元素吸收的影响B. 分析元素对样品基体吸收的影响C. 样品基体对分析元素发射的影响D. 分析元素对样品基体发射的影响答案:A6. 红外光谱中,振动频率与化学键的强度关系是:A. 振动频率越高,化学键越强B. 振动频率越高,化学键越弱C. 振动频率越低,化学键越强D. 振动频率越低,化学键越弱答案:C7. 电位分析法中,参比电极的作用是:A. 提供一个恒定的电位参考B. 测量样品的电位C. 测量样品的电流D. 测量样品的电阻答案:A8. 紫外-可见光谱分析中,最大吸收波长与分子中哪种结构有关?A. 共轭双键B. 非共轭双键C. 单键D. 碳碳单键答案:A9. 核磁共振氢谱中,化学位移的单位是:A. 赫兹(Hz)B. 特斯拉(T)C. 部分每百万(ppm)D. 秒(s)答案:C10. 元素分析中,碳、氢、氮、硫分析的常用方法是:A. 原子吸收光谱法B. 红外光谱法C. 质谱法D. 元素分析仪法答案:D二、填空题(每空2分,共20分)1. 分析化学中,灵敏度是指分析方法能够检测到的_________。
答案:最小量2. 在滴定分析中,滴定误差通常与_________成正比。
2006级分析化学期末试卷A卷

C.掩蔽反应D.诱导反应
20.某有色物浓度为c1,在波长λ1处用厚度为1cm的吸收池测量,求得摩尔吸光系数为κ1;该有色物浓度为3c1时,在λ1处用厚度为3cm的吸收池测量,求得摩尔吸光系数为κ2,则它们的关系是
A.κ1=κ2B.κ1>κ2C.κ1<κ2D.κ2=3κ1
二、填空题(每空1分,共30分)
A.氢火焰离子化检测器B.热导池检测器
C.电子俘获检测器D.火焰光度检测器
17.如果色谱柱固定相用量增加1倍,其他条件不变时,样品的调整保留时间将
A.增大B.减小
C.不变D.先减小再增大
18. IUPAC规定标准氢电极的电极电位为
A.1.0000V B.0.0000V
C.未规定D.由实验确定
19.用KMnO4滴定Fe2+时Cl-的氧化反应速度被加速,此现象称为
C.分配系数小的D.上述都不是
7.对于一个化学反应aA+bB==cC+dD,A为被测组分,B为标准溶液,则滴定度 与标准溶液物质的量浓度c的关系为:
A. C.
B. D.
8.当M和N离子共存时,欲以EDTA滴定其中的M离子,当 时,要准确滴定M,则要求ΔlgK值为:
A.4B.5C.6D.7
9.液-液萃取过程的本质可表述为:
A.邻二氮菲B.HClC.HAcD.H3PO4-H2SO4
12.氯离子选择电极与Cl-浓度呈能斯特响应,其电极电位随试液中Cl-浓度A.增加而增加B.增加而减少
C.减少而减少D.无变化
13.光度分析中,在某浓度下以0.1cm吸收池测定透光度为T。若浓度增大1倍,透光度为:
A.T2B.T/2C.2TD.
1.采用电位法测Βιβλιοθήκη 牙膏中F-含量时,加入总离子强度调节缓冲液的作用是:
06级英文版分析化学期末考试试卷A

第2页
---------------------------------------装---------------------------------------订-------------------------------------------线-----------------------------------------------
0.10 molL H2SO4 and 0.10 molL H3PO4, observed on the titration curves. A. 1 B. 2 C. 3
-1 -1
________end points could be
(
D. 4
)
2. Which one of the following is a pair of conjugate acid and base? ( ) 2232A. H2CO3—CO3 B. HPO4 —PO4 C. H3PO4—HPO4 D. NH3-NH3.H2O 3. The solubility of Ag2S in pure water is________(KSPAg2S=2.0×10-48)
15. When a coagulated colloidal precipitate is re-dispersed during the washing step, this process is known as_____ ( ) A. digestion B. reprecipitation C. occlusion D. peptidization E. none of these II Fill in the blanks with the right answers (2 points per question, 20%) 1. When an analyte solution has an absorbance of 0.752 (A=0.752), the transmittance of it is . 2. Please write down the proton- balance equation of c mol.L-1 NH4H2PO4 aqueous solution__________________________________________. 3. The pH range of an indicator with an acid dissociation constant of 1.0 ×10-8 is . 4. The three general methods for performing EDTA titrations are __________, _________________and _________________. 5. 0.0100molL-1 Ce4+ standard solution was used to titrate 50 ml of 0.0100molL-1 Fe2+ aqueous solution. The potential of the system is____________when half of the Fe2+ solution was titrated. E0'Ce4+/ Ce3+ =1.44V,E0'Fe3+/ Fe2+=0.68V. 6. When potassium permanganate was used to titrate Ca2+ or Fe2+, and HCl was used to adjust pH of the system, the result would_________(larger/smaller). The reason for this phenomena is ____________________________ 7. The particle size of a precipitate is influenced by the experiment variables such as _________, ____________, _____________and ________________. The net effect of these variables can be accounted for, at least qualitatively, a single property of the system called ___________. 8. The pH of an acetic acid solution (HC2H3O2) with Cm = 0.100 M, Ka = 1.75 ×10-5 is _________. 9. During the complex titration, KMY' _____________(decrease, increase or not change ) with the decrease of pH. Consequently, the change in p-function observed in the equivalence region is _________(larger, smaller or not change). 10. To eliminate the interference of Fe(II), Al(III) and other cations during the analysis of SO42-, the solution should be passed through a column containing a _______________(cation, anion or neutral ) exchange resin. 第3页
《 分析化学 》课程期末考试试卷 (1)

《分析化学》课程期末考试试卷一.单选题。
每题1分,共20分。
1、根据“四舍六入五留双”的修约原则,下列哪项是错误的() [单选题] *A、保留五位有效数字:7.28355→7.2836B、保留四位有效数字:17.4551→17.45(正确答案)C、保留三位有效数字:2.005→2.00D、保留四位有效数字:14.446→14.45E、保留四位有效数字:15.0250→15.022、下列哪种情况应采用返滴定法() [单选题] *A、用AgNO3标准溶液测定NaCl试样含量B、用HCl标准溶液测定Na2CO3试样含量C、用EDTA标准溶液测定Al3+试样含量(正确答案)D、用Na2S2O3标准溶液测定K2Cr2O7试样含量E、用EDTA标准溶液测定骨钙3、下列各项所造成的误差那一项属于系统误差() [单选题] *A、滴定管的读数15.05ml记为15.50mlB、滴定时温度有变化C、称重时天平的平衡点有变动D、用1:10的HCl代替1:1的HCl(正确答案)E、滴定过程中有溶液溅出4、下列滴定分析法的特点哪一项是错误的() [单选题] *A、操作简便、快速B、应用范围广C、准确度高D、可测痕迹量组分(正确答案)E、相对误差可达到0.1%5、强碱滴定强酸时,浓度均增大10倍,则滴定突跃范围将() [单选题] *A、增大0.5个pH单位(正确答案)B、增大1个pH单位C、增大1.5个pH单位D、增大2个pH单位E、不变6、将pH=1和pH=14的两种强电解质溶液按等体积混合,混合溶液pH为() [单选题] *A、1B、7C、7.5D、13E、13.65(正确答案)7、配制HClO4-冰醋酸溶液要加入计算量的醋酐,其目的是() [单选题] *A、增大样品溶解能力B、增大样品的酸碱性C、除去HClO4冰醋酸中的水分(正确答案)D、增大突跃范围使终点敏锐E、增强溶剂的区分(均化)效应8、在EDTA标准溶液的标定过程中采用的缓冲溶液是() [单选题] *A、醋酸-醋酸盐缓冲溶液B、磷酸-磷酸盐缓冲溶液C、硼酸-硼酸盐缓冲溶液D、枸橼酸-枸橼酸钠缓冲溶液E、氨-氯化铵缓冲溶液(正确答案)9、EDTA在什么酸度下主要以Y4-的形式存在() [单选题] *A、pH<2.0B、pH=2.7-6.2C、pH=2.0-2.7D、pH=6.2-10.2E、pH>10.2(正确答案)10、标定Na2S2O3标准溶液,常用下列何种基准物质() [单选题] *A、重铬酸钾(正确答案)B、铬酸钾C、草酸D、碳酸钠E、高锰酸钾11、引起酸差的溶液,其pH() [单选题] *A、pH<1(正确答案)B、pH>1C、pH>9D、pH<9E、pH<212、能级跃迁所需能量最小的是() [单选题] *A、σ→σ*B、σ→π*C、π→π*D、n→σ*E、n→π*(正确答案)13、激发光、荧光、磷光三者的波长关系正确的是() [单选题] *A、λ激发光>λ荧光>λ磷光B、λ激发光<λ荧光<λ磷光(正确答案)C、λ激发光=λ荧光=λ磷光D、λ激发光>λ磷光>λ荧光E、λ磷光>λ激发光>λ荧光14、在一般的质谱图上出现非整数质核比的峰,它可能是() [单选题] *A、分子离子峰B、碎片离子峰C、亚稳离子峰(正确答案)D、同位素峰E、同位素峰或碎片离子峰15、红外光谱上的特征区的波数范围是() [单选题] *A、4000~1300cm-1(正确答案)B、3000~1300cm-1C、2000~1300cm-1D、1375~720cm-1E、1300~400cm-116、在CH3CH2CH3 的高分辨NMR谱上,CH2质子的吸收峰分裂为() [单选题] *A、三重峰B、四重峰C、六重峰D、七重峰(正确答案)E、八重峰17、某化合物的质谱图中,检测出分子离子峰的质荷比m/z为115,化合物含有() [单选题] *A.偶数个氮原子B、奇数个氮原子(正确答案)C.任意数目的氮原子D.没有氮原子E、都不对18、对称峰的拖尾因子符合要求的范围是() [单选题] *A、0.85~1.15B、0.90~1.10C、0.95~1.05(正确答案)D、0.99~1.01E、0.2~0.819、用气相色谱法进行定量时,要求混合物中每一个组分都出峰的是() [单选题] *A、外标法B、内标法C、内标对比法D、归一化法(正确答案)E、外标一点法20、高效液相色谱法的定性指标是() [单选题] *A、峰面积B、保留时间(正确答案)C、半高峰宽D、峰高E、标准偏差二、判断题(每题2分,共30分)1、定量分析中,系统误差影响测定结果的精密度,偶然误差影响测定结果的准确度。
2006-2007《分析化学》期末考试试卷(B)

2006-2007《分析化学》期末考试试卷(B)二、回答问题(每题6分,共42分,写试卷纸上)1.已知某NaOH标准溶液吸收了二氧化碳,有部分NaOH变成了Na2CO3。
用此NaOH 溶液测定HCl的含量,以甲基红为指示剂,对测定结果有何影响,为什么?若使用酚酞作指示剂又如何。
2.什么是配合物的条件稳定常数和配位反应的副反应系数,它们之间的关系如何?3.电对的条件电势大小与哪些因素有关?4.吸光光度法中透光率和吸光度的关系式是什么?5.解释下列现象:(1) 用KMnO4滴定C2O42-时,滴入KMnO4的红色消失速度由慢到快;(2) 间接碘量法测铜时,若试液中有Fe 3+ 和AsO43-,它们都可将I-氧化成I2,加入NH4HF2可消除两者的干扰,解释其中原因。
6.用吸光光度法测定某一金属离子,共存离子组分会干扰,有哪些办法可以消除干扰?7.有一新有机显色剂为弱酸,采用吸光光度法测定其离解常数,请阐述理论依据和测定过程。
三、计算题(每题8分,共32分)1.二元弱酸H2B,已知pH=1.92时,δH2B =δHB-;pH=6.22时δHB-=δB2-。
计算:(1)H2B的K a1和K a2。
(2)如果以0.100 mol/L的NaOH溶液滴定0.100 mol/L的H2B,滴定至第一和第二化学计量点时,溶液的pH值各为多少?各选用何种指示剂?2. 25.00mL KI溶液,用10.00mL 0.0500mol/L KIO3溶液处理后,煮沸溶液除去I2。
冷却后加入过量KI溶液使之与剩余KIO3反应,然后将溶液调整至中性。
析出的I2用0.1008mol/L Na2S2O3溶液滴定,消耗21.14mL,求原KI溶液的浓度(10分)。
3.某矿石含铜约0.12%,用双环己酮草酰二腙显色光度法测定。
试样溶解后转入100ml容量瓶中,在适宜条件下显色,定容.用1cm比色皿,在波长600nm测定吸光度,要求测量误差最小,应该称取试样多少克?ε=1.68×104(L·mol-1·cm-1),M Cu=63.5)4.用有机溶剂从100mL水溶液中萃取某药物成分A两次,每次用有机溶剂10mL,欲使总萃取率达99%以上, 则A在两相中的分配比D应为多大? 萃取完后将有机相合并,用等体积水洗涤一次, 则将损失多大比例?(不考虑溶液中的其它因素影响)一.填空(每空1分,共26分,写在试卷上)1. 将0.20mol/LSO42-和0.10mol/LBa2+等体积混合,欲通过加动物胶(p Ka1=2.0,p K a2=8.5 )促其凝聚,这时沉淀溶液的pH值应为___小于2.0______。
分析化学试卷及答案A

内蒙古农业大学2005—2006学年度第一学期期末考试《分析化学》试题(A)一.选择正确答案(每空1分、共30分)1.下列仪器需用所装溶液润洗三次的是。
A. 滴定管B. 容量瓶 C .锥形瓶 D. 量筒2.比较滴定时,用NaOH标准溶液滴定HCl,若NaOH滴定速度过快,且一到终点立即读数,将使HCl溶液的浓度。
A. 偏高B. 偏低C. 无影响D. 可能偏高或偏低3.当电子天平的零点偏离较大时,应调节的部件是________。
A.天平水平 B. 去皮按键 C. 回零按键 D.增量按键4.用硼砂(Na2B4O7·10H2O式量381.4) 标定0.1mol·L-1的HCl溶液,宜称取此基准物的重量为__________.A. 0.1~0.2克B. 0.4 ~ 0.6克C. 0.6 ~ 0.8克D. 0.8 ~ 1.0克5.使用碱式滴定管进行滴定的正确操作方法是__________.A. 左手捏于稍低于玻璃珠的地方B. 左手捏于稍高于玻璃珠的地方C. 右手捏于稍低于玻璃珠的地方D. 右手捏于稍高于玻璃珠的地方6. 用甲醛法测定工业(NH4 )2SO4(其摩尔质量为132g/mol )中的NH3(摩尔质量为17.0g/mol )的含量.将试样溶解后用250ml容量瓶定容,移取25ml用0.2 mol·L-1的NaOH标准溶液滴定,则试样称取量应为__________.A. 0.13 ~ 0.26克B.0.3 ~ 0.6克C. 0.5 ~ 1.0克D. 1.3 ~2.6克D. 2.6 ~5.2克7.按质子理论, Na2HPO4是________.A. 中性物质B. 酸性物质C. 碱性物质D. 两性物质8.某试样为NaOH和Na2CO3的混合物,用HCl标准溶液滴定.先以酚酞为指示剂,耗去HCl溶液V1ml ,继续以甲基橙为指示剂,又耗去HCl溶液V2ml ,则V1与V2的关系为_________.A. V1 = V2B. V1 = 2V2C. 2V1 = V2D. V1 >V2E. V1 < V29.某0.1mol·L-1的HCl溶液约含有0.1mol·L-1NH4Cl(k b,NH3=1.8×10-5)今欲测定其中的HCl的含量,用0.1 mol·L-1的NaOH标准溶液滴定,应选用的指示剂为_______.A. 甲基橙( pK=3.4)B. 甲基红(pK=5.0 )C. 百里酚兰(pK=8.9 )D.酚酞(pK=9.1)10.有关EDTA的酸效应,下列叙述正确的是_________.A.酸效应系数越小,配合物的稳定性越大B.PH值越大,酸效应系数越大.C.酸效应系数越大,配位滴定曲线的PM突跃范围越大.D.酸效应曲线表示的是各金属离子能够准确滴定的最高PH值.11.在测定自来水总硬度时, 如果用EDTA测定Ca2+时, 为了消除Mg2+干扰,实验中常采用的最简便的方法是________.A. 沉淀掩蔽法B. 配位掩蔽法C. 氧化还原掩蔽法D. 离子交换法12.在1moI•L-1HCl介质中,用FeCl3(φFe3+/Fe2+=0.77V)滴定SnCl2(φsn4+/sn2+)=0.14V),理论终点时的电位是。
06级《分析化学》试卷(A、B)2

《分析化学》课程试卷(A卷)本试卷用于生化系2006级化学、化工、食品、生物专业本科学生(时量:120分钟总分100分)注意:1、答案必须填写在答题纸上,填写在试卷上的无效。
2、答卷必须写明题目序号,并按题号顺序答题。
3、请保持行距,保持卷面整洁。
一、填空题(每空1分,共30分)1、定量分析的任务是测定物质中某种或某些组分的____。
试样定量分析一般包括以下几个步骤:____, ____,____, 干扰组分的分离, ____, ____及分析结果的表示。
2、准确度是指————与————之间符合的程度,两者差值越小,分析结果准确度———。
准确度的高低用————来衡量。
3、滴定分析通常用于测定组分含量在————组分,相对误差一般在————±。
4、用高锰钾法滴定Na2C2O4溶液时,KMnO4既是____剂,又是____剂。
滴定至____色并保持30秒不褪即为终点。
终点时溶液颜色越深,滴定误差越____。
5、有色物质溶液的光吸收曲线是以____为横坐标,以____为纵坐标绘制;而标准曲线(又称工作曲线)是以标准溶液的____为横坐标,以____为纵坐标绘制。
6、系统误差又称可测误差,是由某些____原因所造成的,它决定分析结果的____。
系统误差的性质(特点)是:①____;②____;③____。
随机误差又称偶然误差,是由一些____原因造成的,它决定分析结果的____。
随机误差具有的特点是:①____;②____;③____。
二、选择题(每题2分,共20分)1、配制标准溶液,量取浓盐酸合适的量器是()。
A、容量瓶;B、移液管;C、量筒:D、滴定管。
2、在以下论述中正确的是()。
A、精密度高,准确度一定高;B、准确度高,精密度一定高;C、精密度高,系统误差一定小;D、在分析中,首先要求准确度,其次才是精密度。
3、物质的量浓度简称浓度,是指()。
A、单位体积的溶液中所含某溶质的质量;B、单位质量的溶液中所含某溶质的质量;C、单位质量的溶液中所含某溶质的物质的量;D、单位体积的溶液中所含某溶质的物质的量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6. 色谱分离依据的是被分离物质在两相中的分配系数不同,那么,首先流出色谱柱的组分是:A .分配系数大的B .分配比大的C .分配系数小的D .上述都不是7. 对于一个化学反应aA+bB== cC+dD ,A 为被测组分,B 为标准溶液,则滴定度B /A T 与标准溶液物质的量浓度c 的关系为: A .1000M c a b T AB B /A ⋅=C .1000M c T A B B /A = B .1000M c b a T A B B /A ⋅=D .1000Mc b a T B A B /A ⋅= 8. 当M 和N 离子共存时,欲以EDTA 滴定其中的M 离子,当N M C 101C =时,要准确滴定M ,则要求ΔlgK 值为:A .4B .5C .6D .7 9. 液-液萃取过程的本质可表述为:A .金属离子形成螯合物的过程;B .金属离子形成离子缔合物;C .配合物进入有机相的过程;D .将物质由亲水性转变为疏水性的过程。
10. 下面哪一个条件不利于获得纯净而易于分离和洗涤的晶形沉淀:A .在稀溶液中沉淀B .在热溶液中沉淀C .快速沉淀D .陈化11. 在含有Fe 3+和Fe 2+的溶液中,加入下列何种溶液,Fe 3+/Fe 2+电对的电位将降低(不考虑离子强度的影响): A .邻二氮菲B .HClC .HAcD .H 3PO 4-H 2SO 412. 氯离子选择电极与Cl -浓度呈能斯特响应,其电极电位随试液中Cl -浓度A .增加而增加B .增加而减少C .减少而减少D .无变化13. 光度分析中,在某浓度下以0.1cm 吸收池测定透光度为T 。
若浓度增大1倍,透光度为:A.T2B.T/2 C.2T D.T14.在电位法中作为指示电极,其电位应与待测离子浓度:A.成正比B.符合扩散电流公式的关系C.的对数成正比D.符合能斯特公式的关系15.用色谱法进行定量分析时,要求混合物中每一个组分都出峰的是:A.外标法B.归一化法C.内标法D.内加法16.在气相色谱分析中,为了测定农作物中含氯农药的残留量,应选用下列哪一种检测器:A.氢火焰离子化检测器B.热导池检测器C.电子俘获检测器D.火焰光度检测器17. 如果色谱柱固定相用量增加1倍,其他条件不变时,样品的调整保留时间将A.增大B.减小C.不变D.先减小再增大18. IUPAC规定标准氢电极的电极电位为A.1.0000V B.0.0000VC.未规定D.由实验确定19. 用KMnO4滴定Fe2+时Cl-的氧化反应速度被加速,此现象称为A.催化反应B.自动催化反应C.掩蔽反应D.诱导反应20. 某有色物浓度为c1,在波长λ1处用厚度为1cm的吸收池测量,求得摩尔吸光系数为κ1;该有色物浓度为3c1时,在λ1处用厚度为3cm的吸收池测量,求得摩尔吸光系数为κ2,则它们的关系是A. κ1= κ2B. κ1> κ2C. κ1<κ2D. κ2=3κ1二、填空题(每空1分,共30分)1.采用电位法测定牙膏中F-含量时,加入总离子强度调节缓冲液的作用是:(1)________ _______,(2)___ ___________,(3)___ ___________。
2.在银量法中,摩尔法的指示剂是__________,佛尔哈德法的指示剂为_________ _。
3.影响滴定曲线突跃范围的因素主要是:___ ________和___ 。
4.测定值与多次测定平均值的符合程度称为:___ _____________,用以说明各测定值________________。
5.判断难分离物质对在色谱柱中的分离情况,常用作为柱的总分离效能指标,一般主张用作为相邻两峰完全分离的标志。
6.用草酸钠标定KMnO4溶液,为了使反应定量及迅速进行,滴定时应注意控制___________、___ ________和_____ ______。
7.标定NaOH的基准物有________ ______和___________ _____。
8. 写出下列各换算因数计算式沉淀称量形式被测组分换算因数(NH4)3PO4.12MoO3 P2O5Fe2O3 Fe ___ _____ 9.吸光度测量条件的选择主要考虑:入射光波长,______ ___ __,______ _____三个方面。
10. 某NaAc试样,若将试样溶液流经阳离子交换柱则_______离子留在柱上,而_________在流出液中,可用____________直接滴定。
11.气相色谱法使用的热导池检测器,属于___________型检测器,是利用组分与流动相之间___________的差异而产生信号的。
12..符合比耳定律的有色溶液稀释时,其最大吸收峰的波长位置_________,峰高值_____。
13.氧化还原滴定法的指示剂有三种类型: 氧化还原指示剂、和。
14.配位滴定法中使用金属指示剂多数是双键物质不稳定,故常将金属指示剂与以1:99的比例混合、研磨均匀后使用。
15.电位分析法中用得最多的参比电极是。
三、判断题:(化学工程、制药工程学生只做前十题,其它专业的全做。
每题1分,对的打“√”,错的打“⨯”。
共20分)1.固体试样制备的一般程序是:破碎、过筛、混匀和缩分。
()2. 弱酸直接滴定的条件:cK a≥10-8。
否则,就不能被测定。
()3.分析测试结果精密度的高低可用重复性和再现性表示。
()4.试剂或实验用水存在被测物质或含杂质,可用参比溶液来校正。
()5.在分光光度法中,可以通过绘制工作曲线来确定某有色物质的最大吸收波长。
( ) 6.配位滴定曲线主要用来选择指示剂。
()7.高锰酸钾溶液的颜色较深,读取其体积时可以看其最高水平面。
()8.酸碱反应实质是物质间的质子转移,总的得失质子的物质的量应该相等。
()9.在沉淀重量法中,同离子效应将使沉淀的溶解度增大。
()10.离子选择性电极与金属基电极一样,能给出或得到电子。
( ) 11.对任何离子选择性电极的选择性系数Kij的要求是愈小愈好。
()12.溶液显黄色,那是因为溶液吸收了白光中的黄色波长的光。
()13.纸色谱中的固定相是滤纸中的纤维素。
( ) 14.分光光度法中吸光系数a 和摩尔系数κ的不同之处是用不同的参比溶液。
( )15.气相色谱检测器中,氢火焰检测器为质量型检测器。
( ) 16.配位滴定法中常用乙二胺四乙酸二钠盐配制标准溶液,因为其溶解度较大。
( ) 17.离子交换柱装柱的关键操作除了要均匀外,还要注意树脂床中不能夹杂有气泡。
( )18.沉淀重量法中,共沉淀是不利因素,但可利用该现象对微量组分进行富集。
( ) 19.在电化学分析中一定要采用标准氢电极为参比电极。
( )20.配制Na 2S 2O 3标准溶液时,常加入少量的Na 2CO 3(约0.02%)使呈微碱性。
( )四、计算题(本部分6小题,共30分)1. 食肉中蛋白质含量的测定,是将按下法测得N 的质量分数乘以因数6.25即得结果。
称2.000 g 干肉片试样用浓硫酸分解,直至存在的氮完全转化为硫酸氢氨。
再用过量的NaOH 处理,产生的NH 3吸收于50.00 mL H 2SO 4(1.00 mL 相当于0.01550 g Na 2O )中。
过量的酸需要用28.80 mL NaOH (1.00 mL 相当于0.1266 g 邻苯二甲酸氢钾)反滴定。
计算肉片中蛋白质的质量分数 ( Na 2O :62.00 N :14.01,本题6分)。
2. 将1克钢样中的铬氧化为Cr 2O 72-后,加入过量的0.05000mol ·L -1FeSO4溶液20.00mL ,然后以0.01006mol ·L -1的KMO4溶液返滴定,终点时消耗5.55mL ,求铬的质量分数.[Cr 的原子量为52.00](本题5分)3. 某药厂生产铁剂,要求每克药剂中含铁48.00m g.对一批药品测定5次,结果 为(mg ·g -1):47.44,48.15,47.90,47.93和48.03。
问这批产品含铁量是否合 格(P=0.95 t 0.95,4 =2.78 )?(本题5分)4. 称取土壤试样8.2020g ,用pH=8.2的醋酸钠溶液处理,离心,转移含钙的澄清液于100mL 容量瓶中,并稀释至刻度。
取50mL 该溶液用钙离子选择电极和饱和甘汞电极测得电动势为-20.0mV 。
加入3.851210-⋅⨯L mol - 25.0mL 的标准钙溶液,测得电动势0.0mV 。
计算Ca 的含量和每克土壤中Ca 的质量(假定加入标准钙溶液前后离子强度不变,)08.40,5.29==CaMmV S 。
(本题5分)5.分析某试样时,两种组分的相对保留值γ21=1.16,柱的有效塔板高度H=1mm ,需要多长的色谱柱才能将两组分完全分离?(本题4分)6. 用8-羟基喹啉氯仿溶液于pH=7.0时,从水溶液中萃取La 3+,已知它在两相中的分配比D=43,今取含La 3+的水溶液(1mg/mL )20.00 mL ,计算用萃取液10.0 mL 一次萃取和用同量萃取液分两次萃取后,水溶液中剩余的La 3+的质量。
(本题5分) 五、简答题:(化学工程、制药工程专业学生必做。
每小题5分,共10 分)1.叙述毛细管色谱与填充柱色谱的区别。
2.简述原子吸收光谱法的原理。
2008.1分析化学考试试卷(A)答案及评分标准一、(每题一分)1.D 11.D2.B 12.B3.B 13.A4.A 14.D5.B 15.B6.C 16.C7.B 17.A8.B 18.B9.D 19.D 10.C 20.A 二、填空题:(每空一分)1.(1)维持较大而稳定的离子强度(2)维持适宜的酸度 (3)掩蔽Fe 3+、Al 3+,消除干扰2. 铬酸钾,铁铵矾3. 浓度,离解常数4. 精密度,相接近的程度5. 分离度,R=1.56. 温度,酸度,速度7. 草酸,邻苯二甲酸氢钾8.34345212MoOPO )NH (O P 2MM ,32O Fe 2Fe 9. 参比溶液,吸光度读数范围10.Na +,HAc,酸碱滴定(或NaOH 标准溶液)11.浓度,热导系数12.不变,增大 13. 自身指示剂,专属指示剂 14. NaCl 15. 甘汞电极 三、(每题一分)1.√2.×3.√4.×5.×6.×7.√8. √9.× 10.× 11.√ 12.× 13.×14.× 15.√ 16.√ 17.√ 18.√ 19.× 20.√ 四、计算题 1.解:L mol M T c ONa O Na SO H SO H /2500.000.62100001550.01000224242/=⨯=⨯=(1.5分)L mol MT c KHPKHPNaOHNaOH /4500.022.20410001266.01000/=⨯=⨯=(1.5分)%509.8%100000.201.14)202880.005000.0(2%42=⨯⨯-=NaOHSO H C C N (2分)蛋白质%%19.5325.6%=⨯=N (1分)2.解)2(762146)2(4585233227223224分分O H FeCr H Fe O Cr O H FeMnHFeMnO++=++++=++++++-++++-%25.1%100000.15210)55.501006.0500.2005000.0(623Cr =⨯⨯⨯⨯⨯-⨯=ω-(1分)3. 解: 89.47503.4893.4790.4715.4844.471=++++==∑-i x nx (1分)27.015)14.0()04.0()01.0()26.0()45.0(22222=-++++=s (1分)41.027.0|00.4889.47|||=-=-=-sT x t (2分)t 0.95,4 =2.78 , t<t 0.95,4说明这批产品含铁量合格。
