亚硫酸钠的配制
甲醛的分析工序

甲醛的分析工序一、甲醛含量的测定1.原理甲醛与过量的亚硫酸钠反应生成氢氧化钠,反应式如下:HCHO+Na2SO3+H2O=NaOH+CH2(Na2SO3)OH2NaOH+H2SO4== Na2SO4 +H2O用百里香酚酞作指示剂,用1mol/L的硫酸标准溶液滴定生成的氢氧化钠,甲醛的量相当于反应生成的氢氧化钠的量2.试剂和溶液亚硫酸钠溶液配制:称取126克无水亚硫酸钠,用水溶解后稀释至1升,浓度时126g/L硫酸标准溶液:1mol/L百里香酚酞指示剂:1 g溶解在1L乙醇溶液中,浓度1 g/L3.步骤吸取75ml亚硫酸钠溶液置于250ml的锥形瓶中,加2~3滴百里香酚酞指示剂,再用1mol/L的硫酸标准溶液滴定蓝色变为无色,称取1克左右的(称准至0.0002g)甲醛试样,剧烈搅拌使其溶解,然后用1mol/L的硫酸标准溶液滴定,蓝色变为无色,记录消耗硫酸的体积。
计算公式:HCHO%=C×V×0.03003÷M×100%式中:V --滴定消耗硫酸标准溶液的体积C----滴定消耗硫酸标准溶液的浓度M----甲醛试样的质量g二.甲醛的酸度测定方法称取10g甲醛,将样品移至250ml的烧瓶中,加50ml水,装上回流冷凝管,加热混合物至沸腾,连续煮沸10分钟,用25ml水洗回流冷凝管,移开烧瓶并冷却至室温加入4滴溴百里香酚蓝,用0.1mol/L 的标准氢氧化钠滴定至浅蓝色计算公式:酸度% == C×V×0.046÷M×100%式中:V --滴定消耗氢氧化钠标准溶液的体积(毫升)C----氢氧化钠标准溶液的浓度,0.1mol/LM-----甲醛试样的质量g五.甲醛的灰分测定坩埚在马弗炉中约半小时灼烧至恒重,待冷却后,称约2g(精确准至0.0001g)甲醛放于马弗炉中,600℃下灼烧1~2小时至恒重,计算残渣质量百分含量。
灰分=(m烧─ m空坩埚)÷(m总─m空坩埚)×100%m总──称取甲醛和坩埚的总质量m空坩埚──空坩埚的质量m烧──样品在马弗炉中烧完冷却后的质量六.甲醛铁离子测定称10g甲醛,加50毫升水和4滴三乙胺,在一个接有冷凝器的圆底瓶中加热,直至充分溶解冷却至室温,移入100ml容量瓶中,然后(参照甲醛铁离子的测定步骤),用水稀释至刻度,摇匀,计算出甲醛中铁离子含量。
2020版《中国药典》试液配制操作规程

一、目的:建立试液配制规程,规定了试液的配制内容、方法与要求二、范围:适用于试液的配制操作三、职责:化验室对实施本规程负责四、内容:1、试液配制操作1.1氯化碘试液:取碘化钾0.14g与碘酸钾90mg,加水125ml使溶解,再加盐酸125ml,即得。
本液应置玻璃瓶内,密闭,在凉处保存。
1.2 N-乙酰-L-酪氨酸乙酯试液:取N-乙酰-L-酪氨酸乙酯24.0mg,加乙醇0.2ml使溶解,加磷酸盐缓冲液(取0.067mol/L磷酸二氢钾溶液38.9ml与0.067mol/L磷酸氢二钠溶液61.6ml,混合,pH值为7.0)2ml,加指示液(取等量的0.1%甲基红的乙醇溶液与0.05%亚甲蓝的乙醇溶液,混匀)lml,用水稀释至10ml,即得。
1.3乙醇制对二甲氨基苯甲醛试液:取对二甲氨基苯甲醛1g,加乙醇9.0ml与盐酸2.3ml使溶解,再加乙醇至100ml,即得。
1.4乙醇制氢氧化钾试液:可取用乙醇制氢氧化钾滴定液(0.5mol/L)。
1.5乙醇制氨试液:取无水乙醇,加浓氨溶液使每100ml中含NH39~11g,即得。
本液应置橡皮塞瓶中保存。
1.6乙醇制硝酸银试液:取硝酸银4g,加水l0ml溶解后,加乙醇使成l00ml,即得。
1.7乙醇制硫酸试液:取硫酸57ml,加乙醇稀释至1000ml,即得。
本液含H2SO4应为9.5%~10.5%。
1.8乙醇制溴化汞试液:取溴化汞2.5g,加乙醇50ml,微热使溶解,即得。
本液应置玻璃塞瓶内,在暗处保存。
1.9二乙基二硫代氨基甲酸钠试液:取二乙基二硫代氨基甲酸钠0.1g,加水l00ml溶解后,滤过,即得。
1.10二乙基二硫代氨基甲酸银试液:取二乙基二硫代氨基甲酸银0.25g,加三氯甲烷适量与三乙胺1.8ml,加三氯甲烷至l00ml,搅拌使溶解,放置过夜,用脱脂棉滤过,即得。
本液应置棕色玻璃瓶内,密塞,置阴凉处保存。
1.11二苯胺试液:取二苯胺1g,加硫酸l00ml使溶解,即得。
硫代硫酸钠溶液的配制与标定

硫代硫酸钠溶液的配制与标定一、硫代硫酸钠的介绍硫代硫酸钠(Na2S2O3)又称亚硫酸钠,是一种无色晶体或白色粉末,易溶于水,具有还原性和氧化性。
在化学实验室中广泛应用于分析化学、无机化学和有机化学等领域。
二、硫代硫酸钠溶液的配制1. 实验材料:- 硫代硫酸钠(Na2S2O3)固体- 蒸馏水2. 配制步骤:(1)称取适量的固体硫代硫酸钠(Na2S2O3),放入干净的烧杯中。
(2)加入少量蒸馏水,用玻璃棒搅拌均匀,使其完全溶解。
(3)将烧杯中的溶液转移到容量瓶中,并加入足够的蒸馏水至刻度线。
(4)用塞子将容量瓶塞好,并轻轻摇晃几次使其充分混合均匀。
三、硫代硫酸钠溶液的标定1. 实验材料:- 已知浓度的碘标准溶液- 淀粉溶液- 配制好的硫代硫酸钠溶液2. 标定步骤:(1)取一定量的硫代硫酸钠溶液,加入适量的淀粉溶液。
(2)用滴定管滴加碘标准溶液,直至出现明显的蓝色终点。
(3)记录滴定所用的碘标准溶液体积V1。
(4)重复以上步骤,至少进行三次滴定,并求出平均值。
(5)根据反应方程式:Na2S2O3 + 2I2 → Na2S4O6 + 2HI可以得到硫代硫酸钠与碘之间的化学计量关系为:1mol Na2S2O3 = 2mol I2因此,硫代硫酸钠的摩尔浓度C可以计算为:C = (V1×C1×n)/V2其中,V1为碘标准溶液体积,C1为碘标准溶液浓度,n为碘与硫代硫酸钠反应中所需的摩尔比例系数(n=2),V2为取样体积。
四、注意事项1. 在配制和标定过程中,应严格控制实验条件,确保实验结果的准确性和可靠性。
2. 在配制硫代硫酸钠溶液时,应先将固体完全溶解后再加入足够的蒸馏水至刻度线。
3. 在标定过程中,应先进行预实验,确定适当的滴定速度和滴定终点。
4. 滴定前应将所有玻璃仪器清洗干净,并用蒸馏水冲洗干净滴定管。
5. 实验结束后,应及时清理实验台面和仪器设备,并妥善处理废液和废弃物。
标准溶液配制

溶液配制标准溶液的配置与标定一、1N、0.5N、0.1N硫酸标准溶液1、配制1N硫酸标准溶液量取98%的浓硫酸280ml,慢慢倒入装有10L水瓶中,摇匀待标0.5N硫酸标准溶液量取98%的浓硫酸140ml,慢慢倒入装有10L水瓶中,摇匀待标0.1N硫酸标准溶液量取98%的浓硫酸28ml,慢慢倒入装有10L水瓶中,摇匀待标2、标定1)标定方法1N硫酸标准溶液吸取25ml1N碳酸钠基准液于250ml三角烧瓶中,加入2D0.05%甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。
0.5N硫酸标准溶液吸取10ml1N碳酸钠基准液于250ml三角烧瓶中,加入2D0.05%甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。
0.1N硫酸标准溶液吸取25ml1N碳酸钠基准液于250ml三角烧瓶中,加入2D0.05%甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。
2)计算N=N1*V1/V式中:V1-碳酸钠基准液用量 mlN1-碳酸钠基准液当量浓度V-消耗硫酸标准溶液的用量 ml二、10%、25%10%硫酸溶液量取98%的浓硫酸600ml,慢慢倒入装有10L水瓶中,摇匀待标25%硫酸溶液量取98%的浓硫酸1600ml,慢慢倒入装有10L水瓶中,摇匀待标2、标定1)标定方法10%硫酸溶液吸取配制好的10%的硫酸溶液5ml于250ml三角烧瓶中,加入3D甲基红指示剂,用1N的氢氧化钠标准溶液滴定,滴至由红色变为橙色即为终点。
(消耗的氢氧化钠标准溶液应在10.85ml以上,方可达到10%浓度)25%硫酸溶液吸取配制好的25%的硫酸溶液5ml于250ml三角烧瓶中,加入3D甲基红指示剂,用1N的氢氧化钠标准溶液滴定,滴至由红色变为橙色即为终点。
(消耗的氢氧化钠标准溶液应在30.05ml以上,方可达到10%浓度)2)计算N=1000*d*x%/E式中:d-所配硫酸的比重查表x%-所配硫酸百分比浓度E-硫酸的当量 g根据上式算出已配置硫酸溶液的当量浓度V1=N*V/ N1式中:N-计算出所配硫酸溶液的当量浓度N1-氢氧化钠标准溶液的当量浓度V-所取硫酸的用量 ml根据上式算出氢氧化钠标准溶液的用量三、1N盐酸标准溶液的配置1、配制量取36%的盐酸860ml,慢慢倒入装有10L水瓶中,摇匀待标2、标定吸取25ml1N碳酸钠基准液于250ml三角烧瓶中,加入2D0.05%甲基橙指示剂,用配制好的盐酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。
C41药水的配制

C-41药水怎样配C-41是老美的秘方儿啊···呵呵!C-41代用配方之一甲、彩色显影液(pH=10.2)试剂工作液补充液水800ml 800ml无水亚硫酸钠3g 4.4g碳酸钠28g 37g碳酸氢钠2g 2.5g硫酸氢钠1g 1.5g盐酸羟胺2g 2.5g溴化钠 1.5g 0.8g1‰碘化钾溶液2ml 2mlCD-4 4g 5.5g加水至1000ml 1000ml乙、漂白液(pH=6)试剂工作液补充液水700ml 700ml 乙二胺四乙酸二钠盐90g 120g无水碳酸钠34g 45g三氯化铁60g 80g溴化铵100g 130g硝酸钠35g 50g加水至1000ml 1000ml丙、定影液(pH=6.3~6.5)试剂工作液补充液水700ml 700ml硫代硫酸钠(海波)240g 320g无水亚硫酸钠20g 30g偏重亚硫酸钠18g 25g加水至1000ml 1000ml丁、稳定液试剂工作液补充液水800ml 800ml甲醛10ml 10ml表面活性剂(皂角素)1g 1g加水至1000ml 1000ml冲洗程序:工序名称温度(℃)时间彩色显影37.8±0.2 3′15〃漂白24~40 6′30〃水洗24~40 3′15〃定影24~40 6′30〃水洗24~40 3′15〃稳定24~40 1′30〃晾干C-41代用配方之二(日本写真工业推荐)甲、彩色显影液(pH=10.7)水750ml无水亚硫酸钠 1.2g无水碳酸钠12.8g溴化钾0.6g氢氧化钠 1.6g碳酸氢钠 1.35g硼砂6g6-硝基苯骈咪唑硝酸盐(0.2%)12mlCD-4(4-氨基N-乙基-N-β羟乙基-3甲苯胺单水硫酸盐) 3.2g 加水至1000ml乙、漂定液(pH=5.9)水750ml硫代硫酸铵100g无水亚硫酸钠7gEDTA铁钠100g加水至1000ml丙、稳定液湿润剂(10%溶液)2ml加水至1000ml冲洗程序:工序名称温度(℃)时间(分)彩色显影38 2水洗27~38 1漂定24~30 3水洗27~38 3稳定27~38 1晾干参考来源:《摄影技术教程》,徐兴国著,中国人民大学出版社。
常用试液及配制方法

常用试液及配制方法硫代乙酰胺试液取硫代乙酰胺4g,加水使溶解成100ml,置冰箱中保存。
临用前取混合液[由1mol/L氢氧化钠溶液15ml、水及甘油20ml组成],加上述硫代乙酰胺溶液,置水浴上加热20秒钟,冷却,立即使用。
硫代硫酸钠试液可取用硫代硫酸钠滴定液L)。
硫氰酸汞铵试液取硫氰酸铵5g与二氯化汞,加水使溶解成100ml,即得。
硫氰酸铵试液取硫氰酸铵8g,加水使溶解成100ml,即得。
硫酸汞试液取黄氧化汞5g,加水40ml后,缓缓加硫酸20ml,随加随搅拌,再加水40ml,搅拌使溶解,即得。
硫氰酸铬铵试液取硫氰酸铬铵,加水20ml,振摇1小时后,滤过,即得。
本液应临用新制。
配成后48小时即不适用。
硫酸亚铁试液取硫酸亚铁结晶8g,加新沸过的冷水100ml使溶解,即得。
本液应临用新制。
硫酸苯肼试液取盐酸苯肼60mg,加硫酸溶液(1→2)100ml使溶解,即得。
硫酸钙试液本液为硫酸钙的饱和水溶液。
硫酸钛试液取二氧化钛,加硫酸100ml,加热使溶解,放冷,即得。
硫酸钾试液取硫酸钾1g,加水使溶解成100ml,即得。
硫酸铜试液取硫酸铜,加水使溶解成100ml,即得。
硫酸铜铵试液取硫酸铜试液适量,缓缓滴加氨试液,至初生的沉淀将近完全溶解,静置,倾取上层的清液,即得。
本液应临用新制。
硫酸镁试液取未风化的硫酸镁结晶12g,加水使溶解成100ml,即得。
稀硫酸镁试液取硫酸镁,加水使溶解成100ml,即得。
氰化钾试液取氰化钾10g,加水使溶解成100ml,即得。
氯试液本液为氯的饱和水溶液。
本液应临用新制。
氯化三苯四氮唑试液取氯化三苯四氮唑1g,加无水乙醇使溶解成200ml,即得。
氯化亚锡试液取氯化亚锡,加水10ml与少量的盐酸使溶解,即得。
本液应临用新制。
氯化金试液取氯化金1g,加水35ml使溶解,即得。
氯化钙试液取氯化钙,加水使溶解成100ml,即得。
氯化钡试液取氯化钡的细粉5g,加水使溶解成100ml,即得。
亚硫酸钠溶液配制

亚硫酸钠溶液配制以下是亚硫酸钠溶液的一个配制示例:1.确定所需的浓度和体积:假设需要配制100 mL浓度为0.1 M的亚硫酸钠溶液。
2.计算所需的质量:通过摩尔浓度和体积可以计算出所需的质量。
亚硫酸钠的摩尔质量为约174.1 g/mol。
因此,计算所需的质量如下:质量(g)= 摩尔浓度(mol/L)× 摩尔质量(g/mol)× 体积(L)质量(g)= 0.1 mol/L × 174.1 g/mol × 0.1 L = 1.741 g3.准备实验室器材和试剂:准备100 mL容量瓶、称量仪器和亚硫酸钠(Na2SO3)固体。
4.称量固体:使用称量仪器精确称取所需的亚硫酸钠固体质量,即1.741 g。
5.配制溶液:将称取的亚硫酸钠固体加入100 mL容量瓶中,然后用去离子水或溶剂加满至刻度线。
6.摇匀溶液:轻轻摇晃容量瓶,使溶液均匀混合。
7.将溶液转移至需要的容器中,如密封瓶或试管,以便后续使用。
需要特别注意,在实验操作过程中,应遵循正确的实验室安全操作规程,佩戴适当的个人防护装备,并确保正确处理和处置化学废物。
此外,具体的配制步骤和计算公式可能因实验室、仪器和试剂供应商等因素而有所不同,建议参考相关实验室方法和指南进行准确的配制。
亚硫酸钠溶液在实验室和工业上有广泛的应用。
以下是亚硫酸钠溶液常见的用途:还原剂:亚硫酸钠溶液可以用作还原剂,具有强烈的还原性能。
它可用于还原某些金属离子或化合物,如还原醛、酮和硝酸等。
消毒剂:亚硫酸钠溶液具有较强的杀菌和消毒作用,常用于水处理、游泳池消毒、食品加工和酿造业等领域。
环境保护:亚硫酸钠溶液可用于废水处理过程中的脱色、脱臭和去除重金属等污染物质。
食品工业:亚硫酸钠溶液可用作食品添加剂,用于防止食品褐变、抗氧化和抑制微生物生长等。
药品工业:亚硫酸钠溶液用于制备某些药物,如硫酸肼和氢溴酸草酸等。
分析化学:亚硫酸钠溶液可用于分析化学中的一些反应,如还原滴定、催化剂还原和某些氧化反应。
碱性脱漆剂配方

碱性脱漆剂配方配方1碱性脱漆剂(一)亚硫酸钠0.30%硫酸钠0.20%硅酸钠000000肥皂0.20%水99.1%描述脱漆时一般要在本剂中浸泡10~30min。
配方2碱性脱漆剂(二)氢氧化钠77%碳酸钠10%多羟醇(山梨醇)5%甲酚钠5%表面活性剂(如脂肪酸皂、石油磺酸酯、磺化蓖麻油等)3%描述使用时取上述混合物6%~15%,用90℃以上的水(85%~94%)配制成水溶液。
此溶液脱漆质量好,对松香酯漆、醇酸漆效果较好,但对酚醛漆和乙烯漆则效果略差。
配方3碱性脱漆剂(三)磷酸钠25份硅酸钠12份肥皂3份重铬酸钾3份清水1800份描述配制时将水煮沸,按顺序将物料加入溶解,重铬酸钾分多次加入,每次不要加得太多。
配料完毕后,溶液的pH值不超过11。
在使用过程中,如pH值低于7时,则应加入磷酸钠15份,重铬酸钾1.5份,硅酸钠6份,肥皂1.5份来调整。
此溶液也适用于铝件上的脱漆。
配方4脱漆膏(一)氢氧化钠30份淀粉10份硅酸钠(水玻璃)30份浓氨水15份肥皂10份滑石粉5份配方5脱漆膏(二)氢氧化钠40份水15份水玻璃40份描述此为强碱型脱漆剂,具有成本低,不易燃的优点,用浸泡法特别有效。
但对有色金属特别是铝有腐蚀作用。
故不宜用于有色金属。
配方6钢件表面涂层脱除剂氢氧化钠85%硫酸钠6%葡萄糖酸钠5%甲酚3%直链烷基磺酸盐1%描述本剂用于脱除钢件表面的清漆和涂料,其效果极佳。
配方7磷化钢脱漆剂氢氧化钠80%碳酸氢钠11%葡萄糖酸钠5%苯甲酸2%松油1%十二烷基苯磺酸1%描述本脱漆剂成分简单,价格便宜,无毒。
适用于磷化钢表面旧漆的退除,使用温度为75-95℃。
配方8钢铁、镁合金脱漆剂氢氧化钠25%苯甲酸15%木质素磺酸钠5%水55%描述将各组分溶于水,混匀即成。
本品适用于钢铁、镁合金基体表面上旧漆层的脱除,使用温度为75-95℃。
配方9钢铁制品脱漆剂(一)氢氧化钠77%碳酸钠10%十二烷基苯磺酸3%山梨糖醇5%甲酚钠5%描述将各组分混合均匀即成。
na2s2o3标准溶液的配制

na2s2o3标准溶液的配制Na2S2O3标准溶液的配制。
Na2S2O3,也称亚硫酸钠,是一种重要的化学试剂,常用于分析化学和工业生产中。
其标准溶液的配制是化学实验中常见的操作,下面将详细介绍Na2S2O3标准溶液的配制方法。
首先,准备所需试剂和设备,亚硫酸钠固体、去离子水、容量瓶、烧杯、磁力搅拌器、移液器、天平等。
其次,按照所需浓度和体积计算所需的亚硫酸钠固体质量。
一般情况下,可以根据以下公式计算,C1V1=C2V2,其中C1为亚硫酸钠的浓度,V1为亚硫酸钠的体积,C2为标准溶液的浓度,V2为标准溶液的体积。
根据实际情况,确定C1、V1和C2,计算得到V2,即所需标准溶液的体积。
然后,取一定质量的亚硫酸钠固体,用天平称量,精确到毫克。
将称量好的亚硫酸钠固体放入烧杯中,加入适量的去离子水溶解,用磁力搅拌器搅拌至完全溶解。
接下来,将溶解好的亚硫酸钠溶液转移至预先清洁干燥的容量瓶中,用去离子水定容至刻度线。
在转移的过程中,要注意使用移液器,避免溶液的挥发和溶液的残留。
最后,用瓶塞封好容量瓶,轻轻摇匀标准溶液,使其浓度均匀。
标签上标明标准溶液的名称、浓度、配制日期等信息,以便日后使用。
需要注意的是,在配制标准溶液的过程中,要严格按照操作规程进行,避免操作失误和化学品的飞溅。
另外,在称量和转移溶液时,要使用精密的实验仪器,保证配制的准确性和精密度。
总之,Na2S2O3标准溶液的配制是一项常见但重要的化学实验操作,需要严格按照操作规程进行,确保配制出准确浓度的标准溶液。
希望本文的介绍能够对您有所帮助,谢谢阅读!。
标准溶液配制

溶液配制标准溶液的配置与标定一、1N、、硫酸标准溶液1、配制1N硫酸标准溶液量取98%的浓硫酸280ml,慢慢倒入装有10L水瓶中,摇匀待标硫酸标准溶液量取98%的浓硫酸140ml,慢慢倒入装有10L水瓶中,摇匀待标硫酸标准溶液量取98%的浓硫酸28ml,慢慢倒入装有10L水瓶中,摇匀待标2、标定1)标定方法1N硫酸标准溶液吸取25ml1N碳酸钠基准液于250ml三角烧瓶中,加入%甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。
硫酸标准溶液吸取10ml1N碳酸钠基准液于250ml三角烧瓶中,加入%甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。
硫酸标准溶液吸取25ml1N碳酸钠基准液于250ml三角烧瓶中,加入%甲基橙指示剂,用配制好的硫酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。
2)计算N=N1*V1/V式中:V1-碳酸钠基准液用量 mlN1-碳酸钠基准液当量浓度V-消耗硫酸标准溶液的用量 ml二、10%、25%10%硫酸溶液量取98%的浓硫酸600ml,慢慢倒入装有10L水瓶中,摇匀待标25%硫酸溶液量取98%的浓硫酸1600ml,慢慢倒入装有10L水瓶中,摇匀待标2、标定1)标定方法10%硫酸溶液吸取配制好的10%的硫酸溶液5ml于250ml三角烧瓶中,加入3D甲基红指示剂,用1N 的氢氧化钠标准溶液滴定,滴至由红色变为橙色即为终点。
(消耗的氢氧化钠标准溶液应在以上,方可达到10%浓度)25%硫酸溶液吸取配制好的25%的硫酸溶液5ml于250ml三角烧瓶中,加入3D甲基红指示剂,用1N 的氢氧化钠标准溶液滴定,滴至由红色变为橙色即为终点。
(消耗的氢氧化钠标准溶液应在以上,方可达到10%浓度)2)计算N=1000*d*x%/E式中:d-所配硫酸的比重查表x%-所配硫酸百分比浓度E-硫酸的当量 g根据上式算出已配置硫酸溶液的当量浓度V1=N*V/ N1式中:N-计算出所配硫酸溶液的当量浓度N1-氢氧化钠标准溶液的当量浓度V-所取硫酸的用量 ml根据上式算出氢氧化钠标准溶液的用量三、1N盐酸标准溶液的配置1、配制量取36%的盐酸860ml,慢慢倒入装有10L水瓶中,摇匀待标2、标定吸取25ml1N碳酸钠基准液于250ml三角烧瓶中,加入%甲基橙指示剂,用配制好的盐酸标准溶液滴定至橙色,煮沸5min,冷却后继续滴定至橙色为终点。
常用溶液的配制方法

分析化学常用溶液的配制方法乙醇制氢氧化钾试液可取用乙醇制氢氧化钾滴定液0.5mol/L。
乙醇制氨试液取无水乙醇加浓氨溶液使每100ml中含NH3 911g即得。
本液应置橡皮塞瓶中保存。
乙醇制硝酸银试液取硝酸银4g加水10ml溶解后加乙醇使成100ml即得。
乙醇制溴化汞试液取溴化汞2.5g加乙醇50ml微热使溶解即得。
本液应置玻璃塞瓶内在暗处保存。
一氯化碘试液取碘化钾0.14g与碘酸钾90mg加水125ml使溶解再加盐酸125ml即得。
本液应置玻璃瓶内密闭在凉处保存。
N乙酰L酪氨酸乙酯试液取N乙酰L酪氨酸乙酯24.0mg加乙醇0.2ml使溶解加磷酸盐缓冲液取0.067mol/L磷酸二氢钾溶液38.9ml与0.067mol/L磷酸氢二钠溶液61.6ml混合pH值为7.02ml加指示液取等量的0.1甲基红的乙醇溶液与0.05亚甲蓝的乙醇溶液混匀1ml用水稀释至10ml即得。
乙醇制对二甲氨基苯甲醛试液取对二甲氨基苯甲醛1g加乙醇9.0ml与盐酸2.3ml使溶解再加乙醇至100ml即得。
二乙基二硫代氨基甲酸钠试液取二乙基二硫代氨基甲酸钠0.1g加水100ml溶解后滤过即得。
二硝基苯试液取间二硝基苯2g加乙醇使溶解成100ml即得。
二硝基苯甲酸试液取35二硝基苯甲酸1g加乙醇使溶解成100ml即得。
二硝基苯肼试液取24二硝基苯肼1.5g加硫酸溶液1→220ml溶解后加水使成100ml滤过即得。
二乙基二硫代氨基甲酸银试液取二乙基二硫代氨基甲酸银0.25g加氯仿适量与三乙胺1.8ml加氯仿至100ml搅拌使溶解放置过夜用脱脂棉滤过即得。
本液应置棕色玻璃瓶中密塞置阴凉处保存。
二苯胺试液取二苯胺1g加硫酸100ml使溶解即得。
二氨基萘试液取23二氨基萘0.1g与盐酸羟胺0.5g加0.1mol/L盐酸溶液100ml必要时加热使溶解放冷滤过即得。
本液应临用新配避光保存。
稀二硝基苯肼试液取24二硝基苯肼0.15g加含硫酸0.15ml的无醛乙醇100ml使溶解即得。
零氧校准粉剂配比

零氧校准粉剂配比
零氧校准粉剂的配比通常是指使用5%的亚硫酸钠溶液进行零氧校准。
零氧校准是溶解氧测量中的一个重要步骤,它确保了测量结果的准确性。
在进行零氧校准时,通常会使用亚硫酸钠溶液来创建一个低氧或无氧的环境,以便仪器可以校准到零点。
以下是零氧校准的具体步骤:
1. 配制溶液:准备5%的新鲜配制的亚硫酸钠溶液。
2. 校准操作:将溶解氧电极放入上述溶液中,在仪器处于测量状态下,按“模式”键进入模式选择状态,然后选择“Zero”模式状态。
3. 确认读数:待仪器读数稳定后,按“确定”键,贮存电极当前的零氧值,完成零氧校准。
此外,还有其他方法可以制备零氧含量的溶氧标准液,例如使用梅特勒托利多提供的零氧片,或者通过向溶液通氮气、煮沸溶液并用油封来降低溶氧量。
这些方法可以根据实验条件和所需精度进行选择。
需要注意的是,在进行零氧校准时,应遵循相关环境保护法规和技术标准,确保水环境监测工作的准确性和有效性。
亚硫酸钠溶解度

亚硫酸钠溶解度
0。
C时,12.54g∕100m1水;18。
C时,67.8g∕100m1水;80。
C时283g∕100m1水,在33.4。
C时溶解度最高约为28%,水溶液呈碱性,PH 值约为9~9.5。
亚硫酸钠作用与用途
1用于硅和锯的微量分析测定和显影液的配制,还用作还原剂;
2、用于人造纤维稳定剂、织物漂白剂、照相显影剂、染漂脱氧剂、香料和染料还原剂、造纸木质素脱除剂等;
3、用作普通分析试剂和光敏电阻材料;
4、还原性漂白剂,对食品有漂白作用和对植物性食品内的氧化酶有强烈的抑制作用。
我国规定可用于蜜饯,最大使用量为2.0g∕kg;也可用于葡萄糖、液体葡萄糖、食糖、冰糖、饴糖、糖果、竹笋、蘑菇和蘑菇罐头、葡萄、黑加仑浓缩汁,最大使用量0.60g∕kg o竹笋、蘑菇及蘑菇罐头、蜜饯、葡萄和黑加仑浓缩汁的残留量(以SO2计)≤0.05g∕kg;薯类淀粉残留量≤0.03g∕kg;饼干、食糖、粉丝及其他品种的残留量小于
O∙1g∕kg;液体葡萄糖的残留量不得超过0.2g∕kg0。
亚硫酸钠标准溶液的配制与标定

亚硫酸钠标准溶液的配制与标定哎呀,今天咱们来聊聊如何配制和标定亚硫酸钠标准溶液。
这可不是一件简单的事儿,但放心,我会把复杂的步骤尽量讲得通俗易懂,让你在实验室里像个大厨一样得心应手。
好了,话不多说,我们直接上干货吧!1. 配制亚硫酸钠标准溶液1.1 材料准备首先,你需要一些基础材料:亚硫酸钠(化学式 Na₂SO₃)、蒸馏水、一个干净的量筒、一个精密的天平以及一个烧杯。
别小看这些材料,它们就像是你的实验“装备”,每一样都很重要哦!当然,千万别忘了清洗工作,确保你的器具没有残留的杂质,要不然你的实验就可能泡汤。
1.2 配制步骤现在咱们开始实际操作吧。
首先,先用天平称取一定量的亚硫酸钠。
假设你需要配制1000毫升的0.1摩尔/升的溶液,那你就需要称取7.8克的亚硫酸钠。
这个量真的是个精确活儿,就像做菜时要按量加盐一样,少了不行,多了也不行。
然后,把这些亚硫酸钠倒进一个干净的烧杯里,接下来加点蒸馏水,把它们混合成一个均匀的溶液。
记住,要慢慢加水,不要一股脑儿加进去,这样更容易搅拌均匀。
接下来,把这个溶液倒入量筒里,直到量筒里标记的刻度线。
这样就能得到你想要的标准溶液了。
好了,完成了!看,配制溶液其实也不难,就像是在厨房里调味一样,只要按部就班地来,就能做到的。
2. 标定亚硫酸钠标准溶液2.1 为什么要标定接下来,我们得聊聊标定这个环节。
标定是为了确保你的溶液浓度是准确的,不然你就像做了个不靠谱的配方,结果做出来的菜口味奇怪。
标定其实是为了校正你的溶液浓度,确保它符合你所需要的标准。
2.2 标定步骤标定的步骤也不复杂。
首先,你需要准备一瓶已知浓度的标准溶液,通常选择的是一种稳定性好的化学试剂,比如碘酸钠。
然后,取一定量的亚硫酸钠溶液,用滴定的方法进行标定。
滴定的方法其实就像是测量食盐的量一样,你需要慢慢地滴加标准溶液,直到出现明显的变化。
最后,计算出你亚硫酸钠溶液的实际浓度,并根据计算结果进行调整。
在这个过程中,你得耐心点,千万不要急躁。
亚硫酸钠的配制和标定

亚硫酸钠的配制和标定English Answer:Preparation of Sodium Sulfite Solution.Materials:Sodium sulfite (anhydrous)。
Distilled water.Graduated cylinder.Volumetric flask.Procedure:1. Calculate the weight of sodium sulfite required to prepare the desired concentration using the formula:Weight of sodium sulfite (g) = (Concentration (M) x Volume of solution (mL)) / Molecular weight of sodium sulfite (32.06)。
2. Weigh out the calculated amount of sodium sulfite using an analytical balance.3. Transfer the sodium sulfite to a volumetric flask.4. Add a small amount of distilled water to dissolve the sodium sulfite.5. Swirl the flask until all the sodium sulfite is dissolved.6. Fill the flask to the mark with distilled water.7. Stopper the flask and mix thoroughly by inverting several times.Standardization of Sodium Sulfite Solution.Materials:Sodium sulfite solution.Potassium permanganate solution (0.1 M)。
亚硫酸钠配水溶液操作流程

亚硫酸钠配水溶液操作流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help yousolve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts,other materials and so on, want to know different data formats and writing methods, please pay attention!亚硫酸钠是一种常用的化学药剂,在实验室和工业生产中都有着广泛的应用。
无氧水的制备:
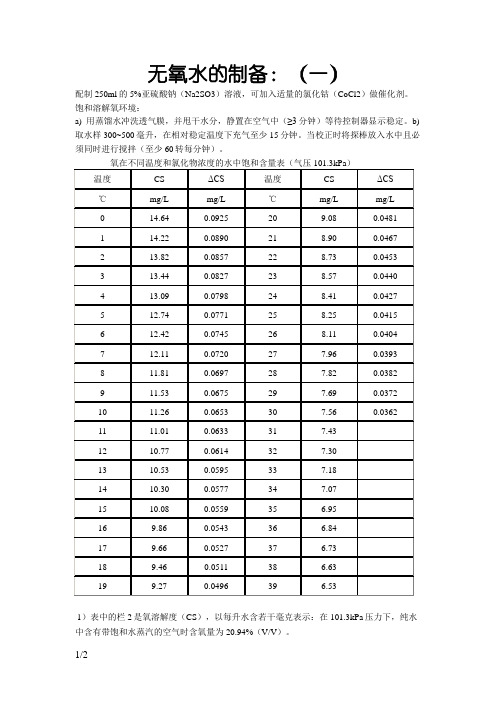
1)表中的栏2是氧溶解度(CS),以每升水含若干毫克表示:在101.3kPa压力下,纯水中含有带饱和水蒸汽的空气时含氧量为20.94%(V/V)。
2)氧在水中的溶解度随含盐度的增加而降低,其关系呈线性关系,实际上水的含量可高达35g/L,含盐量以每升水中含多少克盐表示之,表中所列的ΔCS是进行校正时每升每克盐浓度要减去的数值。
因此氧在含有ng/L盐的水中的溶解度,要用对应的纯水的氧溶解度减去nΔCS的数值便可求得。
6.3.3 无氧水的制备
在配制250mg/L的5%亚硫酸钠(Na2SO3)溶液,可加入适量的氯化钴(CoCl2)做催化剂。
6.3.4 饱和溶氧水的制备
将恒温水浴的水温恒定在所要测定的温度值上,然后用空气泵向水中连续鼓泡2小时以上。
6.4 响应时间和零值误差的测试
在空气中,将溶氧测定仪的示值调至为10.0mg/L,待值稳定后,把传感器放入无氧水中,同时用秒表计时,当示值下降至1 mg/L 时所需时间,即为响应时间;然后再继续记时至
5min末,溶氧测定仪的示值即为残余电流引起的零值误差。
D76类配方及说明(来源中华相机网)

KODAK D76公布于30年代,直到现在,d76仍然是大多数黑白银盐胶卷的“通用参考配方及D76的各种变形配方如下:关于以上多种配方的差别D-76b同D-76相比较,D-76b是一个含对苯二酚量较少的软调显影液配方.在配制D-76显影液时,由于所用水质及无水亚硫酸钠的质量不同,有时会使显影液的pH值稍有变化,从而导致显影能力的差异.再者,D-76显影液中的对苯二酚可和空气中的氧及显影液中的亚硫酸钠发生反应生成对苯二酚磺酸盐,同时也有氢氧化钠生成,显影液pH升高,显影能力变强.由于上述氧化反应,显影液中对苯二酚数量减少(变成了对苯二酚磺酸盐),显影能力下降;但又因有氢氧化钠(NaOH)生成、显影液pH升高,显影能力变强,二者效果相较,后者大于前者,故整个来讲其显影能力被加强.因此显影能力是随空气氧化的程度而变化的,D-76的显影能力也并非固定.为保持显影液的pH为一定值,可朝其中添加硼酸和硼砂,作成具有很强缓冲性的显影液,它即使受到空气氧化而有氢氧化钠生成,或在配制时使用了酸性水,但显影液的pH值仍可以保持恒定,D-76d、D-76BB即属此类显影液.D-76d和D-76BBD-76显影液的pH值约在8.7左右,D-76d显影液的pH值稍低(pH8.5左右),故二者具有几乎相同的性能,但后者的显影能力稍弱.若取同一显影时间进行比较的话,D-76d调子稍软,颗粒细;只要稍微延长一下显影时间即可得相同的效果.故可以说二者的差别是微小的,有时甚至说二者具有相同的性质.在D-76中添加硼酸即变成了D-76BB显影液,由于添加了酸,其pH值有所降低,显影能力变弱.在取同一显影时间进行比较时,其特性为软调、低感光度、微粒.即使是稍许延长D-76BB显影时间,对二者进行同一调子的显影,D-76BB仍表现为低感光度、微粒显影特性.因硼酸和硼砂构成缓冲液,故它和D-76d一样,其pH值、性能都较为稳定.D-76d、D-76BB的硼砂硼酸总量为16g,如果不改变其总量、只变化其二者的比例,则所得显影液的pH值也会稍有差异.例如当硼砂为6g、硼酸为10g时,所得显影液特性介于D-76d和D-76BB之间.D-76C和D-76F在D-76配方中添加起软调化作用的补加剂碘化钾及溴化钾,即变成了更软调显影液D-76C.当用D-76对高感光度胶片进行显影时,把显影时间延长至20分、30分、60分,都可得增感效果,这一措施广泛应用于新闻照片及体育照片的报导上.新闻报导要求迅速,即使是使用散页片,亦要求在短时间内进行显影加工,为此需要提高D-76的碱性,以加强其显影性能.广泛应用于新闻报导上的增感性能好、显影时间短的快速显影液D-76F即为其一例.DK-76和DK-76F将D-76中的硼砂换成柯达尔g即为配方DK-76,它比D-76碱性稍强.在进行同一调子显影时显影时间较D-76稍短,调整显影时间即可得同一显影结果.把DK-76的柯达尔g变成20g即为DK-76F,它和D-76F一样适用于快速显影、盘显及延长显影时间的增感显影.该显影液碱性比D-76F更强,显然此点对微粒显影不利,但因有显影迅速,易进行长时间显影(强化显影)等优点,故被广泛应用于新闻业务上.D-76显影液易于疲劳,从组成上纠其原因是:(1)显影剂减少,(2)显影液碱性变弱;(3)从乳剂中释放出的澳离子等于在显影液中添加了溴化钾.D-76R: P为不使上述诸因素对显影结果产生较大影响,以提高显影液的使用次数,可使每次显影时间较上次稍有延长.例如以600ml显影液对36幅、35毫米135胶卷进行显影,若每个卷的显影时间均较上一卷显影时间延长10%,同一显影液即可对四个卷显影.对胶片进行显影时,由于前述的显影液组成上的变化,即使延长显影时间使影像调子相同,其感光度也会稍有下降,只不过灰雾减少、颗粒变细了.为做到长期使用,使用过的显影液在组成上尽可能维持原状,必须考虑补充液.D-76R是补充液配方.在对一个36幅、35毫米卷进行显影时,补加30ml,并在显影终了,将胶卷取出,保留补充液补加前数量的显影液,余者弃之.再补加D-76R 30ml,从而保持了显影液数量上的一致.补充液D-76R显影剂剂量大,可补偿显影剂的损失;其硼砂量为20g,碱性强,足以弥补显影液pH的下降:又因补充液中不含溴离子,故它的加入起到了使溴离子浓度的增加量降低的作用,因而把源于溴离子增加的影响限于容许范围内.例如:按上述操作方法用600ml显影液可显胶卷20个(为不加补充液时可显胶卷数的5倍,补充液的补充量几乎与原显影液量相等).SD-21和SD-28.SD-21和SD-28属另一种类型显影液,其组成近于边显影边添加补充液时的显影液(在电影胶片的机械显影时,一边连续显影、一边连续补加),它着眼于边显影、边补加这一特性,其显影剂数量和pH与新鲜的D-76相同,但在其中添加了溴化钾.用此类显影液可在感光度几乎不被降低的情况下得到颗粒度好、灰雾小的优质负片.在使用D-?6显影液时,不少人喜欢将用过的D-76显影液添加进新鲜显影液中,其主要考虑是为了减少灰雾和得到好的颗粒度,其效果与每升显影液中添加0.5g左右溴化钾的效果等同.SD-28正好是这样的显影液.FD-122和SD-20富士FD-122和小西六SD-20配方中均采用了与柯达尔g具有相同作用的偏硼酸钠,其显影剂数量也稍有不同,FD-122近于D-76B的量,SD-20的显影剂量稍少一些,两者均有稍显软调的倾向,从而与由偏硼酸钠引起的硬调化作用相抵消.和SD-28一样,添加溴化钾主要是为了得到灰雾小的优质负片.上述两配方和D-76原配方多少有些不同,若对D-76b、DK-76等变型配方稍加研究,则可发现,它们不过是对应于不同的使用目的在配方组成上稍有变化而已,富土FD-122、小西六SD-20亦属D-76变型配方.ID-11和杜邦6D伊尔福的ID-11和柯达的D-76完全相同,杜邦的6D也是如此,可见,D-76确实是各公司的标准显影液配方.2.D76的配置和使用很多人觉得自来水出来的效果和蒸馏水一样,甚至于有位人士在无忌开山讲课的时候也说自来水就行了(他的那个帖子还有很多误导新人的观点就不说了)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Na2SO3配制、标定、测定铜
吴凡
指导老师吴明君教授
四川农业大学雅安625014
摘要
本文通过利用间接碘量法测定铜离子的含量,通过本文,旨在掌握硫代硫酸钠溶液的配制和保存,并掌握硫代硫酸钠溶液浓度的原理和方法,掌握碘量法测定铜的原理和方法,学习铜合金的溶解方法。
关键词Na2SO3配制标定铜间接碘量法
Na2SO3 preparation, calibration, determination of copper
Wufan
Directed by WU Ming-jun
Sichuan Agricultural University yaan 625014
Abstract
This article through the use of indirect iodometry determination of copper ion content, through this paper, aims to master sodium thiosulfate solution preparation and preservation, and mastery of the sodium thiosulfate solution concentration of principle and method, grasps the iodine quantity method determination of brass principle and method,
study the copper alloy solution method.
Key words Na2SO3 preparation calibration copper indirect iodometry
前言
本实验选择碘量法测定铜的含量其中可以作为基准物质的有重铬酸钾,碘酸钾,溴酸钾,和纯铜,本实验选择以纯铜为基准物质。
因为在测定铜盐中最好以铜作为基准物质。
2Cu2++4I-=2CuI↓+I2(为可逆,加KI) I2+2S2O32-=S4O62-+2I-。
反应必须在弱酸性中溶液(PH=3.5-4.0)中进行。
因在强酸性溶液中,I-易被
空气中氧氧化为碘。
如果有Cu2+存在,催化此反应;在碱性溶液中,Cu2+会水解,I2也会分解。
所以通常利用HAc-NaAc,HAc-NH4Ac或NH4HF2等来控制溶液的酸度。
为了使反应完全,必须加入过量的I-。
因I2在水中溶解度较小,过量的I-存在,使I2形成I3-,增加I2的溶解度。
CuI沉淀表面吸附I2,使测定结果偏低。
为此,在用Na2S2O3滴定I2到接近终点时,加入KSCN。
因CuSCN和CuI的溶解度相近,加入KSCN以后,有一部分CuI转化为CuI+SCN-=CuSCN↓+I-,使CuI吸附的I2释放出来;同时由于加入KSCN可以减少KI的用量。
但是只能在滴定到接近终点时才能加入KSCN,否则KSCN将直接在应接近还原Cu2+,使结果偏低。
2Cu2++4SCN-=2CuSCN+(SCN)2-3(SCN)2·4H2O=5SCN-+SO42-+7H++HCN。
1实验部分
1.1试剂
Na2S2O3固体、Na2CO3固体、纯铜(99.9%以上)、6 mol/LHNO3、100g/LKI 溶液、1+1和1mol/L的H2SO4溶液、100g/LKSCN溶液、10g/L淀粉溶液
1.2仪器试剂瓶一个、50mL碱式滴定管一支、碘量瓶若干、分析天平
1.3原理
在乙酸酸性溶液中,Cu2+与过量的KI反应,析出的碘用Na2S2O3标准溶液滴定,用淀粉作指示剂,反应如下:2Cu2++4I-═2CuI↓+I2,I2+2S2O32-═2I-+S4O62-
反应需加入过量的KI,一方面可促使反应进行完全,另方面使形成I3-,以增加I2的溶解度。
为了避免CuI沉淀吸附I2,造成结果偏低,须在近终点(否则SCN-将直接还原Cu2+)时加入SCN-,使CuI转化成溶解度更小的CuSCN,释放出被吸附的I2。
溶液的pH一般控制在3.0~4.0之间,酸度过高,空气中的氧会氧化I2(Cu2+对此氧化反应有催化作用);酸度过低,Cu2+可能水解,使反应不完全,且反应速度变慢,终点拖长。
一般采用NH4F缓冲溶液,一方面控制溶液酸度,另一方面也能掩蔽Fe3+,消除Fe3+氧化I-对测定的干扰。
硫代硫酸钠(Na2S2O3·5H2O)一般都含有少量杂质,如S、Na2SO3、Na2SO4、Na2CO3、NaCl等,还容易风化和潮解,须用间接法配制。
Na2S2O3易受水中溶解的CO2、O2和微生物的作用而分解,故应用新煮沸冷却的蒸馏水来配制;此外,Na2S2O3在日光下,酸性溶液中极不稳定,在pH=9~10时较为稳定,所以在配制时还需加入少量Na2CO3,配制好的标准溶液应贮存于棕色瓶中置于暗处保存。
长期使用的Na2S2O3标准溶液要定期标定。
通常用K2Cr2O7,KIO3,KBrO3,纯铜等作基准物标定Na2S2O3的浓度,反应为:Cr2O72-+6I-+14H+═
2Cr3++3I2+7H2O 析出的碘再用标准Na2S2O3溶液滴定,本实验以纯铜作为标定Na2S2O3溶液的基准物。
1.4步骤
1.4.1Na2S2O3的配置
称取12.5g Na2S2O3·5H2O,加入约300mL新煮沸后冷却的蒸馏水溶解,加入约0.2gNa2CO3固体,然后用新煮沸后冷却的蒸馏水稀释至1L,贮于棕色的试剂瓶中,在暗处放置1周后在标定。
1.4.2 Na2S2O3的标定
(以下分解操作在通风橱内进行)准确称取0.8g的纯铜,置于250mL烧杯中。
加入约3mL6 mol/LHNO3,盖上表面皿,放在电热板上微热。
待铜完全分解后,慢慢升温至干。
冷却后再加入H2SO4(1+1)2mL蒸发至冒白烟、近干(切记蒸干),冷却,定量转入250mL容量瓶中,加水稀释至刻度。
摇匀,从而制得的标准溶液。
准确移取25.00mL的标准溶液于250 mL碘量瓶中,加水25mL,2mLNaF,混匀。
加入7mL100gKI溶液,立即用待标定的Na2SO3滴定至呈淡黄色。
然后加入4 mL10g/L淀粉溶液,继续滴定至浅蓝色。
再加入5 mL100g/LKSCN溶液,摇匀后溶液蓝色转深,再继续滴定至蓝色恰好消失为终点(此时溶液为米色的悬浮液)。
纪录数据,平行滴定4次。
2数据处理与分析
可疑值为最小值0.04913及0.04926
Q 1=(0.04923-0.04913)/(0.04926-0.04913)=0.74 Q 2=(0.04926-0.04923)/(0.04926-0.04913)=0.23
查表得测定次数为4次时Q=0.76,Q 1
Q 2均小于Q 表,故这两个数据均应保留。
置信度为95%时,t=3.18,由
得Na2S 2O3溶液的浓度为0.04921
数据处理:将实验数据按从小到大排列得24.53%,24.87%,25.08%,24.96%
可疑值为最小值24.53%及最大值25.08%,用Q检验法检验得
=(0.2508-0.2496)/(0.2508-0.2453)=0.22
Q
1
=(0.2487-0.2453)/(0.2508-0.2453))=0.62
Q
2
查表得测定次数为4次时Q=0.76,Q1Q2均小于Q表,故这两个数据均应保留。
置信度为95%时,t=3.18,由得Cu的含量为24.86%
3结果与讨论
硫酸铜的配置中再加入硝酸后应将其蒸干,加入硫酸的作用是为了溶解被硝酸氧化的铜,并起到调节pH,保护的典离子的作用,因为在后面实验中典离子在酸性条件下不易被氧化。
本实验选择以定粉为指示剂,因为铜氧化典离子生成碘化亚铜和单质碘,遇定粉县蓝色。
在实验中,若所加的定粉并未使溶液变色,可加量直至溶液变成淡蓝色。
氟化钠的加入由于测定的是矿石等中的铜离子的含量,为了防止铁离子的的干扰,加入氟离子铜铁离子形成络合物,而不被滴定。
滴定过程中选择碘量瓶由于铜氧化典离子生成碘化亚铜和单质碘,碘会挥发,故选择碘量瓶进行滴定。
配置的硫代硫酸钠溶液易被空气中的氧化,在进行测定时要对其进行标定,本实验选择以铜为基准物质;并且应用煮沸后的蒸馏水,并加入少量碳酸钠为呈微碱性,因为碳酸钠可以调节溶液的pH,使溶液呈微碱性抑制细菌的生长,防止细菌对硫代硫酸钾的分解作用。
硫氰化钾必须在接近终点时加入,否则较多的碘会明显的为硫氰化钾所还原,是结果偏低
4致谢
感谢吴明君教授对本次实验的悉心指导;
感谢学校为本次实验成功进行提供的平台。
参考文献
[1] 《分析化学实验.》第三版.北京:四川大学化工学院,浙江大学化学系编.高等教育出版社,2003.6,93-100
[2]《.分析化学.第五版(上册)》. 武汉大学,中国科学技术大学,中山大学,吉林大学编北京:高等教育出版社,2006.7,166-213。
