盐水浓度、凝固点、密度对照表
酸、碱、盐的密度

四.氢氧化钠溶液的密度:
密度 克/厘米 3 1.010 1.021 1.032 1.043 1.054 1.065 1.076
氢氧化钠的含量
% 克/升
克当量/升
1 10.10
0.25
2 20.41
0.51
3 30.95
0.77
4 41.71
1.04
5 52.69
1.32
6 63.89
1.60
7 75.31
42 554.6 11.32
1.338
44 588.9 12.02
1.8337 95 1742 35.55
1.8355 96 1762 35.96
1.8363 97 1781 36.35
1.435 1.456 1.477 1.498 1.520 1.542 1.565 1.587 1.601 1.622 1.634 1.646 1.657 1.669 1.681 1.693 1.704 1.716 1.727 17.49 1.769 1.787 1.802 1.814 1.819 1.824 1.828 1.8312 1.8361 1.8342 1.8325
-16.3
23.5
1.180
-21.2
八.海水主要成分
化学成分
总硬度 YD 钙离子 Ca2+ 镁离子 Mg2+ 碱 度 JD 氯 根 CL硫酸根 SO42钠离子 Na+ 钾离子 K+
含量
129 21 108 3 19324 2696 10722 382
me /L me /L me /L me /L mg/L mg/L mg/L mg/L
1.095
14 153.3 3.12
盐水浓度与凝固点

盐水浓度与凝固点盐水是指将盐溶解在水中形成的溶液。
在盐水中,盐的分子会与水分子相互作用,形成离子,其中阳离子是盐中金属离子,阴离子是盐中的非金属离子。
盐水浓度是指盐溶液中的盐的质量或摩尔浓度的大小。
而凝固点是指物质从液态转变为固态时的温度。
本文将围绕盐水浓度与凝固点的关系展开讨论。
在盐水溶液中,随着盐的浓度的增加,溶液的凝固点会降低。
这是因为溶质(盐)的添加会干扰水分子的结构,使得水分子形成的晶格结构变得不规则,从而需要更低的温度才能使溶液凝固。
这个现象被称为“冰点降低”。
盐水中的溶质通过与溶剂(水)分子相互作用,阻碍了水分子的结晶过程,所以需要更低的温度才能使溶液凝固。
盐水浓度与凝固点之间的关系可以通过一个称为“摩尔冰点降低常数”的物理常数来描述。
摩尔冰点降低常数是一个与溶质和溶剂相关的常数,它表示单位浓度的溶质在单位溶剂中引起的凝固点降低。
不同的盐有不同的摩尔冰点降低常数,这是因为不同的盐在水中的溶解度和离子化程度不同。
除了盐的浓度,其他因素也可以影响盐水的凝固点。
例如,压力的变化会对凝固点产生影响。
根据气候条件和海拔的不同,地球上的海水凝固点与我们通常理解的0℃有所不同。
在较低的温度和较高的压力下,海水的凝固点会降低,这是因为压力增加会压缩溶剂分子,从而降低了凝固点。
盐水中还存在一种现象叫做“过冷”。
过冷是指溶液的温度低于其凝固点,但仍保持在液态的状态。
这种情况下,溶液处于不稳定的状态,一旦有核心物质(如冰晶)引起结晶,整个溶液会迅速凝固。
过冷现象在盐水中更容易出现,因为盐的存在增加了结晶的难度。
盐水浓度与凝固点之间的关系在实际应用中具有重要意义。
例如,在冬季,道路上会撒盐以防止结冰。
这是因为撒盐会使冰的凝固点降低,从而减缓冰的形成速度,提高道路的安全性。
同样地,煮食时加盐也可以使水的沸点升高,加快食物的煮熟速度。
盐水浓度与凝固点之间存在着密切的关系。
随着盐水的浓度增加,溶液的凝固点会降低。
10%浓度盐水的凝固点

10%浓度盐水的凝固点
10%浓度盐水的凝固点取决于盐的种类。
一般来说,普通食用
盐(氯化钠)溶解在水中会降低水的冰点,使盐水的凝固点较纯水低。
但是具体的降低程度取决于溶液的浓度和盐的种类。
根据Raoult's Law(瑞尔定律),浓度越高,凝固点下降的越多。
对于10%浓度的氯化钠(食盐)溶液来说,根据一般的估算,它的凝固点约为-6度摄氏度。
这意味着在正常的冰点0度以下
6度,盐水仍然是液态而不会结冰。
请注意,这个数值仅仅是
一个估计,实际的凝固点可能会受到其他因素的影响而有所变化。
20度盐水浓度和密度对照表
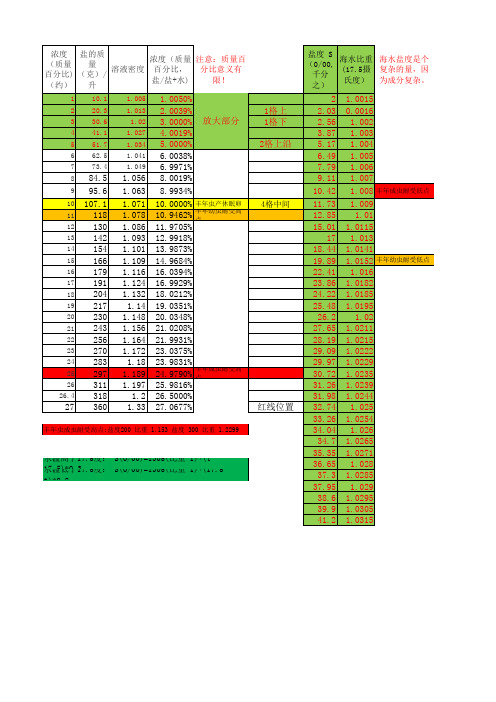
NaCL溶解度和温度关系
温度 0摄氏度
100克水 (克)
35.7
10摄氏度
35.8
20摄氏度
36
30摄氏度
36.3
40摄氏度
36.6
50摄氏度
37
60摄氏度
37.3
70摄氏度
37.8
80摄氏度
38.4
90摄氏度
39
100摄氏度
39.8
1.071 1.078 1.086 1.093 1.101 1.109 1.116 1.124 1.132
1.14 1.148 1.156 1.164 1.172
1.18 1.189 1.197
1.2 1.33
10.0000% 丰年虫产休眠卵
10.9462%
丰年幼虫耐受高 点
11.9705%
12.9918%
2 2.03 2.56 3.87 5.17 6.49 7.79 9.11
1.0015 0.0016
1.002 1.003 1.004 1.005 1.006 1.007
10.42 1.008 丰年成虫耐受低点
11.73 12.85 15.01
17 18.44 19.89 22.41 23.86 24.22 25.48 26.2 27.65 28.19 29.09 29.97 30.72 31.26 31.98 32.74 33.26 34.04 34.7 35.35 36.65 37.3 37.95 38.6 39.9 41.2
6 62.5 1.041 6.0038%
7 73.4 1.049 6.9971%
8 84.5 1.056 8.0019%
9 95.6 1.063 8.9934%
盐液密度计比重计对照表
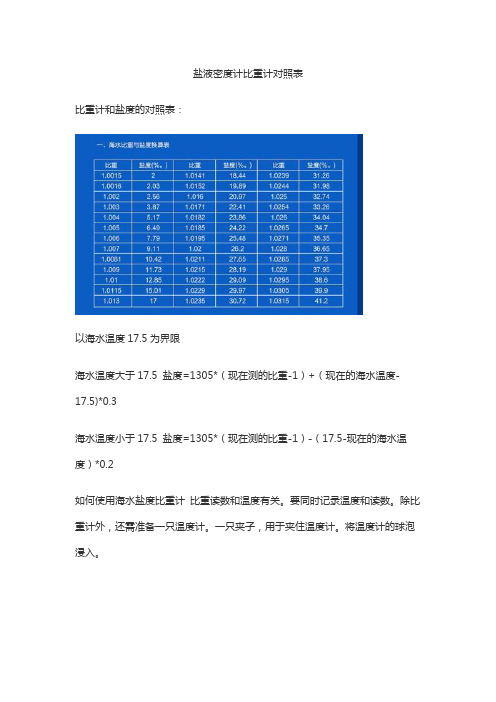
盐液密度计比重计对照表
比重计和盐度的对照表:
以海水温度17.5为界限
海水温度大于17.5 盐度=1305*(现在测的比重-1)+(现在的海水温度-17.5)*0.3
海水温度小于17.5 盐度=1305*(现在测的比重-1)-(17.5-现在的海水温度)*0.2
如何使用海水盐度比重计比重读数和温度有关。
要同时记录温度和读数。
除比重计外,还需准备一只温度计。
一只夹子,用于夹住温度计。
将温度计的球泡浸入。
比重计测量原理
液体比重计的长管子上,常标有下列数字标度……0.7、0.8、0.9、1.0、1.1、1.2、1.3……。
当液体比重计在液体中沉至0.9的标度时,便能立刻知道所量度的液体密度为0.9。
使用这种仪器,物体只会沉到被其所排除之液体的重量恰好等于它自身重量的那种深度为止。
因此,液体比重计在比重较轻的液体里,比在较重的液体里要下沉得更深。
例如,它在酒精里,就会比在掺水的酒精里下沉得更深;在纯牛奶里比在掺水的牛奶里较浅。
教科版小学三年级上册科学第1单元《水》同步作业试题

—6—
第 1 单元 水
活动名称:测量水的沸点。 活动目的:通过实验探究加深对水沸腾的认识,进一步验证水的沸点。 材料准备:温度计、清水、水锅、记录纸等。 活动过程: (1) 在水锅中加入小半锅清水,放在煤气灶上加热。 (2) 观察加热过程中水的变化和温度的变化,记录水沸腾时的温度。 注意事项: (1) 温度计不要用手拿,可以做一个建议的支架把温度计悬挂起来。 (2) 小心烫伤。 思考:你测量到的水的沸点是多少? 和在课堂上测量的水的沸点一样吗? 如果不一样,可能是因为什么? 结论:略。 (可能一样,也可能不一样;如果不一样,可能是因为两次实验的 气压不一样)
⑤没有固定的形状是液态水和水蒸气的共同特征。 ( )
(2) 选择正确答案的序号填在括号里。
①湿衣服在通风、向阳的地方晾干了,是一种( )现象。
A. 蒸 发 B. 液 化 C. 溶解
②关于发生蒸发现象的条件,下列说法正确的是( )。
A. 应选用粗一点的试管
B. 应该在试管中加满水,因为水结冰后体积会缩小
C. 测量温度时温度计不能碰到试管内壁
④为了使冰水混合物的温度降低,可以采用的方法是( )。
A. 加水
B. 搅拌
C. 加盐
(3) 填空。
①水蒸发可以在( ) ( 填温度条件) 进行;水沸腾的温度是( );
①往碟子里倒入少量的水,把它放在向阳、通风的地方。 一段时间后,碟子
里的水会 ( ) ( 填 “ 增 多” 或 “ 减 少”)。 这 是 因 为 水 变 成 我 们 看 不 见 的
( )飞散到空气中去了。 这种现象叫( )现象。
②冬天的早上,我们往往会在室内窗户的玻璃上看到水珠,这是由室内的水
