生物化学-生化知识点_酶促反应动力学 (9章)
生物化学第9章酶促反应动力学

合,可以用透析、超滤、凝胶过滤等物理方法 去除而使酶恢复活力。
可逆抑制作用 inhibition) I 和 S 竞争与酶的活性中心结合,二者只能
结合一个。竞争性抑制剂通常是底物类似物, 它可以与酶结合,但不能被酶催化发生反应。
可逆抑制作用和不可逆 抑制作用的动力学鉴别
② 在反应系统中加入不同量的酶及抑制剂,作不 同抑制剂浓度下反应速率对酶量的直线。可逆抑制 剂得到的是一组通过原点但斜率不同的直线,不可 逆抑制剂得到的是一组不通过原点但斜率与对照相 同的平行线。
一些重要的不可逆抑制剂
(1)非专一性不可逆抑制剂 ① 有机磷化合物 ② 有机汞、有机砷化合物 ③ 重金属盐 ④ 烷化试剂 ⑤ 氰化物、硫化物和CO ⑥ 青霉素
A
B
5%
A A-B + H2O
AH2 +B A2+ + B3+
B+C AOH + BH A + BH2 A3+ + B2+
12% 26% 27%
A + BX AX + B
24%
A + B + ATP A + B + ATP
AB + ADP + Pi AB + AMP + PPi 6%
多底物反应按动力学机制分类
根据平衡学说推导速度方程
k1 ( [E]0-[ES] ) [S]= k 2 [ES]
k2 ([E]0 [ES ]) [S ]
k1
[ES ]
解出 [ES] 得 [ES] [E]0[S] k2 [S] k1
生物化学(第三版)第九章 酶促反应动力学课后习题详细解答_ 复习重点

第九章酶促反应动力学提要酶促反应动力学是研究酶促反应的速率以及影响此速率各种因素的科学。
它是以化学动力学为基础讨论底物浓度、抑制剂、pH、温度及激活剂等因素对酶反应速率的影响。
化学动力学中在研究化学反应速率与反应无浓度的关系时,常分为一级反应、二级反应及零级反应。
研究证明,酶催化过正的第一步是生成酶-底物中间产物,Michaelis-Menten该呢举中间产物学说的理论推导出酶反应动力学方程式,即Km、Vmax、kcat、kcat/Km。
Km是酶的一个特征常数,以浓度为单位,Km有多种用途,通过直线作图法可以得到Km及Vmax。
Kcat称为催化常数,又叫做转换数(TN值),它的单位为s-1,kcat值越大,表示酶的催化速率越高。
kcat/Km常用来比较酶催化效率的参数。
酶促反应除了单底物反应外,最常见的为双底物反应,按其动力学机制分为序列反应和乒乓反应,用动力学直线作图法可以区分。
酶促反应速率常受抑制剂影响,根据抑制剂与酶的作用方式及抑制作用是否可逆,将抑制作用分为可逆抑制作用及不可逆抑制作用。
根据可逆抑制剂与底物的关系分为竞争性抑制、非竞争性抑制及反竞争性抑制3类,可以分别推导出抑制作用的动力学方程。
竞争性抑制可以通过增加底物浓度而解除,其动力学常数Kˊm变大,Vmax不变;非竞争性抑制Km不变,Vˊmax变小;反竞争性抑制Kˊm及Vˊmax均变小。
通过动力学作图可以区分这3种类型的可逆抑制作用。
可逆抑制剂中最重要的是竞争性抑制,过度态底物类似物为强有力的竞争性抑制剂。
不可逆抑制剂中,最有意义的为专一性Ks型及kcat型不可逆抑制剂。
研究酶的抑制作用是研究酶的结构与功能、酶的催化机制、阐明代谢途径以及设计新药物的重要手段。
温度、pH及激活剂都会对酶促反应速率产生重要影响,酶反应有最适温度及最适pH,要选择合适的激活剂。
在研究酶促反应速率及测定酶的活力时,都应选择酶的最适反应条件。
习题1.当一酶促反应进行的速率为Vmax的80%时,在Km和[S]之间有何关系?[Km=0.25[S]]解:根据米氏方程:V=Vmax[S]/(Km+[S])得:0.8Vmax=Vmax[S]/(Km+[S])Km=0.25[S]2.过氧化氢酶的Km值为2.5×10-2 mol/L,当底物过氧化氢浓度为100mol/L时,求在此浓度下,过氧化氢酶被底物所饱和的百分数。
酶促反应动力学
第一节 酶促反应的动力学方程
一、化学动力学基础
1、反应分子数和反应级数 1)反应分子数
指在反应中真正相互作用的分子数。
A
P
A+B
P+Q
2)反应级数
指实验测得的反应速率与反应物浓度之间的关系,符合 哪种速率方程,则这个反应就是几级反应。
蔗糖 + H2O 蔗糖酶 葡萄糖 + 果糖
1
3)零级反应的特征
反应速率与反应物浓度无关。初始浓度增加,反应速度不变, 要使反应物减少一半所需完成的反应量增加,因此最后表现为半 衰期与初始浓度成正比。
二、底物浓度对酶促反应的影响
1、酶促反应初速度与底物浓度之间的关系 1903年Henri以蔗糖酶水解蔗糖为例,研究底物浓度与酶促反
应速度之间关系时,发现两者的关系符合双曲线关系。
k2
Km= (k2+k3)/k1
Km是[ES]的分解常数与生成常数的比值。 Km的真正含义是, Km越大意为着[ES]越不稳定,越容易分解。但不能说明[ES]是容 易分解成底物还是产物。
kcat/Km可表示为 [k3/(k2 + k3)]k1, k3/(k2 + k3)代表[ES] 分解成产 物的分解常数占[ES] 总分解常数的比值。 k3/(k2 + k3)越大,说明 [ES]越容易分解成产物。 k1是[ES] 生成常数。因此, kcat/Km数 值大不仅表示[ES]容易生成,还表示[ES]易分解成产物。真正代 表酶对某一特定底物的催化效率。所以,也称为专一性常数。 极限值是k1 ,意为[ES]不会再分解为底物。
酶的化学本质是蛋白质,因此,酶 对温度具有高度的敏感性,随着温度 的升高,分子的构象会逐渐地被破 坏,失去催化活性。
第九章 酶促反应动力学
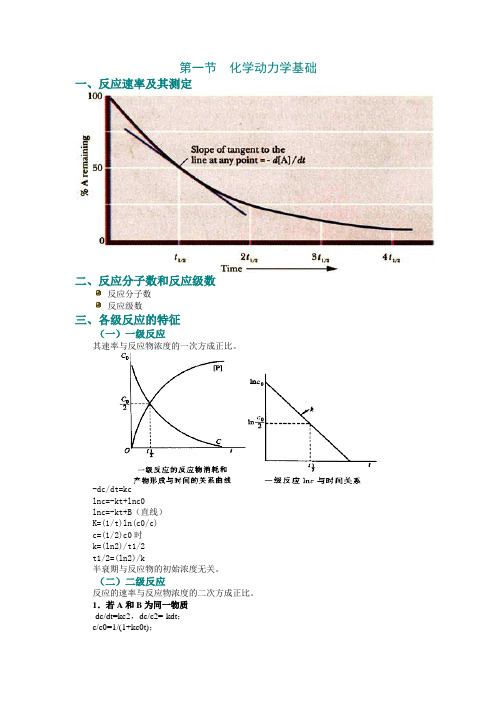
第一节化学动力学基础一、反应速率及其测定二、反应分子数和反应级数反应分子数反应级数三、各级反应的特征(一)一级反应其速率与反应物浓度的一次方成正比。
-dc/dt=kclnc=-kt+lnc0lnc=-kt+B(直线)K=(1/t)ln(c0/c)c=(1/2)c0时k=(ln2)/t1/2t1/2=(ln2)/k半衰期与反应物的初始浓度无关。
(二)二级反应反应的速率与反应物浓度的二次方成正比。
1.若A和B为同一物质-dc/dt=kc2,dc/c2=-kdt;c/c0=1/(1+kc0t);c/c0=1/2时,k=1/c0t1/2。
2.A和B的初始浓度相同k=(1/t){x/[a(a−x)] }3.A和B的初始浓度不同k=[1/t(a−b)]/ln{[b(a−x)]/[a(b−x)]}a:反应物A的初始浓度。
b:反应物B的初始浓度。
(a-x):反应时间为t时A的浓度。
(b-x):反应时间为t时B的浓度。
(三)零级反应反应速率与反应物的浓度无关。
-dc/dt=k,或dx/dt=k。
X=kt,或k=x/t。
第二节底物浓度对酶反应速率的影响一、中间产物学说中间产物学说的实验依据:(1)核酸和酶的复合物可直接用电镜观察;(2)下图;(3)复合物的溶解度和稳定性有所变化;(4)有些复合物可直接分离得到。
酶催化的反应中各成份的变化:酶反应的速度在不停地变,实验上只有初速度的测定才有意义。
酶反应的初速度与底物浓度之间的关系:二、酶促反应的动力学方程式(一)米氏方程的推导Briggs & Haldane 推导k1([Eo]-[ES])[S]=k2[ES]+k3[ES]Km=(k2+k3)/k1,[ES]=[Eo][S]/(Km+[S]) 因为v=k3[ES],而Vmax=k3[Eo] 因此v=Vmax[S]/(Km+[S])米氏方程v=Vmax[S]/(Km+[S])符合v-[S]曲线。
若Km>>[S],v=(Vmax/Km)[S]; 若[S]>>Km ,v=Vmax ;由v=Vmax[S]/(Km+[S]),得Km=[S][(Vmax/v)-1],为典型的双曲线方程。
第9章酶促反应动力学

3 环境因素对酶反应的影响
温度 pH值 激活剂 抑制剂
① 温度对酶反应的影响
最适温度(optimum temperature ):受底物的种类、浓度, 溶液的离子强度, pH, 反应时间等的影响。
② pH对酶反应的影响
反 应反
应
速速 度
度
0
6
8
最适pH
pH 10 pH
最适pH(optimum pH):受到底物的种类、浓度、 缓冲液 的种类等影响。
第9章 酶促反应动力学
研究酶促反应的速率以及影响速率的各种因素
底物浓度对酶反应速率的影响 米氏方程
酶的抑制作用
环境因素对酶反应的影响
1 底物浓度对酶反应速率的影响
1.1米氏学说的提出
① 酶有被底物所饱和的现象
双曲线
② 酶-底物复合物学说(Enzyme-substrate complex)
1903年,Herin-Wurtz
1.4 米氏常数的求法
双倒数作图法(Lineweaver-Burk作图法)
以1/[S]为横坐标, 以1/v为纵坐标作图 缺点: 实验点过于集中于直线的左端, 作图不易十分准确。
2 酶的抑制作用
2.1 抑制作用
失活作用(inactivation):酶蛋白变性而引起
活力丧失。 变性剂对酶无选择性。
抑制作用(inhibition):酶的必须基团化学性
将(4)代入(3)
得:
当反应体系中的底物浓度极大,而使所有的酶分子都 以ES形式存在时,反应速度达到最大值(即最大反应 速度,V)。
将(6)代入(5)
得:
米氏方程式
Km--米氏常数(Michaelis-Menton constant) 表明当已知Km和Vmax时,酶反应速率与底物浓 度的定量关系。
生物化学 酶促反应动力学

酶的抑制作用
A.不可逆抑制
✓ 抑制剂与酶以共价键结合 ✓ 不能用透析、超滤方法除去抑制剂 ✓ 酶的修饰抑制
B.可逆抑制
✓ 抑制剂与酶以非共价键结合 ✓ 能用透析、超滤方法除去抑制剂,而使酶的活性恢复 ✓ 三种类型
①竞争性抑制
- 可以测定每一种底物(A或B)的Km,通过饱和[B]而改变[A]测定A的 KAm,和饱和[A]而改变[B]测定B的KBm
- BiBi反应的2种类型:
i) 序列反应:在任何产物释放之前,两种底物必须先结合到酶上
有序反应: 按照一定顺序前后结合两种底物和按前后顺序释放两种产物 随机反应: 两种底物与酶的结合及两种产物与酶的分离没有固定顺序
✓抑制剂与底物相似,可以竞争性地与酶的活性中心结合 ✓增加底物的浓度可以解除抑制
②非竞争性抑制
✓抑制剂与底物不相似,抑制剂是与活性中心外结合位点结合 ✓可形成酶-抑制剂-底物三元复合物
③反竞争性抑制
✓酶与底物先结合,然后再与抑制剂结合
可逆抑制与不可逆抑制的区别
[I]↑ [I]↑
v0
v0
v0
0
[E]
阴离子(少数) ➢Cl-等
有机小分子(少数) ➢胆汁酸盐等
酶促反应的中间络合物学说
1. 酶(E)的结合基团结合底物(S)形成酶-底物复合物(E-S)
E+S E-S
2. 酶的催化基团催化底物(S)形成产物(P),E-S转变为E-P
E-S E-P
3. 酶的结合基团释放产物P,E-P形成E和P
E-P E + P
B.可逆抑制
✓ 抑制剂与酶以非共价键结合 ✓ 能用透析、超滤方法除去抑制剂,而使酶的活性恢复 ✓ 三种类型
第9章 酶促反应动力学

Байду номын сангаас
思考与练习 1. 1/v对1/[S]的双倒数作图得到的直线斜率为1.2×103min,在1/v轴上的截距为2.0×10-2ml.min/ n mol。 计算Vmax和Km。 2. 一个二肽酶对二肽Ala-Gly和二肽Leu-Gly的Km分别为 2.8×10-4和3.5×10-2,哪一个二肽是酶的最适底物? 该酶的两个非竞争性抑制剂的Ki值分别为5.7×10-2 和2.6×10-4。哪一个是最强的抑制剂? 3. 根据米式方程求(a)Kcat为30s-1,Km为0.005M的酶, 在底物浓度为多少时,酶促反应的速度为1/4 Vmax? (b)底物浓度为1/2Km,2 Km和10 Km时,酶促反应 的速率分别相当于多少Vmax?
5.红细胞中的碳酸酐酶(相对分子质量为30 000)具有很 高的转换数。它催化C02的可逆水合反应: 此反应对CO2从组织运往肺部很重要。如果l0μ g的纯 碳酸酐酶在37℃下lmin内,以最大速度可催化0.3g CO2的水合反应,那么碳酸酐酶的转换数(Kcat)是多少
6. 酶溶液加热时,随着时间的推移,酶的催化活性逐 渐丧失。这是由于加热导致天然酶的构象去折叠。己糖 激酶溶液维持在45℃12分钟后,活性丧失百分之五十。 但是若己糖激酶与大量的底物葡萄糖共同维持在 45℃12分钟,则活性丧失仅为3%。请解释,为什么在 有底物存在下,己糖激酶的热变性会受到抑制? 7.新掰下的玉米的甜味是由于玉米粒中的糖浓度高。可 是掰下的玉米贮存几天后就不那么甜了,因为50%糖已 经转化为淀粉了。如果将新鲜玉米去掉外皮后浸入沸水 几分钟,然后于冷水中冷却,储存在冰箱中可保持其甜 味。这是什么道理?
4.枯草杆菌蛋白酶(相对分子质量27 600)是一种能催化 某些氨基酸酯和酰胺水解的细菌蛋白酶。对于合成的底 物N—乙酰—L—酪氨酸乙酯(Ac-Tyr-OEt),枯草杆菌蛋 白酶的Km和kcat分别为0.15mol/L和550 s-1。 (a) 当 枯 草 杆 菌 蛋 白 酶 的 浓 度 是 0 .40 g/L时 , AcTyr—OEt水解的Vmax是多少? (b)吲哚是枯草杆菌蛋白酶的竞争性抑制剂,抑制剂常 数Ki为0.05mol/L。当吲哚为6.25mmol/L时,计 算 Ac—Tyr-OEt 被 0 . 4 0 g/L 枯 草 杆 菌 蛋 白 酶 水 解 的 Vmax。 (c)计算0.40g/L枯草杆菌蛋白酶与0.25mol/L Ac— Tyr-OEt和1.0mol/L吲哚共同存在时的V。
第九章 酶促反应动力学

酶,从而抑制细菌生长繁殖。
-2-
中国海洋大学海洋生命学院
生物化学习题
2008 年修订
[S] mol/L(×10-4)
1.0
1.5 36 23
2.0 43 29
5.0 65 50
7.5 74 61
28 无I v(μ mol/min) 有 I(2.2×10-4mol/L) 17 v(μ mol/min)
)
A、竞争性可逆抑制剂;B、非竞争性可逆抑制剂;C、反竞争性可逆抑制剂;D、不可逆抑制剂; ⒖ 如果某个单底物酶促反应是二级反应, E S ES E P ,那么决定其催化反应速度的常 A、Km;B、Ks;C、Kcat;D、Kcat/Km
Kcat
⒎ Km 值是酶的特征常数,有的酶虽然有几种底物,但 Km 值是固定不变的。 ⒏ Km 是酶的特征常数,与酶的底物、底物浓度以及温度等因素无关。 ⒐ 酶的最适 pH 值是一个常数,每一种酶只有一个确定的最适常数。 ⒑ 酶的最适温度与酶和底物的作用时间有关,作用时间越长,则最适温度高;作用时间短,则最适 温度低 三、填空题 ⒈ 酶反应速度受许多因素影响,以反应速度对底物浓度作图,得到的是一条 对酶浓度作图,得到的是一条 ⒉ 讨论酶促反应速度时指的是反应的 ⒊ 磺胺类药物可以抑制 三、名词解释 ⒈ 酶催化的中间烙合物学说;⒉ 转换数;⒊ 酶激活剂和抑制剂;⒋ 酶抑制作用和失活作用; 四、问答题 ⒈ 什么是米氏方程?Km 的意义是什么?如何求米氏常数? ⒉ 什么是酶的最适 pH?pH 如何影响酶的活力? ⒊ 什么是酶的最适温度?温度如何影响酶促反应速度? ⒋ 测定酶活力时为什么要加过量的底物? ⒌ 什么是酶的抑制作用?可逆抑制作用和不可逆抑制作用有什么区别?又怎样区别? ⒍ 竞争性抑制、非竞争性抑制和反竞争性抑制作用的主要区别是什么?它们在酶促反应中会使 Vmax 和 Km 值发生什么变化? ⒎ 甘油醛-3-磷酸脱氢酶,相对分子质量 4 万,由 4 个相同亚基组成,每个亚基上有一个活性位点, 在最适条件下, 5μ g 纯酶制剂每分钟可以催化 2.8μ mol 甘油醛-3-磷酸转化为甘油酸-3-磷酸。 请 计算酶的比活力和单个活性位点的转换数。 ⒏ 在不同底物浓度的反应体系中,分别测有无抑制剂存在时的 V,数据如下 速度,即底物消耗量 线;以反应速度 线。 线;以反应速度对 pH 作图,得到的是一条 时测得的反应速度。
《生物化学》酶促反应动力学

k4
[ES]
(3)推导过程-1 由中间产物学说可知,酶促反应分两步进行
在稳态下,ES的生成速率与分解速率相等,达到动态平衡即:
VES生成 = VES分解
k1([E]- [ES]) [S]=(k2+ k3) [ES] 令Km = (k2+ k3)/ k1,则
([E]- [ES]) [S]/ [ES]= (k2+ k3)/ k1= Km
第二单元 酶化学
第8章 酶通论 第9章 酶促反应动力学 第10章 酶的作用机制和酶的调节
第9章 酶促反应动力学
一、化学动力学基础(P351) 二、底物浓度对酶反应速率的影响(P355) 三、酶的抑制作用(P368) 四、温度对酶反应的影响(P378) 五、pH对酶反应的影响(P379) 六、激活剂对酶反应的影响(P380)
1、不可逆的抑制作用
抑制剂与酶的必需基团以共价键结合而引起酶活力丧失, 不能用透析、超滤等物理方法除去抑制剂而使酶复活,称 为不可逆抑制(irreversible inhibition)。
2、可逆抑制作用
抑制剂与酶的必需基团以非共价键结合而引起酶活力丧 失,能用透析、超滤等物理方法除去抑制剂而使酶复活, 称为可逆抑制(reversible inhibition)
4、抑制百分数:
i%= (1- a) × 100% = (1-vi/ v0)× 100%
(二)抑制作用的类型
抑制剂: 凡使酶的必需基团或酶的活性部位中的基团的化学
性质改变而降低酶活力甚至使酶完全丧失活性的物质, 称为抑制剂,用I表示,其作用称为抑制作用。
抑制作用一般分为: 不可逆抑制作用和可逆抑制作用两类。
的速率方程称为本征动力学方程,有具体的物理
第9章 酶促反应动力学

v
5、激活剂对酶作用的影响 激活剂对酶作用的影响
凡是能提高酶活性的物质,称为酶的激活剂( 凡是能提高酶活性的物质,称为酶的激活剂(activator) 激活剂 )
类别
、 、 、 金属离子: 金属离子:K+、Na+、 Mg2+、Cu2+、Mn2+、Zn2+、Se3+ 、 Co2+、Fe2+
阴离子: 阴离子: Cl-、Br还原剂:抗坏血酸、半胱氨酸、 有机分子 还原剂:抗坏血酸、半胱氨酸、谷胱甘肽 金属螯合剂: 金属螯合剂:EDTA
米氏常数: 米氏常数
Km
k2 + k3 = k1
推导原则 从酶被底物饱和的现象出发, 推导原则:从酶被底物饱和的现象出发,按照 原则
假说的设想进行推导。 “稳态平 衡”假说的设想进行推导。
酶反应速度与底物浓度的关系曲线
[S ]
S +E
[Et ] [ES ]
k 1 ←→ 2 k
ES
[ES ]
→ P + E
总活力单位
比活力= 总蛋白 数 总蛋白mg数
= U(或IU) mg蛋白 或 蛋白
转换系数(Kcat) )
量度转换效率
底物( 底物( moL)/ 秒每个酶分子 ) 每个酶分子
称取25mg蛋白酶配成 蛋白酶配成25mL溶液,取2mL溶液测得含蛋白氮 溶液, 溶液测得含蛋白氮0.2mg,另取 例:称取 称取 蛋白酶配成 溶液 溶液测得含蛋白氮 ,另取0.1mL 溶液测酶活力,结果每小时可以水解酪蛋白产生1500g酪氨酸,假定 个 酪氨酸, 溶液测酶活力,结果每小时可以水解酪蛋白产生 酪氨酸 假定1个 酶活力单位定义为每分钟产生1g酪氨酸的酶量 请计算:( 酪氨酸的酶量, :(1) 酶活力单位定义为每分钟产生 酪氨酸的酶量,请计算:( )酶溶液的蛋 白浓度及比活。( 每克纯酶制剂的总蛋白含量及总活力。 。(2) 白浓度及比活。( )每克纯酶制剂的总蛋白含量及总活力。[ Vm= k23 Et ](4)
生物化学(第三版)第九章 酶促反应动力学课后习题详细解答_ 复习重点

第九章酶促反应动力学提要酶促反应动力学是研究酶促反应的速率以及影响此速率各种因素的科学。
它是以化学动力学为基础讨论底物浓度、抑制剂、pH、温度及激活剂等因素对酶反应速率的影响。
化学动力学中在研究化学反应速率与反应无浓度的关系时,常分为一级反应、二级反应及零级反应。
研究证明,酶催化过正的第一步是生成酶-底物中间产物,Michaelis-Menten该呢举中间产物学说的理论推导出酶反应动力学方程式,即Km、Vmax、kcat、kcat/Km。
Km是酶的一个特征常数,以浓度为单位,Km有多种用途,通过直线作图法可以得到Km及Vmax。
Kcat称为催化常数,又叫做转换数(TN值),它的单位为s-1,kcat值越大,表示酶的催化速率越高。
kcat/Km常用来比较酶催化效率的参数。
酶促反应除了单底物反应外,最常见的为双底物反应,按其动力学机制分为序列反应和乒乓反应,用动力学直线作图法可以区分。
酶促反应速率常受抑制剂影响,根据抑制剂与酶的作用方式及抑制作用是否可逆,将抑制作用分为可逆抑制作用及不可逆抑制作用。
根据可逆抑制剂与底物的关系分为竞争性抑制、非竞争性抑制及反竞争性抑制3类,可以分别推导出抑制作用的动力学方程。
竞争性抑制可以通过增加底物浓度而解除,其动力学常数Kˊm变大,Vmax不变;非竞争性抑制Km不变,Vˊmax变小;反竞争性抑制Kˊm及Vˊmax均变小。
通过动力学作图可以区分这3种类型的可逆抑制作用。
可逆抑制剂中最重要的是竞争性抑制,过度态底物类似物为强有力的竞争性抑制剂。
不可逆抑制剂中,最有意义的为专一性Ks型及kcat型不可逆抑制剂。
研究酶的抑制作用是研究酶的结构与功能、酶的催化机制、阐明代谢途径以及设计新药物的重要手段。
温度、pH及激活剂都会对酶促反应速率产生重要影响,酶反应有最适温度及最适pH,要选择合适的激活剂。
在研究酶促反应速率及测定酶的活力时,都应选择酶的最适反应条件。
习题1.当一酶促反应进行的速率为Vmax的80%时,在Km和[S]之间有何关系?[Km=0.25[S]]解:根据米氏方程:V=Vmax[S]/(Km+[S])得:0.8Vmax=Vmax[S]/(Km+[S])Km=0.25[S]2.过氧化氢酶的Km值为2.5×10-2 mol/L,当底物过氧化氢浓度为100mol/L时,求在此浓度下,过氧化氢酶被底物所饱和的百分数。
北京师范大学生物化学课件 第9章重点

v=
- —— dt
dc1
or
v = —— dt
c2:底物浓度
dc2
c1:反应物浓度 反应物浓度
2.反应分子数和反应级数 .
(1)反应分子数 ) 反应分子数是反应中真正相互作用的分子的数目. 反应分子数是反应中真正相互作用的分子的数目.
反应分子数 单分子 双分子 三分子 反应式 A→ P A+B → P+Q A+B+C → P+Q 速率方程式 v = kcA v = kcAcB v = kcAcBcC
pH 对酶反应的影响
100
在一定的pH 在一定的pH 下,
Relative Activity (%)
80
酶具有最大的催 化活性, 化活性,通常称此 pH. pH 为最适 pH. 最适pH是酶的特 最适pH是酶的特 pH 性之一. 性之一.
60
40
20
最适pH 最适
0 2 3 4 5 6 pH 7 8 9 10
一方面是温度升高, 一方面是温度升高,酶促反 应速度加快. 应速度加快.
Relative Activity (%) 100 80
另一方面,温度升高,酶的 另一方面,温度升高, 高级结构将发生变化或变 性,导致酶活性降低甚至 丧失. 丧失. 因此大多数酶都有一个最 适温度. 适温度.在最适温度条件 下,反应速率最大. 反应速率最大.
习题
1.解释中间络合物学说和稳态理论,并推导修 .解释中间络合物学说和稳态理论, 正后的米氏方程. 正后的米氏方程. 2.课本 381习题 . .课本P 习题1. 3.课本 381习题 . .课本P 习题3. 4.推导竞争性可逆抑制作用的动力学方程. .推导竞争性可逆抑制作用的动力学方程. 5.课本 382习题 . .课本P 习题8.
2019生物竞赛生物化学09酶动力学杨荣武《生物化学原理(一)》(39张PPT)

几种酶的动力学参数
米氏方程的双重性
当底物浓度很低的情况下,即[S]<<Km,米氏方程可转 变为:
这时反应速率与底物浓度成正比,符合一级动力学; 当底物浓度很高的情况下,即[S]>>Km,米氏方程可转
四、别构酶的动力学
1. 别构酶的性质 2. S 形曲线和Hill 方程 3. Hill 作图 4. 协同性的优点
影响酶促反应的因素
酶促反应速率和反应类型 酶反应速率与非酶促反应一样,一般都是以单位时间 内,底物或产物浓度的变化值来表示。
影响酶促反应速率的因素 影响酶促反应速率的主要因素包括:酶浓度、底物浓 度、反应温度、反应介质的pH和离子强度以及有无抑 制剂的存在等。
最后,米氏方程可重写成:
解读米氏方程
1. 解读米氏常数Km
Km是酶反应初速率为Vmax一半时底物的浓度。在一定条件下,可以使用 它来表示酶与底物的亲和力。一个酶的Km越大,意味着该酶与底物的亲 和力越低;反之,Km越小,该酶与底物的亲和力越高。 Km可以帮助判断体内一个可逆反应进行的方向。如果酶对底物的Km值小 于对产物的Km值,则反应有利于正反应。否则,有利于逆反应。
正比关系,避免了反应产物以及其它因素的干扰 ② 酶底物复合物处于稳态即ES浓度不发生变化 ③ 符合质量作用定律
Leonor Michaelis (1875-1949)
Maud Menten (1879-1960)
米氏方程的推导
对于一个单底物-单产物反应:
假定νf表示ES形成的速率,νd为ES解离的速率,那么νf= k1[E][S], 即νd=k-1[ES]+k2[ES]=(k-1+k2)[ES]
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
§2.8 酶促反应动力学(9章 P351)
一一一底物浓度对酶反应速率的影响
用反应初速度v对底物浓度[S]作图得P355 图9-6。
曲线分以下几段:
一1一OA段:反应底物浓度较低时v与[S]成正比,表现为一级反应, v = k[S]。
根据酶底物中间络合物学说,酶催化反应时,首先和底物结合生成中间
复合物ES,然后再生成产物P,并释放出E。
E + S = ES → P + E
OA段上,底物浓度小,酶未被底物饱和,有剩余酶,反应速率取决于ES浓
度,与[S]呈线性关系,v正比于[S]。
一2一AB段:反应速度不再按正比升高,表现为混合级反应。
此时酶渐渐为底物饱和,[E S]慢慢增加,v也慢慢增加,为分数级反应。
一3一BC段:反应速度趋于V max,为零级反应,酶促反应表现出饱和现象。
此时底物过量[S]>[E],
[E]已全部转为[E S]而恒定,因此反应速率也恒定,为最大反应速率,V m
为[E]所决定。
ax
非催化反应无此饱和现象。
酶与底物形成中间复合物已得到实验证实。
一一一酶促反应力学方程式
一1一米氏方程推导
1913年Michaelis和Menten提出并推导出表示[S]与v之间定量关系的米氏方程
V max[S]
V =
K m + [S]
Km:米氏常数,物理意义为反应速率为最大速率V max一半时底物的浓度,
单位与底物浓度同。
推导:酶促反应分两步进行。
k1 k3
E + S ES → P + E
k2
v = k3 [ES]
一般k3为限速步骤 v = k3 [ES] … ①
1.[ES] 生成速率:
d[ES]/dt = k1([E] - [ES]) [S]
2.[E S]分解速率:
-d[ES] / dt = k2 [ES] + k3 [ES] = (k2 + k3) [ES]
3.稳态下[ES]不变,ES生成速率和分解速率相等:
k1 ([E]- [ES]) [S] = (k2+k3) [ES]
4.引入K m:令K m = k2+k3 / k1
代入K m = ([E]- [ES]) [S] / [ES] ,
K m [ES] = [E] [S]- [S] [ES], [ES] (K m + S) = [E] [S],
[ES] = [E] [S] / K m+[S],
5.代入①式:v = k3 [ES] = k3 [E] [S] / K m + [S] … ②
6.引入V max:为所有酶都被底物饱和时的反应速率,即此时[E]= [ES]
V max = k3 [ES] = k3 [E]
代入②式:v = V max [S] / K m + [S]
米氏方程表示K m及V max已知时,v~[S]的定量关系。
一2一米氏常数的意义
1.K m是酶的一个特性常数,K m大小只与酶性质有关,而与酶浓度无
关。
当底物确定,反应温度,p H及离子强度一定时,K m值为常数,可用来
鉴别酶。
P359 表9-1 列出一些酶的K m值。
一般K m在1×10-6~10-1mol/L之间。
不同的酶K m值不同,测定K m要在相同测定条件(pH、温度、离子强度)下进行。
2.K m值可用于判断酶的专一性和天然产物,若一个酶有几种底物就
有几个K m值,其中K m值最小的底物称为该酶的最适底物,又称天然底物。
3. 1 / K m可近似表示酶与底物亲和力的大小。
真正表示酶与底物亲和力为K s=k2 / k1 ,(注 K m= k2+k3 / k1)。
4.已知K m可由[S]计算v,或由v计算[S]。
5.K m可帮助推断某一代谢反应的方向和途径。
K m小的为主要催化方向(正、逆两方向反应K m不同)。
一3一V max和k3(k cat)的意义:
酶浓度[E]一定,则对特定底物V max为一常数。
催化常数 k cat 又称酶的转化数,数值上与k3同,为酶被底物饱和时,每秒钟每个酶分子
转换底物的分子数。
大多数酶的k cat为1~104/sec,见P322 表8-
2,为每秒钟酶促反应每微摩尔酶分子转换底物的微摩尔数。
k cat越大,酶
催化效率越高。
一4一k cat / K m的意义:
生理条件下S << K m,V max = k cat [E]
代入米氏方程 v = k cat [E] [S] / K m + [S] = k cat [E] [S] / K m
得出:v = k cat / K m[E][S]
k cat / K m为[E]和[S]反应形成产物的表观二级速度常数,单位:L/mol s。
可以比较不同酶或同一种酶催化不同底物的催化效率,见P362 表9-4。
k cat / K m大小可以比较不同酶或同一种酶催化不同底物的催化效率。
一一一米氏常数求法:
一1一双倒数法:
1 / v = K m / V max×1 /[S] + 1 / V max
以1 / v ~ 1 / [S]作图,见P363 图9-10
纵轴截距:1 / V max;横轴截距:-1 / K m;斜率:K m / V max。
(2)v ~ v / [S]法(Eadic-Hofstee):
v = -K m×v / [S] +V max以v ~ v / [S]作图,见P363 图9-11。
斜率:-K m;纵轴截距:V max;横轴截距:V max / K m。
(3)[S] / v ~ [S]法(Hanes-Woolf):
[S] / v = K m / V max + 1 / V max×[S]
以[S] / v ~ [S]作图,见P363 图9-12
斜率:1 / V max;纵轴截距:K m / V max;横轴截距:-K m。
§2.9 酶的抑制作用
失活作用:使酶蛋白变性而引起酶活力丧失。
抑制作用:酶的必需基团的化学性质改变而引起酶活力降低或丧失,但不引起酶蛋白变性。
引起抑制作用的物质称为抑制剂。
研究酶的抑制剂,可以研究酶的结构与功能、酶催化机制,进行药物、农药的设计与筛选。
一一一抑制作用的类型:
一1一不可逆抑制作用:
抑制剂与酶必需基团以共价键结合而引起酶活力丧失,不能用透析、超过滤等物理方法除去抑制剂而使酶复活,酶被化学修饰。
一2一可逆抑制作用:
抑制剂与酶以非共价键结合而使酶活力降低或丧失,能用物理方法除去抑制剂而使酶复活。
可逆抑制又分为三种类型,如P369 图9-17所示。
1.竞争性抑制:抑制剂(I)和底物(S)竞争酶的结合部位,从而影响了
底物与酶的正常结合。
抑制剂结构大多与底物类似,许多底物过渡态类似物为抑制剂。
抑制剂与酶活性部位结合形成EI复合物,抑制酶与底物的结合。
竞争性抑制可以通过增加底物浓度而解除,如丙二酸或戊二酸对琥珀酸脱氢酶的抑制。
2.非竞争性抑制:底物和抑制剂同时和酶结合,两者无竞争作用。
I与
S结构无共同之处,酶活性降低或被抑制,不能用增加底物浓度来解除抑制,如Leu是精氨酸酶非竞争性抑制剂。
3.反竞争性抑制:酶只有与底物结合后才能与抑制剂结合。
常见于多
底物反应中,如肼类化合物抑制胃蛋白酶。
一一一可逆抑制作用和不可逆抑制作用动力学鉴别
加入一定量抑制剂,以v与酶浓度[E]作图,见P370 图9-8。
加不可逆抑制剂使直线原点右移,斜率不变,加入酶使浓度大于不可逆抑制剂,才表现酶活力;加可逆抑制剂,直线原点不动,斜率变小。
一一一可逆抑制作用动力学
一1一竞争性抑制:1 /v ~ 1 /[S]作图见P371 图9-20,V max不变,K m变大。
纵轴截距:1
/V max不变,V max不变,底物浓度足够高,可克服抑制作用;横轴截距:1
/K m变小,K m变大;斜率:K m / V max变大。
一2一非竞争性抑制:1 /v ~ 1 /[S]作图见P372 图9-21,V max变小,K m不变。
