第九章蛋白质结构案例
第九章-蛋白质相互作用网络

1.组成和修复生物体 蛋白质是生物体细胞的基本构成物质。 人体的肌肉、内脏、皮肤、大脑、毛发、血液及骨 骼等的主要成分都是蛋白质。 蛋白质还可以帮助伤口血液凝固并促进其愈合。
2.调节生物体的生理机能 构成生物体差不多所有的生命活性物质,例如:
催化体内各种生物化学反应的酶 调节机体生长、发育并行使正常生理功能的激素
认为如果由于进化压力来维持特定模体的话,模体中的 组成蛋白应该是进化保守的并且在其他物种中具有直系 同源性。
他们研究了678个蛋白质,且在五个其他物种中都分别 具有一个直系同源蛋白。
五个物种:拟南芥、果蝇、小鼠、线虫和人。
分析结果发现,不同的模体中的蛋白质具有不同的保守率。
只有不到5%的三节点组成的线性模体其组成蛋白质在五个物种 中是完全保守的,而47%的五节点组成的完全连通的模体在五个 物种中是完全保守的。这些结果说明直系同源蛋白在酵母蛋白质 相互作用网络中不是随机分布的,而是保守模体的基本组成使得 这些模体是进化保守的。
蛋白质相互作用:
1. 通过对蛋白质相互作用的研究,认识生命活动的 基本规律。(科学)
2. 利用蛋白质相互作用,发展技术,用于研究生命 活动的规律或应用性技术。(技术)
蛋白相互作用网络
PPIN在许多生物过程和研究防治疾病中发挥着非常重要 的作用。
PPIN的研究比基因网络更为复杂和困难。 蛋白质相互作用网络近年来明显发展较快。
综上所述,蛋白质参与了生命的几乎所有过程,例如遗 传、发育、繁殖、物质和能量的代谢、应激等。
揭示生物体内成千上万种蛋白质的具体功能及其实施功 能的机制,是在21世纪后基因组时代蛋白质研究的核心 内容,也是当前生物科学极富挑战性的研究领域之一。
二、蛋白质组学
第9章 蛋白质的生物合成

其它位点
Ø Peptidyl transferase Ø 多肽链离开通道 Ø mRNA 结合位点 Ø 各种蛋白质因子的结合位点
核糖体与mRNA类似物、tRNA(结合在P 、E位点)一起获得的结晶衍射结果表明:核 糖体中的rRNA 而不是蛋白质,在30S亚基解 码时、与tRNA相互作用中、以及50S亚基的 肽键形成过程中起主要作用。
Ø 大多数碱基-碱基之间的相互作用发生在不变或半 不变碱基之间。
同工tRNA
Ø 超过70种 tRNA负责转运 20种氨基酸; Ø 同工tRNA (Isoaccepting tRNA):
携带同一种氨基酸的不同的tRNA。
四、密码子与反密码子
Ø mRNA上的核苷酸排列顺序称为遗传密码。 Ø mRNA上每三个相邻的核苷酸构成密码子。 Ø tRNA反密码环上的三个相邻的核苷酸构成反密
Ø 大多数生物体含有 20种 aaRSs ; Ø 少数超过 20种 (如E.coli:21种); Ø 少数少于 20种 (如嗜热产甲烷菌:19种).
2、aaRS的高度特异性
1) aaRS对tRNA和AA都高度特异(一一对应); 2) aaRS根据“tRNA identity”(tRNA个性)选择
终止密码子的选择
大肠杆菌
枯草杆菌
酵母
果蝇
UAAU 50.0 UAAU 50.0 UAAG 35.9 UAAG 50.0
UAAG 19.0 UAAG 20.0 UAAA 33.3 UAAA 25.0
UGAU 14.7 Others 16.3
UGAU 10.0 Others 20.0
UAAU 16.7 Others 14.1
【北师大】细胞生物学-----第9章蛋白质分选与膜泡运输

信号假说
① ER转运蛋白质合成的起始。通过ER转运的蛋白合成仍然起 始于胞质溶胶中的游离核糖体。核糖体是蛋白质合成的基本 装置,它并不决定合成蛋白质的去向,合成的蛋白质何去何 从,是由mRNA决定的,也就是说是由密码决定的。
②信号序列与SRP结合。SRP的信号识别位点识别新生肽的信号 序列并与之结合; 同时,SRP上的翻译暂停结构域同核糖体的 A位点作用, 暂时停止核糖体的蛋白质合成。
蛋白质氨基末端的信号序列除了作为信号被SRP识别外, 还具有起始穿膜转移的作用。
可切除(信号肽酶作用位点)
2.内部信号序列(internal signal sequence)
不位于N-末端,但具信号序列的作用,故称为内含信号序列 。
可作为蛋白质共翻译转移的信号被SRP识别,同时它也是起 始转移信号。
③SRP受体(SPR receptor),是膜的整合蛋白,为异二聚体蛋白, 存在于内质网上,可与SRP特异结合。
④停止转移序列(stop transfer sequence),肽链上的一段特 殊序列,与内质网膜的亲合力很高,能阻止肽链继续进入内质 网腔,使其成为跨膜蛋白质。
⑤转位因子(translocator),由3-4个Sec61蛋白复合体构成的 一个类似炸面圈的结构,每个Sec61蛋白由三条肽链组成。
因停止转移信号的作用而形成单次跨膜的蛋白,那么该蛋白
在结构上只有一个停止转移信号序列,没有内含转移信号, 但在N-端有一个信号序列作为转移起始信号。
该蛋白在N-末端信号序列的作用下进行共翻译转运,当停止转移信号进入通道后,与 通道内的结合位点相互作用,使通道转运蛋白失活,从而停止蛋白质的转运。由于N末端的信号序列是可切除的,信号序列被切除后形成单次跨膜蛋白。
22-第9章 蛋白质组-折叠与降解

真核细胞内蛋白质降解的场所
动物细胞的溶酶体(lysosome)是蛋白质降解场所.
E3连接酶家族成员数
F-box 家族
Ring finger家族
---------------------------------------------------------------
酵母
11
线虫
326
90
果蝇
22
4. 循环逐个添加泛素分子。
蛋白质输送到蛋白酶体降解
19S调节复合物含ATP酶,可将蛋白质去折叠送入蛋白酶体内腔, 被降 解生成的多肽链从蛋白酶体另一侧复合物的孔道离开蛋白酶体.
20S
蛋 白 酶 体 结 构 与 功 能
泛素介 导的蛋 白质降 解是一 个有序 的级联
反应
蛋白质泛素化是一个程序化过程:首先泛素需经泛素激活 酶 (E1)活化,然后转移到泛素配位酶(E2)。与此同时, 泛素连接酶 (E3)与选择的降解底物蛋白质结合,并和E2 协作将泛素转移到蛋白质,使蛋白质泛素化。
分 子 伴 侣
细胞中蛋白质从核糖体上合成后,分子伴侣蛋白 (chaperone)即可与新生多肽链结合,阻止疏水 性氨基酸之间的自发聚合。
分子伴侣与蛋白质折叠
蛋白质折叠体的功能
蛋白质在折叠体 GroEL中的折叠 过程 GroEL由 两层7亚基蛋白环 状结构组成,每
个亚基蛋白可与 ATP结合,ATP 的水解提供蛋白
识别 降解 蛋白 质的 三种 方式
借助 磷酸 化修 饰 识别 降解 蛋白 质
免疫应激反应借助磷酸化促使转录抑制蛋白降解, 启动相 关基因的表达。NFkB转录因子由亚基p5O和p65组成。
植物激素响应涉及 抑制因子降解
植物激素如 生长素(a) 和赤霉素(b) 诱导下游基 因表达涉及 抑制因子的 降解(c), 由此释放转 录激活蛋白 ,从而启动 下游激素路 线响应基因 的表达。
生化论文蛋白质的结构与功能ppt课件

3.从某种意义上说,共价键维系了蛋白质的一级结构; 主链上的氢键维系了蛋白质的二级结构;而氨基酸侧链 的相互作用和二硫桥维系着蛋白质的三级结构。亚基 (subunit)内部的侧链相互作用是构象稳定的基础,蛋白 质链之间的侧链的相互作用是亚基组装(四级结构)的基 础,而蛋白质中侧链与配体基团问的相互作用是蛋白质 行使功能的基础。在蛋白质合成过程中还需有形成空间 结构的控制因子,称为分子伴侣(molecular chaperons)。 在蛋白质合成时,尚未折叠的肽段有许多疏水基团暴露 在外,因此具有分子内或分子间聚集的倾向,从而影响 蛋白质的正确折叠。分子伴侣可以与未折叠的肽段进行 可逆的结合,引导肽链的正确折叠,并集合多条肽链成 为较大的结构。例如,热休克蛋白就是分子伴侣的一个 家族。 蛋白质一定的结构执行一定的功能,功能不同
探求数字中所蕴含的规律,且根据这一规律将蛋白质进行
分类,再将分类的结构与蛋白质的功能进行比较,以检验
蛋白质抽象结构的合理性。如果一种对蛋白质结构的简化、
比较和分类能与蛋自质的功能有较好地对应关系,那么这
就是一种对蛋白质结构的有价值的理解。蛋白质结构中, 多种弱力(氢键、范德华力、静电相互作用、疏水相互作 用、堆积力等)和可逆的二硫键使多肽链折叠成特定的构 象。
13
5.蛋白质是生物体各种功能的执行者,同时也是生 物体结构的构建者,蛋白质只有正确折叠并形成相 应的高级结构,才能正常行使其生物学功能,因此 蛋白质结构的研究一直是生物学领域的热点,蛋白 质的一级结构决定其高级结构和功能。
参考文献:1 黄积涛. 蛋白质结构、运动、功能. 天津大学博士学位论文 . 2002 2 胡敏 . 蛋白质结构的空间分布特征研究 . 浙江大学博士学位论文 .
小单位,它们处于永不停息的衰老、
分子生物学09 蛋白质合成

第九章 蛋白质的生物合成_______翻译( translation ) 9.1 参与翻译的主要生物大分子的结构与功能• 核糖体 • mRNA • tRNA• 氨酰-tRNA 合成酶• 辅助蛋白因子(起始因子、延伸因子和终止释放因子)6核糖体的分类与组成70-100 pro8•A 部位—氨酰tRNA 结合部位,也称为受体部位;•P 部位—肽酰tRNA 结合部位;•E 部位—空载tRNA 临时结合的部位;•肽酰转移酶活性部位—催化肽键形成的部位;•mRNA 结合部位;•多肽链离开通道—正在延伸的多肽链离开核糖体的通道;•一些可溶性蛋白质因子(起始因子、延伸因子和终止因子)的结合部位。
9真核细胞多聚核糖体的结构12原核生物多顺反子mRNA 和真核生物单顺反子mRNA 的翻译Shine-Dalgarno sequence, SDmRNA13tRNACC A D-loop14大肠杆菌起始tRNA 的结构氨酰-tRNA 合成酶(aaRS )ó 两步反应机制:1) ATP + 氨基酸 (AA) --> AA-AMP + PP i 2) tRNA + AMP-AA --> AA-tRNA + AMPó分类1) 第一类aaRS 2) 第二类aaRSó校对机制- 在装载氨基酸水平的质量控制1) aaRS是对氨基酸“身份”进行检查唯一的场所2) 核糖体不在乎哪一种氨基酸与tRNA相连3) 实载的tRNA被修饰后仍然能起作用4) 装载前和装载后编辑5) 双筛机制➢mRNA中的起始密码是AUG,少数是GUG。
➢起始密码子的上游约10个核苷酸的地方往往有一段富含嘌呤的序列称SD序列(Shine-Dalgarno序列),一般为3~10个核苷酸,它与核糖体16srRNA 3ˊ端的核苷酸序列互补,可促使核糖体与mRNA 的结合。
氨酰-tRNA合成酶(aaRS)20两类氨酰-tRNA合成酶的催化机理两类aaRS•第一类aaRS一般是单体酶,由此类酶催化的氨基酸有Arg、Cys、Gln、Glu、Ile、Leu、Met、Trp、Tyr和Val。
蛋白质分子的结构解析PPT课件

蛋白质的四级结构涉及亚基的组成、 形状、大小以及亚基之间的相互关系 。四级结构的变化会影响蛋白质的整 体功能。
结构域
总结词
蛋白质的结构域是指在较大的蛋白质分子中,可以独立折叠为较为稳定的三级 结构的区域。
详细描述
结构域通常由200-400个氨基酸残基组成,具有特定的空间构象和功能。不同 的结构域可以组成不同的蛋白质,也可以存在于同一蛋白质的不同部位。
疾病诊断与治疗
疾病标志物发现
通过蛋白质结构解析,可以发现 与疾病相关的标志物,用于疾病
的早期诊断。
个性化治疗
基于蛋白质结构的差异,可以为患 者提供更加个性化的治疗方案,提 高治疗效果。
药物疗效评估
通过比较治疗前后蛋白质结构的变 化,可以评估药物治疗的效果。
生物工程与农业应用
酶工程
蛋白质结构解析有助于设计和优 化酶的活性位点,提高酶的催化
核磁共振技术
总结词
核磁共振技术是一种利用核自旋磁矩进行研究的方法,可以对蛋白质的溶液构象进行解 析。
详细描述
核磁共振技术利用核自旋磁矩的相互作用,通过外部磁场对核自旋进行操控,检测其共 振信号。对于蛋白质分子,可以利用该技术检测其氢原子、碳原子等核自旋的共振信号, 从而推断出蛋白质在溶液中的构象和动态行为。该方法具有高分辨率和高灵敏度,能够
05 蛋白质的结构解析方法
X射线晶体学
总结词
X射线晶体学是一种通过X射线分析晶体 结构的方法,广泛应用于蛋白质结构解 析。
VS
详细描述
X射线晶体学利用X射线在晶体中的衍射 效应,通过分析衍射图像,可以确定晶体 的原子排列和分子结构。对于蛋白质分子 ,可以通过结晶将其固定成晶体,然后利 用X射线分析其结构。该方法能够提供高 分辨率的结构信息,是解析大型蛋白质结 构和复杂蛋白质复合物结构的主要手段之 一。
《蛋白质的结构》PPT课件

36
精选课件ppt
(3) 球状蛋白质分子是紧密的球状或椭球状 实体
(4) 球状蛋白质疏水侧链埋藏在分子内部, 亲水侧链暴露在分子表面
疏水作用力是维持三级结构的主要动力。
(5) 球状蛋白质分子的表面有一个空穴(也称 裂沟、凹槽或口袋)
这种空穴常是结合底物、效应物等配体并 行使生物功能的活性部位。
亚基缔合还可以屏蔽亚基表面 上的疏水残基以避开溶剂水。
41
精选课件ppt
2. 使催化基团汇集在一起
寡聚体的形成可使不同单体亚基的催化基 团汇集在一起以形成完整的催化部位。
42
精选课件ppt
4. 使寡聚蛋白具有别构效应和协同性
多亚基蛋白质一般具有多个结合部位,结合 在蛋白质分子的特定部位上的配体对该分子 的其他部位所产生的影响(如改变亲和力或催 化能力)称为别构效应。
(4)β转角多数都处在蛋白质分子的表面, 在这里改变多肽链方向的阻力比较小。β转 角在球状蛋白质中的含量是相当丰富的, 约占全部残基的四分之一。
21
精选课件ppt
四、无规卷曲(randon coil)
22
精选课件ppt
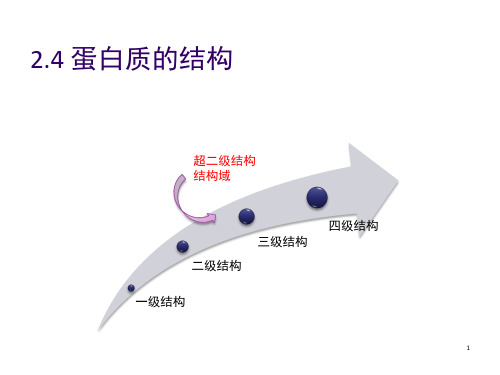
超二级结构和结构域
23
精选课件ppt
一、超二级结构(super—secondary struture)
-“非极性基团
被极性水分子排 挤相互聚拢”作
用力。
离子键(
或盐键)
精选课件ppt
肽键 二硫键 离子键 氢键 疏水键 范德华力
键能
90kcal/mol
3kcal/mol 1kcal/mol 1kcal/mol 0.1kcal/mol
这四种键能远小于共价键,称次级键
提问:次级键微弱但却是维持蛋白质三级结构中主
蛋白质主要结构以及功能含举例

蛋白质的主要结构以及功能含举例
35
β-片层或β-折叠 (pleated sheet structure)
➢伸展的肽链结构 ➢肽键平面之间折叠成锯齿状, 相邻两平面呈110度 ➢结构的维系依靠肽链间的氢键, 氢键的方向与肽链长轴垂直
➢肽链的N末端在同一侧---顺向平行, 反之为反向平行。
蛋白质的主要结构以及功能含举例
和结构域(domain)
➢蛋白质的超二级结构(模体,motif)
蛋白质多肽链上的一些二级结构单元, 有规律地聚集起来, 形成αα,βββ,βαβ, β2α, αTα 等结构称为超二级结构。 例如:基因表达调控中的转录因子(具备功能)
(锌指,亮氨酸拉链、αTα、 β2α )
蛋白质的主要结构以及功能含举例
36
β-转角(β-turn)
➢肽链出现1800转回折的“U”结构 ➢由第1个氨基酸残基的C=O 与第4个氨基酸残基的N-H形成氢键, 中间包括10~12个原子, 较α螺旋紧密 ➢常位于球蛋白分子表面, 为蛋白质活性的重要空间结构部分
蛋白质的主要结构以及功能含举例
37
π-螺旋( π-he维系螺旋稳定 ➢多见于胶原蛋白,3股左手螺旋盘绕 形成右手超螺旋后转变为胶原纤维
芳香族 3种 Tyr Phe Trp
杂环族 2种 His Pro
蛋白质的主要结构以及功能含举例
7
❖根据酸碱性分类:
酸性氨基酸: 2 个–COOH、 1个-NH2 Asp Glu
碱性氨基酸: 1 个–COOH、 2个碱性基团
(氨基、胍基、咪唑基)
Arg Lys His
中性氨基酸: 1 个–COOH、 1个-NH
1、一级结构不同,功能不同 2、一级结构相同,功能相同 3、一级结构中非关键部位氨基酸残基发生
蛋白质结构解析课件

亚基结构
某些蛋白质由多个亚基组成,每个亚 基具有独立的三级结构。
PART 02
蛋白质结构解析方法
X射线晶体学
X射线晶体学是解析蛋白质结构的主要方法之一,通过分析X射线在晶体中的衍射, 可以获得蛋白质分子的三维结构信息。
X射线晶体学适用于蛋白质大分子,尤其是膜蛋白和复合物蛋白的结构解析,能够提 供高分辨率的结构信息。
酶的结构解析
酶的结构包括一级、二级、三级和四级结构,其中一 级结构是指氨基酸的排列顺序,二级结构是指肽链的 折叠方式,三级结构是指整条肽链的三维构象,四级 结构是指多亚基酶蛋白的组合方式。
单击此处添加正文,文字是您思想的提一一二三四五 六七八九一二三四五六七八九一二三四五六七八九文, 单击此处添加正文,文字是您思想的提炼,为了最终 呈现发布的良好效果单击此4*25}
变构效应
蛋白质的变构效应是指蛋白质在与其配体或效应物结合后, 其空间构象发生改变,进而影响其功能的过程。这种效应通 常是由蛋白质中的特定氨基酸残基与配体或效应物的相互作 用所引起的。
变构效应的意义
变构效应在生物体内具有重要的意义,它可以帮助生物体快 速适应环境变化,并调节各种生理过程。例如,某些激素可 以通过变构效应调节靶蛋白的活性,从而影响细胞内的信号 转导过程。
作用具有重要意义。
核磁共振技术解析蛋白质结构的难点在 于信号解析和数据处理,需要专业的技
术和经验。
电子显微镜技术
电子显微镜技术是解析蛋白质结构的重要手段之一,通过观察蛋白质颗 粒的形貌和排列,可以获得蛋白质大分子和复合物的结构信息。
电子显微镜技术适用于观察蛋白质颗粒和病毒等大分子结构,能够提供 高分辨率的形貌信息,对于研究蛋白质的功能和相互作用具有重要意义。
第九章 蛋白质结构分析

全β-折叠蛋白质
人晶状体蛋白(上图c, d)和大肠杆菌NANC离子通道蛋白(下图f)
a-螺旋/β-折叠蛋白质
细胞表面标志蛋白CD98(图d)及糖酵解的绝大多数酶蛋白 (图a)
a-螺旋+β-折叠类蛋白质
人TBP与双螺旋DNA复合物(1CDW.pdb)
(四)四级结构的主要类型和特征
有独立三级结构的单元通过非共价键聚集成的非共价 复合物称为四级结构,其所含独立三级结构单位为亚 基(subunit)。形成四级结构全部依靠非共价键相互 作用,且来自不同亚基的二级结构间可发生强的相互 作用以稳定四级结构,如生成跨亚基的更大β折叠结 构或α螺旋聚集体;其中,氢键、疏水相互作用和静 电作用是主要维持力。为了形成稳定的四级结构,必 然要求相互作用的任两个蛋白质间在空间外形互补以 增加接触面且理化性质互补。这些特征也是预测蛋白 质间相互作用时有用的辅助判据。
(1)主链骨架围绕中心轴盘绕形成右手螺旋; (2)螺旋每上升一圈是3.6个氨基酸残基,螺距为 0.54nm; (3)相邻螺旋圈之间形成许多氢键; (4)侧链基团位于螺旋的外侧。
2. β折叠(βsheets) 的结构特征为:
(1)若干条肽链或肽段平行或反平行排列成片; (2)所有肽键的C=O和N—H形成链间氢键; (3)侧链基团分别交替位于片层的上、下方。
3. 蛋白质三级结构中二级结构的折叠和组装
按二级结构组装模式对蛋白质进行分类对解析蛋 白质高级结构形成规律和预测蛋白质功能有重要 帮助。蛋白质二级结构组装模式主要是全α螺旋 、全β折叠、α螺旋/β折叠,还有少量α螺旋+β 折叠类。
全a-螺旋蛋白质
人血清白蛋白(上图a,b)和细菌视紫红质(下图 a-c)
人细胞珠蛋白(2DC3.pdb)的第121到140位残基 对应的a-螺旋侧面和顶部(N端)视图
《蛋白质结构》PPT课件
位于结构域之间,有利 于活性中心与底物结合
12
4、蛋白质的三级结构
多肽链在二级结构、超二级结构和结构域等结构 层次的基础上,组装而成的完整结构单元。
三级结构的形成使肽链中所有的原子都达到空间 上的重新排布。
举例:1963年Kendrew等通过鲸肌红蛋白的x-射 线衍射分析,测得了它的空间结构
4
(1)α-螺旋(α-helix)
a-螺旋:是多肽链沿长轴卷曲 而成的有规则的螺旋型构象。
要点 每个螺旋含3.6个AA残基,螺距
0.54nm,螺旋直径0.5nm,每个残 基绕轴旋转100o ; 螺旋体中所有氨基酸残基R侧链 都伸向外侧
5
相邻螺旋间(第n个氨基酸残基C=O的氧与第n+4 个氨基酸残基的-NH氢之间)形成平行于螺旋轴 的氢键,肽链上所有的肽键都参与氢键的形成
20
(三)蛋白质的变性
概念:天然蛋白质受物理或化学因素的影响,分 子内部原有的高度规则性的空间排列发生变化, 致使其原有性质和功能发生部分或全部丧失。
变性的因素及作用机制
因素
作用机制
热
破坏氢键
酸碱
破坏盐键
醇
分子进入肽链间空隙,破坏次级键
ቤተ መጻሕፍቲ ባይዱ
高浓度尿素 破坏氢键
盐酸胍
破坏氢键,使-SH暴露
21
变性后的特征
谷氨酸、丝氨酸 8、请列举氨基酸的化学性质,并简述其应用。
作业:P61 3、4
28
3
2、蛋白质的二级结构
蛋白质的二级结构:蛋白质分子中多肽链本身折叠和 盘绕的方式,它仅涉及肽链中主链的构象,并不涉及 侧链的构象。
蛋白质主链的折叠是由氢键维系的有规则的重复构象 组成
第九章蛋白质分解代谢
• 两种重要的转氨酶
草酰乙酸 酸
谷氨酸
GOT
天冬氨酸 氨酸
α-酮戊二酸
丙酮
GPT 丙
A 谷丙转氨酶(GPT,ALT) 急性肝炎患者血清GPT↑↑
B 谷草转氨酶(GOT,AST) 心肌梗死患者血清GOT↑↑
(三)联合脱氨基作用
定义:转氨酶与L-谷氨酸脱氢 酶联合催化使氨基酸的α-氨 基脱下并产生游离氨的过程 称为联合脱氨基作用
我国营养学会推荐80g/日
三、蛋白质的营养价值
➢ 必需氨基酸: 人体需要,但体内不能合成,
必须由食物供给的氨基酸
共有8种:苏、亮、色、苯丙、 蛋、赖、异亮、缬
• 组氨酸、精氨酸
➢ 非必需氨基酸:
人体需要但能合成,不一定由 食物供给的氨基酸
➢ 食物蛋白质的营养价值
取决于所含必需氨基酸的种类、 数量及比例,愈接近人体蛋白质者, 营养价值愈高
瓜氨酸
氨基甲酰磷酸+鸟氨酸 OCT
瓜氨酸
• 反应不可逆
(3)精氨酸的合成 • 部位:胞浆
反应分2步进行
NH2 | C=O | NH | (CH2)2 | CH-NH2 | COOH
COOH
|
H2N-C-H |
精氨酸代琥珀酸合成酶
+ CH2 |
Mg2+
COOH
NH2
COOH
|
|
C===N—CH
|
谷氨酸
NAD+ L-谷氨酸脱氢酶
NADH+H+
亚氨基戊二酸
H2O NH3
α-酮戊二酸
• L-谷氨酸脱氢酶
(1) 辅酶是NAD+或NADP+ (2) 特点:分布广、活性高、特异 性强、反应可逆 (3) 专一性高
第九章蛋白质代谢

氨基酸 NH3 谷氨酸
糖 酵 解 途 径
丙酮酸
丙 氨 α-酮戊 酸 二酸
血液
葡 萄 糖
丙 氨 酸
肝
葡萄糖 尿素
糖 异 生
丙酮酸
尿素循环
NH3 谷氨酸
丙氨酸 α-酮戊二酸
丙氨酸-葡萄糖循环
目录
(2) 谷氨酰胺的运氨作用
• 反应过程
ATP 谷氨酰胺合成酶 ADP+Pi
谷氨酸 + NH3
谷氨酰胺酶
谷氨酰胺
鸟氨酸循环
1932年Krebs、 Henseleit利用大鼠肝切片 作体外实验,发现在供能的条件下,可由 CO2和氨合成尿素。若在反应体系中加入少 量的精氨酸、鸟氨酸或瓜氨酸可加速尿素 的合成,而这种氨基酸的含量并不减少。 为此,他们提出了鸟氨酸循环(ornithine cyclc),又称尿素循环(urea cycle)或 Krebs-Henseleit循环。
CH2
Mg2+
ATP
H2O AMP+PPi
(CH2)3
COOH
CH NH2
COOH
COOH
天冬氨酸
精氨酸代琥珀酸
NH2 CN
COOH CH
NH (CH2)3
CH2 COOH
CH NH2 COOH
精氨酸代琥 珀酸裂解酶
NH2 C NH
NH
(CH2)3
+
CH NH2
COOH
COOH CH CH HOOC
第九章
蛋白质代谢
►蛋白质分解代谢首先在酶的催化下水解为氨 基酸,而后各氨基酸进行分解代谢,或转变 为其它物质、或参与新的蛋白质的合成。
►因此氨基酸代谢是蛋白质分解代谢的中心内 容。
第09章 蛋白质的降解与氨基酸代谢

5. 脱酰氨作用
二、脱羧基作用
体内部分L-AA可在脱羧酶作用下,脱羧生成相应的 一级胺。生物体内广泛存在脱羧酶,其辅酶为磷酸吡 哆醛,但是His脱羧酶无需要辅基(生成组胺)。脱 羧酶的专一性很高,一般一种AA对应一种脱羧酶。
直接脱羧基作用:
氧化脱羧基作用:
*多巴进一步氧化可生成聚合物黑素。人体皮肤的表皮基 底层及毛囊中存在黑素细胞,能将酪氨酸转变为黑素 ,使皮肤和毛发呈现黑色。 *帕金森病人因中枢神经递质多巴胺的减少表现出颤抖等 症状。
Choline
第九章 蛋白质的降解与 氨基酸代谢
第三节 氨和氨基酸的生物合成
ቤተ መጻሕፍቲ ባይዱ
一、氮素循环
二、生物固氮
指大气中的分子氮 分子氮在某些微生物体内固氮酶的作用下 分子氮 还原为NH3,然后再被植物吸收,用于合成氨基酸及 其它含氮化合物的过程。 生物固氮反应在常温常压下进行,是氮素循环的重要 环节,为氨的主要来源,每年自然界生物固氮总量达 到2亿吨,远远超过工业固氮(Fe作催化剂,450℃, 20~30MPa)。
谷氨酸脱氢酶(GDH):普遍存在于动植物和微生物 谷氨酸脱氢酶 体内,无需氧气,活性和专一性都很强,且只对L-谷氨 酸起催化作用。
* 此酶是一个结构很复杂的别构酶。ATP、GTP、NADH 可抑制其活性;ADP、GDP及某些AA可激活其活性。 因此当ATP、GTP不足时,Glu的氧化脱氨会加速进行 ,有利于AA分解供能。
固氮反应
①固氮:N2 + 6H+ + 6e- → 2NH3 ②放氢:2H3O+ + 2e - → H2 + 2H2O
固氮条件 充足的ATP;②强还原剂(还原态铁氧蛋白);③厌 );③ ①充足的 ; 强还原剂(还原态铁氧蛋白); 氧环境。 氧环境。
第九章-细胞骨架(cytoskeleton)

第九章-细胞骨架(cytoskeleton)细胞骨架(cytoskeleton)是一种支持细胞形态并参与细胞运动、细胞分裂等生命活动的网络结构。
细胞骨架由细胞内的微丝(filament)、中间纤维(intermediate filament)和微管(microtubule)三种不同类型的蛋白纤维组成。
本文将分别介绍这三种蛋白纤维及其生物学功能。
微丝(filament)微丝是由直径约为0.7纳米的轻链和重链蛋白依序排列而成的,其长度可达几微米到数十微米。
微丝参与了许多细胞的活动,如细胞的贴附和收缩、细胞的定向运动、细胞分裂时的细胞质分裂等。
微丝在细胞内分布广泛,在细胞膜下、学问边缘、细胞质中均可看到它们的存在。
微丝的结构在细胞内具有动态性,微丝的动态平衡是在微丝生长和微丝解聚之间达到的。
微丝的生长是指微丝单元向氨基末端添加新的单元,微丝解聚剂解聚是指微丝单元从氨基末端依次解离。
微丝结构的多样性,使其在不同的细胞和组织中具有不同的生理和生理功能,其功能包括:1.细胞形态维持2.细胞内运动3.细胞分裂4.细胞外运动中间纤维(intermediate filament)中间纤维是由多种蛋白质复合物组成的、直径约为10纳米的蛋白质纤维,是细胞骨架中最稳定的一种类型。
与微丝相比,在细胞内时间较长,主要定位于细胞内稳定形态和细胞间连接等功能。
中间纤维具有多样性的物种、组织和细胞类型,它们的功能也很多,常见的包括:1.细胞特异性标记物2.相关细胞黏着3.细胞内物质运输4.参与细胞质形态维持5.参与细胞分裂过程微管(microtubule)微管是细胞骨架中直径最大的一类蛋白纤维,直径约为25纳米。
由两种蛋白质复合物丝状蛋白(tubulin)组成,是由 alpha 和 beta 两种 tubulin 蛋白以β特定的方向相互堆叠形成。
微管是一个高度动态的结构,依据其在细胞间操纵某些重要的细胞内形态变化,对于微管动态的研究成为细胞骨架领域的一个重要方向。
第九章酶的蛋白质工程

蛋白质定向进化概念的提出
1993年,美国科学家Arnold F H (加州理工大学,生物化学家)首 先提出酶分子的定向进化的概念, 并用于天然酶的改造或构建新的非 天然酶。
定向进化技术
人为地创造特殊的进化条件,模拟自 然进化机制,在体外对基因进行随机突变, 从一个或多个已经存在的亲本酶(天然的 或者人为获得的)出发,经过基因的突变 和重组,构建一个人工突变酶库,通过一 定的筛选或选择方法最终获得预先期望的 具有某些特性的进化酶。
三类专家: ①蛋白质空间结构测定的专家; ②蛋白质分子设计的专家; ③基因工程的专家。
空间结构测定的专家: 主要应用X射线晶体结构分析的方法与 技术对蛋白质分子的空间结构进行实验 测定。
分子设计专家: 在了解了需要改造的蛋白质的性能及其相应 的结构基础之后,主要通过理论的方法,提 出蛋白质改性的设计方案,这一方案将提供 改性后的蛋白质哪些部分的氨基酸顺序与天 然蛋白质不同,这些新的序列可以导致怎样 的空间结构和电子结构的变化,从而能赋予 新蛋白质什么样的特性。
DNA改组
DNA改组(DNA shuffling)又称 有性PCR (sexual PCR),即将 DNA拆散后重排。它是模仿自然 进化的一种DNA 体外随机突变方 法。 这种方法不仅可以对一种基因 人为进化,而且可以将具有结构 同源性的几种基因进行重组,共 同进化出一种新的蛋白质。
DNA shuffling基本过程包括四个步骤:
定向进化的筛选策略
突变体分离
琼脂板涂布法 在特殊条件下培养突变菌,通过 宿主菌的生长情况、培养基颜色、特定反应的出 现等判断是否具有目的基因。 微孔板悬浮法 在含生色底物平板上培养,挑取 具有活性的克隆接种到96孔板上检测吸光度。使 用微流控芯片。 微球细胞固定法 与数字成像系统结合,将单个细 胞附着在单个固体珠上,突变体进行分离和筛选。 流式细胞计数法 细胞经荧光染色后,通过高速流 动系统,排成单行,逐个通过流式细胞计数仪进 行测定。
蛋白质的结构与功能授课用PPT教案

间结• 构
三级结构(tertiary structure ) 一条多肽链中所有原子或基团在三维
空间的整体排布
• 四级结构(quarternary structure )
- 多个多肽链的组合
蛋白质的一级结构
蛋白质的一级结构指蛋白质分子中多肽链 的氨基酸排列顺序(注意方向),包括二硫键 的位置。
▪ 主要的化学键:肽键,二硫键
2.化学性质 氨基酸的两性解离与等电点
氨基酸是两性电解质,其解离程度取决于所处溶液的 酸碱度。
等电点(isoeletric point,PI):当溶液浓度为某 一pH值时,氨基酸分子中所含的-NH3+和-COO-数目正好相 等,成为兼性离子,净电荷为0,呈电中性,此时溶液的 pH值即为氨基酸的等电点。
在等电点时,氨基酸既不向正极也不向负极移动,pH 变化时,迁移发生变化。
COOH -H +
COO- -H+
COO-
H3N+ C H p K 1 ' H 3N + C H p K 2 ' H 2N C H
R
+ H+
R
+H+
R
pH﹤pI 阳离子
pH=pI 两性离子
pH﹥pI 阴离子
pI 是氨基酸的特征常数
分析多肽链的N-末端和C-末端残基(二硝基氟苯法,丹酰氯法)
用两种不同的裂解方式裂解多肽链为较小片段
测定各片段的氨基酸顺序
用片段重叠法重新建立完整多肽链的一级结构
测序步骤
A.多肽链的拆分
由多条多肽链组成的蛋白质分子,必须先进行 蛋 拆分。可用8mol/L尿素或6mol/L盐酸胍处理,即可 白 分开多肽链(亚基) 质
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. α螺旋(αhelix)的结构特征为:
(1)主链骨架围绕中心轴盘绕形成右手螺旋; (2)螺旋每上升一圈是3.6个氨基酸残基,螺距为 0.54nm; (3)相邻螺旋圈之间形成许多氢键; (4)侧链基团位于螺旋的外侧。
2. 膜蛋白三级结构的基本特征
a~c. 细菌视紫红质蛋白,结晶时结合了大量脂类 (2BRD.pdb);
d. 人淋巴细胞激活抗原 CD98(2DH2.pdb);e. 鸡β1-肾上腺 素受体,七螺旋跨膜蛋白(2VT4.Pdb)并结合有其配体;f. 大 肠杆菌NANC离子通道蛋白(2WJR.pdb)。
Introduction
一、诺贝尔奖与蛋白质结构分析
1914年诺贝尔物理学奖,劳厄(M.von Laue) 发现晶体中的X 射线衍射现象 1915年诺贝尔物理学奖,布拉格父子用X射线对晶体结构的 研究 1936年诺贝尔化学奖,德拜(P.J.W.Debye)用X射线衍射技术 探明分子中原子的排列与结合形式 1944年诺贝尔物理学奖,拉比(I.I.Rabi) 发明核磁共振法
(二)蛋白质家族分类
目前建立在结构域基础上的蛋白质家族数据库有 PROSITE、PRINTS、Pfam、SMART、SWISS、PROT、 ProDom 和BLOCKS等,每个蛋白质结构数据库运用 不同的原理来识别结构相似的蛋白质超家族;将它 们结合起来可以更准确地归类蛋白质家族和描绘结 构域。InterPro数据库,是联合PROSITE、PRINTS、 Pfam和ProDom 四个独立完整的蛋白质结构域数据 库组成站点,它是将蛋白质的结构域和功能位点加 以统一建立的数据库资源。
1958年诺贝尔化学奖,桑格(F.Sanger) 分离和测定一 种蛋白质--胰岛素的氨基酸结构 1962年诺贝尔化学奖,佩鲁茨(M.F.Perutz)和肯德鲁 (J.C.Kendrew) 用 X射线衍射技术测定肌红蛋白和血红 蛋白 的原子排列 1964年诺贝尔化学奖,霍奇金(D.C.Hodgkin)测定维 生素B12等复杂晶体的结构 1972年诺贝尔化学奖,安芬森 (C.B.Anfinsen) 、莫尔 (S.Moore)和斯坦 (W.H.Stein) 对核糖核酸酶的三维结构及 其 124个氨基酸顺序的研究
X-衍射晶体分析技术和NMR技术的比较
与X-衍射晶体分析技术相比较,NMR技术在蛋白质 结构测定的速度上、和研究的对象上都存在一定的 限制,成本太高,步骤繁多。但其无需制备晶体标 本,可在溶液中直接测定,也可进行固相测定,因 此利用NMR法使得某些无法获得晶体结构的蛋白质 或非液相蛋白质(如膜蛋白)的结构测定成为可能 。相对而言,NMR技术更适合小分子质量以及水溶 性较好培养晶体困难的蛋白质结构的分析,对于蛋 白质折叠、局部动力学或构象分析、蛋白-蛋白相 互作用,NMR更体现其优越性。
二、蛋白质高级结构信息
1. 二级结构 (secondary structure) 2. 超二级结构 (super secondary structure) 3. 三级结构 (tertiary structure) 4. 四级结构 (quaternary structure)
三、蛋白质结构分析的主要目标
三、蛋白质结构域与家族分类
(一)蛋白质结构域
结构域是构成蛋白质亚基的紧密球状区域,为 介于二级与三级结构之间的一种结构层次;是蛋白 质中可以具有独立三级结构的部分,通常由一个基 因外显子编码,并可具有特定的功能。 最常见的结构域约含有100~200个氨基酸残基, 一般至少40个、多的可至400个以上;对于一个较大 球状蛋白质分子来说,往往由两个或两个以上相对 独立的三维实体缔合而成三维结构体。
2. β折叠(βsheets) 的结构特征为:
(1)若干条肽链或肽段平行或反平行排列成片; (2)所有肽键的C=O和N—H形成链间氢键; (3)侧链基团分别交替位于片层的上、下方。
人细胞珠蛋白(2DC3.pdb)的第121到140位残基 对应的a-螺旋侧面和顶部(N端)视图
β折叠示意图
a. 反平行和平行的多个β折叠链形成一个完整β折叠结构的氢 键示意图;b.来自人pi型谷胱甘肽-S-转硫酶中单个亚基中连续 主链的部分β折叠结构(2DGQ.pdb)侧面视图,可见转角(turn); c. 来自人pi型谷胱甘肽-S-转硫酶一个亚基中连续主链的部分β 折叠结构顶部视图,可见转角(turn);d. 来自人信号传递蛋白 SMAD4(1DD1.pdb)的一个亚基中部分β折叠结构顶部视图,可见 到大的环区(loop)。
1. 水溶性蛋白质三级结构的基本特征
a. 飘带显示全α螺旋人血清白蛋白单体三级结构,结构略微松 散(2T2Z.pdb);b. 飘带显示全α螺旋人血清白蛋白单体三级结 构,树枝状显示氨基酸侧链,结构明显紧密;
c. 飘带显示全β折叠人晶状体蛋白三级结构,结构略微松散 (2JDF.pdb),全蓝色的树枝状结构为配体;d. 飘带显示全β折 叠人晶状体蛋白的三级结构,树枝状显示氨基酸侧链,结构非 常紧密,全蓝色的树枝状结构为配体。
1982年诺贝尔化学奖,克卢格(A.Klug)将X射线衍 射技术与电子显微技术结合发明显微影象重组技术, 以及在结构分子生物学方面的研究 1985年诺贝尔化学奖,豪普特曼 (H.A.Haupt-man) 和 卡尔(J.Karlc) 开发了用于X射线衍射确定物质晶体结构 的直接计算法 1991年诺贝尔化学奖,恩斯特 (R.Ernst) 发明了傅 立叶变换核磁共振分光法和二维核磁共振技术 2002年诺贝尔化学奖,库尔特· 维特里希“发明了利用 核磁共振技术测定溶液中生物大分子三维结构的方法”
1. 建立研究蛋白质结构信息发掘与预测的 方法; 2. 研究参与生命活动过程的蛋白质的物理 性质、空间架构、功能片段和相互作用; 3. 探索基于蛋白质结构表征蛋白质的生物 学意义; 4. 得到新的预测性的知识。
第二节蛋白质的高级结构
Advanced Structures of Protein
一、蛋白质的高级结构特征 (一)二级结构的主要类型和特征
(三)三级结构的主要类型和特征
三级结构(protein tertiary structure), 即蛋白质分子处于它的天然折叠状态的三维构象, 它是在二级结构的基础上进一步盘绕,折叠形成的 。蛋白质三级结构的稳定主要靠氨基酸侧链之间的 疏水相互作用,氢键、二硫键、范德华力和静电作 用维持。不同类型的蛋白质尽管局部结构分解后具 有很高的相似性,但是由于其含辅助因子的全部共 价相连原子空间的相对位置,即其二级结构的组装 (assembly)模式存在着差异,在三级结构层面不同 的蛋白质将体现各自整体的结构特征。
第九章 蛋白质结构分析
Analysis of Protein Structure
本章重点、难点
重点:使用蛋白质结构数据库分析蛋白 质结构及可视化、蛋白质结构预测方法、 基于蛋白质结构的功能预测方法 难点:蛋白质的三维结构预测及基于结 构的蛋白质功能预测软件的使用、蛋白 质高级结构特征的识别和指认
第一节 引言
3. 蛋白质三级结构中二级结构的折叠和组装
按二级结构组装模式对蛋白质进行分类对解析蛋 白质高级结构形成规律和预测蛋白质功能有重要 帮助。蛋白质二级结构组装模式主要是全α螺旋 、全β折叠、α螺旋/β折叠,还有少量α螺旋 +β折叠类。
全a-螺旋蛋白质
人血清白蛋白(上图a,b)和细菌视紫红质(下图 a-c)
四、蛋白质高级结构的实验解析方法
蛋白质结构实验分析主要有 三大技术平台
(一)X-衍射蛋白质晶体结构分析 (二)核磁共振波谱分析 (三)冷冻电镜技术
(一)蛋白质晶体结构X-衍射分析
是目前分辨率最高的结构测定方法,高通量晶体 结构分析中的几大重要环节是:数据处理与分析 、重原子的定位、密度修饰、分子替换、图形整 合、模型加工和确认。
4. 无规卷曲的结构特征为:
无规卷曲的特点为在主链骨架上无规则盘绕,其 构象状态仍遵循物理化学原理,但波动性较大, 对温度变化敏感;实验测定三级结构时往往无法 识别无规卷曲(缺失其座标),即使有座标则其温 度因子也较高。无规卷曲同Ω环的区分主要是其 长度和其形状的波动性。
(二)超二级结构的主要类型和特征
3. β转角的结构特征为:
多肽链180°回折部分,通常由四个氨基酸残基 构成,借1. 4残基之间形成的氢键维系。
β转角及其连接的β折叠链和α螺旋
a. 人谷胱甘肽-S-转硫酶pi第56到59位残基的β转角连接了来自相同主 链的两段β折叠链,片层末端残基显示为粗枝状,β转角中Gly和Asp显 示为细线,转角区域内第一个Asp的α羰基氧与其后第三位α氨基成氢键 (3DGQ.pdb); b. 来自人细胞珠蛋白(2DC3.pdb)的两段α螺旋由β转角 连接,用粗树枝状显示了两段螺旋末端的脯氨酸。
偶数亚基形成的四级结构具有较高的对称性
PBO-1蛋白质呈现的对称结构
二、蛋白质高级结构中二级结构的 测定与指认
蛋白质二级结构词典(dictionary of secondary structures of proteins, DSSP) 来自模式识别技 术,其仅依据主链肽键基团的坐标判断主链肽键基 团间是否形成氢键,计算氢键能量低于-0.5 kcal/mol则有氢键形成,用于搜索α螺旋和β片层 结构是否存在。 STRIDE程序用特殊方法判定主链肽键之间的氢键 是否存在并用二面角参数辅助识别指认二级结构。
全β-折叠ቤተ መጻሕፍቲ ባይዱ白质
人晶状体蛋白(上图c, d)和大肠杆菌NANC离子通道蛋白(下图f)
a-螺旋/β-折叠蛋白质
细胞表面标志蛋白CD98(图d)及糖酵解的绝大多数酶蛋白 (图a)
a-螺旋+β-折叠类蛋白质
人TBP与双螺旋DNA复合物(1CDW.pdb)
