高二化学晶体结构练习题
2020-2021学年高二化学人教版选修3物质结构与性质第3章《晶体结构与性质》单元检测题

第3章《晶体结构与性质》单元检测题一、单选题(共15小题)1.石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是()A.石墨烯与石墨互为同位素B. 0.12g石墨烯中含有6.02×1022个碳原子C.石墨烯是一种有机物D.石墨烯中的碳原子间以共价键结合2.某化学式为AB的离子晶体,已知5r(A2+)=4r(B2﹣)(各类离子晶体与阴阳离子半径比关系如图所示),经测定其密度为ρg•cm﹣3,其摩尔质量为Mg•mol﹣1,则下列有关该晶体的说法正确的是()A.该晶体结构与ZnS晶体相似B.该晶体每个晶胞中有2个A2+和B2﹣C.该晶体晶胞的边长D. A2+离子紧邻的B2﹣构成的空间结构为正方体3.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2CO2+H2O。
下列有关说法正确的是()A.该反应为吸热反应B. CO2分子晶体中的化学键为非极性键,C. HCHO分子中既含σ键又含π键D.每生成1.8 g H2O消耗2.24 L O24.下列有关金属键的叙述错误的是()A.金属键没有饱和性和方向性B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用C.金属键中的电子属于整块金属D.金属的物理性质和金属固体的形成都与金属键有关5.关于铜晶体的堆积方式说法正确的是()A.按ABABAB……方式堆积,配位数为12B.按ABABAB……方式堆积,配位数为8C.简单立方堆积,配位数为6D.按ABCABC……方式堆积,配位数为126.BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。
由此可推测BeCl2()A.熔融态不导电B.水溶液呈中性C.熔点比BeBr2高D.不与NaOH溶液反应7.离子晶体中一定不存在的相互作用力是()A.离子键B.极性键C.非极性键D.范德华力8.下列关于晶格能的叙述中正确的是()A.晶格能仅与形成晶体的离子所带电荷数有关B.晶格能仅与形成晶体的离子半径有关C.晶格能是指相邻的离子间的静电作用D.晶格能越大的离子晶体,其熔点越高9.关于下图不正确的说法是()A.此种最密堆积为面心立方最密堆积B.该种堆积方式称为铜型C.该种堆积方式可用符号……ABCABC……表示D.该种堆积方式称为镁型10.如图所示,食盐晶体由钠离子和氯离子构成。
2020-2021学年高二化学人教版选修3物质结构与性质第三章《晶体结构与性质》检测题(含答案)

《晶体结构与性质》检测题一、单选题1.下列各组物质中,按熔点由低到高的顺序排列正确的是()①O2、I2、Hg②CO、Al、SiO2③Na、K、Rb④Na、Mg、AlA.①③B.①④C.②③D.②④2.下列变化规律叙述正确的是A.O、S、Na、K的原子半径依次增大B.Na、Mg、Al、Si的还原性依次增强C.HF、HCl、H2S、PH3的稳定性依次增强D.CH4、NaCl、SO2、SiO2的熔点依次增高3.有关晶体的说法不正确的是A.都有自范性B.都是无色透明的C.有各向异性D.有固定熔点4.下列各组晶体中,化学键的类型相同是A.SO2与MgO B.NaCl与HClC.CO2与H2O D.CCl4与KCl5.M元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成化合物Z。
下列说法中正确的是() A.Z是共价化合物B.Z可表示为M2YC.Z的电子式可表示为D.M形成+2价阳离子6.下列说法或表示正确的是A.氯化钠晶体中,每个Na+周围距离相等且紧邻的Na+共有12个B.酒石酸(HOOC-CHOH-CHOH-COOH)不存在手性碳原子C.熔点:MgBr2<SiCl4<SiCD.邻羟基苯甲酸分子内形成了氢键,所以沸点高于对羟基苯甲酸7.下列说法正确的是()A.共价化合物和离子化合物中,一定都含有非金属元素B.阴阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小C.失电子难的原子获得电子的能力一定强D.含有共价键的化合物必是共价化合物8.N A代表阿伏加德罗常数的值,下列说法正确的是A.12 g金刚石中含有化学键的数目为4N AB.18 g的D2O中含有的质子数为10C.28 g的乙烯和环已烷混合气体中所含原子总数为6N AD.1 L 1mol·L¯1的NH4Cl溶液中NH4+和Cl―的数目均为1N A9.关于下列晶体物质的熔沸点高低排列判断正确的是()A.Rb>K>Na B.金刚石>晶体硅>二氧化硅>碳化硅C.H2O>H2S>H2Se>H2Te D.CaO>BaO>NaCl>KCl10.下列选项中,对于指定项目的数目前后相等的是()A.电子数:17gOH—与1mol-OHB.双键数目:1mol与4mol C2H4C.分子数:常温常压下16g氧气与4g氦气D.阴离子总数:72gCaO2与62g Na2O11.下列说法正确的是( )A.电子层结构相同的不同离子,其半径随核电荷数增大而减小B.C、O、S原子半径依次增大,氢化物稳定性逐渐增强C.ⅠA族元素与ⅠA族元素形成的化合物都为离子化合物D.ⅠA族元素的阴离子还原性越强,其最高价氧化物对应的水化物酸性越强12.某些物质的熔点数据如下表,据此做出的下列判断中错误的是A.表中BCl3和CO2均是分子晶体B.铝的化合物的晶体均是离子晶体C.同族元素的氧化物可形成不同类型的晶体D.不同族元素的氧化物可形成相同类型的晶体13.下列说法正确的是A.范德华力普遍存在于分子之间,如液态水中因范德华力的存在使水分子发生缔合B.H2SO4为强电解质,硫酸晶体是能导电的C.冰中1个H2O可通过氢键与4个水分子相连,所以冰中H2O分子与氢键的比值为1:4D.氢键有饱和性和方向性,所以液态水结成冰时体积会变大二、填空题14.中国古代四大发明之一——黑火药,它在爆炸时发生的化学反应为2KNO3+3C+S=A+N2↑+3CO2↑(已配平)(1)①除S外,上列元素的电负性从大到小依次为__________。
高中化学 第三章 晶体结构与性质学3高二3化学试题

促敦市安顿阳光实验学校第三章学业质量检测(90分钟,100分)一、选择题(本题包括17个小题,每小题3分,共51分)1.由单质形成的晶体一不存在的微粒是( C )A.原子B.分子C.阴离子D.阳离子解析:由单质形成的晶体可能有:硅、石(原子晶体),S8、Cl2(分子晶体),Na、Mg(金属晶体),在这些晶体中,构成晶体的微粒分别是原子、分子、金属阳离子和自由电子,构成离子晶体的微粒是阴、阳离子,但离子晶体不可能是单质。
2.下列对化学知识概括合理的是( C )A.原子晶体、离子晶体、金属晶体、分子晶体中都一存在化学键B.同素异形体之间的转化都是物理变化C.原子晶体的熔点不一比金属晶体的高,分子晶体的熔点不一比金属晶体的低D.一种元素可能有多种氧化物,但同种化合价只对一种氧化物解析:稀有气体的晶体中不含有化学键,A项错;3O 2放电2O3是化学变化,B项错;晶体硅的熔点比钨低,蔗糖的熔点比汞高,C项正确;N元素显+4价的氧化物有NO2、N2O4,D项错。
3.下列叙述中正确的是( B )A.干冰升华时碳氧键发生断裂B.CaO和SiO2晶体中都不存在单个小分子C.Na2O与Na2O2所含的化学键类型完全相同D.Br2蒸气被木炭吸附时共价键被破坏解析:A、D两项所述变化属于物理变化,故化学键未被破坏,所以A、D 两项错误;C选项中,Na2O只含离子键,Na2O2既有离子键又有非极性键,所以C项错误,故选B。
4.下列晶体分类中正确的一组是( C )选项离子晶体原子晶体分子晶体A NaOH Ar SO2B H2SO4石墨SC CH3COONa 水晶D Ba(OH)2石玻璃5A.化学键都具有饱和性和方向性B.晶体中只要有阴离子,就一有阳离子C.氢键具有方向性和饱和性,也属于一种化学键D.金属键由于无法描述其键长、键角,故不属于化学键解析:离子键、金属键没有饱和性、方向性;氢键不属于化学键;金属键属于化学键。
6.制造光导纤维的材料是一种很纯的硅氧化物,它是具有立体状结构的晶体,下图是简化了的平面示意图,关于这种制造光纤的材料,下列说法正确的是( C )A.它的晶体中硅原子与氧原子数目比是1︰4B.它的晶体中硅原子与氧原子数目比是1︰6C.这种氧化物是原子晶体D.这种氧化物是分子晶体解析:由题意可知,该晶体具有立体状结构,是原子晶体,一个Si原子与4个O原子形成4个Si—O键,一个O原子与2个Si原子形成2个Si—O键,所以在晶体中硅原子与氧原子数目比是1︰2。
3.1 晶体的常识(课时作业)高二化学(人教版选修3)(解析版)

第三章 晶体结构与性质第一节 晶体的常识一、基础练1.有一种蓝色晶体,化学式可表示为()x y 6M Fe CN ⎡⎤⎣⎦,经X 射线衍射实验发现,它的结构特征是3+Fe 和2+Fe 分别占据立方体互不相邻的顶点,而CN -位于立方体的棱上。
其晶体中阴离子的最小结构单元如图所示。
下列说法正确的是( )A .该晶体的化学式为()226M Fe CN ⎡⎤⎣⎦B .该晶体属于离子晶体,M 呈+1价C .该晶体属于离子晶体,M 呈+2价D .晶体中与每个3+Fe 距离最近且相等的CN 有3个【答案】B【详解】A .由题图可得出,晶体中阴离子的最小结构单元中2Fe +及Fe 3+个数均为11482⨯=,CN -的个数为11234⨯=,因此阴离子的化学式为()26Fe CN -⎡⎤⎣⎦,则该晶体的化学式为()26M Fe CN ⎡⎤⎣⎦,A 项错误; B .由阴、阳离子形成的晶体为离子晶体,M 的化合价为+1,B 项正确;C .M 的化合价为+1,C 项错误;D .由题图可看出与每个3+Fe 距离最近且相等的CN -有6个,D 项错误;故选:B 。
2.如图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,其对应的化学式是XY 的是(图中:o-X , -Y)( )A .B .C .D .【答案】A【详解】[根据顶点、棱上、面上、体心和其他处于立方体内部的原子对晶胞的贡献分别为111842、、、1,求出X 、Y 的数目之比,其化学式分别为XY 、X 3Y 、XY 4、XY 4;故选:A 。
3.下图为高温超导领域里的一种化合物(钙钛矿)结构中的最小重复单元。
该化合物中,每个钛离子周围与它最接近且距离相等的钛离子有a 个,元素氧、钛、钙的原子个数比为b 。
则a 、b 是( )A .6,3∶1∶1B .24,10∶8∶1C .12,5∶4∶1D .3,3∶2∶1【答案】A【详解】 由晶胞结构可知,晶胞顶点上相邻的钛离子相距最近,则钛离子周围与它接近且距离相等的钛离子有6个,a=6;晶胞中位于顶点的钛原子个数为8×18=1,位于棱上的氧原子个数为12×14=3,位于体内的钙原子的个数为1,则氧、钛、钙的原子个数比为 3:1:1,故选A 。
2022北京高二(下)期中化学汇编:几种简单的晶体结构模型

2022北京高二(下)期中化学汇编几种简单的晶体结构模型一、单选题1.(2022·北京市第五中学高二期中)NH 4Cl 的晶胞为立方体,其结构如下。
下列说法不正确的是A .NH 4Cl 晶体属于离子晶体B .NH 4Cl 晶胞中H-N-H 键角为90°C .NH 4Cl 晶体中既有离子键又有共价键D .每个Cl -周围与它最近且等距离的+4NH 的数目为82.(2022·北京师大附中高二期中)为了探究54SbCl SnCl 、是否为离子化合物,可以进行下列实验,其中合理的是 选项 实验结论 A常温下观察,5SbCl 为黄色液体,4SnCl 为无色液体 都是离子化合物 B测定熔点,依次为2.8C 33C -︒︒、 都不是离子化合物 C分别溶解于水中,各滴入3HNO 酸化的3AgNO 溶液,产生白色沉淀 都是离子化合物 D测定两种物质水溶液导电性,发现都可以导电都是离子化合物 A .A B .B C .C D .D 3.(2022·北京师大附中高二期中)下列有关冰和干冰的叙述不正确...的是 A .干冰中只存在范德华力不存在氢键B .干冰和冰都是由分子密堆积形成的晶体C .干冰比冰的熔点低D .冰中存在氢键,每个水分子周围有4个紧邻的水分子4.(2022·北京师大附中高二期中)下列关于沸点的比较中,不正确...的是 A .222Cl Br I <<B .邻羟基苯甲醛>对羟基苯甲醛C .332322CH Cl CH CH Cl CH CH CH Cl <<D .金刚石>碳化硅>硅晶体5.(2022·北京师大附中高二期中)“类推”是一种重要的学习方法,但有时会产生错误的结论,下列类推结论正确的是A .NaCl 晶体中含有离子键,则2MgCl 晶体中也含有离子键B .IV A 族元素氢化物的沸点顺序是444GeH SiH CH >>,则V A 族元素氢化物的沸点顺序是333AsH PH NH >>C .晶体中有阴离子,必有阳离子,则晶体中有阳离子,必有阴离子D .金刚石中碳原子的杂化类型为3sp 杂化,则石墨中碳原子的杂化类型也为3sp 杂化6.(2022·北京·牛栏山一中高二期中)下列关于物质熔点或沸点的比较中,不正确...的是 A .沸点:Cl 2<Br 2<I 2B .熔点:金刚石>碳化硅>硅晶体C .沸点:CH 3Cl <CH 3CH 2Cl <CH 3CH 2CH 2ClD .沸点:邻羟基苯甲醛>对羟基苯甲醛7.(2022·北京·牛栏山一中高二期中)冠醚能与碱金属离子作用,并随环的大小不同而与不同的金属离子作用。
第三章 第一节 第2课时 晶胞 晶体结构的测定 高二化学同步练习
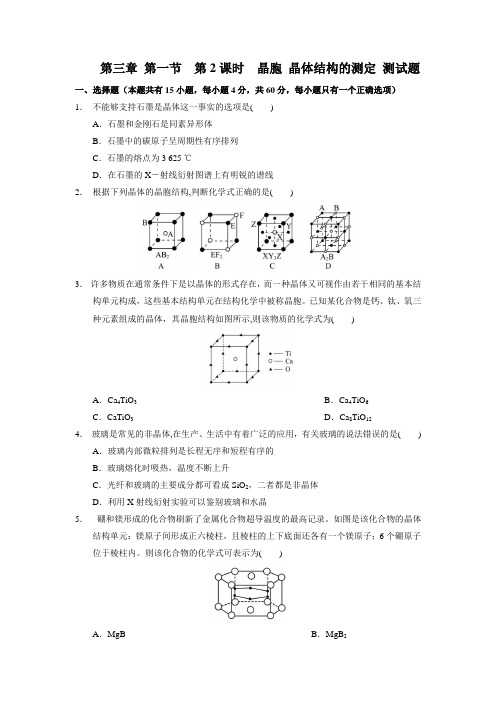
第三章第一节第2课时晶胞晶体结构的测定测试题一、选择题(本题共有15小题,每小题4分,共60分,每小题只有一个正确选项)1.不能够支持石墨是晶体这一事实的选项是()A.石墨和金刚石是同素异形体B.石墨中的碳原子呈周期性有序排列C.石墨的熔点为3 625 ℃D.在石墨的X-射线衍射图谱上有明锐的谱线2.根据下列晶体的晶胞结构,判断化学式正确的是()3.许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视作由若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称晶胞。
已知某化合物是钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为()A.Ca4TiO3B.Ca4TiO6C.CaTiO3D.Ca8TiO124.玻璃是常见的非晶体,在生产、生活中有着广泛的应用,有关玻璃的说法错误的是() A.玻璃内部微粒排列是长程无序和短程有序的B.玻璃熔化时吸热,温度不断上升C.光纤和玻璃的主要成分都可看成SiO2,二者都是非晶体D.利用X射线衍射实验可以鉴别玻璃和水晶5.硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。
如图是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱内。
则该化合物的化学式可表示为()A.MgB B.MgB2C.Mg2B D.Mg3B26.金属晶体中金属原子有三种常见的堆积方式,a、b、c分别代表这三种晶胞的结构,其晶胞a、b、c 内金属原子个数比为()A.3∶2∶1 B.11∶8∶4C.9∶8∶4 D.21∶14∶97.某晶体的一部分如图所示,这种晶体中A、B、C三种微粒数之比是()A.3∶9∶4 B.1∶4∶2C.2∶9∶4 D.3∶8∶48.晶体是内部微粒(分子、离子或原子等)在空间有规则排列、具有整齐外形、以多面体出现的固体物质。
在晶体空间里无限地周期性重复的具有代表性的最小单元,称为晶胞。
一种Al-Fe合金的晶胞如图所示。
原子晶体分子晶体练习

高二化学原子晶体分子晶体练习 4.121.下列晶体由原子直接构成,且属于分子晶体的是()A.固态氢B.固态氖C.磷D.三氧化硫2.下列物质呈固态时,一定属于分子晶体的是()A.非金属单质B.非金属氧化物C.含氧酸D.金属氧化物3.下列关于SiO2晶体的叙述中正确的是()A.通常状况下,60 g SiO2晶体中含有的分子数为N A(N A表示阿伏加德罗常数的值)B.60 g SiO2晶体中,含有2N A个Si—O键C.该晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点D.SiO2晶体中含有1个硅原子和2个氧原子4.根据表中给出物质的熔点数据(AlCl3沸点为182.7 ℃),判断下列说法错误的是()A.MgO中的离子键比4C.AlCl3晶体是离子晶体D.晶体硼是原子晶体5.下列说法中正确的是()A.C60汽化和I2升华克服的作用力不相同B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近C.NaCl和HCl溶于水时,破坏的化学键都是离子键D.常温下TiCl4是无色透明液体,熔点-23.2 ℃,沸点136.2 ℃,所以TiCl4属于分子晶体6.BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。
由此可推测BeCl2() A.熔融态不导电B.水溶液呈中性C.熔点比BeBr2高D.不与NaOH溶液反应7.关于氢键的下列说法中正确的是()A.每一个水分子内含有两个氢键B.冰、水和水蒸气中都存在氢键C.水结成冰体积膨胀与氢键有关D.H2O是一种非常稳定的化合物,这是由氢键所致8.在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。
则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是()A.sp,范德华力B.sp2,范德华力C.sp2,氢键D.sp3,氢键9.已知氮化碳晶体是新发现的高硬度材料,且构成该晶体的微粒间只以单键结合。
下列关于该晶体的说法错误的是()A.氮化碳属于原子晶体,比金刚石中的硬度更大B.该晶体中每个碳原子与4个氮原子相连,每个氮原子与3个碳原子相连,氮化碳的化学式为C3N4C.该晶体中碳原子和氮原子的最外层都满足8电子结构D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构10.下表是某些原子晶体的熔点和硬度。
高二化学晶体结构练习题1

高二化学晶体结构练习题学校:__________姓名:__________班级:__________考号:__________一、单项选择1、认真分析NaCl和CsCl的晶体结构,判断下列说法错误的是()A.NaCl和CsCl都属于AB型的离子晶体B.NaCl和CsCl晶体中阴、阳离子个数比相同,所以阴、阳离子的配位数相等C.NaCl和CsCl晶体中阴、阳离子的配位数分别为6和8D.NaCl和CsCl都属于AB型的离子晶体,所以阴、阳离子半径比不相同2、图是CaF2晶胞的结构。
下列说法正确的是( )A.一个CaF2晶胞中含有8个Ca2+B.一个CaF2晶胞中含有8个F-C.在CaF2晶胞中Ca2+的配位数为4D.在CaF2晶胞中F-的配位数为83、根据下列结构示意图,判断下列说法中不正确的是()A.在NaCl晶体中,距Na+最近的Cl-形成正八面体B.在CaF2晶体中,每个晶胞平均占有4个Ca2+C.在金刚石晶体中,碳原子与碳碳键数目比为1:2D.该气态团簇分子的分子式为EF或FE4、下列选项所述中的数字不是6的是()A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数B.在金刚石晶体中,围成最小环的原子数C.在二氧化硅晶体中,围成最小环的原子数D.在CsCl晶体中,与一个Cs+最近的且距离相等的Cs+的个数5、下列所示的图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于NaCl晶体结构的图象是()⑴⑵⑶⑷A.图⑴和图⑶B.图⑵和图⑶C.只有图⑴D.图⑴和图⑷6、食盐晶体如下图所示。
在晶体中,表示Na+,ο表示Cl-。
已知食盐的密度为ρg/cm3,NaCl摩尔质量M g/mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是()7、下面关于晶体的叙述中,错误的是()A、氯化铯晶体中,每个Cs+周围紧邻8个Cl-B、氯化钠晶体中,每个Na+周围距离最近且相等的Na+共有6个C、干冰晶体中,每个CO2分子周围紧邻12个CO2分子D、金刚石为网状结构,由共价键形成的碳原子环中,最小环上有6个碳原子8、CaC2晶体的晶胞结构和NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。
2022学年下学期高二暑假化学新教材巩固练习题及答案11晶体结构与性质

2022学年下学期高二暑假新教材巩固练习题及答案11晶体结构与性质例1.砷化镓是一种重要的半导体材料,熔点为1238℃。
它在600℃以下能在空气中稳定存在,并且不被非氧化性的酸侵蚀。
砷化镓的晶胞结构如图所示。
下列说法正确的是A.砷化镓是一种分子晶体B.砷元素在周期表位置是第四周期第VB族C.晶胞中Ga原子与As原子的数目之比为4∶1D.晶胞中Ga与周围等距且最近的As形成的空间构型为正四面体例2.下列有关晶体的说法中正确的是A.共价晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键H O>H S;锂<钠<钾<铷<铯B.熔点:MgO>NaCl;22C.金刚石的硬度大于晶体硅的硬度,其熔点也高于晶体硅的熔点D.晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子1.K3[Fe(CN)6]俗称赤血盐、赤血盐钾,化学上常用于检验亚铁离子。
下列关于K3[Fe(CN)6]的说法错误的是A.该化合物中的Fe为+3价B.铁离子提供空轨道C.配体是CN-,配位数为6D.1 mol K3[Fe(CN)6]中含有的σ键数目为6N A2.下列各物质的晶体中,晶体类型相同的是A.NaCl和HCl B.晶体硅和灰锡C.CS2和MgSO4D.金刚石和石墨3.下列关于晶体的分类正确的是A.A B.B C.C D.D4.冰晶胞中水分子的空间排列方式与金刚石晶胞(晶胞结构如图所示)类似。
下列有关冰晶胞的说法合理的是A.冰晶胞内水分子间以共价键相结合B.晶体冰与金刚石晶体硬度都很大C.冰分子间的氢健具有方向性和饱和性,也是一种σ键D.氢键的存在导致冰晶胞与金刚石晶胞微粒的排列方式类似5.下列说法不正确...的是A.利用原子光谱上的特征谱线来鉴定元素,称为光谱分析B.焰色试验是与电子跃迁有关的物理现象C.用X射线衍射摄取石英玻璃和水晶的粉末得到的图谱是相同的D.等离子体和离子液体都具有良好的导电性6.下列关于共价晶体、分子晶体的叙述中,正确的是A.金刚石为网状结构,碳原子与周围4个碳原子形成正四面体结构B.晶体中分子间作用力越大,分子越稳定C.HI的相对分子质量大于HF,所以HI的沸点高于HFD.在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键7.三氯化氮(NCl3)常温下是一种淡黄色的液体,其分子结构呈三角锥形。
高二化学晶体的结构与性质专项训练单元 易错题难题检测试题

高二化学晶体的结构与性质专项训练单元易错题难题检测试题一、晶体的结构与性质1.萤石(CaF2)属于立方晶体(如图),晶体中每个Ca2+被8个F-包围,则晶体中F-的配位数为A.2B.4C.6D.82.碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示,下列说法错误的是()A.在石墨烯晶体中,每个C原子连接3个六元环B.石墨烯晶体中的化学键全部是碳碳单键C.在金刚石晶体中,C原子采用sp3杂化D.在金刚石晶体中,六元环中最多有4个C原子在同一平面3.已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。
下列关于C3N4晶体的说法错误的是A.该晶体属于原子晶体,其熔、沸点很高B.该晶体中每个碳原子上连有4个氮原子,每个氮原子连接3个碳原子C.该晶体中碳原子和氮原子都满足最外层8电子结构D.该晶体的结构与金刚石类似,都是原子间以非极性键形成的空间网状结构4.二茂铁[(C2H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。
已知二茂铁的熔点是173℃(在100℃以上能升华),沸点是249℃,不溶于水,易溶于苯、乙醚等有机溶剂。
下列说法不正确的是()A.二茂铁属于分子晶体B.在二茂铁中,C5H5-与Fe2+之间形成的化学键类型是离子键C.已知环戊二烯的结构式为,则其中仅有1个碳原子采取sp3杂化D. C5H5-中一定含有 键5.KO 2的晶体结构和NaCl 相似,KO 2可以看作是Na +的位置用K +代替,Cl -的位置用O 2-代替,则关于KO 2晶体结构的描述正确的是( )A .如图一个超氧化钾小晶胞中含有4个KO 2B .和K +距离相同且最近的O 2-构成的多面体是正六面体C .和K +距离相同且最近的K +有8个D .和K +距离相同且最近的O 2-共有8个6.下列说法不正确的是A .有化学键断裂的过程不一定是化学过程B .NH 4Cl 和 Na 2SO 4 晶体中含有的化学键类型相同C .H 2O 比 H 2S 更稳定,是因为氧的非金属性更强D .离子晶体中一定含有离子键,分子晶体中一定含有共价键7.碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
人教版高二化学下册练习:晶体结构与性质

人教版高二化学下册练习:晶体结构与性质一.选择题(共15小题)1.下列物质中,既含有离子键又含有共价键的是()A.H2SO4B.NaOH C.MgCl2D.NaCl2.硅烷(SiH4)可用于制造高纯硅,而SiH4可由硅化镁(熔点1102℃)制得,硅化镁晶体的晶胞如图所示,每个Mg原子位于Si原子组成的四面体中心。
下列说法不正确的是()A.硅化镁可能为分子晶体B.硅化镁的化学式为Mg2SiC.每个晶胞中含有8个Mg原子D.每个Si原子周围距离最近且等距的Mg原子有8个3.胆矾(CuSO4•5H2O)可以写成[Cu(H2O)4]SO4•H2O,其结构片断如下。
下列说法中不正确的是()A.基态Cu2+的价层电子排布式是3d9B.的VSEPR模型名称是正四面体C.胆矾中H2O与的作用力是氢键D.胆矾中Cu2+是中心离子,配位数是54.邻二氮菲的结构简式为,简写为phen,遇FeSO4溶液生成橙红色配合物[Fe(phen)3]SO4,其中Fe2+的配位数为6。
下列说法不正确的是()A.phen中,不含手性碳原子B.[Fe(phen)3]2+中,phen的一个N参与配位C.[Fe(phen)3]2+中,Fe2+提供空轨道,N提供孤对电子D.[Fe(phen)3]SO4中,既存在极性键也存在非极性键5.胆矾(CuSO4⋅5H2O)的结构示意图如图所示。
下列说法不正确的是()A.基态Cu2+的价层电子轨道表示式是B.H2O中氧原子的VSEPR的价层电子对数是4C.中的O﹣S﹣O的键角小于H2O中的H﹣O﹣H的键角D.胆矾中的H2O与Cu2+、H2O与的作用力分别为配位键和氢键6.镍二硫烯配合物基元的COFs材料因具有良好的化学稳定性、热稳定性和导电性而应用于电池领域。
一种基于镍二硫烯配合物的单体结构简式如图所示,下列关于该单体的说法不正确的是()A.Ni属于d区元素B.S与Ni形成配位键时,S提供孤电子对C.组成元素中电负性最大的是O D.醛基中C原子的价层电子对数为47.干冰(CO2)的晶胞结构如图所示。
高二化学晶体结构与性质试题

高二化学晶体结构与性质试题1.下列四种晶体,它们的熔点按由低到高的顺序排列正确的是①金刚石②氯化钠③干冰④钠A.④②③①B.③①②④C.④②①③D.③④②①【答案】D【解析】金刚石是原子晶体,熔点最高;干冰是分子晶体,熔点最低;氯化钠是离子晶体,钠是金属晶体,二者的熔点不易判断,但从选项中可知,答案选D。
【考点】考查晶体类型的判断,性质应用2.下列各项所述的数字不是6的是 ( )A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数B.在金刚石晶体中,最小的环上的碳原子个数C.在二氧化硅晶体中,最小的环上的原子个数D.在NaCl晶体中,与一个Cl-最近的且距离相等的Na+的个数【答案】C【解析】A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数是6个,分别位于其上下前后左右六个方向,正确;B.在金刚石晶体中,每个C原子与相邻的四个C原子形成四个共价键,键角是109°28′,这种结构向空间扩展就形成了一种立体网状结构,其最小的环上的碳原子个数的6个;C.二氧化硅晶体是原子晶体,结构与金刚石类似,最小的环上的原子个数是有6个Si原子6个O原子,所以一共有12个原子,错误;D.在NaCl晶体中,与一个Cl-最近的且距离相等的Na+的个数是6个,分别位于其上下前后左右六个方向,正确。
【考点】考查晶体中微粒的个数的知识。
3.某研究所合成了一种球形分子,它的分子式为C60Si60,其结构中包含有C60和Si60结构。
下列对该分子的叙述中正确的是A.分子中Si60被包裹在C60里面B.形成的晶体属于分子晶体C.其摩尔质量为2400D.熔点高、硬度大【答案】B【解析】A、硅的原子半径比碳大,所以硅化合物Si60C60,外层球壳为Si60,内层球壳为C60,故A错误;B、根据题意知,该晶体是由分子构成的,属于分子晶体,故B正确;该分子中存在碳碳键、硅硅键都属于非极性键,故B错误;C、该分子是由60个碳原子和60个硅原子结合而成,该物质的摩尔质量为2400g/mol,故C不正确;D、该物质是分子晶体,熔点低,硬度小,D不正确,答案选B。
第三章晶体结构与性质第二节分子晶体与共价晶体——提升训练高二下学期化学人教版选择性必修2

第三章晶体结构与性质第二节分子晶体与共价晶体——提升训练2021-2022学年高中化学人教版(2019)选择性必修2一、选择题(共15题)1.下列各组物质的性质排序正确的是A .硬度:Li >Na >K >RbB .沸点:CF 4>CCl 4>CBr 4>CI 4C .熔点:碳化硅<晶体硅<金刚石D .熔点:NaF <NaCl <NaBr <NaI2.下列化合物中,属于原子晶体的是A .干冰B .氯化钠C .氟化硅D .二氧化硅3.4SiCl 的分子结构与4CCl 类似,对其作出如下推断,其中正确的是①4SiCl 晶体是分子晶体①常温常压下4SiCl 不是气体①4SiCl 的分子是由极性共价键形成的①4SiCl 的熔点高于4CClA .全部B .只有①①C .只有①①D .只有①4.我国科学家合成了富集11B 的非碳导热材料立方氮化硼晶体,晶胞结构如图。
下列说法错误的是A .N 原子周围等距且最近的N 原子数为12B .该晶胞中含有4个B 原子,4个N 原子C .11BN 和10BN 的化学性质无差异D .该晶体具有良好的导电性5.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是A .SO 2和SiO 2B .CO 2和H 2OC .BN 和HClD .CCl 4和KCl6.设N A 为阿伏加德罗常数的值。
下列说法中正确的是( )A .28 g 晶体硅中含有Si—Si 键的个数为2N AB .124 g 白磷(P 4)晶体中含有P—P 键的个数为4N AC .12 g 金刚石中含有C—C 键的个数为4N AD .SiO 2晶体中每摩尔硅原子可与氧原子形成2N A 个共价键(Si—O 键)7.A N 表示阿伏加德罗常数的值,下列说法正确的是A .7.8g 中含有的 键数目为0.6A NB .3.6g 冰中含有的氢键数目为0.4A NC .标准状况下,11.2L HF 中含有的电子数目为5A ND .12g 2SiO 晶体中含有的Si—O 键数目为0.4A N8.美国Lawrece Liermore 国家实验室成功地在高压下将2CO 转化为具有类似2SiO 结构的原子晶体,下列关于2CO 的原子晶体说法,正确的是A .2CO 的原子晶体和分子晶体互为同分异构体B .在一定条件下,2CO 原子晶体转化为2CO 分子晶体是物理变化C .2CO 的原子晶体和2CO 分子晶体具有相同的物理性质和化学性质D .在2CO 的原子晶体中,每一个C 原子结合4个O 原子,每一个O 原子跟两个C 原子相结合 9.下列叙述正确是A .酶具有很强的催化作用,胃蛋白酶只能催化蛋白质的水解,348K 时活性更强B .医疗上的血液透析利用了胶体的性质,而土壤保肥与胶体的性质无关C .鱿鱼中可以添加少量HCHO ,既可以使鱿鱼保存期延长,又可使鱿鱼变漂亮D .金刚石是由原子构成的空间网状结构,熔沸点高,硬度大10.下列“类比”结果正确的是A .2点燃2Mg+CO 2MgO+C ,则2327Mg+2NO 4MgO+Mg 燃N 点B .CCl 4溶剂能有效萃取水溶液中的单质碘,那么CCl 4也能萃取碘—淀粉溶液中的碘C .1mol 乙醛最多能被2molCu(OH)2氧化,则1mol 甲醛最多也是被2molCu(OH)2氧化D .HF 熔点大于HCl ,则SiF 4熔点大于SiCl 411.下表为元素周期表的一部分,其中X 、Y 、Z 、W 为短周期元素,W 元素的核电荷数为X 元素的2倍。
第三章 晶体结构与性质 分子晶体练习 【新教材】2020年秋人教版(2019)高中化学选择性必修2

第二节分子晶体与共价晶体第1课时分子晶体基础过关练题组一分子晶体及其结构1.下列有关分子晶体的说法中正确的是()A.分子内均存在共价键B.分子间一定存在范德华力C.分子间一定存在氢键D.其结构一定为分子密堆积2.下列各组物质各自形成晶体,均属于分子晶体的化合物是()A.NH3、HD、C10H8B.PCl3、CO2、H2SO4C.SO2、SiO2、P2O5l4、Na2S、H2O23.下列各物质所形成的晶体中,属于分子晶体且分子内只含极性共价键的是()A.CO2B.O2C.NH4ClD.Ar4.(2020河南郑州外国语学校高二月考)在海洋深处的沉积物中含有大量可燃冰,其主要成分是甲烷水合物。
甲烷水合物的结构可以看成是甲烷分子装在由水分子形成的“笼子”里。
下列说法正确的是()A.甲烷分子和水分子的VSEPR模型都是正四面体形B.甲烷分子通过氢键与构成“笼子”的水分子相结合C.可燃冰属于分子晶体D.水分子的键角大于甲烷分子的键角a的CO2分子有() 5.干冰晶胞如图所示,若干冰的晶胞棱长为a,则每个CO2分子周围与其相距√22A.4个B.8个C.12个D.6个6.下图为冰晶体的结构模型,大球代表O,小球代表H。
下列有关说法正确的是()A.冰晶体中每个水分子与另外四个水分子形成四面体结构B.冰晶体具有空间网状结构,是共价晶体C.水分子间通过H—O键形成冰晶体D.冰融化后,水分子之间的空隙增大7.(1)德国和美国科学家制出了由20个碳原子构成的空心笼状分子C20,该笼状结构是由许多正五边形构成的(如图所示)。
1个C20分子共有个正五边形,共有个共价键;C20晶体属于晶体。
(2)科学家拟合成一种“二重结构”的球形分子,即把足球形C60分子嵌入足球形Si60分子中,外面的硅原子与里面的碳原子以共价键相结合。
下列关于这种物质的叙述不正确的是(填字母)。
A.该物质是一种新型化合物B.该物质是两种单质组成的混合物C.该晶体属于分子晶体D.该物质具有极高的熔、沸点题组二分子晶体的性质8.下列性质可能符合分子晶体特点的是(深度解析)①熔点1070℃,易溶于水,水溶液能导电②熔点10.31℃,液态不导电,水溶液能导电③能溶于CS2,熔点112.8℃,沸点444.6℃④熔点97.81℃,质软,固态能导电,密度为0.97g·cm-3A.①④B.②③C.①②D.②④9.下列各物质所形成的晶体的熔、沸点高低的比较正确的是()A.H2>N2>O2B.NH3>AsH3>PH3C.Cl2>Br2>I2D.C(CH3)4>(CH3)2CHCH2CH3>CH3CH2CH2CH2CH310.C60分子和C60晶胞示意图如图所示。
第三章 晶体结构与性质 高二化学同步练习

第三章 晶体结构与性质 章末单元测试题一、选择题(本题共有15小题,每小题3分,共45分,每小题只有一个正确选项)1. 晶体是一类非常重要的材料,在很多领域都有广泛的应用。
我国现已能够拉制出直径为300毫米的大直径硅单晶,晶体硅大量用于电子产业。
下列对晶体硅的叙述中正确的是( )A .形成晶体硅的速率越大越好B .晶体硅没有固定的熔、沸点C .可用X 射线衍射实验来鉴别晶体硅和玻璃D .晶体硅的形成与晶体的自范性有关,而与各向异性无关2. 下列关于物质特殊聚集状态结构的叙述中,错误的是( )A .等离子体的基本构成微粒是带电的离子和电子及不带电的分子或原子B .非晶体基本构成微粒的排列是长程无序和短程有序的C .液晶内部分子沿分子长轴方向有序排列,使液晶具有各向异性D .纳米材料包括纳米颗粒和颗粒间的界面两部分,两部分都是长程有序的3. 关于晶体的下列说法正确的是( )①在晶体中只要有阴离子就一定有阳离子,只要有阳离子就一定有阴离子②分子晶体的熔点一定比金属晶体的低③晶体中分子间作用力越大,分子越稳定④离子晶体中,一定存在离子键⑤分子晶体中,一定存在共价键⑥共价晶体中,一定存在共价键⑦熔融时化学键没有破坏的晶体一定是分子晶体A .②④⑥B .④⑤⑦C .④⑥⑦D .③④⑦4. 某晶体结构最小的重复单元如图。
A 为阴离子,在立方体内,B 为阳离子,分别在顶点和面心,则该晶体的化学式为( )A .B 2AB .BA 2C .B 7A 4D .B 4A 75. 利用反应CCl 4+4Na=====973 K Ni-Co C(金刚石)+4NaCl 可实现人工合成金刚石。
下列关于该反应的说法错误的是( )A .C(金刚石)属于共价晶体B .该反应利用了Na 的强还原性C .CCl 4和C(金刚石)中的C 的杂化方式相同D .NaCl 晶体中每个Cl -周围有8个Na +6.下面有关晶体的叙述中,不正确的是()A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子B.氯化钠晶体中,每个Na+周围距离相等的Na+共有6个C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子7.下列说法中正确的是()A.金刚石晶体中的最小碳环由6个碳原子构成B.Na2O2晶体中阴离子与阳离子数目之比为1 1C.1 mol SiO2晶体中含2 mol Si—O键D.金刚石化学性质稳定,在高温下也不会和O2反应8.观察下列模型并结合有关信息,判断下列说法不正确的是()HCN S8SF6B12结构单元结构模型示意图备注—易溶于CS2—熔点1 873 K A.HCN的结构式为H—C≡N,分子中含有2个σ键和2个π键B.固态硫S8属于共价晶体C.SF6是由极性键构成的非极性分子D.单质硼属原子晶体,结构单元中含有30个B—B键9.解释下列物质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的是() A.钠、镁、铝的熔点和沸点逐渐升高,硬度逐渐增大B.金刚石的硬度大于晶体硅的硬度,其熔点也高于晶体硅的熔点C.KF、KCl、KBr、KI的熔点依次降低D.CF4、SiF4、GeF4、SnF4的熔点和沸点逐渐升高10.高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。
第三章 晶体结构与性质 检测题-高二下学期化学人教版(2019)选择性必修2

第三章《晶体结构与性质》检测题一、单选题1.下列有关化学键、氢键和范德华力的叙述中,不正确的是()A.金属键是金属离子与“电子气”之间的强烈作用,金属键无方向性和饱和性B.共价键是原子之间通过共用电子对形成的化学键,共价键有方向性和饱和性C.范德华力是分子间存在的一种作用力,分子的极性越大,范德华力越大D.氢键不是化学键而是一种较弱的作用力,所以氢键只存在于分子与分子之间2.关于晶体,下列有关叙述不正确的是A.利用超分子的分子识别特征,可以分离C60和C70B.晶体内部离子在微观空间呈周期性有序排列,使晶体具有各向异性C.可通过X-射线衍射实验区分晶体和非晶体D.“硅-炭黑晶体管”为一种新型材料,硅、炭黑均属于晶体3.已知某化合物的晶体是由以下最小单元密置堆积而成的,关于该化合物的以下叙述中错误的是A.1 mol该化合物中有1 mol Y B.1 mol该化合物中有1 mol BaC.1 mol该化合物中有7 mol O D.该化合物的化学式是YBa2Cu3O74.晶体的性质与晶体类型密切相关,下列关于晶体的描述不正确的是A.结构相似的共价晶体,原子半径越小,晶体的硬度和熔沸点越高B.某无色晶体能溶于水,质硬而脆,熔点为801℃,熔化状态下能导电,则该晶体可能为离子晶体C.易溶于CS2,液态时不导电,水溶液能导电的晶体为分子晶体D.含有阳离子的晶体不一定是金属晶体,金属晶体都具有较高的熔点、良好的导电性和延展性5.下列说法正确的是A.含有金属元素的化合物一定是离子化合物B.完全由非金属元素组成的化合物可能是离子化合物C.IA族和VIIA族元素原子间只能形成离子键D.金属键只存在于金属单质中6.下列物质具有自范性、各向异性的是A.钢化玻璃B.塑料C.水晶D.陶瓷A.由玻璃制成规则的玻璃球体现了晶体的自范性B.晶体由于内部质点排列的高度有序性导致其许多物理性质表现出各向异性C.等离子体是由电子、阳离子和电中性粒子组成的整体上呈电中性的物质聚集体D.若MgO中离子键的百分数为50%,则MgO可看作离子晶体与共价晶体之间的过渡晶体8.下列物质中有氧离子存在的是A.CaO B.H2O C.KClO3D.KOH9.X、Y、Z、W是原子序数依次增大的短周期主族元素,它们均位于不同的奇数族。
2020-2021学年高二化学人教版选修3物质结构与性质第三章《 晶体结构与性质》测试题 (1)

第三章《晶体结构与性质》测试题一、单选题1.下列变化需要克服共价键的是A.干冰的升华B.二氧化硅的熔化C.氯化钾熔化D.汞的气化2.下列物质属于非晶体的是。
①松香;②冰;③石英;④沥青;⑤铜;⑥纯碱A.①②③④⑤⑥B.①④C.①③D.⑤⑥3.如图所示晶体结构是一种具有优良的压电、电光等功能的晶体材料的最小结构单元(晶胞)。
晶体内与每个“Ti”紧邻的钡原子数和这种晶体材料的化学式分别是(各原子所带电荷均已略去)( )A.8;BaTi8O12B.8;BaTiO3C.3;BaTi2O3D.6;BaTiO34.离子化合物的熔点与离子的半径、离子所带的电荷有关,离子的半径越小,离子所带的电荷越高,则离子化合物的熔点就越高。
试判断KCl、CaO两种晶体熔点的高低顺序:A.KCl>CaO B.NaCl=CaO C.CaO>KCl D.无法比较5.据报道,某星球大气中含有一种称为硫化羰(COS)的化合物,其分子结构与二氧化碳类似,能在氧气里燃烧。
下列关于硫化羰的说法不正确的是()A.二氧化碳是非极性分子,但硫化羰是极性分子B.二氧化碳与硫化羰均无还原性C.固体硫化羰是分子晶体D.硫化羰分子中的三个原子处于同一直线上6.下列物质中熔点最高的是()A.Hg B.H2O C.W D.Na7.下列图像是NaCl、CsCl、ZnS等离子晶体结构图或是从其中分割出来的部分结构图。
试判断属于NaCl的晶体结构的图像为A.B.C.D.8.有关晶体的结构如下图所示,下列说法中错误的是A.钛酸钙的化学式为CaTiO3B.在金刚石晶体中,碳原子与碳碳键(C—C)数目之比为1:2C.硒化锌晶体中与一个Se2-距离最近且相等的Se2-有8个D.一个CaF2晶胞中平均含有4个Ca2+和8个F--9.下列关于物质特殊聚集状态的叙述中,错误的是A.在电场存在的情况下,液晶分子沿着电场方向有序排列B.非晶体的内部原子或分子的排列杂乱无章C.液晶最重要的用途是制造液晶显示器D.由纳米粒子构成的纳米陶瓷有极高的硬度,但低温下不具有优良的延展性10.下列金属晶体中,自由电子与金属阳离子间的作用力最弱的是A.Na B.K C.Mg D.Al11.下列有关物质性质的描述不符合事实的是A.有机物不导电B.钠和钾的合金可作原子反应堆的导热剂C.金刚石是自然界最硬的物质D.过氧化钠可以作供氧剂12.下表是A、B、C、D、E、F六种短周期元素的部分化合价、电负性和原子半径数据。
2022-2024北京重点校高二(上)期末化学汇编:几种简单的晶体结构模型

2022-2024北京重点校高二(上)期末化学汇编几种简单的晶体结构模型一、单选题1.(2024北京汇文中学高二上期末)下列对物质性质解释合理的是2.(2024北京第四中学高二上期末)BeCl2可以以单体、二聚体和多聚体的形式存在。
下列关于BeCl2的说法不正确...的是A.单体是非极性分子B.二聚体的沸点比单体更高C.多聚体是平面结构D.二聚体和多聚体中均存在配位键3.(2024北京首师大附中高二上期末)因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构也不同。
两种铁晶胞(均为立方体,边长分别为以anm和1.22anm)的结构示意图如下。
下列说法不正确...的是A.用X射线衍射可测定铁晶体的结构B.图2代表的铁单质中,一个铁原子周围最多有4个紧邻的铁原子C.图1与图2代表的铁单质中,原子之间以金属键相互结合D.图1与图2代表的铁单质的密度不同4.(2022北京西城高二上期末)下列说法中不正确...的是A.离子晶体中可能存在共价键、氢键B.硫单质熔点高于白磷的原因是硫硫键键能大于磷磷键键能C.可通过融化状态下是否导电,区分离子晶体与分子晶体D.石墨晶体中片层间距远大于层内碳原子间距,说明层间靠范德华力维系二、解答题5.(2024北京昌平高二上期末)普鲁士蓝类似物因其易于合成且具有良好的电化学性质等优势被广泛探索应用。
一种含锰普鲁士蓝类似物A的晶胞为立方体,边长为x nm,结构如图a所示,从各个方向所视视图均为图b。
(1)基态Mn原子价层电子排布式是。
(2)比较C和N的非金属性强弱,从原子结构的角度说明理由:。
(3)A中存在两种Mn3+,一种与C直接相连,一种与N直接相连,因此书写化学式时,Mn不能合并书写,而要写成Mn[Mn(CN)6];Mn3+与N之间的作用力类型可能是,理由是。
(4)已知阿伏加德罗常数为N A,该晶体的密度为g·cm−3。
(1nm=10−7cm)(5)利用图c装置电解难溶物Na2Mn[Mn(CN)6]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高二化学晶体结构练习题学校:__________姓名:__________班级:__________考号:__________一、单项选择1、认真分析NaCl与CsCl得晶体结构,判断下列说法错误得就是()A.NaCl与CsCl都属于AB型得离子晶体B.NaCl与CsCl晶体中阴、阳离子个数比相同,所以阴、阳离子得配位数相等C.NaCl与CsCl晶体中阴、阳离子得配位数分别为6与8D.NaCl与CsCl都属于AB型得离子晶体,所以阴、阳离子半径比不相同2、图就是CaF2晶胞得结构。
下列说法正确得就是( )A.一个CaF2晶胞中含有8个Ca2+B.一个CaF2晶胞中含有8个F-C.在CaF2晶胞中Ca2+得配位数为4D.在CaF2晶胞中F-得配位数为83、根据下列结构示意图,判断下列说法中不正确得就是()A.在NaCl晶体中,距Na+最近得Cl-形成正八面体B.在CaF2晶体中,每个晶胞平均占有4个Ca2+C.在金刚石晶体中,碳原子与碳碳键数目比为1:2D.该气态团簇分子得分子式为EF或FE4、下列选项所述中得数字不就是6得就是()A.在NaCl晶体中,与一个Na+最近得且距离相等得Cl-得个数B.在金刚石晶体中,围成最小环得原子数C.在二氧化硅晶体中,围成最小环得原子数D.在CsCl晶体中,与一个Cs+最近得且距离相等得Cs+得个数5、下列所示得图象就是从NaCl或CsCl晶体结构图中分割出来得部分结构图,试判断属于NaCl晶体结构得图象就是()⑴⑵⑶⑷A.图⑴与图⑶B.图⑵与图⑶C.只有图⑴D.图⑴与图⑷6、食盐晶体如下图所示。
在晶体中,表示Na+,ο表示Cl-。
已知食盐得密度为ρg/cm3,NaCl摩尔质量M g/mol,阿伏加德罗常数为N,则在食盐晶体里Na+与Cl-得间距大约就是()7、下面关于晶体得叙述中,错误得就是()A、氯化铯晶体中,每个Cs+周围紧邻8个Cl-B、氯化钠晶体中,每个Na+周围距离最近且相等得Na+共有6个C、干冰晶体中,每个CO2分子周围紧邻12个CO2分子D、金刚石为网状结构,由共价键形成得碳原子环中,最小环上有6个碳原子8、CaC2晶体得晶胞结构与NaCl晶体得相似(如图所示),但CaC2晶体中含有得中哑铃形C22-得存在,使晶胞沿一个方向拉长。
下列关于CaC2晶体得说法中错误得就是()A.1个Ca2+周围距离最近且等距离得C22-数目为6B.该晶体中得阴离子与F2就是等电子体C.6、4克CaC2晶体中含阴离子0、1molD.与每个Ca2+距离相等且最近得Ca2+共有12个9、下列有关说法不正确就是()图16-1A.水合铜离子得模型如图(a)所示,1个水合铜离子中有4个配位体B.CaF2晶体得晶胞如图(b)所示,每个CaF2晶胞平均占有4个Ca2+C.H原子得电子云图如图(c)所示,H原子核外大多数电子在原子核附近运动D.金属Cu中Cu原子堆积模型如图(d),为最密堆积,每个Cu原子得配位数均为12 10、如下图,在氯化钠晶体中,与每个Na+等距离且最近得几个Cl-所围成得空间几何构型为()A.十二面体 B.正八面体 C.正六面体 D.正四面体11、已知Li—Mg,Al—Be,B—Si在周期表中处于对角线位置,处于对角线元素得单质及同类化合物性质相似,下列有关说法不.正确得就是()A .钠晶体就是通过钠离子与自由电子间强烈得相互作用聚集而成得B .氯离子与紧邻得钠离子可构成以氯离子为中心得正八面体C .该金属氧化物可能显两性D .从其中一个三角形剖面知,该金原子族由30个原子构成12、下列图像就是从NaCl 或CsCl 晶体结构图中分割出来得部分结构图,试判断属于NaCl 晶体结构得图像就是( )A .图(1)与图(3)B .图(2)与图(3)C .只有图(1)D .图(1)与图(4)13、有关晶体得结构如下图所示,下列说法中错误..得就是( )A .在NaCl 晶体中,距Na +最近得Cl -形成正八面体B .该气态团簇分子得分子式为EF 或FEC .在CO 2 晶体中,一个CO 2 分子周围有12个CO 2 分子紧邻D .在碘晶体中,碘分子得排列有两种不同得方向14、有关晶体结构得叙述中,错误得就是( )A .金刚石得网状结构中,最小得环上有6个碳原子B .在氯化钠晶体中,每个氯离子周围都紧邻6个氯离子C .在金属铜得晶体中,由于存在自由电子,因此铜能导电D .分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键15、某化学式为AB 得离子晶体,已知5r(A 2+)=4r(B 2-)(各类离子 晶体与-+r r 关系如下图所示),经测定其密度为ρg ·cm -3,其摩尔质量为Mg ·mol -1,则下列有关该晶体得说法正确得就是( )A .该晶体结构与ZnS 晶体相似B .该晶体每个晶胞中有2个A 2+与B 2-C.该晶体晶胞得边长为34ρA N M cm D .A 2+离子紧邻得B 2-构成得空间结构为立方体16、(1)氯酸钾熔化,微粒间克服了__________得作用力;二氧化硅熔化,微粒间克服了__________得作用力;碘得升华,粒子间克服了__________得作用力。
三种晶体得熔点由高到低得顺序就是____________。
(2)下列六种晶体:①CO 2,②NaCl ,③Na ,④Si ,⑤CS 2,⑥金刚石,它们得熔点从低到高得顺序为__________(填序号)。
(3)在H 2、(NH 4)2SO 4、SiC 、CO 2、HF 中,由极性键形成得非极性分子就是__________,由非极性键形成得非极性分子就是__________,能形成分子晶体得物质就是____________,含有氢键得晶体得化学式就是______________,属于离子晶体得就是______________,属于原子晶体得就是______________,五种物质得熔点由高到低得顺序就是____________________。
(4)A 、B 、C 、D 为四种晶体,性质如下:A .固态时能导电,能溶于盐酸B .能溶于CS 2,不溶于水C .固态时不导电,液态时能导电,可溶于水D .固态,液态时均不导电,熔点为3 500℃试推断它们得晶体类型:A .__________;B 、__________;C 、________;D 、________。
17、下面有关晶体得叙述中,不正确得就是( )A .金刚石网状结构中,由共价键形成得碳原子环中,最小得环上有6个碳原子B .氯化钠晶体中,每个Na +周围距离相等得Na +共有6个C .氯化铯晶体中,每个Cs +周围紧邻8个Cl -D .干冰晶体中,每个CO 2分子周围紧邻12个CO 2分子18、在NaCl 晶体中,距离最近得Na +组成得最小多面体就是A .正四面体B .正六面体C .正八面体D .正十二面体19、如图就是氯化铯晶体得晶胞(晶体中得最小重复单元),已知晶体中两个最近得Cs +离子核间距离为a cm ,氯化铯得相对分子质量为M ,N A 为阿伏加德罗常数,则氯化铯晶体密度就是20、请回忆食盐晶体得晶胞结构,已知食盐得密度为ρ g ·cm -3,其摩尔质量为M g ·mol -1,阿伏加德罗常数为N A ,则在食盐晶体中Na +与Cl-得核间距大约就是()A 、 32A M N ρ cmB 、 32A M N ρ cmC 、 32A N M ρ cmD 、 328A N M ρ cm21、下列化学式既能表示物质得组成,又能表示物质得一个分子得就是()A .NaOHB .SiO 2C .FeD .C 3H 822、有关晶体得叙述正确得就是()A .在SiO 2晶体中,由Si 、O 构成得最小单元环就是8元环B .在12 g 金刚石中,含C —C 共价键键数为4 molC .在60 g 二氧化硅中,含Si —O 共价键键数为4 molD .在NaCl 晶体中,每个Na +周围与它最近且距离相等得Na +有6个二、填空题23、某离子晶体晶胞得结构如右图所示。
X(·)位于立方体顶点,Y(o)位于立方体中心。
试分析:(1)晶体中每个Y同时吸引着________个X,每个X同时吸引着________个Y,该晶体得化学式为________。
(2)晶体中每个X周围与它最接近且距离相等得X共有________个。
(3)晶体中距离最近得2个X与1个Y形成得夹角∠XYX就是________。
(4)设该晶体得摩尔质量为M g/mol,晶体密度为ρg/cm3,阿伏加德罗常数得值为N A,则晶体中两个距离最近得X中心距离为________cm。
24、如图所示一些晶体中得某些结构,它们分别就是NaCl、CsCl、干冰、金刚石、石墨结构中得某一种得某一部分:(1)代表金刚石得就是(填编号字母,下同)________,其中每个碳原子与________个碳原子最接近且距离相等。
金刚石属于________晶体。
(2)代表石墨得就是________,其中每个正六边形占有得碳原子数平均为________个。
(3)表示NaCl得就是________,每个Na+周围与它最接近且距离相等得Na+有________个。
(4)代表CsCl得就是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰得就是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)已知石墨中碳碳键得键长比金刚石中碳碳键得键长短,则上述五种物质熔点由高到低得排列顺序为________________________________________。
25、根据下图推测,CsCl晶体中两距离最近得Cs+间距离为a,则每个Cs+周围与其距离为a得Cs+数目为________,每个Cs+周围距离相等且次近得Cs+数目为________,距离为________,每个Cs+周围距离相等且第三近得Cs+数目为________,距离为________,每个Cs+周围紧邻且等距得Cl-数目为________。
26、水就是生命之源,它与我们得生活密切相关。
在化学实验与科学研究中,水也就是一种常用得试剂。
(1)水分子中氧原子在基态时核外电子排布式为________;(2)写出与H2O分子互为等电子体得微粒______(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢原子(H3O+)。
下列对上述过程得描述不合理得就是()A.氧原子得杂化类型发生了改变 B.微粒得形状发生了改变C.微粒得化学性质发生了改变 D.微粒中得键角发生了改变(4)下列就是钠、碘、金刚石、干冰、氯化钠晶体得晶胞图(未按顺序排序)。
