QMST-QR-016-计量器具检定记录卡
QMST-QR-014仪器设备台帐

QMST-QR-014仪器设备台帐
一、基本信息
1.设备名称:QMST-QR-014
2.型号规格:QR-014
3.设备编号:E256
4.供应商:Qingdao Yuming Technology Co., Ltd.
5.设备分类:高端装置
6.购置日期:2023年3月
7.质保期:三年
8.状态:在用
9.投用部门:实验室
10.存放地点:质控室
11.使用人员:张
二、使用情况
1.设备安装位置:实验室
2.使用频率:每天使用4小时
3.使用范围:实验室
4.设备开关状态:普遍关闭
5.设备使用情况:良好
三、维护管理
1.检查和保养:每月1次
2.保养内容:清洗、更换润滑油、检查零件是否松动、检查电气安全装置、校准仪器
3.报修:月底检查时发现异常情况时及时报修
4.更换:损坏或维修价格超出财务报废标准时,更换新的设备
四、安全保护
1.建立安全操作规程,规定操作人员应按照说明书、安全操作规程使用设备,严禁将设备用于非法用途。
2.使用前先接通电源,检查安全装置是否工作正常。
3.使用时穿安全鞋、戴安全帽,避免设备落物引起的伤害。
4.禁止非专业人员操作设备。
5.设备操作时不得携带金属物品,以避免意外火花引起的火灾。
六、资料存档
1.购置合同:
2.使用说明书:。
医疗器械经营企业质量管理体系全套记录表格

医疗器械经营企业质量管理体系全套记录表格内部审核与管理制度实施考核检查记录使用部门:NO: QMST-QR-001召回计划实施情况报告NO: QMST-QR-002文件发放/回收记录表文件更改申请审批记录表NO: QMST-QR-004购进(采购)记录文件作废/保留/销毁单NO: QMST-QR-006合格供方名单NO: XX-QR-007首营企业审批表首营品种审批表注:附生产企业许可证、营业执照、批准文件、质量标准、出厂检验报告、样品、价格批文、GSP证书及临床总结报告等资料.NO: QMST-QR-009质量验收记录养护档案表NO: QMST-QR-011设备报废单NO: QMSTXX-QR-012仪器设备维修保养记录NO: QMST-QR-013仪器设备台帐NO: QMST-QR-014设备日常保养点检表NO: QMST-QR-015计量器具检定记录卡取样记录养护设备使用记录库存质量养护记录在库检查记录部门:质量管理部检验员:审核:NO: QMST-QR-020年月库区:表号:温度范围℃适宜相对湿度范围%注:冷库温度:2-8℃,相对湿度:45-75%NO: QMST-QR-021NO: QMST-QR-022销售记录(清单)出库复核记录不合格产品报损审批表报告单位:报告日期:报损台帐不合格台帐(销毁记录)编号:说明:来源指不合格的来源部门或门店或客户名称NO: QMST-QR-027NO: QMST-QR-028NO: QMTS-QR-029顾客投拆查询质量台帐人员培训考核记录表NO: QMST-QR-032顾客质量投诉及处理记录NO: QMST-QR-033客户资格审核表NO: XX-QR-034质量记录处理(销毁)记录单号:NO: XX-QR-035采购计划编制:日期:批准:日期:NO: QMST-QR-036产品质量保证协议书甲方:公司乙方:公司为认真贯彻医疗器械等产品的法律法规,保证产品质量,明确质量责任,甲、乙双方本着平等、互利的原则,经协商,达成如下协议:一、乙方保证向甲方提供最新版本的供应商和产品资料,并保证所提供资料的真实性、合法性,并有责任及时更新已经过期、变更的资料,其中包括:1.合法有效、加盖公章的《营业执照》、许可证(按许可证管理的)复印件;2.合法有效、加盖公章的强制认证证书或其他有特别管理要求的文件复印件;3.产品的有效及合法批件复印件。
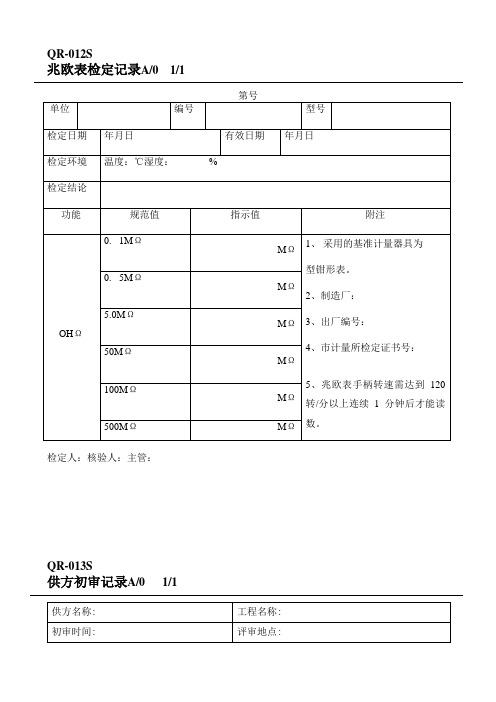
强制检定计量器具检定记录卡概览

强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
编号:1228500450 制卡日期 2010年 10 月 3 日制卡人:林珠
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
非强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
强制检定计量器具检定记录卡
编号:WL1006 制卡日期 2005 年 9 月 1 日制卡人:。
医疗器械经营企业质量管理规章制度及工作程序

(2016年新版)医疗器械经营企业质量管理制度及工作程序(全套)医疗器械经营企业质量管理制度xxxxxx医疗科技有限公司2016年医疗器械经营质量管理制度1、医疗器械经营质量管理制度目录1.质量管理机构(质量管理人员)职责QMST-MS-0012.质量管理规定QMST-MS-0023.采购、收货、验收管理制度QMST-MS-0034.供货者资格审查和首营品种质量审核制度QMST-MS-0045.仓库贮存、养护、出入库管理制度QMST-MS-0056.销售和售后服务管理制度QMST-MS-0067.不合格医疗器械管理制度QMST-MS-0078.医疗器械退、换货管理制度QMST-MS-0089.医疗器械不良事件监测和报告管理制度QMST-MS-00910.医疗器械召回管理制度QMST-MS-01011.设施设备维护及验证和校准管理制度QMST-MS-01112.卫生和人员健康状况管理制度QMST-MS-01213.质量管理培训及考核管理制度QMST-MS-01314.医疗器械质量投诉、事故调查和处理报告管理制度QMST-MS-01415.购货者资格审查管理制度QMST-MS-01516.医疗器械追踪溯管理制度QMST-MS-01617.质量管理制度执行情况考核管理制度QMST-MS-01718.质量管理自查制度QMST-MS-01819.医疗器械进货查验记录制度QMST-MS-01920.医疗器械销售记录制度QMST-MS-0202、医疗器械经营质量工作程序目录1.质量管理文件管理程序QMST-QP-0012.医疗器械购进管理工作程序QMST-QP-0023.医疗器械验收管理工作程序QMST-QP-0034.医疗器械贮存及养护工作程序QMST-QP-0045.医疗器械出入库管理及复核工作程序QMST-QP-0056.医疗器械运输管理工作程序QMST-QP-0067.医疗器械销售管理工作程序QMST-QP-0078.医疗器械售后服务管理工作程序QMST-QP-0089.不合格品管理工作程序QMST-QP-00910.购进退出及销后退回管理工作程序QMST-QP-01011.不良事件报告工作程序QMST-QP-01112.医疗器械召回工作程序QMST-QP-0121、医疗器械经营质量管理制度文件名称:质量管理机构(质量管理人员)职责编号:QMST-MS-001起草部门:质量管理部起草人:审阅人:批准人:起草时间:审核时间:批准时间:版本号:A0变更记录:变更原因:为建立符合《医疗器械监督管理条例》650号令、《医疗器械经营监督管理办法》局令8号、《国家食品药品监督管理总局关于施行医疗器械经营质量管理规范的公告(2014年第58号)的规范性文件,特明确质量管理机构或质量管理负责人的质量管理职责:一、组织制订质量管理制度,指导、监督制度的执行,并对质量管理制度的执行情况进行检查、纠正和持续改进;二、负责收集与医疗器械经营相关的法律、法规等有关规定,实施动态管理;三、督促相关部门和岗位人员执行医疗器械的法规规章及本规范;四、负责对医疗器械供货者、产品、购货者资质的审核;五、负责不合格医疗器械的确认,对不合格医疗器械的处理过程实施监督;六、负责医疗器械质量投诉和质量事故的调查、处理及报告;七、组织验证、校准相关设施设备;八、组织医疗器械不良事件的收集与报告;九、负责医疗器械召回的管理;十、组织对受托运输的承运方运输条件和质量保障能力的审核;十一、组织或者协助开展质量管理培训;十二、其他应当由质量管理机构或者质量管理人员履行的职责。
医疗器械经营企业质量管理制度及工作程序

(2016年新版)医疗器械经营企业质量管理制度及工作程序(全套)医疗器械经营企业质量管理制度xxxxxx医疗科技有限公司2016年医疗器械经营质量管理制度1、医疗器械经营质量管理制度目录1.质量管理机构(质量管理人员)职责QMST-MS-0012.质量管理规定QMST-MS-0023.采购、收货、验收管理制度QMST-MS-0034.供货者资格审查和首营品种质量审核制度QMST-MS-0045.仓库贮存、养护、出入库管理制度QMST-MS-0056.销售和售后服务管理制度QMST-MS-0067.不合格医疗器械管理制度QMST-MS-0078.医疗器械退、换货管理制度QMST-MS-0089.医疗器械不良事件监测和报告管理制度QMST-MS-00910.医疗器械召回管理制度QMST-MS-01011.设施设备维护及验证和校准管理制度QMST-MS-01112.卫生和人员健康状况管理制度QMST-MS-01213.质量管理培训及考核管理制度QMST-MS-01314.医疗器械质量投诉、事故调查和处理报告管理制度QMST-MS-01415.购货者资格审查管理制度QMST-MS-01516.医疗器械追踪溯管理制度QMST-MS-01617.质量管理制度执行情况考核管理制度QMST-MS-01718.质量管理自查制度QMST-MS-01819.医疗器械进货查验记录制度QMST-MS-01920.医疗器械销售记录制度QMST-MS-0202、医疗器械经营质量工作程序目录1.质量管理文件管理程序QMST-QP-0012.医疗器械购进管理工作程序QMST-QP-0023.医疗器械验收管理工作程序QMST-QP-0034.医疗器械贮存及养护工作程序QMST-QP-0045.医疗器械出入库管理及复核工作程序QMST-QP-0056.医疗器械运输管理工作程序QMST-QP-0067.医疗器械销售管理工作程序QMST-QP-0078.医疗器械售后服务管理工作程序QMST-QP-0089.不合格品管理工作程序QMST-QP-00910.购进退出及销后退回管理工作程序QMST-QP-01011.不良事件报告工作程序QMST-QP-01112.医疗器械召回工作程序QMST-QP-0121、医疗器械经营质量管理制度文件名称:质量管理机构(质量管理人员)职责编号:QMST-MS-001起草部门:质量管理部起草人:审阅人:批准人:起草时间:审核时间:批准时间:版本号:A0变更记录:变更原因:为建立符合《医疗器械监督管理条例》650号令、《医疗器械经营监督管理办法》局令8号、《国家食品药品监督管理总局关于施行医疗器械经营质量管理规范的公告(2014年第58号)的规范性文件,特明确质量管理机构或质量管理负责人的质量管理职责:一、组织制订质量管理制度,指导、监督制度的执行,并对质量管理制度的执行情况进行检查、纠正和持续改进;二、负责收集与医疗器械经营相关的法律、法规等有关规定,实施动态管理;三、督促相关部门和岗位人员执行医疗器械的法规规章及本规范;四、负责对医疗器械供货者、产品、购货者资质的审核;五、负责不合格医疗器械的确认,对不合格医疗器械的处理过程实施监督;六、负责医疗器械质量投诉和质量事故的调查、处理及报告;七、组织验证、校准相关设施设备;八、组织医疗器械不良事件的收集与报告;九、负责医疗器械召回的管理;十、组织对受托运输的承运方运输条件和质量保障能力的审核;十一、组织或者协助开展质量管理培训;十二、其他应当由质量管理机构或者质量管理人员履行的职责。
最全设备管理手册之表格记录
现场作业情况
是否服从经管处经管
5
经管处评定
是否擅自接驳水电,每发生一次扣1分。
3
动火作业是否得到批准
3
施工现场是否整洁
3
施工现场是否有安全警示,无,发现一次扣1分。
3
有无违章作业行为,发现一次,扣完。
5
有无安全防护措施,发现一次,扣完。
5
固体、液体、气体废物是否妥善处理,否,发现一次扣1分。
3
有无事故发生,发生一次扣完。
施工单位:
建设地点:
工程造价:
开工时间:
交工时间:
工
程
概
况
工程质量验收评语
质 量
评定等级
参加验收单位:
验收人:
参加验收单位:
验收人:
参加验收单位:
验收人:
参加验收单位:
验收人:
注:1、工程质量现场验收,确认质量达到规范要求后,请即签字盖章认可。
2、本表一式四份,均用碳素或蓝黑墨水填写。
QR-018S
编号:
安装位置:
诊断仪器型号:
设备型号及主要技术参数:
诊断内容及状态结果记录
专家意见:
签名: 年 月 日
设备经管部意见:
签名: 年 月 日
主管副总经理审批:
签名: 年 月 日
QR-034S
报废设备、器件清单A/0 1/1
经管处名称: 年度 半年
序号
设备、器件名称
设备编号
型号
单价
生产厂家
报废时间
处置办法
经管处:供方:主任签名:部门经理签名:年月日
工程
内容、评分规范
应得分
经管处评分
设备部评分
计量器具校验记录
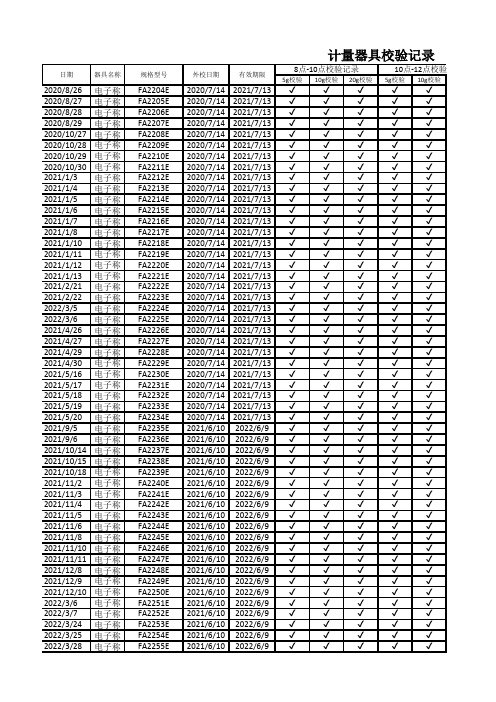
5g 校验10g 校验20g 校验5g 校验10g 校验2020/8/26电子称FA2204E 2020/7/142021/7/13✔✔✔✔✔2020/8/27电子称FA2205E 2020/7/142021/7/13✔✔✔✔✔2020/8/28电子称FA2206E 2020/7/142021/7/13✔✔✔✔✔2020/8/29电子称FA2207E 2020/7/142021/7/13✔✔✔✔✔2020/10/27电子称FA2208E 2020/7/142021/7/13✔✔✔✔✔2020/10/28电子称FA2209E 2020/7/142021/7/13✔✔✔✔✔2020/10/29电子称FA2210E 2020/7/142021/7/13✔✔✔✔✔2020/10/30电子称FA2211E 2020/7/142021/7/13✔✔✔✔✔2021/1/3电子称FA2212E 2020/7/142021/7/13✔✔✔✔✔2021/1/4电子称FA2213E 2020/7/142021/7/13✔✔✔✔✔2021/1/5电子称FA2214E 2020/7/142021/7/13✔✔✔✔✔2021/1/6电子称FA2215E 2020/7/142021/7/13✔✔✔✔✔2021/1/7电子称FA2216E 2020/7/142021/7/13✔✔✔✔✔2021/1/8电子称FA2217E 2020/7/142021/7/13✔✔✔✔✔2021/1/10电子称FA2218E 2020/7/142021/7/13✔✔✔✔✔2021/1/11电子称FA2219E 2020/7/142021/7/13✔✔✔✔✔2021/1/12电子称FA2220E 2020/7/142021/7/13✔✔✔✔✔2021/1/13电子称FA2221E 2020/7/142021/7/13✔✔✔✔✔2021/2/21电子称FA2222E 2020/7/142021/7/13✔✔✔✔✔2021/2/22电子称FA2223E 2020/7/142021/7/13✔✔✔✔✔2022/3/5电子称FA2224E 2020/7/142021/7/13✔✔✔✔✔2022/3/6电子称FA2225E 2020/7/142021/7/13✔✔✔✔✔2021/4/26电子称FA2226E 2020/7/142021/7/13✔✔✔✔✔2021/4/27电子称FA2227E 2020/7/142021/7/13✔✔✔✔✔2021/4/29电子称FA2228E 2020/7/142021/7/13✔✔✔✔✔2021/4/30电子称FA2229E 2020/7/142021/7/13✔✔✔✔✔2021/5/16电子称FA2230E 2020/7/142021/7/13✔✔✔✔✔2021/5/17电子称FA2231E 2020/7/142021/7/13✔✔✔✔✔2021/5/18电子称FA2232E 2020/7/142021/7/13✔✔✔✔✔2021/5/19电子称FA2233E 2020/7/142021/7/13✔✔✔✔✔2021/5/20电子称FA2234E 2020/7/142021/7/13✔✔✔✔✔2021/9/5电子称FA2235E 2021/6/102022/6/9✔✔✔✔✔2021/9/6电子称FA2236E 2021/6/102022/6/9✔✔✔✔✔2021/10/14电子称FA2237E 2021/6/102022/6/9✔✔✔✔✔2021/10/15电子称FA2238E 2021/6/102022/6/9✔✔✔✔✔2021/10/18电子称FA2239E 2021/6/102022/6/9✔✔✔✔✔2021/11/2电子称FA2240E 2021/6/102022/6/9✔✔✔✔✔2021/11/3电子称FA2241E 2021/6/102022/6/9✔✔✔✔✔2021/11/4电子称FA2242E 2021/6/102022/6/9✔✔✔✔✔2021/11/5电子称FA2243E 2021/6/102022/6/9✔✔✔✔✔2021/11/6电子称FA2244E 2021/6/102022/6/9✔✔✔✔✔2021/11/8电子称FA2245E 2021/6/102022/6/9✔✔✔✔✔2021/11/10电子称FA2246E 2021/6/102022/6/9✔✔✔✔✔2021/11/11电子称FA2247E 2021/6/102022/6/9✔✔✔✔✔2021/12/8电子称FA2248E 2021/6/102022/6/9✔✔✔✔✔2021/12/9电子称FA2249E 2021/6/102022/6/9✔✔✔✔✔2021/12/10电子称FA2250E 2021/6/102022/6/9✔✔✔✔✔2022/3/6电子称FA2251E 2021/6/102022/6/9✔✔✔✔✔2022/3/7电子称FA2252E 2021/6/102022/6/9✔✔✔✔✔2022/3/24电子称FA2253E 2021/6/102022/6/9✔✔✔✔✔2022/3/25电子称FA2254E 2021/6/102022/6/9✔✔✔✔✔2022/3/28电子称FA2255E 2021/6/102022/6/9✔✔✔✔✔计量器具校验记录8点-10点校验记录10点-12点校验记录日期器具名称规格型号外校日期有效期限2022/3/29电子称FA2256E2021/6/102022/6/9✔✔✔✔✔2022/5/11电子称FA2257E2021/6/102022/6/9✔✔✔✔✔2022/5/12电子称FA2258E2021/6/102022/6/9✔✔✔✔✔2022/5/13电子称FA2259E2021/6/102022/6/9✔✔✔✔✔20g校验5g校验10g校验20g校验5g校验10g校验20g校验✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔操作人录点-12点校验记录13点-15点校验记录15点-17点校验记录✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔✔。
计量器具保养点检表

测定具
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
3C
31
1
校正标识
有、并且在限期内
目
2
电源
电力不足时,及时更换
目
3
清洁
使用后应擦净油污等
目
4
防锈
测量头涂少许油脂
丰
5
6
7
8
【点检NG内容】
点检人
日期
NG内容
修理/检定记录
签名
日期
审核:日期:作成:日期:
年—月
计量器具名称
杠杆百(千)分表(ST)
规格
管理编号
使用 单位
责 任 人
【日常
常点检项目
]备注:2代表
狂OKX代表
gNG
NO.
点检项目
判定基准
测定具
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
3C
31
1
校正标识
有、并且在限期内
目
2
表针
摆动灵活
目丰
22
23
检测设备周期检定记录卡

检测设备周期检定记录卡1.设备信息:设备名称:_______________设备编号:_______________制造商:_______________型号:_______________出厂日期:_______________检定日期:_______________2.检定参数:检定周期:_______________检定单位:_______________检定标准:_______________检定准确度:_______________日期检定结果检定员签名______________________________________________ ______________________________________________ ______________________________________________ ______________________________________________ ______________________________________________4.备注:____________________________________________________________ _______________________________________________________________ _______________________________________________________________ ___5.附录:检定单位资质证书复印件:_______________检定仪器仪表证书复印件:_______________6.文件管理:检定记录卡编号:_______________文件存档位置:_______________文件保管人:_______________文件保管期限:_______________7.检定结果说明:在检定记录栏中,填写设备的检定日期和检定结果。
