人教版高一化学必修一《氧化还原反应》专题
人教版化学必修一第二章第三节氧化还原反应 -知识点总结+典例 (含答案)

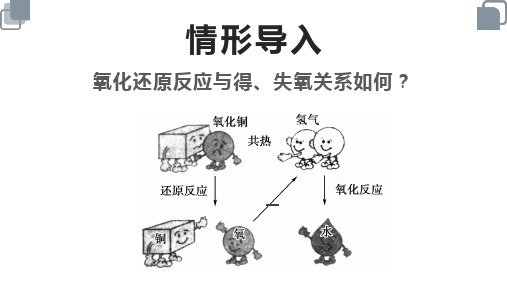
2.3氧化还原反应➢ 氧化还原反应基本概念1.特征:有元素化合价的升降。
(判断依据)2.本质:电子的转移。
3.规律:升失氧化还原剂,降得还原氧化剂。
✧ 还原剂,具有还原性,化合价升高,失去电子,被氧化,发生氧化反应,得到氧化产物。
✧ 氧化剂,具有氧化性,化合价降低,得到电子,被还原,发生还原反应,得到还原产物。
4.转移电子的表示方法:(1)双线桥 变价元素由反应物指向生成物,上方标明 得/失 变价元素原子数╳每个原子化合价改变量 如:① H 2 + CuO === Cu + H 2O ② MnO 2 + 4HCl(浓)=== MnCl 2 + Cl 2↑+2H 2O则①中1mol H 2反应的转移电子数为 。
②中生成1molCl 2的转移电子数为 。
注:转移电子数与反应中各物质系数成正比。
(2)单线桥 反应物中失电子元素指向得电子元素,上方直接标明转移电子数目,不需要写得/失。
H 2 + CuO === Cu + H 2O5.氧化还原反应与四种基本反应类型的关系 :6. 常见的氧化剂和还原剂✧ 常见氧化剂:Cl 2、Br 2、O 2、O 3、浓H 2SO 4、HNO 3、KMnO 4、KClO 3、K 2Cr 2O 7、Fe 3+、HClO 、ClO -、MnO 2、H 2O 2、Na 2O 2等等等✧ 常见还原剂: 金属、S 2-、HS 、H 2S 、S 、SO 2、 SO 32-、 HSO 3-、 I - 、Fe 2+ 、Br - 、Cl -等等等➢ 题型1 概念理解判断( )1.有失去电子的反应为还原反应( )2.含有氧元素的物质是氧化剂( )3.氧化剂得到电子的数目和还原剂失去电子的数目一定相等( )4.有一种元素被氧化必定有另一种元素被还原( )5.有单质参与的反应一定是氧化还原反应( )6.置换反应不一定属于氧化还原反应( )7.在反应中不一定所以元素的化合价都发生变化( )8.在化学反应中,得电子越多的氧化剂,其氧化性越强➢ 题型2 转移电子数计算 1.下列表示反应中电子转移的方向和数目正确的是( )A .B .C .D .2.实验室常用KMnO 4和浓盐酸反应制备Cl 2化学方程式如下,2KMnO 4+16HCl (浓)=2KCl+2MnCl 2+5Cl 2↑氧化剂+还原剂→还原产物+氧化产物 硫碘铁溴+8H2O下列说法不正确的是()A.Cl2是氧化产物B.有0.8mol的HCl被氧化时,标况下生成Cl2 5.6LC.KMnO4是氧化剂D.每8mol HCl参加反应,转移电子的物质的量为5mol3.下列反应中水的作用是:(填序号)①2Na+2H2O==2NaOH+H2↑②2H2O==2H2↑+O2↑③Cl2+H2O==HCl+HClO④3NO2+H2O==2HNO3+NO ⑤2F2+2H2O==4HF+O2(1)水作只还原剂;(2)水只作氧化剂;(3)水既作氧化剂也作还原剂;(4)水既不是氧化剂也不是还原剂。
高一化学(必修一)《第一章 氧化还原反应》练习题及答案

高一化学(必修一)《第一章氧化还原反应》练习题及答案班级:___________姓名:___________考号:___________一、单选题1.古诗是古人为我们留下的宝贵精神财富,下列诗句中不涉及氧化还原反应的是()A.野火烧不尽,春风吹又生B.粉身碎骨浑不怕,要留清白在人间C.春蚕到死丝方尽,蜡炬成灰泪始干D.爆竹声中一岁除,春风送暖入屠苏2.李时珍在《本草纲目》中对火药的描述是“火药乃焰硝(主要成分为KNO3)、硫磺、杉木炭所合,以为烽遂铳机诸药者”,下列有关叙述错误的是()A.火药发生爆炸时,“焰硝、硫磺、杉木炭”之间发生了氧化还原反应B.焰硝中的KNO3易溶于水,其溶解度受温度影响较大C.火药中的硫黄化学性质比较活泼,可以与铜化合生成硫化铜D.“木炭”是木材经过不完全燃烧所残留的黑色多孔固体燃料3.氧化还原反应发生在同种元素之间的是()A.Zn+2HCl=ZnCl2+H2↑B.2H2S+SO2=3S↓+2H2OC.H2+CuO ΔCu+H2O D.2H2O通电2H2↑+O2↑4.铬能慢慢地溶于稀盐酸得到蓝色溶液,若通入空气则溶液颜色变绿,发生的反应有①Cr+2HCl=CrCl2+H2↑、②4CrCl2+4HCl+O2=4CrCl3+2H2O,下述叙述中不正确的是()A.反应①属于置换反应B.HCl在反应①②中均发生还原反应C.反应①中HCl被还原D.溶液颜色由蓝变绿是因为Cr2+发生氧化反应5.在四大基本类型的反应中,一定是氧化还原反应的是()A.复分解反应B.置换反应C.分解反应D.化合反应6.下列化学反应属于氧化还原反应,但不属于四种基本反应类型的是()A.Cl2+2KBr=Br2+2KClB.2NaHCO3ΔNa2CO3+H2O+CO2↑C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 D.2Na2O2+2CO2=2Na2CO3+O27.下列化学反应中电子转移的表示方法一定不正确的是 ( )A .B .C .D .8.我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为2KNO 3+S +3C 点燃K 2S +N 2↑+3CO 2↑。
人教版高一化学必修1-第二章化学物质及其变化第一课时《氧化还原反应》PPT教学课件

●典例剖析 (2014·试题调研)下列化学反应中电子转移的
表示方法正确的是( )
【解析】 A项元素的电子得失标反;B项也是元素的电 子得失标反;D项电子转移方向弄反,即箭头指出标反。
【答案】 C
已知铜在常温下能被稀硝酸溶解,其反应的化 学方程式如下:
3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O (1)用双线桥法表示电子得失的方向和数目: ___________________________________________。 (2)用单线桥法表示电子得失的方向和数目: ____________________________________。 (3)若3 mol Cu参加反应,则该过程转移的电子是 ________mol。
(2)从化合价升降的角度认识
①从化合价的角度分析氧化反应、还原反应的特点:
升高 降低
②从化合价的角度判断:氧化还原反应是有__元__素__化__合__价__升__降_ 的化学反应。
(3)从电子转移的角度认识
①从电子转移的角度分析氧化反应、还原反应的特点: 失去电子或电子对偏离 得到电子或电子对偏向
②从电子转移的角度判断: 氧化还原反应是_有__电__子__转_移__(_得__失_或__偏__移__) ___的化学反应。 2.氧化还原反应的基本概念和实质 (1)基本概念和实质 ①基本概念。
得到
偏向
失去
偏离
还原
氧化
②实质:电子的转移(即电子的得失或偏移)。 ③特征:元素化合价发生变化。 (2)反应中概念间的关系
①氧化剂在反应中化合价__降__低____→具有__氧__化____性→被 __还__原____→生成__还__原____产物。
②还原剂在反应中化合价_____升__高_______→具有__还__原____ 性→被__氧__化____→生成__氧__化____产物。
高中化学人教版必修一《专题2.3.1氧化还原反应》课件
【答案】Fe CuSO Fe CuSO 还原 氧化
4
4
四、氧化还原反应中电子转移的表示方法
1.双线桥法 表明反应前后同一元素原子间的电子转移情形。
(1)双线桥法的基本步骤
(2)注意事项 ①箭头、箭尾对应化合价变化的同种元素。 ②必须注明“得到”或“失去”的字样。 ③还原剂失去电子总数与氧化剂得到电子总数相等。
1.电子得失型
以反应2Na+Cl2
2NaCl为例,反应进程中产生了电子的
得失:一个钠原子失去一个电子,
钠元素从0价升高到__+__1价,钠元素被_氧__化__。 氯元素从0价着落到__-__1价,一个氯原子得到一个电子,氯元 素被还原,在此反应中氧化剂是__C_l_2____,还原剂是__N_a____。
D.Cu0 +2H2+S6 2e-O4(浓)==△===C+u2 SO4++S4O2↑+2H2O
【解析】 【答案】BC
针对训练
1.工业上制取ClO2的化学反应:2NaClO3+SO2+ H2SO4=2ClO2+2NaHSO4,下列说法正确的是(多选)( )
A.SO2在反应中被氧化 B.NaClO3在反应中失去电子 C.H2SO4在反应中作氧化剂 D.1 mol氧化剂在反应中得到1 mol电子
2.单线桥法 表明反应前后不同元素原子的电子转移情形。
(1)单线桥法的基本步骤
(2)注意事项 ①单线桥表示氧化剂和还原剂中变价元素原 子得失电子的情形; ②不需标明“得”或“失”,只标明电子转 移数目; ③箭头标明电子转移的方向; ④单线桥箭头从还原剂中失电子的元素原子 指向氧化剂中得电子的元素原子。
2.化合价升降的角度(特点) 氧化还原反应必有化合价的变化,元素化合价
升高的反应为氧化反应,元素化合价着落的反应为 还原反应。这可作为判定氧化还原反应的根据。
人教版高中必修一化学课件:2.3.1氧化还原反应

非氧化还原反应
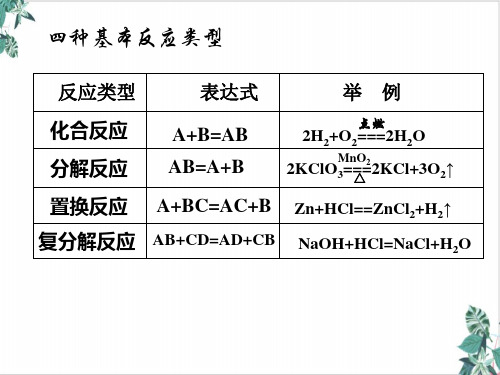
(2)氧化还原反应与四种基本反应类型的关系
基本反应类 型
反应实例
化合反应 3Fe+2O2 点=燃 Fe3O4 CaO+H2O = Ca(OH)2
分解反应 2H2O 电=解2H2↑+O2↑ ∆ CaCO3 = CaO+CO2 ↑
Fe+CuSO4=FeSO4+Cu 置换反应 Zn+H2SO4=ZnSO4+H2 ↑
含元素的化合价降低,具有氧化性,本身被还原 还原剂:失电子(或电子对偏离)的 物质,在反应时所
含元素的化合价升高,具有还原性,本身被氧化 氧化产物和还原产物(生成物) 氧化产物:氧化反应得到的产物
还原产物:还原反应得到的产物
常见的氧化剂、还原剂
⑴氧化剂: 得电子,化合价降低,高价态物质。
1)活泼的非金属单质:O2 , Cl2 2)高价的氧化物:CuO , Fe2O3 3)高价的含氧酸及其盐:
(4)氧化还原反应与四种基本反应类型的关系图示:
分解反应
化合反应
复分解反应
氧化还原反应 置换反应
氧化还原反应的几个“不一定”
• (1)一种元素被氧化,不一定有另一种元素被 还原。 Cl2 + H2O = HCl + HClO
• (2)有单质参加或生成的反应不一定是氧化还 原反应。
放电
3O2 = 2O3
Ø 从电子转移的角度看氧化还原反应 化合价的升降是由电子转移引起的,电子
转移也是判断氧化还原反应的标准。
钠原子失电子,化合价升高,发生氧化反应
0
0
+1 -1
点燃
2Na + Cl2 = 2NaCl
氯原子得电子,化合价降低,发生 还原反应
§2-3《氧化还原反应》专题训练含答案

高中化学必修一§2-3《氧化还原反应》专题训练(一)、知识板块1、氧化还原反应的三个定义2、氧化还原反应的实质与特征3、氧化还原反应与四种基本反应的关系4、氧化还原反应的表示方法:单线桥与双线桥5、氧化还原反应的口诀:失升还被氧,得降氧被还6、氧化还原反应类型①部分氧化还原反应:部分氧化与部分还原②自身氧化还原反应:具备一同③歧化反应:具备三同(同一物质、同一价态、同种元素)④归中反应(反歧化反应):不同价态、同种元素(H2S与浓H2SO4、SO 2;NH4NO3)7、常见氧化剂:O3 O2 Cl2 Br2 H2O2 Na2O2MnO2PbO2Fe2O3CuO HNO3浓H2SO4HClO H2CrO4K2Cr2O7KMnO4K2FeO4 KClO3 NaClO Ca(ClO)2 Ag+ Fe3+ ClO—常见还原剂:金属、可燃物Fe2+I – Br–S2-HS-SO32-HSO3-H2SO3SO2H2S8、氧化还原反应的发生条件:两强制两弱(据此判别氧化还原反应能否发生)9、氧还性与化合价的关系:高氧低还中兼(如Fe3+ Fe2+ Fe ,H2SO4H2SO3S H2S ,但HClO例外,比HClO4氧化性强)10、氧还性与“三度”(温度、浓度、酸度)的关系:成正比。
11、氧还性强弱比较①根据化学反应方程式(二王法、傻瓜判断法)②根据金属活动顺序表、非金属活动顺序表(F2O3Cl2Br2O2I2S)③根据与同一物质反应的难易、顺序、化合价:如Na2SO3H2SO3SO2分别与O2反应;Cl2O2I2分别与Fe反应;FeCl3 CuCl2分别与Fe反应。
12、氧化还原反应典例①Fe3+分别与Cu、I-、S2-、H S-、H2S、SO32-、H SO3-、SO2反应;②Cl2分别与FeBr2、FeI2反应;③Fe加入FeCl3、CuCl2混合溶液中;④Fe(OH)3、Fe2O3分别与HI酸反应;SO2通入Cl2、Br2、I2水中。
高中化学人教版必修一:专题06 氧化还原反应的应用(教师版)

高中化学人教版必修一:专题06 氧化还原反应的应用❖氧化还原反应的强弱规律及其应用❖氧化还原反应的价变规律及其应用❖氧化还原反应的守恒规律及其应用知识点一氧化剂与还原剂相对强弱比较1.常见的氧化剂(1)活泼的非金属单质:如F2、Cl2、Br2、I2、O2、O3;(2)元素处于高价态的化合物:KClO3、KMnO4、K2Cr2O7、HNO3、浓H2SO4;(3)高价态的金属阳离子:Fe3+、Ag+、Cu2+;(4)其它:HClO、漂白粉、MnO2、Na2O2、H2O2、NO2、银氨溶液、新制的Cu(OH)2。
2.常见的还原剂(1)典型的金属单质,如:K、Ca、Na、Mg等(2)某些非金属单质及其化合物,如:H2、C、CO等(3)有变价元素的最低价态化合物,如:H2S、HI、HBr、HCl等(4)非金属阴离子,如:S2-、I-、Br-、Cl-等3. 氧化性和还原性相对强弱比较氧化剂在反应里表现氧化性。
氧化能力强弱是氧化剂得电子能力的强弱,不是得电子数目的多少,如浓硝酸的氧化能力比稀硝酸强,得到电子的数目却比稀硝酸少。
还原剂在反应里表现还原性。
还原能力强弱是还原剂失电子能力的强弱,如钠原子失电子数目比铝原子少,钠原子的还原能力比铝原子强。
【典例1】★★★☆☆已知在酸性条件下有以下反应关系:①KBrO3能将KI氧化成I2或KIO3本身被还原Br2;②Br2能将I-氧化为I2;③KIO3能将I-氧化为I2也能将Br-氧化为Br2,本身被还原为I2向KI的硫酸溶液中滴加少量KBrO3溶液后,所得产物除水外还有()A.Br2、Br-、I2B.Br-、I2、IO3-C.Br-、IO3-D.Br-、I2【典例2】★★★☆☆根据反应式:①Fe + Cu2+=Fe2++Cu ②2Fe3++Cu=2Fe2++Cu2+可判断离子的氧化性从强到弱的顺序是()A.Fe2+、Fe3+、Cu2+B.Fe2+、Cu2+、Fe3+C.Cu2+、Fe2+、Fe3+D.Fe3+、Cu2+、Fe2+【训练1】★★★☆☆根据反应:①Fe+Cu2+=Fe2++Cu ②2Fe3++Cu=Cu2++2Fe2+③2Fe2++Cl2=2Fe3++2Cl﹣④HClO+H++Cl﹣=Cl2↑+H2O可以判断出各微粒的氧化性或还原性由强到弱的顺序正确的是()A.氧化性:HClO>Cl2>Fe3+>Cu2+>Fe2+B.氧化性:Cl2>HClO>Fe3+>Cu2+>Fe2+C.还原性:Fe>Cu2+>Fe2+>Cl->Cl2D.还原性:Fe2+>Cu2+>Fe3+>Cl->Cl2【训练2】★★★☆☆由相同条件下的三个反应:①2NaA +B2 =2NaB +A2;②2NaC +A2 =2NaA +C2;③2NaB +D2 =2NaD +B2;可判断()A.氧化性:A2>B2>C2>D2B.还原性:C->A->B->D-C.2NaD +A2 =2NaA +D2可进行D.2NaC+B2 =2NaB+C2不能进行【训练3】★★★☆☆下列关于物质性质的比较,错误的是()A.原子氧化性:Na>P>S B.氧化性强弱:I>Br>ClC.氧化性强弱:F2>Cl2>Br2D.还原性强弱:Na>Mg>Al知识点二氧化还原反应的价态变化规律、强弱规律及其应用1.价态变化规律(1)表现性质规律氧化还原反应中有化合价升高的元素,必有化合价降低的元素。
人教版高中化学必修一《氧化还原反应》物质及其变化PPT课件

特征
本质
化合价的升价
电子的转移
宏观
微观
一、氧化还原反应
例、指出下列氧化还原反应中哪种元素被氧化、被还原?
(1) 2KClO3 = 2KCl + 3O2↑ (2) Cl2 + 2NaOH = NaCl + NaClO + H2O (3) 5NH4NO3 = 4N2 + 2HNO3 + 9H2O (4) 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 (注意:FeS2中硫元素呈−1价) (5) MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O (6) 2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O
氧化还 原反应
氧化反应
同时
还原反应
失电子或共用电子对偏离
同时
得失电子 总数相等
得电子或共用电子对偏向
一、氧化还原反应
3、从电子转移的角度认识氧化还原反应
化合价降低,得电子,被还原
0 H2
+
+2 CuO
=∆=
+1 H2O
+
0 Cu
化合价升高,失电子,被氧化
一、氧化还原反应
3、从电子转移的角度认识氧化还原反应
得到氧,被氧化
物质 在反 应中
得到氧 被氧化
H2 同 时 CuO 失去氧 被还原
氧化反应
同时
还原反应
一、氧化还原反应
1、从得失氧的角度认识氧化还原反应
H2 + CuO =∆= H2O + Cu 3CO + Fe2O3 =∆= 3CO2 + 2Fe 特点: 元素从化合态转化为游离态 Fe + CuCl2 == FeCl2 + Cu ➢从“得失氧”的角度认识氧化还原反应具有局限性, 是片面的。需要从一个更宽广的视角来认识化学反应。
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
人教版高一化学必修一第二章第三节氧化还原反应和答案

氧化还原反应的基本规律1、守恒规律氧化还原反应中,氧化剂得到电子总数等于氧化剂失去的电子总数,表现为化合价升高总数等于化合价降低总数。
2、强弱规律对于氧化还原反应“氧化剂+还原剂====还原产物+氧化产物”能进行,则满足:氧化性:氧化剂>氧化产物还原性:还原剂>还原产物3、价态规律当元素具有可变化合价时,一般情况下:例如,浓H2SO4中的S只具有氧化性,H2S中的S只具有还原性,单质S既具有氧化性也具有还原性。
4.先后规律在浓度相差不大的溶液中(1)如果一种氧化剂遇到了几种还原剂时,将按照还原性由强到的顾序依次反应。
例如:Zn、Fe同时加入盐酸中,还原性Zn>Fe,则Zn先与盐酸反应。
(2)如果一种还原剂遇到了几种氧化剂时,将按照氧化性由属到弱的顺序依次反应。
例如在含有Fe2+、Cu2+的溶液中加入锌粉,氧化性:Cu2+>Fe2+,则锌粉先与Cu2+反应,然后再与Fe2+反应5.归中规律例如:守恒法在金属与硝酸反应计算中的应用1、某稀硫酸和稀硝酸的混合溶液中c(NO3-)+c(SO42-)=2.5mol/L,取200mL该混合酸,则能溶解铜的最大质量为()A. 12.8gB. 19.2gC. 32.0gD. 38.4g通过离子方程式进行计算2、锌和某浓度的HNO3反应时,若参加反应的锌与HNO3的物质的量之比为2:5,产物有硝酸锌、X和水,则X可能是()A、NH4NO3B、N2OC、N2O3D、NO23、将38.4g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:①NO2的体积为___L.②若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为___mol•L-1.4、在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol/L、0.1 mol/L,向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度是()A.0.15 mol/L B.0.225 mol/L C.0.30 mol/L D.0.45 mol/L5、R2O6n-在一定条件下可以把Mn2+氧化成MnO4-,若反应后R2O6n-转变为RO3n-.又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值为()6、已知2Fe2++Br2═2Fe3++2Br−往100mL溴化亚铁溶液中缓慢通入2.24L(标准状况)氯气,反应完成后溶液中有1/3的溴离子被氧化成溴单质。
人教版高中化学必修一第一章第三节氧化还原反应 含解析

新教材•化学(RJ) 必修•第一册
新教材·化学(RJ) 必修·第一册
解析:应先根据元素化合价的变化标出反应中电子转移的方向和数目, 然后分析各物质被氧化、被还原的情况。
从式中看出,每生成 1 个 O2 转移 4 个电子。
新教材•化学(RJ) 必修•第一册
新教材·化学(RJ) 必修·第一册
(1)用单线桥法表示反应①,用双线桥法表示反应②中的电子转移情况。
新教材•化学(RJ) 必修•第一册
2.表示方法
新教材·化学(RJ) 必修·第一册
(1)双线桥法
标明所有化合价发生 变化 的元素, 标价态 ━化合价没有变化 的元素不用标明
↓
一条线由反应物中化合价降低的元素指向产
物中化合价发生变化的相应元素,另一条由 连双线 ━反应物中化合价 升高 的元素指向产物
中化合价发生变化的相应元素
新教材•化学(RJ) 必修•第一册
研习一 氧化还原反应
新教材•化学(RJ) 必修•第一册
自读教材
新教材·化学(RJ) 必修·第一册
1.从得氧、失氧的角度分析 反应:2CuO+C=高==温==2Cu+CO2↑
(1)CuO 失去氧,发生__还__原 ____反应。 (2)C 得到氧,发生__氧__化____反应。 结论:一种物质被__氧__化____,另一种物质被__还__原____的反应都是氧化还原反应。
结论:反应前后有元素化合价___升_降____的反应都是氧化还原反应。
新教材•化学(RJ) 必修•第一册
新教材·化学(RJ) 必修·第一册
3.从电子转移的角度分析
(1)反应:2Na+Cl2=点==燃==2NaCl
①氯原子 得 电子,发生 还原 反应,被 还原 ②钠原子 失 电子,发生 氧化 反应,被 氧化
人教版高一化学必修一《氧化还原反应基本概念》专题讲义

氧化还原反应基本概念一、新课标知识梳理:1、从元素的化合价的角度分析:2、从电子转移的角度分析:3、电子转移的表示方法:双线桥法4、氧化还原反应与四大基本反应类型的关系二、基础知识释疑:例1.试标出下列物质中各加横线元素的化合价。
CuO CH4FeCl3NO2HNO3H2O2 P2O5SiO2Cu2OKMnO4K2Cr2O4NaH例2.判断哪些反应是氧化还原反应,并指出哪些元素的化合价在反应后有所改变。
①①③④⑤例3.判断哪些反应是氧化还原反应,指出哪些元素的化合价在反应后有所改变,并找出氧化剂、还原剂、氧化产物、还原产物,用双线桥法分析。
①Fe+CuSO 4=FeSO 4+Cu ①S+O 2=SO 2①CaCl 2+Na 2CO 3 =CaCO 3↓+2NaCl例4.在下列各式中,当左边的物质能生成右边的物质时,试指出下列带点的元素是被氧化还是被还原?(1)KC .lO 3→KCl (2)HClO .→O 2 (3)KI .→I 2 (4)N .O 2→HNO 3例5.二氧化硫与硫化氢相遇,发生如下反应:SO 2+2H 2S=2H 2O +3S↓ 在这个反应中二氧化硫和硫化氢,哪个是氧化剂,哪个是还原剂?在反应的产物中,氧化产物与还原产物的物质的量之比是多少?三、新课标达标练习:1.在下列反应中,属氧化还原反应的是( )A .CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑B .ZnO+H 2SO 4(稀)=ZnSO 4+H 2OC .2H 2O 22H 2O+O 2↑ D .CaCO 3 CaO+CO 2↑ 2.化学反应中,如果某元素由化合态变为游离态则该元素( )A .被氧化B .被还原C .可能被氧化,也可能被还原D .没有发生氧化还原反应 3.在下列反应中HCl 中氢元素的化合价发生变化的是( )A .NaOH+HCl=NaCl+H 2OB .Zn+2HCl=ZnCl 2+H 2↑C .MnO 2+4HClMnCl 2+2H 2O+Cl 2↑ D .CuO+2HCl=CuCl 2+H 2O4.以下变化中需加入氧化剂才能发生的是( )5.下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )A .Na +、Ba 2+、Cl -、SO 42-B . Ca 2+、HCO 3-、C1-、K +C .MnO 4-、K +、I -、H +D . H + 、Cl - 、Na + 、CO 32- 6.属于氧化还原反应的离子方程式的是( )A .CaCO 3+2H + = Ca 2++CO 2↑+H 2OB .2Fe 2++Cl 2 = 2Fe 3++2Cl -C .HCO 3-+H+ = CO 2↑+H 2OD .2Na +2H 2O = 2NaOH +H 2↑7.下列化学变化中,需加入氧化剂才能实现的是( )A .C→CO 2B .CO 2→ COC .CuO→CuD .H 2SO 4→BaSO 4催化剂高温△++--→→→+↑→32222232Fe Fe D Cu CuCl C Cl Cl B O H CO HCO A . .. .8.制备氰氨基化钙的化学方程式为CaCO 3+2HCN=CaCN 2+CO↑+H 2↑+CO 2↑,在反应中( ) A .氢元素被氧化,碳元素被还原B .HCN 既是氧化剂又是还原剂C .H 2是氧化产物,CaCN 2为还原产物D .CO 是氧化产物,H 2为还原产物9.下列反应中HCl 只体现还原性的是 ( )A .5Cl 2+I 2+6H 2O=10HCl +2HIO 3B .2Cl 2+2Ca (OH )2=CaCl 2+Ca (ClO )2+2H 2OC .MnO 2+4HCl=MnCl 2+2H 2O +Cl 2↑D .2NaCl +2H 2O2NaOH +Cl 2↑+H 2↑10.下列叙述正确的是( )A .金属阳离子被还原后,一定得到该元素的单质B .失电子难的原子获得电子的能力一定强C .含有最高价元素的化合物不一定具有强的氧化性 D. 阳离子只有氧化性,阴离子只有还原性11.氢化钙可以作为生氢剂(其中CaH 2中氢元素为-1价),反应方程式如下: CaH 2+2H 2O=Ca(OH)2+2H 2↑,其中水的作用是( )A .既不是氧化剂也不是还原剂B .是氧化剂C .是还原剂D .既是氧化剂又是还原剂 12.请把符合要求的化学方程式的编号填入直线上。
人教版高中化学必修一课件-2.3氧化还原反应

思考与交流2
分析下列反应是否是氧化还原反应,并判断那些物质 发生氧化反应,那些发生还原反应。
化合价升高 氧化反应
+2
0
CuSO4 + Fe
0
+2
C u + FeSO4
化合价降低 还原反应 化合价升高 氧化反应
+1
0
HCl + Zn
下列关于化学反应的说法中正确的是 ( B) A 、化合反应一定是氧化还原反应; B、有单质生成的分解反应一定是氧化还原反
应;
C、置换反应有可能是氧化还原反应; D、复分解反应不一定是氧化还原反应。
谢谢
Cl-
化合价升高,氧化反应
点燃
H2 + Cl2 ==== 2HCl 化合价降低,还原反应
再来分析氢气与 氯气的反应吧!
延伸
共用电子对
H+1
:
-1
Cl
化合价升降原因二: 共用电子对的偏移
结论
电子的转移(得失或偏 移)是元素化合价发生 变化的原因,也是氧化
还原反应的本质。
化学反应的树状分类法 化合反应 分解反应
0
+2
H2 + ZnCl2
化合价降低 还原反应
练习
下列反应中,属于氧化还原反应的是( )
①3Cl2+6KOH===5KCl+KClO3+3H2O
②2NO2+2NaOH===NaNO3+NaNO2+H2O
③SnCl4+2H2O==SnO2+4HCl
④NaOH+HCl===H2O+NaCl
A.①② B.②③
第二章 化学物质及其变化
新人教版高一化学必修一第三节氧化还原反应教学课件

新人教版 高一化 学必修 一第三 节氧化 还原反 应
(3)下列反应属于氧化还原反应的是__②__③__⑤__⑥__(填序号)。 ①HNO3+NH3===NH4NO3 ②2KClO3 =M=△n=O==2 2KCl+3O2↑ ③2NaBr+Cl2===2NaCl+Br2 ④CO2+Ca(OH)2===CaCO3↓+H2O ⑤S+2KNO3+3C ==△===K2S+N2↑+3CO2↑
①2NO+O2===2NO2 ②③CNOH24+HCCOaO3 ====△===C=aNCHO33↑+CO2↑+H2O ④2KClO3=M=△n=O==2 2KCl+3O2↑ ⑤Fe+2HCl===FeCl2+H2↑ ⑥Zn+CuSO4===ZnSO4+Cu ⑦HCl+KOH===KCl+H2O ⑧BaCl2+Na2SO4===BaSO4↓+2NaCl (2)上述各反应属于氧化还原反应的是_①__④__⑤__⑥___(填序号)。
(2)注意事项 ①不需要标明“得到”或“失去”,只标明电子转移数目; ②要用箭头标明电子转移的方向; ③箭头由反应物中失电子元素原子指向得电子元素原子。
如 (3)巧记口诀 先确定变价元素,再计算价态变化; 桥上标明电子数,箭头还原到氧化。
特别
提示 单线桥和双线桥两种表示方法的形式不同,实质相同。在分析氧化还原
新人教版 高一化 学必修 一第三 节氧化 还原反 应
新人教版 高一化 学必修 一第三 节氧化 还原反 应
深度思考 (1)氧化还原反应有何特征,其实质是什么? 提示 氧化还原反应的特征:元素的化合价发生变化(宏观表现);氧化还原反应的 实质:电子发生了转移(微观变化)。 (2)如何判断一个化学反应为氧化还原反应? 提示 判断一个反应是否为氧化还原反应的关键是分析反应前后有无元素化合价 变化。
人教版高中化学必修一《氧化还原反应》物质及其变化PPT精品课件

学 科
规律方法指导
核
心
素 养
信息提取
已知四个氧化还原反应化学方程式,要求判断其中氧 化剂、还原剂属于不同物质的选项。
思路建立
元素化合价变化→氧化剂、还原剂。
第四部分
课堂达标验收
课 堂
选择正确答案
研
标价态
习
明确变价元素的化合价升降关系。
连单线
始于氧化剂中的降价元素 一条线
止于还原产物中的相应元素
标得失 标出转移电子的总数。
课 堂
电子转移表示方法
探
双线桥法
究
正确标出反应前后各元素的化合价。
研
标价态
习
明确变价元素的化合价升降关系。
连双线
一条线 一条线
始于氧化剂中的降价元素 止于还原产物中的相应元素 始于还原剂中的升价元素 止于氧化产物中的相应元素
移)的反应
课 堂
基本概念和关系
探
失去电子,化合价升高,被氧化
究 研
发生
生成
化合价升高的物质
氧化反应
氧化产物
习 反 应 物
得 失 电 子 相
等
同 时 发 生
同 时 生 成
生 成 物
发生
生成
化合价降低的物质
还原反应
还原产物
得到电子,化合价降低,被还原
课 堂
电子转移表示方法
探
单线桥法
究
正确标出反应前后各元素的化合价。
课 前
认识氧化还原反应
新
知
3.从电子转移的角度——有电子得失的反应
化学人教版高中必修1高一化学《氧化还原反应》课件-PPT

2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
人教版高中化学必修一《氧化还原反应》物质及其变化PPT精品课件

第一章 物质及其变化
2.氧化还原反应与四种基本反应类型的关系
(1)置换反应一定是氧化还原反应。 (2)复分解反应一定不是氧化还原反应。 (3)有单质参加的化合反应是氧化还原反应。 (4)有单质生成的分解反应是氧化还原反应。
栏目 导引
第一章 物质及其变化
【素养升华】 变化观念:氧化还原反应中的几个“不一定”
栏目 导引
第一章 物质及其变化
3.下列说法正确的是( ) A.氧化还原反应的本质是元素化合价的升降 B.氧化还原反应一定有氧元素参加 C.氧化反应一定先于还原反应发生 D.发生氧化反应的物质也可能同时发生还原反应
栏目 导引
2.单线桥法 (1)基本步骤
第一章 物质及其变化
栏目 导引
(2)注意事项
第一章 物质及其变化
①单线桥表示反应物中变价元素原子得失电子(或电子对偏移)
的情况;
②不需标明“得到”或“失去”,只标明电子转移的数目;
③箭头标明电子转移的方向;
④单线桥箭头从失去电子(或电子对偏离)的元素原子指向得到 电子(或电子对偏向)的元素原子。 (3)巧记口诀 先确定变价元素,再计算价态变化;
2.对于反应 MnO2+4HCl(浓)=====MnCl2+Cl2↑+2H2O。 (1)MnO2 在 反 应 中 __________ 电 子 , 所 含 元 素 化 合 价 __________,发生__________反应。 (2)HCl 在反应中__________电子,所含元素化合价__________, 发生__________反应。 (3)用单线桥法标出该反应中电子转移的方向和数目: ______________________________________________________ __________________。
1.3氧化还原反应 课件(共19张PPT)高一上学期化学人教版(2019)必修第一册

一、氧化还原反应
反应前后有元素的化合价发生变化,是氧化还原反应的重要特征
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
有元素化合价升降的反应都是氧化还原反应,不一定存在得失氧。
0
0
+1
-1
- e-
+ e-
Na
Na+
Cl
Cl-
失去2xe-,化合价升高,被氧化
得到2xe- ,化合价降低,被还原
3. 氧化还原反应的本质
一、氧化还原反应
氧化还原反应的本质:电子的得失
0
0
+1
-1
电子对偏离化合价升高,被氧化
电子对偏向化合价降低,被还原
+1
1
+17
2
8
7
你的电子借我用用
Cl
H
你的电子借我用用
电子对偏向Cl
3.氧化还原反应的本质
一、氧化还原反应
氧化还原反应的本质:共用电子对的偏移
练一练
1. 标出下列反应中元素的化合价,判断是否是氧化还原反应
2Al + 3Cu2+ = 2Al3+ + 3Cu
Ba2+ + SO42- =BaSO4 ↓
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
氧还原反应型离子反应
练一练
2. 下列反应中,属于非氧化还原反应的是 ( )A.Cl2+2KOH=KCl+KClO+H2O B.3NO2+H2O=2HNO3+NOC.Na2O2+SO2=Na2SO4D.2NaHCO3 Na2CO3+CO2↑+H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化还原反应【新课标知识梳理】氧化还原反应几乎每年高考都无法回避。
氧化还原反应贯穿整个中学化学教材,既是重点又是难点。
考查多以选择题和配平题的方式出现,在综合题中涉及到化学部分内容时,又往往以书写化学方程式的形式出现。
在某些计算题中涉及到氧化还原反应时,又以先写化学方程式后根据方程式进行反应物和生成物的相关的量的计算。
理解氧化还原反应的特征、规律,掌握电子守恒原理的巧妙运用,同时明确基本概念,牢记常见氧化剂、还原剂性质的强弱顺序,就能顺利地解出题目。
相关知识点:一、概念:是氧化还原反应二、特征(判断方法):三、本质:表示方法:1.双线桥法:表明了物质中的元素的原子在反应前后的电子得失情况-2↑+2H2O失2e-2.单线桥法:表明了物质在反应过程中电子的转移情况2e-2∆====MnCl2+Cl2↑+2H2O四、有关概念得电子,化合价降低,被还原,发生还原反应氧化剂+(氧化性)失电子,化合价升高,被氧化,发生氧化反应五、基本规律及应用1.守恒律:化合价有升必有降,电子有得必有失。
对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,失电子总数与得电子总数相等。
应用:有关氧化还原反应的计算及配平氧化还原方程式。
2.价态律:元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要呈现一种性质。
物质若含有多种元素,其性质是这些元素性质的综合体现。
应用:判断元素或物质氧化性或还原性的有无。
3.强弱律:较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。
应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质。
亦可用于比较物质间氧化性或还原性的强弱。
4.转化律:氧化还原反应中,以元素相邻价态间的转化最容易;同种元素不同价态之间若发生反应,元素的化合价只靠近而不交叉;同种元素,相邻价态间不发生氧化还原反应。
应用:分析判断氧化还原反应能否发生。
5.难易律:越易失电子的物质,失后就越难得电子,越易得电子的物质,得后就越难失去电子;一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应。
同理,一种还原剂遇多种氧化剂时,氧化性最强的优先发生反应。
应用:判断物质的稳定性及反应顺序(注意:难失电子的物质不一定易得电子)。
六、物质氧化性和还原性相对强弱的判断方法1. 根据金属活动顺序判断K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au单质的还原性逐渐减弱对应的阳离子氧化性逐渐增强2.根据非金属活动性顺序进行判断F2Cl2O2Br2I2S P C Si H2氧化性逐渐减弱F-Cl-O2-Br-I-S2-还原性逐渐增强3.根据反应方程式进行判断氧化剂+还原剂==还原产物+氧化产物还原性:还原剂>还原产物氧化性:氧化剂>氧化产物4.据被氧化或被还原的程度的不同进行判断。
Fe+2HCl==FeCl2+H2↑2Fe+3Cl2== 2FeCl3Cl2将Fe氧化至+3价,而HCl只能将Fe氧化为+2价,故氧化性:Cl2> HCl5.据氧化还原反应进行的难易程度(反应条件)的不同进行判断6.依据元素周期律进行判断【新课标经典例题】氧化还原反应概念部分:1.下列反应不属于四种基本反应类型,但属于氧化还原反应的是()A.Fe+CuSO4=FeSO4+CuB.Fe2O3+3CO2Fe+3CO2C.AgNO3+NaCl=AgCl↓+NaNO3D.2KMnO4K2MnO4 +MnO2 +O2↑2.下列属于氧化还原反应的是()A.CaCO3CaO+CO2↑B.Na2O+H2O=2NaOHC.Na2CO3+H2SO4=.Na2SO4+CO2↑+H2OD.MnO2+4HCl MnCl2+Cl2↑+2H2O3.下列变化需要加入氧化剂才能实现的是()A. NaOH→NaClB. H2SO4→H2C. HCl→Cl2D. CaCO3→CO24.在下列反应中,水既不作氧化剂,又不作还原剂的是()A.2Na+2H2O=2NaOH+H2↑B. Na2O=2NaOHC. H2O H2↑+O2↑D.C+H2O CO+H25.下列变化过程一定属于还原反应的是()A. HCl→MgCl2B. Na→Na+C.CO→CO2D.Fe3+→Fe2+6.下列反应氯元素只被氧化的是()A.5Cl2+I2+6H2O=10HCl+2HIO3B.MnO2+4HCl MnCl2+Cl2↑+H2OC.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2 +2H2OD.2HClO2HCl+O2↑7.分析下列氧化还原反应中化合价的变化,指出氧化剂和还原剂(1)2Fe+3Cl22FeCl3氧化剂_________ 还原剂___________(2) CuO+CO Cu+CO2 氧化剂_________ 还原剂___________(3)2Al+3H2SO4=Al2(SO4)3+3H2↑ 氧化剂_________ 还原剂___________(4) 2KClO32KCl+3O2↑ 氧化剂_________ 还原剂___________氧化还原反应规律运用部分:1.已知N元素的最低化合价是–3价,最高化合价是+5价,那么下列物质中的N元素只具有氧化性的是()A、NH3B、N2C、NO2D、HNO32.已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O Y+H2↑;Z+H2O W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为A、X>Y、 Z>WB、X<Y、 Z<WC、X>Y、 Z<<WD、X<Y、 Z>W3.对于反应:2H2S+SO2===3S ↓+2H2O,被氧化的硫原子与被还原的硫原子的质量之比为()A、1:1B、2:1C、3:1D、1:24.根据反应式:① 2Fe3+ + 2I- = 2Fe2+ + I2 ② Br2 + 2Fe2+ = 2Fe3+ + 2Br-可判断离子的还原性从强到弱的顺序是()A、Br-、Fe2+ 、Cl-B、I- 、Fe2+ 、Br-C、Br- 、I- 、Fe2+D、Fe2+ 、I- 、Br-5.在离子反应x R2++y H++O2==m R3++n H2O中,对m和R3+的判断正确的是()A、m=2,R3+是氧化产物B、m=2,R3+是还原产物C、m=4,R3+是氧化产物D、m=4,R3+是还原产物6.已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2↑ ;②Cu+2H2SO4(浓) CuSO4+SO2↑ +2H2O。
试回答下列问题:⑴反应①中元素被还原,反应②中元素被还原。
(填元素符号)⑵当反应①生成2g H2时,消耗H2SO4的质量是 g 。
⑶反应②中生成32g SO2气体时,消耗H2SO4的质量是 g ,其中有 g H2SO4作为氧化剂被还原。
基础达标一、选择题1.氧化还原反应发生在同种元素之间的是( )A.Zn+2HCl====ZnCl 2+H 2↑B.2H 2S+SO 2====3S↓+2H 2OC.H 2+CuO====Cu+H 2OD.2H 2O 电解2H 2↑+O 2↑ 2.不属于四种基本反应类型的氧化还原反应是( )A.2KMnO 4 ∆K 2MnO 4+MnO 2+O 2↑B.2Na+Cl 2点燃2NaClC.Zn+CuSO 4 ZnSO 4+CuD.Fe 2O 3+3CO 高温2Fe+3CO 23.下列反应属于非氧化还原反应的是( )A.Fe 2O 3+高温2Fe+3CO 2B.NH 4NO 3 ∆N 2O↑+2H 2OC.2NaHCO3 ∆Na 2CO 3+CO 2↑+H 2OD.Cu 2(OH)2CO 3 ∆2CuO+CO 2↑+H 2O 4.下列变化需要加入还原剂才能实现的是( )A.MnO -4−→−Mn 2+B.HCl −→−Cl 2C.Fe −→−Fe 3+D.KClO 3−→−O 2 5.以下说法正确的是( ) A.物质所含元素化合价升高的反应叫还原反应B.在氧化还原反应中,失去电子的元素化合价降低C.物质中某元素失去电子,则此物质是氧化剂D.还原剂中必定有一种元素被氧化6.已知CO 2O 3在酸性溶液中易被还原成CO 2+,CO 2O 3、Cl 2、FeCl 3、I 2的氧化性依次减弱。
下列反应在水溶液中不可能发生的是( )A.3Cl 2+6FeI 2====2FeCl 3+4FeI 3B.Cl 2+FeI 2====FeCl 2+I 2C.CO 2O 3+6HCl====2COCl 3+3H 2OD.2Fe 3++2I -====2Fe 2++I 27.根据下列反应判断有关的物质还原性由强到弱的顺序是( )H 2SO 3+I 2+H 2O====2HI+H 2SO 42FeCl 3+2HI====2FeCl 2+2HCl+I 23FeCl 2+4HNO 3====2FeCl 3+NO↑+2H 2O+Fe(NO 3)3A.H 2SO 3>I ->Fe 2+>NOB.I ->Fe 2+>H 2SO 3>NOC.Fe 2+>I ->H 2SO 3>NOD.NO >Fe 2+>H 2SO 3>I -二、填空题8.过氧化氢H 2O 2(氧的化合价为-1),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。
对于下列A~D 涉及H 2O 2的反应,填写空白:A.Na 2O 2+2HCl====2NaCl+H 2O 2B.Ag 2O+H 2O====2Ag+O 2+H 2OC.2H 2O 2====2H 2O+O 2D.3H 2O 2+Cr 2(SO 4)3+10KOH====2K 2CrO 4+3K 2SO 4+8H 2O(1)H 2O 2仅体现氧化性的反应是(填代号)_______。
(2)H 2O 2既体现氧化性又体现还原性的反应是(填代号)_______。
(3)上述反应说明H 2O 2、Ag 2O 、K 2CrO 4氧化性由强到弱的顺序是:_______。
拓展题1.(2010广东大综合,21) 从海水中可以提取溴,主要反应为:2Br -+Cl 2====2Cl -+Br 2,下列说法正确的是( )A.溴离子具有氧化性B.氯气是还原剂C.该反应属于复分解反应D.氯气的氧化性比溴单质强2.(2010全国理综Ⅲ,11) 已知KH和H2O反应生成H2和KOH,反应中1 mol KH()A.失去1 mol电子B.得到1 mol电子C.失去2 mol电子D.没有电子得失3.(经典回放)ClO2是一种广谱型的消毒剂,根据世界环保联盟要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。
