g元素名称、符号、原子序数检测
原子序数元素符号中文名称拉丁文名英文名

原子序数元素符号中文名称拉丁文名英文名1 H 氢 Hydrog enium Hydrog en2 He 氦 Helium Helium3 Li 锂 Lithum Lithum4 Be 铍 Beryll ium Beryll ium5 B 硼 Borium Boron6 C 碳 Carbon ium Carbon7 N 氮 Nitrog enium Nitrog en8 O 氧 Oxygen ium Oxygen9 F 氟 Fluoru m Fluori ne10 Ne 氖 Neonum Neon11 Na 钠 Natriu m Sodium12 Mg 镁 Magnes ium Magnes ium13 Al 铝 Alumin ium Alumin ium14 Si 硅 Silici um Silico n15 P 磷 Phosph yorum Phosph orus16 S 硫 Sulphu Sulfur17 Cl 氯 Chloru m Chlori ne18 Ar 氩 Argonu m Argon19 K 钾 Kalium Potass ium20 Ca 钙 Calciu m Calciu m21 Sc 钪 Scandi um Scandi um22 Ti 钛 Titani um Titani um23 V 钒 Vanadi um Vanadi um24 Cr 铬 Chromi um Chromi um25 Mn 锰 Mangan um Mangan ese26 Fe 铁 Ferrum Iron27 Co 钴 Cobalt um Cobalt28 Ni 镍 Niccol um Nickel30 Zn 锌 Zincum Zinc31 Ga 镓 Galliu m Galliu m32 Ge 锗 German ium German ium33 As 砷 Arseni um Arseni c34 Se 硒 Seleni um Seleni um35 Br 溴 Bromiu m Bromin e36 Kr 氪 Krypto mum Krypto n37 Rb 铷 Rubidi um Rubidi um38 Sr 锶 Stront ium Stront ium39 Y 钇 Yttriu m Yttriu m40 Zr 锆 Zircon ium Zircon ium41 Nb 铌 Niobiu m Niobiu m42 Mo 钼 Molybd anium Molybd enum43 Tc 锝 Techne tium Techne tium44 Ru 钌 Ruthen ium Ruthen ium45 Rh 铑 Rhodiu m Rhodiu m46 Pd 钯 Pallad ium Pallad ium47 Ag 银 Argent um Silver48 Cd 镉 Cadmiu m Cadmiu m49 In 铟 Inlium Indium50 Sn 锡 Stannu m Tin51 Sb 锑 Stibiu m Antimo ny52 Te 碲 Tellur um Tellur ium53 I 碘 Iodium Iodine54 Xe 氙 Xenonu m Xenon55 Cs 铯 Caesiu m Caesiu m56 Ba 钡 Baryum Barium57 La 镧 Lantha num Lantha num59 Pr 镨 Praseo dymiu m Praseo dymiu m60 Nd 钕 Neodym ium Neodym ium61 Pm 钷 Promet hium Promet hium62 Sm 钐 Samari um Samari um63 En 铕 Europi nu Europi um64 Gd 钆 Gadoli nium Gadoli nium65 Tb 铽 Terbiu m Terbiu m66 Dy 镝 Dyspro sium Dyspro sium67 Ho 钬 Holmiu m Holmiu m68 Er 铒 Erbium Erbium69 Tm 铥 Thuliu m Thuliu m70 Yb 镱 Ytterb ium Ytterb ium71 Lu 镥 Lrteti um Luteci um72 Hf 铪 Hafniu m Hafniu m73 Ta 钽 Tanata lum Tantal um74 W 钨 Wolfra m Tungst en75 Re 铼 Rheniu m Rheniu m76 Os 锇 Osmium Osmium77 Ir 铱 Iridiu m Iridiu m78 Pt 铂 Platin um Platin um79 Au 金 Aurum Gold80 Hg 汞 Hydrar gyrum Mercur y81 Tl 铊 Thalli um Thalli um82 Pb 铅 Plumbu m Lead83 Bi 铋 Bismut hum Bismut h84 Po 钋 Poloni um Poloni um85 At 砹 Astati um Astati ne86 Rn 氡 Radon Radon87 Fr 钫 Franiu m Franci um88 Ra 镭 Radium Radium89 Ac 锕 Actini um Actini um90 Th 钍 Thoriu m Thoriu m91 Pa 镤 Protac tiniu m Protac tiniu m92 U 铀 Uraniu m Uraniu m93 Np 镎 Neptun ium Neptun ium94 Pu 钚 Pluton ium Pluton ium95 Am 镅 Americ ium Americ ium96 Cm 锔 Curkel ium Curium97 Bk 锫 Berkel ium Berkel ium98 Cf 锎 Califo rnium Califo rnium99 Es 锿 Einste inium Einste inium 100 Fm 镄 Fermim Fermiu m一些常见元素中英文名称对照表基本概念、基本理论元素化合物有机化学其它。
原子符号原子团
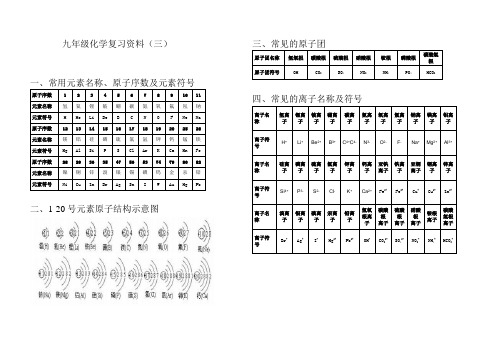
锂离子
铍离子
硼离子
碳离子
氮离子
氧离子
氟离子
钠离子
镁离子
铝离子
离子符号
H+
Li+
Be2+
B3+
C4+C4-
N3-
O2-
F-
Na+
Mg2+
Al3+
离子名称
硅离子
磷离子
硫离子
氯离子
钾离子
钙离子
亚铁离子
铁离子
亚铜离子
铜离子
锌离子
离子符号
Si4+
P3-
S2-
Cl-
K+
Ca2+
Fe2+
Fe3+
Cu+
Cu2+
28
29
30
35
47
50
74
79
80
82
元素名称
镍
铜
锌
溴
银
锡
碘
钨
金
汞
铅
元素符号
Ni
Cu
Zn
Br
Ag
Sn
I
W
Au
Hg
Pb
二、1-20号元素原子结构示意图
三、常见的原子团
原子团名称
氢氧根
碳酸根
硫酸根
硝酸根
铵根
磷酸根
碳酸氢根
原子团符号
OH
CO3
SO4
NO3
NH4
PO4
HCO3
四、常见的离子名称及符号
离子名称
Zn2+
离子名称
部编人教版九年级化学上册第3单元 物质构成的奥秘 3.3.2 元素符号 元素周期表【习题课件】

(3)R2+结构示意图为
,R元素位于元素周期表中第
____四____周期,它的化学性质与第三周期中的___镁____
元素相似。
探究培优·拓展练
18.【中考•南京】核电荷数为1~18的元素的原子结构示 意图等信息如下,回答下列问题:
探究培优·拓展练
(1)图中不同元素的本质区别是__核__内__质__子__数__不__同__,原子 序数为9的元素位于第___二_____周期。
(4)写出核外电子排布与氖原子相同的阳离子和阴离子符 号各一个:阳离子__N__a_+_(_或__M__g_2+__或__A_l_3+__) ___,阴离子 _O__2-__(或__F_-__或__N_3_-_)_。
探究培优·拓展练
【点拨】本题运用归纳比较法解答。分析元素周期表, 比较和挖掘同一周期、同一族元素之间存在的内在规律。 如同一周期的元素,原子的电子层数相同,从左到右最 外层电子数依次递增;同一族的元素,原子的最外层电 子数一般相同,从上到下,电子层数依次递增。
夯实基础·逐点练
【点拨】元素周期表是按照原子序数由小到大,根据原 子结构和元素性质周期性变化的规律排列而成的。由图 可知:Y、Z在同一周期,X、Z在同一族,原子序数X< Y<Z,故A、B、D均错误。 【答案】C
夯实基础·逐点练
9.(1)下面是一次练习中,王老师收集的一些错误符号, 请你将其改正过来: 钙 CA 镁 mg 汞 Ag 铝 Cl 氖 Ni _钙__C_a___镁__M__g___汞__H__g___铝__A_l___氖__N_e______________。
夯实基础·逐点练
7.【2018•内江改编】如图为元素周期表的一部分,根 据三种元素的相关信息,下列说法不正确的是( D )
高一化学必修 第一册(2019版)_《原子结构与元素周期表》素养评价(第2课时)

第一节原子结构与元素周期表元素周期表核素(30分钟50分)一、选择题(本题包括5小题,每小题4分,共20分)1.下表符号中“2”的含义正确的一组是( )H 2He 2Cl Ca2+A 质量数中子数质子数电荷数B 质量数质子数原子个数电荷数C 质子数中子数原子个数电子数D 质量数质子数中子数电荷数2.(2019·邢台高一检测)在宾馆、办公楼等公共场所,常使用一种电离式烟雾报警器,其主体是一个放有镅-241Am)放射源的电离室Am原子核内中子数与核外电子数之差是( )A.241B.146C.95D.51【补偿训练】医学研究证明,放射性I可以用来治疗肿瘤。
下列有关I叙述正确的是( )A I是碘的一种同素异形体B I是一种新发现的元素C I位于元素周期表中第四周期第ⅦA族D I核内的中子数与核外电子数之差为293.(2019·西安高一检测)有5种单核粒子,它们分别是(“”内元素符号未写出),则它们所属元素的种类有( )A.2种B.3种C.4种D.5种4.(2019·沈阳高一检测)2018年中国化学会制作了新版周期表,包含118种元素。
下列有关元素周期表说法正确的是( )A.元素周期表中含元素最多的族是第ⅢB族B.元素周期表有18个族C.第ⅠA族的元素全部是金属元素D.短周期是指第一、二、三、四周期5.(2019·济南高一检测)ⅤA族元素中的A、B两种元素所在周期分别最多可排18和8种元素,且B在A的上一周期,当A的原子序数为x时,B的原子序数为( )A.x-18B.x-8C.x+8D.x+18二、非选择题(本题包括1小题,共10分)6.(2019·临沂高一检测)A、B、C、D为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B元素原子的质子数。
(1)写出A元素的名称:________。
(2)B位于周期表中第________周期第________族。
人教版高中化学必修二课件第一章第一节第1课时元素周期表

提示:短周期元素中族序数与周期数相同的有三种元素:
氢、铍、铝。若族序数(或周期数)为1,则为氢;若族序数(或 周期数)为2,则为铍;若族序数(或周期数)为3,则为铝。
2.主族序数=最高正价数,这一关系有例外吗?请举例。
提示:这个关系对除O、F两种元素以外的任何主族元素都
是成立的,因为O、F无最高正价。
二、元素在元素周期表中位置的确定方法 1.以0族为基准给元素定位 稀有气体元素 周期数 He 一 Ne 二 Ar 三 Kr 四 Xe 五 Rn 六
原子序数
2
10
18
36
54
86
(1)确定纵行数(族序数)。 元素的纵行数=原子序数-相近且小的稀有气体原子序
数,所得纵行数与族序数的对应关系如下表。
纵行数 1 2 13 14 15 16 17 18
族序数
纵行数
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
3 4 5 6 7 8、9、10 Ⅷ族
0族
11 12
族序数 ⅢB ⅣB ⅤB ⅥB ⅦB
ⅠB ⅡB
(2)确定周期数。 元素的周期数=原子序数相近且小的稀有气体的周期数
+1。
例如:判断原子序数为41的元素在元素周期表中的位置。 分析:41与36接近,有41-36=5,该元素处于第五周期ⅤB 族。使用此法若为第六、七周期ⅢB族(含镧系、锕系元素)后 的元素需再减14定位。 2.根据每周期元素的种类给元素定位 周期序数 一 二 三 四 五 六 七
6.X、Y、Z是短周期三种元素,它们在周 期表中的位置如右图所示,试回答:
(1)X元素单质的化学式是________。
(2)Z元素的原子结构示意图为________。
(3)Y在元素周期表中的位置是
人教版九年级化学上册第三单元3.3.2 元素符号和元素周期表

讨论与交流
【思考】下图为元素周期表中的一小格, 你能从中发现什么信息
原子序数 相对原子质量
20 Ca
钙
40.08
元素符号 元素名称
合作解疑三
元素周期表的规律
【合作探究】请同学们结合所学内容,完成下列问题, 填写在导学案上,并展示交流。
问题1:以排列形式试着画出前18号原子的原子 结构示意图; 问题2:试着分析每一周期和主族有什么规律?
第三单元 物质构成的奥秘
课题 3 元素
第2课时
元素符号 元素周期表
下图中,来自美国的汤姆对于实验室中三瓶贴了中 文标签的药品表示看不懂中文,很无奈,同学们有什么 办法让各国的人们都能看懂药品标签上的名称么?
合作解疑一
元素符号
【合作探究】请同学们阅读课本P61页内容,完成下列 问题,填写在导学案上,并展示交流。
问题1:谁编排了元素周期表,编排依据是什么? 问题2:什么是周期,共有几个周期? 问题3:什么是族,共有几个族?
小组展示四
元素周期表与门捷列夫
1869年2月,俄国化学家门捷列夫编制了他的第一 张元素周期表。
门捷列夫
门捷列夫第一张元素周期表 门捷列夫第二张元素周期表
小组展示四
元素周期表的结构
原子序数:元素周期表按元素原子核电荷数递增的顺 序给元素周期表编了号。 周期:每一横行叫一周期,共7个周期。 族:每一纵行叫一族(其中8、9、10三个纵行共同组 成一个族)
(14)______群之马。
[答案] (1)Fe (2)C (3)H (4)Au (5)Zn 1)Ca (12)I (13)Cl (14)He
5、碘元素在元素周期表中的信息如图。下列说法正确的 是( D ) A.1个碘原子中含有53个中子 B.碘元素属于金属元素 C.1个I2分子中含有53个电子 D.碘的相对原子质量为126.9
锎

化学元素
01 发现简史
03 物理性质
目录
02 矿藏分布 04 化学性质
05 制备方法
07 危害
目录
06 应用领域
锎是一种放射性金属元素,化学符号为Cf,原子序数为98。锎属于锕系元素,是第六个被人工合成出来的 超铀元素,自然界能自行产生的元素中质量最高的,所有比锎更重的元素皆必须通过人工合成才能产生。
一旦进入体内,锎会造成很大的损害。另外,锎-249和锎-251能释放伽马射线,对外表组织造成伤害。锎 所释放的电离辐射在骨骼和肝脏中可致癌 。
参考资料 1 锎|Californium|7440-71-3|参数,分子结构式,图谱信息 .物竞化学品数据库[引用日期202009-21] 2 新型. 佛罗里达州立大学:稀土元素锎的新发现[J]. 化工新型材料, 2015(5):266-266. 3 辞海编辑委员 会.辞海 理科分册 上:上海辞书出版社,1978.09:第305页 4 刘慧颖, 曹丽君, 常淑艳. 锎-252后装治疗晚期宫 颈癌疗效分析[J]. 中华医药杂志, 2006. 5 锎 .中国铁合金在线知识库[引用日期2016-05-28] 6 董丽. 锎能用于 安全储存放射性废料[J]. 现代材料动态, 2014(12):3-3. 7 米文权. 锎(CF)—世界上最昂贵的金属[J]. 金属世界, 2003(1):7-7. 8 郑秀惠, 陈竹钦, 李力,等. 252锎中子放疗对宫颈癌细胞凋亡的影响[J]. 第三军医大学学报, 2003, 25(18):1667-1669. 9 科技日报/12.1 10 C.E.布列斯列尔, 邱陵. 放射性元素[M]. 科学出版社......
危害
锎累积在骨骼组织里的锎会释放辐射,破坏身体制造红血球的能力。由于放射性极强,在环境中的存量极低, 所以锎在生物体中没有任何自然的用途。
化学元素表

化学元素符号表第01 号元素: 氢[化学符号]H, 读“轻”第02 号元素: 氦[化学符号]He, 读“亥”第03 号元素: 锂[化学符号]Li, 读“里”第04 号元素: 铍[化学符号]Be, 读“皮”第05 号元素: 硼[化学符号]B, 读“朋”第06 号元素: 碳[化学符号]C, 读“炭”第07 号元素: 氮[化学符号]N, 读“淡”第08 号元素: 氧[化学符号]O, 读“养”第09 号元素: 氟[化学符号]F, 读“弗”第10 号元素: 氖[化学符号]Ne, 读“乃”第11 号元素: 钠[化学符号]Na, 读“纳”第12 号元素: 镁[化学符号]Mg, 读“美”第13 号元素: 铝[化学符号]Al, 读“吕”第14 号元素: 硅[化学符号]Si, 读“归”第15 号元素: 磷[化学符号]P, 读“邻”第16 号元素: 硫[化学符号]S, 读“流”第17 号元素: 氯[化学符号]Cl, 读“绿”第18 号元素: 氩[化学符号]Ar,A, 读“亚”第19 号元素: 钾[化学符号]K, 读“甲”第20 号元素: 钙[化学符号]Ca, 读“丐”第21 号元素: 钪[化学符号]Sc, 读“亢”第22 号元素: 钛[化学符号]Ti, 读“太”第23 号元素: 钒[化学符号]V, 读“凡”第24 号元素: 铬[化学符号]Cr, 读“各”第25 号元素: 锰[化学符号]Mn, 读“猛”第26 号元素: 铁[化学符号]Fe, 读“铁”第27 号元素: 钴[化学符号]Co, 读“古”第28 号元素: 镍[化学符号]Ni, 读“臬”第29 号元素: 铜[化学符号]Cu, 读“同”第30 号元素: 锌[化学符号]Zn, 读“辛”第31 号元素: 镓[化学符号]Ga, 读“家”第32 号元素: 锗[化学符号]Ge, 读“者”第33 号元素: 砷[化学符号]As, 读“申”第34 号元素: 硒[化学符号]Se, 读“西”第35 号元素: 溴[化学符号]Br, 读“秀”第36 号元素: 氪[化学符号]Kr, 读“克”第37 号元素: 铷[化学符号]Rb, 读“如”第38 号元素: 锶[化学符号]Sr, 读“思”第39 号元素: 钇[化学符号]Y, 读“乙”第40 号元素: 锆[化学符号]Zr, 读“告”第41 号元素: 铌[化学符号]Nb, 读“尼”第42 号元素: 钼[化学符号]Mo, 读“目”第43 号元素: 碍[化学符号]Tc, 读“得”第44 号元素: 钌[化学符号]Ru, 读“了”第45 号元素: 铑[化学符号]Rh, 读“老”第46 号元素: 钯[化学符号]Pd, 读“巴”第47 号元素: 银[化学符号]Ag, 读“银”第48 号元素: 镉[化学符号]Cd, 读“隔”第49 号元素: 铟[化学符号]In, 读“因”第50 号元素: 锡[化学符号]Sn, 读“西”第51 号元素: 锑[化学符号]Sb, 读“梯”第52 号元素: 碲[化学符号]Te, 读“帝”第53 号元素: 碘[化学符号]I, 读“典”第54 号元素: 氙[化学符号]Xe, 读“仙”第55 号元素: 铯[化学符号]Cs, 读“色”第56 号元素: 钡[化学符号]Ba, 读“贝”第57 号元素: 镧[化学符号]La, 读“兰”第58 号元素: 铈[化学符号]Ce, 读“市”第59 号元素: 镨[化学符号]Pr, 读“普”第60 号元素: 钕[化学符号]Nd, 读“女”第61 号元素: 钷[化学符号]Pm, 读“颇”第62 号元素: 钐[化学符号]Sm, 读“衫”第63 号元素: 铕[化学符号]Eu, 读“有”第64 号元素: 钆[化学符号]Gd, 读“轧”第65 号元素: 铽[化学符号]Tb, 读“忒”第66 号元素: 镝[化学符号]Dy, 读“滴”第67 号元素: 钬[化学符号]Ho, 读“火”第68 号元素: 铒[化学符号]Er, 读“耳”第69 号元素: 铥[化学符号]Tm, 读“丢”第70 号元素: 镱[化学符号]Yb, 读“意”第71 号元素: 镥[化学符号]Lu, 读“鲁”第72 号元素: 铪[化学符号]Hf, 读“哈”第73 号元素: 钽[化学符号]Ta, 读“坦”第74 号元素: 钨[化学符号]W, 读“乌”第75 号元素: 铼[化学符号]Re, 读“来”第76 号元素: 锇[化学符号]Os, 读“鹅”第77 号元素: 铱[化学符号]Ir, 读“衣”第78 号元素: 铂[化学符号]Pt, 读“伯“第79 号元素: 金[化学符号]Au, 读“今”第80 号元素: 汞[化学符号]Hg, 读“拱”第81 号元素: 铊[化学符号]Tl, 读“他”第82 号元素: 铅[化学符号]Pb, 读“千”第83 号元素: 铋[化学符号]Bi, 读“必”第84 号元素: 钋[化学符号]Po, 读“泼”第85 号元素: 砹[化学符号]At, 读“艾”第86 号元素: 氡[化学符号]Rn, 读“冬”第87 号元素: 钫[化学符号]Fr, 读“方”第88 号元素: 镭[化学符号]Ra, 读“雷”第89 号元素: 锕[化学符号]Ac, 读“阿”第90 号元素: 钍[化学符号]Th, 读“土”第91 号元素: 镤[化学符号]Pa, 读“仆”第92 号元素: 铀[化学符号]U, 读“由”第93 号元素: 镎[化学符号]Np, 读“拿”第94 号元素: 钚[化学符号]Pu, 读“不”第95 号元素: 镅[化学符号]Am, 读“眉”第96 号元素: 锔[化学符号]Cm, 读“局”第97 号元素: 锫[化学符号]Bk, 读“陪”第98 号元素: 锎[化学符号]Cf, 读“开”第99 号元素: 锿[化学符号]Es, 读“哀”第100 号元素: 镄[化学符号]Fm, 读“费”第101 号元素: 钔[化学符号]Md, 读“门”第102 号元素: 锘[化学符号]No, 读“诺”第103 号元素: 铹[化学符号]Lw, 读“劳”第104 号元素: 鐪[化学符号]Rf, 读“卢”第105 号元素: 钅杜[化学符号]Db, 读“杜”第106 号元素: 钅喜[化学符号]Sg , 读”喜“第107 号元素: 钅波[化学符号]Bh, 读"波“第108 号元素: 钅黑[化学符号]Hs, 读”黑“第109 号元素: 钅麦[化学符号]Mt, 读"麦" 第110 号元素: 鐽[化学符号]Ds, 读”达“第111 号元素: 钅仑[化学符号]Rg, , 读”伦“第112 号元素: uub(112)第113 号元素: uut(113)第114 号元素: uuq(114)第115 号元素: uup(115)第116 号元素: uuh(116)1 H 氢(qīng) 水素(すいそ,hydrogenium)2 He 氦(hài) ヘリウム(helium)3 Li 锂(lǐ) リチウム(lithium)4 Be 铍(pí) ベリリウム(beryllium)5 B 硼(péng) 硼素(ほうそ,borum)6 C 碳(tàn) 炭素(たんそう,carbonium)7 N 氮(dàn) 窒素(ちっそ,nitrogenium)8 O 氧(yǎng) 酸素(さんそ,oxygenium)9 F 氟(fú) 弗素(ふっそ,fluorum)10 Ne 氖(nǎi) ネオン(neon)11 Na 钠(nà) ナトリウム(sodium)12 Mg 镁(měi) マグネシウム(magnesium)13 Al 铝(lǚ) アルミニウム(aluminium)14 Si 硅(guī) 珪素(けいそ,silicium)15 P 磷(lín) 燐(りん,phosphorum)16 S 硫(liú) 琉黄(いおう,sulphur)17 Cl 氯(lǜ) 塩素(えんそ,chlorum)18 Ar 氩(yà) アルゴン(argon)19 K 钾(jiǎ) カリウム(potassium)20 Ca 钙(gài) カルシウム(calcium)21 Sc 钪(kàng) スカンジウム(scandium)22 Ti 钛(tài) チタン(titanium)23 V 钒(fán) バナジウム(vanadium)24 Cr 铬(gè) クロム(chromium)25 Mn 锰(měng) マンガン(manganese)26 Fe 铁(tiě) 鉄(てつ,ferrum)27 Co 钴(gǔ) コバルト(cobalt)28 Ni 镍(niè) ニッケル(nkckel)29 Cu 铜(tóng) 铜(どう,cuprum)30 Zn 锌(xīn) 亜铅(あえん,zincum)31 Ga 镓(jiā) ガリウム(gallium)32 Ge 锗(zhě) ゲルマニウム(germanium)33 As 砷(shēn) 砒素(ひそ,arsenium)34 Se 硒(xī) セレン(selenium)35 Br 溴(xiù) 臭素(しゅうそ,bromium)36 Kr 氪(kè) ケリプトン(krypton)37 Rb 铷(rú) ルビジウム(rubidium)38 Sr 锶(sī) ストロンチウム(strontium)39 Y 钇(yǐ) イッテルウム(yttrium)40 Zr 锆(gào) ジルコニウム(zirconium)41 Nb 铌(ní) ニオブ(niobium)42 Mo 钼(mù) モリブテン(molybdenum)43 Tc 锝(dé) テクネチウム(technetium)44 Ru 钌(liǎo) ルテニウム(ruthenium)45 Rh 铑(láo) ロジウム(rhodium)46 Pd 钯(bā) パラジウム(palladium)47 Ag 银(yín) 银(ぎん,argentum)48 Cd 镉(gé) カドミウム(cadmium)49 In 铟(yīn) インジウム(indium)50 Sn 锡(xī) 锡(すず,stannum)51 Sb 锑(tī) アンチモン(antimony)52 Te 碲(dì) テルル(tellurium)53 I 碘(diǎn) 沃素(ようそ,iodium)54 Xe 氙(xiān) キセノン(xenon)55 Cs 铯(sè) セシウム(cesium)56 Ba 钡(bèi) バリウム(barium)57 La 镧(lán) ランタン(lanthanum)58 Ce 铈(shì) セリウム(cerium)59 Pr 镨(pǔ) プラセオジム(praseodymium)60 Nd 钕(nǚ) ネオジム(neodymium)61 Pm 钷(pǒ) プロメチウム(promethium)62 Sm 钐(shàn) サマリウム(samerum)63 Eu 铕(yǒu) ユーロビウム(europium)64 Gd 钆(gá) ガドリニウム(gadolinium)65 Tb 铽(tè) テルビウム(terbium)66 Dy 镝(dí) ジスプロシウム(dysprosium)67 Ho 钬(huǒ) ホルミウム(holmium)68 Er 铒(ěr) エルビウム(erbium)69 Tm 铥(diū) ツリウム(thulium)70 Yb 镱(yì) イッテルビウム(ytterbium)71 Lu 镥(lǔ) ルテチウム(lutetium)72 Hf 铪(hā) ハフニウム(hafnium)73 Ta 钽(tǎn) タンタル(tantalum)74 W 钨(wū) タングステン(tungsten)75 Re 铼(lái) レ二ウム(rhenium)76 Os 锇(é) オスミウム(osmium)77 Ir 铱(yī) イリジウム(iridium)78 Pt 铂(bó) 白金(はっきん,platinum)79 Au 金(jīn) 金(きん,aurum)80 Hg 汞(góng) 水银(すいぎん,hydrargyrum)81 Tl 铊(tā) タリウム(thallium)82 Pb 铅(qiān) 铅(なまり,plumbum)83 Bi 铋(bì) ビスマス(bismuth)84 Po 钋(pō) ポロニウム(polonium)85 At 砹(ài) アスタチン(astatine)86 Rn 氡(dōng) ラドン(radon)87 Fr 钫(fāng)フランシウム(francium)88 Ra 镭(léi) ラジウム(radium)89 Ac 锕(ā) アクチニウム(actinium)90 Th 钍(tǔ) トリウム(thorium)91 Pa 镤(pú) プロトアクチニウム(protoactinium)92 U 铀(yóu) ウラン(uranium)93 Np 镎(ná) ネプツニウム(neptunium)94 Pu 钚(bù) プルトニウム(plutonium)95 Am 镅(méi) アメリシウム(americium)96 Cm 锔(jù) キュリウム(curium)97 Bk 锫(péi) バークリウム(berkelium)98 Cf 锎(kāi) カリホルニウム(californium)99 Es 锿(āi) アインスタイニウム(einsteinium) 100 Fm 镄(fèi) フェルミウム(fermium)101 Md 钔(mén) メンテレビウム(mendelevium) 102 No 锘(nuò) ノーベリウム(nobelium)103 Lw 铑(láo) ローレンシウム(lawrencium)104 Rf 钅卢(lú) ラザホージウム(rutherfordium) 105 Db 钅杜(dù) ドブニウム(dubnium)106 Sg 钅喜(xǐ) シーボーギウム(seaborgium) 107 Bh 钅波(bō) ボーリウム(bohrium)108 Hs 钅黑(hēi) ハッシウム(hassium)109 Mt 钅麦(mài) マイトネリウム(meitnerium) 110 Ds Ds ダルムスタチウム。
化学元素名称、符号、化合价、原子质量表
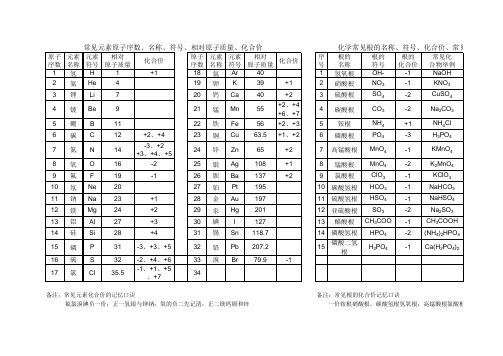
备注:常见元素化合价的记忆口诀备注:常见根的化合价记忆口诀
氟氯溴碘负一价;正一氢银与钾钠;氧的负二先记清;正二镁钙钡和锌正三是铝正四硅;下面再把变价归;全部金属是正价;一二铜来二三铁。
一价铵根硝酸根,碳酸氢根氢氧根;高锰酸根氯酸根,硫酸氢根醋酸跟,还有磷酸二氢根。
附:字体加粗的内容是重点记忆并且必须熟练、准确书写与运用的内容,切记!!!
暂记铵根为正价,负三有个磷酸根
锰正二四与六七;碳的二四要牢记。
非金属负主正不齐;氯的负一正一五七。
氮磷负三与正五;不同磷三氮二四。
硫有负二正四六;边记边用就会熟。
二价硫酸碳酸根,亚硫酸根锰酸根,还有一个磷酸氢根2012年10
酸根,
酸氢根。
2年10月31日 杨作斌整理。
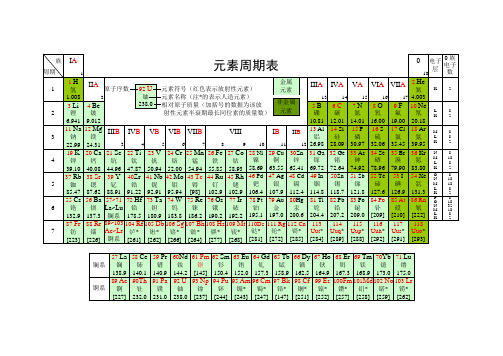
化学元素周期表

化学元素周期表现代化学的元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,就是元素周期表的雏形。
利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。
1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序)排列,经过多年修订后才成为当代的周期表。
在周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。
氢是元素周期表中的第一号元素,元素名来源于希腊文,原意是“水素”。
氢是由英国化学家卡文迪许在1766年发现,称之为可燃空气,并证明它在空气中燃烧生成水。
1787年法国化学家拉瓦锡证明氢是一种单质并命名。
氢在地壳中的丰度很高,按原子组成占15.4%,但重量仅占1%。
在宇宙中,氢是最丰富的元素。
在地球上氢主要以化和态存在于水和有机物中。
有三种同位素:氕、氘、氚。
氢在通常条件下为无色、无味的气体;气体分子由双原子组成;熔点-259.14°C,沸点-252.8°C,临界温度33.19K,临界压力12.98大气压,气体密度0.0899克/升;水溶解度21.4厘米³/千克水(0°C),稍溶于有机溶剂。
在常温下,氢比较不活泼,但可用合适的催化剂使之活化。
在高温下,氢是高度活泼的。
除稀有气体元素外,几乎所有的元素都能与氢生成化合物。
非金属元素的氢化物通常称为某化氢,如卤化氢、硫化氢等;金属元素的氢化物称为金属氢化物,如氢化锂、氢化钙等。
氢是重要的工业原料,又是未来的能源。
氦,原子序数2,原子量4.002602,为稀有气体的一种。
元素名来源于希腊文,原意是“太阳”。
1868年有人利用分光镜观察太阳表面,发现一条新的黄色谱线,并认为是属于太阳上的某个未知元素,故名氦。
镓的化学基本性质

镓的化学基本性质元素名称:镓元素原子量:69.72元素类型:金属发现人:布瓦博德朗发现年代:1875年原子序数:31元素符号:Ga元素中文名称:镓元素英文名称:Gallium相对原子质量:69.72核内质子数:31核外电子数:31核电核数:31质子质量:5.1863E-26质子相对质量:31.217所属周期:4所属族数:IIIA摩尔质量:70氢化物:GaH3氧化物:Ga2O3最高价氧化物化学式:Ga2O3密度:5.907熔点:29.78沸点:2403.0外围电子排布:4s2 4p1核外电子排布:2,8,18,3颜色和状态:蓝白色金属原子半径:1.81常见化合价:+3发现人:布瓦博德朗发现时间和地点:1875 法国元素来源:它凝固时膨胀,通常是作为从铝土矿中提取铝或从锌矿石中提取锌时的副产物得到的元素用途:用于半导体工业,发光二极管和砷化镓激光二极管。
其他化合物:GaCl3-氯化锌扩展介绍:一种稀有蓝白色三价金属元素,在低温时硬而脆,而一超过室温就熔融。
发现过程:1875年,法国的布瓦博德朗在用光谱分析从闪锌矿得到的提取物时,发现了镓。
元素描述:银白色金属。
密度5.904克/厘米3。
溶点29.78℃。
沸点2403℃。
化合价2和3。
第一电离能5.999电子伏特。
凝固点很低。
由于稳定固体的复杂结构,纯液体有显著的过冷的趋势,可以放在冰浴内几天不结晶。
质软、性脆,在空气中表现稳定。
加热可溶于酸和碱;与沸水反应剧烈,但在室温时仅与水略有反应。
高温时能与大多数金属作用。
由液态转化为固态时,膨胀率为3.1%,宜存放于塑料容器中。
元素来源:自然界中常以微量分散于铝于矿、闪锌矿等矿石中。
由铝土矿中提取制得。
元素用途:用来制作光学玻璃、真空管、半导体的原料。
装入石英温度计可测量高温。
加入铝中可制得易热处理的合金。
镓和金的合金应用在装饰和镶牙方面。
也用来作有机合成的催化剂。
元素辅助资料:在化学元素周期系建立的过程中,性质相似的元素成为一族已为化学家们接受。
镧系元素

均为活泼金属,仅次于碱金属,
与镁接近。
在不太高的温度下, 可与氧、硫、氯、
氮反应,可作脱硫剂、脱氧剂等。
可与水、酸反应,应将其保存在 煤油里。
22-1-4 离子的颜色——呈周期性变化
颜色 未成对 未成对 离子 离子 4f 电子数 (4fn) 4f 电子数 (4fn) La3+(4f0) 0 0 Lu3+(4f14) 无 Ce3+(4f1) 1 1 Yb3+(4f13) 无 22-1-4 离子的颜色 3+ 12 3+ 2 Pr (4f ) 2 2 Tm (4f ) 绿 Nd3+(4f3) 3 3 Er3+(4f11) 淡红 Pm3+(4f4) 4 4 Ho3+(4f10) 粉红淡黄 Sm3+(4f5) 5 5 Dy3+(4f9) 黄 Eu3+(4f6) 6 6 Tb3+(4f8) 淡红 Gd3+(4f7) 7 7 Gd3+(4f7) 无
2、离子交换法(离子交换色层分离法):
稀土元素
(三)稀土元素的应用:
据统计,目前世界稀土有 70% 左右消耗于材 料方面。稀土材料应用之广遍及国民经济各个 领域和行业:冶金、石油化工、轻工、光学、 磁学、电子、生物医疗和原子能工业等。稀土 金属在电子材料、原子能材料、药物合成及超 导技术等高新技术领域的应用也日益广泛,稀 土储氢材料(如LaNi5,La2Mg17等)用于H2的 储运、能源的检验、制冷及提纯氢等方面。
稀土元素
(一)稀土元素的资源 我国稀土资源有五大特点:储量大、分布广、 类型多、矿种多、品位高。 根据硫酸复盐溶解度不同,可将稀土元素分为铈 组和钇组: 铈组(La、Ce、Pr、Nd、Pm、Sm、)硫酸复 盐较难溶 钇组( Eu 、 Gd 、 Tb 、 Dy 、 Y 、 Ho 、 Er 、 Tm 、 Yb、Ln)硫酸复盐较易溶
2020-2021学年高中化学新鲁科版必修第二册 第1章第2节元素周期律和元素周期表作业

元素周期律和元素周期表1.原子序数从3依次增加到9的元素,下列递变关系中正确的是( )A.电子层数逐渐增多B.原子半径逐渐增大C.最高正化合价数值逐渐增大D.从C到F,最低负化合价从-4到-1【解析】选D。
根据原子的核外电子排布可知,从3号到9号元素都为2个电子层,最外层电子数从1→7逐渐递增,最高正价依次升高(O、F除外),最低负价的绝对值等于8-最外层电子数,半径逐渐减小,所以D正确,A、B、C均错误。
2.(2020·桂林高一检测)原子序数为31的元素R,在周期表中的位置为( )A.第三周期第ⅤA族B.第四周期第ⅢA族C.第五周期第ⅢA族D.第四周期第ⅤA族【解析】选B。
与31号元素相邻的稀有气体原子序数为36,因31比36少5,所以R元素与36号元素处于同一周期(第四周期),其位置应在36号元素Kr左移5 个格,即是第四周期第ⅢA族。
3.(2020·静海高一检测)下列有关元素周期表中“族”的说法正确的是( )A.元素周期表中共有七个主族、八个副族、一个0族B.元素周期表中从ⅢB族到ⅡB族10个纵列的元素都是金属元素C.同一主族元素的化学性质相同D.族序数后标注B的元素是主族元素【解析】选B。
A.元素周期表有18个纵列,其中包括七个主族、七个副族、一个0族和Ⅷ族共16个族,故A错误;B.元素周期表中从ⅢB族到ⅡB族这10个纵列为过渡元素,都是金属元素,故B正确;C.同主族最外层电子数相同,原子半径不同,则同主族元素的性质具有相似性和递变性,故C错误;D.族序数后标注B的元素是副族元素,A为主族元素,故D错误。
4.下列元素在同周期,且原子半径依次增大的是( )A.O、N、CB.I、Br、ClC.O、S、NaD.Al、Si、P【解析】选A。
O、N、C三元素在同一周期,核电荷数逐渐变小,原子半径逐渐增大,A项正确;I、Br、Cl在同一主族,核电荷数逐渐变小,原子半径逐渐减小,B项错误;O、S在同一主族,原子半径逐渐增大,S、Na在同一周期,核电荷数逐渐变小,原子半径逐渐增大,故r(O)<r(S)<r(Na) ,C项错误;Al、Si、P在同一周期,核电荷数逐渐增大,原子半径逐渐减小,D项错误。
新课标人教版九年级化学 ——《元素符号和元素周期表》同步检测试卷(含答案)

新课标人教版九年级化学——《元素符号和元素周期表》同步检测试卷(含答案)一、选择题1.下列科学家中,发现了元素周期律并编制了元素周期表的是()A.拉瓦锡B.门捷列夫C.道尔顿D.阿伏加德罗2.下列元素名称与元素符号书写都正确的是()A.锌Zn B.硅SI C.氯cl D.贡Hg3.下列符号所表示的元素中全部是金属元素的是()A.O、C、H、Cl B.Al、Fe、Zn、HgC.H、P、Si、K D.S、Mg、N、Ar4.“2O”表示的意义是()A.2个氧原子B.1个氧分子C.氧元素D.氧气5.下列符号中,既有宏观意义,又有微观意义的是()A.Fe2+B.Fe3+C.Fe D.2Fe6.[2018·潍坊]某矿石样本只含有如图1所示的四种元素,该矿石中可能含有的物质是()图1A.碳酸钙(CaCO3)B.二氧化硅(SiO2)C.氧化铝(Al2O3)D.二硫化亚铁铜(CuFeS2)7.图2是钠元素在元素周期表中的信息和钠原子的结构示意图。
下列说法错误的是()图2A.钠的原子序数为11B.钠原子核外有3个电子层C.钠的相对原子质量为22.99D.化学反应中,钠原子易得电子8.[2018·重庆B]“中国芯”的主要材料是高纯度的单质硅,其结构类似于金刚石。
下列有关硅的说法正确的是()A.属于金属元素B.元素符号为SIC.硅元素是地壳中含量最多的元素D.单质硅由原子构成9.图3是元素周期表第4周期的一部分。
据此判断下列说法中错误的是()图3A.镍元素的符号为NiB.钴元素的相对原子质量是58.93 gC.从左到右各元素的原子序数依次增大D.各元素都属于金属元素10.[2017·江西]改编2017年5月我国发布了四种新元素的中文名称,图4是其中一种元素的信息。
下列有关说法错误的是()图4A.镆属于金属元素B.镆的原子序数115表示其核内有115个中子C.“Mc”表示镆元素、1个镆原子D .四种新元素的原子中质子数不同11.[2018·滨州]下表列出了部分元素的原子结构示意图。
元素周期表

15磷P [Ne] 3s23p3 16硫S [Ne] 3s23p4 17氯Cl [Ne] 3s23p5 18氩Ar 1s22s22p63s23p6 19钾K [Ar] 4s1 20钙Ca [Ar] 4s2
21钪Sc [Ar] 3d14s2 22钛Ti [Ar] 3d24s2 23钒V [Ar] 3d34s2 24铬Cr* [Ar] 3d54s1 25锰Mn [Ar] 3d54s2 26铁Fe [Ar] 3d64s2 27钴Co [Ar] 3d74s2 28镍Ni [Ar] 3d84s2
基态原子电子组态
表: 基态电中性原子的电子组态
57镧La*[Xe] 5d16s2 5铈Ce*[Xe] 4f15d16s2 59镨Pr [Xe] 4f36s2 60钕Nd [Xe] 4f46s2 61钷Pm [Xe] 4f56s2 62钐Sm [Xe] 4f66s2
63铕Eu [Xe] 4f76s2 6钆Gd*[Xe] 4f75d16s2 65铽Tb [Xe] 4f96s2 66镝Dy [Xe] 4f106s2 67钬Ho [Xe] 4f116s2 68铒Er [Xe] 4f126s2 69铥Tm [Xe] 4f136s2 70镱Yb [Xe] 4f146s2
主族
族的结构
零族
I A
1 1 II A
234
副族
Ⅷ 族
0
2 III IV V VI VII
K2
AA A AA
5
6
7
8
9
1 0
L K
8 2
3
11
1 2
III IV V VI VII BBBBB
VIII
IB
II B
1 3
1 4
1 5
(完整版)化学元素周期表超清可打印
[222]
P
O
N
M
L
K
8
18
32
18
8
2
7
87Fr
钫
[223]
88Rr
镭
[226]
89~103
Ac~Lr
锕系
104Rf
钅卢*
[261]
105Db
钅杜*
[262]
106Sg
钅喜*
[266]
107Bh
钅波*
[264]
108Hs
钅黑*
[277]
109Mt
钅麦*
[268]
110Ds
钅达*
[281]
111 Rg
族
周期
IA
1
元素周期表
0
18
电子层
0族电子数
1
1H
氢
1.008
IIA
2
金属
元素
原子序数元素符号(红色表示放射性元素)
元素名称(注*的表示人造元素)
相对原子质量(加括号的数据为该放
非金属
元素
92U
铀
238.0
射性元素半衰期最长同位素的质量数)
IIIA
13
IVA
14
VA
15
VIA
16
VIIA
17
2He
氦
钐
150.4
63Eu
铕
152.0
64Gd
钆
157.3
65Tb
铽
158.9
66Dy
镝
162.5
67Ho
钬
164.9
68Er
铒
167.3
八下2.5表示元素的符号-答案

第5节表示元素的符号知识点1:元素的符号1.元素符号的写法元素符号是国际上统一采用的符号,通常用该元素拉丁文名称的第一个字母大写来表示元素。
当两个元素的第一个字母相同时,可写上该元素的第二个字母(小写)以示区别。
即由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写。
如Ne(氖)、Na(钠)、Mn(锰)、Cu (铜)、Ca(钙)等。
元素符号书写口诀:一大二小拉丁文。
2.常见元素的元素符号钙元素与铜元素、氯元素的拉丁文第一个字母相同,都是“C”,为便于区别,写上该元素的第二个字母,因此钙元素符号为Ca。
3.元素符号表示的意义(1)宏观上表示一种元素,如“N”表示氮元素,“O”表示氧元素。
每种元素只能有一种元素符号。
(2)微观上表示这种元素的1个原子,如“N”表示1个氮原子,“O”表示1个氧原子。
(3)如果物质直接由原子构成,则该元素符号还表示一种物质,如“Fe”表示铁这种物质。
说明若元素符号前面有数字,则只能表示该元素的几个原子(即只有微观含义)。
如:“3H”只能表示3个氢原子,“6Fe”只能表示6个铁原子。
【例1】下列元素符号书写正确的是 ( D )A. MN B.CA C.mg D.Zn【例2】下列各组元素,元素符号的大写字母相同的一组是( C )A.硫、磷、硅B.氩、氖、铝C.碳、钙、氯D.氟、氧、钠【例3】氕、氘、氚三种不同原子在元素周期表中的位置情况是(A)A. 占同一个位置B. 占三个不同位置C. 不占位置D. 只有氕占位置【例4】下列有关元素符号“Cu”表示的意义中错误的是( B )A.一个铜原子 B.一个铜元素 C.铜 D.铜元素(易错点:化学符号及其周围数字的意义)【例5】下列有关符号“Cu”表示的意义中,不正确的是( B )A.一个铜原子 B.一个铜元素 C.铜 D.铜元素【例6】下列符号既能表示一种元素,又能表示一个原子的是( C )A.O2 B.Mg2+C.H D.2N2【例7】下列化学用语中,既能表示宏观意义,又能表示微观意义的是(C)A. 2ZnB. 2N2C. HD. 5S【例8】“2Na”表示的意义是 ( C )A.表示两个钠元素 B.表示裰种钠元素C.表示两个钠原子 D.既表示两个钠元素,又表示两个钠原子【例9】如图所示,“○”和“●”分别表示氢原子和氧原子,其中粒子可用4H表示的是( C )【例10】写出下列元素的元素符号或名称:铁;铜;锌;钙;钠;Al ;P ;Ag ;Ne .【答案】Fe; Cu; Zn; Ca; Na;铝;磷;银;氖;【例11】回答下列问题:(1)用化学符号表示:①氧化铝中铝元素显+3价:②氦气:③3个亚铁离子④2个铵根离子。
化学元素符号表
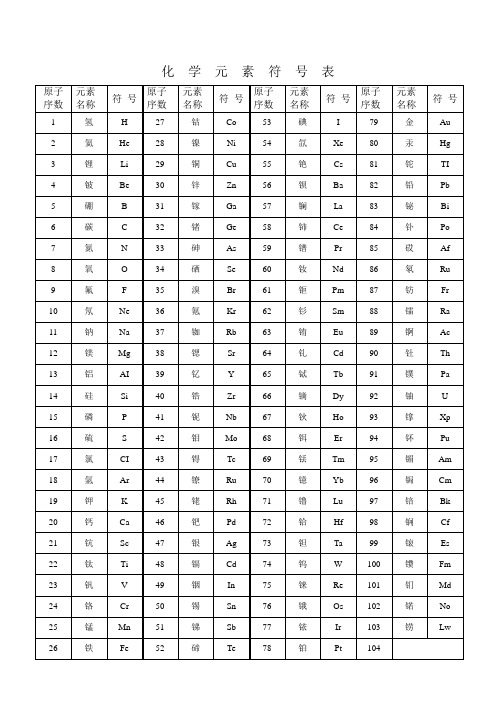
化学元素符号表【化学】常用36元素的一些性质和用途氢(H)主要性质和用熔点为-259.1 ℃,沸点为-252.9 ℃,密度为 0. 089 88 g/L(10 ℃)。
无色无臭气体,不溶于水,能在空气中燃烧,与空气形成爆炸混合物。
工业上用于制造氨、环已烷、甲醇等。
氦(He)主要性质和用途熔点为-272.2 ℃(加压),沸点为-268.9 ℃,密度为0.178 5 g/L(0 ℃)。
无色无臭气体。
化学性质不活泼。
用于深海潜水、气象气球和低温研究仪器。
锂(Li)主要性质和用途熔点为180.5 ℃,沸点为1 347 ℃,密度为0.534 g/cm3(20 ℃)。
软的银白色金属,跟氧气和水缓慢反应。
用于合金、润滑油、电池、玻璃、医药和核弹。
铍(Be)主要性质和用途熔点为1 278±5 ℃,沸点为2 970 ℃(加压下),密度为1.848 g/cm3(20 ℃)。
较软的银白色金属,在空气和水中稳定,即使在红热时也不反应。
用于与铜和镍制合金,其导电性和导热性极好。
硼(B)主要性质和用途熔点为2 300 ℃,沸点为3 658 ℃,密度为2.340 g/cm3(β-菱形)(20 ℃)。
具有几种同素异形体,无定形的硼为暗色粉末,跟氧气、水、酸和碱都不起反应,跟大多数金属形成金属硼化物。
用于制硼硅酸盐玻璃、漂白和防火。
碳(C)主要性质和用途熔点约为3 550 ℃(金刚石),沸点约为4 827 ℃(升华),密度为3.513 g/cm3(金刚石)、2.260 g/cm3(石墨)(20 ℃)。
用于首饰(金刚石)、炼钢(焦炭)、印刷(炭黑)和精制糖(活性炭)等。
氮(N)主要性质和用途熔点为-209.9 ℃,沸点为-195.8 ℃,密度为1.251 g/L(0 ℃)。
无色无臭气体。
在室温下一般不活泼。
用于制硝酸、化肥、炸药、塑料和染料等。
氧(O)主要性质和用途熔点为-218.4 ℃,沸点为-183.0 ℃,密度为1.429 g/L(0 ℃)。
