水环境化学1.pptx
合集下载
《水环境化学》课件

水环境化学的重要性 和应用
水环境化学对于保护水资 源、维护环境、促进可持 续发展具有重要的意义。
水的物理化学性质
溶解度溶解度是指单位体Fra bibliotek溶液中 最多能溶解多少物质,它是 表征物质在水中溶解程度的 重要参数。
离子强度
水中的离子强度是所有阴离 子和阳离子的浓度之和和它 们的电荷平方和之比的平方 根。
pH值
水环境监测方法
通过水质监测,及时发现水体 污染的情况,采取有效的技术 措施来防治和修复水体污染。
水环境化学的未来
1 水环境化学的发展趋势
未来水环境化学将逐渐转向绿色、可持续和低碳化发展。
2 水环境化学的应用前景
水环境化学需求将继续增长,未来将更多地应用于水资源保护、净化和开发领域。
3 水环境化学的挑战与机遇
水环境化学
水是地球上最珍贵的资源之一,水环境化学是研究水体的化学性质、污染及 其净化和水质监测的学科。
水环境化学简介
什么是水环境化学?
水环境化学是研究水及其 体系在自然界和生产生活 中的各种过程所涉及到的 化学现象的学科。
水环境化学的研究对 象和内容
研究水环境中各种物质的 迁移、转化和去除,以及 不同水环境对生态环境的 影响。
3
物理污染物
有些物理污染物如悬浮物、浮游生物、颗粒物或沉积物都会影响水的质量和可用性。
水的净化与处理
常见水污染物的去除方法
颗粒物、悬浮物主要通过过滤 和沉淀去除,生物污染物主要 通过消毒去除,化学污染物主 要依靠氧化、还原、沉淀和离 子交换等方法除去。
常见水处理技术及其原理
如生物处理、深度处理、反渗 透等技术,利用技术手段将水 中的污染物清除或降低到符合 生产和生活需求的标准。
水化学1ppt-水环境化学(1)

据预测,30-40km高度的奇氧损失由NOx循环支配, 50km海拔以上高度则由HOx循环支配奇氧损失
据推测,在30-40km高空中的奇氧损耗主要是由NOx 循环催化引起的,而在50km以上高空中HOx循环催 化是引起奇氧损耗的主要原因
有人预测,海拔30-40km处的奇氧损耗是由NOx循环 主导的,50km以上则由HOx循环主导
—H2CO3 —HCO3—CO32-
酚酞变色
甲基橙变色
22
例2——已知碱度和pH,求各物种浓度
已知水体的总碱度为1.00× 10-3mol/L ,计 算pH8和pH10时水中H2CO3、HCO3-、 CO32-浓度(假定只由它们构成碱度)
23
解答
pH=8时,碱度以HCO3-为主,所以可假 定 再根据离解常数和pH分别得到
酚酞变色
甲基橙变色
20
2)酸度
与强碱发生中和作用的物质总量,代表中和强 碱的能力
无机酸度 酚酞酸度(二氧化碳) 总酸度
21
3)碱度、酸度、碳酸盐总量、pH之间的 关系
根据滴定结果,可以推算: 总碱度-碳酸盐碱度=碳酸盐总量 二氧化碳酸度-无机酸度=碳酸盐总量 总碱度+二氧化碳酸度=碳酸盐总量
33
解答(续)
要调节到pH=9.0,cT=2mmol/L,用 NaHCO3增加cT,应投加0.35mmol/L, 这同时增加碱度0.35mmol/L。
计算pH=9.0和cT=2mmol/L时的碱度,求 所缺的碱度,由NaOH补足。
34
例6:好氧呼吸导致的pH变化
已知初始TOC浓度为6mg/L,pH=6.9,碱度 为1.2mmol/L。如果发生好氧呼吸,水中的有 机物全部分解,且释放出NH4+,请求出最终 的pH值。
据推测,在30-40km高空中的奇氧损耗主要是由NOx 循环催化引起的,而在50km以上高空中HOx循环催 化是引起奇氧损耗的主要原因
有人预测,海拔30-40km处的奇氧损耗是由NOx循环 主导的,50km以上则由HOx循环主导
—H2CO3 —HCO3—CO32-
酚酞变色
甲基橙变色
22
例2——已知碱度和pH,求各物种浓度
已知水体的总碱度为1.00× 10-3mol/L ,计 算pH8和pH10时水中H2CO3、HCO3-、 CO32-浓度(假定只由它们构成碱度)
23
解答
pH=8时,碱度以HCO3-为主,所以可假 定 再根据离解常数和pH分别得到
酚酞变色
甲基橙变色
20
2)酸度
与强碱发生中和作用的物质总量,代表中和强 碱的能力
无机酸度 酚酞酸度(二氧化碳) 总酸度
21
3)碱度、酸度、碳酸盐总量、pH之间的 关系
根据滴定结果,可以推算: 总碱度-碳酸盐碱度=碳酸盐总量 二氧化碳酸度-无机酸度=碳酸盐总量 总碱度+二氧化碳酸度=碳酸盐总量
33
解答(续)
要调节到pH=9.0,cT=2mmol/L,用 NaHCO3增加cT,应投加0.35mmol/L, 这同时增加碱度0.35mmol/L。
计算pH=9.0和cT=2mmol/L时的碱度,求 所缺的碱度,由NaOH补足。
34
例6:好氧呼吸导致的pH变化
已知初始TOC浓度为6mg/L,pH=6.9,碱度 为1.2mmol/L。如果发生好氧呼吸,水中的有 机物全部分解,且释放出NH4+,请求出最终 的pH值。
第水环境化学(共10张PPT)

水环境中污染物种类繁多,一般分为两大类:
cp—单位溶液理体积论上颗,粒物即的浓非度k离g/L子; 性有机化合物可通过溶解作用分配到土壤
有机质中,并经一定时间达到分配平衡,此时有机化合物
在土壤有机质和水中含量的比值称分配系数。
第5页,共10页。
▪实际上,有机化合物在土壤(沉积物)中的吸着存在着二种主要机
作用、挥发作用、水解作用、光解作用、生物富集和生物降 解作用等过程进行迁移转化。
第4页,共10页。
二、分配作用
1.分配理论
▪近20年来,国际上对有机化合物的吸附分配理论开展了
使得pH降低,一般伴随E降低,pH会降低,酸性增强,金属溶解,酸性增强情况下,金属Hg容易甲基化;
②靠吸范附 德作华用力,,广即后在者泛非则研极是性各究有种机化。溶学剂键结中力果,如土氢均壤键矿、表物离明质子对偶,有极机键颗化、合配粒物位物的键表及(面π沉键吸作积附用作物的用结或或果于。土土壤壤矿物)从质对水有机中化合吸物的表面吸附作用,前者主要
cT = cs·cp+cw 式中:cT—单位溶液体积内颗粒物上和水中有机毒物质量的总和ug / L;
cs—有机毒物在颗粒物上的平衡浓度,ug/kg;
cp—单位溶液体积上颗粒物的浓度kg/L;
cw—有机毒物在水中的平衡浓度,ug/L。
此时水中有机物的浓度(cw)为:cw =cT / (Kp cp十1)
第7页,共10页。
▪一般吸附固相中含有有机碳(有机碳多,则Kp大),为了在类型各异组分复 杂的沉积物或土壤之间找到表征吸着的常数,引入标化分配系数(Koc):
➢ 使得pH降低,一般伴随E降低,pH会降低,酸性增强,金属溶解, 酸性增强情况下,金属Hg容易甲基化; ➢ 静止水体的富营养化。
cp—单位溶液理体积论上颗,粒物即的浓非度k离g/L子; 性有机化合物可通过溶解作用分配到土壤
有机质中,并经一定时间达到分配平衡,此时有机化合物
在土壤有机质和水中含量的比值称分配系数。
第5页,共10页。
▪实际上,有机化合物在土壤(沉积物)中的吸着存在着二种主要机
作用、挥发作用、水解作用、光解作用、生物富集和生物降 解作用等过程进行迁移转化。
第4页,共10页。
二、分配作用
1.分配理论
▪近20年来,国际上对有机化合物的吸附分配理论开展了
使得pH降低,一般伴随E降低,pH会降低,酸性增强,金属溶解,酸性增强情况下,金属Hg容易甲基化;
②靠吸范附 德作华用力,,广即后在者泛非则研极是性各究有种机化。溶学剂键结中力果,如土氢均壤键矿、表物离明质子对偶,有极机键颗化、合配粒物位物的键表及(面π沉键吸作积附用作物的用结或或果于。土土壤壤矿物)从质对水有机中化合吸物的表面吸附作用,前者主要
cT = cs·cp+cw 式中:cT—单位溶液体积内颗粒物上和水中有机毒物质量的总和ug / L;
cs—有机毒物在颗粒物上的平衡浓度,ug/kg;
cp—单位溶液体积上颗粒物的浓度kg/L;
cw—有机毒物在水中的平衡浓度,ug/L。
此时水中有机物的浓度(cw)为:cw =cT / (Kp cp十1)
第7页,共10页。
▪一般吸附固相中含有有机碳(有机碳多,则Kp大),为了在类型各异组分复 杂的沉积物或土壤之间找到表征吸着的常数,引入标化分配系数(Koc):
➢ 使得pH降低,一般伴随E降低,pH会降低,酸性增强,金属溶解, 酸性增强情况下,金属Hg容易甲基化; ➢ 静止水体的富营养化。
《水环境化学》PPT课件

总含盐量(TDS):
TDS=[K++Na++Ca2++Mg2+]+[HCO3-+NO3-+Cl-+SO 24
2、天然水的性质
(Characteristic of Natural Waters) (1)碳酸平衡(Balance of H2CO3) 水体中存在四种化合态:
CO2、CO32-、HCO3-、H2CO3
常把CO2和H2CO3合并为H2CO3*。
H2CO3*— HCO3-—CO32-体系可用下面 的反应和平衡常数表示:
CO2 + H2O = H2CO3* H2CO3* = H+ + HCO3HCO3- = H+ + CO323
pK0 = 1.46 pK1 = 6.35
pK2 = 10.3
α0 =[H2CO3* ]/{[H2CO3* ]+[HCO3- ]+[CO32]} α1= [HCO3- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]} α2 = [CO32- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]}
3、胶体相互凝聚
4. “边对面”絮凝
胶体颗粒凝聚方式
(Aggregation Way of Colloid Particulate)
(5)第二极小值絮凝; (6)聚合物粘结架桥絮凝; (7)无机高分子的絮凝; (8)絮团卷扫絮凝; (9)颗粒层吸附絮凝;
表面吸附
离子交换吸附
专属吸附
(1)吸附等温线和等温式
(Adsorption Isotherms and Isothermal Equation)
TDS=[K++Na++Ca2++Mg2+]+[HCO3-+NO3-+Cl-+SO 24
2、天然水的性质
(Characteristic of Natural Waters) (1)碳酸平衡(Balance of H2CO3) 水体中存在四种化合态:
CO2、CO32-、HCO3-、H2CO3
常把CO2和H2CO3合并为H2CO3*。
H2CO3*— HCO3-—CO32-体系可用下面 的反应和平衡常数表示:
CO2 + H2O = H2CO3* H2CO3* = H+ + HCO3HCO3- = H+ + CO323
pK0 = 1.46 pK1 = 6.35
pK2 = 10.3
α0 =[H2CO3* ]/{[H2CO3* ]+[HCO3- ]+[CO32]} α1= [HCO3- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]} α2 = [CO32- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]}
3、胶体相互凝聚
4. “边对面”絮凝
胶体颗粒凝聚方式
(Aggregation Way of Colloid Particulate)
(5)第二极小值絮凝; (6)聚合物粘结架桥絮凝; (7)无机高分子的絮凝; (8)絮团卷扫絮凝; (9)颗粒层吸附絮凝;
表面吸附
离子交换吸附
专属吸附
(1)吸附等温线和等温式
(Adsorption Isotherms and Isothermal Equation)
水化学2ppt水环境化学(1)

交界酸
V2+, Cr2+, Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Ti3+, V3+, Zn2+, Pb2+, Bi3+
软酸
B类:Cu+, Ag+, Au+, Cd2+, Hg2+, Sn2+, Tl3+, Au3+, In3+, Br+
配位稳定性: Mn2+< Fe2+< Co2+< Ni2+< Cu2+> Zn2+
水化学2ppt水环境化学(1)
水中阳离子的形态与pH值关系 水化学2ppt水环境化学(1)
(2)多核羟基配合物的形成
n 金属离子与水的简单配位——逐级离解
水化学2ppt水环境化学(1)
n 多核羟基配合物
多核羟基配合物形成的条件?
水化学2ppt水环境化学(1)
n 以Fe3+水解为例 Fe(ClO4)3投加到水中,配位平衡:
硬酸
A类:IA, IIA离子, Al3+, Sc3+, La3+, Si4+, Ti4+, Zr4+, Th4+, Cr3+, Mn3+, Fe3+, Co3+
配位稳定性: N>>P, O>>S, F>>Cl F>O>N=Cl>Br>I>S OH->RO->RCO2CO32->>NO3PO43->>SO42->>ClO4-
水环境化学 ppt课件
(2)金属水合氧化物:
褐铁矿:Fe2O3﹒nH2O
水化赤铁矿:2Fe2O3﹒H2O 得到具有重要胶体作用的:
针铁矿:Fe2O3﹒H2O 水解 [FeOOH]∞聚合无机高分子
水铝石:Al2O3﹒H2O
[Al(OH)3]∞聚合无机高分子
三水铝石:Al2O3﹒3H2O
[MnOOH]∞聚合无机高分子
二氧化硅凝胶:SiO2﹒nH2O
水环境中发现的腐殖质大部分为富里酸这一 类,原因在于易溶于水,来源有二:一部分是水 生植物的分泌物和降解产物;另一部分来自土壤, 由土壤淋溶液和泾流带入水体。河水中腐殖质平 均含量在10~15mg/L,但起源于沼泽地带的河流 其含量要丰富的多。
水体污染
由于人类活动排放的污染物进入河流、湖泊、 海洋或地下水等水体,使水和水体底泥的物理、 化学性质或生物群落组成发生变化,从而降低了 水体的使用价值,这种现象称为水体污染。
水体的自净作用 污水排入水体后,一方面对水体产生污染,
另一方面水体本身有一定旳净化污水能力,即经 过水体的物理、化学与生物的作用,使污染物浓 度逐渐降低,经过一段时间后,水体往往能恢复 到受污染前的状态,并在微生物的作用下分解, 从而使水体由不洁恢复为清洁,这一过程称为水 体的自净过程。
• 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭
• “不怕太阳晒,也不怕那风雨狂,只怕先生骂我 笨,没有学问无颜见爹娘 ……”
• “太阳当空照,花儿对我笑,小鸟说早早早……”
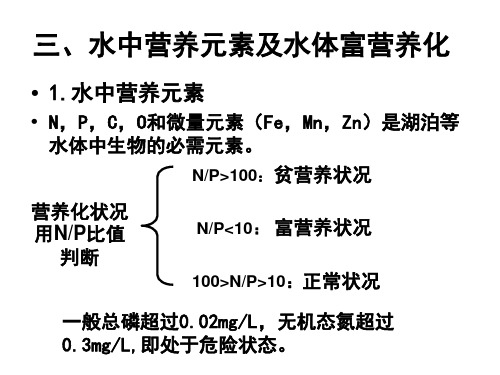
藻类疯长; 藻类尸体分解引起水体溶氧下降; 水体发臭; 水生生物死亡; 绿藻和硅藻由蓝藻取代产生藻毒素。
▪举例:触目惊心的赤潮中毒事件
➢赤潮区域内,某些赤潮生物分泌赤潮毒素,污染鱼、贝 类等生物,生物毒素可在这些生物体内蓄积,当毒素的蓄 积量超过人体可接受的水平时,人一旦食用了这些生物, 就会导致疾病发生,甚至会爆发传染病。
第三章水环境化学

天然水体的pH值一般在6~9之间。 水中含有的各种碳酸化合物控制水的pH值并具有缓冲作用。
2020/4/10
12
§1.2天然水的性质
(4)水的硬度
水中所含钙、镁离子总量称为水的总硬度。
水的硬度分级
总硬度
水质
0~4度
很软水
4~8度
软水
8~16度
中等硬水
16~30度
硬水30度ຫໍສະໝຸດ 上很硬水常用“度”作为硬度单位。例如l0mg/L的CaO称为1德国度, l0mg/L的CaCO3称为法国度。
生物自净
在生物的作用下,污染物的数量减少,浓度下降,毒 性减轻或消失.
2020/4/10
23
§2.水中污染物的分布和存在形态
上个世纪60年代,美国学者曾把水体中的污染物划 分为八类:(1)耗氧污染物(一些能较快被微生物降解 成人C类O、2和动H物2O患的病有原机微物生)物;与(细2)致菌病)污;染(3)物合(成一有些机可物使; (4)植物营养物;(5)无机物及矿物质;(6)由土壤、岩石 等冲刷下来的沉淀物;(7)放射性物质;(8)热污染。 总的可以分为两大类:
2020/4/10
13
§1.3天然水体--海洋
海洋覆盖着70.8%的地球表面,总面积约 3 6 1 1 0 1 2 m2, 平 均 深 度 3 8 0 0 m, 总 体 积 为 13701015m3。
海水离子强度I约为0.7。海水pH值在表层为
8.1~8.3,在深层可下降到7.8。主要成分依次为
地下水中污染物质
• 耗氧污染物 • 病原体,如细菌、病毒、原生动物等 • 植物营养物质 • 有机化学物品 • 放射性物质
2020/4/10
19
§1.4天然水的水质
2020/4/10
12
§1.2天然水的性质
(4)水的硬度
水中所含钙、镁离子总量称为水的总硬度。
水的硬度分级
总硬度
水质
0~4度
很软水
4~8度
软水
8~16度
中等硬水
16~30度
硬水30度ຫໍສະໝຸດ 上很硬水常用“度”作为硬度单位。例如l0mg/L的CaO称为1德国度, l0mg/L的CaCO3称为法国度。
生物自净
在生物的作用下,污染物的数量减少,浓度下降,毒 性减轻或消失.
2020/4/10
23
§2.水中污染物的分布和存在形态
上个世纪60年代,美国学者曾把水体中的污染物划 分为八类:(1)耗氧污染物(一些能较快被微生物降解 成人C类O、2和动H物2O患的病有原机微物生)物;与(细2)致菌病)污;染(3)物合(成一有些机可物使; (4)植物营养物;(5)无机物及矿物质;(6)由土壤、岩石 等冲刷下来的沉淀物;(7)放射性物质;(8)热污染。 总的可以分为两大类:
2020/4/10
13
§1.3天然水体--海洋
海洋覆盖着70.8%的地球表面,总面积约 3 6 1 1 0 1 2 m2, 平 均 深 度 3 8 0 0 m, 总 体 积 为 13701015m3。
海水离子强度I约为0.7。海水pH值在表层为
8.1~8.3,在深层可下降到7.8。主要成分依次为
地下水中污染物质
• 耗氧污染物 • 病原体,如细菌、病毒、原生动物等 • 植物营养物质 • 有机化学物品 • 放射性物质
2020/4/10
19
§1.4天然水的水质
《水环境化学》PPT课件 (2)

浓度(C)之间的关系可用下式表示完整:版G课=件pApt ·C·10BpH式中:A、B—常数2。1
➢ 其次是颗粒物的粒度和浓度对重金属吸附量的影响。颗粒物对重金 属的吸附量随粒度增大而减少,并且,当溶质浓度范围固定时,吸附 量随颗粒物浓度增大而减少。
➢ 此外,温度变化、几种离子共存时的竞争作用均对吸附产生影响。
离子进入Stern层后。不能被通常提取交换性阳离子的提取
剂提取,只能被亲和力更强的金属离子取代,或在强酸性
条件下解吸。
完整版课件ppt
17
▪专属吸附的另一特点是它在中性表面甚至在与吸附离子 带相同电荷符号的表面也能进行吸附作用。例如,水锰矿 对碱金属(K、Na)的吸附作用属于离子交换吸附,而对于 Co、Cu、Ni等过渡金属元素离子的吸附则属于专属吸附。
完整版课件ppt
13
▪由于胶体具有巨大的比表面和表面能,因此固液界面存
在表面吸附作用,胶体表面积愈大,所产生的表面吸附能也愈
大,胶体的吸附作用也就愈强,它是属于一种物理吸附。
一般么蒙脱石单位比表面积=800m2/g左右,伊利石
=30-80m2/g , 高 岭 石 =10-50=800m2/g , 腐 殖 质 =400900m2/g,
完整版课件ppt
11
4r 2
r 3
▪ 单位比表面积(ρ为密度)=面积(球)/重量=
4 =r 3 (cm2/g) 3
▪ 表面能(又称为表面吸附能):任何分子之间均存在引力,在物体内部,
某分子受到各方面作用力相等,因而处于平衡状态,但是在胶体表面上,分
子受力不均匀(因为表面分子周围的分子数量不相等),因而产生了所谓的
第二节、水中无机污染物的迁移转化
《水环境化学》PPT课件

完整版课件ppt
18
2、石油的降解 (P126)
石油是由烷烃、环烷烃、烯烃、芳香烃 和杂环化合物等组成。
石油在水中可光化学降解或生物降解。
完整版课件ppt
19
(1)光化学降解:
在阳光照射下,石油中的烷烃及侧链芳烃受激发 活化进行光化学氧化。
据测,油浓度为2000kg/km3的水面,油膜厚度 2.5μm,由于光化学氧化,几天光照即能把油膜清除。
氧化)
完整版课件ppt
4
不易被氧化的:饱和的脂肪烃、含有苯环
结构的芳香烃、含氮的脂肪胺类化合物等 ;
容易被氧化的:醛、芳香胺、不饱和的烯
烃和炔烃、醇及含硫化合物(如硫醇、硫醚)等。
完整版课件ppt
5
② 还原反应 : 在有机物分子中加氢或脱氧的反应称为有机
物的还原反应。例如:
HCHO (甲醛) + H2→ CH3OH (甲醇 ) (加氢
24
③ 芳香烃的降解: 石油中苯、苯的同系物、萘等在微生物
作用下先是氧化成二酚,然后苯环分裂成 有机酸,再经有关生化反应,最终分解为 二氧化碳和水。
完整版课件ppt
25
④ 环烷烃降解:环烷烃最稳定,只有少
数微生物能使它降解。如环己烷在微生物作用下
缓慢氧化:
完整版课件ppt
26
课堂作业
教材P80 习题3、4、5、7、13、14
进行,最后分解为CO2和H2O。
完整版课件ppt
22
② 烯烃的降解
当双键在中间位置时,主要的降解途径与饱和 烷烃相似。
当双键位在碳1和碳2位时,在不同微生物的 作用下,主要降解途径有三种:即烯烃的不饱和 端氧化成环氧化物、不饱和末端氧化成醇、饱和 末端氧化成醇。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
B] B]
pH
pH
pH
lg
[H2CO3] [HCO3 ]
B B
lg
[H2CO3 ] [HCO3 ]
缓冲容量 cB cA
pH pH 使水溶液体系的pH值上升一个单位所需加入的 强碱的量。
表 水样缓冲容量与碳酸浓度的关系
水样号
pH
[HCO3-] mg.L-1
总无机碳cT
cA
(10-3 mol.L-1)
▪ 注意这里“溶解度”概念和基础化学有所 区别。
▪ 在实际应用中,人们常常控制水体的pH, 使其中的重金属离子生成氢氧化物沉淀, 以除去废水中的重金属。
pH
1
7.0 74
1.49
0.5
2
7.0 277
5.56
1.92
▪ 地面水的缓冲容量是有限的,当实测 pH<4.5或者>10.8时,表明水体已经受到 强酸和强碱的污染。
3.3.3 沉淀与溶解(教材90页+戴树桂教材)
▪ 涉及污染物:重金属污染物 ▪ 涉及环境要素:水、碳酸组分、H2S
溶解和沉淀是污染物在环境中迁移的重要途径,一 般金属化合物在水中的迁移能力可以直观的用溶 解度来衡量:溶解度小者,迁移能力小;溶解度 大者,迁移能力大。
色,CO32-转变为HCO3-。两 色变为红色, HCO3-
次滴定耗用的标准酸量之和 转变为H2CO3*。三次
叫做酚酞碱度。
滴定的标准酸量之和
叫做总碱度。
总碱度 = [ HCO3-] + 2[CO32-] + [ OH-] – [H+] ( 由H2CO3的质子条件PBE导出 [H+] = [OH-] + [ HCO3-] + 2[CO32-])
3.3 水体中污染物的迁移和转化
主要内容
▪ 本节主要介绍污染物在水体中迁移和转化 的基本作用方式。
▪ 3.4节是研究典型污染物(重金属、营养元 素和难降解有机污染物等)在水体中的具 体行为,可能涉及本节中介绍的多种迁移 和转化方式。
转化
化学与物理化 学作用
生物与生物化 学作用
污染物
无机污染物
有机污染物
10.8
8.3 4.5
图 含碳酸水的中和曲线
用酸滴定pH>10.8的碱性水样
e点,pH=10.8,水中强碱部分全 部被酸溶液中和,所耗用的标准 酸量叫做苛性碱度。但是由于中 和曲线突跃不明显,也没有合适 的酸碱指示剂确定终点,苛性碱 度不能测定。
加入酚酞。c点,pH=8.3, 加入甲基橙。a点,
酚酞指示剂由红色变为无 pH=4.5,甲基橙由黄
可溶性铅物种 [Pb(II )T ] * Ks0[H ]2 * Ks1[H ] Ks2 8Ks3[H ]1
图 PbO的溶解度 (图的推导)
说明
▪ 氧化物和氢氧化物具有两性特性,能与质 子或者氢氧根离子反应,存在一个pH,在 此pH值下溶解度最小。在碱性或者酸性更 小的pH区域,溶解度都变得更大。
碳酸各组分总量守恒。
图 碳酸化合态分布图
(代表三种化合态在总量中所占的比例)
表 25 ℃碳酸平衡系数
(续表)
(2)开放体系
CO2在气相和液相之间 达到平衡,当研究过程 是长期的,例如一年期 间的水质组成,则作为 开放体系处理。开放体 系内[H2CO3*]不变。在 天然条件下,开放体系 是实际存在的,而封闭 体系是开放体系趋向平 衡过程中的一个微小阶 段。
碳酸各组分的分布情况?
水体中的碳酸平衡: CO2 H2O H2CO3* pK 1.46 H 2CO3* H HCO3 pK 6.35 HCO3 H CO32 pK 10.33
(1)封闭体系
CO2在气液界面的平衡 时间需要数日,若所考
虑到的溶液反应在数小
时之内完成,则视为封
闭体系。封闭体系内的
(酸度及酸度的推导,教材89页,由于同样的原因 总酸度也不能测定)
除pH<4.5的水样外,一般用碱度表示水样的酸 碱性!!
例题
▪ 例1:某水体 pH=8.00,碱度=1.00×10-3 mol.L-1,计算该水体中各碱度成分的浓度。
▪ 例2:天然水pH=7.0,碱度为1.4 m mol.L-1, 为使pH=6.加入酸多少?
有机污染物和无机污染物在水环境中的迁移转 化行为差别很大!!
表 有机物在水环境中的迁移和转化方式
无机污染物
有机污染物
沉淀与溶解
水解
氧化还原
配位 吸附与解吸
吸附与解吸
分配 挥发
光解
生物降解
3.3.1 碳酸平衡(教材80、88页)
水体中可能存在的碳酸组分: CO2、 H2CO3 、 HCO3-、 CO32- ,常把CO2和 H2CO3 合并为 H2CO3*,实际上H2CO3 、 含 量较低,主要是溶解性气体CO2。
ห้องสมุดไป่ตู้
一、金属氧化物和氢氧化物
▪ 在研究氧化物和氢氧化物的溶解度问题的 时候,应该考虑这些固体与羟基金属离子 配合物的平衡。
金属离子
氧化物 氢氧化物
羟基 配合物
氧化物
PbO(s) 2H Pb2 H2O lg* Ks0 12.7 PbO(s) H PbOH lg* Ks1 5.0 PbO(s) H2O Pb(OH )20 lg Ks2 4.4 PbO(s) 2H2O Pb(OH )3 H lg*Ks3 -15.4
酚酞碱度=[OH-]+[CO32-]-[H2CO3*] – [H+] (由 HCO3-的质子条件PBE导出
[H+] = [OH-] + [CO32-] - [H2CO3*] )
用碳酸平衡系数来表示: 总碱度 = CT (α1+ 2α2) + KW /[H+] – [H+] 酚酞碱度 = CT (α2 - α0) + KW /[H+] – [H+]
天然水体的缓冲能力
大多数天然水体的pH值在6-9之间,HCO3占优势,是一个很好的缓冲体系,假如仅考 虑碳酸体系控制水体pH值,在pH < 8.3时 (仅考虑碳酸的第一级离解):
pH
pK1
lg
[H 2CO3 ] [HCO3 ]
若向水中投入ΔB量的碱性废水
pH
pK1
lg
[ H 2CO3 [HCO3
pH=6
pH=10 pH=10.3
图 开放体系的碳酸平衡
3.3.2 天然水的碱度和酸度及缓冲能力
(教材88页)
▪ 碱度(alkalinity):接受质子的总物质的 量,包括强碱、弱碱及强碱弱酸盐。
▪ 酸度 Acidity:给出质子的总物质的量,包 括强酸、弱酸及强酸弱碱盐。
▪ 酸度和碱度的测量方法:酸碱滴定,双指 示剂法。
