水环境化学(3)-4-22
环境化学第三章水

二节 气体在水中的溶解性
水的质量特征:
• 酸度和碱度
第一节 概述
• 盐度和氯度:1千克水中碳酸盐转变为氧化物、溴化物 和碘化物转变为氯化物、有机物完全氧化后所含固体 的总克数。
• 硬度 • 溶氧量:25℃时的饱和浓度
[O2 (aq)] = 2.6×10-3 mol/L = 8.32 mg/L
• 清度和色度
化合物直接与 pH值有关,实际涉及到水解和羟基配合物的平
衡过程,该过程往往复杂多变,这里用强电解质的最简单关 系式表述: Me(OH)n(s) → Men+ + nOH根据溶度积表达式 可导出金属离子浓度 等号两边取负对数: Ksp = [Men+][OH-]n [Men+] = Ksp/[OH-]n = Ksp[H+]n/Kwn -lg[Men+] =-lgKsp-nlg[H+] + nlgKw (3-21)
HS- → H+ + S2则总反应: H2S →2 H+ + S2-
K2= 1.3×10-15
K1,2=K1K2=1.16×10-22
三、溶解沉淀平衡
在饱和水溶液中,H2S浓度总是保持在0.1mol/L,则 [H+]2[S2-] = K1,2×[H2S] = 1.16×10-22×0.1 = 1.16×10-23 由于在水溶液中 H 2 S 的二级电离甚微,故可近似认为 [H+] = [HS-],因此可求得溶液中[S2-]浓度:
三、溶解沉淀平衡
第二节 天然水中的平衡
溶解和沉淀是污染物在水环境中迁移的重要途径,一般金
属化合物在水中迁移能力,直观地可以用溶解度来衡量。
溶解度小者,迁移能力小; 溶解度大者,迁移能力大。 在固—液平衡体系中,需用溶度积来表征溶解度。
三章-水环境化学2省名师优质课赛课获奖课件市赛课一等奖课件
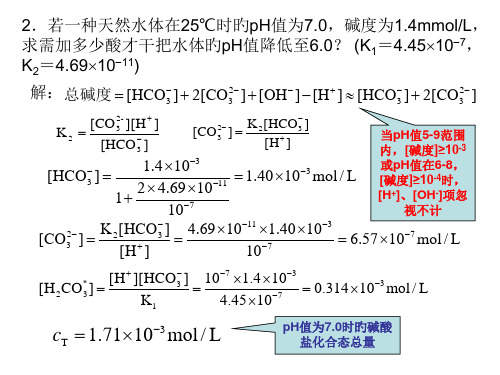
4.69 1011 1.40 103 107
6.57 107 mol / L
[H2CO*3 ]
[H ][HCO3 ] K1
107 1.4 103 4.45 107
0.314103 mol / L
cT 1.71103 mol / L
pH值为7.0时旳碱酸 盐化合态总量
pH为6.0时碳酸盐化合物态总量=pH为7.0时旳总量
加入的酸量为碱度降低值 (1.4 0.526) 103=0.873103 mol / L
解题旳要点:在碳酸总量不变前提下, 碱度旳降低值即为加入旳酸量。
环节 : 1 求碳酸总量; 2 求碱度; 3 求差。
解法二(书上旳解法):
pH值不同步旳各碳酸 化合物旳百分数为已知
解:总碱度 [HCO3 ] 2[CO32 ] [OH ] [H ] cT (1 22 )
存在形式:镉人是因食水用迁含移镉旳性大元米素和饮,用除含了镉旳硫水化而镉中毒外,,全其身疼他痛旳,化合物
均能溶于水。故在称“水骨体痛中症”镉。主据要统计以,C在d129+6状3年态至存19在68年。5还月,可共与有无机和 有机配位体生成多种确可诊溶患者性25配8人合,物死。亡人天数然达水128中人镉。 旳溶解度受碳
了目前人们所说旳神经毒
事故。在世界许多地方,
气(如:沙林,甲氟磷酸
对硫磷造成旳死亡率是令
异丙酯)。另某些同属构
人震惊旳:1958年在印度
造成为农药。
有l00起致命旳病例,叙利
亚有67起;在日本,每年
平都有336人中毒致死。
2、多氯联苯(polychlorinated biphenlys)
——米糠油事件。1968年,日本九州爱知县一带在生产米糠 油过程中,因为生产失误,米糠油中混人了多氯联苯(作脱 臭工艺中旳热载体 ),致使1400多人食用后中毒,4个月后, 中毒者猛增到5000余人,并有16人死亡。与此同步,用生产 米糠油旳副产品黑油做家禽饲料,又使数十万只鸡死亡。
环境化学-第三章-水环境化学-第二节-水中无机污染物的迁移转化

对于其他金属碳酸盐则可写为: -lg[Me2+] =0.5p Ksp -0.5pα2 由2 [Me2+] + [H+] = [HCO3-] + 2[CO32-] + [OH-]得: (Ksp/α2)1/2 (2 – α1- 2α2) + [H+] – Kw/[H+] = 0
当pH > pK2 时,α2≈1,CO32-为主,lg[Ca2+] = 0.5 lg KSP
四、氧化还原
氧化-还原平衡对水环境中无机污染物的迁移转化 具有重要意义。水体中氧化还原的类型、速率和平衡, 在很大程度上决定了水中主要溶质的性质。例如,厌 氧型湖泊,其湖下层的元素都将以还原形态存在;碳 还原成-4价形成CH4;氮形成NH4+;硫形成H2S;铁 形成可溶性Fe2+。其表层水由于可以被大气中的氧饱 和,成为相对气体性介质,如果达到热力学平衡时, 则上述元素将以氧化态存在:碳成为CO2;氮成为 NO3-;铁成为Fe(OH)3沉淀;硫成为SO42-。显然这种 变化对水生生物和水质影响很大。
发生吸附的表面净电荷的符号 - 金属离子所起的作用 吸附时所发生的反应 发生吸附时要求体系的pH值 吸附发生的位置 对表面电荷的影响 反离子
阳离子交换 配位体交换 >零电位点 任意值 扩散层 无 内层 负电荷减少 正电荷增加
(2)吸附等温线和等温式:在固定温度下,当吸附达到平 衡时,颗粒物表面的吸附量(G)与溶液中溶质平衡浓度
达到临界状态,就可以发生快速凝聚。
三、溶解和沉淀
溶解与迁移 实际溶解沉淀过程的复杂性 1、氧化物和氢氧化物:氧化物可以视作氢氧化物的脱水产物 Me(OH)n (s) Men+ + n OH根据溶度积: Ksp= [ Men+ ] [ OH- ]n 可转化为: [ Men+ ] = Ksp / [ OH- ]n = Ksp[ H+] / Kwn -lg [ Men+ ] = -lgKsp – n lg [ H+ ] + n lgKw pc = pKsp- n pKw + n pH = pKsp – n pOH 可以做 pc-pH 图,斜率等于 n,即金属离子价; 截距是 pH = 14 - (1/n)pKsp。
(完整版)第三章水环境化学答案

第三章水环境化学1、请推导出封闭和开放体系碳酸平衡中[H 2CO 3*]、[HCO 3-]和[CO 32-]的表达式,并讨论这两个体系之间的区别。
解: 开放体系,考虑到CO 2在气液相之间的平衡,[H 2CO 3*] 不变根据亨利定律: [CO 2(aq)] = K H Pco 2 lg[H 2CO 3*] ≈ lg[CO 2(aq)] = lg K H + lg Pco 2 = - 4.9lg[HCO 3-] = lg K 1 + lg [H 2CO 3*] + pH= -11.3 + pHlg[CO 32-] = lgK 1 + lgK 2 + lg[H 2CO 3*] + 2pH= -21.6 + 2pH*][][][*][]][[32133231CO H H K HCO CO H HCO H K +--+==*][][][*][][][32221233223221CO H H KK CO CO H CO H K K +--+⋅==⋅][][][233*32--++=CO HCO CO H C T 是常数。
的总和为各种碳酸化合态浓度假设,T C TC HCO ⎥⎦⎤⎢⎣⎡-=31αTC CO ⎥⎦⎤⎢⎣⎡-=232αTC CO H ⎥⎦⎤⎢⎣⎡*=320α122122][][1(-+++=K H K K H α1211)][][1(-++++=H K K H α122110][][1(-++++=H K K H K α*][][][*][]][[32133231CO H H K HCO CO H HCO H K +--+==*][][][*][][][32221233223221CO H H K K CO CO H CO H K K +--+⋅==⋅][][][][21233*32+--H K K CO HCO C CO H T 和含有的表示式,,为变量表示以:,][],[*],[21023332得到,,代入把αααT C CO HCO CO H --eg oo d 2、请导出总酸度、CO 2酸度、无机酸度、总碱度、酚酞碱度和苛性碱度的表达式作为总碳酸量和分布系数(α)的函数。
环境化学重点

= 4.69×10-11×1.00×10-3 /1.00×10-8
例2
(p156)
4.69 10 0.469 , 10 [ HCO3 ] 1.00 10 [CO3 ]
若水体 pH升高到10.00, 碱度仍保持1.00×10-3 mol/L,再计算 该水体中各碱度成分的浓度。 碱度 = [ HCO3-] + 2[CO32-] + [OH-] [OH-] = 1.00×10-4 mol/L 1.00×10-3 = [HCO3-] + 2[CO32-] + 1.00×10 -4
= 2 酚酞碱度 – 总碱度
B、酸度(Acidity):指水中能与强碱发生中和作用的全 部物质,亦即放出 H+ 或经过水解能产生 H+ 的物质总 量。组成水中酸度的物质可归纳为三类:强酸弱酸和 强酸弱碱盐。
无机酸度:以甲基橙为指示剂滴定到 pH = 4.3
无机酸度 = [H+] - [HCO3-] - 2 [CO32-] - [OH-]
试计算25度,标准大气压下,水中有机物浓 度是多少时, 可基本消耗全部的氧气?
(3)气体在水中的溶解性
氧气溶解度随着温度的变化,要求会计算。
Lg(C2/C1) = △H / (2.303R) ( 1/T1 - 1/T2 )
当温度从0 ℃升到35 ℃时,氧在水中的溶解度将从 14.74mg/L降低到7.03mg/L。
水资源
地球上水贮量13,9亿,其中97%为海洋淡水, 不能直接利用。 水是人类发展不可缺少的自然资源,是人类 和一切生物赖以生存的物质基础。人类对水 资源的开发和利用包括: A直接利用,数量和质量会发生变化; B水能的利用,发展水运等,无量的消耗。
水环境化学讲义精选全文完整版

可编辑修改精选全文完整版水环境化学讲义水圈包括海洋水、大气水、陆地水。
陆地水包括:地下水:潜水,承压水,冻土水,岩石、土壤分子水。
地表水:冰帽水、径流水、湖泊水、沼泽水。
生物水。
从分子与溶液的角度看水与天然水作为分子的水的组成、结构、特性:易作溶剂:氢键、异性相吸、六边形、较大分子间隙。
作为溶液的天然水的物理化学性质粘度:流体运动过程中,分子之间形成的剪切应力的物理量,水的粘度相对较大且随温度升高而急剧减少。
离子活度(ɑ)及离子强度(L)离子活度系数:反映溶液体系中某离子表现活性的物理量。
当量数:相当于1摩尔氢离子所含电子量的物理化学量。
当量浓度:1L溶液中所有某种物质的当量数的量。
当量=【M Zi】/|Zi| ,摩尔浓度【M Zi】=|Zi|*当量。
一切化学反应都是当量平衡。
离子缔合体。
范德华力包括静电力、诱导力、色散力。
溶液体系中因分子与分子间碰撞作用形成的离子束称为离子缔合体。
第二章天然水化学成分最早形成于大气层(凝结核),成分的直接影响因素包括生物、土壤、岩石。
生物是最大来源;成分的间接影响因素包括气候、地貌(接触时间)、水文要素(容量、流速等)天然水主要离子化学水化学反应回顾:(1)中和反应(2)沉淀-溶解反应:CaCO3<==>Ca2++CO32-(3)氧化还原反应(4)水解反应Fe3++3OH-<==>Fe(OH)3↓Fe(OH)3+3OH-<==>Fe(OH)63-未脱水而先形成配位体(配位反应特例)(5)配位反应Fe3++CN-<==>Fe(CN)63-氰化物处理(6)置换反应(7)吸附-解吸反应:2Na++Mg(胶体)2+<==>(Na胶体Na)2++Mg2+ 2Na++Cd(胶体)2+<==>(Na胶体Na)2++Cd2+骨痛病(8)缔和反应:在离子强度很高的条件下发生。
AgCl+Cl -<==>AgCl2-标准海水矿化度35.5g/L ,碱金属一般不发生配位反应。
水文地球化学课后思考题

复习题与思考题1. 名词解释(1)阳离子交换容量;(2)弥散通量;(3)水文地球化学;(4)水动力弥散;(5)弥散问题数学模型;(6)大陆效应;地下水污染;(7)碱度;(8)酸度;(9)硬度;(10)永久硬度;(11)暂时硬度;(12)碳酸盐硬度;(13)非碳酸盐硬度;(14)生化耗氧量(BOD);(15)化学耗氧量(COD)(16)物理吸附;(17)化学吸附;(18)离子交替吸附作用;(19)阳离子交换容量;(20)同位素效应;(21)同位素分馏;(22)同位素交换反应;(23)射性同位素的半衰期;(24) TDS;(25)全等溶解;(26)非全等溶解;2.思考并回答下列问题绪论(1)试说明水文地球化学的含义。
(2)试说明水文地球化学作为一个独立学科的发展历史。
(3)说明水文地球化学的研究意义。
第一章地下水的化学成分(1)试说明水的结构特征。
(2)水有那些特异性质,试分别对其予以说明。
(3)地下水的化学成分有那几类,分别予以简要说明。
(4)通常有哪些方法可用来对水质分析结果进行检验?(5)地下水化学成分的图示方法有哪些?试分别予以简要说明。
第二章地下水化学成分的形成作用(1)怎样根据化学反应的自由能资料计算反应的平衡常数?(2)水溶液中组分活度系数的计算方法主要有哪些?试说明其适用条件。
(3)试说明影响矿物在水中溶解度的因素。
(4)试分别说明纯水中石膏、萤石、石英、三水铝石溶解度的计算方法。
(5)试说明矿物稳定场图的绘制方法。
(6)试定性地说明为什么在CO2-H2O系统中水溶液显酸性,而在CaCO3-H2O系统中水溶液显碱性。
(7)已知H2CO3的一、二级电离常数分别为K a1和K a2,试导出CO2──H2O系统中:溶解碳总量为C T、氢离子浓度为[H+]时,H2CO3、HCO3-和CO32-含量的计算公式。
若25℃时,K a1=10-6.35、K a2=10-10.33,试分析说明上述组分中那一种组分在什么样的pH区间内含量最大?(8)在CO2分压(p)已知的CO2—H2O系统中,已知下述反应的平衡常数分别为CO2分压为10-3.5(atm),水的离子积为10-14,且上述反应均已达到平衡状态。
水环境化学知识点总结

15
27、天然水体中重要的无机配体有:OH-、Cl-、 CO32-、HCO3-、F-、S2-、CN-、NH3
28、不易水解的有机污染物:烷烃 烯烃 芳香烃 硝基苯 杂环化合物 PCBs醇类 醚类 羧酸
易水解的有机污染物:卤代烷烃 酰胺 胺 羧酸酯 氨基甲酸盐 环氧化物 腈类 有机磷酸酯 尿素类 磺 酸酯 酐
22、金属污染物 :Cd、 Hg、 Pb、 As、 Cr、 Cu、 Zn、 Tl、 Ni、Be
2021/10/10
14
23、环境中某一重金属的毒性与其 游离金属离子 浓度 、 配合作用 、和 化学性质 有关。
24、TN 、 TP 总磷、总氮和 COD常衡量水体富 营养化的指标。
25、水体的自净作用可分为 物理作用、化学作用 和生物作用。
2021/10/10
7
14、沉淀物中重金属重新释放诱发因素:①盐浓 度升高:碱金属和碱土金属阳离子可将被吸附在 固体颗粒上的金属离子交换出来。②氧化还原条 件的变化:有机物增多,产生厌氧环境,铁猛氧 化物还原溶解,使结合在其中的金属释放出来。 ③pH值降低:氢离子的竞争吸附作用、金属在低 pH值条件下致使金属难溶盐类以及配合物的溶解。 ④增加水中配合剂的含量:天然或合成的配合剂 使用量增加,能和重金属形成可溶性配合物,有 时这种配合物稳定性较大,以溶解态形式存在, 使重金属从固体颗粒上解吸下来。
3、水体中可能存在的碳酸组分 CO2、 CO32-、HCO3-、H2CO3 ( H2CO3*)
2021/10/10
2
4、天然水中的碱度和酸度:碱度:水中能与强酸 发生中和作用的全部物质,即能够接受质子H+的 物质总量;酸度:凡在水中离解或水解后生成可 与强碱(OH-)反应的物质(包括强酸、弱酸和 强酸弱碱盐)总量;即水中能与强碱发生中和作 用的物质总量。
养殖水环境化学实验

或
{V样 }mL
1000
{Cl- }mg/L 35.45 1000 {V样}mL 式中: 硝酸银标准溶液对氯离子的滴定度; TAgNO / Cl cAgNO3 准溶液浓度。
3
({V1}mL {V0 }mL ) {cAgNO3 }mol/L
为硝酸银标
思考题
滴定过程中为何要剧烈摇荡? 滴定过程中为何要控制酸度在一定范围? 铬酸银沉淀为砖红色,滴定终点的颜色为什么定为淡砖红色,而不是 砖红色?
主要仪器
150mL锥形瓶、25mL棕色酸式滴定管、50mL和25mL移液管等。
试剂
1.氯化钠标准溶液(cNaCl = 0.01410mol/L):称取0.4121g,溶于 纯水中,在容量瓶中稀释至500mL。此标准溶液1mL含0.5000mg 氯化物(以Cl-表示)。 2.硝酸银标准溶液:称取2.40g硝酸银,溶于纯水并稀释至1000mL, 贮于棕色瓶中。准确浓度需要标定。 3.铬酸钾溶液(50g/L):称取5.0g铬酸钾溶于少量纯水中,再稀释至 100mL。
HCO3
50.00
• 当VT<2VP时: 1000 (2V c
2
{c1 CO2- }mmol/L
3
1000 {cHCl }mol/L 2{VP }mL 5cHCl mol/L 50.00
OH-
mmol/L
c
1 CO23 2
实验一、氯离子及盐度的测定
氯离子的测定原理
在中性至弱碱性范围内(pH6.5~10.5),以铬酸钾为指示剂, 用硝酸银溶液滴定氯化物时,由于氯化银的溶解度小于铬酸银, 当氯离子被完全沉淀后,银离子就与铬酸根离子生成砖红色铬酸 银沉淀,使白色混浊溶液中出现稳定的砖红色成分,便指示终点 到达。沉淀滴定反应如下: Ag++ClAgCl 2Ag++ CrO42Ag2CrO4 (砖红色)
环境化学复习题库(含答案)

环境化学复习题库(含答案)环境化学复习题库第一章绪论一、填空1、造成环境污染的因素有物理、化学和生物的三方面,其中化学物质引起的约占__80%-90%_。
2、环境化学研究的对象是: 环境污染物。
3、环境中污染物的迁移主要有机械、物理-化学和生物迁移三种方式。
4、人为污染源可分为_工业_、__农业_、__交通_、和__生活_。
5、如按环境变化的性质划分,环境效应可分为环境物理、环境化学、环境生物三种。
二、选择题1、属于环境化学效应的是 AA热岛效应 B温室效应 C土壤的盐碱化 D噪声A _污染水体后引起的 2、五十年代日本出现的痛痛病是由___A CdB HgC PbD As 3、五十年代日本出现的水俣病是由_B__污染水体后引起的A CdB HgC PbD As 三、问答题1、举例说明环境效应分为哪几类,2、举例简述污染物在环境各圈的迁移转化过程。
第二章大气环境化学一、填空题1、写出下列物质的光离解反应方程式:(1)NO + hν NO + O 2(2)HNO+ hν HO + NO 或HNO+ hν H + NO 2 2 2(3)HNO+ hν HO + NO 3 2(4)HCO + hν H + HCO 或HCO + hν H + CO 222(5)CHX + hν CH + X 332、大气中的NO可以转化成 HNO 、 NO和 HNO 等物质。
23333、碳氢化合物是大气中的重要污染物,是形成光化学烟雾的主要参与者。
4、乙烯在大气中与O的反应机理如下: 3CH(O)CH 232第 1 页共 10 页环境化学复习题库+ CH == CH HCO+HCOO O322225、大气颗粒物的去除与颗粒物的粒度、化学组成和性质有关,去除方式有和湿沉降两种。
干沉降6、制冷剂氯氟烃破坏臭氧层的反应机制是:CFmCln + hv CFmCln-1 + ClCl + O O + ClO 32ClO +O O + Cl 27、当今世界上最引人瞩目的几个环境问题中的____温室效应_____、___臭氧层破坏_______、光化学烟雾___等是由大气污染所引起的。
2024年环境化学(带)

环境化学(带附件)环境化学是一门研究化学物质在环境中的存在、迁移、转化、归趋和影响的科学。
它是环境科学与化学的交叉学科,旨在揭示化学物质与环境的相互作用规律,为环境保护和污染控制提供科学依据。
本文将从环境化学的定义、研究内容、研究方法和发展趋势等方面进行阐述。
一、环境化学的定义环境化学是研究化学物质在环境中的行为、效应及其与环境相互作用的科学。
它关注化学物质在空气、水、土壤、生物等环境介质中的分布、迁移、转化、降解和生物可利用性等方面。
环境化学的研究对象包括自然环境中存在的化学物质和人类活动排放的化学物质。
二、环境化学的研究内容1.环境分析化学:研究环境中化学物质的检测、测定和监控方法,为环境化学研究提供数据支持。
2.环境污染化学:研究污染物的来源、排放、迁移、转化和归宿,探讨污染物的环境行为和生态效应。
3.环境生物化学:研究生物体与化学物质相互作用的规律,探讨化学物质对生物体的毒性、代谢和生物降解等过程。
4.环境催化化学:研究催化剂在环境污染物降解和资源化中的作用,为环境污染控制提供技术支持。
5.环境地球化学:研究地球表层环境中化学元素的分布、迁移和循环,探讨化学物质在地质历史演变中的作用。
6.环境化学污染控制:研究化学污染物的治理技术、政策和法规,为环境管理提供科学依据。
三、环境化学的研究方法1.采样与分析方法:采用现场采样、实验室分析和仪器检测等技术,获取化学物质在环境中的浓度、形态和分布等数据。
2.模型模拟方法:建立数学模型,模拟化学物质在环境中的迁移、转化和归趋过程,预测污染物的影响范围和程度。
3.实验室模拟方法:通过实验室模拟环境条件,研究化学物质的环境行为和生物效应。
4.现场监测方法:利用遥感、传感器等技术,实时监测环境中化学物质的浓度和分布。
5.联合研究方法:结合多种研究手段,从不同角度探讨化学物质与环境相互作用的过程和机制。
四、环境化学的发展趋势1.环境纳米化学:研究纳米材料在环境化学污染控制中的应用,探讨纳米技术在环境保护领域的潜力。
水环境化学3-3

S(VI)等,其被还原后依次被转变为H2O、Fe(II)、 Mn(II)、S(-II)等。 水中主要还原物质是各种有机化合物,有机化
合物被氧化后,生成各种复杂结构的物质。
由于天然水是一个复杂的氧化还原混合
体系, 其pE应介于其中各个单体系的pE之间,
而且接近于含量较高的单系pE值。
决定电位:某个单体系的含量比其他体系高
5、无机铁的氧化还原
天然水中的铁主要以Fe(OH)3(s)或Fe2+形态 存在。铁在高pE水中将从低价氧化成高价态或 较高价态,而在低的pE水中将被还原成低价态 或与其中硫化氢反应形成难溶的硫化物。
现以Fe3+-Fe2+-H2O体系为例讨论 pE 对铁形态浓度的影响 。 设总溶解铁浓度为1.0×10-3mol/L :
2
NH3 Zn(NH3 ) 2
2
2
[ Zn(NH3 ) 2 ] K2 2.1 102 2 [ ZnNH3 ][NH3 ] Zn2 2 NH3 Zn(NH3 ) 2
2 2
[ Zn(NH3 ) 2 ] 2 K1 K 2 8.2 104 [ Zn2 ][NH3 ]2
令 pEθ = 1/n lg[K]
得 pE = pEθ + 1/n lg[氧化态]/[还原态]
根据Nernst方程:E = Eθ + 0.059/n lg[氧化态]/[还原态] 比较两式可得: pE=E/0.059 pEθ= Eθ /0.059
下面以Fe为例,讨论如何绘制pE—pH图。 假定溶液中溶解性铁的最大浓度为1.0×10-7mol/L, Fe的pE—pH图必须落在水的氧化还原限度内。
以pE对1gC作图
pE
0 -3 -6 -9 -12 -15 -6 -3 0 3 6 9 12
环境化学(第二版)课后习题参考答案

习题第一章绪论2、根据环境化学的任务、内容和特点以及发展动向,你认为怎样才能学好环境化学这门课?环境化学是一门研究有害化学物质在环境介质中的存在、化学特征、行为和效应及其控制的化学原理和方法的科学。
环境化学以化学物质在环境中出现而引起环境问题为研究对象,以解决环境问题为目标的一门新型科学。
其内容主要涉及:有害物质在环境介质中存在的浓度水平和形态,潜在有害物质的来源,他们在个别环境介质中和不同介质间的环境化学行为;有害物质对环境和生态系统以及人体健康产生效用的机制和风险性;有害物质已造成影响的缓解和消除以及防止产生危害的方法和途径。
环境化学的特点是要从微观的原子、分子水平上来研究宏观的环境现象与变化的化学机制及其防治途径,其核心是研究化学污染物在环境中的化学转化和效应。
目前,国界上较为重视元素(尤其是碳、氮、硫和磷)的生物地球化学循环及其相互偶合的研究;重视化学品安全评价、臭氧层破坏、气候变暖等全球变化问题。
当前我国优先考虑的环境问题中与环境化学密切相关的是:以有机物污染为主的水质污染、以大气颗粒物和二氧化硫为主的城市空气污染;工业有毒有害废物和城市垃圾对水题和土壤的污染。
3、环境污染物有哪些类别?主要的化学污染物有哪些?按环境要素可分为:大气污染物、水体污染物和工业污染物。
按污染物的形态可分为:气态污染物、液态污染物和固体污染物;按污染物的性质可分为:化学污染物、物理污染物和生物污染物。
主要化学污染物有:1.元素:如铅、镉、准金属等。
2.无机物:氧化物、一氧化碳、卤化氢、卤素化合物等3•有机化合物及烃类:烷烃、不饱和脂肪烃、芳香烃、等;4. 金属有机和准金属有机化合物:如,四乙基铅、二苯基铬、二甲基胂酸等;5. 含氧有机化合物:如环氧乙烷、醚、醛、有机酸、酐、酚等;6. 含氮有机化合物:胺、睛、硝基苯、三硝基甲苯、亚硝胺等;7. 有机卤化物:四氯化碳、多氯联苯、氯代二噁瑛;8. 有机硫化物:硫醇、二甲砜、硫酸二甲酯等;9. 有机磷化合物:磷酸酯化合物、有机磷农药、有机磷军用毒气等。
第三章水环境化学-第三节水中有机污染物的迁移

在文献报道中,常用的确定亨利常数的方法是: KH'=ca/cw
KH'=KH /(RT)=KH/(8.31T) = 4.1×10-4KH 对于微溶化合物,(摩尔分数<0.02),亨利常数的 估算公式为:
KH =ps•Mw/Sw KH'=0.12ps·Mw/Sw·T)
2021/7/22
Kh表示水解速率常数
水解速率与pH有关, Mabey等学者将水解速率归结为 由酸性催化、碱性催化和中性过程三个部分,因而水 解速率可表示为在某一pH条件下的准一级反应。
则水解速率常数为
R H K h [ C ] K A [ H ] K N K B [ O ] C H K hK AH K NK H B K W
直接光解光量子产率φd
dc dt Iad
Iad-化合物吸收光的速率,C-化合物的浓度.
对一个化合物来讲Φd是恒定的,与所吸收光子的波 长无关,而且Φ常常小于或等于1。
光解速率 RP 取决于污染物吸收光的平均速率 Ia′和光量子产率 Φ两个方面;
若
( IaKaC )
Ka Ka
则 RPKPC ,KP表示光降解速率常数
2005吉林石化苯爆炸
硝基苯
松花江
2021/7/22
背景介绍:
2005年11月13日,中国石油吉林石化分公司双苯厂硝基 苯精馏塔发生爆炸,造成8人死亡,60人受伤,直接经济 损失6908万元。 事故形成的硝基苯污染带流经吉林、黑龙江两省引发松 花江水污染,在国内历时42天,12月25日进入俄罗斯。 水污染导致下游哈尔滨市供水中断,瓶装饮用水迅速脱 销,全市浴池、洗车行、美容院紧急封停;部分企业停工; 哈尔滨全市中小学被迫停课。
环境化学名词解释

名词解释1、环境污染——由于人为因素使环境的构成或状态发生变化,环境素质下降,从而扰乱和破坏了生态系统和人们的正常生活和生产条件,就叫环境污染。
2、环境化学——是在化学科学的传统理论和方法基础上发展起来的,以化学物质在环境中出现而引起的环境问题为研究对象,以解决环境问题为目标的一门新兴学科。
3、污染物的迁移——指污染物在环境中所发生的空间位移及其所有引起的富集、分散和消失的过程。
4、化学污染物——是指由人类活动产生的天然环境化学组分共存和相互作用又可能产生不良生态效应或健康效应的化学物质。
5、环境污染化学——主要研究化学污染物在生态环境体系中的来源、转化、归宿及生态效应的学科。
又分为大气、水体和土壤三个部分。
6、光化学烟雾——碳氢化合物和氮氧化物等一次污染物在强烈太阳光作用下发生化学反应而生成一些氧化性很强的二次污染物(如臭氧、PAN,硝酸等),这些反应物和产物的混合物所形成的烟雾,称光化学烟雾。
7、温室效应——大气具有易使太阳短波辐射到达地面而拦截地表向外放出长波辐射的作用,而使地球表面温度升高的现象。
8、积聚膜——DP在 0.05~2 um范围内,主要来源于爱根核膜的凝聚,燃烧过程所产生蒸汽冷凝、凝聚,以及由大气化学反应所产生的各种气体分子转化成的二次气溶胶等。
积聚膜的粒子不易被干、湿沉降去除,主要的去除途径是扩散,这两种膜合称为细粒子。
9、爱根核膜——粒径小于0 .05um,主要来源于燃烧过程所产生的一次气溶胶粒子和气体分子通过化学反应均相成核转换的二次气溶胶粒子,所以又称成核型。
10、酸雨——由于酸性物质的湿沉降而形成的。
11、粗粒子膜——DP大于2um,主要来源于机械过程所造成的扬尘,海盐溅沫、火山灰和风砂等一次气溶胶粒子,主要靠干沉降和雨水冲刷去除。
12、敏化光解——水体中存在的天然物质被阳光激发,又将其激发态的能量转移给化合物而导致的分解反应。
13、生物富集——是指生物通过非吞食方式,从周围环境蓄积某种元素或难降解物质,使其在机体内浓度超过周围环境中浓度的现象。
水环境化学3-2
三、溶解和沉淀
溶解表示了污染物在水环境中的迁移能力, 水对许多物质具有很强的溶解能力,原因是水 分子是极性分子,他对极性大的离子键化合物 比极性小的共价键化合物具有更强的溶解能力; 例如水对硫酸盐(金属与SO42-)的溶解能力远远 大于对硫化物(金属与S2-)的溶解能力。
一般金属化合物在水中迁移能力,直观地 可以用溶解度来衡量。溶解度小者,迁移能力 小。溶解度大者,迁移能力大。不过,溶解反 应时常是一种多相化学反应,在固—液平衡体 系中,一般需用溶度积来表征溶解度。 下面着重介绍金属氧化物、氢氧化物、硫化物、 碳酸盐及多种成分共存时的溶解—沉淀平衡问题。
水解
(3) 腐殖质
腐殖质是广泛存在于天然水中有机胶体物 质,主要是由植物残体(骸)及生物体死亡后, 被微生物分解而形成的有机物质,其组成比较 复杂,一般的说,腐殖质首先在土壤中生成, 由于土壤和水体相通,因此在水体也存在有相 当的数量,也有人指出,水体中的腐殖质有一 部分是在该水体系统中直接产生的。
水化学平衡发生变化 湖泊生态遭到严重破坏, 生物群落发生明显变化 湖泊内源物质的释放
水体污染
由于人类活动排放的污染物进入河流、湖泊、 海洋或地下水等水体,使水和水体底泥的物理、 化学性质或生物群落组成发生变化,从而降低了 水体的使用价值,这种现象称为水体污染。
水体的自净作用
污水排入水体后,一方面对水体产生污染,
(4)水体悬浮沉积物 天然水体中各种环境胶体物质往往并非单 独存在的,而是相互作用结合成为某种聚集 体,即成为水中悬浮沉积物,它们可以沉降 进入水体底部,也可重新悬浮进入水中。 一般,悬浮沉积物是以粘土矿物为核心 骨架,有机物和金属水合氧化物结合在其表 面成为各微粒间的粘附架桥物质,把若干微 粒组合成絮状聚集体,经絮凝成为粗颗粒降 到水体底部。 (5)其它 藻类、细菌、表面活性剂等也有类似胶 体化学表现。
第11讲_水中有机污染物的迁移转化

辐射的形式进行“去活化”再回到基态
(2) 光量子产率与直接光解速率
❖ 进行光化学反应的光子占吸收总光子数之比, 称为光量子产率(Φ)。
生成或破坏给定物种的摩尔数 体系吸收光子的摩尔数
波长为的光所引起的直接光解速率 : dc
dt
I '
K c
假设与波长无关,则全波段光所引起的直接光解速率 :
RP
dc
dt
K c d c
K
d
设, KP K d,
则, RP
dc dt
KPc
c c0 exp(KPt),
t1/ 2 0.693 / K P
(3)水中化合物的直接光解反应
水解速率与pH的关系
❖ Mabey等把水解速率归纳为
◎酸性催化过程 ◎碱性催化过程 ◎中性催化过程
❖ 水解速率为三个催化过反应速度的和:
-
d[RX] dt
K
h [RX]
Kh KA[H ] K N KB[OH-] KA[H ] K N KBK W /[H ]
式中:
KA—酸性催化二级反应水解速率常数; KB—碱性催化二级反应水解速率常数; KN—中性催化二级反应水解速率常数; Kh—在某一pH值下总水解速率常数。
速率
E(酶)+S(底物)
ES
E+P(产物)
R
dB dt
Y
dc dt
max
Bc Ks c
1 1 Ks 1
R B max max c
式中:c—污染物(底物)浓度; B—细菌浓度; Y—消耗一个单位碳所产生的生物量; µm a x — 最 大 的 比 生 长 速 率 ; K s — 半 饱 和 常 数 , 即 R / B = µm a x / 2 时 的 底 物 浓 度 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
迁移过程中,大部分重金属在水体 中的可溶态都是配合形态,随环境条件 改变而运动和变化。
至于毒性,自由铜离子的毒性大于 配合态铜;甲基汞的毒性大于无机汞。
1、天然水体中配合作用的特点
(Character of Complexation in Natrual Water Bodies)
(1)大多数配合物稳定地存在于水中;
(2)羟基、卤素配体的竞争配位作用, 影响金属难溶盐的溶解度; (3)重金属离子与不同配体的配位作用, 改变其化学形态和毒性。
2、分类 (Classification)
天然水体中常见的配位体可分为 无机和有机两类。 其中重要的无机配体有:OH-、Cl-、 CO32- 、 HCO3- 、 F- 、 S2- ,其中最重要的 无机配体是OH-、Cl-。
3、腐殖质形成的螯合物
腐殖质对环境中几乎所有金属离子都有螯合作用,尤其是对过渡金 属 螯 合 性 更 强 。 对 金 属 螯 合 能 力 强 弱 一 般 符 合 欧 文 - 威 廉 ( Irving-
Willian)次序,即
Mg<Ca<Cd<Mn<Co<Zn≈Ni<Cu<Hg
从海洋沉积物中分离出的腐殖质,其对金属的总螯合容量约97-150mg/g; 对于不同金属其螯合能力不同,Cu、Zn、Ni、Co、Mn,螯合容量分别为
无机螯合剂较少,如聚合磷酸盐,由相 邻的PO43-基团中的氧原子同金属离子形成环 状配位结构。
聚合磷酸盐最基本结构形式为:
(二) 配合物在溶液中的稳定性
稳定常数是衡量配合物稳定性大小的尺度,例如Zn(NH3)2+ 总反应 Zn2+ + 4NH3 = Zn(NH3)42+
可由下面反应生成
Zn2+ + NH3 = ZnNH32+ Zn2+ + NH3 = ZnNH32+
2、腐殖质的化学结构
腐殖质具有非常复杂的化学结构,而 且结构还随其来源(如土壤、淡水、海 水、褐煤、沉积物)而异。腐植酸分子 核心是一个含有大量有机杂原子基团的 高分子化合物,核心外围联结很多功能 基团。
腐殖质三种分子间的区别在于分子量 和官能团含量的不同。如腐植酸和胡敏 质比富里酸有更高的分子量和较少的亲 水官能团。总的来说,腐殖质的结构中 还有羧基、酚基、醇基、羰基等官能团.
络合物的特性。
人们利用这种特性将一些重金属盐类用作混
凝剂进行废水处理,取得了很好效果。
表
类别 名称 硫酸铝 氯化铝 含铁硫酸铝 硫酸铝钾 聚硫酸铝 聚氯化铝 硫酸亚铁 硫酸铁 三氯化铁 聚合硫酸铁 聚氯化铁 消石灰 氧化镁 碳酸镁
常用无机混凝剂
分子式 Al2(SO4)3·18H2O AlCl3 Al2(SO4)3+ Fe2(SO4)3 Al2(SO4)3·K2SO4·24H2O [Al2(OH)n(SO4)3-n/2]m [Al2(OH)nCl6-n]m FeSO4·7H2O Fe2(SO4)3·2H2O FeCl3·6H2O [Fe2(OH)n(SO4)3-n/2]m [Fe2(OH)nCl6-n+]m Ca(OH)2 MgO MgCO3 略记号 AS AC MIC KA PAS PAC FSS FS FC PFS PFC CHO MO MC 使用 pH
海水中腐殖质含量约占有机物总量的6%-30%, 一般在 100-300ug/l 范围内。海水中腐殖质经高分子 多孔聚合物 XAD-2 吸附浓集后,再用酸碱处理,即 可获得腐殖质的三种重要组分:
其中: (1)腐植酸,是能溶于碱而沉积于酸的组分; (2)富里酸,是兼能溶于酸和碱的组分; (3)胡敏质,是酸碱皆不溶的组分。
一类是简单配位化合物,包括单核配位化合物(如 Cu(NH3)42+)和多核配位化合物,如
OH ( H 2 O) 4 Fe OH Fe( H 2 O) 4
4
配位化合物的另一大类螯合物,是由多基配位体 与金属离子同时生成多齿配位键,构成环状螯合结构的 产物。 大多数螯合剂都是有机配体;
课后思考与作业
1.腐殖质的环境化学意义 ;腐殖质与金属离子间的螯 合方式有哪几种?
低分子 铝盐 高分子
6.0~8.5
6.0~8.5 8.0~11 4.0~11 4.0~11 4.0~11 4.0~11 9.5~14 9.5~14
低分子 铁盐 高分子
其他
低分子
(四) 腐殖质的配合作用 (Complexation of Humic Substances) 腐殖质是带负电荷的高分子弱电解质。 是生物体物质在土壤、水和沉积物中转化 而成。 多含有–COOH、–OH等。 分子量300-30000。
ZnNH32+ + NH3 = Zn(NH3)22+
Zn(NH3)22+ + NH3 = Zn(NH3)32+ Zn(NH3)32+ + NH3 = Zn(NH3)42+ K1 K2 K3 K4
Zn2+ + 2NH3 = Zn(NH3)22+
Zn2+ + 3NH3 = Zn(NH3)32+ Zn2+ + 4NH3 = Zn(NH3)42+ β1 β2 β3 β4
络离子的电荷降低,并且羟基数目增多, 都有利于羟基桥联,生成更高级的多核络合 物。
这里的水解和羟基桥联两种反应交替进行,其最 终结果则是生成难溶的氢氧化铝沉淀。
[Aln(OH)3n] → [Al(OH)3]n
除Fe3+和Al3+外,许多金属离子如Zn2+、Cu2+、
Mg2+ 、 Pb2+ 、 Hg2+ 、 Sn2+ 等,也都具有生成多核
为累积稳定常数(或累积生成常数):
[Zn( NH 3 ) 2 4 2 ] 2 K K 8 . 2 10 1 2 2 2 [Zn ][NH 3 ]
概括起来配合物反应的逐级生成常数和累积生成常数可 表示如下:
L L L M ML ML2 MLn
有机配体又可分为两大类:一类是水体 中动物、植物、微生物的新陈代谢产物或他 们残骸的分解物,其中最重要的是腐殖质, 此外还有泥炭、厩肥、植物残体、微生物的 代谢产物、动植物生活分泌物等; 另一类属于人为污染物,包括洗涤剂、 清洁剂、农药、表面活性剂如 NTA(氨基三 乙酸)、EDTA等。
天然水体中常见的配位化合物可分为两类:
2 [ Zn ( NH ) 2 2 2 ] 生成常数K2为 : K 2 . 1 10 2 [ZnNH3 ][NH 3 ]
这里 K1 、 K2 、 K3 、 K4 称为逐级生成常数(或逐级稳定 常数),表示NH3加至中心Zn2+上是一个逐步的过程。
累积稳定常数是指几个配位体加到中心金属离子过 程的加和。例如,Zn(NH3)22+的生成可用下面反应式表 示: Zn2+ + 2NH3 = Zn(NH3)22+
第三章 水环境化学
(Water Environmental Chemistry)
第一节
天然水的基本特征及污染物的存在形态
第二节 水中无机污染物的迁移转化 第三节 水中有机污染物的迁移转化 第四节 废水处理技术概述
《环境化学》 第三章 水环境化学
第二节
水中无机污染物的迁移转化 (Transport and Transformation of inorganic Pollutants)
(1)在pH较高的碱性溶液中或离子强度低的条件 下,羟基和羧基大多离解,使高分子呈现的负电 荷相互排斥,构型伸展,亲水性强,因而趋于溶 解。 ( 2 )在 pH 降低而呈酸性溶液中,或有较高浓度的 金属阳离子时,各官能团难于离解而电荷减少, 高分子趋于卷缩成团,亲水性弱,因而趋于沉淀 或凝聚。
1、腐殖质的生成及其主要成分
腐殖质的化学结构特征
( 1 )以碳链为骨架,以 —O— , —N— 为交联 基团; (2)含氢键,带有很多含氧功能基; (3)分子量大,如胡敏质、腐植酸分子量可达 几万; (4)分子内多处带有电荷,高度极性; (5)分子内蛋白质类和碳水化合物类的部分很 容易发生水解;芳香核部分不易发生化学降 解和生物降解。
一、污染物在颗粒物与水之间的迁移 (吸附-解吸) 二、溶解和沉淀
三、氧化-还原
四、配合作用
(一)概述
污染物特别是重金属大部分以配合物形 态存在于水体,其迁移、转化及毒性等均与 配合作用有密切关系。
例如,许多污染物就是以配合物的形式 排放,像无氰镀镉和有氰镀镉的废水中,镉 分别以氨羧酸配合物和氰络离子 Cd(CN)42- 的 形式排入水体中。生活污水中的洗涤剂也是 良好的配位体。
Zn2+ + NH3 = ZnNH32+
生成常数K1为:
[ ZnNH32 ] 2 K1 3 . 9 10 [ Zn 2 ][NH 3 ]
在上述反应中为了方便起见,把结合水省略了。 然后ZnNH32+继续与NH3反应,生成Zn(NH3)22+:
ZnNH32+ + NH3 = Zn(NH3)22+
67.4、26.1、17.4、9.6、5.6mg/g。
腐殖质与金属形成的螯合物一般都不溶于水; 富里酸与金属生成的螯合物相对易溶些,当 [FA]/[Me]>2时,倾向于易溶。
金属离子与富里酸生成螯合物的可溶程度
在pH=6-8范围内,天 然水中各金属离子与富里酸 生成螯合物的可溶程度如图 所示。 一般地说Fe3+、Cr3 + 、 Al3 + 、Pb2+、Cu2 +的螯合 物更为难溶,所以这些螯合 物容易在土壤或沉积物中富 集累积。
