第三章水环境化学.pptx
《水环境化学》课件

水环境化学的重要性 和应用
水环境化学对于保护水资 源、维护环境、促进可持 续发展具有重要的意义。
水的物理化学性质
溶解度溶解度是指单位体Fra bibliotek溶液中 最多能溶解多少物质,它是 表征物质在水中溶解程度的 重要参数。
离子强度
水中的离子强度是所有阴离 子和阳离子的浓度之和和它 们的电荷平方和之比的平方 根。
pH值
水环境监测方法
通过水质监测,及时发现水体 污染的情况,采取有效的技术 措施来防治和修复水体污染。
水环境化学的未来
1 水环境化学的发展趋势
未来水环境化学将逐渐转向绿色、可持续和低碳化发展。
2 水环境化学的应用前景
水环境化学需求将继续增长,未来将更多地应用于水资源保护、净化和开发领域。
3 水环境化学的挑战与机遇
水环境化学
水是地球上最珍贵的资源之一,水环境化学是研究水体的化学性质、污染及 其净化和水质监测的学科。
水环境化学简介
什么是水环境化学?
水环境化学是研究水及其 体系在自然界和生产生活 中的各种过程所涉及到的 化学现象的学科。
水环境化学的研究对 象和内容
研究水环境中各种物质的 迁移、转化和去除,以及 不同水环境对生态环境的 影响。
3
物理污染物
有些物理污染物如悬浮物、浮游生物、颗粒物或沉积物都会影响水的质量和可用性。
水的净化与处理
常见水污染物的去除方法
颗粒物、悬浮物主要通过过滤 和沉淀去除,生物污染物主要 通过消毒去除,化学污染物主 要依靠氧化、还原、沉淀和离 子交换等方法除去。
常见水处理技术及其原理
如生物处理、深度处理、反渗 透等技术,利用技术手段将水 中的污染物清除或降低到符合 生产和生活需求的标准。
第三章水环境化学

第三章水环境化学
18
第七节 有机污染物的水环境化学
7.1 有机物污染程度的指标
▪ 溶解氧 DO (dissolved oxygen) 水中溶解的氧的量。
耗氧作用:使 DO 下降,如耗氧有机物分解,生物 呼吸等。
复氧作用:使 DO 增加,如空气中氧的溶解,水生 植物的光合作用。
有机物的氧化分解需要消耗大量的氧,若有机物过多, 会造成水中 DO 量不断减少,可导致有机物缺氧分解而产生 腐败现象。
第三章 水环境化学
第三章水环境化学
1
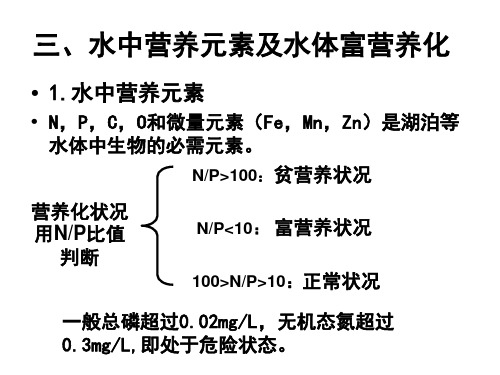
第六节 水体的氮、磷污染和富营养化
水体营养物增加导致水生植物(主要是浮游植 物和各种藻类)大量繁殖,水体溶解氧下降,水质 恶化,鱼类及其它生物大量死亡的现象。
在湖泊、水库、河口、港湾等水流缓慢的地 区最容易发生,是由氮、磷等化合物过多排入水 体所引发的二次污染现象。
第三章水环境化学
3
在适当的温度、光照和环境酸度下,天然水体中的藻 类进行光合作用,合成本身的藻类原生质。
106 CO2 + 16 NO3- + HPO42- + 122 H2O + 18 H+ + 能量 + 微量元素
C106H263O116N16P (藻类原生质) + 138 O2
藻类的繁殖中成为控制性因பைடு நூலகம்的是无机态的氮 和磷营养物。
第三章水环境化学
8
受蓝藻污染的太湖水
工作人员在打捞蓝藻
第三章水环境化学
9
第三章水环境化学
10
云南滇池的蓝藻污染
第三章水环境化学
11
云南滇池的蓝藻污染
第三章水环境化学
12
赤潮
第三章-水环境化学(第一次课)

ii 表示方法
总含盐量(Total Dissolved Solids-TDS),也称总矿化度: 水中所含各种溶解性矿物盐类的总量称为水的总含盐量。
总含盐量=Σ阳离子+Σ阴离子
iii 测定
重量法
总含盐量=溶解固形物
cT
[H
2 CO
* 3
](1
K1 [H
]
K1K 2 [H ]2
)
0
[H2CO*3
]
1
cT
(1
K1 [H ]
K1K 2 [H ]2
) 1
说明pH决定它们的 含量多少
1
[HCO
3
]
cT
[H ] (
K1
1
K2 [H
) ]
1
2
[CO32 ] cT
([H ]2 K1K 2
[H ] 1)1 K2
lg c2 H • ( 1 1 ) 15.59103 ( 1 1 ) c1 2.303R T1 T2 2.3038.314 298.15 273.15
c2 8.289 1.778 14.74mg / L
0 ℃时的含量14.74mg/L 20 ℃时为9.227mg/L
2.在一个标准大气压下,25℃时CO2在水中的溶解度。已知 CO2在干空气中的含量为0.0314%(体积)。
氧气的分压为
0.9813105 20.95% 0.2056105 Pa
[G(O2) ] KH PG 1.26108 0.2056105 2.590104 mol / L
[G(O2) ] 2.590104 32 8.289mg / L
环境化学课件第三章 水环境化学

图 水环境体系(水体)
<返回>
水环境化学是研究化学物质在天然水体中的存在形态、反应机制 、迁移转化和归趋的规律及其化学行为对生态环境的影响。水环 境化学是环境化学的重要组成部分,为水污染控制和水资源的保 护提供了科学依据。
水环境化学研究的领域包括河口、海洋、河流、湖泊等。
研究的特点是: (1)体系非常复杂 离子、分子、胶体微粒 (2)界面现象突出、重要 重金属、有机物附着在胶体微粒面
海湾 海
大洋 海洋沉积物间隙水
DP Dg K
P 0
水循环 Water cycle
1.水的自然循环: 特点:①由降雨量自然循环的大致尺度
②水的性质基本不变 2.水的社会循环 特点:①工业与生活污水的产生与排放是主
要的污染源 ②水的性质不断变化
水资源的主要问题
●我国水资源人均和亩均水量少; ●水资源在地区分布上很不均匀,水土资源 组合不平衡 ●水量年内及年际变化大,水旱灾害频繁 ●水土流失严重,许多河流含沙量大; ●我国水资源开发利用各地很不均衡
第三章 水环境化学 Aquatic chemistry
知识点:认识天然水的基本特征和污染物的分布形 态,掌握水中污染物的迁移转化规律,学 会建立水质模型
重 点:水中污染物的迁移和转化规律 难 点:水质模型的建立
水圈:Hydrosphere 1978年.R.A.Horne
《水环境化学》PPT课件

TDS=[K++Na++Ca2++Mg2+]+[HCO3-+NO3-+Cl-+SO 24
2、天然水的性质
(Characteristic of Natural Waters) (1)碳酸平衡(Balance of H2CO3) 水体中存在四种化合态:
CO2、CO32-、HCO3-、H2CO3
常把CO2和H2CO3合并为H2CO3*。
H2CO3*— HCO3-—CO32-体系可用下面 的反应和平衡常数表示:
CO2 + H2O = H2CO3* H2CO3* = H+ + HCO3HCO3- = H+ + CO323
pK0 = 1.46 pK1 = 6.35
pK2 = 10.3
α0 =[H2CO3* ]/{[H2CO3* ]+[HCO3- ]+[CO32]} α1= [HCO3- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]} α2 = [CO32- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]}
3、胶体相互凝聚
4. “边对面”絮凝
胶体颗粒凝聚方式
(Aggregation Way of Colloid Particulate)
(5)第二极小值絮凝; (6)聚合物粘结架桥絮凝; (7)无机高分子的絮凝; (8)絮团卷扫絮凝; (9)颗粒层吸附絮凝;
表面吸附
离子交换吸附
专属吸附
(1)吸附等温线和等温式
(Adsorption Isotherms and Isothermal Equation)
第3章:水环境化学

第3章:水环境化学
举例:水中可溶性金属离子可以多种形态存在。例如,铁可以
Fe(OH)2+、Fe(OH)2+、Fe2(OH)24+、Fe3+等形态存在。这些 形态在中性(pH=7)水体中的浓度可以通过平衡常数加以计算:
Fe3++H2O=Fe(OH)2++H+ [Fe(OH)2+][H+]/[Fe3+]=8.9×10-4
代入亨利定律即可求出氧在水中的摩尔浓度为:
[O2(aq)]= KH·=1.26×10-8×0.2056×105=2.6×10-4 mol/L 氧的分子量为32,因此其溶解度为8.32mg/L。
气 体 溶 解 度 随 温 度 升 高 而 降 低 , 这 种 影 响 可 由 Clausius-Clapeyron (克拉帕龙)方程式显示出:
CO2在水中离解部分可产生等浓度的H+和HCO3-。H+及HCO3-的浓度可 从 CO2的酸离解常数(K1)计算出: CO2+H2O CO2·H2O 亨利常数 KH [C=OP23CO H.232O 4]×10-7molL-1Pa-1
第3章:水环境化学
CO2·H2O HCO3-+H+ 一级电离
环境化学第三章__水环境化学(PPT)

第十二页,共九十页。
代入亨利定律即可求出氧在水中的摩尔(mó ěr)浓度为:
[O2(aq)]= KH·PO2=1.26×10-8×0.2056×105 =2.6×10-4 mol/L
氧的分子量为32,因此其溶解度为8.32 mg/L。
第三章 水环境 化学 (huánjìng)
第一节 天然水的根本特征及污染物的存在形态(xíngtài)
第二节 水中无机污染物的迁移转化 第三节 水中有机污染物的迁移转化
第一页,共九十页。
内容提要: 本章主要介绍天然水的根本特征,水中重要污染物存在形态及分布, 污染物在水环境中的迁移转化(zhuǎnhuà)的根本原理。
第二十三页,共九十页。
❖❖[图CO中3的2p-]H可=以8.3忽可略以不作计为,一水个分中界只点有,[CpOH2<〔8.a3q,〕很]、小[,H22CO3]、
❖[HCO3-],可以只考虑一级电离平衡(pínghéng),即此时:
❖
❖❖❖当溶所液以的ppHH>=8p[.3KH时1-],lg[[KHH122[CC[HHOO23C3C**]OO3]+3可*]l]g以[H忽C略O不3-计]。,水中只存在
P↑↓R
C 1 0 6H 2 6 3 O 1 1 0N 1 6P 1 3 8 O 2
第十七页,共九十页。
〔二〕天然水的性质(xìngzhì)
1、碳酸平衡〔重点〕
对于CO2-H2O系统,水体中存在着CO2〔aq〕、H2CO3、HCO3-和CO32-等 四种化合态,常把CO2(aq)和H2CO3合并为H2CO3*,实际上H2CO3含量 (hánliàng)极低,主要是溶解性气体CO2(aq)。
水环境化学 ppt课件
(2)金属水合氧化物:
褐铁矿:Fe2O3﹒nH2O
水化赤铁矿:2Fe2O3﹒H2O 得到具有重要胶体作用的:
针铁矿:Fe2O3﹒H2O 水解 [FeOOH]∞聚合无机高分子
水铝石:Al2O3﹒H2O
[Al(OH)3]∞聚合无机高分子
三水铝石:Al2O3﹒3H2O
[MnOOH]∞聚合无机高分子
二氧化硅凝胶:SiO2﹒nH2O
水环境中发现的腐殖质大部分为富里酸这一 类,原因在于易溶于水,来源有二:一部分是水 生植物的分泌物和降解产物;另一部分来自土壤, 由土壤淋溶液和泾流带入水体。河水中腐殖质平 均含量在10~15mg/L,但起源于沼泽地带的河流 其含量要丰富的多。
水体污染
由于人类活动排放的污染物进入河流、湖泊、 海洋或地下水等水体,使水和水体底泥的物理、 化学性质或生物群落组成发生变化,从而降低了 水体的使用价值,这种现象称为水体污染。
水体的自净作用 污水排入水体后,一方面对水体产生污染,
另一方面水体本身有一定旳净化污水能力,即经 过水体的物理、化学与生物的作用,使污染物浓 度逐渐降低,经过一段时间后,水体往往能恢复 到受污染前的状态,并在微生物的作用下分解, 从而使水体由不洁恢复为清洁,这一过程称为水 体的自净过程。
• 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭
• “不怕太阳晒,也不怕那风雨狂,只怕先生骂我 笨,没有学问无颜见爹娘 ……”
• “太阳当空照,花儿对我笑,小鸟说早早早……”
藻类疯长; 藻类尸体分解引起水体溶氧下降; 水体发臭; 水生生物死亡; 绿藻和硅藻由蓝藻取代产生藻毒素。
▪举例:触目惊心的赤潮中毒事件
➢赤潮区域内,某些赤潮生物分泌赤潮毒素,污染鱼、贝 类等生物,生物毒素可在这些生物体内蓄积,当毒素的蓄 积量超过人体可接受的水平时,人一旦食用了这些生物, 就会导致疾病发生,甚至会爆发传染病。
3章水环境化学

界第6位。但由于人口众多,人均水资源占有量
不足,仅为2200立方米,约为世界人均占有量
的1/4,被列为世界几个人均水资源贫乏的国家
之一。
9
我国水资源现状:
水资源时空分布不均,南多北少:
比如,黄淮海流域人口占全国的34.7%,水
资源量却只占全国的7.6%,人均水资源量仅有
重的缺水期。
这份报告还称,2030年,我国将缺水400-500亿立 方米,缺水高峰将会出现。
12
13
水的循环
14
第一节 天然水的基本特征及污染物的 存在形态
一、天然水的基本特征
在水污染化学中,水体指河流、湖泊、沼泽、
水库、地下水、冰川、海洋等贮水体的总称。
水体的组成不仅包括水,而且也包括悬浮物
24
自养生物—利用太阳能或化学能把简单无生命的无机 物引进复杂的生命分子中,组成生命体。 异养生物—利用自养生物产生的有机物作为能源及合 成它自身的原始物质。
利用太阳能从无机矿物合成有机物的生物体称为生产
者,水体产生生物体的能力称为生产率,生产率是由
化学及物理的因素相结合而决定的。
在高生产率的水体中藻类生产旺盛,死藻的分解引起 水中溶解氧水平的降低,这就是水体的富营养化。在 许多情况下,P(磷酸盐)是限制的营养物。
【教学重点】:天然水的基本特征;水质标准
和指标;水中常见化合物、污染物存在形态及分 布;污染物在水环境中的迁移转化的基本原理。
【教学难点】:水中重要污染物存在形态及分
布;污染物在水环境中的迁移转化的基本原理。
【教学课时数】:8学时
6
概述
[课件]第三章 水环境化学(2)PPT
![[课件]第三章 水环境化学(2)PPT](https://img.taocdn.com/s3/m/9485c8f349649b6648d74726.png)
2、多氯联苯(polychlorinated biphenlys)
二、水中污染物的分布和存在形态
功绩:为 20世纪上半叶防止农业病虫 (一)有机污染物 害,减轻疟疾伤寒等蚊蝇传播的 疾病 危害起到了不小的作用。 1948年诺贝 1、农药(主要是有机氯和有机磷) 尔生理学和医学奖给了米勒。
DDT (Dichloro Diphenyl Trichloroethane):双对氯苯基三氯乙 烷,化学式(ClC6H4)2CHCCl3
——米糠油事件。1968年,日本九州爱知县一带在生产米糠 油过程中,由于生产失误,米糠油中混人了多氯联苯(作脱 臭工艺中的热载体 ),致使1400多人食用后中毒,4个月后, 中毒者猛增到5000余人,并有16人死亡。与此同时,用生产 米糠油的副产品黑油做家禽饲料,又使数十万只鸡死亡。 PCBs Biphenly 1978-1979年间为期6个月的时间里,台湾油症地区约 2000人食用了受多氯联苯和多氯联二苯并呋喃污染的食用油。 多氯联苯从热交换器漏入成品油中。一部分多氯联苯受热后 多氯联苯极难溶于水,不易降解,易溶于有机溶剂和脂肪中, 降解产生了多氯二苯并呋喃和其他氯化物,造成了高达数万 具有高的辛醇-水分配系数,能强烈的分配到沉积有机质和生 人的患者。 物脂肪中,因此,即使它在水中浓度很低时,在水生生物体内 1986年,加拿大一辆卡车载着一台有高浓度多氯联苯液 体的变压器去废物储存场,途中在经过安大略省北部的凯拉 和沉积物中的浓度仍然可以很高。由于 PCBs在环境中的持久 城附近时,有400多升PCBs从变压器中泄漏,污染了100公 性、生物累积性、远距离迁移性及对人体健康的危害, 1973年 里的高速公路和其它车辆,对当地的居民身体健康造成极大 以后,各国陆续开始减少或停止生产。 伤害。
第3章水环境化学

二氧化碳在水中的溶解度: (25℃)
Pco2 =(1.0130-0.03167)×105×3.14×10-4 = 30.8 (Pa)
[CO2(aq)] = KH Pco2 = 3.34×10-7×30.8 = 1.028×10-5 mol.L-1
CO2含量超过平衡容量,过量CO2会使CaCO3溶解,这部分CO2称为侵蚀性CO2,侵
蚀性CO2对水下混凝土建筑起破坏作用。
硬度 水中硬度决定于钙、镁离子的总量。硬度的表示方法各
国不统一,我国也不一致,在《生活饮用水的水质标准》中规定 总硬度(以碳酸钙计)小于450mg/L,也可用小于250mg/L(以
H2CO3*
HCO3-COΒιβλιοθήκη 2-lg C6.35
10.33
pH
(2)开放体系(所研究的过程在长时间内发生时采用开放体系 )
CO2在气相和液相之间达到平衡,此时 [H2CO3* ] = [CO2 (aq)]
而[CO2 (aq)]根据亨利定律可以算出: [CO2 (aq)] = KH Pco2
因此,pH变化时,开放体系中[H2CO3* ] 不变,而CT, [HCO3- ],以 及[CO32- ]改变
性CO2; ③有机物指标:溶解氧、化学需氧量(COD)、生化需氧量
(BOD)、总需氧量(TOD)、总有机碳(TOC)等。
1、物性指标
温度 水温对水中溶盐有影响,对杂质的存在与迁移也有
影响。
气味 由于水中有机物的分解和水中溶解的气体、矿物成
分及沟渠中的污物而产生的水臭称为天然臭气;工业污水 和生活污水所引起的水臭称为人为臭气。水中含有矿物质 和有机物时,便会产生气味。饮用水应无异嗅和异味。工 业给水对气味一般无严格要求。
第三章水环境化学

2020/4/10
12
§1.2天然水的性质
(4)水的硬度
水中所含钙、镁离子总量称为水的总硬度。
水的硬度分级
总硬度
水质
0~4度
很软水
4~8度
软水
8~16度
中等硬水
16~30度
硬水30度ຫໍສະໝຸດ 上很硬水常用“度”作为硬度单位。例如l0mg/L的CaO称为1德国度, l0mg/L的CaCO3称为法国度。
生物自净
在生物的作用下,污染物的数量减少,浓度下降,毒 性减轻或消失.
2020/4/10
23
§2.水中污染物的分布和存在形态
上个世纪60年代,美国学者曾把水体中的污染物划 分为八类:(1)耗氧污染物(一些能较快被微生物降解 成人C类O、2和动H物2O患的病有原机微物生)物;与(细2)致菌病)污;染(3)物合(成一有些机可物使; (4)植物营养物;(5)无机物及矿物质;(6)由土壤、岩石 等冲刷下来的沉淀物;(7)放射性物质;(8)热污染。 总的可以分为两大类:
2020/4/10
13
§1.3天然水体--海洋
海洋覆盖着70.8%的地球表面,总面积约 3 6 1 1 0 1 2 m2, 平 均 深 度 3 8 0 0 m, 总 体 积 为 13701015m3。
海水离子强度I约为0.7。海水pH值在表层为
8.1~8.3,在深层可下降到7.8。主要成分依次为
地下水中污染物质
• 耗氧污染物 • 病原体,如细菌、病毒、原生动物等 • 植物营养物质 • 有机化学物品 • 放射性物质
2020/4/10
19
§1.4天然水的水质
《水环境化学》PPT课件

完整版课件ppt
18
2、石油的降解 (P126)
石油是由烷烃、环烷烃、烯烃、芳香烃 和杂环化合物等组成。
石油在水中可光化学降解或生物降解。
完整版课件ppt
19
(1)光化学降解:
在阳光照射下,石油中的烷烃及侧链芳烃受激发 活化进行光化学氧化。
据测,油浓度为2000kg/km3的水面,油膜厚度 2.5μm,由于光化学氧化,几天光照即能把油膜清除。
氧化)
完整版课件ppt
4
不易被氧化的:饱和的脂肪烃、含有苯环
结构的芳香烃、含氮的脂肪胺类化合物等 ;
容易被氧化的:醛、芳香胺、不饱和的烯
烃和炔烃、醇及含硫化合物(如硫醇、硫醚)等。
完整版课件ppt
5
② 还原反应 : 在有机物分子中加氢或脱氧的反应称为有机
物的还原反应。例如:
HCHO (甲醛) + H2→ CH3OH (甲醇 ) (加氢
24
③ 芳香烃的降解: 石油中苯、苯的同系物、萘等在微生物
作用下先是氧化成二酚,然后苯环分裂成 有机酸,再经有关生化反应,最终分解为 二氧化碳和水。
完整版课件ppt
25
④ 环烷烃降解:环烷烃最稳定,只有少
数微生物能使它降解。如环己烷在微生物作用下
缓慢氧化:
完整版课件ppt
26
课堂作业
教材P80 习题3、4、5、7、13、14
进行,最后分解为CO2和H2O。
完整版课件ppt
22
② 烯烃的降解
当双键在中间位置时,主要的降解途径与饱和 烷烃相似。
当双键位在碳1和碳2位时,在不同微生物的 作用下,主要降解途径有三种:即烯烃的不饱和 端氧化成环氧化物、不饱和末端氧化成醇、饱和 末端氧化成醇。
3 水环境化学 环境化学课件

3
水中这些主要离子的分类,常用来作为表征水体主要化学特 征指标。
硬 Ca2+ HCO3度 Mg2+ CO32酸 H+ OH碱 金 属 阳 离 子 Na+ SO42- ClNO3-
阴 离 子
碱
度
酸
根
4
2.水中的金属离子
水 溶 液 中 金 属 离 子 的 表 示 式 常 写 成 Mn+, 与 水 水 合 形 成
19
2.天然水中的酸碱度
酸度 水中能与强碱发生中和作用的全部物质
(放出H+或经过水解能产生H+的物质的总量)
组成水中酸度的物质
(1)强酸; (2)弱酸如CO2、H2CO3、H2S、蛋白质以及各种有机酸类; (3)强酸弱碱盐。
天然水体的缓冲能力
天然水体的pH值一般在6~9之间。 水中碳酸化合物控制水的pH值--具有缓冲作用。
矿物酸度=[H+]-[HCO3-]-2[CO32-]-[OH-]
23
在化学计量点 pH=8.3 ( pH HCO3- ) : 水中所有碳酸盐类都要转 化为HCO3-,此时 一个H2CO3*能够提供1个H+, 一个CO32-需要消耗1个H+, 一个OH-需要消耗1个H+ 因此得到H+平衡方程:[H+]+[H2CO3*]=[CO32-]+[OH-] 滴定前,如果上式右侧〉左侧,则存在碳酸盐碱度,而当上式 右侧<左侧,存在二氧化碳酸度,并得到其计算公式: 碳酸盐碱度= [CO32-]+[OH-]-[H+]-[H2CO3*]
=4.45×10-7molL-1
=4.68×10-11molL-1
第三章水环境化学

第三章水环境化学第三章水环境化学一、名词解释:亨利定律水体富营养化分配定律辛醇-水分配系数吸附等温线分配系数生长代谢赤潮共代谢水解速率直接光解间接光解生物浓缩因子二、填空1、天然水中的总碱度= [HCO3-] +2 [CO32-] + [OH-] - [H+] 。
2、水中污染物大体可分为8类:①耗氧污染物,②致病污染物,③合成有机物,④植物营养物,⑤无机物与矿物质,⑥由土壤、岩石等冲刷下来的沉积物,⑦放射性物质,⑧热污染。
3、水循环过程通常由蒸发、水汽输送、凝结降水、径流4个环节组成。
4、水环境中胶体颗粒物的吸附作用有表面吸附、离子交换吸附和专性吸附等。
5、天然水的PE随水中溶解氧的减少而降低,因而表层水呈氧化性环境。
6、有机污染物一般通过吸附作用、挥发作用、水解作用、光解作用、生物富集和降解等过程进行迁移转化。
7、一般天然水体的决定电位是溶解氧,而有机污染物积累的厌氧体系中决定电位是有机物。
8、腐殖质与环境有机物之间的作用主要涉及吸附效应、溶解效应、对水解反应的催化作用、对微生物过程的影响以及光敏效应和猝灭效应等。
9、水体呈富营养状态时,水面藻类增殖,成片成团地覆盖水体表面。
这种现象发生在湖面上称为水华或湖靛,而发生在海湾或河口区域则称为赤潮。
10、海水以Cl- 和Na+离子为主。
11、天然水中常见的八大离子是K+,Na+,Ca2+,Mg2+,HCO3-,NO3-,Cl-,SO42-。
12、天然水体中最重要的无机配位体是OH-和Cl-,其次是HCO3-和SO42-等。
13、水体中常见的吸附等温线有Henry型、Langmuir型和Freundlich型三种14、有机化合物在土壤(沉积物)中的吸着存在着二种主要机理:分配作用和吸附作用。
15、辛醇-水分配系数常用k ow表示,反映了化合物在水相和有机相之间的迁移能力,它与化合物的水溶性、土壤吸咐常数和生物浓缩因子密切相关。
16、水体中典型的自养生物是藻类,自养生物的C、N、P源分别是CO2、NO3-、PO43-。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H2CO3*— HCO3-—CO32-体系可用下面的 反应和平衡常数表示:
CO2 + H2O = H2CO3* H2CO3* = H+ + HCO3HCO3- = H+ + CO32-
pK0 = 1.46 pK1 = 6.35 pK2 = 10.33
α0 =[H2CO3* ]/{[H2CO3* ]+[HCO3- ]+[CO32- ]} α1= [HCO3- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]} α2 = [CO32- ] /{[H2CO3* ]+[HCO3- ]+[CO32- ]}
带负电荷的高分子弱电解质,多含有– COOH、–OH等。在pH高,离子强度低条 件下,羟基、羧基大多离解,负电荷相互排 斥,构型伸展,亲水性强。
2、水环境中颗粒物的吸附作用
(Adsorption of Particals in Water Environmen) 表面吸附
离子交换吸附
专属吸附
(1)吸附等温线和等温式
第一节 天然水的基本特征及污染物的存在形态
一、天然水体的基本特征 (Basic Character of Natural Waters)
1、天然水的组成(Constitution of Natural Waters)
八大离子:
K+、Na+、Ca2+、Mg2+、HCO3-、NO3-、Cl-和SO42-
强酸 弱酸 强酸弱碱盐
总酸度= [H+]+ [ HCO3-] +2[H2CO3*] - [ OH-] CO2酸度= [H+]+ [H2CO3*] - [CO32-] - [ OH-] 无机酸度= [H+]- [ HCO3-]-2 [CO32-] - [ OH-]
二、水中污染物的分布及存在形态
1、有机污染物 (Organic Pollutant)
第三章 水环境化学
(Water Environmental Chemistry)
本章重点
1、无机污染物在水体中进行沉淀-溶解、氧化-还原、 配合作用、吸附-解吸、絮凝-沉淀的基本原理;
2、计算水体中金属存在形态;
3、pE计算;
4、有机污染物在水体中的迁移转化过程和分配系数、 挥发速率、水解速率、光解速率和生物降解速率的 计算方法。
3、沉积物中重金属的释放
(Release of Heavy Metals in Sediment)
沉积物中的重金属可能重新进入水 体,这是产生二次污染的主要原因。 不仅对于水生生态系统,而且对于饮 用水的供给都是很危险的。
诱发释放的主要因素:
(1)盐浓度升高; (2)氧化还原条件的变化; (3)降低pH值; (4)增加水中配合剂的含量。
总含盐量(TDS):
TDS=[K++Na++Ca2++Mg2+]+[HCO3-+NO3-+Cl-+SO42-
2、天然水的性质
(Characteristic of Natural Waters) (1)碳酸平衡(Balance of H2CO3) 水体中存在四种化合态:
CO2、CO32-、HCO3-、H2CO3
(Transport and Transformation of inorganic Pollutants)
一、颗粒物与水之间的迁移 (Transport Between Particles and Water)
1、水中的颗粒物的类别
矿物微粒和黏土矿物 金属水合氧化物 腐殖质 悬浮沉积物 其他
腐殖质(Humic Substances)
农药
有机氯 有机磷
多氯联苯 (PCBS) 卤代脂肪烃 醚
单环芳香族化合物 苯酚类和甲酚类 酞酸酯类 多环芳烃(PAH) 亚硝胺和其他化合物
2、金属污染物 (Metal Pollutant)
Cd、 Hg、 Pb、 As、 Cr、 Cu、 Zn、 Tl、 Ni、 Be
第二节 水中无机污染物的迁移转化
(Adsorption Isotherms and Isothermal Equation)
吸附是指溶质在界面层浓度升高的现象, 水体中颗粒物对溶质的吸附是一个动态 平衡过程。
在一定的温度下,当吸附达到平衡时,颗粒物 表面上的吸附量(G)与溶液中溶质平衡浓度 (C) 之间的关系用吸附等温式表达。
H型( Henry)等温式(直线型)
3、胶体相互凝聚
4. “边对面”絮凝
胶体颗粒凝聚方式
(Aggregation Way of Colloid Particulate)
(5)第二极小值絮凝; (6)聚合物粘结架桥絮凝; (7)无机高分子的絮凝; (8)絮团卷扫絮凝; (9)颗粒层吸附絮凝;
(2)天然水中的碱度和酸度
(Acidity and Alkalinity in Natural Waters)
碱度(Alkalinity)
指水中能与强酸发生中和作用 的全部物质,即接受质子的物质总 量,包括强碱、弱碱及强碱弱酸盐。
测定方法:
酸碱滴定,双指示剂法
H+ + OH- = H2O H+ + CO32- = HCO3H+ + HCO3- = H2CO3
(酚酞终点) (甲基橙终点)
总碱度 = [ HCO3-] + 2[CO32-] + [ OH-] – [H+] 酚酞碱度=[OH-]+[CO32-]-[H2CO3*] – [H+] 苛性碱度= [OH-]- [ HCO3-] - 2[CO32-] – [H+]
酸度 (Acidity)
是指水中能与强碱发生中和作用的全 部物质,亦即放出H+或经过水解能产生H+ 的物质的总量。
二、水中颗粒物的聚集
(Aggregation of Particals in Water)
胶体颗粒的聚集亦可称为凝聚或絮凝。
凝聚:由电介质促成的聚集。
絮凝:由聚合物促成的聚集。
胶体颗粒凝聚方式
(Flocculation Way of Cห้องสมุดไป่ตู้lloid Particulate)
1、压缩双电层的聚集 2、专属吸附凝聚
G kC
式中:K——分配系数
F型(Freundlich)等温式
1
G kC n
用对数表示:
lg G lg k 1 lg C n
L型(Langmuir)等温式
G G0C /( A C)
1/ G 1/ G0 ( A / G0 )(1/ C)
G0—单位表面上达到饱和时的最大吸附量 A—常数
