技术中心实验室招标URS
无菌隔离器URS
无菌隔离器用户需求说明User Requirement Specification for Sterile IsolatorReview and Approval审核和批准版本修订索引Revision History目录1.介绍 (3)2.目的 (3)3.范围 (3)4.职责 .................................................................................................................... 错误!未定义书签。
5.术语和缩略语 (3)6.法规和指南 (4)7.参考文件............................................................................................................. 错误!未定义书签。
8.系统和设备描述 (4)9.URS内容 (5)1. 介绍本用户需求说明(URS)是为了规定XX公司XX的XX系统的建造、运输、自动化控制系统等的技术要求,为该系统的招标提供技术依据,并作为后续验证工作的基础。
本文件作为供应商编制设备设计说明、建造要求、调试和服务技术条款的基础,供应商应根据本文件需求逐条做出响应,提供其技术要求是否满足本文件需求标准,如有偏差和不符合项应列出,并详细说明或提供解决方案。
2. 目的用户需求说明是一系列的技术说明中的第一个。
它是用户对项目范围的预期情况进行的高层次说明,是用户对XXX系统具体输出要求的详述,是设备设计的依据,决定了该设备的性能,同时为该设备的设计、测试、验证提供了可接受标准依据。
3. 范围本URS用于规定XXX的XXXX系统的用户需求说明。
本URS不包括以下内容:无菌隔离器系统运行所需的洁净及公用工程安装相关的管道、管件及管道设计与安装要求将在另外的URS进行单独编制。
技术中心实验室招标URS解析
******公司管理规程变更记载目录1.介绍 (2)2.综述 (2)3.质量要求 (3)4.其他要求 (3)5.系统 (3)6.约束 (8)7.生命周期 (8)8.术语 (9)9.参考资料 (9)10.修订历史 (9)1.综述1.1项目介绍技术部实验室现共用质量部二楼实验室、实验场所和办公场地较为拥挤。
现经公司研究决定,将现行政楼三楼左侧部分改造装修,作为技术部实验室使用,以便于开展相关研发工作工作。
2.综述2.1背景该工程包括原行政楼三楼,为研发办工艺研究室、实验室、物料暂存、留样、标本展等功能间的改造2.2目的及益处该工程完成后,有利于满足满公司配方颗粒、破壁饮片、生鲜活性粉等研究项目的开展。
2.3主要功能该工程功能间主要由墙面、顶面、门窗、地面、电源、内饰、供排水、通风换气、实验台柜、门禁系统、监控系统等组成,提供符合实验要求的实验场所及办公场所。
3.质量要求符合实验室及公司方面的各项要求。
4.其他要求所有的材料、安装必须符合国内的相应规定,同时供应商需要提前将相关文件及资质提交我公司批准。
5.系统6.约束由供应商负责推荐匹配的系统、设备,并确保整个系统的运转。
系统应至少有供应商保质1年。
7.周期7.1.交付交付的要求如下:具备交付清单核对所有物品所有交付物品都应有标识,标注名称或交付代号设备应妥善包装、密封以防止在运输中损坏文件应为中文版本供应商应提供系统相应操作和维护的培训7.2支持供应商应负责提供其在国内的售后服务信息,并给出不同层次支持和服务的大致时间。
7.3变更控制符合业主变更要求。
对URS的回复:在URS接收后三天之内回复;要求供应商接到本URS后,要制订详细的设备设计方案(DQ),并逐条做出响应,如果能够实现相应要求,须详细说明实现方式;如不能实现相应要求,应注明:“无法满足需求”,并进行相应的风险评估。
报价单:URS接收五天之内提交8.术语无9.参考资料(1)《建筑地面设计规范》GB50037-96(2)《建筑设计防火规范》(GB 50016-2006)(3)《民用建筑设计通则》(GB 50352—2005)(5)《药品生产质量管理规范》2010修订版(6)《实验室安全通用要求》GB19489-200610.修订历史无11.附录无。
大家一起学文件系列-URS篇

� 运行条件:阐述系统、设施、设备的公共介质条件,如:水、 电、气、汽、真空、空压,设备运行的空间位置条件,以便设 计者在现有的公共设施条件的基础上设计出满足客户需求的系 统、设施、设备; � 系统描述和介质特性:对于工艺设备、系统,应进行简单的系 统描述,同时应对设备、系统介质的特性(如流动性、粘度、 大小等)进行介绍,使设计者了解设备、系统所处的工艺环境, 在设计时充分考虑相应的技术要求并满足工艺步骤。 � � 功能要求和质量标准:阐述期望系统、设施、设备实现的功能 首先对需求对象的整体功能进行综述。 并采用文字说明、 图表、 图纸等形式。 � � � 将每一个功能单元进行详细描述。 每一功能都要对应有质量标准。 安全情况:考虑需求对象运行过程可能出现的基本设施故障、 危险、异常状况,并描述与应急措施要求。报警、停机…… � 技术规范:详细阐述需求对象各个部件的技术要求。技术规范 应包括材质要求、表面要求、机械结构要求、产能、用途、噪 音水平、校准要求等方面。 � 材质要求:对材质的适用性、耐用性进行描述,耐受清洗、消 毒、灭菌、产品相容性。 � 加工要求:提出表面加工工艺要求,与产品直接接触的表面、 与产品不直接接触的表面、外表面分别阐述,考虑焊接、抛光、 钝化等工艺要求。 � � � � � 机械结构要求:考虑部件的功能,阐述部件的机械结构。 驱动系统应与操作区域完全隔离,驱动机械结构应易于维护。 噪音水平 校准要求 维护:提出需求对象可维护性的要求,要求供应商应提供的维 护(包括服务期限、服务内容、服务及时性等) 。
URS 用于设计、招标、采购的依据,它是项目的开始。 石头 968 2012 年 05 月 24 日
6
大家一起学文件——URS 篇
一、 什么是 URS 1、 2、 3、 URS: 即 User Requirements Specification, 用户需求说明, 缩写为 URS。 URS 文件:以文件形式编写的,将用户的需求书面化的文件。 这类文件也需要按照相应的文件管理规程的规定进行文件申请、审核、
用户需求标准(URS)管理

目录1.目的通过制定《用户需求(URS)编写及管理程序》,提出《用户需求(URS)》的编写原则、编写要求和主要内容,规范URS文件的管理规定,达到公司文件管理要求。
2.范围2.1 《用户需求(URS)编写及管理程序》应包括URS用途、编写原则、编写规定和文件模版。
2.2 《用户需求(URS)编写及管理程序》适用于公司内公用系统、设施、工艺设备和实验室检测仪器的用户需求(URS)的编写。
3.职责3.1 设施、设施支持系统、公共工程系统的URS由工程部负责编写。
3.2 生产工艺设备的URS由负责该项工作分属的生产部、技术部专业经理和直接操作人员编写。
3.3 实验室检测仪器的URS由负责该项工作分属的生产部、技术部和质量部专业经理和直接操作人员编写。
4.参考4.1 《药品生产质量管理规范》(2010年修订版)4.2 《药品生产质量管理规范指南》(2001)4.3 美国cGMP标准4.4 欧盟GMP4.5 公司内相关管理文件5.定义5.1 用户需求(URS):为达到项目目标,根据项目技术包中的设备清单及要求和验证主计划中对各个系统、设施、设备所提出的各种功能的、书面的确认要求所编写的对该系统、设施、设备具体要求的文件。
5.2 URS文件:以本文要求为基础,将用户需求书面化的文件。
这类文件应符合质量管理相关文件中规定的文件申请、审核、批准和文件维护程序。
5.3 公用系统:指制药生产线中所需要的水、冷、气/ 汽、电、空压、真空等系统设施的统称。
这些系统一般归属环保能源工程部管理。
5.4 设施:指制药企业中与生产、检验、仓储、工程等相关的车间、实验室和仓库等功能房间的统称。
5.5 工艺设备和检测设备:指制药企业中与生产工艺和质量检验相关的关键设备。
5.6 项目:一个要在一定时间内、利用有限资源(人力,物力,财力等)完成的、要满足一系列特定目标(性能,质量,数量,技术指标)的有限任务。
6.编写原则6.1 用户需求URS文件的变更程序应按相关质量管理文件的要求进行变更和文件控制。
实验室厂房URS

公司名称 文件类型 文件名称 文件编号 生效日期
化验室URS

药厂实验室URS(用户需求书)年月起草、审核与批准净化施工单位确认签收版本历史目录1. 目的 (4)2. 范围 (4)3. 适用的法规和指南 (4)4. 定义和缩写 (5)5. 化验室改造工程描述 (5)6. 相关时间规定 (7)7. 化验室改造工程内容 (7)8. 系统URS描述 (7)9. 验证要求 (16)10. 文件方面的要求 (16)11. 质保期和售后服务 (17)12. 附件 (18)附件1各供应商按照我公司提供的平面图,自行设计并提供上述1-35项文件附件2品牌一经确认,施工时不可要求更换品牌,前期亦可提供更优质的材质,需提供样品。
1. 目的本用户需求说明(URS)的目的是为了规定######有限公司质量部化验室微生物实验区、理化实验区和辅助区等功能区的净化工程、围护结构(隔板和吊顶)、水电系统、地面、实验台柜、通风系统、排水等技术要求,为该系统的招标提供技术依据,并作为后续验证工作的基础。
在本URS中用户仅提出基本的技术要求和系统的基本要求,并未涵盖和限制供应方更高的设计与制造标准和更加完善的功能、更完善的配置和性能、更优异的部件和更高水平的控制系统。
投标方应在满足本URS的前提下提供供应方能够达到的更高标准和功能的高质量设备及其相关服务。
供应方的设备应满足中国有关设计、制造、安全、环保等规程、规范和强制性标准要求。
如遇与供应方所执行的标准发生矛盾时,应按较高标准执行(强制性标准除外)。
该URS在移交给服务商之后,将意味着所有指定的要求被涵盖在服务商的供应范围之内。
本文件的解释权由海南利能康泰制药有限公司GMP小组负责。
2. 范围本文件的范围涉及到#########化验室项目的最低要求,服务商应以URS作为详细设计以及报价的基础。
服务商在设计、施工、调试、验证时必须要按照URS来执行。
本项目初步设计由########有限公司完成。
具体设计详见设计图及其它设计文件。
承包方需根据招标文件、上述图纸、文件及本URS进行投标。
用户需求(URS)编写及管理规程
文件内容1 范围 (1)2 参考标准 (1)3 目的 (2)4 定义 (2)5 管理机构及职责 (2)6 URS与确认的关系 (3)7 管理流程 (4)8 前提条件 (6)9 URS编制 (7)10 相关文件及记录 (19)11 变更登记 (19)发放范围:质量管理部产品制造部设备保障部技术发展部采购供应部技改工程部文件审批:1 范围本规程应包括URS用途、编写原则、编写规定和文件模版,适用于本公司工艺设备/设施、检验设备/仪器、仪表购置前提出的用户需求标准。
本规程适用于本公司工艺设备/设施、检验设备/仪器、仪表购置的管理人员、技术人员.2 参考标准《药品生产质量管理规范》(2010年修订版)《药品生产质量管理规范指南》(2010版)《中华人民共和国药典》(2010版)(ISPE)新建和改造的工厂医药工程指南。
良好自动化生产实践指南第五版PIC/S指南:计算机化系统GMP指南;PIC/S备忘录:药品质量控制实验室检查;以上所列法律、法规及标准为最新版本且根据实际需要增加3 目的本规程为公司内公用系统、设施、工艺设备和实验室检测仪器的用户需求(URS)的编写提供依据。
4 定义URS:即用户需求说明,是指使用方对设备、厂房、硬件设施系统等提出的自己的期望使用需求说明,这个需求综合根据自己的使用目的、环境、用途等提出自己具体的方案,设备供应商依据客户提供的URS方案进行设备设计(或确认自己已经完成设计的设备能符合需方的要求),待客户完成DQ(设计确认)后,再进行设备的制造.公用系统:指制药生产线中所需要的水、冷、气/汽、电、压缩空气、真空等系统设施的统称.设施:指制药企业中与生产、检验、仓储、工程等相关的车间、实验室和仓库等功能房间的统称。
工艺设备和检测设备:指制药企业中与生产工艺和质量检验相关的关键设备。
项目:一个要在一定时间内、利用有限资源(人力,物力,财力等)完成的、要满足一系列特定目标(性能,质量,数量,技术指标)的有限任务。
urs内容及怎样写

GHL-250型高速混合制粒机用户需求说明(URS)(编制单位:)(编制时间:)(URS编号:)目录1、综述2、标准及法规3、供货范围4、术语说明5、技术要求5.1生产工艺要求5.2厂房设施及公用系统要求5.3设备主机部分5.4电气控制及安全防爆5.5清洗消毒要求5. 6 EHS要求6、服务要求6.1 FAT要求6.2包装运输要求6.3文件资料要求6.4 备品零件要求6.5安装调试要求6.6 SAT要求6.7培训要求6.8 保修要求6.9 其它要求7、修订历史1、综述目的:提供GHL-250型高速混合制粒机的设计、制造、采购、验收和确认的依据。
范围:本URS适用于GHL-250型高速混合制粒机招标采购和加工制作。
责任:参加投标方即编制方负责编制此URS,招标方对本URS的编制文件审核,确认URS的内容完全满足招标方的需求,作为进行技术及商务招标的依据。
一旦编制方(即供方)中标,必须严格按照本URS所明确的法规标准、技术要求、服务要求,提供相关设备设施和服务,招标方及中标方均有责任对此URS 保密。
工艺描述:物料在添加辅料之后,在设备的容器内,经高速搅拌混合均匀,并在容器内形成一定的高速流动层,切碎刀在此流动层内高速剪切,形成颗粒状,在出料推杆作用下,颗粒被卸出。
整个过程在设备容器内完成,可以有效防止产尘。
密封装置采用净化的气密封。
环境标准:D级净化环境,GMP标准厂房,温度18-26度,湿度45%-65%公用介质情况:压缩空气(气动和净化)、电源、清洁用纯化水2、标准及法规除满足本URS特殊要求外,必须符合中国的相关法规:《药品生产质量管理规范(2010 年修订)》中华人民共和国制药机械行业标准JB20014-20018-2004《中华人民共和国环境保护法》《GB 50231-98 机械设备安装工程施工及验收通用规范》《GB 12348-90工业企业厂界噪声标准》3、供货范围GHL-250型高速混合制粒机1台套(其组成是GHL-250型高速混合制粒机主机,以及随机文件和操作维护工具)4、术语说明词语定义URS User requirement specification 客户需求说明IQ Installation Qualification 安装验证OQ Operational Qualification 操作验证EHS Environment Health Safety 环境健康安全FAT Factory Acceptance Test 工厂接收测试SAT Site Acceptance Test 现场接收测试5、技术要求5.1生产工艺需求编号需求必须/期望URS001 适应制备颗粒,产量:50~100KG/批,用于片剂、胶囊剂的湿混合制粒必须URS002 含量均匀度(标准:RSD%≤2%)必须URS003 筒体容积250L 必须URS004 切割速度双速电机切割功率4.5/5.5KW 必须URS005 混合速度9/11KW 必须5.2 公用系统需求编号需求必须/期望URS006 电源:50HZ-380V 三相五线制,配备功率不大于50KW 必须URS007 设备外形长2050宽1100高1450 必须URS008 设备重量:小于1000KG 必须URS009 压缩空气过滤处理,压力0.7MPA,耗用量1.2M3/H 必须5.3设备主机部分需求编号需求必须/期望URS010 外封板SUS304不锈钢必须URS011 切割刀SUS304不锈钢必须URS012 气缸动作提升容器盖,容器盖有加料口,能有效关闭必须URS013 气缸动作出料必须URS014 搅拌桨SUS304不锈钢必须URS015 旋转部位气密封,可进气或纯化水5.4电气控制需求编号需求必须/期望URS016 5.7英寸触摸屏,PLC流程控制,可控制电机转速、压缩空气、纯化水、出料机构等必须URS017 设备必须有接地装置,接地电阻小于或等于4欧姆必须URS018 电器均为国内知名品牌必须5.5 清洗消毒需求编号需求必须/期望URS019 可自动加纯化水,搅拌清洗,排除清洗水必须URS020 必须方便使用消毒剂擦洗消毒必须5.6 EHS要求:需求编号需求必须/期望URS021 设备绝缘电阻应不小于1MΩ必须URS022 工作噪声:≤70分贝,无异常声响必须URS023 设备边缘应该平整,没有潜在尖角伤及操作员工必须URS024 设备使用、操作和维修等方面的结构设计合理,便于维护操作,设计制造满足相关设备安全设计规范必须URS025 电力故障时设备处于停止状态,电源重新启动必须人工操作后方可启动必须6服务要求6.1 FAT要求需求编号需求必须/期望URS026 设备制做完毕,供方检查测试无问题后将检测结果通知需方必须URS027 在供方现场试机所需模拟物料费用由供方负担必须URS028 现场试机过程中如出现异常,供方应进行原因调查,制定整改方案并对新方案进行风险评估必须URS029 测试时设备应能正常运行,生产能力和粒度符合要求,保证产品质量必须6.2包装运输要求需求编号需求必须/期望URS030 包装满足运输和装卸要求,防潮湿、防磕碰、防振动,由于包装不良而造成的任何锈损,供方承担全部损失和费用必须URS031 运输时间包含在供货周期内,供方负责运输,并承担运输费用必须URS032 机器到货清单必须详列每装箱内容物必须6.3文件资料需求编号需求必须/期望URS033 须提供文件清单,所有文件资料均须提供中文版各一份必须URS034 须提供机器零组件分解组立图及零件编号,名称说明表必须URS035 提供机器操作保养手册或说明书、故障排除说明书、检修规程、润滑图必须URS036 须提供电路控制线路图(电路之配线以符号标明于接在线以便核查) 必须6.4备品零件需求编号需求必须/期望URS037 提供备品配件清单必须URS038 机器试车后于保修期限内其消耗品或电子零件故障需由供应商负责免费供应修缮或更换。
技术中心实验室招标URS

******公司管理规程变更记载目录1. 介绍 (2)2. 综述 (2)3. 质量要求 (3)4. 其他要求 (3)5. 系统 (3)6. 约束 (8)7. 生命周期 (8)8. 术语 (9)9.参考资料 (9)10.修订历史 (9)1.综述1.1项目介绍技术部实验室现共用质量部二楼实验室、实验场所和办公场地较为拥挤。
现经公司研究决定,将现行政楼三楼左侧部分改造装修,作为技术部实验室使用,以便于开展相关研发工作工作。
2.综述2.1背景该工程包括原行政楼三楼,为研发办工艺研究室、实验室、物料暂存、留样、标本展等功能间的改造2.2目的及益处该工程完成后,有利于满足满公司配方颗粒、破壁饮片、生鲜活性粉等研究项目的开展。
2.3主要功能该工程功能间主要由墙面、顶面、门窗、地面、电源、内饰、供排水、通风换气、实验台柜、门禁系统、监控系统等组成,提供符合实验要求的实验场所及办公场所。
3.质量要求符合实验室及公司方面的各项要求。
4.其他要求所有的材料、安装必须符合国内的相应规定,同时供应商需要提前将相关文件及资质提交我公司批准。
5.系统6.约束由供应商负责推荐匹配的系统、设备,并确保整个系统的运转。
系统应至少有供应商保质1年。
7.周期7.1.交付交付的要求如下:具备交付清单核对所有物品所有交付物品都应有标识,标注名称或交付代号设备应妥善包装、密封以防止在运输中损坏文件应为中文版本供应商应提供系统相应操作和维护的培训7.2支持供应商应负责提供其在国内的售后服务信息,并给出不同层次支持和服务的大致时间。
7.3变更控制符合业主变更要求。
对URS的回复:在URS接收后三天之内回复;要求供应商接到本URS后,要制订详细的设备设计方案(DQ),并逐条做出响应,如果能够实现相应要求,须详细说明实现方式;如不能实现相应要求,应注明:“无法满足需求”,并进行相应的风险评估。
报价单:URS接收五天之内提交8.术语无9.参考资料(1)《建筑地面设计规范》GB50037-96(2)《建筑设计防火规范》(GB 50016-2006)(3)《民用建筑设计通则》(GB 50352—2005)(5)《药品生产质量管理规范》2010修订版(6)《实验室安全通用要求》GB19489-2006 10.修订历史无11.附录无。
药企原子吸收URS

原子吸收分光光度计用户需求说明(URS)XXX制药公司2020年XX月文件审批:起草:审核:批准:目录1 简述和背景 (4)2 目的 (4)3 适用范围 (4)4 参考文献 (4)5 用户要求 (5)5.1 硬件要求 (5)5.2 软件要求 (5)5.3 附件要求 (6)5.4 外观及安全性要求 (7)5.5 性能要求 (7)5.6 法规要求 (9)5.7 培训要求 (9)5.8 验证、确认要求 (10)5.9 文件要求 (10)5.10供应商要求 (11)5.11 其他要求 (11)1 简述和背景原子吸收分光光度计是用于中药材、中药饮片重金属及有害元素测定的检测设备。
测量时依据要求可选择石墨炉法、火焰法、以及氢化物法。
设备由光源、原子化器、背景校正系统、自动进样系统和检测系统组成。
原子吸收分光光度计的测量对象是呈原子状态的金属元素和部分非金属元素,是基于测量蒸汽中原子对特征电磁辐射的吸收强度进行定量分析的一种仪器分析方法。
原子吸收分光光度法遵循朗伯比尔定律,一般通过比较对照品溶液和供试品溶液的吸光度,可计算供试品中待测元素的含量。
2 目的本文是中心实验室对需要购买的原子吸收分光光度计的用户需求说明。
主要阐述了我们对要购买原子吸收分光光度计的软硬件要求、安全要求、性能要求、法规要求、培训要求,文件要求、供应商要求、其他要求等。
使供应商能够提供满足我公司需求的原子吸收分光光度计。
3 适用范围供应商需达到本文的全部要求后,方可从其处购入设备。
仪器购入后安装在指定位置。
本URS 为仪器的基本要求,但实际过程中不仅限于此要求。
4 参考文献《药品生产质量管理规范》(2010版)《中华人民共和国药典》2015年版及附录《计算机化系统》《中华人民共和国药典》2020年版《药品GMP指南》(2011年版)《原子吸收光谱仪检定规程》JJG(教委) 023-1996《原子吸收分光光度计检定规程》JJG 694-2009《原子吸收分光光度计》GB/T 21187-20075 用户要求所购设备应满足以下要求:5.1 硬件要求5.2 软件要求5.3 附件要求5.4 外观及安全性要求5.5 性能要求5.6 法规要求5.7培训要求5.8验证、确认要求5.9文件要求5.10供应商要求5.11 其他要求。
化验室URS

药厂实验室URS (用户需求书)起草、审核与批准净化施工单位确认签收版本历史1-目的2.范围 (4)3.适用的法规和指南 (4)4.定义和缩写 (5)5・化验室改造工程描述 (5)6.相关时间规定 (7)7.化验室改造工程内容 (7)&系统URS描述 (8)9.验证要求 (16)10・文件方面的要求 (16)行・质保期和售后服务 (17)12・附件 (18)附件1各供应商按照我公司提供的平面图,自行设计并提供上述1-35项文件附件2品牌一经确认,施工时不可要求更换品牌,前期亦可提供更优质的材质,需提供样品。
1.目的本用户需求说明(URS)的口的是为了规定######有限公司质量部化验室微生物实验区、理化实验区和辅助区等功能区的净化工程、圉护结构(隔板和吊顶)、水电系统、地面、实验台柜、通风系统、排水等技术要求,为该系统的招标提供技术依据,并作为后续验证工作的基础。
在本URS中用户仅提出基本的技术要求和系统的基本要求,并未涵盖和限制供应方更高的设讣与制造标准和更加完善的功能、更完善的配置和性能、更优异的部件和更高水平的控制系统。
投标方应在满足本URS的前提下提供供应方能够达到的更高标准和功能的高质量设备及其相关服务。
供应方的设备应满足中国有关设计、制造、安全、环保等规程、规范和强制性标准要求。
如遇与供应方所执行的标准发生矛盾时,应按较高标准执行(强制性标准除外)。
该URS在移交给服务商之后,将意味着所有指定的要求被涵盖在服务商的供应范围之内。
本文件的解释权由海南利能康泰制药有限公司GMP小组负责。
2.范围本文件的范围涉及到#########化验室项LI的最低要求,服务商应以URS作为详细设计以及报价的基础。
服务商在设计、施工、调试、验证时必须要按照URS来执行。
本项目初步设计山########有限公司完成。
具体设计详见设计图及其它设计文件。
承包方需根据招标文件、上述图纸、文件及本URS进行投标。
负压隔离实验室装修改造用户需求URS说明书
负压隔离实验室装修改造用户需求(URS)说明书1. 项目简介本文件是描述罗欣药业(上海)有限公司(以下简称罗欣)负压隔离实验室装修改造的用户需求说明,供应商应根据本文件需求逐条做出响应,提供的技术要求应满足本文件需求的标准,如有偏差和不符合项应列出,并详细说明或提供解决方案。
2. 目的该文件是罗欣对项目范围的提出的期望功能和使用需求的说明,是图纸设计和设备选型的基本依据,是保证施工商提供的设计符合用户要求的标准,也是最终验收的依据。
经批准的用户需求标准将作为商务合同的附件,与合同具有同等的法律效力。
3. 范围该文件适用于罗欣公司负压隔离实验室装修改造的用户需求说明。
4.项目概述罗欣(上海)实验室,位于罗欣药业(上海)有限公司张江法拉第路85号,本次改造的区域为1号楼1212、1213、1216、1217房间,建筑地上六层(底层为G层),混凝土框架结构,火灾危险性为丙类,耐火等级二级,建筑面积105㎡,南北向7.7 米,东西方向13.7 米,层高3.9米,建筑总层高26.6米,功能设置为制剂小试研发,预计放置称量隔离器、设备隔离器、混合机、流化床、包衣机、压片机、胶囊充填机等,包衣和流化床放置区同时也是吸入制剂设备预留区;最大允许容纳实验人员4-6人,人流、物流、废物流分开,有合理的人流进出设计和物料进出设施;功能间有换鞋、更衣、缓冲间、物料准备间、洗衣间、清洗间等,设计应有合理的空调通风、装修材料和密闭负压设计,能够达到OEB4类高活性药品实验防护等级的要求;环境为一般区,温度:18~26℃;相对湿度:30% ~70%。
5.工程范围(1)、图纸优化设计:要求施工单位对本次发包平面图中相关部分进行优化设计,要求节能、合法合规,满足行业规范要求;(2)、工程施工范围:本次施工内容包含但不限于结构承重加固、装饰装修、暖通、电气、空调自控,所有安装为交钥匙工程,包工包料,甲方提供车间主要生产和实验设备,附设备清单及公用需求列表见附件;其他设备、材料由施工方提供。
实验室设计的URS的主要内容

实验室设计的URS的主要内容实验室设计的URS的主要内容一、实验室设计布局:实验室设计规划、通风柜、实验台、通风系统、配套设施是我国较早从事集规划设计、制造安装、售后服务为一体的现代实验室设备公司,无论是新建、扩建、或是改建项目,它不单纯是选购合理的仪器设备,还要综合考虑实验室的总体规划、合理布局和平面设计,以及供电、供水、供气、通风、空气净化、安全措施、环境保护等基础设施和基本条件。
在做实验室规划的时候,首先要考虑的因素是就是“安全”,实验室是最易发生爆炸、火灾、毒气泄露等的场所。
我们在做平面设计的时候,应尽量地要保持实验室的通风流畅、逃生通道畅通。
二、实验台与实验台通道划分标准(通道间隔宽度用L表示)L>800mm时,一边可坐人操作;(距离太拥挤)L>1200mm时,一边可坐人,一边可站人,中间不可过人;L>1500mm时,两边可坐人,中间可过人;L>1800mm时,两边可坐人,中间可过人可过仪器天平台、仪器台不宜离墙太近,离墙400mm为宜。
为了在工作发生危险时易于疏散,实验台间的过道应全部通向走廊。
另:实验室建筑层高宜为3.7米-4.0米为宜,净高宜为2.7米-2.8米,有洁净度、压力梯度、恒温恒湿等特殊要求的实验室净高宜为2.5米-2.7米(不包括吊顶);实验室走廊净宽宜为2.5米-3.0米。
普通实验室双门宽以1.1米-1.5米(不对称对开门)为宜,单门宽以0.8米-0.9米为宜。
三、实验室规划设计实验室家具、实验室仪器部分:仪器分析实验室,主要设置各种大型精密分析仪器,同时也包括普通小型分析仪等,一般设计的实验室家具有:仪器台、实验台、中央实验台、通风柜、天平台、电脑台、气瓶柜、洗涤台、器皿柜、药品柜、急救器、万向排气罩、原子吸收罩等。
实验仪器:干燥箱、培养箱、霉菌培养箱、电热鼓风干燥箱、电热恒温干燥箱、真空干燥箱、生化培养箱、恒温培养箱、光照培养箱、二氧化碳培养箱、隔水式培养箱、振荡培养箱、人工气候箱、种子培养箱、种子老化箱、电子天平等。
技术中心实验室招标URS解析(20210109210249)
****** 公司管理规程变更记载技术中心实验室招标URS1. 介绍 (2)2. 综述 (2)3. 质量要求 (3)4. 其他要求 (3)5. 系统 (3)6. 约束 (8)7. 生命周期 (8)8. 术语 (9)9. 参考资料 (9)10修订历史 (9)1.1项目介绍技术部实验室现共用质量部二楼实验室、实验场所和办公场地较为拥挤。
现经公司研究决定,将现行政楼三楼左侧部分改造装修,作为技术部实验室使用,以便于开展相关研发工作工作。
2. 综述2.1背景该工程包括原行政楼三楼,为研发办工艺研究室、实验室、物料暂存、留样、标本展等功能间的改造2.2目的及益处该工程完成后,有利于满足满公司配方颗粒、破壁饮片、生鲜活性粉等研究项目的开展。
2.3主要功能该工程功能间主要由墙面、顶面、门窗、地面、电源、内饰、供排水、通风换气、实验台柜、门禁系统、监控系统等组成,提供符合实验要求的实验场所及办公场所。
3. 质量要求符合实验室及公司方面的各项要求。
4. 其他要求所有的材料、安装必须符合国内的相应规定,同时供应商需要提前将相关文件及资质提交我公司批准。
6. 约束由供应商负责推荐匹配的系统、设备,并确保整个系统的运转。
系统应至少有供应商保质1年。
7. 周期7.1.交付交付的要求如下:具备交付清单核对所有物品所有交付物品都应有标识,标注名称或交付代号设备应妥善包装、密封以防止在运输中损坏文件应为中文版本供应商应提供系统相应操作和维护的培训7.2支持供应商应负责提供其在国内的售后服务信息,并给出不同层次支持和服务的大致时间。
7.3变更控制符合业主变更要求。
对URS勺回复:在URSS收后三天之内回复;要求供应商接到本URS后,要制订详细的设备设计方案(DQ,并逐条做出响应,如果能够实现相应要求,须详细说明实现方式;如不能实现相应要求,应注明:“无法满足需求”并进行相应的风险评估。
报价单:URS接收五天之内提交8. 术语无9. 参考资料(1)《建筑地面设计规范》GB5003A96(2)《建筑设计防火规范》(GB 50016-2006(3)《民用建筑设计通则》(GB 5035—2005)(5)《药品生产质量管理规范》2010修订版(6)《实验室安全通用要求》GB19489-200610. 修订历史无11. 附录无。
干热灭菌柜URS

干热灭菌柜用户需求说明文件批准审批公司/职务姓名签名日期编写人审核人批准人版本日期修订原因新制订目录1. 介绍 32. 目的 33. 简介 34. 缩略语 45. 法规和指南 66. 公用系统参数需求77. 用户需求88. 推荐供应商品牌269. 附件26介绍本用户需求说明(URS)是为了规定国际标准制剂项目干热灭菌柜的技术要求,为该系统的招标提供技术依据,并作为后续验证工作的基础。
本文件作为供应商编制设备设计制造、调试和服务技术条款的基础,供应商应根据本文件需求逐条做出响应,提供其技术要求是否满足本文件需求标准,如有偏差和不符合项应列出,并详细说明或提供解决方案。
目的用户需求说明是系列技术说明中的第一个。
它是用户对项目范围的预期情况进行的高层次说明,是用户对国际标准制剂项目的干热灭菌柜具体输出要求的详述,是设计的依据,决定了干热灭菌柜的性能,同时为干热灭菌柜的设计、测试、验证提供了可接受标准依据。
简介本用户需求说明适用于国际标准制剂项目的干热灭菌柜。
设备功能干热灭菌柜的作用:容器具、培养皿等的灭菌除热源。
设备产能干热灭菌柜灭菌有效容积:0.75m3设备工作原理:干热灭菌柜由灭菌内腔、加热系统、冷却系统及控制系统组成,灭菌程序分为加热、控温灭菌除热源及降温三个阶段。
灭菌柜通过鼓风机电加热达到较高的温度后,对物品进行恒温灭菌除热源。
设备组成灭菌腔室、加热系统、冷却系统、控制系统(硬件和软件)工艺描述干热灭菌柜将用于化验室容器具、培养皿等的灭菌除热源。
干热灭菌柜能够全自动PLC控制,配有触摸屏人机操作界面且要求触摸屏能动态显示整个工作过程,并且能够自动记录。
干热灭菌柜所包括的范围:设备主体;控制系统;验证文件(包括但不限于DQ、FAT、SAT、IQ、OQ):图纸及说明书等文件资料。
可接受标准灭菌柜应满足下列主要功能方面的可接受标准(在FAT中进行确认)功能要求可接受标准干热灭菌柜有效容积≥0.75m3循环风机能耐300℃高温,在高温下长期稳定压差有在线压差监测检测口有预留检测口,以便于高效检漏供应商应当保证该设备适合机械部件、容器具、工具等物品采的灭菌,保证该设备符合FDA、欧盟、WHO、中国2010版GMP规范等要求。
URS管理制度

目录2.范围 (3)3.职责 (3)4.参考 (3)5.定义 (3)6.编写原则 (4)7.各类别用户需求(URS)的编写 (5)7.1公共工程系统/设施用户需求(URS)的编写(见附件1) (5)7.2工艺设备URS的编写(见附件2) (8)7.3实验仪器用户需求(URS)的编写(见附件3) (11)7.4单一设备和仪器用户需求(URS)(见附件4) (14)8.文件管理 (14)8.1文件版本规划 (15)8.2文件起草 (15)8.3文件会审 (16)8.4文件批准 (16)8.5文件分发 (16)8.6文件变更 (16)8.7文件关闭 (17)9.附件 (17)9.1公共系统/设施用户需求(URS)编写模板(VA-3-02(A01)) (17)9.2工艺设备用户需求(URS)编写模板(VA-3-02(A02)) (17)9.3实验仪器用户需求(URS)编写模板(VA-3-02(A03)) (17)9.4单一设备用户需求(URS)编写模板(VA-3-02(A04)) (17)1.目的通过制定《用户需求(URS)编写及管理程序》,提出《用户需求(URS)》的编写原则、编写要求和主要内容,规范URS文件的管理规定,达到公司文件管理要求。
2.范围2.1 《用户需求(URS)编写及管理程序》应包括URS用途、编写原则、编写规定和文件模版。
2.2 《用户需求(URS)编写及管理程序》适用于公司内公用系统、设施、工艺设备和实验室检测仪器的用户需求(URS)的编写。
3.职责3.1 设施、设施支持系统、公共工程系统的URS由工程部负责编写。
3.2 生产工艺设备的URS由负责该项工作分属的生产部、技术部专业经理和直接操作人员编写。
3.3 实验室检测仪器的URS由负责该项工作分属的生产部、技术部和质量部专业经理和直接操作人员编写。
4.参考4.1 《药品生产质量管理规范》(2010年修订版)4.2 《药品生产质量管理规范指南》(2001)4.3 美国cGMP标准4.4 欧盟GMP4.5 公司内相关管理文件5.定义5.1 用户需求(URS):为达到项目目标,根据项目技术包中的设备清单及要求和验证主计划中对各个系统、设施、设备所提出的各种功能的、书面的确认要求所编写的对该系统、设施、设备具体要求的文件。
用户说明(URS)编写及管理规程

用户说明(URS)编写及管理规程文件改版历史记录版本版本升级日期版本升级原因/主要内容第一版第二版目录1.范围 (1)2.目的 (1)3.定义 (1)4.参考 (1)5.附件 (1)6.内容 (1)6.1.URS涵义 (1)6.2.编写原则 (2)6.3.URS编写的核心要求 (2)6.4.URS的分解和起草人 (2)6.5.设施类URS编写 (3)6.6.公共工程系统/工艺系统/设备URS的编写 (3)6.7.文件管理 (7)附件1:URS编写的目录模版 (8)附件2:________URS申请/审批表 (9)1.范围本文规定了用户说明(URS)的编写要求,包括URS用途、编写原则、编写规定和文件模版。
2.目的规范《用户说明》的编写原则、编写要求和主要内容以及这类文件管理的规定。
3.定义3.1.URS:User Requirements Specification,即用户需求说明,用户为达到项目目标,对该系统、设备具体要求的文件。
3.2.FDS:Functional design specification,即功能设计说明,为满足用户需求对设备、系统进行的一系列书面设计说明,包括各类图纸。
3.3.DDS:Detailed design specification,即详细设计说明;根据确定的功能设计,对设备、系统进行详细的、具体的书面设计说明,为建造做好准备。
3.4.DQ:Design Qualification缩写,即设计确认。
指对最终设计图纸和加工工艺说明的审查。
3.5.公用系统:指制药生产线中所需要的水、冷、气/汽、电、空压、真空等系统设施的统称。
这些系统一般归属工程部管理。
3.6.设施:指制药企业中与生产、检验、仓储、工程等相关的车间、实验室和仓库等功能房间的统称。
3.7.项目:一个要在一定时间内、利用有限资源(人力,物力,财力等)完成的、要满足一系列特定目标(性能,质量,数量,技术指标)的有限任务。
用户需求(URS)管理制度

目录1.目的 (3)2.范围 (3)3.职责 (3)4.参考 (3)5.定义 (3)6.编写原则 (4)7.各类别用户需求(URS)的编写 (5)7.1公共工程系统/设施用户需求(URS)的编写(见附件1) (5)7.2工艺设备URS的编写(见附件2) (8)7.3实验仪器用户需求(URS)的编写(见附件3) (11)7.4单一设备和仪器用户需求(URS)(见附件4) (14)8.文件管理 (14)8.1文件版本规划 (14)8.2文件起草 (15)8.3文件会审 (16)8.4文件批准 (16)8.5文件变更 (16)8.6文件关闭 (17)9.附件 (17)9.1公共系统/设施用户需求(URS)编写模板(VA-3-02(A01)) (17)9.2工艺设备用户需求(URS)编写模板(VA-3-02(A02)) (17)9.3实验仪器用户需求(URS)编写模板(VA-3-02(A03)) (17)9.4单一设备用户需求(URS)编写模板(VA-3-02(A04)) (17)1.目的通过制定《用户需求(URS)编写及管理程序》,提出《用户需求(URS)》的编写原则、编写要求和主要内容,规范URS文件的管理规定,达到公司文件管理要求。
2.范围2.1 《用户需求(URS)编写及管理程序》应包括URS用途、编写原则、编写规定和文件模版。
2.2 《用户需求(URS)编写及管理程序》适用于公司内公用系统、设施、工艺设备和实验室检测仪器的用户需求(URS)的编写。
3.职责3.1 设施、设施支持系统、公共工程系统的URS由工程部负责编写。
3.2 生产工艺设备的URS由负责该项工作分属的生产部、技术部专业经理和直接操作人员编写。
3.3 实验室检测仪器的URS由负责该项工作分属的生产部、技术部和质量部专业经理和直接操作人员编写。
4.参考4.1 《药品生产质量管理规范》(2010年修订版)4.2 《药品生产质量管理规范指南》(2001)4.3 美国cGMP标准4.4 欧盟GMP4.5 公司内相关管理文件5.定义5.1 用户需求(URS):为达到项目目标,根据项目技术包中的设备清单及要求和验证主计划中对各个系统、设施、设备所提出的各种功能的、书面的确认要求所编写的对该系统、设施、设备具体要求的文件。
用户需求说明(URS)编写及管理规程

1 目的为规范用户需求说明(URS)文件的编写和管理,特制定本管理规程。
2 范围适用于本公司公用系统、工艺设备/设施、实验室检测仪器等对产品质量有影响的关键系统或设备。
3 职责3.1 工程设备部:负责公司厂房设施、公用系统等URS的编写;3.2 生产部:负责生产工艺设备URS的编写;3.3 QC:负责实验室检测仪器URS的编写;3.4 QA:负责URS文件的审核和批准。
4 定义用户需求说明(URS):是指在满足相关法规、标准的前提下,使用方根据使用目的、环境、用途等对设备、厂房、硬件设施系统等提出的自己的期望使用需求说明,以达到生产、检测或管理的目标所需要的条件。
5 内容5.1 URS的编制5.1.1 URS文件的编制、审核、批准等需严格执行GMP文件的相关管理程序,并应在购置前完成。
5.1.2 URS编制时需考虑相关规范及标准,如中国cGMP,《中国药典》等。
5.1.3 各个需求之间应没有冲突,每个需求,特别是那些预期符合GMP要求的需求应以一定的方式加以说明。
5.1.4 URS虽然独立于设备/设施等的设计者,但仍需要用户与设计者进行有效地沟通,以使双方理解一致,对于强制性的需求和可选择的特性应明示。
5.1.5 URS中应包含功能性的和非功能性的要求:功能性、有效性、可维护性、可用性等,且这些需求可进行客观的证实。
5.1.6 用户需求说明(URS)编写的核心要求:5.1.6.1 要准确、清楚地阐述:建造什么,需要什么样的东西,且其界限应清晰;5.1.6.2 专业参数应精确;5.1.6.3 要求应提完整;5.1.6.4 提出的需求应是可实现的。
5.2 URS的内容URS应包含但不仅限于以下内容:5.2.1 性能要求:最大最小批量、压力、温度、容积等要求,设备尺寸、自动(手动)控制、电脑控制、屏幕、数据备份、报警等控制要求;给定条件下设备的稳定性需求。
5.2.2 外观要求:表面涂层色彩要求;表面粗糙度要求;表面镀铬;不锈钢亚光;表面氧化处理;表面喷塑等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
******公司管理规程
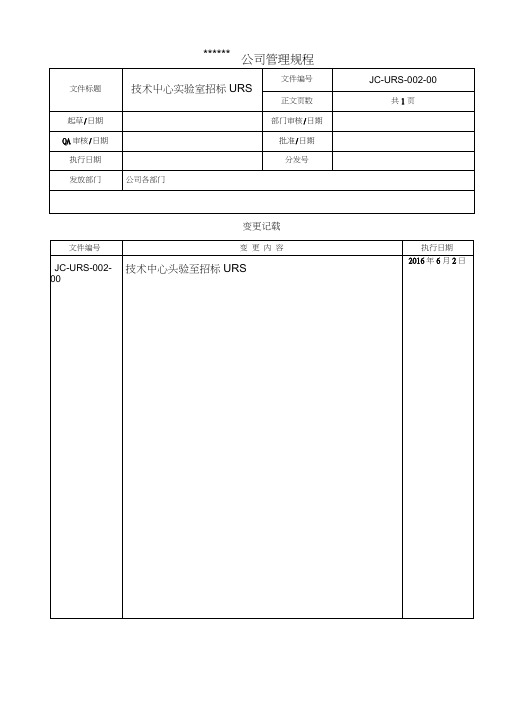
文件标题技术中心实验室招标URS 文件编号JC-URS-002-00正文页数共 1 页
起草/日期部门审核/日期
QA审核/日期批准/日期
执行日期分发号
发放部门公司各部门
变更记载
文件编号变更内容执行日期JC-URS-002-00技术中心实验室招标URS2016年6月2日
目录
1.介绍 (2)
2.综述 (2)
3.质量要求 (3)
4.其他要求 (3)
5.系统 (3)
6.约束 (8)
7.生命周期 (8)
8.术语 (9)
9.参考资料 (9)
10.修订历史 (9)
1.综述
1.1项目介绍
技术部实验室现共用质量部二楼实验室、实验场所和办公场地较为拥挤。
现经公司研究决定,将现行政楼三楼左侧部分改造装修,作为技术部实验室使用,以便于开展相关研发工作工作。
2.综述
2.1背景
该工程包括原行政楼三楼,为研发办工艺研究室、实验室、物料暂存、留样、标本展等功能间的改造
2.2目的及益处
该工程完成后,有利于满足满公司配方颗粒、破壁饮片、生鲜活性粉等研究项目的开展。
2.3主要功能
该工程功能间主要由墙面、顶面、门窗、地面、电源、内饰、供排水、通风换气、实验台柜、门禁系统、监控系统等组成,提供符合实验要求的实验场所及办公场所。
3.质量要求
符合实验室及公司方面的各项要求。
4.其他要求
所有的材料、安装必须符合国内的相应规定,同时供应商需要提前将相关文件及资质提交我公司批准。
5.系统
6.约束
由供应商负责推荐匹配的系统、设备,并确保整个系统的运转。
系统应至少有供应商保质1年。
7.周期
7.1.交付
交付的要求如下:
具备交付清单核对所有物品
所有交付物品都应有标识,标注名称或交付代号
设备应妥善包装、密封以防止在运输中损坏
文件应为中文版本
供应商应提供系统相应操作和维护的培训
7.2支持
供应商应负责提供其在国内的售后服务信息,并给出不同层次支持和服务的大致时间。
7.3变更控制
符合业主变更要求。
对URS的回复:在URS接收后三天之内回复;要求供应商接到本URS后,要制订详细的设备设计方案(DQ),并逐条做出响应,如果能够实现相应要求,须详细说明实现方式;如不能实现相应要求,应注明:“无法满足需求”,并进行相应的风险评估。
报价单:URS接收五天之内提交
8.术语
无
9.参考资料
(1)《建筑地面设计规范》GB50037-96
(2)《建筑设计防火规范》(GB 50016-2006)
(3)《民用建筑设计通则》(GB 50352—2005)
(5)《药品生产质量管理规范》2010修订版
(6)《实验室安全通用要求》GB19489-2006
10.修订历史
无
11.附录
无。
