第十三章 杂环化合物(好)
201313新版有机化学杂环化合物

或 N N
NH N
• sp2-N吸电子能力较sp2- C强, 故吡啶为缺电子体系.
武汉大学医学有机化学2013
武汉大学医学有机化学2013
三、五员杂环化合物的化学性质
(1) 卤化 呋喃、噻吩在温和条件下(如溶剂稀释及低温)反应 可得一卤代产物;
Br2, 0℃
O 80%
Br
O O
O
Cl2 -40℃
+ O Cl
Cl
O
Cl
吡咯卤化常得四卤化物,唯有2-氯吡咯可直接卤 化制得。
Br Br N H Br
Br2, 0℃
N H
(1H-氮杂 )
武汉大学医学有机化学2013
二、芳杂环
具有芳香特征的杂环化合物称为芳杂环 五元杂环
O
S
呋喃
N O S N
噻吩
N N H
吡咯
N H
N H
N
噁唑
噻唑
咪唑
吡唑
武汉大学医学有机化学2013
六元杂环
N N N
O
吡啶
苯并杂环
嘧啶
吡喃(无芳香性)
N
N 吲哚 H
杂环并杂环
喹啉
N
N
异喹啉
N N
武汉大学医学有机化学2013
说明:吡咯、呋喃、噻吩的亲电取代反应, 对试剂及反应条件必须有所选择和控制。 卤代反应 不需要催化剂,要在较低温度和 进行。 硝化反应 不能用混酸硝化,一般是用乙酰 基硝酸酯(CH3COONO2)作硝化试剂,在低 温下进行。 磺化反应 呋喃、吡咯不能用浓硫酸磺化, 要用特殊的磺化试剂——吡啶三氧化硫的络 合物,噻吩可直接用浓硫酸磺化。
杂环化合物

+ H2SO4 S
2)H2 )
25℃
S
SO3H
S
4. 用途:合成药物 用途:
H2 MoS2
S
(四)吡咯
N H
含氮化合物的碱性取决于氮原子上未共用 电子对与H 结合能力。 电子对与 +结合能力。 1.物理性质:无色油状液体, 131℃,难溶于 1.物理性质:无色油状液体,b.p 131℃,难溶于 物理性质 易溶于醚或醇中。 水,易溶于醚或醇中。 鉴别:盐酸松片反应呈红色。 鉴别:盐酸松片反应呈红色。
N H
O
S
2. 吡啶
sp2杂化 共平面 大π键 π电子数为6,符合休克尔规则(4n+2)。 电子数为 ,符合休克尔规则( )。 具有芳香性(比苯小) 具有芳香性(比苯小) 电负性: 电负性:N>C,环上碳原子的电子云密度降 , 亲电取代比苯困难,且主要为β 位 比苯困难 低,亲电取代比苯困难,且主要为β-位。 比较容易发生亲核取代,且主要在α 位 比较容易发生亲核取代,且主要在α-位。 容易发生亲核取代 碱性。 N上有未共用电子对,容易接受质子,具有碱性。 上有未共用电子对,容易接受质子,具有碱性
CHO
α-呋喃甲醛 呋喃甲醛
HO CH CH OH H CH C H CHO OH OH
戊糖
稀HCl
O
CHO + 3H2O
2. 物理性质 无色液体,b.p 161.7℃,在光、热空气 无色液体, ℃ 在光、 中,很快产生树脂状聚合物 黄→褐→黑 鉴别方法: 鉴别方法: 遇苯铵醋酸盐溶液呈深红色, 遇苯铵醋酸盐溶液呈深红色,也能鉴别戊糖
7
N N N N H
2 4 8 3 9
5
O
苯并吡喃(氧杂萘) 苯并吡喃(氧杂萘)
第十三章杂环化合物化合物习题答案

(1)
O H2 Ni2
H2 Ni O
HI
ICH2CH2CH 2CH 2I
KCN C 2H5OH
NCCH 2CH 2CH2 CH2CN
H 2NCH2(CH 2) 4CH2NH 2
(2)
N
KMnO4/H N COOCH2 C 6H 5 N
COOH SOCl 2 Et3N N
COCl
C 6 H5CH 2 OH
5. 用简单的化学方法区别下列化合物: (1)吡啶 γ-甲基吡啶 苯胺 (2)吡咯 四氢吡咯 N-甲基六氢吡啶
【解】
(1)苯 胺
(+)白↓
吡 啶
(-) Br2 H2O (-) KMnO4 H+,
(-)
-甲基吡啶
(+)紫色褪去
(2)吡 咯
(+)显红色
四氢吡咯
HCl 松木片
(-) NaNO2HCl
洗涤 蒸馏 干燥
纯净苯
酸层:含 -噻吩磺酸 Na2CO3 洗涤 减压蒸馏 干燥 纯净吡啶
乙酸酐,回流 分离
固相:含1-乙酰基六氢吡啶 有机层 Na2CO3 洗涤 干燥 蒸馏 纯净甲苯
稀HCl
分离
水层:含吡啶盐酸盐
8.合成下列化合物(无机试剂任选): (1)由呋喃合成己二胺 (2)由-甲基吡啶合成-吡啶甲酸苄酯 (3)由 -甲基吡啶合成 -氨基吡啶 (4)由 噻吩合成5-硝基噻吩
(+)黄色油状物
N-甲基六氢吡啶
(-)
(+)无明显现象
6. 使用简单的化学方法将下列混合物中的杂质除去。 (1)苯中混有少量噻吩 (2)吡啶中混有少量六氢吡啶 (3)甲苯中混有少量吡啶
【解】 (1)苯 噻吩 (2)吡 啶 六氢吡啶 (3)甲苯 吡啶
《有机化学》第13章 杂环化合物和生物碱

4-甲基嘧啶
4-甲基噻唑
⑶ 连有取代基的杂环化合物命名时,也可将杂环作为取代基,以侧链为母体来命名。
4-嘧啶磺酸
β-吲哚乙酸(3-吲哚乙酸)
2-苯并咪唑甲酸乙酯
⑷ 为区别杂环化合物的互变异构体,需标明杂环上与杂原子相连的氢原子所在的位 置,并在名称前面加上标位的阿拉伯数字和大写H的斜体字。
2023/6/13
⑴ 卤代反应
在室温条件下,吡咯、呋喃和噻吩能与氯或溴发生激烈反应,得到多卤代物。将反应 物用溶剂稀释并在低温下进行反应时,可以得到一氯代物或一溴代物。碘化反应需要 在催化剂存在下进行。例如:
2023/6/13
6
(2)硝化反应
在低温条件下,吡咯、呋喃和噻吩能与比较缓和的硝化剂硝酸乙酰酯(CH3COONO2) 发生硝化反应,主要生成α-硝基化合物。例如:
3. 颜色反应
生物碱能与一些试剂发生颜色反应,比如钒酸铵的浓硫酸溶液、浓硝酸、浓硫酸、 甲醛、氨水等,利用此性质可鉴别生物碱。比如莨菪碱遇1%钒酸铵的浓硫酸溶液显 红色,可待因遇甲醛-浓硫酸试剂显紫红色等。
二、重要的生物碱 1. 烟碱 又叫尼古丁,主要以苹果酸盐及柠檬酸盐的形式存在于烟草中。其结构式
2023/6/13
13
血红素是卟啉环与Fe2+形成的配合物;叶绿素是卟啉环与Mg2+形成的配合物,它们的 结构式如下:
血红素在体内与蛋白质结合形成血红蛋白,存在于红细胞中,是人和其他哺乳动物 体内运输氧气的物质。叶绿素是植物进行光合作用不可缺少的物质。
2023/6/13
14
二、呋喃衍生物
呋喃甲醛是最常见的呋喃衍生物,又称为糠醛,它是一种无色液体,沸点为161.7℃, 在空气中易氧化变黑,是一种良好的溶剂。 糠醛是合成药物的重要原料,通过硝化可制得一系列呋喃类抗菌药物,如治疗泌尿 系统感染的药物呋喃坦丁、治疗血吸虫病的药物呋喃丙胺等。
有机化学 理论篇 第五版 第13章 杂环化合物

β-吲哚乙酸
呼吸系统疾病专家钟南山医生说:“大家都 知道防范新型冠状病毒的严重威胁,但别忘了, 吸烟和二手烟也是呼吸系统疾病主要的危险因素 之一,对于控烟,我们应该更加坚决。”人们往 往是在生命受到威胁的时候,才会更加重视健康 。但如果早一点看到威胁和其带来的后果,并采 取行动,就可以避免生命过早受到威胁或不可逆 了解吸烟有害健康的的病科变学和道死理亡,。知吸晓烟吸就烟是损最人好害的己例,子增。强自觉抵制 香烟诱惑的意识。远离香烟,营造清新的无烟世界;拒绝烟草,更好 地拥抱健康!
有机化学(理论篇)
第13章 杂环化合物
第13章 杂环化合物
有机化学(理论篇)
【课程思政】
拒绝烟草 拥抱健康
国家卫生健康委和世卫组织 共同发布的《中国吸烟危害健康 报告2020》报告显示,我国吸烟 人数超过3亿人,每年使我国100 多万人失去生命。烟草几乎损害 人体的所有器官,报告中充分列 举了吸烟及二手烟与四大慢性病 即慢性恶性肿瘤、呼吸疾病、心 血管疾病及糖尿病之间的关联,
13.3.1 呋喃 13.3.2 糠醛 13.3.3 噻吩 13.3.4 吡咯 13.3.5 噻唑、吡唑、咪唑及其衍生物 13.3.6 吲哚
13.4 六元杂环化合物
13.4.1 吡啶 13.4.2 喹啉和异喹啉
第十三章 杂环化合物

2.呋喃、吡咯、噻吩的化学性质 (1)亲电取代反应
特点:活性比苯大, 吡硌>呋喃>噻吩>>苯。 亲电试剂主要进入α-位。 遇强酸或氧化剂时容易使环破坏。
a.卤化
呋喃、噻吩、吡咯的卤化反应活性与苯胺和苯酚相 似,在室温与氯或溴反应很激烈,得到多卤代物。为了 避免多取代,反应一般在低温和稀溶液中进行。
吡啶比苯容易还原,在常温常压下可催化加氢得六 氢吡啶(哌啶,Piperidine)。
吡啶
六氢吡啶
六氢吡啶为无色具有特殊臭味的液体,沸点106°C, 熔点−7°C,具有一般二级胺的碱性,碱性比吡啶强,易 溶于水,常用作溶剂及有机合成原料。
(2)卟吩环系化合物
卟吩环是由四个吡咯和四个次甲基(-CH)交替相联组 成的共轭体系。卟吩环呈平面结构,环的中央空穴可以共 价键、配位键和不同的金属结合。在叶绿素中与镁结合, 血红素中与铁结合,维生素中与钴结合。
卟吩环 血红素
三、六元杂环化合物 1.吡啶结构与芳香性
结构特征:a.平面结构 b.成环的六个原子都为sp2杂化,杂原子上的 孤对电子在sp2杂化轨道不参与共轭构成。 c.π电子数符合休克尔规则,具有芳香性。
150-200℃
e.取代呋喃、噻吩、吡咯的定位效应
邻、对位定位基 间位位基
练习:P343,17.10
(2)加成反应
呋喃、吡咯、噻吩催化加氢,得饱和的杂环化合物。
200-250℃
四氢吡咯(有机碱)
50℃
四氢呋喃(有机溶剂)
四氢噻吩
(3)双烯合成
呋喃、吡咯、噻吩具有共轭双烯的性质,与亲双烯 体可进行Diels-Alder反应。
(4)吡咯的酸碱性
吡咯的碱性极弱(pKb=13.6),这是因为氮原子中 的未成键电子对参与了环的共轭,不能再与酸结合。
有机化学答案(高占先版)—第13章 杂环化合物

---------------------------------------------------------------最新资料推荐------------------------------------------------------ 有机化学答案(高占先版)—第13章杂环化合物第 13 章杂环化合物 13-1 命名下列化合物或写出结构式。
(1) 4-甲基-2-乙基噻唑(2) 2-呋喃甲酸(3) N-甲基吡咯(4) 2,3-吡啶二甲酸(5) 3-乙基喹啉(6) 5-异喹啉磺酸(7) 3-吲哚乙酸(8) 6-氨基嘌呤(9) 4-甲基-2-乙基咪唑知识点:杂环化合物的命名。
13-2 下列化合物是否是极性分子?若是,请标出分子偶极矩的方向。
它们都是极性分子,偶极矩方向如下:NHONHONH2N芳香结构知识点:偶极矩的判断。
13-3 下列化合物有无芳香性?(1)、(2)、(4)、(5)和(6)有芳香性;(3)无芳香性。
知识点:杂环化合物的芳香性判据。
13-4 指出下列各组化合物的碱性中心,按碱性由强到弱排列成序。
(1)氮原子为碱性中心, C>B>D>A。
(2) A 的两性氮均为碱性中心; B 氮原子为碱性中心; C 中双键氮为碱性中心。
1 / 7A>C>B, B 由于孤对电子参与芳香性大键,故碱性极弱。
知识点:含氮化合物碱性比较。
13-5 判断下列化合物中每个氮原子的杂化状态并比较氮原子的碱性强弱。
NClNHCH2CH2CH2CH2N(CH3)2NNCH2CH2NH2HNNCH3CH3CH3OCOH3CHNABCABCABC (1)(2)(3) (1) A. sp3杂化 B. sp2 杂化 C.sp3杂化;碱性:C>B>A。
(2) A. sp2杂化 B. sp2 杂化 C.sp3杂化;碱性: C>A>B。
(3) A. sp2杂化 B. sp3 杂化 C.sp3杂化;碱性: C>B>A。
知识点:杂化类型判断,碱性判断。
有机化学第13章杂环化合物
2)若环内不止一个杂原子时,则按O、S、N的顺序编 号。若杂原子相同,则使杂原子的编号尽可能小。如:
N
CH3 S 5-甲基噻唑
二、五元杂环化合物 1、结构和芳香性
X = O : 2s22p4 X X = S : 3s23p4
X = NH : 2s22p3 所有原子均为sp2 杂化,杂化轨道表示为:
O:
分子具有平面结构,
S:
有Π56大Π键。所以
N:
有芳香性。
杂化轨道
未杂化轨道
2、鉴别 呋喃蒸汽遇被盐酸浸过的松木片呈绿色; 噻吩在浓硫酸存在下,与靛红加热显示蓝色; 吡咯蒸汽遇被盐酸浸过的松木片呈红色。
3、化学性质 1)芳香性
分子中存在Π56大Π键,Π电子云密度比苯大, 所以它们亲电取代反应的活性比苯高。
第十三章 杂环化合物
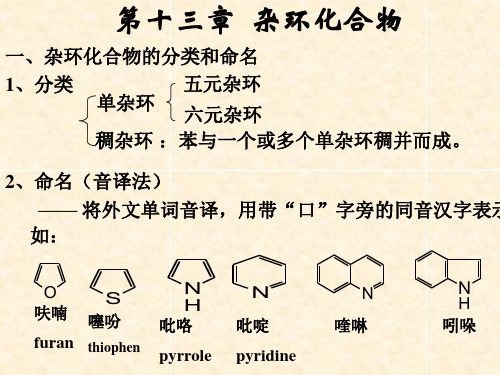
一、杂环化合物的分类和命名
1、分类
五元杂环
单杂环 六元杂环
稠杂环 :苯与一个或多个单杂环稠并而成。
2、命名(音译法)
—— 将外文单词音译,用带“口”字旁的同音汉字表示 如:
O 呋喃
furan
S 噻吩
thiophen
N H 吡咯
pyrrole
N 吡啶 pyridine
N 喹啉
N
H 吲哚
2、性质
1)碱性:
<
N H
NH2
<
.N.
< NH3 < 脂肪胺
pKb: 13.6 9.5
8.8 4.75 3.2
2)成盐
N + HCl
N*HCl (或
+ NHCl )
NH3
应用:分离提纯吡啶。
3)亲电取代反应
有机化学+第14章+杂环化合物2007
CH3CH2
δ+ δCH CH2
δ+ δHX
δ- δ+ CF3 CH CH2
δ+ δHX
CH3CH2 CH CH2 XH
CF3 CH CH2 HX
δ+ δ-
CH3 CH CH2 + HBr
H3C CH CH2 Br H
双 键 上 连 有 烷 基 : CH3CH2, CH(CH3)2,C(CH3)3
第五节 烯烃的α-H反应:
一、卤代反应
CH3 C
H
H C
H
CH3 C
H
H C
H
Cl2, 500℃
ClCH2 C
H
O
hv
+
N-Br
O NBS
H C
H
BrCH2 C
H
H C
H
烯烃与卤素究竟是发生加成反应还是α-卤代反应,取决于反
应温度。通常是较低的温度有利于加成,高温或低浓度卤素 有利于卤代。NBS: N-溴代丁二酰亚胺
这类定位基一般可使苯环活化(卤素除外)。
a. 带负电荷的离子,如:
O
b. 与苯环直接相连的原子都有未共用电子对,且以单键与其 它原子相连。可以形成 p –π共轭,使苯环电子云密度增加。
N
O
X
CH3 N
CH3
=
O O C CH3
c. 与苯环直接相连的基团可与苯环的大π键发生π–π共
轭、超共轭作用,增加苯环电子云密度。
第十三章 杂环化合物
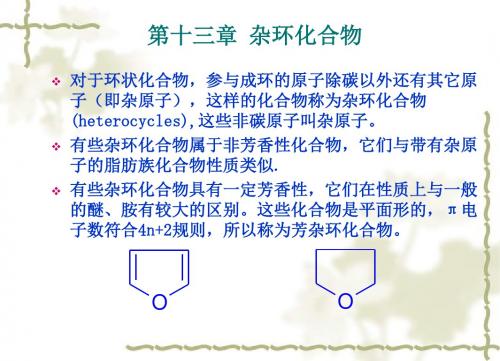
对于环状化合物,参与成环的原子除碳以外还有其它原 子(即杂原子),这样的化合物称为杂环化合物 (heterocycles),这些非碳原子叫杂原子。
杂环化合物

第13章杂环化合物本章重点介绍杂环化合物的分类和命名;五元杂环化合物的结构特点、芳香性、亲电取代反应,六元杂环化合物的结构特点、芳香性、亲核取代反应;五元、六元杂环化合物的衍生物及其生物活性;稠杂环化合物的结构特点等。
在环状有机化合物中,构成环系的原子除碳原子外,还含有一个或多个非碳原子时,叫做杂环化合物(heterocyclic compound);环上除碳以外的原子称为杂原子,常见的杂原子有氧、硫、氮等。
大多数杂环化合物具有不同程度的芳香性,环也比较稳定。
因此,杂环化合物是有机化合物中数量最庞大的一类,约占总数的三分之二以上。
自然界中最具有强烈生物活性的天然有机化合物,绝大多数正是杂环化合物。
例如:对核酸(nucleic acid)的活性起决定作用的碱基就是嘌呤(purine)和嘧啶(pyrimidine)的衍生物。
又如叶绿素(chlorophyll)、氨基酸(amino acid)、维生素(vitamin)、血红素(haeme)、核酸(nucleic acid)、生物碱(alkaloid)等,大多数都在生命的生长、发育、遗传和衰亡过程中起着关键作用。
在现有的药物中,杂环类化合物占了相当大的比重。
它们应用于各种疾病和医疗领域,其数量之大和种类之多,是难以想象的,比如我们非常熟悉的青霉素(benzylpenicillin)、头孢菌素(先锋霉素cephalosporin)、喹喏酮(Quinolone)类以及治疗肿瘤的5–Fu(5–Fluorouracil)、喜树碱(comptothecin)、紫杉醇(Taxol)等,都是含有杂环的化合物。
内酯、交酯、环状酸酐、内酰胺性质上与相应的开链化合物相似,它们不列入杂环化合物中讨论。
本章将着重讨论五元和六元具有芳香性的化合物。
你在学完本章后,应该能回答以下问题:1.你能写出一些常见杂环化合物的结构和名称吗?2.为什么吡咯有一定的酸性而吡啶却显碱性?3.为什么吡啶可以任意比例溶于水,同时又能溶于其它有机化溶剂?4.为什么吡啶既能起亲电取代反应又可进行亲核取代反应?5.你能写出青霉素、头孢菌素、咖啡因、尼群地平、雷米封等常用药物的结构及英文名称吗?13.1 杂环化合物的分类和命名法杂环化合物的分类是以杂环的骨架为基础,按环的形状分为单杂环和稠杂环,最有意义的是五元杂环和六元杂环,详见表13–1。
13-杂环

N9 H 嘌呤 purine
N3
N 10
4
蒽
吖啶 acridine
二、命名
杂环化合物的命名,包括基本环和环上取代基 两部分,取代基的命名与一般化合物大体一致。
1.杂环基本环的命名
简单的杂环(看作杂环的基本环)都有一特 定的名称,按英文音译名选择相应的汉字,旁 边加“口”,表示环状化合物:
+ 2 HCl O H2 己 二胺 H2O 己 二酸 Cl(CH2)4Cl NaCN NC(CH2)4CN
二、α-呋喃甲醛(糠醛)
1. 制备
C5 H8O4 + n H2O n 稀HCl n C5 H10O5
戊聚糖
HO CH CH OH H
戊醛糖
HC HC O CH C CHO + H2O
H CH HO C OH
氧化硫的加合化合物。
+ SO3 N
CH2Cl2 室温
N SO3
(固体,含量90 %)
噻吩比较稳定,既可以直接磺化(产率稍低), 也可以用温和的磺化试剂磺化。
O
ClCH2CH2Cl
SO3-
N H
O
+
N SO3
r. t. 3 days N H
-
O3 S
O
SO3-
N H
ClCH2CH2Cl
Ba(OH)2
CH2 CH2 CH3 CH3 + 4S 600~650 oC + 3 H2S S
2 HC CH + S
2 HC CH + H2S
300 oC S
Al2O3 400 oC S +
H2
3.鉴别:
有机化学-第十三章

3.命名
取代基位号及名称加上母环的名称即为杂环化合物的 名称,例如:
课堂练习
1、命名下列杂环化合物: (1)
Br
(2)
CH3
N
O
NO2
2 – 硝基 – 4 –溴呋喃
3 – 甲基吡啶
杂环化合物的结构与芳香性
一、五元单杂环化合物的结构和芳香性
五元单杂环如呋喃、噻吩、吡咯,在结构上,都符 合 Huckel 的关于芳香性的规则,即环上原子共平面,彼 此以 σ 键相连接,四个碳原子各有一个电子在 p 轨道 上,杂原子有两个电子在 p 轨道上,这些 p 轨道都垂直 于σ 键所在的平面,相互重叠形成大 π 键——闭和的 共轭体系,π 电子数目为4n+2。结构如图所示:
亲电取代反应主要发生在 α 位上
二、定位规律
对五元杂环的亲电取代反应环上取代基有一定的定位 作用,以噻吩为例,说明如下: (1)当 α 位上有邻对位定位基(x)时,亲电试剂(E)主 要进入 5 位,3 位次之:
(2)当 α 位上有间定位基(Y)时,则 E 主要进入 4 位,少量进入 5 位:
近年发现不少天然存在的呋喃或氢化呋喃衍生物,具 有明显的生物活性或药用价值。例如,从重斑病感染的薯 类植物块根中分离的苦味成为含多种呋喃衍生物,如3-呋 喃甲酸,巴他酸(bacatic acid),番薯酮等
二、α-呋喃甲醛
1.来源与制备 呋喃甲醛最初是从米糠中得来,故俗称糠醛,因为这 些农副产品中都含有戊聚糖,在稀酸作用下水解成戊醛糖 ,再进一步脱水环化,得到糠醛:
4)综上所述,它们的芳香性由强到弱的顺序为:
二、六元单杂环化合物的结构和芳香性
吡啶具有六元单杂环的典型结构和苯的结构很相似, 是苯中的一个碳原子被氮原子代替,氮原子以 sp2 杂化 轨道和两个相邻碳原子的 sp2 杂化轨道形成两个 σ 键 。环上每个原子均有一个 p 轨道垂直于环的平面,组成 闭合的6电子大 π 轨道,因此,吡啶环也有芳香性。吡 啶的结构如图所示:
杂环化合物

沉淀剂是复盐、杂多酸和某些有机酸,例如,碘碘化钾、碘化汞钾、碘化铋钾、磷钼酸、硅钨酸、 、 苦味酸和鞣酸等。不同生物碱能与不同的沉淀试剂作用 呈不同颜色的沉淀。 (3) 显色反应 一些氧化剂或脱水剂,例如,高锰酸钾、重铬酸 钾、浓硝酸、浓硫酸、钒酸铵或甲醛的浓硫酸溶液等。 它们能与不同的生物碱反应呈现不同的颜色。 显色剂在色谱分析上常作为生物碱的鉴定试剂。
三、重要的生物碱
1.烟碱
又名尼古丁,剧毒,属吡啶衍生物类生物碱。为 无色或微黄色液体,在烟草中以柠檬酸盐或苹果酸盐 的形式存在。烟碱也是有效的农业杀虫剂。
2.麻黄碱
3.咖啡碱和茶碱
咖啡碱
茶碱
4.吗啡和可待因
吗啡
可待因
5.小檗碱
6.莨菪碱
7.利血平
环醚、内酯、内酐和内酰胺等,不属杂环化合物。
第一节
杂环化合物的分类和命名
一、杂环化合物的分类
五元杂环 单杂环
根据环的形式分类
杂 环
六元杂环。 芳环并杂环 杂环并杂环。 含一个杂原子杂环
稠杂环
根据环中杂原子的数目分类
含两个杂原子杂环
二、杂环化合物的命名
1.译音法 根据杂环化合物的英文名称,选择带“口”字偏 旁的同音汉字来命名。
Pd
S
+ 2H2
0.2~0.4MPa
S 四氢噻吩
N H
Ni + 2H2 200℃
N H 四氢吡咯
第四节 六元杂环化合物
一、吡啶的结构Biblioteka ..N原子为sp2杂化
. .
. .
. .
吡啶π 电子数符合休克尔规则,具有芳香性。吡 啶的芳香性比苯弱。
吡啶
二、吡啶的性质 1.碱性
有机化学 第13章 杂环化合物

-5-30℃
O 2—硝基呋喃(35 %)Fra bibliotekNO2
3.磺化
O
SO3—吡啶 CH2Cl—CH2Cl
O SO3H
2—呋喃磺酸 (41%)
4.傅瑞德尔—克拉夫茨酰基化
+ (CH3CO)2O
O
BF3 CH3COOH
O
C O
CH3
2—乙酰基呋喃 (75—92%)
(二)加成反应 1.催化加氢
2.1, 4-加成反应(狄尔斯—阿尔德反应:D-A反应)
H N N H3C O N
O
CH3 N
N CH3
咖啡碱
N
核酸分子中有腺嘌呤和鸟嘌呤。
习题1
(1)
习题2
O CHO (2) O CH2OH
(1)2—甲基呋喃; (2)5—甲基—2—呋喃甲酸; (3)2—噻吩磺酸; (4)N—甲基吡咯 (或1—甲基吡咯); (5)3—硝基吡啶; (6)2,3—吡啶二甲酸; (7)2—甲基喹啉; (8)8—羟基喹啉。
(二)化学性质 1.弱碱性 与强酸可成盐。 2.亲电取代反应 发生在苯环上。
NO2
HNO3,H2SO4
N
0℃
+
N NO2 N
3.亲核取代反应
发生在吡啶环上。
NaNH2 液NH3
NH2
N
N
4.氧化反应
苯环先被氧化。
KMnO4 100℃
COOH COOH
N
2,3-吡啶二甲酸
N
△ _ CO 2
COOH N
(四)几种常见稠杂环。
第十三章 杂环化合物

OH N N OH N N OH H
尿酸
尿酸是嘌呤最重要的衍生物,人的血液内含少量尿酸, 是核蛋白的一种代谢产物。鸟类、爬虫类的生物,蛋白 质的代谢产和尿酸,而人和其他高级动物则是尿素,当 然尿内也含有少量尿酸。
OH N OH N i N N OH H O
尿酸
O N N ii N NH O
核酸的生命活动很重要,它决定生命的遗传及蛋白质的 合成作用的物质,核酸中存在的嘌呤环系是腺嘌呤和鸟 嘌呤。
S
+ I2
0℃ S I
S
+
CH3COOH Br2 室温
S
+ HBr Br
I I N H I I
+ 4I2 +4NaOH
N H
+ 4NaI + 4H2O
吡咯反应活性更高,常卤化得四卤化物,即使与 碘反应也不例外:
2. 加成反应 呋喃、噻吩、吡咯均可进行催化加氢反应,失 去芳香性而得饱和杂环化合物。呋喃、吡咯可用 一般催化剂,噻吩能催化剂中毒,需用特殊催化 剂:
+ CH3C
OH
+
O
O CH3C ONO2
50C ~ 300C O
+ CH COOH
3
NO2
+
S
O 00C CH3CONO2 S
100C N H
NO2 (主)
+
NO2 S
(次)
+
N H
CH3COONO2
NO2
(主)
+
N H
NO2
(次)
(2)磺化 呋喃、噻吩、吡咯也需避免直接用硫 + 酸磺化,常用温和的非质子磺化试剂(H 与杂原 子结合,就会破坏环的共轭体系),常用吡啶与 SO3加成物作为磺化剂进行反应:
第十三章杂环化合物及生物碱

4
CH3
N3
N2 1
H
4 –甲基咪唑
(3)如果环上有多个不同杂原子时,按氧、硫、氮得 顺序编号
H3C 4 N3
H3C 5
2
S1
4,5–二甲基噻唑
(4 ) 当只有1个杂原子时,也可用希腊字母编号,靠
近杂原子得第一个位置就是α-位,其次为β-位、γ-
位等。
β
O α CH3
CH3
γ β
α
N
α-甲基呋喃 γ-甲基吡啶
+ NaNH2
N
+ NaOH
N
NH2
2、 加成反应
+ 2 H2 Ni
O
O
+ 2 H2 MoS2
S
S
+
2 H2 Pd
N
H
N
H
呋喃、吡咯均可进行催化加氢反应,噻吩中得硫能使
催化剂中毒,需使用特殊催化剂加氢。
吡啶比苯易还原,用金属钠和乙醇可使其还原。
Na+ C2H5OH
N
N H
+ 2 H2 Pt
N
N
H
呋喃、噻吩、吡咯分子中各原子间得键长并 不完全相等,因此芳香性比苯差。
电负性强弱顺序就是:氧>氮>硫, 芳香性强弱顺序就是:苯>噻吩>吡咯>呋喃。
2、 六元杂环
吡啶
N..
N●● sp2杂化
吡啶π电子数(6)符合休克尔规则,具有芳香性。
吡啶分子中,氮原子得电负性比碳大,使吡啶环上 碳原子得电子云密度相对降低,所以此类杂环称为缺 电子芳杂环。
第十三章杂环化合物及生物碱
(3)单杂环根据杂原子得数目不同又分为含一个 杂原子、含两个杂原子得单杂环等
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4、在空气中色变深并聚合成树脂状;
5、在极稀的情况下,有香味,可作为香料。
例如
+ C6H5COONO2
N
H
CH3CN 0C
NO2
N
H
=O
OH N H O2
H N
=O
OH H O N H
H N
-羟基吲哚
N H
OH
靛蓝,不溶 于水,
靛白,溶 于 水
靛蓝染料来自于松蓝植物,它含 有-羟基吲哚 ,经空气 中发酵后成靛蓝染料,靛蓝不溶于水,必须先将它用锌粉、亚
2、加成反应
(1)加氢:都 能发生,噻吩困难些
氢气+镍(钯) :全还原 钠+乙醇 、锌+盐酸:可局部还原
Ni/H2 O O HCl CH2CH2Cl CH2CH2Cl
NaCN
CH2CH2CN CH2CH2CN
H2O
CH2CH2COOH CH2CH2COOH
四氢呋喃(HTF) 优秀的有机溶剂
(2)双烯合成:只有呋喃能发生。
嘧啶 1,3-氨杂苯
吡咯 氨杂茂
quinoline
喹啉 1-氮杂萘
S
thiophene
O
furan
N
pyridine 吡啶,氮杂苯
噻吩
呋喃
杂环母核编号法: *一个杂原子的:杂原子编1号 *二个或以上杂原子的:从O- S - N - C的顺序编号 *二个相同杂原子:连有H或基团的杂原子为1号 *稠环中的公用碳不编号 *嘌呤的编号特殊 *注意:在不违反上述原则下,尽量使取代基为小号
SO3-N+
H+ N SO3H
不用浓硫酸磺化
-吡咯磺酸
+ (CH3CO)2O S
H3PO4 S
+ C CH3 CH3COOH O
2-乙酰基噻吩
+ 95%H2SO 4 S
+
25 C S
SO 3H
噻吩-2-磺酸
N H - H2O + C6H5N2Cl CH3COONa N H N=N C6H5
噻吩因很容易磺化而溶于 H2SO4,比苯 容易磺化 ,利用这一性质可以除去苯或 汽油中的噻吩.
=O O =O
O
O
=O O
=O
(3) 吡咯的弱酸性
NH2 N Kb 3.8 10-10 H 2.5 10-14
*N-H的氢易于离解,表现出一定的弱酸性。
OH Ka 10
-10
N H 10-15
R-OH 10-18-25
反应举例:
KOH
N K+
R-X N RX R N R + MgX2
N H
RMgX N MgX
3 4
三、卟啉类化合物
δ
8
β
5
卟啉类化合物的母体是一个卟吩环。
7
卟吩环是由四个吡咯环以 -碳原子通过四个次甲基(-CH=)
6
交替连接起来的,含 有18个 电子,是大芳香体系。
重要衍生物 叶绿素:是镁的络合物。存在于绿色植物中。能进行光 合作用。 血红素:是亚铁离子的络合物。存在于动物的红细胞中, 具有载氧的功能。
四、嘌呤及基衍生物
是由嘧啶和咪唑并联而成稠杂环化合物。 它的羟基和氨基衍生物是核酸的重要组成部分,
6 1N 2 N 3
NH2 N N N H N N N N H
5 4 N9 H
7 N 8
NH N
OH N
注意:编号顺序
腺嘌呤
鸟嘌呤
五、尿酸
13-5生物碱
*吡咯、呋喃对酸敏感,H+易与O、N结合成盐,
发生开环聚合反应,故不能用强酸性亲电试剂。
反应举例如下:
O O
低温,不加催化剂
+ Br2 O
乙酐+硝酸
0C
乙酰基硝酸酯
O
Br +
HBr
2-溴呋喃
CH3COONO2 O -5 C -30 C O
NO2
不用混酸硝化
2-硝基呋喃
+ N SO3N ClCH2CH2Cl N
碱性大
(3)吡啶重要的衍生物
COOH N N CONH2 N CH2OH
烟酸 -吡啶甲酸
N N CH3
烟酰胺
CONHNH2 N
维生素B6
烟碱(尼古丁)
雷米封 -吡啶甲酰肼
§ 13-4 稠杂环化合物
代表化合物:喹啉和吲哚
一、喹啉
5
结构分析:
8
N
(一)主要化学性质
1、SE 反应
喹啉能发生 SE 反应, 但活性不如苯,主要发生在 苯环的 5-位和 8-位上。
吡啶发生 SE 反应的活性不如苯, 且主要发生在 3-位。
3
N
AlCl3 + Cl2 100 C
Cl N
(3-氯吡啶)
NO2 N
亲电取代反应 条件提高
+ 浓HNO3 N
浓 H2SO 4
300 C
(3-硝基吡啶)
SO 3H N
+ 发烟 H2SO 4 N
HgSO 4 200 C
(吡啶-3-磺酸)
不发生付-克反应(相似于硝基苯)
OH
=O
O O
花青素正离子
=O
O +
OH OH OH O + OH OH
OH
OH
O
黄芩素
OH OH OH O +
H
OH
-
OH OH OH O PH=7-8 OH OH OHH+
+ H OH
OH
P >3 OH
花青素正离子 红色,存在于 玫瑰中
OH
淡紫色
OH
O PH>11
=O
花青素负离子,蓝色。 存在于矢车菊中
KMnO4 N N Na +C2H5OH
COOH COOH
练习
KMnO4/H+ N CH3
HOOC
N
COOH N COOH
二、吲哚
1、具有芳香性,但电子离 域 不彻底,电子云分布不均匀; 2、亲电取代发生在3-位上;反应条件同吡咯(磺化用吡啶 三氧化硫络合物,硝化用乙酰硝酸酯); 3、性质相似于吡咯。能使盐酸松木片变红
5
3-甲基吡啶
N
3
N 1
CH3
CH3
N
H3 C
8
HO
3,8-二甲基喹啉
8-羟基喹啉
如果环内含有不止一种杂原子时,编号的 先后顺序是 O、S、N、C。 例如
H3C HOCH2CH2 S 1 N3
4-甲基-5-(-羟乙基)噻唑
(以杂环作为母体来命名)
带有复杂取代基的杂环化合物的命名
CH2 COOH N H
N
稠杂环化合物
N
N H
二、命名
1、杂环母核命名:
音译法(杂环外文名字音译,再加“口”字旁)
碳环母核名前加“杂”字。
2、复杂杂环化合物的命名
先将母核编号 取代基简单时:杂环为母体,注明取代基位次 取代基复杂时:取代基为主链,杂环当作取代基
杂环母核音译命名法: N
N
N H
N
pyrimidine
pyrrole
(2)
吡啶的重要反应
CH3NH2 > > N 8.8 9.3 NH2 >
A、碱性
N R 3.36
Pkb
不能与乙酸酐、对甲苯磺酰氯发生酰化反应(因没有N-H键)。
N + HCl - KOH + N HCl N + KCl + H2O
不溶于水
溶于稀盐酸中
可作为吡啶的除去、分离、精制的方法。
B、亲电取代反应
一、五元杂环化合物的化学性质
三种基本性质:
*具有芳香性,能发生亲电取代反应;
*芳香性(或环稳定性)不如苯; *都 具有一定程度的不饱和性,能发生双键加成反应。
化合物的稳定性顺序: 苯噻吩吡咯呋喃
1、亲电取代反应
总的规律:
*亲电取代反应发生在位上
*亲电取代活性比苯大,顺序如下:
吡咯>呋喃>噻吩>苯
NO2
混酸
0C N Br + N Br2 + 浓H2SO 4 , Ag2SO 4
+ NO2 N
+ N Br N
H2SO 4 浓 220 C SO 3H N
2、SN 反应
喹啉能发生 SN 反应, 主要发生在吡啶环的 2- 位 上。
+ KNH2 N
二甲苯
100 C N NH2
3、氧化还原反应
氧化反应优先发在苯环上,还原反应优先发生在吡啶环上。
四、
§ 13-3 六元杂环化合物
一、吡啶
N
(1) 结构分析:
` ` ` ` ` N N `` `
*C、N都是SP2杂化,所有原 子共平面 * N原子的P轨道上只有一个电 子参与环上共轭,一对未共用电子 对处于SP2轨道上,未参与环上共 轭。 *具有芳香性。但电子离域不彻 底,在-位上具有较大的电子云密 度
能分解格氏试剂
思考:
N H + Ac2O N H COCH3 N COCH3
还是
?
(4)氧化反应
呋喃和吡咯易被 氧化;噻吩比较稳定。 (5)检别反应: 呋喃:松 木片 盐酸反应变绿色; 或加丁烯二酸酐产生白色沉淀。 吡咯:松木片加盐酸反应变红色。
噻吩:加靛红和浓硫酸产生蓝色溶液
二、呋喃甲醛(糠醛)
第十三章 杂环化合物
*杂环化合物是指: 成环的原子除碳以外,还有其它原子参与的比 较稳定的一类化合物。 *常见杂原子:O、S、N。
