中国现代化工之母──氯碱工业
中国现代化工之母──氯碱工业-沪科版高一化学上册教案

中国现代化工之母──氯碱工业-沪科版高一化学上册教
案
一、教学目标
1.了解氯碱工业的发展历史和现状;
2.掌握氯碱工业的原理和技术;
3.学习氯碱工业的应用。
二、教学重难点
•重点:氯碱工业的发展历史和技术原理;
•难点:氯碱工业的设备和安全生产。
三、教学内容及教学步骤
1. 氯碱工业的发展历史
氯碱工业的起源
•安东尼·莱文霍克于1774年用电解法制备了氢氧化钠;
•葛缤德在1886年用电解法制备了氯气。
氯碱工业在中国的发展
•1950年代开展;
•1960年代发展迅速;
•1978年后得到改革和发展。
2. 氯碱工业的技术原理
氯碱工业的原理
氯碱工业是利用电解法将食盐水溶液分离成氯气、氢气和氢氧化钠的生产过程。
氯碱工业的技术流程
① 准备原料
② 电解
③ 分离产物
氯碱工业的设备
•电解槽
•收集器
•氢气收集槽
•离子交换膜
氯碱工业的安全生产
•确保电解槽、收集器的清洁;•保证电解槽的稳定性;
•严格控制温度、电流和电压。
3. 氯碱工业的应用
•氢氧化钠的应用
•氯气的应用
•次氯酸钠的应用
•氢气的应用
四、课后作业
•完成练习题;
•思考氯碱工业的未来发展方向。
五、教学反思
氯碱工业是中国现代化工的重要组成部分。
学生在本节课的学习中,了解了氯碱工业的发展历史、技术原理、设备和安全生产等方面的知识。
通过此次学习,他们对中国现代化工的重要性有了更深刻的理解和认识。
氯碱工业简述

氯碱生产简介化工二班张晨200900112073【摘要】我国是世界氯碱生产大国,氯碱工业是以盐和电为原料生产烧碱、氯气、氢气的基础原材料工业,氯碱产品种类多,关联度大,其下游产品达到上千个品种,具有较高的经济延伸价值,它广泛应用于农业、石油化工、轻工、纺织、建材、电力、冶金、国防军工、食品加工等国民经济各命脉部门,在我国经济发展中具有举足轻重的地位。
据有关部门测算1万吨氯碱产品所带动的一次性经济产值在10亿元人民币以上。
我国一直将主要氯碱产品产量及经济指标作为我国国民经济统计和考核的重要指标。
因为知识有限,本文针对氯碱工业的原理方法,发展历史,生产现状作简要介绍。
【关键字】氯碱工业电解方法发展现状研究方向一、生产原理氯碱工业利用电解饱和食盐水溶液制取烧碱(氢氧化钠)和氯气并副产氢气的生产过程。
过程包括盐水精制、电解和产品精制等工序,其中主要工序是电解,其中电解主要采用电解饱和食盐水反应原理。
1.电解过程的反应:(1)电解过程的主反应食盐水溶液中主要有四种离子,即Na+、C1一、OH一和H+。
当直流电通过食盐水溶液时,阴离子向阳极移动,阳离子向阴极移动。
当阴离子到达阳极时,在阳极放电,失去电子变成不带电的原子;同理,阳离子到达阴极时,在阴极放电,获得电子也变成不带电的原子。
离子在电极上放电的难易不同,易放电的离子先放电,难放电的离子不放电。
在阴极上,H+比Na+容易放电,所以,阴极上是H2放电,电极反应为:2H+一2e-→H2在在阳极上,C1-比OH-易放电,所以,阳极上是Cl2放电,其放电反应为2C1-一2e-→C12不放电的Na+和OH一则生成了NaOH。
电解食盐水溶液的总反应式为2NaCl+2H2O →2NaOH+CI2十H2(2)电解过程的副反应随着电解反应的进行,在电极上还有一些副反应发生。
在阳极上产生的C12部分溶解在水中,与水作用生成次氯酸和盐酸:Cl2+H20→HCl+HClO电解槽中虽然放置了隔膜,但由于渗透扩散作用仍有少部分NaOH从阴极室进入阳极室,在阳极室与次氯酸反应生成次氯酸钠。
氯碱工业ppt1 人教课标版

NaCl
NaOHΒιβλιοθήκη Na+ + ClNa++OH-
HCl
H2SO4
H+ + Cl2H++SO42-
电解饱和食盐水原理分析
在阳极: 2Cl- -2e 在阴极: 2H++2e 总反应式:
通电
Cl2 H2
2NaCl+2H2O
2NaOH+H2 +Cl2
电解:电解质在通电的条件下发生的氧化还原反应。
重要的化工基本原料
中国公众科技网
/
中国化工企业互联网
思考题
电解饱和食盐水一段时间后, 再次收集阴阳两极上得到的气体, 结果测得气体体积之比为2:1,为 什么?
思考题
若电解熔融状态下的氯化钠, 请推测可能的产物是什么?
思考题
上海氯碱总厂
近代著名实业家——吴蕴初
(1891—1953)化工专 家,著名的化工实业家,我国氯碱工 业的创始人。二三十年代,他研究成 功廉价生产味精的方法,在我国创办 了第一个味精厂、氯碱厂、耐酸陶器 厂和生产合成氨与硝酸的工厂。他大 力支持学会活动,资助清寒优秀学生 上大学培养成高级科技人才。他为我 国化学工业的兴起和发展作出了卓越 的贡献。
课后作业
短期作业: 1。课本P32第4题、第5题。 2。查询资料,了解吴蕴初先生的生平事迹。 中期作业: 电解水和电解饱和食盐水的比较研究。 长期作业: 对我国氯碱工业的发展历史及现状开展研究, 并以制作个人学习网页的形式展示相关成果。
相关网站推荐
中国氯碱网 /
中国现代化工之母
食盐的用途
氯气的检验方法
湿润的淀粉KI试纸遇氯气变蓝:
中国现代化工之母──氯碱工业

京沪高速公路淮安路段液氯的泄漏
新华网报道:某年某月某日,京沪 高速公路淮安路段一辆满载液氯 的液罐车和对面来车相撞 ,大量 液氯外泄。消防员到达现场,并 用水驱散氯气,4小时后险情终被 排除。此时,消防员的头上的金 属国徽,以及身上的金属领花、 纽扣等严重受蚀。绿色消防服也 严重褪色。是什么物质使金属国 徽,领花受蚀,什么物质又使消 防服严重褪色?
3、某同学用经过氯气消毒的自来水配制下列物质的溶液, 不会引起溶液明显变质的是( A ) A、KCl B、NaOH C、AgNO3 D、FeCl2
课后作业
1. 复习本节学习内容; 2. 《乐学》P63 知识点一 3. 《乐学》P65 随堂练习1、2、3、4、6题 4. 活页P 42 1、2、3、4、8题
舍勒 (1742~1786) 瑞典化学家。
京沪高速公路淮安路段液氯的泄漏
• 新华网报道: 某年某月某日,京沪高速 公路淮安路段一辆满载液氯的液罐车 和对面来车相撞 ,大量液氯外泄。颜据色目 击者描述气:味“一股黄绿色的气体就像探 照灯光一样,‘唰’地射向空中,并 有刺鼻的味道,眼睛也熏得睁不开溶。解”性
酚酞变红后褪色 实验中酚酞褪色的原因是什么?
①因为Cl2与碱发生了反应 ②因为氯水中含有的HClO起漂白作用
你是否能设计实验证明哪种猜测是对的呢?
取褪色后的溶液少量滴加几滴NaOH溶液。若溶液 恢复红色,说明是原因①;若溶液未恢复红色,说 明是原因②
(4 )与碱反应
2NaOH+Cl2=NaCl+NaClO+H2O 常用NaOH 吸收多余Cl2
浩瀚的海洋 资源的宝库
• 海水中含盐3%,主要为氯化钠; • 还含有氯化镁、硫酸镁等。
氯在自然界中以化合态存在(主要是NaCl)。
氯碱工业发展史

氯碱工业发展史氯碱工业是基本无机化工之一。
主要产品是氯气和烧碱(氢氧化钠),在国民经济和国防建设中占有重要地位。
随着纺织、造纸、冶金、有机、无机化学工业的发展,特别是石油化工的兴起,氯碱工业发展迅速。
氯碱工业的形成18世纪,瑞典人K.W.舍勒用二氧化锰和盐酸共热制取氯气:这种方法称化学法。
将氯气通入石灰乳中,可制得固体产物漂白粉,这对当时的纺织工业的漂白工艺是一个重大贡献。
随着人造纤维、造纸工业的发展,氯的需要量大增,纺织和造纸工业,成为当时消耗氯的两大用户。
用化学方法制氯的生产工艺持续了一百多年。
但它有很大缺点,从上述化学反应式,可见其中盐酸只有部分转变为氯,很不经济;且腐蚀严重,生产困难。
烧碱最初也用化学法(也称苛化法,即石灰-苏打法)生产:Na2CO3+Ca(OH)2─→2NaOH+CaCO3电解食盐水溶液同时制取氯和烧碱的方法(称电解法),在19世纪初已经提出,但直到19世纪末,大功率直流发电机研制成功,才使该法得以工业化。
第一个制氯的工厂于1890年在德国建成,1893年在美国纽约建成第一个电解食盐水制取氯和氢氧化钠的工厂。
第一次世界大战前后,随着化学工业的发展,氯不仅用于漂白、杀菌,还用于生产各种有机、无机化学品以及军事化学品等。
20世纪40年代以后,石油化工兴起,氯气需要量激增,以电解食盐水溶液为基础的氯碱工业开始形成并迅速发展。
50年代后,苛化法只在电源不足之处生产烧碱。
电解法的发展氯碱生产用电量大,降低能耗始终是电解法的核心问题。
因此,提高电流效率,降低槽电压和提高大功率整流器效率,降低碱液蒸发能耗,以及防止环境污染等,一直是氯碱工业的努力方向。
初期为了连续有效地将电解槽中的阴、阳极产物隔开,1890年德国使用了水泥微孔隔膜来隔开阳极、阴极产物,这种方法称隔膜电解法。
以后,改用石棉滤过性隔膜,以减少阴极室氢氧离子向阳极室的扩散。
这不仅适用于连续生产,而且可以在高电流效率下,制取较高浓度的碱液。
2.1中国现代化工之母氯碱工业(llz)

}
}
}
(稍过量 2CO3 ) CO32稍过量Na 加入试剂4 加入试剂 (适量 适量HCl )
}
除去沉淀
调整溶液的pH=7 调整溶液的
除杂要求:不引入新杂质;为保证杂质除尽,所加试剂需稍过量, 除杂要求:不引入新杂质;为保证杂质除尽,所加试剂需稍过量, 稍过量 新引入杂质需在后面加入试剂中除去。 新引入杂质需在后面加入试剂中除去。
离子交换膜法制烧碱
1、生产设备名称:离子交换膜电解槽 生产设备名称: 阳极: 金属钛网(涂钛钌氧化物) 阳极: 金属钛网(涂钛钌氧化物) 阴极: 碳钢网(有镍涂层) 阴极: 碳钢网(有镍涂层) 阳离子交换膜: 阳离子交换膜: 只允许阳离子(Na+)通过,把 只允许阳离子(Na 通过, 电解槽隔成阴极室和阳极室。 电解槽隔成阴极室和阳极室。 2、离子交换膜的作用: 、离子交换膜的作用:
溶液中: 溶液中:
阴极: 阴极: 2H+ + 2e → H2↑ H+优先 优先Na +得电子 阳极: 阳极: 2Cl- - 2e-→ Cl ↑ 2 Cl-优先 优先OH-失电子 总反应: 总反应:
电解饱和 食盐水
练习:试纸用氯化钠溶液浸湿,贴在玻璃片上,另在甲、 练习:试纸用氯化钠溶液浸湿,贴在玻璃片上,另在甲、 乙两个区域均滴加少许淀粉碘化钾试液。 直流电源的两端 乙两个区域均滴加少许淀粉碘化钾试液。在直流电源的两端 淀粉碘化钾试液 各连上铅笔芯,让两根铅笔芯同时在试纸上移动。 各连上铅笔芯,让两根铅笔芯同时在试纸上移动。问:哪根 碳棒可以写出蓝字?该碳棒是什么极? 碳棒可以写出蓝字?该碳棒是什么极? 蓝字
(2004.13上海)图中能验证氯化钠溶液( (2004.13上海)图中能验证氯化钠溶液(含酚 上海 酞)电解产物的装置是
中国现代化工之母──氯碱工业
(2)漂白剂
黄绿色刺激性气味能溶于水剧毒比空气重1体积水中溶解2体积氯气在标准状况下密度为317gl氯原子的结构示意图得到1个电子易失去一个电子表现出很强的氧化性二
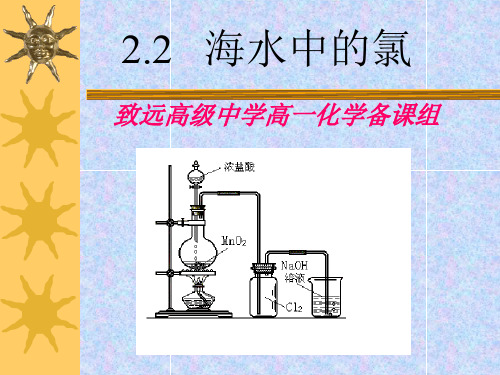
2.2 海水中的氯
致远高级中学高一化学备课组
一:氯气的物理性质
颜色: 黄绿色
气味: 刺激性气味
溶解性: 能溶于水 1体积水中溶解2体积氯气
有无毒性: 剧毒 密度: 比空气重 在标准状况下密度为_3_.1_7_g_/_L
氯原子的结构 示意图Fra bibliotek得到1个电子易失去一个电子,表现出很强的氧化性
二:氯气的化学性质
(一)氯气与金属的反应.
1、氯气和钠反应
问题1.氯气与钠反应的现象? 问题2:氯化钠的怎样形成?
2Na+Cl2→点燃 2NaCl
小结:氯气和钠反应形成离子键, 氯化钠为离子化合物
2、铁丝在氯气中燃烧
实验现象 铁丝燃烧,生成棕褐色烟
(三)氯气与水的反应.
&观察实验现象,推测氯水中可能存在的物质?
物质:水 氯分子 盐酸 次氯酸
Cl2+H2O
HCl+HClO
HCl→H+ +Cl—
HClO
H+ +ClO—
分子: 水分子;氯分子;次氯酸( HClO )
离子: H+ ;OH- ;Cl- ;ClO-
&次氯酸(HClO )的性质 +1 次氯酸中氯的化合价 HClO
思考1:氯原子是怎样与氢原子结合生成氯化氢分子的呢?
氯化氢的形成过程
点燃
H2 + Cl2→2HCl
氯气和氢气混合光照反应
以食盐为原料的化工产品

•(一)实验原理
• 1.原料:氯化钠固体、浓硫酸 • 2.化学方程式 :
•NaCl (固)+ H2SO4(浓) •微热 NaHSO4 + HCl↑(实验室) •NaHSO4 + NaCl (固) •强热 Na2SO4 + HCl↑ •总反应式:•2NaCl (固) + H2SO4( 浓)•强热 Na2SO4 +2HCl↑
• •3NaOH + H3PO4 → Na3PO4 + 3H2O •② 与酸性氧化物反应
• •2NaOH + SiO2 → Na2SiO3 + H2O
•③ 与盐反应(如:与酸式盐反应生成正盐
)
•
NaOH + NaHCO3 →•Na2CO3 + H2O
•④ 使酸碱指示剂变色
•电离: 物质在水溶液中离解成自由移动离
• 当氯化氢排出时,与水的接触面积大,充 分溶解在烧杯中的水里,使漏斗内压强减小, 液面上升,烧杯内的液面则下降。
• 当漏斗内液体与烧杯内液体即将脱离时, 漏斗内液体由于重力作用而落下,如此反复进 行,达到防止液体倒吸的目的。
•氯化 钠
• 固体
•浓硫酸
•浓硫酸
•实 验 室 制
氯 化 氢
的 装 置
生装置类型相同的是( A. H2 和 HCl B. CO2 和 HCl C. O2 和 HCl • D. H2 和 CO2
•D )
•作业:
•1、化学练习册 P11
•2、 同步课课精练 P35~36 •) 能力加油站( 9、13不做
•再见
•练
•1、求喷泉实验后习所得盐酸的物质的量浓
•?
度。若水未充满烧瓶,结果是否相同
06氯化氢的性质和盐酸 氯碱工业

06氯化氢的性质氯碱工业【知识回顾】【知识点详解】(二)中国现代化工之母——氯碱工业(Cl2 NaOH)1、电解饱和食盐水阳极(石墨棒):与直流电源正极相连(1)电极名称阴极(铁棒):与直流电源负极相连(2)化学用品:饱和NaCl(aq),酚酞试液,碘化钾淀粉溶液(或碘化钾淀粉试纸)(3)现象和电极反应式阳极:2Cl- - 2e → Cl2↑ 气泡黄绿色,气体有刺激性气味,湿润的KI淀粉试纸变蓝色氧化反应阴极:2H++ 2e → H2↑ 有气泡,检验有轻微的爆鸣声,附近先红(为什么)还原反应通直流电总反应:2NaCl + 2H2O → 2NaOH + H2↑+ Cl2↑(问)实际生产中必须将阴极区和阳极区隔离,为什么?(1)防止阴极区H2和阳极区Cl2混合爆炸(2)防止阴极区NaOH与阳极区Cl2反应,产品不纯【随堂练习】1. 下列叙述正确的是:()A .HCl 是无色有刺激性气味气体,极易溶于水B .液态氯化氢是电解质,能导电C .HCl 在潮湿的空气中能形成浓的白烟D .HCl 的电子式为H +[:Cl:]—。
2. 下列不能进行喷泉实验的是:() A .氨气溶于水(溶解性1:700) B .SO 2溶于NaOHC .CO 2溶于NaOHD .O 2溶于水3. 某学生用氯化氢气体做喷泉实验,进入烧瓶内的水不足烧瓶容积的1/4,其可能的原因是:()A .用胶头滴管挤入的水太少B .喷水用的导管太粗C .烧瓶内未集满氯化氢气体,有3/4容积的空气D .氯化氢只溶解了1/4,余下的3/4不能再被溶解了4. 盐酸与下列物质反应不是其酸性的体现的是:()A . CuOB .NaHCO 3C . AgNO 3D .Zn5.人们把氯碱工业称为中国现代化学工业之母,这是因为:()A .氯碱工业在中国发展得最早、最快B .氯碱工业生产的氯气、氢气、烧碱和纯碱都是重要的化工原料C .氯碱工业用电解生产方法 D. 氯碱工业容易造成大气污染6.氯化钠和水都是稳定的化合物,使它们发生分解十分困难,只有在什么条件下才能使食盐水电解?()A . 加热情况下B .加压条件下C .通直流电情况下D .一般情况下7.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl 2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是:()A a 为正极,b 为负极;NaClO 和NaClB a 为负极,b 为正极;NaClO 和NaClC a 为阳极,b 为阴极;HClO 和NaClD a 为阴极,b 为阳极;HClO 和NaCl8. 喷泉是一种非常美丽的自然景观。
氯碱工业简述

氯碱生产简介化工二班张晨200900112073【摘要】我国是世界氯碱生产大国,氯碱工业是以盐和电为原料生产烧碱、氯气、氢气的基础原材料工业,氯碱产品种类多,关联度大,其下游产品达到上千个品种,具有较高的经济延伸价值,它广泛应用于农业、石油化工、轻工、纺织、建材、电力、冶金、国防军工、食品加工等国民经济各命脉部门,在我国经济发展中具有举足轻重的地位。
据有关部门测算1万吨氯碱产品所带动的一次性经济产值在10亿元人民币以上。
我国一直将主要氯碱产品产量及经济指标作为我国国民经济统计和考核的重要指标。
因为知识有限,本文针对氯碱工业的原理方法,发展历史,生产现状作简要介绍。
【关键字】氯碱工业电解方法发展现状研究方向一、生产原理氯碱工业利用电解饱和食盐水溶液制取烧碱(氢氧化钠)和氯气并副产氢气的生产过程。
过程包括盐水精制、电解和产品精制等工序,其中主要工序是电解,其中电解主要采用电解饱和食盐水反应原理。
1.电解过程的反应:(1)电解过程的主反应食盐水溶液中主要有四种离子,即Na+、C1一、OH一和H+。
当直流电通过食盐水溶液时,阴离子向阳极移动,阳离子向阴极移动。
当阴离子到达阳极时,在阳极放电,失去电子变成不带电的原子;同理,阳离子到达阴极时,在阴极放电,获得电子也变成不带电的原子。
离子在电极上放电的难易不同,易放电的离子先放电,难放电的离子不放电。
在阴极上,H+比Na+容易放电,所以,阴极上是H2放电,电极反应为:2H+一2e-→H2在在阳极上,C1-比OH-易放电,所以,阳极上是Cl2放电,其放电反应为2C1-一2e-→C12不放电的Na+和OH一则生成了NaOH。
电解食盐水溶液的总反应式为2NaCl+2H2O →2NaOH+CI2十H2(2)电解过程的副反应随着电解反应的进行,在电极上还有一些副反应发生。
在阳极上产生的C12部分溶解在水中,与水作用生成次氯酸和盐酸:Cl2+H20→HCl+HClO电解槽中虽然放置了隔膜,但由于渗透扩散作用仍有少部分NaOH从阴极室进入阳极室,在阳极室与次氯酸反应生成次氯酸钠。
中国现代化工之母──氯碱工业-沪科版高一化学上册教案

中国现代化工之母──氯碱工业一、概述氯碱工业是指利用电解的方法在氯化钠溶液中分离氯、氢氧化钠和氢氧化氢等化学品的工业。
它是中国现代化工的代表之一,也是我们国家二十世纪六七十年代以来大力发展的重要工业。
氯碱工业对于国民经济的发展和人民生活的改善起着重要的作用。
二、工业过程氯碱工业是由三步反应组成的电化学反应:1. 氯化钠的电解电解池正极通入氯化钠溶液,负极通入水蒸气或饱和氢氧化钠溶液。
在电解过程中,氯化钠的分子在正极被氧化成氯气、钠离子和电子,同时在负极发生还原反应,水分子或氢氧化钠被还原成氢气和氢氧化钠离子。
电解反应的化学方程式为:$$\\text{2NaCl + 2H}_2\\text{O} \\rightarrow \\text{Cl}_2\\text{(气) +H}_2\\text{(气) + 2NaOH}$$2. 氢氧化钠的脱水在电解产生的氢氧化钠溶液中加入一定量的热量就会发生脱水反应,水分子与氢氧化钠分子结合生成水合离子。
化学方程式为:$$\\text{NaOH} + \\text{H}_2\\text{O} \\rightarrow \\text{Na+} +\\text{OH}-\\text{(氢氧根离子)}$$3. 氢氧化钠的吸湿氢氧化钠吸收大量的湿气,形成固体氢氧化钠。
化学方程式为:$$\\text{NaOH} + \\text{H}_2\\text{O} + \\text{CO}_2 \\rightarrow\\text{NaHCO}_3$$三、应用氯碱工业的产物包括氯气、氢气和氢氧化钠。
这些产品是众多工业的重要原材料,主要用于制造氯化物、药品、塑料、纤维、合成橡胶和化学肥料等产品。
另外,氯碱工业还可以提供氯气和氢气,这两种气体也是制造许多有机化学品的基础原料,如乙烯、丙烯、丁二烯等。
这些化学品广泛应用于生产塑料、纤维、橡胶、合成洗涤剂等产品,是现代工业中非常重要的化学品。
四、现状目前,我国在氯碱工业领域的技术水平已相对成熟,成为维持国内化工产业顺利发展的有力保障。
氯碱工业

电解食盐水必须考虑的因素:
简单便宜电解槽设计
高电流密度减少投资
电解槽质量高,对湿氯气和碱耐性
强 电流效率和产率高,低的能耗
氯碱工业电解的三种方法:
Hale Waihona Puke 1.汞阴极法:消耗水银,污染较严重,已不再 发展。 2.隔膜法: 3.离子交换法:
隔膜法电解是目前电解法生产烧碱最主要的方法之 一,所谓隔膜法是指在阳极与阴极之间设置隔膜, 把阴、阳极产物隔开。隔膜是一种多孔渗透性隔层, 它不妨碍离子的迁移和电流通过并使它们以一定的 速度流向阴极,但可以组织OH-向阳极扩散,防止 阴、阳极产物间的机械混合。 特点 ①隔膜电解法与水银电解法、离子膜电解法、 比较总能耗(包括电、蒸气)最高。②氢氧化钠产品 (固体)含有3%左右的氯化钠,不能用于人造丝与 合成纤维的生产。③隔膜所用的细微石棉纤维,吸 入肺内有损健康。但因生产设备容易制作,材料便 于取得,在电源比较丰富或电价比较低廉,对于烧 碱含盐量的要求又不很苛刻的地区,特别是有地下 盐水或附近有联合发电与供汽设施的地区,仍在普 遍采用。
4OH--4e=2H2O+O2↑ φ Θ =0.401v
还伴有副反应发生:
阴极区
阳极区
Cl2+2NaOH=NaCl+NaClO+H2O
4OH--4e=2H2O+O2↑ φ Θ =0.401v 2Cl- -2e- = Cl2↑ φ Θ=1.3533v 可以看出来O2比Cl2 先析出来,解决办法: 1.我们选用氧过电位大的电极,使OH-的放 电阻滞因素大大超过Cl-,这样阳极上主要发 生Cl-氧化反应,可选用石墨作为电解水的阳 极。 2.提高Cl-浓度,降低OH- 浓度,尽最大可能 阻止OH- 迁移到阳极。对此可以参照课本96 页。 3.采用离子膜,对离子进出有选择性的膜。
现代工业之母---氯碱工业
现代工业之母---氯碱工业教学目标:知识与技能目标:1、了解电解质及电离方程式概念;2、掌握电解饱和食盐水的过程、现象及解释;3、培养学生实验探究的能力。
方法与过程目标:1、通过分析电解饱和食盐水的过程,培养学生尊重实验事实的思想。
情感、态度与价值目标:通过简介氯碱工业的发展,激发学生的爱国情怀。
教学过程:引入NaCl溶液的用途?简介化学史话演示实验,观察实验现象,并进行大胆猜测。
补充电解质、电离方程式解释现象布置作业过程:(展示)这是你们粗盐提纯后的氯化钠,再由实验室老师配制好的饱和食盐水。
问:氯化钠溶液的用途?如:0.9%的氯化钠溶液为生理盐水;“现工业之母----氯碱工业“的原料简介“化学史话”、“上海氯碱总厂车间”照片图(演示试验)----电解饱和食盐水现象:阴极:滴有酚酞的溶液变红,产生了气体(大胆猜测可能的气体:H2? Cl2? O2?,可用什么方法证明或排除?)阳极:产生了能使湿润的淀粉KI试纸变蓝色的气体相关知识补充:1. 2KI+Cl22KCl+I22. 电解质:水溶液或熔融状态能导电的化合物。
酸、碱和盐都是电解质。
电解质在水溶液中或熔融状态下能电离出自由移动的离子。
例:NaCl溶液中存在大量自由移动的离子:Na+和Cl-;H2O也能电离出少量的H+和OH-,Na+、H+往阴极上移动,Cl-和OH-往阳极上移动。
阳极:Cl- 失去电子成为原子,并生成氯气。
可表示为:Cl- +e Cl,2 Cl-Cl2↑阴极:氯离子失去的电子通过导线,移动到阴极;氢离子得到电子生成氢气。
可表示为:H+ +e H, 2H+H2↑可见, 氯离子失去的电子总数等于氢离子得到的电子总数;因而理论上来说,阴、阳级上产生的H2和Cl2的体积是相等的。
又因为H+不断减少,使得阴极上OH-大于H+,即阴极附近溶液呈碱性了,即产生了NaOH,所以溶液变红。
化学方程式: 通电2NaCl + 2H2O NaOH + H2↑ + Cl2↑这种使直流电通过电解质溶液而发生氧化还原反应的过程叫电解。
氯碱工业是基本无机化工之一

氯碱工业是基本无机化工之一。
主要产品是氯气和烧碱(氢氧化钠),在国民经济和国防建设中占有重要地位。
随着纺织、造纸、冶金、有机、无机化学工业的发展,特别是石油化工的兴起,氯碱工业发展迅速。
氯碱工业的形成18世纪,瑞典人K.W.舍勒用二氧化锰和盐酸共热制取氯气:这种方法称化学法。
将氯气通入石灰乳中,可制得固体产物漂白粉,这对当时的纺织工业的漂白工艺是一个重大贡献。
随着人造纤维、造纸工业的发展,氯的需要量大增,纺织和造纸工业,成为当时消耗氯的两大用户。
用化学方法制氯的生产工艺持续了一百多年。
但它有很大缺点,从上述化学反应式,可见其中盐酸只有部分转变为氯,很不经济;且腐蚀严重,生产困难。
烧碱最初也用化学法(也称苛化法,即石灰-苏打法)生产:Na2CO3+Ca(OH)2─→2NaOH+CaCO3电解食盐水溶液同时制取氯和烧碱的方法(称电解法),在19世纪初已经提出,但直到19世纪末,大功率直流发电机研制成功,才使该法得以工业化。
第一个制氯的工厂于1890年在德国建成,1893年在美国纽约建成第一个电解食盐水制取氯和氢氧化钠的工厂。
第一次世界大战前后,随着化学工业的发展,氯不仅用于漂白、杀菌,还用于生产各种有机、无机化学品以及军事化学品等。
20世纪40年代以后,石油化工兴起,氯气需要量激增,以电解食盐水溶液为基础的氯碱工业开始形成并迅速发展。
50年代后,苛化法只在电源不足之处生产烧碱。
电解法的发展氯碱生产用电量大,降低能耗始终是电解法的核心问题。
因此,提高电流效率,降低槽电压和提高大功率整流器效率,降低碱液蒸发能耗,以及防止环境污染等,一直是氯碱工业的努力方向。
初期为了连续有效地将电解槽中的阴、阳极产物隔开,1890年德国使用了水泥微孔隔膜来隔开阳极、阴极产物,这种方法称隔膜电解法。
以后,改用石棉滤过性隔膜,以减少阴极室氢氧离子向阳极室的扩散。
这不仅适用于连续生产,而且可以在高电流效率下,制取较高浓度的碱液。
氯碱工业简介

氯碱工业简介工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于农业、石油化工、轻工、纺织、建材、电力、冶金、国防军工、食品加工等国民经济各命脉部门,据有关部门测算,1万吨氯碱产品所带动的一次性经济产值在10亿元以上。
我国是世界氯碱生产大国,一直将主要氯碱产品产量及经济指标作为我国国民经济统计和考核的重要指标。
随着国民经济的不断发展,氯碱企业不断满足各行业对氯碱产品的需求,更有力地推动了相关产业的发展,促进了国家现代化建设事业的发展。
氯碱工业中的离子膜生产工艺被公认为目前技术上最先进、经济上最合理的烧碱生产方法。
离子膜烧碱生产工艺包括一次盐水制备、二次盐水制备、电解、淡盐水脱氯等工序,并配套整流、氯氢处理、合成盐酸、次氯酸钠装置。
化学反应式:NaCl + H2O 电解 Na+ + H+ + Cl- + OH-Na+ + OH- NaOH阴极 2H+ + 2e H2阳极 2Cl- - 2e Cl2(1)一次盐水精制精制盐以及精制卤水放至化盐桶内进行溶盐。
来自离子膜电解的部分淡盐水,通过膜法除硝,除去盐水中的部分SO42-,保持系统的SO42-平衡。
处理过的盐水经给料泵送入化盐池。
从化盐池出来的粗盐水在折流板中分别与加入的NaOH、NaClO溶液充分混合后再进入前反应槽,NaOH与Mg2+,生成Mg(OH)2沉淀。
菌藻类及有机物被NaClO 氧化分解为小分子。
前反应槽出来的盐水加入Na2CO3溶液反应,进入后反应槽,生成的CaCO3通过陶瓷膜过滤器除去。
陶瓷膜过滤器截留的滤渣与前面的沉淀物经板框压滤机回收盐水后,盐泥外运。
过滤盐水(NaCl含量310~315g/L)进入过滤精盐水贮槽,经过滤精盐水泵送入二次盐水精制与电解工序。
主要反应如下:除硝反应:BaCl2+Na2SO4=BaSO4↓+2NaCl除镁反应:MgCl2+2NaOH=Mg(OH)2↓+2NaCl除钙反应:CaCl2+Na2CO3=CaCO3↓+2NaClCaSO4+Na2CO3=CaCO3↓+Na2SO4(2)二次盐水、电解、脱氯将过滤精盐水进一步净化和处理,以满足离子膜电解单元对盐水的要求。
投资备忘录——《氯碱工业》

投资备忘录——《氯碱工业》上周投研工作还了解了氯碱工业及其相关个股情况,氯碱工业是传统基础化工原料行业,具有较高的经济延伸价值,广泛应用于轻工、化工、纺织、建材、农业、电力、电子、国防、军工、冶金和食品加工等国民经济各个部门。
氯碱工业的发展能带动和促进一大批相关行业的迅速发展,对国民经济的发展具有重要意义。
行业概况氯碱工业通过电解饱和食盐水,生产烧碱(氢氧化钠)、氯气和氢气,产业链中还包括电石(碳化钙)、盐酸、PVC(聚氯乙烯)和漂白粉等。
从广义来看,工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业;从狭义来看,氯碱工业主要包括烧碱和聚氯乙烯两大产品。
根据化学反应的平衡关系,工业上每生产1吨烧碱会产生大约0.886吨的氯和0.025吨的氢气;大概折算生成1吨PVC对应需要0.8吨烧碱。
依托行业不同生命阶段关键因素的发展特征对行业的成熟度进行综合判定和分析,目前我国氯碱行业处在行业成熟阶段。
据统计:2023年全球氯碱市场总规模达到7683.01亿元(人民币),中国氯碱市场规模达到3561.08亿元(人民币),并占全球氯碱市场总份额的46.35%,产量将近占到全球的一半,是当之无愧的世界第一、由于氯碱工业中烧碱、氯气和氢气理论上会以2:1:1的摩尔比生成,我国烧碱产能全球第一,即意味着我国氯气(液氯)、氢气(仅指氯碱工业)的产能也是全球第一、国内烧碱和PVC的表观消费量(当年产量+进口量-出口量)是呈现逐步提升的趋势,PVC受国内房地产行业的影响,稍微有所下降,过去5年(2023-2023年)的复合增速分别为3.6%和4.1%。
从烧碱和PVC产能和产量来看,国内供给产能大于市场需求,2023年两大单品的产能利用率分别为85%和89%(下表统计数据中的产量比上产能,不过中泰化学报表中披露的PVC行业开工率78%,未能超过100%则还是说明了行业产能过剩),且有多余的产量可以用于出口。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
BEA Confidential. | 11
电解水与电解饱和食盐水对比
电解水
电解饱和食盐水
反应装置 电源,导线,电极,电解池 电源,导线,电极,电解池
反应条件
通电
通电
阳极产物
氧气
氯气
验证方法
带火星木条复燃
淀粉碘化钾溶液
阴极产物 验证方法
氢气 可燃性、爆鸣实验
氢气、氢氧化钠 ① 可燃性、爆鸣;
以食盐为原料的 化工产品
同一附 顾一舟
上海氯碱化工新产品推荐会
优酷视频
你还知道哪些氯碱化工的产品?
BEA Confidential. | 2
氯碱工业
氯碱工业
海水晒盐
以食盐为原料
BEA Confidential. | 3
氯碱工业
氯气
氯碱工业
氢气
海水晒盐
以食盐为原料
氢氧化钠
碳酸钠 BEA Confidential. | 4
氯碱工业
氯碱工业
氯气
氢气
进一步
盐酸 消毒剂
海水晒盐
以食盐为原料
氢氧化钠
三氯化铁
碳酸钠 BEA Confidential. | 9
聚氯乙烯
氯碱化工的产品之一:84消毒液
BEA Confidential. | 10
家用消毒液制取装置
①装置中发生的化学反应是什么? c点是阳极?还是d点是阳极?
②这个装置这样设置有哪些优点? ③这个装置有不足之处吗?怎样改进?
②酚酞变红色了
化学方程式
2H2O 通电2H2 O2
BEA Confidential. | 12
2NaCl 2H2O 通电2H2 Cl2 2NaOH
辩题:上海是否适合兴建氯碱化工厂?
优势 VS 不利
氯碱工业
氯气
氢气
进一步
盐酸 消毒剂
海水晒盐
以食盐为原料
氢氧化钠
走进上海氯碱化工厂
你 还 记 得 电 解 反 应 吗 ?
上海氯碱总厂电解车间
BEA Confidential. | 5
探究水的组成-电解水反应
初中
BEA Confidential. | 6
电解饱和食盐水装置
BEA Confidential. | 7
电解饱和食盐水产物验证
现象
结论
BEA Confidential. | 8
三氯化铁
碳酸钠 BEA Confidential. | 13
聚氯乙烯
ห้องสมุดไป่ตู้
课后作业
①查阅有关吴蕴初先生和天原化工厂的化学史话 ②完成相应的配套练习
BEA Confidential. | 14
教具创新
BEA Confidential. | 15
Thank You
Guyizhou
