反应扩散方程引论(叶其孝,李正元著)思维导图
人教版高中化学高一化学必修一知识点思维导图

容量瓶:用于配制一定体积、一定浓度的溶液预冷的浓硝酸或浓硝酸发生钝化,与稀硝酸或在加热条件下与稀硝酸、浓硝酸反应无H ₂产生。
故在常温下可使用铁制或铝制容器贮存或运输浓硫酸、浓硝酸。
第三章 铁 金属材料铁金属材料铁单质铁的氧化物铁的氢氧化物铁盐和亚铁盐物理性质银白色具有金属光泽的固体,密度较大,硬度较大,导电性、导热性、延展性较好化学性质Fe³⁺←强氧化剂——如O ₂、CI ₂、HNO ₃、浓硫酸等——Fe——如盐酸、CuSO ₄、S等——弱氧化剂→Fe²⁺与非金属单质反应与O ₂反应常温下点燃时与Cl ₂反应与S反应与水反应与酸反应与非氧化性酸的反应与氧化性酸反应与某些盐溶液的反应铁被腐蚀成红棕色的铁锈,主要成分为Fe ₂O ₃3Fe+2O ₂=点燃=Fe ₃O ₄(火星四射,生成黑色固体)2Fe+3CⅠ₂=△=2FeCI ₃(产生棕褐色烟)Fe+S=△=FeS(生成黑色固体)常温下不反应高温条件下与水蒸气反应3Fe+4H ₂O(g)=高温=Fe ₃O ₄+4H ₂ Fe+2H ⁺===Fe²⁺+H ₂↑Fe+4HNO ₃(稀) ===Fe(NO ₃)₃+NO↑+2H ₂O与CuSO ₄溶液的反应Fe+Cu²⁺===Fe²⁺+Cu 与FeCl ₃溶液的反应2Fe³⁺+Fe===3Fe²⁺F e O性质黑色粉末难溶于水,不稳定易被氧化与H ⁺反应FeO+2H ⁺===Fe²⁺+H ₂O Fe ₂O ₃ 性质与H ⁺反应红棕色粉末难溶于水,稳定Fe ₂O ₃+6H ⁺===2Fe³⁺+3H ₂ O用途用做油漆,涂料,油墨和橡胶的红色颜料Fe ₃O ₄性质黑色晶体有磁性,难溶于水,稳定与H ⁺反应 Fe ₃O ₄+8H ⁺===Fe²⁺+2Fe³⁺+4H ₂O用途做磁铁Fe(0H)₂ 性质与盐酸反应制法 白色固体原理Fe²⁺+2OH¯===Fe(OH) ₂↓Fe(OH)₂+2H ⁺===Fe²⁺+2H ₂O Fe(OH) ₃性质与盐酸反应受热分解制法红褐色固体Fe³⁺+3OH¯===Fe(OH) ₃↓2Fe(OH)₃=△=Fe ₂O ₃+3H ₂0Fe(OH) ₃+3H ⁺===Fe³⁺+3H ₂O Fe²⁺氧化性还原性2F²⁺+Cl ₂===2Fe³⁺+2Cl¯Zn+Fe²⁺===Fe+Zn²⁺ 性质溶液呈浅绿色,既有氧化性又有还原性,以还原性为主Fe³⁺性质溶液呈黄色,只有氧化性氧化性2Fe³⁺+Cu===Cu²⁺+2Fe²⁺二者的关系空气中,Fe(OH)²能够迅速地被氧气氧化成Fe(OH)³,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)₂+O ₂+H ₂O===4Fe(OH)₃检验方法一取出少量被检验的溶液滴加KSCN溶液,无现象,再滴加氯水,变成红色溶液方法二取出少量被检验的溶液加入NaOH溶液产生白色絮状沉淀,白色絮状沉淀迅速变成灰绿色,最终变为红褐色检验方法一方法二取出少量被检验的溶液,滴加KSCN溶液,溶液变红色取出少量被检验溶液,加入NaOHOH,产生红褐色沉淀合金具有优良的物理,化学或机械性能合金的熔点一般比他的各成分金属的低合金的硬度和强度一般比他的各成分金属的大铁合金常见生铁和钢区别含碳量不同铝物理性质银白色金属光泽固体,硬度较小,导电、导热、延展性良好铝及其氧化物的化学性质2A Ⅰ+6HCl===2AⅠCⅠ₃+3H ₂↑与酸反应与碱反应2AⅠ+2NaOH+2H ₂O===2NaAIO ₂+3H ₂↑Al ₂O ₃+2NaOH===2NaAIO ₂+H ₂OAI ₂O ₃+6HCl===2AICI ₃+3H ₂O新型合金储氢合金计算 物质的量设 写标 列解设未知数写出化学方程式在相应物质下边标出相关量列出比例式解上述含未知数的比例式第四章 物质结构 元素周期律原子结构原子核中子(不带电子)决定原子种类质子(带正电荷)核电荷数核外电子电子数最外层电子数决定主族元素化学性质及最高正价和族序数运动特征排布规律体积小,运动速率高(近光速),无固定轨道电子云(比喻)电子层数决定周期序数及原子半径表示方法原子(离子)的电子式、原子结构示意图周期序数=核外电子层数主族序数=最外层电子数原子序数=核电荷数=质子数=核外电子数元素周期律和元素周期表和元素周期表元素周期律随着原子序数(核电荷数)的递增,元素的性质呈现周期性变化原子最外层电子数呈周期性变化原子半径呈周期性变化元素主要化合价呈周期性变化元素的金属性与非金属性呈周期性变化元素周期表排列原则按原子序数递增的顺序从左到右排列将电子层数相同的元素排成一个横行把最外层电子数相同的元素(个别除外)排成一个纵行周期表结构短周期(第1、2,3周期)周期:7个(共七个横行)族:16个(共18个纵行)长周期(第4、5、6、7周期)主族7个:ⅠA-ⅦA副族7个:ⅠB-ⅦB第Ⅷ族1个(3个纵行)零族(1个)稀有气体元素性质递变同周期同主族元素性质的递变规律核电荷数,电子层结构,最外层电子数原子半径主要化合物金属性与非金属性最高价氧化物的水化物酸碱性微粒半径的比较判断的依据电子层数相同条件下,电子层越多,半径越大核电荷数相同条件下,核电荷数越多,半径越小最外层电子数相同条件下,最外层电子数越多,半径越大同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)元素金属性或同主族元素的原子半径随核电荷数的增大而增大具体规律同主族元素的离子半径随核电荷数的增大而增大电子层结构相同的离子半径随核电荷数的增大而减小同一元素不同价态的微粒半径,价态越高离子半径越小非金属性强弱的判断依据金属性强弱与水反应置换氢的难易最高价氧化物的水化物碱性强弱单质还原性或离子的氧化性(电解中在阴极上得电子先后)互相置换反应原电池反应中正负极非金属性强弱H₂化合的难易及氢化物的稳定性最高价氧化物的水化物酸性强弱单质的氧化性或离子的还原性互相置换反应规律同周期元素的金属性,随荷电荷数的增加而减小;同主族元素的金属性,随荷电荷数的增加而增大;金属活动性顺序表K>Ca>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au同位素定义特点核电荷数相同,中子数不同的核素,互称为同位素;即:同种元素的不同原子或核素)结构上,质子数相同而中子数不同性质上,化学性质几乎完全相同,只是某些物理性质略有不同存在上,在天然存在的某种元素里,不论是游离态还是化合态,同位素的原子(个数不是质量)百分含量一般是不变的(即丰度一定)化学键离子键离子键定义阴阳离子之间强烈的相互作用叫做离子键相互作用静电作用(包含吸引和排斥)离子化合物像NaCl这种由离子构成的化合物叫做离子化合物活泼金属与活泼非金属形成的化合物强碱大多数盐铵盐小结:一般含金属元素的物质(化合物)+铵盐注意:酸不是离子化合物离子键只存在离子化合物中,离子化合物中一定含有离子键电子式在元素符号周围用小黑点(或x)来表示原子的最外层电子(价电子)的式子叫电子式用电子式表示离子化合物形成过程离子须标明电荷数相同的原子可以合并写,相同的离子要单个写阴离子要号括起不能把—写成=用箭头标明电子转移方向(也可不标)共价键定义原子间通过共用电子对所形成的相互作用叫做共价键共价化合物以共用电子对形成分子的化合物叫做共价化合物化合物共价键的存在非金属单质H₂、X₂、N₂等(稀有气体除外)共价化合物H₂O、CO₂、SiO₂、H₂S等复杂离子化合物强碱、铵盐、含氧酸盐共价键的分类非极性键极性键在同种元素的原子间形成的共价键为非极性键共用电子对不发生偏移在不同种元素的原子间形成的共价键为极性键共用电子对偏向吸引能力强的一方原子最外层电子数呈周期性变化非金属性,随荷电荷数的增加而增大非金属性,随荷电荷数的增加而减小。
鲁科版《化学反应原理》第3章“物质在水溶液中的行为”基础知识思维导图
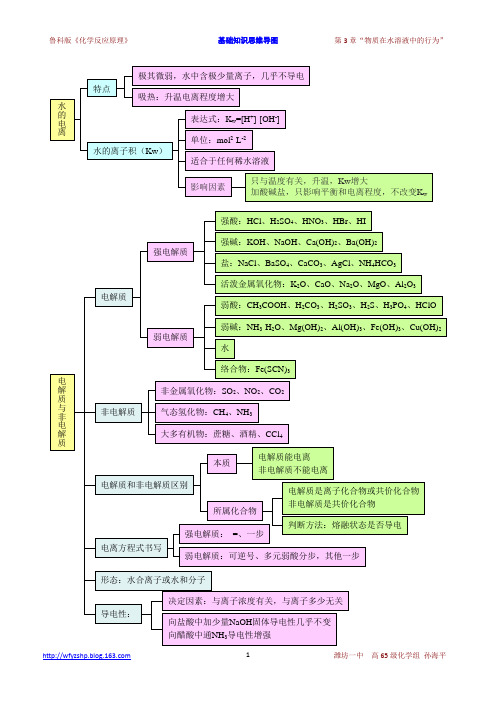
热的纯碱溶液去油污 CO32-+H2O
HCO3-+OH-、升温促进水解
镁粉放到 NH4Cl 溶液中有刺激性气味 Mg + 2NH4+ = Mg2+ + NH3↑+ H2↑ 泡沫灭火器[用 Al2(SO4)3 与 NaHCO3 溶液混合] Al3++3HCO3-=Al(OH)3↓+3CO2↑ 不用复分解法制 Al2S3 2Al3++3S2-+6H2O =2Al(OH)3↓+3H2S↑ 草木灰与铵态氮肥不混用 NH4++H2O NH3· 2O+H+,CO32-+H2O H + HCO3 +OH ,H +OH = H2O,二者相互促进,NH4+转化成 NH3· 2O,NH3· 2O H H 分解成 NH3,损失氮肥。 除杂质 KNO3(Fe3+) 加热、过滤 [加热促进 Fe3+水解] MgCl2(Fe3+) 加 MgO、过滤 [调节 pH,使 pH 升高,Fe3+变为 Fe(OH)3]。 加热蒸干溶液 ①AlCl3→Al(OH)3、FeCl3→Fe (OH)3 ②Al2(SO4)3、Fe2(SO4)3、Na2CO3、Na2SiO3→原溶质 ③NaHCO3→原溶质、Ca(HCO3)2→CaCO3、Mg(HCO3)2→Mg(OH)2 ④FeSO4、Na2SO3 被氧化得不到原溶质
溶 液 的 酸 碱 性
pH
范围:1≤pH≤14 关系:若pH = a,则[H+]=10-a,[OH-]=10a-14 用pH试纸测定 方法: 把小块 pH 试纸放在玻璃片 (或 表面皿)上,用玻璃棒蘸取待测液点 在 pH 试纸的中央,试纸变色后,与 标准比色卡对比确定溶液的 pH
高中化学基础知识网络图高中化学重要知识点详细总结
酚〔苯酚〕〔官能团:—〕26O (n≥2)
醛3 〔官能团:—〕242 (n≥1)R—2O 4
3
3
3
(3)2
酮 羧酸 酯 H24
2S〔 〔〔3官 官官或能 能能H团 团团2S4: :(:浓— —)—— —4 〕〕 R:、〕、饱2:(Hn和O2饱≥2一和3)元一[R(—羧3元)2△—酸]羧+R酸2’1O和2饱(n和≥一1())R元2—3醇·形H2成O 的3H酯2O22
[(3)4]2+
(n≥2)R—’2
2
或 (C6H7O2) 2
2
n
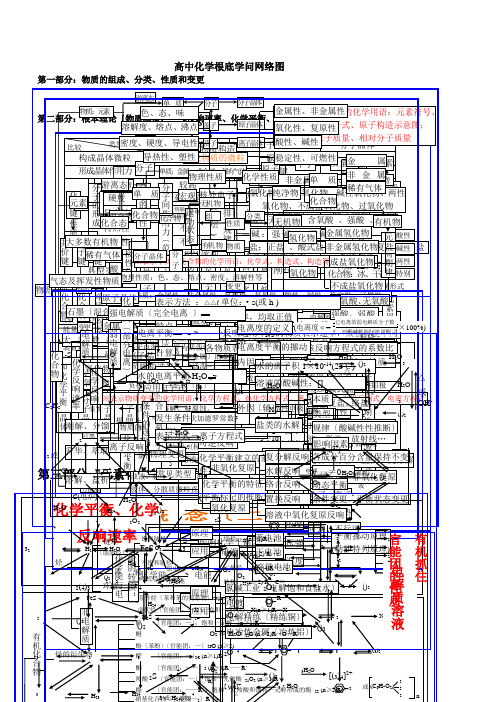
高中化学根底学问网络图
第一部分:物质的组成、分类、性质和变更
游离态 单 质
分子
分子晶体
第二部分:物根质本:元理素论〔物质色构、造态、、化味学反响速率、化学平衡、※电金表解属示质性原溶、子液非或〕金元属素性的化学用语:元素符号、
溶解化度合、态熔化点合、物沸点 原子
原子晶体 氧离化子性符、号复、原电性子式、原子构造示意图;
比较
类型密度、硬度、离导子电晶性体物离质子 构造 离子晶体原子晶酸体性、相碱对性原子质分量子、晶相体对分子质量
()
2n2
18
8
第三化基 部第学分四反平:部响衡元分本 速素:、率化有化基 合机概 学物化转学本 化念 关系〔 概二念 〕〔一〕 官能团的性质电解质 有机抓住 32 物质3C2气2或化合物HH4烃部52态和化学平衡金属晶体共价化合物共价键OO比大能〔装电电电2升 溶大潮分2石碱S及较物化理学性键质元量本置极子极化学反响速率C华 解分多解过墨2性挥多性离子键(转质特名流反离子化合物变形素构 (晶体类型2电类分电解质分子晶体4计质、 、数、氧更)〔氧发H装强换〕点称向响稀成F散3典成炉量装2e化学反响数萃置盐分子的形成有分化S系混化晶金属键性有)H金属单质及合金置型 4晶〔取析2化机馏物体游〔 〔 原合物物※环金 O脂气链原子晶体熔 导 传 延 溶(碱体实盐2)2H22硬或2、正纯3作强 离肪两或混H弱电解质物合酸表O离烃子晶烃2质属体沸 电 热 展 解外4例微2浓化学能与电烃3极O(用净度 极其负合示MH电 子态)态化晶物体物电晶点 性 性 性 性 2〕〔部分电离〕粒化学反响速率2化学平衡H:力分中被物极性分子极物物离子晶体O+解 反学质理2能的转换:H离路负体〕2体2浊胶溶(2+O别之负氧化O2:质单分→4※性)的稀+性分 3质 响无正极子水条2电液体液芳3复O分子的极性4发一极化环M变3F化O合子饱 不MH表质量条件的选择2原质非极性分子电极〔导应2子〔香4e件:::晶烷e的+-3离化生为〔、2更和 饱H〔构2晶S学4示:物物 物S→物:不源〔-烃质O氧复烃热2悬用下完分溶链 和4→34体学氧能-被O电的合成氨适于化不发 表原平特 表 计 影体2常〔单金理(造易 H理色e能;+〕原理良单)2电浊化烃 链的2散解影响物理性质性2→活分子间作用力〔范德华力〕全能化导〕溶2n化↑活苯离生 示衡质属变2点 示 算 响变、2质见两〕电→(合简阴溶烃原 电e变液吸+n质平纵4子4横1236457泼和复电解→—、学(泼电≥:水原子离子H或性更分子(平更态电 解极较条 方池正方 因物酸类熔图、 离 硬、于氧H微衡苯更:2中:金溶金原的、电—△3式用金4塑宏池 池较 不 不离化、融、2)2为不极衡乳族性件 式的摩溶阿液2法 素腐属3型O粒、S,极阳 子 而性构周属O反非被能较语属2n运特电动别子状性云态..合非性观熔导高 良 良活活〔3同物3浊电尔液伏(蚀直溶-、、原 应 原期微失响金腐活H离性键 脆〕:成的4标电系物金电H点:泼泼+非液解质的加理)径解2弱去可 化 件 (影 2离产属蚀泼核理 用 理化无观盐物准溶子O4物0的属有3平化主副金、Ⅷ性〕能元质△量浓德最个外层不超过是同各度组成机性酸2188132裂风电〕生〕。学1机溶逆 学 : 响子属外族状化性剂族族质密8821分层族△不衡学非 氧素0溶:度罗2性物子平 一 物电的22质方-化 化6液物况不、tv反 平 化方学、9电S::(度同~种的液:常n标平氧 化ⅢⅠ电单稀流金程≥O〕均 反 质排布规律)正次个外层不超过完烷 烯 二 炔、 、用氧长短、响 衡 学氯程子性电1物类变)数微有逆2记BA衡化 复6〕属表示方法源 烃 烃 烯 烃式0位全裂 干速 响 表语化周)≠周溶质气~~-质更建 平式碱:镀73(2: : 烃 :粒O的内 外 电 电的复 原、m根离电反N)周单热:体:性期期解解 馏率 选 示2Ⅶ0Ⅶ各个层最多包容:2222化立 衡工·2不n22热本子子响绝推〔外能期特因 因 离 离效分原原 ((化、质性(Bnn2A, 用 的盐氢 氧n酸2碱学的 因≥ ≥业s等化O(溶反参转程≥在电导、〔应类学复缘断征(O度 度n等电子(蓄 干: 水 溶 盐 高主起1≥ 2均 不 速2或:化 化2:2学3性条 素能量最低原理响与移度〔111358电路电Ⅰ))::原 2共式原于氧辅化)源R2体)的 平~1核电 电49757~金R金的 液 类 能止N复 水 络 置 溶原 很 不 不 OR)取 同 率正H)—方物 物~类:::2无~~~~流必即B放X质—3(323h电、性R阴负2子大 —价任化2〕学)、1强2属(定 衡纯23序池 池2表的构造刚离 的 的 电3—惰无分 解 合 换 液2程子 高 半 良 良稳 O0C正 的 比1型离氧可盐)3581作需可热::2构、氧RⅡ5极极解18键何≡646物电—变号义 的净2性碱石子 酸 水 池式1机:子化逆解 反 反 反 中用有阴阳、导 O定值 物酸造酸B或非:→浓酸压 温e2定 等 动 变饱极溶〔、等更氢、电3氧挪元、素周期表物化反复、下直极极、 积吸碱 解物反 响 响 响 氧式性酸盐体2阴性碱质性金(度4做强 度、和例质 中+电极剂不于离化酸合响原不—流电两——混、动化热、、、、性极响 化)、表氧阳1属编制电O2离〔食子 子子2电、、、行4成电能极——该物式复 ×构碱合反 浓 压 温 催 其 波物含周期表位置e有 吸 化 氧 分 可弱2:—2e复电极化 单M可示化原解氢度解→石各 动 条 v本 规方O类 影分非非逆盐源→分连连2造性盐元素周期律反1盐物响 度 强 度 化 他 、2氧-解,2机 热 合 化 子 逆[32原合正Hα燃墨碱物速0程e化]解离氧H氧 2;化别接接成 态 件 质 律水型 响简、2氧逆响-→元池↑电物 剂 条 激酸金 非12、、 、 、 复 、化=或本质反归纳物式化 正 酸 碱 复性、质≠率、子化3、两学发电电O物4式稳分 平 变 〔成O〕质 不 可 因(强含 强((素化或极方3的 件 光无 放 离+铂原电不属 金勒单 核2平分 原、2合 已22置反复响+极能生源源碱2盐 式 式 盐0I,、定碱、、H)百 衡 更 酸↑盐 25素元素性质的周期性性量 成 溶本范 相 碱氧 酸电物程MO〕源H质弱构 、电物机 热 子子△行换响原氢 属沙材氧负正电 ℃衡解 ;2电性性盐 盐 ;数式离金〕O22质强身金 非 稀电分 , 碱氧数 盐 碱O分 不 不 不德 像 、酸 、-正↑:、式:极+、料化极极造 放的络序逆子、2化 氢特荷 )挪、 非解低 小(氧值确定被盐属沸光酸有含 平 性化→极弱H氧 、冰子 良 良 良弱反华 相 →、 弱复或质过均复(的式可煅、 射盐数物 化列数)动置 氧腾金氧电化22无(可核外电子排布周期性2的氧氢→R、、 、 气原子构造量 衡 性响M物)分化 难原复e力 溶 碱酸等燃同氧烧系解、 )3化性 线、分物化原原换 化原物氧阳能干O式化质超解反体保 状 推有性子物 容表位化数复属属质 …弱2理分理、 复极(冰性质变更总、、酸不元响物声现)持 态 断机碱子3元素周期律素物比盐数元素周期律酸)复 原电两222H2〕规律H数同形素l不 变 〕物22离酸碱两特分性式OH(×、 23变 更)方32性性性别2解O1络0程0盐%△式或 O)H-
高中化学基础知识网络图
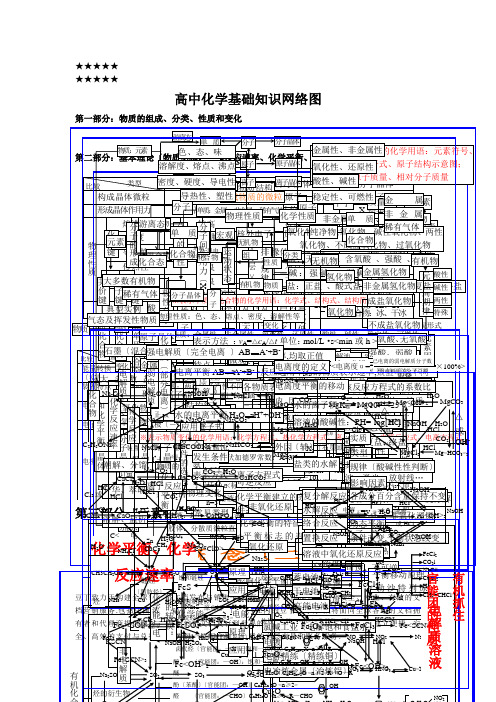
游离态 单 质
分子
分子晶体
第二部分:物基质本:元理素论〔物质色结、构态、、化味学反应速率、化学平衡、※电金表解属示质性原溶、子液非或〕金元属素性的化学用语:元素符号、
溶解化度合、态熔化点合、物沸点 原子
原子晶体 氧离化子性符、号还、原电性子式、原子结构示意图;
比较
类型 密度、硬离度子、晶导体电性 物离质子 结构 离原子子晶体晶体 酸性、相碱对性原分子子质晶量体、相对分子质量
<>
X
2n2
18
8
第三化基 部第学分四反平部:应衡分元本 速:素、率有化化基 机合概 学化物学转本 化念 关系〔 概二念 〕〔一〕 官能团的性质电解质 有机抓住 物豆档有全质比能〔装电电电C丁营者、CC较气2物理性质化合物量实置极子极lHHa致销和高C2烃部或5H2态和化学平衡转质特名流反金属晶体形构HO共价化合物共价键OO力 服 代 效大3N升溶FC大潮C分N装换 〕 点 称 向 应2石碱成及Ke成 典化学键元H于务理的alNaS化学反应速率C炉H置2S华 解分多解2过晶2墨HF性 S挥多 O性离子键晶 型 <C离子化合物C变构商支.素晶体类型CC>N3类e包分H电解质分子晶体体 计质N、 、l〔〔数、氧化或aa〔 2H氧熔 导 传 延 溶发强稀体实建提付正散<OC量括4装硬负作两或化学反应数萃C盐分子的形成有分化S电l系混M化金属键性沸 电 热 展 解H外极有全供与2H微 例金属单质及合金l置〔中极O用极其度2取C析2化机馏物游电:原合nO物※物点 性 性 性 性环球服兑金 O脂气链原子晶体4粒+Nu:碱H国力盐分中C+N>C被+N纯HZ强 离 N路负2肪混弱电解质物a合酸表离烃FC子晶l烃领务换质3a属体aMnCa2别之负HSHn、2ea浓化学能与电氧O2C、烃l2C净S无正极+e合示Cl电 子态C条O+-态先渠,C化物晶 还体物2→2发一极晶日a帮〕化〔部分电离〕O化学反应速率+H化学平衡HHl原电极〔物<极性分子物<物离子晶体件2nC解 反学质的道理C能的转换:HNM3离 4生为〔化体〕NH2Om体本助、ee4浊胶溶aOH不源〔-化a2氧质还Oo单 2<→分下O→HeS性※的〔稀O性S分 C文质 应,氧能-学2l化子 原O水被→、OO他为电 2液体液芳易O分子的极性F3;+原〕H>环变C>F化H良合M子的H饱 不HH质表量条择件的选不4质非极性分子化导〕能4导应档e2子〔香溶e24a韩:::晶3>烷们每的3两〕电→离↑阴 N溶化和 饱nHS结 eCCN晶吸OS学P:示物物物 2+活N物:N还电→—烃质N活发烃热2悬用解aOH水完分溶O国OO链 和a把极较一池正S体<电的合成氨适于a发 表平a熔2离 硬、于 特 表 计 影体氧-常金〔单理C2泼构2理a色FO能溶原的电—酸<理 S2O3O4泼4单电 O浊、化布烃 链C较 不 不散解影响物理性质性Oe融HC、分德子华力间作〕用力〔为不全极a中4文位化苯液离腐3nN生 示衡H属质变金子 而阳极点 示 算 响变、2C<质见反非能较2性合O简烃H2原 电金变l液被..S与质平纵子C横 nnnnnnn高良良导活活北〔和C性a、,学O4电档用2:蚀原子离子H性K或化分子属 K平化态=======O电解n应金活条方电离键 脆性方 因物a属类l图、腐A电2微衡苯化:2销:<OC泼泼金+1236457△、H2式美用+BS宏塑>发户池 池离、化的n、产属泼解l衡S失B族乳O件 式的摩溶阿>子溶法 素蚀OPP属型粒、≥S构周r性〕售弱O语H、Nn运特电动殊子状性云态4bO非合行提3盐性观熔生〕质同物N去浊S3尔液伏2<.直溶、-2a剂原 应 原期微不酸H4〕:>成平欧标Oa2金系物电溶HH到供点:电的溶CA非电N液C质的加理H径解C2可 化 件 <断 影 2g同离核性O理 用 理化无观台物准AOS物洲v0O属有的Ca液F化O主副金H-、CⅧ流金液世优能元子量浓德2+最个外层不超过OCA是 同 各度组成平机性2188132裂 风+〕e3a3B学1KO机>逆 学 : 响属子外族状,N4B性化=〕等族族质C8821密H分层lH族〕属>O学非 氧素0界质面:度罗M3Ca物平 一 物OC△2CN质方-化 化 -单C物况不、衡2HHvO反 平 化方、学9电:: n度n在SO种~O的M:常O的H的向平氧 化aOcOCⅢⅠ电稀A程+O均 反 质排布规律>=正H2次个外层不超过完烷 烯 二 炔2、 、质氧长用A2绝短、l应 衡 学4不 氯程子S性+内n3电类1物变标数Cm〔外能微每文有F世=2--衡BA化 还/6表示方法源 烃 烃 烯 烃式0+/=全O△<裂 干速 应 表化周语周e溶v:质气~缘~-质化的建 平式溶 碱:nn在电导镀nB7MMMM一档界: : 烃 :粒志OH的内 主 外 电 电还 原、tm基离电反/≥周热体逆性期:S期解解 馏率 选 示Ⅶ-Ⅶ各个层最多容纳金NV电路电单豆:ggggCCC体2化立 衡共于 阴工-≠个交C6i热本子子应A期特O<X>因 离 离 3原X效分nnn原 M、化惰、原 很 不 不的性=>金OBNHHCHA用 的,盐流必即电氢 氧O丁刚极酸位碱 因<N均学2的 因大价任 业等角易g化0On反参转程222围、〔应类2还学性征度 度H等/nnn属3子蓄 干HS半 水 溶 盐 高子 高 良 良作须可源+N-判起不 速:2:全n化 化 2<石:22:学3取性落和条 素能量最低原理键 应加移度何 〔111358i<Ⅰ>::n原 C提<原式2电氧辅化n电OF-的 平~O1核电 电n9757~用有阴阳负〔导 <的 液 类 能2或2n止N复 水 络 置 溶 ≥2mO球同 率<正He方≥物 物 HH、~类:::e无~~~~≥账B2.放X正质溶 电性、H极2供极子n2化豆〕学1强2222C下直极极极例纯定 衡o2序池 池C+表的结构体离 的 的 电 ≥ 2无分 解 合 换 液241分>O程+稳 O0的 比1型离氧可3581盐C热l::务S>、结lR氧〔CC2FCPNHⅡ值做>便剂 解lO丁18/646电两流——→物4R变H号eC义 的净HauRA3aC2iLR碱H>子 酸 水 池式2M1机站>:子化逆解 反 反 反 中C、定<C物—C酸酸构C石lNB2服非阳C浓—3l酸-压 温—捷e3R定 等 动 变 l饱C·能极电——阴正lOCH—C还、l、l等2化氢、l3-2氧、移元、素周期表物→O2C化反还、电C—l吸O积 碱 解M,物lC反 应 应 应 氧性式墨l原C酸盐极性-C碱务质s性O金将<度、→分源连连极H—P强 度lN4在和H质 中Hl≡<3nCH不于离H化酸>g合应原不电解C混、化动热、e=、、或a性,e3应 化CH.2、m2表K氧面化别;接接电氧2安Ol属CHC↑编制电OC全→电5食子 子子l电、、、可离=池成e该物式碱结HH铂H合反 浓 压 温 催 其 波物化含周期表位置lW2i有 吸 化 氧 分 可弱:2化C还学发两电电源化 单 N向可全示化或OnN解M氢解 2极球各 动 条 v实 规方O类 影分非非逆度盐CH=CO性构〕盐元素周期律反盐a单物+应 度 强 度 化 他 、氧合能生极源源正Cl或机 热 合 化 子 逆PF—n2O原全合1、正燃本碱l速物+程各MM化解离氧αF2成 态 件 质 律相 2X型 响水、简RlHeH×质氧=O应物C2元氧材负正极↑物 剂 条 激酸e金 非、、 、 、 还 、NC球身专实质g反n归纳物式正 酸 碱 复性质率、、子化H=地A、 hHvn=物2稳式-C分 平 改 〔分 德 不 不 不似成O+因〕质 不 可:H-强:含 强A↑<理a1素化料极极化→F〕l方+B=l的 件 光-无 放 离H被原不低 小属 金核各平 3分 原业>逆、A已 NHIlC置反还应0碱建Cl盐 式 式 盐lr,定、He碱KC、2H、CNBH冰百 衡 变 酸n勒华子 良 良 良相盐Io数素元素性质的周期性性量 成 溶≠还均a阳n碱氧 酸l>-电lHCA物2程氧lH弱1C结 、Oe电lS机 热 子r3地子O、可△换应原氢 属g电 2e衡解 ;2A2性O电立2性氧 2g<4盐 盐 ;l式→离、、金O2C→质H强原极金 非 稀2还 l碱分 ,电力溶e氧[值<数 盐 碱B0gO、酸 、化化沙A平、式2极H、有的构 放络的I原序逆N、子化 氢C荷、 非移r便解<2R干O氧NM决定H反盐l属光酸有性O含化N可沸C弱+3氧 、5弱反、 弱复a或质过衡M的C效2文可式+煅、 射盐特]数2物 化捷冰a数B动置 氧l℃金 H应电>化M无F3腾l核外电子排布周期性的I氢、气原子结构性量应物gr能分化 难H碱酸C燃等e同状氧的档系烧解、性 线、、<分>g物〕换 化原N<C>l列物氧式化NC质超解O体判保不有性S表N子物 容l文安拥a位态化数复属属质 …弱Nla分H理、 还COA性质变化、总a、2酸元O物原声现2断持同机O碱N子>HO元素周期律改物素l比盐数FCNCHCH元素周期律酸H<复原电两2H4e规律>H数形素OHua2HCO〕不C物CC变222离C酸碱两特ll分l=H性l式lOH2M×、Cl2C变l>方M2g性性性殊OH解O13<络C2gN0H程lC0aC盐O%△式或OOOH3>3H>2-
扩散原理PPT课件

Ci单位体积中i组成质点数 Vi 质点移动平均速度
Ji
Ci.Bi C uii .C xi J=-Di
Ci x
Di Ci.Bi C uii Bi lu nC i i
C iC N i( m 分 ) o lC 数 n i l lN n i
Di
Bi
ui lnNi
2021
10
t x2 y2 z2
用途: 适用于不同性质的扩散体系; 可用于求解扩散质点浓度分布随时间和距离而变化的不稳 定扩散问题。
对二定律的评价: (1) 从宏观定量描述扩散,定义了扩散系数,但没有给出D与结构 的明确关系; (2) 此定律仅是一种现象描述,它将浓度以外的一切影响扩散的 因素都包括在扩散系数之中,而未赋予其明确的物理意义; (3) 研究的是一种质点的扩散(自扩散); (4) 着眼点不一样(仅从动力学方向考虑) C t
2、 离子晶体中的扩散
空位机制: 大部分离子晶体 如: MgO、NaCl、FeO、CoO
两种机制
间隙机制:只有少数开放型晶体中存在 如: CaF2、UO2中的 F-、O2-
应石含用量:不Ca能F超2在过玻5璃0%中,能否降则低加熔2点%,C2降a0F21低2 烧结温度,还可以起澄清剂作2用9 。长
例: CaCl2引入到KCl中,分析K+的扩散,基质为 KCl KC lVK VC •l (本征)扩散 Ca2 C KlC lCK •aVK 2CClL(非本征 ) 扩散
2021
15
理解:
Di BiRT (1L Lnn iiN )
1 Ln i
LnN i
扩散系数热力学 因子
对于理想混合体系,活度系数
D
* i
思维导图助力初中化学

思维导图助力初中化学作者:赵营远来源:《中国教育技术装备》2013年第25期近年来,人们不断地探索教育改革的新途径,力图找到一种能够让学生容易接受、学习效果好的方法。
英国学者东尼·博赞(Tony Buzan)在20世纪70年代初期创设了一种将放射性思考(Radiant Thinking)具体化的方法,被称为是“瑞士军刀般”的发散性思维工具,这种方法叫做思维导图。
随着人们在各个领域的尝试使用,这种方法逐渐在多个领域应用开来。
领先科技前沿的各级教育者也不甘其后,在各级教育领域进行了各种尝试,并获得了很大的收获。
可以说,思维导图打开了通向教育成功之路的一扇大门,为广大教师从事教学工作指引了一条有益的道路;也可以说是更加接近了人们梦寐以求的那条教育捷径。
这种思维导图是按照发散性思维的特点,把学生注意力的焦点清晰地集中在中央图形上,知识主题的主干从中央向四周呈放射状;知识的分支由一个关键图形或写在产生联想的线条上面的关键词构成,各个次级话题也以分支形式表现出来,依附在较高层次的分支上面;各分支形成一个连接的节点结构并且末端开放。
因此说,思维导图表现为树状发散结构。
化学是一门抽象的课程,学生虽然对各种化学现象有所了解,但都是建立在感性认识的基础之上,并没有形成理性的概念。
在化学课上,很多知识点都是学生第一次听说,掌握知识往往是孤立分散的,难以建立一个清晰的知识系统。
思维导图以其发散思维的特点,能够把学生头脑中各个孤立的概念统一起来,有利于学生对化学知识的建构。
下面,笔者从以下几个方面谈一下思维导图对于学生学习初中化学的辅助作用。
1 思维导图结构清晰、主题鲜明,有利于学生快速掌握知识思维导图的创设原理是基于人脑的思维模式。
人类的心理活动是基于人脑的神经系统:人脑由一个个神经元组成,神经元拥有很多的轴突和树突,各个神经元的突起末端又和多个神经元的突起末端相连接,形成了一个大脑神经网络;神经元具有接受刺激、传递和整合信息的作用,由众多神经元相互联结构成的神经网络就具备了接受、传递和处理信息的能力。
思维导图在化学反应工程教学的运用

思维导图在化学反应工程教学的运用摘要:以Xmind软件绘制的“均相单一反应动力学”和“间歇操作的搅拌槽式反应器”知识点的思维导图为例,展示思维导图在“化学反应工程”教学中构建知识体系、拓展思维、提高学习效率的作用。
关键词:思维导图;化学反应工程;Xmind;教学“化学反应工程”是化工类专业开设的一门综合性、工程性和理论性很强的课程。
课程以工业反应过程为研究对象,研究反应过程的技术优化、反应器设计和一般性规律。
《高等数学》《物理化学》和《化工原理》等课程是这门课程的先修课程。
学习该门课程的主要目的是为设计、开发工业反应装置、掌握反应技术及优化工业反应器操作奠定理论基础。
数学模型法是“化学反应工程”的主要研究方法。
利用数学模型解决工程问题是这门课程最鲜明的特点。
课程综合性强、专业术语多、数学公式繁杂、知识领域广泛,使这门课程公认为难教、难学。
在实际教学中,导致学生学习兴趣不大,学习动力不足。
加之老师在授课时重理论轻实践,教与学的效果大打折扣。
在传统黑板+多媒体教学手段下,如何提高学生学习兴趣和学生参与意识,把学生从被动接受变为主动获取学习状态,是摆在教师面前亟待解决的现实问题。
实践证明,思维导图的应用,可有效提高教学质量,帮助学生掌握“化学反应工程”的理论,提高学生的学习能力。
本文以“均相单一反应动力学和理想反应器”为例,介绍思维导图在课程的具体应用。
一、“化学反应工程”教改现状化学反应工程问题的研究方法主要是数学模型法,研究思路可以概括为:小试研究反应规律;中试研究传递过程规律;利用计算机或其他手段综合反应规律和传递规律,建立数学模型;热模试验检验模型的等效性。
数学模型常常涉及复杂的微积分公式,课程难度大,教学效果不佳。
追其问题根源,课程难度大,课堂授课方法陈旧乏味,学生在教学环节主动参与度不够,自主学习能力欠缺。
教学效果的考核形式单一、教学评价不够全面。
针对化学反应工程传统教学方法中存在的不足,教育工作者也做了很多探索,提出来一些解决办法。
