物理化学期末考试题库(上下册)
物理化学1期末考试试题---样题
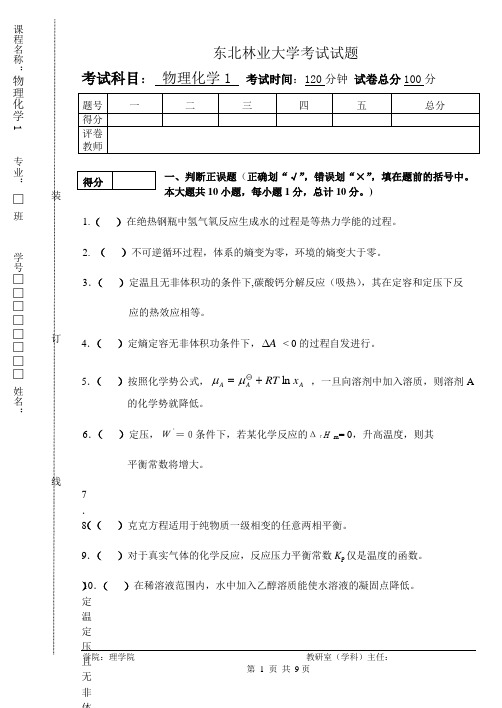
东北林业大学考试试题考试科目: 物理化学1 考试时间:120分钟 试卷总分100分一、判断正误题(正确划“√”,错误划“×”,填在题前的括号中。
本大题共10小题,每小题1分,总计10分。
)1.( )在绝热钢瓶中氢气氧反应生成水的过程是等热力学能的过程。
2. ( )不可逆循环过程,体系的熵变为零,环境的熵变大于零。
3.( )定温且无非体积功的条件下,碳酸钙分解反应(吸热),其在定容和定压下反应的热效应相等。
4.( )定熵定容无非体积功条件下,A ∆ < 0的过程自发进行。
5.( )按照化学势公式,A A A x RT ln +=μμ ,一旦向溶剂中加入溶质,则溶剂A的化学势就降低。
6.( )定压,W‘=0条件下,若某化学反应的ΔrHm = 0,升高温度,则其平衡常数将增大。
7.( )定温定压且无非体积功条件下, 若反应的K 〇 /J 〇< 时,反应向右进行。
8.( )克克方程适用于纯物质一级相变的任意两相平衡。
9.( )对于真实气体的化学反应,反应压力平衡常数K p 仅是温度的函数。
10.( )在稀溶液范围内,水中加入乙醇溶质能使水溶液的凝固点降低。
二、选择题(在每个小题四个备选答案中选出一个正确答案,填在题前的括号中;本大题共10小题,每小题1分,总计10分)1.()下列说法正确的是A.△U S,P<0的过程自发 B. △G >0的过程自发C. △S总>0的过程自发D. △S >0的过程自发2.()克拉佩龙方程适用于A. 任意两相平衡B. 纯物质任意两相平衡C. 纯物质一级相变的任意两相平衡D. 固-气或液气两相平衡3. ()实际气体节流膨胀是A.等焓过程B.等G过程C.等容过程D.等熵过程4.()下列物质在同等条件下,所列熵值的关系,何者正确?A. S(纯铁)> S(碳钢)B. S(纯铁)< S(碳钢)C. S(纯铁)= S(碳钢)D. 不确定5.()25℃时,有一份糖水溶液和一份食盐水溶液,其渗透压分别为Π1和Π2,且Π1=Π2,则糖水溶液浓度c糖和食盐水溶液浓度c盐的关系应为A. c糖>c盐B. c糖<c盐C. c糖=c盐D. 不确定6.()若蒸馏与水完全不互溶的高沸点有机液体,宜采用的方法是:A. 减压蒸馏B.精馏C. 水蒸汽蒸馏D. 萃取2.对于一定量单组份均相系统,由热力学基本方程pdV SdT dA --=可知, ()=∂∂VTA ( ); =⎪⎭⎫⎝⎛∂∂VT p ( )。
《物理化学》期末考试试题及答案(上册)

《物理化学》期末考试试题及答案(上册)《物理化学》练习题⼀、填空题1.理想⽓体经过节流膨胀后,焓____(升⾼,降低,不变)。
2.()0T dH dV =,说明焓只能是温度的函数,与_____⽆关。
3.1molH 2(g )的燃烧焓等于1mol_______的⽣成焓。
4. 物理量Q 、T 、V 、W ,其中属于状态函数的是;与过程有关的量是;状态函数中属于⼴度量的是;属于强度量的是。
5.焦⽿汤姆逊系数J-T µ= ,J-T 0µ>表⽰节流膨胀后温度节流膨胀前温度。
6.V Q U =?的应⽤条件是。
7.热⼒学第⼆定律可表达为:“功可全部变为热,但热不能全部变为功⽽。
8.⽤ΔG ≤0判断过程的⽅向和限度的条件是_________。
9. 热⼒学第三定律的表述为。
10. 写出热⼒学基本⽅程d G = 。
11. 卡诺热机在T 1=600K 的⾼温热源和T 2=300K 的低温热源间⼯作,其热机效率η=___。
12. ⾼温热源温度T 1=600K ,低温热源温度T 2=300K 。
今有120KJ 的热直接从⾼温热源传给低温热源,此过程ΔS =________。
13. 1mol 理想⽓体由298K ,100kpa 作等温可逆膨胀,若过程ΔG =-2983J ,则终态压⼒为。
14. 25°C 时,0.5molA 与0.5molB 形成理想液态混合物,则混合过程的ΔS= 。
15. ⼀定量的理想⽓体经历某种过程变化到终态,若变化过程中pV γ不变,则状态函数(ΔS 、ΔH 、ΔU 、ΔG 、ΔA )中,不变。
16. 在⼀定的温度及压⼒下,溶液中任⼀组分在任意浓度范围均遵守拉乌尔定律的溶液称为___________。
17. 25°C 时,10g 某溶质溶于1dm 3溶剂中,测出该溶液的渗透压Π=0.4000kpa ,该溶质的相对分⼦质量为________18. 氧⽓和⼄炔⽓溶于⽔中的享利系数分别是717.2010Pa kg mol -和811.3310Pa kg mol -,由享利定律系数可知,在相同条件下,在⽔中的溶解度⼤于在⽔中的溶解度。
物理化学(上)期末试题四及参考答案

物理化学(上)期末试题四及参考答案⼀、填空题(每⼩题2分,共20分)1、系统处于热⼒学平衡状态时,必须同时满⾜、、、四个条件平衡。
2、同⼀个系统的U、H、A、G这四个热⼒学量,最⼤,最⼩。
3、补全热⼒学函数关系式:dG= + VdP ;(?G/?p)T = 。
4、理想⽓体与温度为T的⼤热源接触作等温膨胀,吸热Q,所做的功是变化到相同终态的最⼤功的20%,则系统的熵变为(⽤T和Q表⽰)。
5、等温等压下两种纯物质混合形成理想溶液,则△mix V 0,△mix H 0,△mix S 0,△mix G 0(填“>”或“<”或“=”)。
6、⾮理想⽓体的标准态是指:。
7、热分析法绘制相图时,常需画出不同组成混合物的温度-时间曲线,这种线称之为。
8、写出化学反应等温式:。
9、反应C(s)+O2(g)=CO2(g),2 CO(g) +O2(g)= 2CO2(g),C(s)+ 1/2 O2(g)=CO(g)的平衡常数分别为K1Θ、K2Θ、K3Θ,这三个平衡常数之间的关系是K3Θ= 。
10、298K时有⼀仅能透过⽔的渗透膜将0.01mol/L和0.001mol/L的蔗糖溶液分开,欲使该体系达平衡,需在浓度为的溶液上⽅施加压⼒,该压⼒为Pa。
⼆、选择题(每⼩题2分,共30分)1、下列说法不符合近代化学的发展趋势与特点的是()(A)从单⼀学科到交叉学科(B)从宏观到微观(C)从平衡态研究到⾮平衡态研究(D)从表相到体相2、下列关于热⼒学⽅法的叙述,不正确的是()(A)热⼒学研究对象是⼤量分⼦的集合,所得的结论不适⽤于分⼦的个体⾏为。
(B)热⼒学可以解决怎样把⼀个变化的可能性变为现实性的问题(C)经典热⼒学不考虑物质的微观结构和反应机理(D)经典热⼒学不能解决⼀个具体变化所需要的时间3、下列参数中属于过程量的是()(A)H (B)U (C)W (D)V4、实际⽓体处于下列哪种情况时,其⾏为与理想⽓体接近()(A)⾼温⾼压(B)⾼温低压(C)低温⾼压(D)低温低压5、在⼀个刚性绝热容器内发⽣苯在氧⽓中燃烧的反应()(A) △U=0,△H<0,Q=0 (B) △U=0,△H>0,W=0(C) △U=0,△H=0,Q=0 (D) △U=0,△H=0,W=06、关于Joule-Thomson系数µJ-T,下列说法错误的是()(A)µJ-T是系统的强度性质(B)µJ-T<0,表⽰节流膨胀后⽓体的温度下降(C)常温下,⼤多数⽓体的µJ-T为正值,⽽H2和He的µJ-T为负值(D)理想⽓体的µJ-T = 07、⼯作在393K和293K的两个⼤热源间的卡诺热机,其效率约为()(A) 83%(B) 25%(C) 100%(D) 20%8、当10mol N2和20mol H2混合通过合成氨塔,反应⼀段时间后有5mol NH3⽣成。
物理化学期末考试题及答案pdf

物理化学期末考试题及答案pdf一、选择题(每题2分,共20分)1. 以下哪种物质的摩尔质量与水(H2O)的摩尔质量相同?A. 氢气(H2)B. 二氧化碳(CO2)C. 氨气(NH3)D. 甲烷(CH4)答案:D2. 根据理想气体定律,当温度和压力保持不变时,气体体积与摩尔数的关系是:A. 成正比B. 成反比C. 无关D. 不确定答案:A3. 以下哪种类型的晶体在熔化时不吸收热量?A. 离子晶体B. 分子晶体C. 金属晶体D. 共价晶体答案:D4. 根据吉布斯自由能变化公式,当ΔG < 0时,反应是否自发进行?A. 是B. 否C. 不确定D. 只在特定条件下自发答案:A5. 以下哪种物质在标准状态下不是气体?A. 氧气(O2)B. 氮气(N2)C. 氦气(He)D. 水(H2O)答案:D6. 以下哪种物质的溶解度随温度升高而降低?A. 氯化钠(NaCl)B. 糖(蔗糖)C. 氢氧化钙(Ca(OH)2)D. 硝酸钾(KNO3)答案:C7. 以下哪种类型的电池是可充电电池?A. 干电池B. 铅酸电池C. 锂电池D. 碱性电池答案:B8. 以下哪种物质的pH值小于7?A. 纯水B. 柠檬水C. 牛奶D. 肥皂水答案:B9. 以下哪种物质的导电性最好?A. 玻璃B. 橡胶C. 铜D. 陶瓷答案:C10. 以下哪种物质的比热容最大?A. 水B. 空气C. 铁D. 铝答案:A二、填空题(每题2分,共20分)11. 阿伏伽德罗常数的近似值是 ________ mol^-1。
答案:6.022 x 10^2312. 物质的量浓度(M)的单位是 ________。
答案:mol/L13. 标准大气压(1 atm)的值是 ________ Pa。
答案:1.01325 x 10^514. 理想气体定律的公式是 ________。
答案:PV = nRT15. 热力学第一定律的公式是 ________。
答案:ΔU = Q - W16. 电化学电池的电动势(E)公式是 ________。
物理化学期末考试试题含答案

化学专业《物理化学》上册期末考试试卷(2)(时间120分钟)一、单项选择题(每小题2分,共30分)1、下列对某物质临界点的描述,错误的是( )(A)液相摩尔体积与气相摩尔体积相等 (B)气化热为零(C)液相与气相的相界面消失 (D)气、液、固三相共存2、理想气体的分子运动论公式为213pV mNu =2121 ,µµµµ≠≠21 µµ≠1µ2µ2121 ,µµµµ=>2121 ,µµµ<<i n m $,式中u 是( )(A)分子平均运动速率 (B)最可几速率(C)分子运动最大速率 (D)根均方速率3、某单组分体系的V m (l)>V m (s),当压力升高时,其熔点将 ( ) (A) 升高 (B) 降低 (C) 不变 (D) 不确定4、某气体进行不可逆循环过程的熵变为 ( )(A) ΔS 系 = 0 , ΔS 环 = 0 (B) ΔS 系 = 0 , ΔS 环 > 0 (C) ΔS 系 > 0 , ΔS 环 = 0 (D) ΔS 系 > 0 , ΔS 环 > 05、1mol 理想气体经一等温可逆压缩过程,则( ) (A) ΔG >ΔF (B) ΔG <ΔF (C)ΔG =ΔF (D)ΔG 与ΔF 无法进行比较6、下面有关统计热力学的描述,正确的是( )(A) 统计热力学研究的是大量分子的微观平衡体系 (B) 统计热力学研究的是大量分子的宏观平衡体系 (C) 统计热力学是热力学的理论基础(D) 统计热力学和热力学是相互独立互不相关的两门学科7、对于定位体系,N 个粒子分布方式D 所拥有微观状态数W D 为:( )(A) W D = N !πN i g i /N i !(B) W D = N !πg i Ni /Ni ! (C) W D = N !πg i Ni /Ni (D) W D = πg i Ni /Ni ! 8、苯(A)与甲苯(B)形成理想混合物,当把5mol 苯与5mol 甲苯混合形成溶液,这时,与溶液相平衡的蒸汽中,苯(A)的摩尔分数是:( )(A) y A = 0.5(B) y A < 0.5 (C) y A > 0.5 (D) 无法确定9、下列气体溶于水溶剂中,哪个气体不能用亨利定律( )(A) N 2(B) O 2 (C) NO 2 (D) CO10、注脚“1”代表298K 、p θ 的O 2,注脚“2”代表298K 、2p θ 的H 2,那么( )(A) (B) 因为,与大小无法比较 µ(C) (D)11、NH 4HS (s )和任意量的NH 3(g )及H 2S (g )达平衡时,有( )(A) C = 2,Φ = 2,f = 2 (B) C = 1,Φ = 2,f = 1 (C) C = 2,Φ = 3,f = 2 (D) C = 3,Φ = 2,f = 312、NaCl 水溶液和纯水经半透膜达成渗透平衡时,该体系的自由度是( ) (A) 1 (B) 2 (C) 3 (D) 413、在相图上,当体系处于下列哪一点时只存在一个相? ( )(A) 恒沸点 (B) 熔点 (C) 临界点 (D) 低共熔点14、化学反应体系在等温等压下发生∆ξ= 1 mol 反应,所引起体系吉布斯自由能的改变值Δr G m 的数值正好等于体系化学反应吉布斯自由能 (∂G /∂ξ)T ,p ,的条件是:( ) (A) 体系发生单位反应 (B) 反应达到平衡 (C) 反应物处于标准状态 (D) 无穷大体系中所发生的单位反应15、已知反应3O 2(g) = 2O 3(g) 在25℃时,Δr H =-280 J ⋅mol -1,则对该反应有利的条件是 ( )(A) 升温升压 (B) 升温降压 (C) 降温升压 (D) 降温降压题号 一 二 三 四 五 六 七 八 得分得分得分评卷人复核人学院: 年级/班级: 姓名: 学号:装 订 线 内 不 要 答 题《物理化学》上册期末试卷本卷共 8 页第1页 《物理化学》上册期末试卷本卷共 8 页第2页二、填空题(每空1分,共10分)1、在隔离体系中发生某剧烈的化学反应,使体系的温度及压力皆明显上升,则该体系的△H 0,△F 0。
物理化学(上)期末试题三及参考答案

物理化学(上)期末试题三及参考答案⼀、填空题(每⼩题2分,共20分)1、热⼒学第零定律是指:。
2、熵与热⼒学概率之间的函数关系式是。
3、补全热⼒学函数关系式:C P= (?S/?T)P4、⼀定量的单原⼦理想⽓体定压下从T1变化到T2的熵变与定容下从T1变化到T2的熵变之⽐为:5、化学势的表⽰式中,是偏摩尔量。
6、稀溶液的依数性包括、、和。
7、反应NH4HS(s)=NH3(g)+H2S(g),在298K时测得分解压为66.66Pa,则该温度下该反应的K pΘ= ;K p= 。
8、1atm压⼒下⽔和⼄醇系统的最低恒沸混合物含⼄醇质量分数为0.9557,现将含⼄醇50%的⼄醇⽔溶液进⾏分馏,最终得到的物质为。
9、⽔在101.3kPa时沸点为373K,汽化热为40.67 kJ/mol(设汽化热不随温度变化);毕节学院的⼤⽓压约为85.5 kPa,则在毕节学院⽔的沸点为K。
10、反应NH4HS(s)=NH3(g)+H2S(g)已达平衡;保持总压不变,往系统中充⼊⼀定量的惰性⽓体,平衡移动⽅向为。
⼆、选择题(每⼩题2分,共30分)1、下列属于化学热⼒学范畴的是()(A)物质结构与性能的关系(B)化学反应速率(C)化学变化的⽅向和限度(D)反应机理2、下列关于热⼒学⽅法叙述正确的是()(A)热⼒学研究所得的结论不适⽤于分⼦的个体⾏为(B)热⼒学可以解决某条件下怎样把⼀个变化的可能性变为现实性的问题(C)经典热⼒学详细讨论了物质的微观结构(D)经典热⼒学常需计算⼀个变化所需要的时间3、下列函数中为强度性质的是:()(A) S (B) (?G/?p)T(C) (?U/?V)T(D) C V4、⼀定量的纯理想⽓体,下列哪组量确定后,其他状态函数⽅有定值。
()(A)T (B)V (C)T、U (D)T、p5、对⼀化学反应,若知其△C p,m= ∑νB C p, m, B > 0,则该反应的()(A)△H随温度升⾼⽽增⼤(B)△H随温度升⾼⽽减少(C)△H⼤于零(D)△H⼩于零6、某⽓体的压缩因⼦Z> 1,表⽰该⽓体()(A)易于压缩(B)不易压缩(C)易于液化(D)不易液化7、下列说法错误的是()(A)热容的⼤⼩与系统所含物质的量有关(B)对于⽓体来说,其C p, m恒⼤于C V, m(C)对于任意系统,因为体积随温度升⾼可能减⼩,所以其C p,可能⼩于C V(D)对于体积不变的刚性容器中的系统,因为定容,所以有C V⽽没有C p值8、某可逆热机的⾼温热源为T2,低温热源为T1(1)若选⽤⽔蒸⽓为⼯作物质,其热机效率为ηW(2)若选⽤汽油为⼯作物质,其热机效率为ηO则下列关系正确的是:()(A)ηW >ηO(B)ηW<ηO(C)ηW=ηO(D)⽆法⽐较9、已知某温度下,?f H mΘ(CO2)=-393.3 kJ/mol,?c H mΘ(CO)=-282.8 kJ/mol,则?f H mΘ(CO)为()(A)-110.5 kJ/mol (B)110.5 kJ/mol(C)-676.1 kJ/mol (D)-172.3 kJ/mol10、过饱和溶液中的溶质的化学势与纯溶质的化学势相⽐较,前者()(A) ⼤(B) ⼩(C)与后者相等(D)⽆法⽐较11、两⽀烧杯各有1kg⽔,向A杯中加⼊0.01mol蔗糖,向B杯中加⼊0.01mol NaCl,两⽀烧杯在相同条件下按同样的速度降温,则()(A)A杯先结冰(B)B杯先结冰(C)两杯同时结冰(D)都不会结冰12、I2(s)与I2(g)平衡共存,系统⾃由度为()(A) 0 (B) 1(C) 2 (D) 313、化学反应等温式?r G m=?r G mΘ+RT lnQ,当选取不同标准态时()(A)?r G m和Q的值都改变(B)?r G m和Q的值都改变(C)?r G m的值改变,Q不变(D) ?r G m不变,Q的值改变14、反应C(s)+O2(g)=CO2(g),2 CO(g) +O2(g)= 2CO2(g),C(s)+ 1/2 O2(g)=CO(g)的平衡常数分别为K1Θ、K2Θ、K3Θ,这三个平衡常数之间的关系是()(A) K3Θ=K1ΘK2Θ(B) K3Θ= K1Θ/K2Θ(C) K3Θ= K1Θ/Θ2K(D) K3Θ=ΘΘ21/KK15、等温等压下,A和B组成的均相系统中,当改变浓度时A的偏摩尔体积增加,则B的偏摩尔体积将()(A) 增加(B) 减⼩(D) 随A和B的⽐例不同⽽不同三、解答题(计算过程必须有公式、代⼊数据后的式⼦、计算结果以及必要的⽂字说明;回答问题须简要说明理由。
物理化学期末考试试题库

物理化学期末考试试题库1第一章 热力学第一定律选择题1.热力学第一定律ΔU=Q+W 只适用于( )(A) 单纯状态变化 (B) 相变化 (C) 化学变化 (D) 封闭物系的任何变化 答案:D2.关于热和功, 下面的说法中, 不正确的是(A) 功和热只出现于系统状态变化的过程中, 只存在于系统和环境间的界面上(B) 只有在封闭系统发生的过程中, 功和热才有明确的意义(C) 功和热不是能量, 而是能量传递的两种形式, 可称之为被交换的能量(D) 在封闭系统中发生的过程中, 如果内能不变, 则功和热对系统的影响必互相抵消 答案:B2.关于焓的性质, 下列说法中正确的是( )(A) 焓是系统内含的热能, 所以常称它为热焓 (B) 焓是能量, 它遵守热力学第一定律(C) 系统的焓值等于内能加体积功 (D) 焓的增量只与系统的始末态有关 答案:D 。
因焓是状态函数。
3.涉及焓的下列说法中正确的是( )(A) 单质的焓值均等于零 (B) 在等温过程中焓变为零 (C) 在绝热可逆过程中焓变为零(D) 化学反应中系统的焓变不一定大于内能变化 答案:D 。
因为焓变ΔH=ΔU+Δ(pV),可以看出若Δ(pV)<0则ΔH <ΔU 。
4.下列哪个封闭体系的内能和焓仅是温度的函数( )(A) 理想溶液 (B) 稀溶液 (C) 所有气体 (D) 理想气体 答案:D5.与物质的生成热有关的下列表述中不正确的是( )(A) 标准状态下单质的生成热都规定为零 (B) 化合物的生成热一定不为零 (C) 很多物质的生成热都不能用实验直接测量(D) 通常所使用的物质的标准生成热数据实际上都是相对值 答案:A 。
按规定,标准态下最稳定单质的生成热为零。
6.dU=CvdT 及dUm=Cv,mdT 适用的条件完整地说应当是( )(A) 等容过程 (B)无化学反应和相变的等容过程 (C) 组成不变的均相系统的等容过程(D) 无化学反应和相变且不做非体积功的任何等容过程及无反应和相变而且系统内能只与温度有关的非等容过程 答案:D7.下列过程中, 系统内能变化不为零的是( )(A) 不可逆循环过程 (B) 可逆循环过程 (C) 两种理想气体的混合过程 (D) 纯液体的真空蒸发过程答案:D 。
物理化学期末考试试题库

WORD 完美格式技术资料 专业整理 第一章 热力学第一定律选择题 1.热力学第一定律ΔU=Q+W 只适用于( )(A) 单纯状态变化 (B) 相变化 (C) 化学变化 (D) 封闭物系的任何变化 答案:D2.关于热和功, 下面的说法中, 不正确的是(A) 功和热只出现于系统状态变化的过程中, 只存在于系统和环境间的界面上(B) 只有在封闭系统发生的过程中, 功和热才有明确的意义(C) 功和热不是能量, 而是能量传递的两种形式, 可称之为被交换的能量(D) 在封闭系统中发生的过程中, 如果内能不变, 则功和热对系统的影响必互相抵消 答案:B2.关于焓的性质, 下列说法中正确的是( )(A) 焓是系统内含的热能, 所以常称它为热焓 (B) 焓是能量, 它遵守热力学第一定律(C) 系统的焓值等于内能加体积功 (D) 焓的增量只与系统的始末态有关 答案:D 。
因焓是状态函数。
3.涉及焓的下列说法中正确的是( )(A) 单质的焓值均等于零 (B) 在等温过程中焓变为零 (C) 在绝热可逆过程中焓变为零(D) 化学反应中系统的焓变不一定大于内能变化 答案:D 。
因为焓变ΔH=ΔU+Δ(pV),可以看出若Δ(pV)<0则ΔH <ΔU 。
4.下列哪个封闭体系的内能和焓仅是温度的函数( )(A) 理想溶液 (B) 稀溶液 (C) 所有气体 (D) 理想气体 答案:D5.与物质的生成热有关的下列表述中不正确的是( )(A) 标准状态下单质的生成热都规定为零 (B) 化合物的生成热一定不为零 (C) 很多物质的生成热都不能用实验直接测量(D) 通常所使用的物质的标准生成热数据实际上都是相对值 答案:A 。
按规定,标准态下最稳定单质的生成热为零。
6.dU=CvdT 及dUm=Cv ,mdT 适用的条件完整地说应当是( )(A) 等容过程 (B)无化学反应和相变的等容过程 (C) 组成不变的均相系统的等容过程(D) 无化学反应和相变且不做非体积功的任何等容过程及无反应和相变而且系统内能只与温度有关的非等容过程 答案:D7.下列过程中, 系统内能变化不为零的是( )(A) 不可逆循环过程 (B) 可逆循环过程 (C) 两种理想气体的混合过程 (D) 纯液体的真空蒸发过程答案:D 。
物理化学期末考试试卷

物理化学期末考试试卷一、选择题(每题2分,共20分)1. 气体分子之间的平均距离远大于分子直径,因此气体分子之间的相互作用力可以忽略不计。
这种说法正确吗?A. 正确B. 错误2. 理想气体状态方程为 PV=nRT,其中P、V、n、R和T分别代表什么?A. 压力、体积、物质的量、气体常数、温度B. 体积、压力、物质的量、温度、气体常数3. 根据热力学第二定律,下列哪种说法是正确的?A. 热量可以自发地从低温物体传向高温物体B. 热量不能自发地从低温物体传向高温物体4. 化学平衡常数K只与温度有关,与反应物和生成物的浓度无关。
这种说法正确吗?A. 正确B. 错误5. 电化学中,原电池的正极发生氧化反应,负极发生还原反应。
这种说法正确吗?A. 正确B. 错误6. 表面张力是由于液体表面分子之间的相互吸引力引起的。
这种说法正确吗?A. 正确B. 错误7. 根据范德华力,分子间距离越近,分子间的作用力越强。
这种说法正确吗?A. 正确B. 错误8. 胶体的分散质粒子直径通常在1-100纳米之间。
这种说法正确吗?A. 正确B. 错误9. 电解质溶液的导电性与溶液中离子的浓度成正比。
这种说法正确吗?A. 正确B. 错误10. 根据热力学第一定律,能量守恒定律在化学反应中不适用。
这种说法正确吗?A. 正确B. 错误二、填空题(每空1分,共10分)11. 理想气体的内能只与_______有关。
12. 热力学第一定律的数学表达式为:ΔU = Q + _______。
13. 化学动力学研究的是化学反应的_______。
14. 阿伏伽德罗常数表示的是每摩尔物质中所含有的_______数。
15. 根据热力学第二定律,不可能从单一热源吸热使之完全转化为_______。
三、简答题(每题10分,共20分)16. 简述热力学第一定律和第二定律的主要内容。
17. 描述化学平衡的基本原理,并解释勒夏特列原理。
四、计算题(每题15分,共30分)18. 已知某理想气体在等压过程中,温度从T1升高到T2,求该过程中气体的体积变化。
《物理化学》期末试卷(一)(附答案)

物理化学课 程 考 核 试 卷学年第 一 学期 级 专业(类)考核科目 物理化学 课程类别 必修 考核类型 考试 考核方式 闭卷 卷别 A(注:考生务必将答案写在答题纸上,写在本试卷上的无效)一、选择题 ( 共 8题 14分 )1. 2 分 (0123)体系的压力p (体系)与环境的压力p (环境)有何关系?( )(A) 相等 (B) 无关系(C) p (体系)>p (环境) (D) 可逆变化途径中p (体系)=p (环境)2. 2 分 (1232)关于偏摩尔量,下面的叙述中不正确的是:(A) 偏摩尔量的数值可以是正数、负数和零(B) 溶液中每一种广度性质都有偏摩尔量,而且都不等于其摩尔量(C) 除偏摩尔吉布斯自由能外,其他偏摩尔量都不等于化学势(D) 溶液中各组分的偏摩尔量之间符合吉布斯-杜亥姆关系式3. 1 分 (0739)对实际气体的节流膨胀过程,有 ( )(A) ΔH = 0 (B) ΔS = 0(C) ΔG = 0 (D) ΔU = 04. 2 分 (0891)在101.3 kPa 下,110℃的水变为110℃水蒸气,吸热Q p ,在该相变过程中下列哪个关系式不成立?( )(A) ∆S 体> 0(B) ∆S 环不确定(C) ∆S 体+∆S 环> 0(D) ∆S 环< 05. 1 分 (2842)2842在等温等压下,当反应的Δr G m$= 5 kJ ×mol -1时,该反应能否进行? ( )(A) 能正向自发进行(B) 能逆向自发进行(C) 不能判断(D) 不能进行6. 2 分 (0392)某化学反应在恒压、绝热和只作体积功的条件下进行,体系的温度由T 1升高到T 2,则此过程的焓变ΔH : ( )(A) 小于零 (B) 等于零(C) 大于零 (D) 不能确定7. 2 分 (0459)石墨(C)和金刚石(C)在 25℃, 101 325 Pa 下的标准燃烧焓分别为-393.4 kJ·mol -1和-395.3kJ·mol -1,则金刚石的标准生成焓Δf H m $(金刚石, 298 K)为: ( )(A) -393.4 kJ·mol -1(B) -395.3 kJ·mol -1(C) -1.9 kJ·mol -1(D) 1.9 kJ·mol -18. 2 分 (2640)恒沸混合物在气、液两相平衡共存时的自由度为: ( )(A)0 (B)1 (C)2 (D)3二、填空题 ( 共12题 26分 )9. 5 分 (3310)按照 D.P. Stevenson 等人的工作,异构化反应:环己烷 (l) = 甲基环戊烷 (l)的平衡常数可以用如下的方程式表示:ln K p $= 4.184 - 2059 K/T则 25℃的Δr H m $= _________ J ⋅mol -1Δr S m $= _________ J ⋅K -1⋅mol -110. 2 分 (0079)007910 mol 单原子理想气体,在恒外压0.987p ∃下由400 K,2p ∃等温膨胀至0.987p ∃,物体对环境作功 kJ 。
物理化学期末复习题及答案

物理化学期末复习题及答案物理化学是一门结合了物理学原理和化学现象的学科,它涉及到能量转换、物质结构、化学反应动力学等多个方面。
期末复习时,重点应该放在理解基本概念、掌握计算方法和熟悉实验操作。
以下是一些物理化学的期末复习题及答案,供同学们参考。
# 物理化学期末复习题一、选择题1. 热力学第一定律的数学表达式是什么?A. ΔU = Q - WB. ΔH = Q + WC. ΔS = Q/TD. ΔG = ΔH - TΔS答案:A2. 在理想气体状态方程 PV = nRT 中,下列哪个变量是温度的函数?A. PB. VC. nD. R答案:A二、填空题1. 根据吉布斯自由能的定义,当ΔG < 0 时,反应是_________的。
答案:自发2. 阿伏伽德罗常数的值大约是_________。
答案:6.022 x 10^23 mol^-1三、简答题1. 简述什么是熵,以及熵增加原理的意义是什么?答案:熵是热力学系统无序度的量度,通常用符号 S 表示。
熵增加原理指的是在一个孤立系统中,自发过程会导致系统熵的增加,直至达到平衡状态。
熵增加原理是热力学第二定律的一种表述,它反映了自然界趋向于更加无序状态的普遍趋势。
2. 什么是化学平衡常数?它与哪些因素有关?答案:化学平衡常数(K)是一个在特定条件下,反应物和生成物浓度比值的常数,它表征了化学反应达到平衡时各物质的相对浓度。
化学平衡常数与温度有关,通常不随压力或浓度的变化而变化。
四、计算题1. 已知某理想气体在等压过程中,温度从 300 K 升高到 600 K,求气体体积的变化量。
答案:设初始体积为 V1,最终体积为 V2。
根据盖-吕萨克定律(等压变化),有 V1/T1 = V2/T2。
代入数据得 V2 = (T2/T1) * V1 = (600 K / 300 K) * V1 = 2 * V1。
因此,体积变化量ΔV = V2 - V1 = V1。
2. 某化学反应的ΔH = -20 kJ/mol,ΔS = 0.05 kJ/(mol·K),求在 298 K 时的ΔG。
物理化学期末考试题库(上下册)

一 化学热力学基础1-1 判断题1、可逆的化学反应就是可逆过程。
(×)2、Q 和W 不是体系的性质,与过程有关,所以Q+W 也由过程决定。
(×)3、焓的定义式H=U+pV 是在定压条件下推导出来的,所以只有定压过程才有焓变。
(×)4、焓的增加量ΔH 等于该过程中体系从环境吸收的热量。
(×)5、一个绝热过程Q=0,但体系的ΔT 不一定为零。
(√)6、对于一个定量的理想气体,温度一定,热力学能和焓也随之确定。
(√)7、某理想气体从始态经定温和定容两个过程达终态,这两个过程Q 、W 、ΔU 及ΔH 是相等的。
(×)8、任何物质的熵值是不可能为负值或零的。
(×)9、功可以全部转化为热,但热不能全部转化为功。
(×)10、不可逆过程的熵变是不可求的。
(×)11、任意过程中的热效应与温度相除,可以得到该过程的熵变。
(×)12、在孤立体系中,一自发过程由A B,但体系永远回不到原来状态。
(√)13、绝热过程Q=0,而T QdS δ=,所以dS=0。
(×)14、可以用一过程的熵变与热温商的大小关系判断其自发性。
(√)15、绝热过程Q=0,而ΔH=Q ,因此ΔH=0。
(×)16、按克劳修斯不等式,热是不可能从低温热源传给高温热源的。
(×)17、在一绝热体系中,水向真空蒸发为水蒸气(以水和水蒸气为体系),该过程W>0,ΔU>0。
(×)18、体系经过一不可逆循环过程,其体S ∆>0。
(×)19、对于气态物质,C p -C V =nR 。
(×)20、在一绝热体系中有一隔板,两边分别是空气和真空,抽去隔板,空气向真空膨胀,此时Q=0,所以ΔS=0。
(×)21、高温物体所含的热量比低温物体的多,因此热从高温物体自动流向低温物体。
(×)22、处于两相平衡的1molH 2O (l )和1molH 2O (g ),由于两相物质的温度和压力相等,因此在相变过程中ΔU=0,ΔH=0。
物理化学期末考试试题

物理化学期末考试试题一、选择题(每题2分,共20分)1. 在物理化学中,下列哪个量是状态函数?A. 热量B. 功C. 熵D. 温度2. 根据热力学第一定律,下列哪个表达式是正确的?A. ΔU = Q + WB. ΔH = Q - WC. ΔG = ΔH - TΔSD. ΔS = Q/T3. 理想气体状态方程是:A. PV = nRTB. PV = nRC. PV = RTD. PV = nT4. 一个化学反应在恒温恒压下进行,其反应焓变与反应熵变的关系是:A. ΔH = ΔG + TΔSB. ΔG = ΔH - TΔSC. ΔS = ΔH/TD. ΔG = ΔS - TΔH5. 根据范特霍夫方程,下列哪个描述是错误的?A. ΔG = ΔH - TΔSB. ΔG = ΔG° + RT ln(Q)C. ΔG° = -RT ln(K)D. ΔH° = ΔG° + RT ln(K)二、简答题(每题10分,共30分)6. 简述理想气体的微观模型,并解释其基本假设。
7. 解释什么是化学平衡常数,并说明它如何随温度变化。
8. 描述吉布斯自由能的概念,并解释它在化学反应中的应用。
三、计算题(每题25分,共50分)9. 已知一个理想气体在298K时的摩尔体积为22.4L/mol,求其在1atm压力下的摩尔数。
10. 假设一个化学反应在298K下进行,其标准生成焓ΔH°为-50kJ/mol,标准生成熵ΔS°为0.02kJ/(mol·K),求该反应在1atm 和1M浓度下的吉布斯自由能变化ΔG。
四、论述题(共30分)11. 论述温度对化学反应速率的影响,并给出一个具体的化学反应例子来解释这一现象。
12. 讨论在实际工业过程中,如何通过控制反应条件来优化化学反应的产率和选择性。
五、实验题(共30分)13. 设计一个实验来测定某一固体物质的热容,并说明实验步骤、所需设备和预期结果。
物理化学期末试题及答案

物理化学期末试题及答案一、选择题(每题2分,共20分)1. 下列哪种物质的摩尔质量不是以克/摩尔为单位?A. 氧气B. 二氧化碳C. 氢气D. 氮气答案:C2. 在理想气体状态方程中,PV=nRT中,P代表的是:A. 压力B. 体积C. 温度D. 摩尔数答案:A3. 根据热力学第一定律,下列哪项描述是正确的?A. 能量守恒B. 能量可以被创造或消失C. 能量可以被转化为质量D. 能量可以在不同形式间转换答案:D4. 以下哪个选项是正确的?A. 温度是热力学系统的宏观量B. 温度是热力学系统的微观量C. 温度是热力学系统的微观量和宏观量D. 温度不是热力学系统的量答案:A5. 根据热力学第二定律,下列哪项描述是错误的?A. 热量不能自发地从低温物体传递到高温物体B. 所有自然过程都会导致熵增加C. 熵是状态函数D. 熵是过程函数答案:D6. 在电化学中,哪个术语用于描述电子的流动?A. 电流B. 电压C. 电阻D. 电势答案:A7. 什么是电解质?A. 一种不导电的物质B. 一种在溶液中不产生离子的物质C. 一种在溶液中产生离子的物质D. 一种在熔融状态下产生离子的物质答案:C8. 根据阿伏伽德罗定律,1摩尔任何气体在标准状态下的体积是多少?A. 22.4 LB. 22.4 mLC. 224 LD. 224 mL答案:A9. 什么是布朗运动?A. 原子的无规则运动B. 分子的无规则运动C. 电子的无规则运动D. 离子的无规则运动答案:B10. 在理想气体的范德瓦尔斯方程中,b代表什么?A. 气体分子的体积B. 气体分子间的相互作用力C. 气体分子的动能D. 气体分子的势能答案:A二、填空题(每题2分,共20分)1. 摩尔质量的单位是______。
答案:克/摩尔2. 理想气体状态方程的公式是______。
答案:PV=nRT3. 热力学第一定律表明能量______。
答案:守恒4. 温度的单位是______。
物理化学期末试题及答案

物理化学期末试题及答案一、选择题(每题2分,共20分)1. 以下哪项是物质的三态变化?A. 固态、液态、气态B. 固态、液态、等离子态C. 固态、液态、超临界态D. 固态、液态、非晶态答案:A2. 热力学第一定律表明能量守恒,其表达式为:A. ΔU = Q + WB. ΔH = Q - WC. ΔG = Q - WD. ΔS = Q/T答案:A3. 理想气体状态方程为:A. PV = nRTB. PV = mRTC. PV = RTD. PV = nRT + a答案:A4. 以下哪种力是分子间的主要作用力?A. 重力B. 电磁力C. 万有引力D. 核力答案:B5. 根据热力学第二定律,下列哪项描述是正确的?A. 热量不能自发地从低温物体传到高温物体B. 热量可以自发地从低温物体传到高温物体C. 热量可以自发地从高温物体传到低温物体D. 热量不能自发地从高温物体传到低温物体答案:A6. 以下哪种物质的溶解度随温度升高而降低?A. 氯化钠B. 蔗糖C. 硝酸钾D. 氢氧化钙答案:D7. 根据布朗运动,下列哪项描述是正确的?A. 布朗运动是宏观物体的运动B. 布朗运动是分子的无规则运动C. 布朗运动是原子的有序运动D. 布朗运动是分子的有序运动答案:B8. 以下哪项是电解质?A. 乙醇B. 蔗糖C. 氯化钠D. 二氧化碳答案:C9. 根据阿伏伽德罗定律,1摩尔任何气体在标准状态下的体积是:A. 22.4 LB. 22.4 mLC. 224 LD. 224 mL答案:A10. 以下哪种物质是半导体?A. 石墨B. 铜C. 硅D. 金答案:C二、填空题(每空1分,共20分)1. 物质的量浓度的单位是______。
答案:mol/L2. 阿伏伽德罗常数的近似值是______。
答案:6.022 x 10^233. 标准大气压下,水的沸点是______。
答案:100°C4. 根据热力学第三定律,绝对零度是______。
物理化学期末考试试题库(附答案与解析)

精品文档. 第一章 热力学第一定律选择题 1.关于焓的性质, 下列说法中正确的是( )(A) 焓是系统内含的热能, 所以常称它为热焓 (B) 焓是能量, 它遵守热力学第一定律(C) 系统的焓值等于内能加体积功 (D) 焓的增量只与系统的始末态有关答案:D 。
因焓是状态函数。
2.涉及焓的下列说法中正确的是( )(A) 单质的焓值均等于零 (B) 在等温过程中焓变为零 (C) 在绝热可逆过程中焓变为零(D) 化学反应中系统的焓变不一定大于内能变化答案:D 。
因为焓变ΔH=ΔU+Δ(pV),可以看出若Δ(pV)<0则ΔH <ΔU 。
3.与物质的生成热有关的下列表述中不正确的是( )(A) 标准状态下单质的生成热都规定为零 (B) 化合物的生成热一定不为零 (C) 很多物质的生成热都不能用实验直接测量(D) 通常所使用的物质的标准生成热数据实际上都是相对值答案:A 。
按规定,标准态下最稳定单质的生成热为零。
4.下面的说法符合热力学第一定律的是( )(A) 在一完全绝热且边界为刚性的密闭容器中发生化学反应时,其内能一定变化(B) 在无功过程中, 内能变化等于过程热, 这表明内能增量不一定与热力学过程无关(C) 封闭系统在指定的两个平衡态之间经历绝热变化时, 系统所做的功与途径无关(D) 气体在绝热膨胀或绝热压缩过程中, 其内能的变化值与过程完成的方式无关答案:C 。
因绝热时ΔU =Q +W =W 。
(A )中无热交换、无体积功故ΔU =Q +W =0。
(B )在无功过程中ΔU =Q ,说明始末态相同热有定值,并不说明内能的变化与过程有关。
(D )中若气体绝热可逆膨胀与绝热不可逆膨胀所做的功显然是不同的,故ΔU 亦是不同的。
这与内能为状态函数的性质并不矛盾,因从同一始态出发,经绝热可逆膨胀与绝热不可逆膨胀不可能到达同一终态。
5.关于节流膨胀, 下列说法正确的是(A) 节流膨胀是绝热可逆过程(B)节流膨胀中系统的内能变化(C)节流膨胀中系统的焓值改变(D)节流过程中多孔塞两边的压力不断变化 答案:B6.在实际气体的节流膨胀过程中,哪一组描述是正确的:(A )Q >0, H =0, p < 0 (B )Q =0, H <0, p >0 (C )Q =0, H =0, p <0 (D )Q <0, H =0, p <0答案:C 。
物理化学期末考题目库(上下册)

一 化学热力学基础1-1 判断题1、可逆的化学反应就是可逆过程。
(×)2、Q 和W 不是体系的性质,与过程有关,所以Q+W 也由过程决定。
(×)3、焓的定义式H=U+pV 是在定压条件下推导出来的,所以只有定压过程才有焓变。
(×)4、焓的增加量ΔH 等于该过程中体系从环境吸收的热量。
(×)5、一个绝热过程Q=0,但体系的ΔT 不一定为零。
(√)6、对于一个定量的理想气体,温度一定,热力学能和焓也随之确定。
(√)7、某理想气体从始态经定温和定容两个过程达终态,这两个过程Q 、W 、ΔU 及ΔH 是相等的。
(×)8、任何物质的熵值是不可能为负值或零的。
(×)9、功可以全部转化为热,但热不能全部转化为功。
(×)10、不可逆过程的熵变是不可求的。
(×)11、任意过程中的热效应与温度相除,可以得到该过程的熵变。
(×)12、在孤立体系中,一自发过程由A B,但体系永远回不到原来状态。
(√)13、绝热过程Q=0,而T QdS δ=,所以dS=0。
(×)14、可以用一过程的熵变与热温商的大小关系判断其自发性。
(√)15、绝热过程Q=0,而ΔH=Q ,因此ΔH=0。
(×)16、按克劳修斯不等式,热是不可能从低温热源传给高温热源的。
(×)17、在一绝热体系中,水向真空蒸发为水蒸气(以水和水蒸气为体系),该过程W>0,ΔU>0。
(×)18、体系经过一不可逆循环过程,其体S ∆>0。
(×)19、对于气态物质,C p -C V =nR 。
(×)20、在一绝热体系中有一隔板,两边分别是空气和真空,抽去隔板,空气向真空膨胀,此时Q=0,所以ΔS=0。
(×)21、高温物体所含的热量比低温物体的多,因此热从高温物体自动流向低温物体。
(×)22、处于两相平衡的1molH 2O (l )和1molH 2O (g ),由于两相物质的温度和压力相等,因此在相变过程中ΔU=0,ΔH=0。
物理化学期末考试试题库 (附答案与解析)

第一章热力学第一定律选择题1.关于焓的性质, 下列说法中正确的是()(A) 焓是系统内含的热能, 所以常称它为热焓 (B) 焓是能量, 它遵守热力学第一定律(C) 系统的焓值等于内能加体积功 (D) 焓的增量只与系统的始末态有关答案:D。
因焓是状态函数。
2.涉及焓的下列说法中正确的是()(A) 单质的焓值均等于零 (B) 在等温过程中焓变为零 (C) 在绝热可逆过程中焓变为零(D) 化学反应中系统的焓变不一定大于内能变化答案:D。
因为焓变ΔH=ΔU+Δ(pV),可以看出若Δ(pV)<0则ΔH<ΔU。
3.与物质的生成热有关的下列表述中不正确的是()(A) 标准状态下单质的生成热都规定为零 (B) 化合物的生成热一定不为零 (C) 很多物质的生成热都不能用实验直接测量(D) 通常所使用的物质的标准生成热数据实际上都是相对值答案:A。
按规定,标准态下最稳定单质的生成热为零。
4.下面的说法符合热力学第一定律的是()(A) 在一完全绝热且边界为刚性的密闭容器中发生化学反应时,其内能一定变化(B) 在无功过程中, 内能变化等于过程热, 这表明内能增量不一定与热力学过程无关(C)封闭系统在指定的两个平衡态之间经历绝热变化时, 系统所做的功与途径无关(D) 气体在绝热膨胀或绝热压缩过程中, 其内能的变化值与过程完成的方式无关答案:C。
因绝热时ΔU=Q+W=W。
(A)中无热交换、无体积功故ΔU=Q+W=0。
(B)在无功过程中ΔU=Q,说明始末态相同热有定值,并不说明内能的变化与过程有关。
(D)中若气体绝热可逆膨胀与绝热不可逆膨胀所做的功显然是不同的,故ΔU亦是不同的。
这与内能为状态函数的性质并不矛盾,因从同一始态出发,经绝热可逆膨胀与绝热不可逆膨胀不可能到达同一终态。
5.关于节流膨胀, 下列说法正确的是(A)节流膨胀是绝热可逆过程(B)节流膨胀中系统的内能变化(C)节流膨胀中系统的焓值改变(D)节流过程中多孔塞两边的压力不断变化答案:B6.在实际气体的节流膨胀过程中,哪一组描述是正确的:(A)Q >0, H=0, p < 0 (B)Q=0, H <0, p >0 (C)Q=0, H =0, p <0 (D)Q <0, H =0, p <0答案:C。
《物理化学》下册期末考试试卷

化学专业《物理化学》下册期末考试试卷一、单项选择题(每小题2分,共30分)1、0.001 mol ·kg -1 K 3[Fe(CN) 6] 水溶液的离子强度为:( ) (A) 6.0×10-3 mol ·kg -1 (B) 5.0×10-3 mol ·kg -1 (C) 4.5×10-3 mol ·kg -1 (D) 3.0×10-3 mol ·kg -12、电导测定应用广泛,但下列问题中哪个是不能用电导测定来解决的( ) (A)求难溶盐的溶解度 (B)求弱电解质的解离度 (C)求平均活度系数 (D)测电解质溶液的浓度3、298 K 时, 0.005 mol ·kg -1 的 KCl 和 0.005 mol ·kg -1 的 NaAc 溶液的离子平均活度系数分别为 γ ±,1和 γ ±,2,则有 ( )(A) γ ±,1= γ ±,2 (B) γ ±,1> γ ±,2 (C) γ ±,1< γ ±,2 (D) γ ±,1≥ γ ±,24、金属与溶液间电势差的大小和符号主要取决于: ( )(A) 金属的表面性质 (B) 溶液中金属离子的浓度 (C)金属与溶液的接触面积 (D)金属的本性和溶液中原有的金属离子浓度5、金属活性排在H 2之前的金属离子,如Na + 能优先H +在汞阴极上析出,这是由于:( ) (A) φθ(Na +/ Na) < φ θ(H +/ H 2) (B) η (Na) < η (H 2) (C) φ (Na +/ Na) < φ (H +/ H 2)(D) H 2在汞上析出有很大的超电势, 以至于φ (Na +/Na) > φ (H +/H 2)6、已知Λ()K O H m 291,2∞=4.89×10-2-12mol m S ⋅⋅,此时(291K)纯水中的m (H +) =m (OH -) =7.8×10-8 mol ·kg -1,则该温度下纯水的电导率为( )(A)3.81×10-9 S ·m -1 (B )3.81×10-6 S ·m -1 (C)7.63×10-9 S ·m -1 (D )7.63×10-6 S ·m -17、基元反应体系aA + dD → gG 的速率表达式中,不正确的是:( ) (A) -d[A]/dt = k A [A]a [D]d ; (B) -d[D]/dt = k D [A]a [D]d ; (C) d[G]/dt = k G [G]g ; (D) d[G]/dt = k G [A]a [D]d 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一化学热力学基础1-1 判断题1、可逆得化学反应就就是可逆过程.(×)2、Q与W不就是体系得性质,与过程有关,所以Q+W也由过程决定。
(×)3、焓得定义式H=U+pV就是在定压条件下推导出来得,所以只有定压过程才有焓变。
(×)4、焓得增加量ΔH等于该过程中体系从环境吸收得热量.(×)5、一个绝热过程Q=0,但体系得ΔT不一定为零.(√)6、对于一个定量得理想气体,温度一定,热力学能与焓也随之确定。
(√)7、某理想气体从始态经定温与定容两个过程达终态,这两个过程Q、W、ΔU及ΔH就是相等得.(×)8、任何物质得熵值就是不可能为负值或零得。
(×)9、功可以全部转化为热,但热不能全部转化为功。
(×)10、不可逆过程得熵变就是不可求得.(×)11、任意过程中得热效应与温度相除,可以得到该过程得熵变。
(×)12、在孤立体系中,一自发过程由A B,但体系永远回不到原来状态。
(√)13、绝热过程Q=0,而,所以dS=0.(×)14、可以用一过程得熵变与热温商得大小关系判断其自发性。
(√)15、绝热过程Q=0,而ΔH=Q,因此ΔH=0。
(×)16、按克劳修斯不等式,热就是不可能从低温热源传给高温热源得。
(×)17、在一绝热体系中,水向真空蒸发为水蒸气(以水与水蒸气为体系),该过程W>0,ΔU>0。
(×)18、体系经过一不可逆循环过程,其〉0。
(×)19、对于气态物质,C p-C V=nR。
(×)20、在一绝热体系中有一隔板,两边分别就是空气与真空,抽去隔板,空气向真空膨胀,此时Q=0,所以ΔS=0。
(×)21、高温物体所含得热量比低温物体得多,因此热从高温物体自动流向低温物体。
(×)22、处于两相平衡得1molH2O(l)与1molH2O(g),由于两相物质得温度与压力相等,因此在相变过程中ΔU=0,ΔH=0。
(×)23、在标准压力下加热某物质,温度由T1上升到T2,则该物质吸收得热量为,在此条件下应存在ΔH=Q得关系。
(√)24、带有绝热活塞(无摩擦、无质量)得一个绝热气缸装有理想气体,内壁有电炉丝,将电阻丝通电后,气体慢慢膨胀。
因为就是一个恒压过程Q p=ΔH,又因为就是绝热体系Qp=0,所以ΔH=0.(×)25、体系从状态变化到状态Ⅱ,若ΔT=0,则Q=0,无热量交换.(×)26、公式只适用于可逆过程。
( ×)27、某一体系达到平衡时,熵最大,自由能最小。
( ×)28、封闭体系中,由状态1经定温、定压过程变化到状态2,非体积功,且有与,则此变化过程一定能发生。
(√)29、根据热力学第二定律,能得出,从而得到、。
( ×)30、只有可逆过程得才可以直接计算。
( ×)31、凡就是自由能降低得过程一定都就是自发过程。
(×)32、只做体积功得封闭体系,得值一定大于零。
( √)33、偏摩尔量就就是化学势.(×)34、在一个多组分溶液中,只有溶质才有偏摩尔量。
(×)35、两组分混合成溶液时,没有热效应产生,此时形成得溶液为理想溶液. ( ×)36、拉乌尔定律与亨利定律既适用于理想溶液,也适用于稀溶液。
(×)37、偏摩尔量因为与浓度有关,所以它不就是一个强度性质。
( ×)38、化学势得判据就就是吉布斯自由能判据。
(×)39、自由能G就是一个状态函数,从始态到终态Ⅱ,不管经历何途径,总就是一定得。
(√)40、定温定压及时,化学反应达平衡,反应得化学势之与等于产物得化学势之与。
( √)41、偏摩尔量就是容量性质,它不仅与体系得T、p有关,还与组成有关。
(×)42、在定温定压下,任一组分在全部浓度范围内都符合亨利定律得溶液,称为理想溶液.(×)43、定温定压得可逆过程,体系得吉布斯自由能得减少等于体系对外所做得最大非体积功.√44、可逆过程中,体系对环境做功最大,而环境对体系做功最小。
(√)45、理想气体绝热恒外压膨胀时,其温度将升高.(×)46、不可逆过程得熵变就是不可求得.(×)47、热不可能从低温物体传向高温物体.(×)48、单组分体系得偏摩尔量即为摩尔量。
49、热力学温度为0度时,任何纯物质得熵值都等于0。
50、理想溶液混合前后,熵变为0。
(×)51、根据定义,所有体系得广度性质都有加与性质。
(×)52、可以用体系得熵变与热温商得大小关系判断任意过程得自发性。
53、绝热过程Q=0,由于,所以dS=0。
(×)54、在定温定压下,CO2由饱与液体转变为饱与蒸气,因温度不变, CO2得热力学能与焓也不变。
( ×)55、25℃时H2(g)得标准摩尔燃烧焓等于25℃时H2O(g)得标准摩尔生成焓。
( ×)56、稳定态单质得Δf H mΘ(800K)=0. (√)70、临界温度就是气体加压液化所允许得最高温度。
(√)71、可逆得化学反应就就是可逆过程。
(×)72、Q与W不就是体系得性质,与过程有关,所以Q+ W也由过程决定. (×)73、焓得定义式H= U +pV就是在定压条件下推导出来得,所以只有定压过程才有焓变。
(×)74、焓得增加量∆H等于该过程中体系从环境吸收得热量.(×)75、一个绝热过程Q= 0,但体系得∆T不一定为零.(√)76、对于一定量得理想气体,温度一定,热力学能与焓也随之确定。
(√)77、某理想气体从始态经定温与定容两过程达终态,这两过程得Q、W、∆U及∆H就是相等得(×)78、任何物质得熵值就是不可能为负值与零得。
(×)79、功可以全部转化为热,但热不能全部转化为功。
(×)80、不可逆过程得熵变就是不可求得。
(×)81、某一过程得热效应与温度相除,可以得到该过程得熵变.(×)82、在孤立体系中,一自发过程由A→B,但体系永远回不到原来状态。
(√)83、绝热过程Q = 0,即,所以d S=0。
(×)84、可以用一过程得熵变与热温熵得大小关系判断其自发性。
(√)85、绝热过程Q = 0,而由于∆H = Q,因而DH等于零。
(×)86、按Clausius不等式,热就是不可能从低温热源传给高温热源得. (×)87、在一绝热体系中,水向真空蒸发为水蒸气(以水与水蒸气为体系),该过程W〉0,DU>0.(×)88、体系经过一不可逆循环过程,其∆S体>0。
(×)89、对于气态物质,C p-C V = nR。
(×)90、在一绝热体系中有一隔板,两边分别就是空气与真空,抽去隔板,空气向真空膨胀,此时Q= 0,所以∆S=0。
×91、克拉佩龙方程适用于纯物质得任何两相平衡。
( )92、克—克方程比克拉佩龙方程得精确度高。
( )93、一定温度下得乙醇水溶液,可应用克—克方程式计算其饱与蒸气压。
()1—2 选择题1、273K,时,冰融化为水得过程中,下列关系就是正确得有(B)A、B、C、D、2、体系接受环境做功为160J,热力学能增加了200J,则体系(A)A、吸收热量40JB、吸收热量360JC、放出热量40JD、放出热量360J 3、在一绝热箱内,一电阻丝浸入水中,通以电流。
若以水与电阻丝为体系,其余为环境,则(C)A、B、C、D、4、任一体系经一循环过程回到始态,则不一定为零得就是(D)A、B、C、D、5、对一理想气体,下列关系式不正确得就是(A)A、B、C、ﻩD、6、当热力学第一定律写成时,它适用于(C)A、理想气体得可逆过程B、封闭体系得任一过程C、封闭体系只做体积功过程D、封闭体系得定压过程7、在一绝热刚壁体系内,发生一化学反应,温度从,压力由,则(D)A、B、C、D、8、理想气体定温定压混合过程中,下列体系得性质不正确得就是(C)A、B、C、D、9、任意得可逆循环过程,体系得熵变(A)A、一定为零B、一定大于零C、一定为负D、就是温度得函数10、一封闭体系从变化时,经历可逆R与不可逆IR途径,则(B)A、B、C、D、11、理想气体自由膨胀过程中(D)A、B、C、D、12、与在绝热定容得体系中生成水,则(D)A、B、C、D、13、理想气体可逆定温压缩过程中,错误得有(A)A、B、C、D、14、当理想气体反抗一定外压做绝热膨胀时,则(D)A、焓总就是不变得B、热力学能总就是不变得C、焓总就是增加得D、热力学能总就是减小得15、环境得熵变等于(B、C)A、B、C、D、16、在孤立体系中进行得变化,其与得值一定就是(D)A、B、C、D、17、某体系经过不可逆循环后,错误得答案就是(A)A. B、ﻩC、D、18、C6H6(l)在刚性绝热容器中燃烧,则(D)A、B、C、D、19 、下列化学势就是偏摩尔量得就是(B )A. B、C、D、20、在,,1mol过冷得水结成冰时,下述表示正确得就是(C )A. B、C、D、21、下述化学势得公式中,不正确得就是(D)A、B、C、D、22、在373、15K,101、325Pa,与得关系就是(B)A. B、C、D、无法确定23、制作膨胀功得封闭体系,得值( B )A.大于零B、小于零C、等于零D、无法确定24、某一过程,应满足得条件就是( D )A.任意得可逆过程B.定温定压且只做体积中得过程C.定温定容且只做体积功得可逆过程D.定温定压且只做体积功得可逆过程25、1mol理想气体经一定温可逆膨胀过程,则( A)A. B、C、D、无法确定26、纯液体在正常相变点凝固,则下列量减少得就是(A)A.S B、GC、蒸汽压D、凝固热27、右图中哪一点就是稀溶液溶质得标准态得点( B )A、a点B、b点C、c点D、d点28、在下,当过冷水蒸气凝结为同温度得水,在该过程中正、负号无法确定得就是( D )A. B、C、D、29、实际气体得化学势表达式为,其中标准态化学势为(A)A.逸度得实际气体得化学势B.压力得实际气体得化学势C.压力得理想气体得化学势D.逸度得理想气体得化学势30、理想气体得不可逆循环,( B )A. B、C、D、无法确定31、在两相中含A、B两种物质,当达平衡时,正确得就是(B )A. B、C、D、32、多组分体系中,物质B得化学势随压力得变化率,即得值( A )A. B、C、D、无法确定33、、标准压力下,1mol过冷水蒸汽凝集成冰,则体系、环境及总得熵变为( B )A. B、C、D、34、p—V图上,1mol单原子理想气体,由状态A变到状态B,错误得就是(B)A. B、C、D、35、体系经不可逆过程,下列物理量一定大于零得就是(C )A. B、C、D、36、一个很大得恒温箱放着一段电阻丝,短时通电后,电阻丝得熵变(D)A. B、C、D、无法确定37、热力学得基本方程可使用与下列哪一过程(B )A、298K,标准压力得水蒸发得过程B、理想气体向真空膨胀C、电解水制备氢气D、合成氨反应未达平衡38、温度为T时,纯液体A得饱与蒸汽压为,化学势为,在1时,凝固点为,向A溶液中加入少量溶质形成稀溶液,该溶质就是不挥发得,则、、得关系就是( D )A. B、C、D、39下列性质不符合理想溶液通性得就是:(D )A、∆mixV=0B、∆mix S >0C、∆mixG<0 D、∆mix G 〉040、从A态到B态经不可逆过程ΔS体就是: ( D )A、大于零B、小于零C、等于零D、无法确定41、常压下—10℃过冷水变成-10℃得冰,在此过程中,体系得ΔG 与ΔH如何变化:(D )A、ΔG〈0,ΔH>0B、ΔG>0,ΔH>0C、ΔG=0,ΔH=0D、ΔG<0,ΔH<042、某绝热封闭体系在接受了环境所做得功之后,其温度:( A)A、一定升高B、一定降低C、一定不变D、不一定改变43、对于纯物质得标准态得规定,下列说法中不正确得就是:(C)A、气体得标准态就就是温度为T,压力为100kPa下具有理想气体性质得纯气体状态。
