浙江医药股份有限公司关于与 AMBRX
浙江苏泊尔制药有限公司产品更新技改项目环境影响评价...

浙江苏泊尔制药有限公司产品更新技改项⽬环境影响评价...浙江苏泊尔制药有限公司产品更新技改项⽬环境影响评价简本⼀.项⽬概况浙江怡园医药化⼯有限公司成⽴于2002年5⽉,系苏泊尔集团的全资⼦公司,是⼀家⽣物医药⽣产企业。
公司于2005年取得医药⽣产许可证后,于2005年1⽉1⽇更改为浙江苏泊尔制药有限公司。
公司位于袍江⼯业区越东路,占地65亩。
经过⼏年的发展与投⼊,公司现有固定资产2000万元,总资产3600万元。
公司主要⽣产3-氨基丁烯酸⼄酯及2-(2,3-⼆氯亚苄基)⼄酰⼄酸甲酯产品。
2005年实现⼯业总产值2700万元,创利税410万元。
由于3-氨基丁烯酸⼄酯、2-(2,3-⼆氯亚苄基)⼄酰⼄酸甲酯产品已处于市场衰退期,公司⽬前拥有产品销售量逐年减少,且公司在近两年内研制出了⼀些新产品,为促进企业发展,提⾼企业经济效益,公司决定淘汰现有⽣产产品,新上⼀些污染少、效益好、技术含量⾼的新产品,即淘汰现有3-氨基丁烯酸⼄酯、2-(2,3-⼆氯亚苄基)⼄酰⼄酸甲酯产品,⽣产替硝唑、噻克硝唑、奥硝唑等11个新产品。
项⽬投资:总投资4500万元,其中固定资产总投资1900万元,流动资⾦2600万元。
企业⾃筹2800万元,其余拟通过银⾏贷款解决。
项⽬效益:年销售收⼊8500万元,年利润1600万元,税后净利润1100万元,投资回收期3.39年。
⼆.⼯程内容及污染因素分析1、项⽬名称、性质及实施地点项⽬名称:浙江苏泊尔制药有限公司产品更新技改项⽬建设性质:技改建设单位:浙江苏泊尔制药有限公司实施地点:技改项⽬在绍兴市袍江⼯业区、浙江苏泊尔制药有限公司现⼚区内实施。
2、项⽬⽣产规模及产品⽅案技改项⽬⽣产规模及产品⽅案见表1。
表1 技改项⽬⽣产规模及产品⽅案3、主要⽣产设备项⽬主要⽣产设备见表2~表9。
表2 替硝唑主要⽣产设备⼀览表表3 塞克硝唑主要⽣产设备⼀览表表4 盐酸安⾮他酮主要⽣产设备⼀览表表5 奥硝唑主要⽣产设备⼀览表表6 ⾮洛地平主要⽣产设备⼀览表表7 拉莫三嗪主要⽣产设备⼀览表表8 富马酸喹硫平主要⽣产设备⼀览表表9 舒马曲坦主要⽣产设备⼀览表4、主要原辅料消耗项⽬主要原辅料消耗见表10~表17。
医药生物:紧抓“未满足临床需求”与“美好生活需求”

证券分析师叶寅投资咨询资格编号:*********************************.CN 倪亦道投资咨询资格编号:S1060518070001 *********************.CN 韩盟盟投资咨询资格编号:***************************************.CN 李颖睿投资咨询资格编号:S1060520090002***********************.CN证券研究报告紧抓“未满足临床需求”与“美好生活需求”2021年6月20日行业评级医药生物强于大市(维持)投资要点2020H1回顾:截至2021年6月11日,医药板块指数上涨7.58%,同期沪深300指数上涨0.26%,医药板块跑赢沪深300 7.32pp。
估值处于历史中位,相比年初溢价率有所提升。
全基金持仓比例变化不大。
2021年1-4月份,医药制造业收入8774亿元,同比增长28.50%;利润总额1611亿元,同比增长80.20%。
医药制造业恢复势头强劲。
行业观点:政策推进维持行业分化,紧抓未满足临床需求与美好生活需求。
2021年医改继续推进,控费仍为医药行业政策的主旋律。
目前药品带量采购已进入第五轮,成为常态化工作,集采品种量增价跌趋势明显。
高值耗材带量采购在2020年下半年冠脉支架中率先开始,即将在更多品种中展开。
控费的前提下,在医药行业中寻找结构性机会至关重要。
我们认为应紧抓社会发展所带来的两大核心需求:(1)尚未满足的临床需求与(2)持续升级的美好生活需求。
投资建议:2018-2021年以来,行业政策方向已经明晰,我们预计未来相当一段时间仍处于行业政策密集推广的阶段,建议回避受政策压制领域,坚守政策免疫且符合行业发展趋势的高景气细分龙头。
主线一:由创新驱动的临床需求。
随着技术实力的提升以及审批环境的改善,中国无论从药品还是器械行业,均迎来自主创新的收获期,同时激活了CRO、CMO等相关外包产业链,重点推荐:恒瑞医药、凯莱英、药石科技、东诚药业、智飞生物、康宁杰瑞、九典制药、心脉医疗;主线二:迭代升级的美好生活需求。
杭城药业“双头会”

决 ,而这使得 2 0 年 年底公 司流 动资金贷 款 比期 05
初增加 了l亿元 。 2 更让人忧心的是 ,截至2 0 年 l月3 ,公 司 05 2 旧 的流 动负债总额达到16 . 亿元 ,流动 比率( 映公 司 9 反 的短 期偿债能 力) 和速动 比率{ 指可以立 即用 来偿 付 流 动负债的资产 ) 分别降至D 5 和Q , ,远远 低于 92 55 5 2 l 正 常 水 平 —— 而 这 显 然 预 示 了 至 2 0 年 和 的 05
资本 财 ●技
J 年的挣扎 ,鑫富药业终于下决心从医药保健品领域撤退 ,出 5 售该公司旗下药业厂区整体资产 。而接手鑫富药业相关资产的正是同在 杭州临安的医药上市公司——天 目药业。
- '
~
"
本刊记者 钟文倩
对 于 已 亏损 S 的 医药 保健 品 业 务 ,鑫 富 药 业 年
于鑫富药业 对三家被 收购公司绝对 控
股 ,因此 在 采 取 权益 法 核 算 的情 况 下 ,又 导 致 了 ]7 2万 元 的投 资 亏 7. 8
损。
方 想收 缩 战线 ,甩 下包袱 ,以便 集 中精力做好主业;而另一方由பைடு நூலகம்主营就是这 块 ,因此对 于这 部分 业务驾轻 就熟 ,通过 收购还能进一步扩大市场份额 ,因此此番交 易可谓各取所需 ,你情我愿。”屈呋称。
提的是 ,2 0 年 天 目药业在主营 业务上 , 08
26 S 7 2 %,由此 导致 毛 利 率从 2 。 年 05
的7 2 1 %下 降至 2 0 年 的7 .%。而 2 06 0i 9 对于当年仅 得的 13 万 元净利润 ,同 97
只 有药品和 保健 品实现营 业利润率 同 比正 增 长 ,分 别 为 2 2 %和 i.1 33 9 %,其 余 在 电子产 6 品 和 医疗 器械 业 务 模 块 上 的营 业 利 润 增 长 率 ,分别为 一6 2 2 o %和一4 9 2 , %的负增长 。 5 而对 于收购鑫 富药业相 关资产的决 定 , 似 乎也可 以从 天 目药业2 0 年的财 报表述 中 09 找 出 些 许 端 倪 。例 如 该 财 报 宣 称 计 划 在 2 0 年 “ 大 做 强 保 健 品 市 场 ” ,并称 要 09 做 “ 激活 内部机 制 ,跳 出小规 模经营 的模式 ,
干货抗体偶联药物(adc)深度研究报告

干货抗体偶联药物(adc)深度研究报告目录一、行业背景针对病症历史沿革基本原理介绍二、核心技术抗体部分(1)靶点选择(2)抗体选择(3)抗体修饰(4)抗体内吞连接物部分(1)连接物(Linker)选择(2)连接方式及DAR(3)新技术Abzena的ThioBridge毒素部分核心专利-连接物与毒素排序三、效果对比:Kadcyla对比Herceptin四、核心公司竞争情况1.领先公司(1)Seattle Genetics (2)ImmunoGen (3)Immunomedics 2.规模较大公司(1)Abzena (2)Agensys (3)Celldex (4)Progenics Pharmaceuticals (5)Genmab (6)Sorrento旗下Concortis 3.大型药企在ADC领域的布局(1)Abbvie 及其旗下Stemcentrx (2)Roche旗下Genetech的情况(3)武田旗下Takeda Oncology (4)辉瑞ADC 产品Mylotarg(5)复星、药明、浙江医药与Ambrx (6)三生制药及三生国健(7)丽珠医药集团旗下丽珠单抗(8)江苏恒瑞医药(9)四川恒康旗下上海美雅珂生物(10)其他药企五、行业市场规模六、ADC成功要素分析独家技术优秀团队研发方向一、行业背景抗体偶联药物Antibody-drug Conjugate (ADC)是拥有强细胞毒性的化疗药物通过连接物与单抗偶联形成的,兼具小分子药物强大的杀伤力和纯单抗高度的靶向性,因而成为肿瘤靶向治疗的研究和发展热点。
但是,ADC 本身并非在各方面强于纯单抗。
其疗效的显著提升是通过牺牲药品的均一性与稳定性实现的。
现在比较成熟的两种偶联技术分别侧重均一性与稳定性,有一些新式偶联技术能够在两方面同时改善。
1、针对病症ADC药物被用于癌症治疗,其针对病症由其中抗体所针对的靶点决定,能够对将该靶点高表达的肿瘤细胞进行针对性DNA破坏或抑制微管。
浙江医药企业名单

详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细 详细
浙江医药股份有限公司 浙江英特药业有限责任公司中药分公司 浙江英特药业有限责任公司新特药分公司 浙江英特药业有限责任公司药品分公司 浙江英特药业有限责任公司 嘉兴市博雅达医药有限公司 海宁医药集团有限责任公司 宁波普诺生物医药有限公司 宁波百草世家医药有限公司 宁波大红鹰医药供销有限公司 中化宁波(集团)有限公司 宁波药材股份有限公司医药批发分公司 宁波药材股份有限公司 浙江鼎盛医药有限公司 宁波医药股份有限公司药品分公司 宁波医药股份有限公司医药批发部 宁波医药股份有限公司新源分公司 宁波医药股份有限公司新特药分公司 宁波医药股份有限公司中西药分公司 宁波医药股份有限公司 海盐县医药总公司 杭州欣瑞能医疗器械有限公司 杭州国坚贸易有限公司 杭州中益医疗器械有限公司 杭州昆瀚医疗科技有限公司 杭州联舟生物科技有限公司 浙江恩赞生物医药有限公司 杭州博克医疗生物制品有限公司 浙江紫荆生物技术有限公司 杭州嘉普生物科技有限公司 浙江省医疗器械有限公司 杭州弘健生物科技有限公司 杭州科华医疗设备有限公司 杭州希美医疗科技有限公司 杭州普安基因工程有限公司 杭州金针贸易有限公司 杭州中翰盛泰科技有限公司 浙江为诚医药股份有限公司 杭州百利医药有限公司 浙江正方龙腾医药有限公司 湖州方兴医药有限公司 湖州浙通医疗器械有限公司 湖州心良药业有限公司 浙江双溪医药有限公司 浙江华圣医药有限公司 浙江湖州京华医药有限公司 湖州欣瑞医药有限公司
浙AA5760020 浙AB5760004 浙AA5760011 浙AA5760010 浙AA5760006 浙AB5760002 浙AA1021205 浙AA0717231 浙AA0718240 浙AA0719242 浙AA0722264 浙AA0725280 浙AA0720258 浙AA7001027 浙AA7002053 浙AA5790017 浙AA7004097 浙AA5790009 浙AA7003077 浙AA7005128 浙AA5790020 浙AA579001790001 浙AA5790006 浙AA0726281 浙AA5780006 浙AB5780004 浙AB5780001 浙AA1111230 浙AA5780008 浙AB5780005 浙AA5700010 浙AA5790014 浙AA5790004 浙AB5770008 浙AB5770007 浙AA5770021 浙AA5770019 浙AA1101054 浙AA1102075 浙AA1103092 浙AA5780004 浙AA0160211 浙AA0172234
四川国为制药有限公司诉阿斯利康(瑞典)有限公司确认是否落入专利权保护范围纠纷案

四川国为制药有限公司诉阿斯利康(瑞典)有限公司确认是否落入专利权保护范围纠纷案文章属性•【案由】知识产权权属、侵权纠纷•【案号】(2023)最高法知民终7号•【审理法院】最高人民法院•【审理程序】二审•【裁判时间】2023.06.14正文四川国为制药有限公司诉阿斯利康(瑞典)有限公司确认是否落入专利权保护范围纠纷案中华人民共和国最高人民法院民事裁定书(2023)最高法知民终7号上诉人(原审被告):四川国为制药有限公司。
住所地:中华人民共和国四川省眉山市眉山经济开发区新区。
法定代表人:郭礼新,该公司执行董事。
委托诉讼代理人:王艳,女,该公司员工。
委托诉讼代理人:王雪昕,女,该公司员工。
被上诉人(原审原告):阿斯利康(瑞典)有限公司。
住所地:瑞典王国南泰利耶15185。
代表人:彼得·斯托姆,该公司高级专利代理师。
委托诉讼代理人:邰红,北京市金杜律师事务所律师。
委托诉讼代理人:郭煜,北京市金杜律师事务所专利代理师。
上诉人四川国为制药有限公司(以下简称四川国为公司)因与被上诉人阿斯利康(瑞典)有限公司(以下简称阿斯利康公司)确认是否落入专利权保护范围纠纷一案,不服中华人民共和国北京知识产权法院(以下简称原审法院)于2022年11月18日作出的(2022)京73民初586号民事判决,向本院提起上诉。
本院于2023年1月13日立案后,依法组成合议庭,因案件涉及商业秘密,于2023年2月21日不公开开庭审理了本案。
上诉人四川国为公司的委托诉讼代理人王艳、王雪昕,被上诉人阿斯利康公司的委托诉讼代理人邰红、郭煜到庭参加诉讼。
本案现已审理终结。
四川国为公司上诉请求:撤销原审判决,确认阿斯利康公司享有的名称为“作为用于治疗糖尿病的SGLT2抑制剂的(1S)-1,5-脱水-L-C-(3-((苯基)甲基)苯基)-D-葡萄糖醇衍生物与氨基酸的结晶溶剂合物和络合物”、专利号为20078002××××.X的发明专利(以下简称涉案专利)权利要求9不属于药品专利链接案件审理的专利类型。
这家中国药企何以获得美国关税豁免

这家中国药企何以获得美国关税豁免作者:来源:《文萃报·周五版》2018年第31期今年7月6日,美国率先对价值340亿美元的自中国进口商品加征25%的关税。
市场一片震荡,一家为自己争得了关税豁免权的中国制药企业却格外平静。
在最后关头把浙江医药股份有限公司(下称浙江医药)的产品从美国的征税清单上抹除掉,并不是美国贸易代表突然释放善意,更不是收取了这家公司的好处费,而是该企业通过最直接的方式——跟美国贸易代表办公室据理力争,通过法律途径使对方更改了决策。
解决问题而不是一味哀嚎赵俊兴是美籍华人,已在制药行业工作25年。
2013年3月,赵俊兴带着他自主研发的无菌喷雾干燥粉针制剂生产专利——注射用盐酸万古霉素制剂——加入浙江医药,担任副董事长。
今年4月13日,赵俊兴收到“美国要对中国商品征税”的消息。
浙江医药出口到美国的产品大概占总销售额的30%,大部分产品都是以价格优势取胜。
本来就微薄的利润,如果再被征25%的额外关税就会完全失去竞争力,届时市场会被欧洲或是印度的产品占据。
浙江医药董事长李春波来电催问这件事该如何处理。
有30年美国生活经验的赵俊兴回答,按照美国的法律,并不是总统发布法律就能够直接实施。
每一项法律在未实施之前,所有的美国公民都可以要求发表自己的意见,“让我去做点工作”。
“一份逻辑性非常强的证词”挂掉电话后,赵俊兴立即找了美国一家律师事务所,着手整理出“一份逻辑性非常强的证词”。
对时事比较关心的赵俊兴知道,美国国内现在最受关注的正好是“鸦片危机”问题,每天平均有100名美国人死于鸦片类药物过量。
依赖鸦片类药物的人免疫能力下降,容易出现感染。
而万古霉素是一种抗耐药菌的“超级抗生素”,一旦产生鸦片类药物依赖,在美国的标准治疗方式就是使用万古霉素。
但给这些病人的关键用药,美国几乎不生产,主要从中国进口,仅浙江医药生产的万古霉素就占全球产量的50%。
像浙江医药这样有创新技术、能够给美国病人减轻病痛的产品出现在打击清单中,赵俊兴相信这并不是美国想要的。
中外制药株式会社与温州海鹤药业有限公司确认是否落入专利权保护范围纠纷案

中外制药株式会社与温州海鹤药业有限公司确认是否落入专利权保护范围纠纷案文章属性•【案由】专利权权属纠纷•【案号】(2022)最高法知民终905号•【审理法院】最高人民法院•【审理程序】二审•【裁判时间】2022.08.05正文中外制药株式会社与温州海鹤药业有限公司确认是否落入专利权保护范围纠纷案最高人民法院民事判决书(2022)最高法知民终905号上诉人(原审原告):中外制药株式会社。
住所地:日本国东京都北区浮间五丁目5番1号。
代表人:奥田修,该株式会社董事长、总裁兼总经理。
委托诉讼代理人:李斌馨,北京奋讯(上海)律师事务所律师。
委托诉讼代理人:尚广振,北京奋讯(上海)律师事务所律师。
被上诉人(原审被告):温州海鹤药业有限公司。
住所地:中华人民共和国浙江省温州市温州经济技术开发区星海街道滨海二十五路360号。
法定代表人:王仁民,该公司执行董事。
委托诉讼代理人:贺伊博,北京允天律师事务所律师。
委托诉讼代理人:张秋林,北京允天律师事务所律师。
上诉人中外制药株式会社因与被上诉人温州海鹤药业有限公司(以下简称海鹤公司)确认是否落入专利权保护范围纠纷一案,不服中华人民共和国北京知识产权法院(以下简称原审法院)于2022年4月15日作出的(2021)京73民初1438号民事判决,向本院提起上诉。
本院于2022年5月23日立案后,依法组成合议庭,因案件涉及商业秘密,于2022年7月5日不公开开庭进行了审理。
上诉人中外制药株式会社的委托诉讼代理人李斌馨、尚广振,被上诉人海鹤公司的委托诉讼代理人贺伊博、张秋林到庭参加诉讼。
本案现已审理终结。
中外制药株式会社上诉请求:撤销原审判决,改判支持其原审全部诉讼请求。
包括:1.确认海鹤公司申请注册的“艾地骨化醇软胶囊”(以下简称涉案仿制药)落入专利号为200580009877.6、名称为“ED-71制剂”的发明专利权(以下简称涉案专利权)的保护范围;2.对海鹤公司作出错误专利声明及违反《药品专利纠纷早期解决机制实施办法(试行)》(以下简称药品专利纠纷实施办法)第六条规定的行为予以批评教育。
2012年最新药企排名

2011年1-12月全部制药企业按利润总额排序No.企业名称1中国医药集团总公司2威高集团有限公司3上海医药(集团)有限公司4山东步长制药有限公司5扬子江药业集团有限公司6新和成控投集团有限公司7哈药集团有限公司8云南白药股份有限公司9天津天士力集团有限公司10齐鲁制药有限公司11杭州赛诺菲安万特民生制药有限公司12广州医药集团有限公司13四川科伦药业股份有限公司14康美药业股份有限公司15浙江医药股份有限公司16江苏恒瑞医药股份有限公司17华润东阿阿胶有限公司18修正药业集团股份有限公司19神威药业有限公司20江苏正大天晴药业股份有限公司21石药集团有限公司22山东省药用玻璃股份有限公司23鲁南制药集团股份有限公司24辽宁成大生物股份有限公司25辅仁药业集团有限公司26北京双鹤药业股份有限公司27上海罗氏制药有限公司28杭州华东医药集团有限公司29浙江海正药业股份有限公司30北京泰德制药有限公司31武汉人福医药集团股份有限公司32华瑞制药有限公司33北京双鹭药业股份有限公司34杭州民生医药控股集团有限公司35上海怡新医疗设备有限责任公司36乐普(北京)医疗器械股份有限公司37深圳信立泰药业股份有限公司38南京圣和药业有限公司39丽珠医药集团股份有限公司40东宝实业集团有限公司41山东罗欣药业股份有限公司42西安万隆制药股份有限公司43黑龙江珍宝岛药业股份有限公司44北京同仁堂健康药业股份有限公司45西安杨森制药有限公司46微创医疗器械(上海)有限公司47辰欣药业股份有限公司48青岛黄海制药有限责任公司49康恩贝集团有限公司50中美天津史克制药有限公司51北京同仁堂股份有限公司53瑞阳制药有限公司54仁和(集团)发展有限公司55广东罗浮山国药股份有限公司56江苏康缘集团有限责任公司57贵州益佰制药股份有限公司58浙江仙琚制药股份有限公司59江西济民可信集团有限公司60天津中新药业集团股份有限公司61辉瑞制药有限公司62拜耳医药保健有限公司63南京医药产业(集团)有限责任公司64成都地奥制药集团有限公司65健康元药业集团股份有限公司66西安力邦制药有限公司67牡丹江市友搏药业有限责任公司68四川好医生药业集团有限公司69浙江华海药业股份有限公司70上海西门子医疗器械有限公司71珠海联邦制药股份有限公司72江中药业股份有限公司73北京同仁堂科技发展股份有限公司74宜昌东阳光药业股份有限公司75江苏济川制药有限公司76葵花药业集团股份有限公司77寿光富康制药有限公司78山东绿叶制药有限公司79中美上海施贵宝制药有限公司80宁夏启元药业有限公司81重庆华邦制药股份有限公司82四川百利药业有限责任公司83北京紫竹药业有限公司84菏泽睿鹰制药集团有限公司85上海科华生物工程股份有限公司86深圳市海王生物工程股份有限公司87宁夏泰瑞制药股份有限公司88天津药业集团有限公司89上海莱士血液制品股份有限公司90北京同仁堂健康药业(福州)有限公司91浙江尖峰药业有限公司92利君国际医药(控股)有限公司93河南省宛西制药股份有限公司94海南卫康制药(潜山)有限公司95上海凯宝药业股份有限公司96山东淄博山川医用器材有限公司97锦州奥鸿药业有限责任公司98黑龙江江世药业有限公司99四川禾润制药有公司100海南养生堂药业有限公司101九芝堂股份有限公司102山东福胶集团有限公司103长春金赛药业股份有限公司104江苏奥赛康药业股份有限公司105亚宝药业集团股份有限公司107沈阳三生制药有限责任公司108吉林四环制药有限公司109金花企业(集团)股份有限公司110江苏苏中药业集团股份有限公司111北京嘉林药业股份有限公司112苏州东瑞制药有限公司113中国通用技术(集团)控股有限责任公司114回音必集团有限公司115南京绿叶思科药业有限公司116吉林金宝药业股份有限公司117山东达因海洋生物制药股份有限公司118卫材(中国)药业有限公司119广东一方制药有限公司120海南海药股份有限公司121葛兰素史克制药(苏州)有限公司122山东新华医疗器械股份有限公司123浙江天皇药业有限公司124山东新华医药集团有限责任公司125湘北威尔曼制药股份有限公司126贵州百灵企业集团制药股份有限公司127双鸽集团有限公司128昆明制药股份有限公司129浙江中贝九洲集团有限公司130北京四环制药有限公司131北京赛科药业有限责任公司132广州康臣药业有限公司133哈尔滨誉衡药业股份有限公司134海南海灵化学制药有限公司135雅安三九药业有限公司136江苏江山制药有限公司137北京费森尤斯卡比医药有限公司138北京诺华制药有限公司139山东福胶集团东阿镇阿胶有限公司140贵州泰邦生物制品有限公司141百泰生物药业有限公司142赛诺菲安万特(北京)制药有限公司143常州四药制药有限公司144海南惠普森医药生物技术有限公司145山东仙河药业有限公司146上海强生制药有限公司147泰尔茂医疗产品(杭州)有限公司148诺维信(中国)生物技术有限公司149浙江升华拜克生物股份有限公司150山东博士伦福瑞达制药有限公司151吉林万通药业集团梅河药业股份有限公司152广州龙沙有限公司153广州南新制药有限公司154珠海亿邦制药股份有限公司155江苏恩华药业股份有限公司156横店集团康裕药业有限公司157秦皇岛骊骅淀粉股份有限公司158中美合资山西普德药业有限公司159集安益盛药业股份有限公司161吉林敖东延边药业股份有限公司162河南福森药业有限公司163曼秀雷敦(中国)药业有限公司164山西振东制药股份有限公司165浙江天宇药业股份有限公司166天圣制药集团股份有限公司167华北制药河北华民药业有限责任公司168上海强生有限公司169株洲千金药业股份有限公司170山西康宝生物制品股份有限公司171重庆福安药业(集团)股份有限公司172北京绿竹生物制药有限公司173普洛股份有限公司174江苏亚邦药业集团股份有限公司175北京协和制药二厂176江苏万邦生化医药股份有限公司177青岛华仁药业股份有限公司178吉林紫鑫药业股份有限公司179北京赛升药业有限公司180海南亚洲制药有限公司181汇仁集团有限公司182大理药业股份有限公司183西南合成制药股份有限公司184东盛科技启东盖天力制药股份有限公司185哈尔滨仁皇药业有限公司186武汉健民药业集团股份有限公司187上海康德莱企业发展集团有限公司188北京韩美药品有限公司189吉林四长制药有限公司190昆明龙津药业股份有限公司191紫光古汉集团股份有限公司192江西青峰药业有限公司193湖北新生源生物工程股份有限公司194广州市香雪制药股份有限公司195浙江亚峰药厂有限公司196成都恩威投资(集团)有限公司197帝斯曼维生素(上海)有限公司198汕头市超声仪器研究所有限公司199北京利德曼生化股份有限公司200浙江司太立制药股份有限公司201吉林金泉宝山药业集团股份有限公司202迪沙药业集团有限公司203四川大千药业有限公司204山东凤凰制药股份有限公司205四川禾邦阳光制药股份有限公司206河北恒利集团制药股份有限公司207山东福田药业有限公司208辽宁诺康生物制药有限责任公司209长沙楚天科技有限公司210浙江莎普爱思药业股份有限公司211山东天力药业有限公司212广东台城制药股份有限公司213通化万通药业股份有限公司216沈阳双鼎制药有限公司217哈尔滨三联药业有限公司218湖州数康生物科技有限公司219东软飞利浦医疗设备系统有限责任公司220武汉远大制药集团有限公司221云南生物谷灯盏花药业有限公司222哈尔滨圣泰制药股份有限公司223上海卫康光学眼镜有限公司224吉林省辉南长龙生化药业股份有限公司225北京博士伦眼睛护理产品有限公司226北京天新福医疗器材有限公司227英科新创(厦门)科技有限公司228大冢(中国)投资有限公司229北京万泰生物药业股份有限公司230上海杰隆生物制品有限公司231甘肃独一味生物制药股份有限公司232东港工贸集团有限公司233内蒙古福瑞中蒙药科技股份有限公司234上海宝龙药业有限公司235重庆正川玻璃有限公司236深圳九新药业有限公司237甘李药业有限公司238珍奥集团股份有限公司239广东太安堂药业股份有限公司240广东彼迪药业有限公司241宁波戴维医疗器械股份有限公司242北京谊安医疗系统股份有限公司243上海其胜生物制剂有限公司244上海迪赛诺化学制药有限公司245深圳市卫武光明生物制品有限公司246重庆莱美药业股份有限公司247北京北大维信生物科技有限公司248烟台荣昌制药股份有限公司249天津华津制药有限公司250湖南方盛制药有限公司251四川逢春制药有限公司252湖南恒生制药有限公司253山东金城医药化工股份有限公司254浙江永宁药业股份有限公司255海口奇力制药有限公司256宁波人健药业集团有限公司257浙江佐力药业股份有限公司258美罗药业股份有限公司259黑龙江迪龙制药有限公司260江西樟树天齐堂中药饮片有限公司261四川宝光药业股份有限公司262广东太阳神集团有限公司263辽宁依生生物制药有限公司264苏州天马医药集团有限公司265北京协和药厂266浙江新东港药业股份有限公司267重庆华森制药有限公司270云南维和药业股份有限公司271梅河口四环制药有限公司272上海复旦复华药业有限公司273葛兰素史克(天津)有限公司274贵州健兴药业有限公司275浙江万邦药业有限公司276山西振东泰盛制药有限公司277本溪龙宝(集团)参茸有限公司278浙江亚太药业股份有限公司279瑞声达听力技术(中国)有限公司280中国医学科学院医学生物学研究所281四川国瑞药业有限责任公司282浙江史密斯医学仪器有限公司283江苏吴中医药集团有限公司284云南盟生药业有限公司285哈尔滨派斯菲科生物制药股份有限公司286山东齐都药业有限公司287浙江天新药业有限公司288安徽协和成药业饮片有限公司289山东三九药业有限公司290深圳立健药业有限公司291杭州南洋药业有限公司292江西益康医疗器械集团有限公司293贵州同济堂制药有限公司294云南良方制药有限公司295浙江新光药业有限公司296上海天伟生物制药有限公司297巴斯夫维生素有限公司298南京先声东元制药有限公司299沈阳红旗制药有限公司300吉林省通化振国药业有限公司301赤峰天奇制药有限公司302贵阳新天药业股份有限公司303浙江康乐药业股份有限公司304江苏七o七天然制药有限公司305青海制药厂有限公司306山东先声麦得津生物制药有限公司307麒麟鲲鹏(中国)生物药业有限公司308烟台大洋制药有限公司309承德颈复康药业集团有限公司310吉林一正药业有限公司311广西玉林制药集团有限责任公司312海南双成药业股份有限公司313桂林市啄木鸟医疗器械有限公司314海南皇隆制药厂有限公司315浙江我武生物科技有限公司316海南中化联合制药工业股份有限公司317贵州威门药业股份有限公司318山东中保康医疗器具有限公司319丹东医创药业有限责任公司320福建归真堂药业股份有限公司321蓬莱诺康药业有限公司323宁波鑫高益磁材有限公司324江西3l医用制品集团有限公司325浙江圣达药业有限公司326珠海亿胜生物制药有限公司327北京同仁堂制药有限公司328济南宏济堂制药有限公司329北京周林频谱科技有限公司330湖南洞庭药业股份有限公司331宁波立华制药有限公司332安徽省皖北药业股份有限公司333哈尔滨一洲制药有限公司334山东鲁抗医药股份有限公司335浙江京新药业股份有限公司336陕西金裕制药股份有限公司337同溢堂药业有限公司338宁波永新光学股份有限公司339北京京丰制药有限公司340贵州益康制药有限公司341苏州中化药品有限公司342鲁南厚普制药有限公司343哈尔滨凯程制药有限公司344安徽黄山胶囊股份有限公司345湖南华纳大药厂有限公司346福建南少林药业有限公司347西安环球印务股份有限公司348浙江众益药业有限公司349山西仟源制药股份有限公司350赤峰制药股份有限公司351宁夏多维药业有限公司352山东鑫泉医药有限公司353北京利祥制药有限公司354桂林天和药业股份有限公司355上海执诚生物科技股份有限公司356上海医疗器械(集团)有限公司手术器械厂357浙江长生鸟药业有限公司358广州阳普医疗科技股份有限公司359陕西汉王药业有限公司360沈阳兴齐制药有限公司361浙江康德莱医疗器械股份有限公司362上海联合赛尔生物工程有限公司363贵州百灵企业集团天台山药业有限公司364大连华立金港药业有限公司365旭化成医疗器械(杭州)有限公司366黑龙江福和华星制药集团股份有限公司367陕西盘龙制药有限公司368江西百神药业股份有限公司369上海卡乐康包衣技术有限公司370湖北午时药业股份有限公司371康普药业股份有限公司372广东立国制药有限公司373江西三鑫医疗器械集团有限公司374宜昌三峡制药有限公司375澳诺(中国)制药有限公司377山东华鲁制药有限公司378上海昊海生物科技有限公司379上海百特医疗用品有限公司380青州尧王制药有限公司381云南天宏香精香料有限公司382江西药都医药集团股份有限公司383南京臣功制药股份有限公司384海南灵康制药有限公司385杭州澳亚生物技术有限公司386宜宾五粮液集团宜宾制药有限责任公司387辽宁科泰生物基因制药股份有限公司388广东环球制药有限公司389广东顺峰药业有限公司390贵州景峰注射剂有限公司391浙江新赛科药业有限公司392浙江车头制药有限公司393云南云河药业有限公司394安丘市鲁安药业有限公司395江西百神昌诺药业有限公司396上海景峰制药有限公司397浙江思贤制药有限公司398珠海安生凤凰制药有限公司399四川川大华西药业股份有限公司400宁波市天衡制药有限公司401内蒙古奇特生物高科技术(集团)有限公司402兰州佛慈制药股份有限公司403成都恒瑞制药有限公司404四川美大康药业股份有限公司405悦康药业集团有限公司406云南广泰生物科技开发公司407湖北成田制药股份有限公司408宁波绿之健药业有限公司409天津市威曼生物材料有限公司410山东潍坊盛泰药业有限公司411广东邦民制药厂有限公司412湖南湘泉制药有限公司413天津喜来健医疗器械有限公司414浙江巴奥米特医药产品有限公司415大连库利艾特医疗制品有限公司416浙江巨都药业集团有限公司417甘肃金维沙药业有限公司418西门子听力仪器(苏州)有限公司419陕西汉江药业集团股份有限公司420通化华厦药业有限责任公司421福建天泉药业股份有限公司422深圳科兴生物工程有限公司423湖南福来格生物技术有限公司424德州德药制药有限公司425济南利民制药有限责任公司426北京岐黄制药有限公司427上海浦东金环医疗用品股份有限公司428汕头金石制药总厂429上海新兴医药股份有限公司431广东省博罗先锋药业集团有限公司432北京星昊医药股份有限公司433贵州远程制药有限责任公司434金华寿仙谷药业有限公司435贵州太和制药有限公司436浙江海翔药业股份有限公司437江苏省健尔康医用敷料有限公司438淮南山河药用辅料有限公司439湖南春光九汇现代中药有限公司440空气化工产品气体(深圳)有限公司441浙江天一堂药业有限公司442山东健民药业有限公司443贵州金桥药业有限公司444浙江震元制药有限公司445沈阳红药制药有限公司446上海绿谷制药有限公司447通化昌源医药科技有限公司448巨化集团公司制药厂449通化茂祥制药有限公司450广东艾希德药业有限公司451甘肃岷海制药有限责任公司452湖南大自然制药有限公司453云南特安呐制药股份有限公司454湖州金洁实业有限公司455莆田仁德医疗器械厂456浙江苏嘉医疗器械股份有限公司457南京星银药业集团有限公司458艾森生物(杭州)有限公司459海南中和药业有限公司460杭州天目山药业股份有限公司461浙江万联药业有限公司462浙江昂利康制药有限公司463山东京卫制药有限公司464北京宝树堂科技药业有限公司465杭州桐庐尖端内窥镜有限公司466浙江诚意药业有限公司467华北制药金坦生物技术股份有限公司468南昌立健药业有限公司469吉林省博大制药有限责任公司470海南通用同盟药业有限公司471重庆凯林制药有限公司472武汉启瑞药业有限公司473甘肃省丰源本草天然产物股份有限公司474浙江华康药业股份有限公司475浙江都邦药业股份有限公司476海南海神同洲制药有限公司477湖南迪诺制药有限公司478四川美大康佳乐药业有限公司479哈尔滨东方制药有限公司480重庆慧远药业有限公司481通化金马药业集团股份有限公司482上海津村制药有限公司483艾康生物技术(杭州)有限公司485深圳市中联制药有限公司486中发实业集团业锐药业有限公司487杭州老桐君制药有限公司488四川合信药业有限责任公司489北京万东医疗装备股份有限公司490红河千山生物工程有限公司491黑龙江澳利达奈德制药有限公司492甘肃扶正药业科技股份有限公司493广西桂林中族中药股份有限公司494浙江康莱特药业有限公司495山西广生医药包装股份有限公司496南京易亨制药有限公司497贵州百祥制药有限责任公司498成都华神集团股份有限公司499吉林天强制药有限公司500甘肃奇正实业(集团)有限公司501宁波天益医疗器械有限公司502厦门金日制药有限公司503山东北大高科华泰制药有限公司504上海欣科医药有限公司505浙江天台药业有限公司506浙江得恩德制药有限公司507福建省闽东力捷迅药业有限公司508安徽辉克药业有限公司509北京思达医用装置有限公司510陕西秦明医学仪器股份有限公司511浙江拓普药业股份有限公司512辽宁本溪三药有限公司513西安仁仁药业有限公司514贵州家诚药业有限责任公司515河北万邦复临药业有限公司516上海光电医用电子仪器有限公司517杨凌东科麦迪森制药有限公司518甘肃陇神戎发制药有限公司519湖北省宏源药业有限公司520上海味之素氨基酸有限公司521通化久铭药业有限公司522开开援生制药股份有限公司523温州市维日康生物科技有限公司524甘肃新兰药药业有限公司525西安碑林药业股份有限公司526安徽宏业药业有限公司527通化玉圣药业股份有限公司528苏州二叶制药有限公司529四川制药制剂有限公司530浙江丽水众益药业有限公司531内蒙古双奇药业股份有限公司532天津中安药业有限公司533浙江惠松制药有限公司534福建新大陆生物技术有限公司535淄博伊马新华制药设备有限公司536珠海宏利药业有限公司537南京海辰药业有限公司539山东益康药业股份有限公司540海南康芝药业股份有限公司541云南盘龙云海药业有限公司542北京太洋药业有限公司543沈阳志鹰制药厂544大连华立德泽药业有限公司545云南腾药制药股份有限公司546浙江康吉尔药业有限公司547西北医疗器械集团有限公司548华东医药股份有限公司549上海紫源制药有限公司550湖州展望药业有限公司551联邦制药(内蒙古)有限公司552深圳赛保尔生物药业有限公司553绿十字(中国)生物制品有限公司554上海金皮宝制药有限公司555浙江华光胶囊有限公司556贵州瑞和制药有限公司557宁波华辉医用器械有限公司558烟台中亚药业有限责任公司559九江昂泰胶囊有限公司560河北九派制药有限公司561瑞莱生物工程(深圳)有限公司562甘肃祁连山药业有限公司563大连jms医疗器具有限公司564成都蓉药实业集团有限公司565上海阿洛卡医用仪器有限公司566绍兴华通制药有限公司567衢州伟荣药化有限公司568黑龙江哈尔滨医大药业有限公司569艾博生物医药(杭州)有限公司570山东洁晶药业有限公司571河南省新谊药业股份有限公司572深圳万和制药有限公司573海南爱科制药有限公司574杭州华津药业有限公司575山东华信制药集团股份有限公司576杭州京泠医疗器械有限公司577浙江维康药业有限公司578浙江科惠医疗器械有限公司579惠州市九惠制药股份有限公司580陕西郝其军制药股份有限公司581杭州光典医疗器械有限公司582西安阿房宫药业有限公司583广西金海堂药业有限责任公司584大同同星抗生素有限责任公司585芜湖绿叶制药有限公司586广东一力集团制药有限公司587上海海虹实业(集团)有限公司588贵州和仁堂药业有限公司589眼力健(杭州)制药有限公司590内蒙古兰太药业有限公司591杭州手心医药化学品有限公司593江西制药有限责任公司594辉南辉发药业股份有限公司595太极集团有限公司596黑龙江黑宝药业股份有限公司597东芝(大连)有限公司598陕西必康制药有限公司599通化正和药业有限公司600广东万年青制药有限公司601福建南方制药股份有限公司602北京松下电工有限公司603上海英伯肯医学生物技术有限公司604上海曹杨医药用品厂605甘肃益民药业有限责任公司606海南澳美华制药有限公司607河北天成药业有限公司608哈尔滨大洋制药股份有限公司609凯莱英医药化学(阜新)技术有限公司610四川明欣药业有限责任公司611珠海金鸿药业有限公司612湖南平安医械科技有限公司613新疆华世丹药业股份有限公司614金色年华药业有限公司615北京三元基因工程有限公司616黑龙江北大荒药业有限公司617徕卡显微系统(上海)有限公司618锦州九泰药业有限责任公司619浙江龙飞实业股份有限公司620牡丹江灵泰药业股份有限公司621上海童涵春堂中药饮片有限公司622云南植物药业有限公司623浙江迪耳药业有限公司624绍兴振德医用敷料有限公司625浙江远力健药业有限责任公司626厦门特宝生物工程股份有限公司627浙江新康药用玻璃有限公司628铁岭北亚药用油有限公司629陕西省康乐制药厂630上海黄海制药有限责任公司631贵州苗药药业有限公司632上海运佳黄浦制药有限公司633西安正大制药有限公司634浙江海森药业有限公司635辽源誉隆亚东药业有限责任公司636云南理想药业有限公司637牡丹江恒远药业有限公司638甘肃亚兰药业有限公司639潍坊三维生物工程集团有限公司640通化博祥药业股份有限公司641福州海王金象中药制药有限公司642四川阳光润禾药业有限公司643赤峰艾克制药科技股份有限公司644福州迈新生物技术开发公司645浙江泰利森药业有限公司。
2018年医药流通行业运行统计分析报告

2018年医药流通行业运行统计分析报告一、医药流通行业发展概况 (4)(一)整体规模 (4)(二)企业效益 (5)(三)销售品类与渠道 (5)(四)销售区域分布 (7)(五)所有制结构 (7)(六)医药物流配送 (9)(七)医药电商 (9)(八)企业上市 (10)(九)注册执业药师 (11)(十)社会经济贡献 (11)二、医药流通行业运行特点 (11)(一)药品批发企业销售增长有所放缓 (11)(二)药品零售企业连锁率进一步提高 (12)(三)医药电商开启资源整合的平台化发展之路 (13)(四)医药物流市场竞争明显加剧 (14)三、医药流通行业趋势展望 (15)(一)药品流通市场销售规模稳步增长 (15)(二)药品流通行业发展进入结构调整期 (15)(三)资本成为改变药品流通行业格局的重要力量 (16)(四)医药电商发展模式日新月异 (16)(五)智慧供应链服务水平不断提升 (17)(六)专业化服务成为药品零售企业核心竞争力 (17)(七)药品流通行业和企业软实力日益增强 (18)附录: (18)图1 2013-2017 年药品流通行业销售趋势 (5)图2 2017年医药全行业销售品类结构 (6)图3 2017年典型样本城市零售药店销售品类结构 (6)图4 2017年药品流通企业主营业务收入所有制结构 (8)图 5 2017年药品流通企业利润总额所有制结构 (8)图 6 2017年药品流通直报企业B2B业务销售结构 (10)图7 2017年药品流通直报企业B2C业务销售结构 (10)表录表 1 2017年医药区域总销售统计表 (18)表 2 2017年西药类区域销售统计表 (19)表 3 2017年中成药类区域销售统计表 (20)表 4 2017年中药材类区域销售统计表 (21)表 5 2017年医疗器材类区域销售统计表 (22)表 6 2017年药品批发企业主营业务收入前100位排序 (23)表7 2017年药品零售企业销售总额前100位排序 (25)一、医药流通行业发展概况2017年是全面落实“十三五”规划的重要一年,是供给侧结构改革的关键之年。
注射用盐酸万古霉素(万君雅)市场分析

注射用盐酸万古霉素(万君雅)市场情况注射用盐酸万古霉素(万君雅)市场情况一、产品简介:通用名称:盐酸万古霉素商品名称:万君雅英文名称:Vancomycin Hydrochloride for Injection汉语拼音:Zhusheyong Yansuan Wangumeisu【规格】1.0g(按万古霉素计),0.5g。
【包装】1瓶/盒【批准文号】注册证号H20050118【生产企业】雅来丹麦制药公司(Alpharma ApS)阿特维斯(佛山)制药有限公司【功能主治】/【适应症】本品适用于耐甲氧西林金黄色葡萄球菌及其他细菌所致的感染:败血症、感染性心内膜炎、骨髓炎、关节炎、灼伤、手术创伤等浅表性激发感染、肺炎、肺脓肿、脓胸、腹膜炎、脑膜炎。
【用法用量】通常用盐酸万古霉素每天2g(效价),可分为每6小时500mg或每12小时1g,每次静滴在60分钟以上,可根据年龄、体重、症状适量增减。
老年人每12小时500mg或每24小时1g,每次静滴在60分钟以上。
新生儿每次给药量10-15mg/kg,出生一周内的新生儿每12小时给药一次,出生一周至一月新生儿每8小时给药一次,每次静滴在60分钟以上。
配药方法为在含有本品0.5g的小瓶中加入10mL注射用水溶解,在以至少100mL生理盐水或5%葡萄糖注射液稀释,静滴时间在60分钟以上。
【不良反应】报审时在进行安全性评价的107例对象中,发祥其临床检查值异常变化的副作用33例(30.8%),再审结束时在进行安全性评价的3009例对象中,发现其临床检查值有异常变化的副作用404例(13.43%).(副作用的发生频率根据报审、再审结束时的数据及我公司的研究报告等)重大副作用:1)休克、过敏样症状(少于0.1%):因为可产生休克、过敏样症状(呼吸苦难、全身潮红、浮肿等),所以应留心观察,若出现症状则停止给药,采取适当处理措施。
2)急性肾功能不全(0.5%),间质性肾炎(频率不明):因可出现急性肾功能不全,间质性肾炎等重要的肾功能损害,所以有必要进行定期检查,若出现异常最好停止给药,若必须继续用药,则应减低药量慎重给药。
IPO特殊案例1、医药企业IPO被否主要原因

医药企业IPO被否主要原因2017年10月24日,第十七届发审委召开2017年第9次会议,湘北威尔曼制药股份有限公司首次公开发行股票未获通过,据笔者统计,这是2017年以来IPO 被否的第5家医药公司。
笔者归纳医药行业首次公开发行反馈意见以及发审委主要关注问题,从中亦可一窥医药公司被否主要原因,以供参考。
一、商业贿赂由于我国医疗体制问题,多数医院存在以药养医现象,医药公司亦依赖销售代表公关进入医院机构采购体系,商业贿赂成为行业潜规则。
《刑法》第163条规定,公司、企业或者其他单位的工作人员利用职务上的便利,索取经营者财物或者非法收受经营者财物,为经营者谋取利益,数额较大的,或者在经济往来中,利用职务上的便利,违反国家规定,收受经营者给予的各种名义的回扣、手续费,归个人所有的行为。
《刑法》第164条规定,经营者为谋取不正当利益,给予公司、企业或者其他单位的工作人员以财物,数额较大的行为,则构成本罪。
此处的经营者一般包括自然人和单位。
商业贿赂情节严重的,行贿和受贿者均面临刑事处罚风险,不符合IPO之合法合规要求,由此也是监管部门关注重中之重。
2017年3月27日,南京圣和药业股份有限公司于主板发审委第44次会议被否。
在《首次公开发行股票申请文件反馈意见》规范性问题第2个问题问到:《招股说明书》披露,发行人主要采用“配送商+专业化学术推广”的销售模式。
请发行人补充披露“配送商+专业化学术推广”的销售模式中“配送商”的含义,“配送商”是否是经销商,经销和直销模式下的销售金额及比例。
请保荐机构核查相关信息披露的准确性和适当性。
第5个问题问到:请发行人补充披露营销支持人员和驻外营销人员是否均属于发行人的员工,二者的区别,对营销支持人员和驻外营销人员的管理方式;补充披露市场拓展费的主要内容。
请发行人补充说明对营销支持人员和驻外营销人员的激励方式,相关经销商的激励方式,相关返点、返利等的会计处理方式提成、奖金等的会计处理方式;报告期内举行学术化推广的具体情况,相关费用的发生情况,相应的会计处理;市场拓展费的详细内容,会计核算方法。
普洛药业:关于全资子公司药品通过仿制药一致性评价的公告

证券代码:000739 证券简称:普洛药业公告编号:2020-41普洛药业股份有限公司关于全资子公司药品通过仿制药一致性评价的公告近日,普洛药业股份有限公司(以下简称“公司”)之全资子公司浙江巨泰药业有限公司收到国家药品监督管理局核准签发的关于阿莫西林胶囊的《药品补充申请批件》,该药品通过仿制药一致性评价。
现将相关情况公告如下:一、药品基本情况1.药品名称:阿莫西林胶囊2.剂型:胶囊剂3.规格:0.125g、0.25g4.申请事项:补充申请(一致性评价)5.注册分类:化学药品6.批件号:2020B03000/2020B030017.药品批准文号:国药准字H33021729/国药准字H330217288.药品生产企业:浙江巨泰药业有限公司9.审批结论:经审查,本品通过仿制药质量和疗效一致性评价。
二、药品的其他相关情况阿莫西林属于青霉素类广谱β-内酰胺类抗生素,对大多数致病的革兰氏阳性菌及革兰氏阴性菌均有强大的抑菌和杀菌作用,临床广泛用于治疗敏感菌所致上呼吸道感染、泌尿生殖道感染、皮肤软组织感染、下呼吸道感染以及与其他药物联用根除幽门螺杆菌,且轻中度肾病患者无需调整剂量。
阿莫西林胶囊已进入甲类医保和2018年国家基药目录。
根据米内网数据库显示,2019年阿莫西林胶囊国内销售额约为24亿元,同比上涨10%。
截止目前,公司用于开展阿莫西林胶囊(0.125g、0.25g)一致性评价累计投入研发费用约828万元。
三、对公司的影响及风险提示公司阿莫西林胶囊通过仿制药一致性评价,有利于扩大该药品的市场份额,提升该产品的市场竞争力,对公司长期经营有一定的积极作用。
该产品未来销售情况可能会受市场环境变化等不确定性因素的影响。
敬请广大投资者谨慎决策,注意防范投资风险。
特此公告。
普洛药业股份有限公司董事会2020年5月18日。
浙江医药股票深度分析(详情)

浙江医药股票深度分析(详情)浙江医药股票深度分析浙江医药是一家从事医药研发、制造和销售的医药类上市公司,成立于1999年11月16日,并于2016年12月16日在上海证券交易所上市。
其总部位于浙江省绍兴市,拥有浙江亚太药业股份有限公司、绍兴县康宁医院等子公司。
浙江医药的核心业务为原料药、制剂药产品的研发、制造和销售。
其原料药产品包括维生素B12、聚乙二醇4000、甲磺酸伊马替尼等,制剂药产品包括苯扎贝特、地塞米松系列等。
此外,浙江医药还从事医药研发、注册、销售、医药流通等业务,并拥有多个国家级的创新药物研发平台和医药创新技术平台。
从财务表现上看,浙江医药的业绩表现较为稳定。
2017至2019年,公司的营业收入分别为54.2亿元、58.2亿元和61.8亿元,同比增长率分别为4.27%、5.62%和4.33%。
净利润分别为3.6亿元、3.7亿元和3.5亿元,同比增长率分别为-2.49%、2.88%和-2.48%。
每股收益分别为0.24元、0.25元和0.23元,同比增长率分别为-2.44%、2.88%和-2.48%。
在经营环境方面,医药行业是关系国计民生的重要行业,对于保障公共健康和实现经济持续健康发展具有重要作用。
同时,医药行业也面临着诸多挑战,如技术创新、政策监管、市场竞争等。
在这样的背景下,浙江医药需要不断加强自身研发实力、提高产品品质和服务质量,以应对市场挑战。
未来,浙江医药可以通过加大研发投入、拓展产品线、加强品牌建设等方式来提升市场竞争力。
同时,公司还可以通过兼并收购等方式扩大业务规模,提高市场份额。
总体来说,浙江医药是一家具有研发实力和市场竞争力的医药类上市公司,但也需要关注市场变化和政策风险等因素,以保持稳健的业绩表现和可持续发展。
浙江医药股票目标价多少钱根据我了解到的信息,浙江医药股票的价格目标价为____11.35元____。
这个价格是基于5.52x2023年市盈率。
目前该公司的股价为9.65元,存在一定的上涨空间。
医药:海正药业牵手辉瑞百灵与百诺技术转让

医药:海正药业牵手辉瑞百灵与百诺
技术转让
第一农经讯9月13日,贵州百灵与海正药业可谓风光无限,把利好消息发挥的淋漓极致。
1、贵州百灵与济南百诺签订技术转让合同
9月13日,贵州百灵(002424)晚间公告,公司9月12日与济南百诺医药科技开发有限公司签订《技术转让合同书》,双方经过有效的协商,就治疗失眠的化药3类“美乐托宁原料及缓释片”项目临床批件技术转让事宜签订该合同。
按该合同,济南百诺将其拥有的“美乐托宁原料及缓释片”转让给公司,内容包括:临床批件及该品种相关的生产、开发全部权利,临床批件号为:2011L00537、2011L00536;该品种临床前研究工作由济南百诺负责,临床试验及申报生产工作由公司负责,济南百诺配合公司完成上述工作,使研制药品的工艺、质量及稳定性达到《药品注册管理办法》的技术要求。
公司向济南百诺提供本项目技术转让费,总计750万元。
2、海正药业牵手辉瑞设合资公司
9月13日,海正药业(600267)与全球最大的以研发为基础的制药企业辉瑞公司在杭州宣布,由双方合资组建的海正辉瑞制药有限公司正式成立。
据悉,海正辉瑞制药有限公司总投资2.95亿美元,注册资本2.5亿美元。
其中海正药业和辉瑞的持股比例分别为51%
和49%.双方将向合资企业注入现有产品线中经过精挑细选的产品。
合资企业成立伊始的产品组合将覆盖肿瘤、心血管、抗感染、神经系统、免疫抑制剂等治疗领域。
综上,受次利好消息影响,第一农经预计相关股都将备受投资者以及股民的青睐,被大肆拉高,节节攀升。
浙江泛亚生物医药股份有限公司与浙江泛亚生物医药股份有限公司民事裁定书

浙江泛亚生物医药股份有限公司与浙江泛亚生物医药股份有限公司民事裁定书【案由】民事侵权责任纠纷其他侵权责任纠纷【审理法院】江苏省高级人民法院【审理法院】江苏省高级人民法院【审结日期】2021.03.19【案件字号】(2021)苏民辖终41号【审理程序】二审【审理法官】葛晓燕顾洪青汤立双【审理法官】葛晓燕顾洪青汤立双【文书类型】裁定书【当事人】浙江泛亚生物医药股份有限公司【当事人】浙江泛亚生物医药股份有限公司【当事人-公司】浙江泛亚生物医药股份有限公司【法院级别】高级人民法院【原告】浙江泛亚生物医药股份有限公司【本院观点】根据《最高人民法院关于适用的解释》第二百八十五条第一款规定,公益诉讼案件由侵权行为地或者被告住所地中级人民法院管辖,但法律、司法解释另有规定的除外。
【权责关键词】撤销侵权管辖权异议被告住所地侵权行为地侵权行为实施地侵权结果发生地证明公益诉讼【指导案例标记】0【指导案例排序】0【本院认为】本院经审查认为:根据《最高人民法院关于适用的解释》第二百八十五条第一款规定,公益诉讼案件由侵权行为地或者被告住所地中级人民法院管辖,但法律、司法解释另有规定的除外。
该法第二十四条规定,民事诉讼法第二十八条规定的侵权行为地,包括侵权行为实施地、侵权结果发生地。
江苏省苏州市人民检察院诉称,2017年至2020年,泛亚公司通过天猫和淘宝网络平台向包括苏州地区在内的地域销售蝉花系列产品,并发往苏州市姑苏区等地,并提供初步证据。
故苏州为被诉侵权行为地,原审法院依照上述规定对本案有管辖权,其裁定驳回泛亚公司提出的管辖权异议,并无不当,应予维持。
泛亚公司上诉理由不成立,本院不予采纳。
依照《中华人民共和国民事诉讼法》第一百七十条第一款第一项、第一百七十一条的规定,裁定如下:【裁判结果】驳回上诉,维持原裁定。
本裁定为终审裁定。
【更新时间】2022-08-23 04:46:55【二审上诉人诉称】泛亚公司上诉称,江苏省苏州市人民检察院未就本案提供依据以证明有损害事实发生,因此,本案不存在有侵权行为地的情形。
企业信用报告_浙江医药股份有限公司昌海生物分公司

目录一、企业背景 (5)1.1 工商信息 (5)1.2 分支机构 (5)1.3 变更记录 (6)1.4 主要人员 (10)1.5 联系方式 (10)二、股东信息 (11)三、对外投资信息 (11)四、企业年报 (11)五、重点关注 (12)5.1 被执行人 (12)5.2 失信信息 (12)5.3 裁判文书 (13)5.4 法院公告 (13)5.5 行政处罚 (13)5.6 严重违法 (13)5.7 股权出质 (13)5.8 动产抵押 (13)5.9 开庭公告 (13)5.11 股权冻结 (14)5.12 清算信息 (14)5.13 公示催告 (14)六、知识产权 (14)6.1 商标信息 (14)6.2 专利信息 (14)6.3 软件著作权 (15)6.4 作品著作权 (16)6.5 网站备案 (16)七、企业发展 (16)7.1 融资信息 (16)7.2 核心成员 (16)7.3 竞品信息 (16)7.4 企业品牌项目 (16)八、经营状况 (17)8.1 招投标 (17)8.2 税务评级 (18)8.3 资质证书 (18)8.4 抽查检查 (19)8.5 进出口信用 (19)8.6 行政许可 (20)一、企业背景1.1 工商信息企业名称:浙江医药股份有限公司昌海生物分公司工商注册号:330600000199306统一信用代码:91330600325593940P法定代表人:王红卫组织机构代码:32559394-0企业类型:股份有限公司分公司(上市)所属行业:批发业经营状态:开业注册资本:-注册时间:2014-12-26注册地址:浙江省绍兴市越城区沥海街道畅和路58号营业期限:2014-12-26 至 9999-09-09经营范围:一般项目:日用化学产品销售;日用化学产品制造;食品添加剂销售;销售:卫生材料、制药机械、消字号产品、化妆品、化学试剂(不含危险品)、医疗器械(限国产一类);化妆品生产(凭有效许可证经营);生产、销售:饲料添加剂、化工产品(不含危险化学品及易制毒化学品);年产:氢(压缩的)1140万Nm3、一氧化碳和氢气混合物5164万Nm3、二氧化碳(压缩的)6300吨、异戊醛8000吨、乙酸2890吨、30%硫酸15000吨、甲醇/乙醇混合物3000吨、3-甲基-3-丁烯-1-醇2500吨。
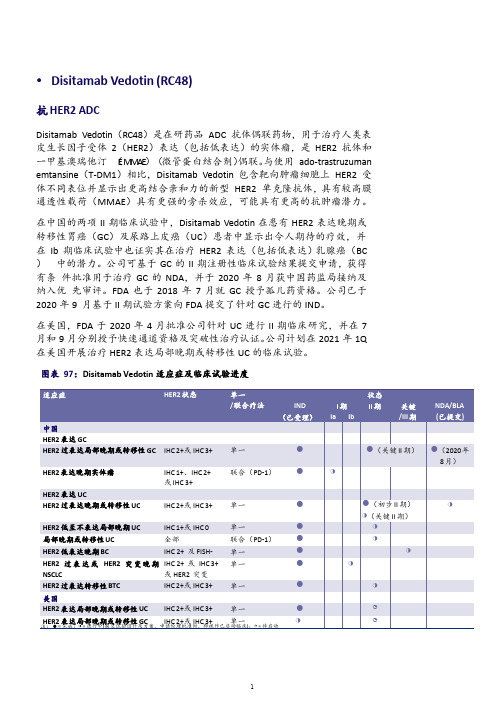
荣昌生物Disitamab Vedotin (RC48)药物价值评估(2021年)
deruxtecan
第一三共╱阿斯利康
适应症
HER2过表达GC HER2阳性GC HER2阳性GC
HER2阳性GC
临床阶段
NDA II I
II
公司在中国进行了 II 期注册性临床试验,针对 HER2 过表达(IHC 2+或 IHC 3+)晚期或转移性 GC 的安全性及疗效。该试验是一项开放标签、多中心、 单臂 II 期临床研究,截至 2020 年 6 月 22 日,该试验招募 127 名曾接受过 至少两次化疗治疗的 HER2 过表达(IHC 2+或 3+)GC 或 GEJ 癌症患者,其中
HER2 低至不表达局部晚期 UC
IHC 1+或 IHC 0
单一
局部晚期或转移性 UC HER2 低表达晚期 BC
全部
联合(PD-1)
IHC 2+ 及 FISH- 单一
HER2 过 表 达 或 HER2 突 变 晚 期 IHC 2+ 或 IHC 3+ 单一
NSCLC
或 HER2 突变
浙江医学科技开发有限公司健康药房中河路店介绍企业发展分析报告

Enterprise Development专业品质权威Analysis Report企业发展分析报告浙江医学科技开发有限公司健康药房中河路店免责声明:本报告通过对该企业公开数据进行分析生成,并不完全代表我方对该企业的意见,如有错误请及时联系;本报告出于对企业发展研究目的产生,仅供参考,在任何情况下,使用本报告所引起的一切后果,我方不承担任何责任:本报告不得用于一切商业用途,如需引用或合作,请与我方联系:浙江医学科技开发有限公司健康药房中河路店1企业发展分析结果1.1 企业发展指数得分企业发展指数得分浙江医学科技开发有限公司健康药房中河路店综合得分说明:企业发展指数根据企业规模、企业创新、企业风险、企业活力四个维度对企业发展情况进行评价。
该企业的综合评价得分需要您得到该公司授权后,我们将协助您分析给出。
1.2 企业画像类别内容行业空资质增值税一般纳税人产品服务:药品零售;食品经营(销售预包装食品);保1.3 发展历程2工商2.1工商信息2.2工商变更2.3股东结构2.4主要人员2.5分支机构2.6对外投资2.7企业年报2.8股权出质2.9动产抵押2.10司法协助2.11清算2.12注销3投融资3.1融资历史3.2投资事件3.3核心团队3.4企业业务4企业信用4.1企业信用4.2行政许可-工商局4.3行政处罚-信用中国4.5税务评级4.6税务处罚4.7经营异常4.8经营异常-工商局4.9采购不良行为4.10产品抽查4.12欠税公告4.13环保处罚4.14被执行人5司法文书5.1法律诉讼(当事人)5.2法律诉讼(相关人)5.3开庭公告5.4被执行人5.5法院公告5.6破产暂无破产数据6企业资质6.1资质许可6.2人员资质6.3产品许可6.4特殊许可7知识产权7.1商标7.2专利7.3软件著作权7.4作品著作权7.5网站备案7.6应用APP7.7微信公众号8招标中标8.1政府招标8.2政府中标8.3央企招标8.4央企中标9标准9.1国家标准9.2行业标准9.3团体标准9.4地方标准10成果奖励10.1国家奖励10.2省部奖励10.3社会奖励10.4科技成果11 土地11.1大块土地出让11.2出让公告11.3土地抵押11.4地块公示11.5大企业购地11.6土地出租11.7土地结果11.8土地转让12基金12.1国家自然基金12.2国家自然基金成果12.3国家社科基金13招聘13.1招聘信息感谢阅读:感谢您耐心地阅读这份企业调查分析报告。
浙江医药在与日本药企的国际知识产权诉讼案中获胜

浙江医药在与日本药企的国际知识产权诉讼案中获胜
佚名
【期刊名称】《企业家》
【年(卷),期】2013(000)003
【摘要】2013年2月1日,浙江医药股份有限公司董事长李春波的心终于可以放下了一一持续两年、从德国一直打到美国的国际知识产权诉讼案,因日本Kaneka公司在规定期限内放弃了上诉,浙江医药最终在美国337调查案中获胜,这也意味着中国企业应诉美国337调查“再下一城”。
【总页数】1页(P106-106)
【正文语种】中文
【中图分类】F279.23
【相关文献】
1.适应国际知识产权发展新形势——日本内阁会议通过知识产权相关法律修改草案[J], 闻雷
2.我国医药产业应对国际知识产权保护的对策 [J], 姜松柏
3.聚焦基层医药市场把握药企发展机遇第四届嬗变中的中国基层医药市场高峰论坛在厦门召开 [J], 王霞
4.“一带一路”中非传统医药合作与国际知识产权制度的变革 [J], 冯洁菌; 周濛
5.推进中医药“十病十药”研发,带动首都中医药同步发展——北京市政府9部门联合召开“十病十药”名医、名院、名企献方大会 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
股票代码:600216 股票简称:浙江医药编号:临2013-018浙江医药股份有限公司关于与AMBRX, Inc.
签署《合作开发和许可协议》的公告
本公司董事会及全体董事保证本公告内容不存在任何虚假记载、误导性陈述或者重大遗漏,并对其内容的真实性、准确性和完整性承担个别及连带责任。
特别提示:
1、本次协议所涉аHer2-ADC产品(以下称许可产品)是用于乳腺癌适应症的单克隆抗体药物偶联物候选药物,属于国际上近几年癌症治疗领域创新开发的技术和药物,在美国尚处于临床前试验阶段,在中国能否进一步合作开发成功,不仅存在技术上的风险,也存在按照我国有关法规、政策能否履行通过政府有关审批等的风险。
2、即使未来双方合作开发在国内取得成功获得上市许可,后续商业化推广能否取得预期效益,仍存在不确定性。
经六届十一次董事会审议通过,2013年6月14日公司(协议一方,为“甲方”)与AMBRX公司(协议另一方,为“乙方”)经友好协商,本着互惠互利的原则,正式签署《合作开发和许可协议》(以下简称“协议”)。
根据协议,甲乙双方将合作研发并商业化许可产品。
按上海证券交易所有关规定,现将协议有关情况公告如下:
一、协议审议情况
本协议已经公司六届十一次董事会审议通过,无需提交股东大会和政府相关部门审批。
二、合作方基本情况
乙方,AMBRX公司是一家位于美国圣地亚哥市临床阶段的生物技术公司,
其创始人之一是全球著名科学家彼得.舒尔兹(Peter G.Schultz)教授。
该公司在全球拥有700多项专利,在中国有30个专利申请。
其核心能力是在蛋白质药物研发上突破技术难关并持续创新,如蛋白质定点共轭技术。
该公司开发成功了非天然氨基酸定点插入蛋白质序列的革命性技术,并先后在大肠杆菌表达系统和CHO(中国仓鼠卵巢细胞)表达系统中取得了成功。
这项突破性的技术将对生物制药行业带来深远的影响。
由于在抗体蛋白上定点插入非天然氨基酸上带有独特的化学位点,使蛋白质定点共轭小分子药物十分容易,从而在安全的前提下使靶向治疗效果更加明显。
理论上可以使用该项技术对已知蛋白质药物重新修饰,生产出具有专利的、优化的新蛋白质药物。
为此,跨国制药巨头默克、礼来、施贵宝和Astellas等纷纷与该公司进行相关产品的技术合作。
应用该项技术生产的蛋白质药物,最快的长效生长激素已完成Ⅱ期临床。
三、关于许可产品аHer2-ADC产品情况
аHer2-ADC是指主要与Her2靶点结合的、偶联了肿瘤化疗药物的单克隆抗体药物结合物(英文简称为ADC药物)。
单克隆抗体是具有高度特异性的靶向药物,其对肿瘤细胞的靶向性非常高,故被誉为治疗恶性肿瘤的“生物导弹”。
传统ADC(抗体药物偶联物)技术就是在抗体蛋白的天然氨基酸上非定点偶联具有抗肿瘤作用的化疗药物(或称小分子药物),以增加单克隆抗体的疗效并降低小分子药物的毒性。
因此,传统ADC(抗体药物偶联物)是由疗效和毒性不等的偶联混合物组成。
目前,通过定点偶联来获得单一ADC 纯品已成为ADC领域新的研发方向。
Ambrx 的ADC是通过定点嵌入非天然氨基酸来实现在单克隆抗体上定点、定量接入抗肿瘤的小分子药物,以获得单一的ADC纯品。
这相当于在“生物导弹”上精确地装上了“核弹头”,使得治疗更加安全、有效、定向。
最近以来,默克、施贵宝和Astellas已与Ambrx建立合作关系,利用这一技术共同开发新一代ADC产品。
Her2是目前已经公认的治疗乳腺癌的作用靶点,靶点就是抗体作用于肿瘤细胞的位点,罗氏公司以此靶点开发的单抗药物赫赛汀(Herceptin)2011年销售额达56亿美元。
其通过传统技术开发的аHer2-ADC (Kadcyla)为一个混合物在美国已于2013 年批准上市。
本协议目标产品аHer2-ADC,是用新一代AMBRX
开发的定点ADC技术,在单克隆抗体特定位点上接上肿瘤化疗药物来获得单一的ADC纯品,抗体和化疗药物共同对肿瘤细胞起作用,ADC以期比传统的ADC 进一步增加药物的疗效。
简单的说,这是一个靶向Her2靶点的单克隆抗体药物的定点偶联物(аHer2-ADC),是新一代的ADC,也是AMBRX公司在开发ADC系列药物中进展最快的一个。
目前,该许可产品在美国尚处于临床前试验阶段,公司将在AMBRX 公司的支持下,立即开展该产品的临床前研究及向国家食品药品监督管理总局申报临床试验的准备工作。
四、协议主要条款
1、根据协议,本公司将获得中国区域内AMBRX公司关于许可产品现有专利的独占许可,可以研发、生产、销售该许可产品用于预防和治疗人类疾病。
2、双方同意委托无锡药明康德生物技术有限公司负责临床前、临床研究和生产工艺开发。
本公司将支付相关的研发费用,包括在国内获得产品批准文号前所需的所有费用,以及澳大利亚境内至一期临床完成所需的费用。
本公司董事会授权经营层与无锡药明康德生物技术有限公司签署《产品开发合作服务协议》,同时,按照项目进程逐步签订《子技术开发合同》,《子技术开发合同》为《产品开发合作服务协议》的附件。
公司根据《子技术开发合同》规定的价格和相关条款分阶段支付研发费用。
3、公司承诺建设一个完全符合国际GMP标准的生产工厂负责该许可产品全球的供应。
4、双方将成立联合指导委员会,联合指导委员会由六名成员组成,双方均可指派三名成员。
自协议生效日起三年委员会主席由AMBRX公司指派的成员之一担任,此后由浙江医药指派的成员担任。
联合指导委员会的主要职责为:(1)批准并向公司提供无锡药明康德生物技术有限公司为履行《产品开发合作服务协议》所拟定的研发工作计划。
(2)计划、监督并指导许可区域内许可产品的开发、商业化及有关合规性审批,并协调符合现行GMP要求的生产厂的建设活动。
5、许可产品在中国上市销售后,AMBRX公司将按净销售额不超过20%的比例提取权益金,作为许可费的支付。
支付许可费的截止期限为以下二者较晚的
期限届满时:
(1)涉及许可产品的现有专利到期之时;
(2)在中国首次商业销售后的20年。
6、如果AMBRX公司依据Ⅰ期临床数据在中国以外直接进行转让或许可;或者AMBRX公司依据Ⅰ期临床数据在中国以外继续独立开发许可产品并承担一切费用,则根据产品所处的不同阶段,AMBRX公司将按转让收入或产品净销售额不超过20%的比例向公司支付许可费。
五、对公司的影响
协议的签署,有助于公司进入生物制药的高端领域,有助于与AMBRX公司建立一套长期互利合作机制,并争取成为AMBRX公司后续研发产品的商业化基地。
许可产品аHer2-ADC是运用了革命性技术的新一代单抗偶联物,若最终该产品能成功上市,将对公司在生物制药领域的发展具有巨大的推动作用,其战略意义十分重大。
风险提示:
1、本次协议所涉аHer2-ADC产品(以下称许可产品)是用于乳腺癌适应症的单克隆抗体药物偶联物候选药物,属于国际上近几年癌症治疗领域创新开发的技术和药物,在美国尚处于临床前试验阶段,在中国能否进一步合作开发成功,不仅存在技术上的风险,也存在按照我国有关法规、政策能否履行通过政府有关审批等的风险。
2、即使未来双方合作开发在国内取得成功获得上市许可,后续商业化推广能否取得预期效益,仍存在不确定性。
公司将根据相关规定,及时披露项目重大进展情况,敬请广大投资者理性投资,注意投资风险。
特此公告!
浙江医药股份有限公司董事会
2013年6月14日。
