献给初学者:PCR常见问题分析
PCR常见问题、原因分析及其对策

镁离子浓度不当
总结词
镁离子是PCR反应的重要成分,对PCR的效率和产物质量有 重要影响。
详细描述
镁离子浓度过高可能导致非特异性扩增和产物稳定性下降; 镁离子浓度过低则可能影响DNA聚合酶的活性,导致PCR失 败或扩增效率低下。因此,需要根据实验条件和试剂盒推荐 ,选择合适的镁离子浓度。
03
pcr问题对策
详细描述
模板质量的好坏直接影响到pcr的扩增 效果,因此需要确保模板的纯度和浓 度,避免使用降解严重的模板,以提 高pcr的产量和特异性。
优化pcr循环参数
总结词
pcr循环参数的优化可以显著提高pcr的效率和特异性。
详细描述
通过调整变性、退火、延伸等温度和时间,可以优化pcr循环参数,提高pcr的效率和特异性。同时, 合理设置预变性时间和循环数,可以有效避免非特异性扩增和产物积累。
优化引物设计
总结词
引物设计是pcr反应的关键,优化引物设计可以显著提高pcr的特异性和效率。
详细描述
引物设计时需考虑特异性、长度、GC含量、引物二聚体和发夹结构等因素,通过合理设计引物,可以避免非特 异性扩增和引物二聚体形成,提高pcr的特异性。
提高模板质量
总结词
模板质量对pcr结果的影响不容忽视, 提高模板质量可以提高pcr的产量和特 异性。
模板质量差
总结词
模板质量的好坏直接影响到PCR的效率和产物质量。
详细描述
模板中可能含有抑制剂、DNA聚合酶抑制剂或DNA聚合酶竞争性抑制剂等物质, 这些物质会影响DNA聚合酶的活性,导致PCR失败或扩增效率低下。此外,模 板的浓度过低或过高也可能影响PCR结果。
pcr循环参数不当
总结词
PCR循环参数包括变性、退火、延伸等步骤,这些步骤 的温度和时间设置对PCR结果有重要影响。
PCR常见问题分析及对策

PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性)PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性)2009-03-28 11:38问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因: 1.引物特异性差 2.模板或引物浓度过高 3.酶量过多4.Mg2+浓度偏高5.退火温度偏低6.循环次数过多对策:1.重新设计引物或者使用巢式PCR 2.适当降低模板或引物浓度 3.适当减少酶量 4.降低镁离子浓度 5.适当提高退火温度或使用二阶段温度法 6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因: 1.模板不纯 2.Buffer不合适 3.退火温度偏低 4.酶量过多 5.dNTP、Mg 2+浓度偏高 6.循环次数过多对策: 1.纯化模板 2.更换Buffer 3.适当提高退火温度 4.适量用酶 5.适当降低dNTP和镁离子的浓度 6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策: 1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外; 2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR引物设计的黄金法则(转自tiangen) 1.引物最好在模板cDNA的保守区内设计。
DNA序列的保守区是通过物种间相似序列的比较确定的。
在NCBI 上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区 2.引物长度一般在15~30碱基之间。
PCR技术之——常见问题解析及处理方法

PCR技术之——常见问题解析及处理方法我们进行核酸扩增时,往往会不定的出现一些异常问题,本期我给大家搜集了一些平时经常性遇到的一些问题,希望对大家有所帮助。
(一)相对特异性 PCR产物的特异性主要取决于引物链的特异性。
由于存在同源序列,随意设计的引物链,其PCR产物在电泳分析时可能出现多条链,因此在设计引物链时应考虑其绝对特异性和相对特异性。
前者指两条引物链的核苷酸序列只与靶DNA片段互补,后者是指两条引物链的核苷酸序列及两者之间的DNA长度对靶DNA片段是特异的,但亦可与其他区域的DNA片段互补,而其PCR产物的长度与靶DNA片段的扩增产物的长度明显不同,应根据两引物问的DNA片段长度,预计PCR产物的大小,并与电泳分析的DNA片段大小比较.或用寡聚核苷酸限制性内切酶片段分析,或用分子杂交、核苷酸序列分析来测定。
(二)标本中存在的有形成分对反应的抑制这一点主要是针对来自临床标本中的杂质加细菌蛋白质和Taq DNA聚合酶抑制因子,须注意避免污染和去除标本中的杂质;将标本加热煮沸使抑制因子与DNA分离。
对于来自标本中的细胞和细胞器的崩解、核酸酶的激活均可使待检的DNA降解,降解的DNA是Taq DNA聚合酶作用良好底物,能与靶DNA竞争,从而扩增大量的非特异性DNA,这种非特异性DNA会使背景干扰超过了前景信号影响PCR循环扩增效率,减少特异性DNA扩增产量。
(三)Taq DNA聚合酶 Taq DNA聚合酶扩增的特异性受PCR循环次数及延伸时间与温度的影响循环次数太多使延伸时间延长和Taq DNA聚合酶单位用量增长可能导致非特异性扩增;循环次数太少,则不能得到充足的扩增产物,温度不适宜会影响扩增产物数量,延伸温度一般高于复性温度。
(四)复性温度与时间引物与变性DNA的复性温度对PCR 的特异性有影响,复性温度由引物的碱基成分决定。
在低温度(37℃)下复性可出现比扩增DNA长的非特异性扩增带;而在55~60℃复性的扩增带一般是特异的,复性时间过长或过短都会增加非特异性扩增。
PCR检测常见问题与解决途径

P C R检测常见问题与解决途径------------------------------------------作者xxxx------------------------------------------日期xxxxPCR检测常见问题与解决途径利用PCR方法检测转基因成分时,经常出现假阳性、假阴性、非特异性扩增和涂抹带。
尤其是假阳性和假阴性可使检测结果得出错误结论,有时可造成严重后果。
为了提高转基因检测的准确性和可靠性,PCR检测应尽量减少假阳性、假阴性、非特异性扩增和涂抹带现象的发生。
一个好的PCR方法不但要求特异性好、灵敏度高、还要求具有高的可重复性、重现性、鲁棒性,尽量减少假阳性、假阴性和非特异性扩增。
本文对PCR检测中出现的假阳性、假阴性、非特异性扩增和涂抹带的原因及其解决方法予以综述。
一、假阳性:(一)假阳性现象假阳性是指检测阴性材料得到阳性结果。
如果一次实验中的几个阴性对照中出现一个或几个阳性结果,提示本次实验中其它标本的检测结果可能有假阳性。
实验中设立的阴性对照可提示有无假阳性结果出现。
(二)造成假阳性的原因1. 样品间交叉污染:样本污染主要有收集样本的容器被污染,或样本放置时,由于密封不严溢于容器外,或容器外粘有样本而造成相互间交叉污染;样本核酸模板在提取过程中,由于吸样枪污染导致标本间污染;2. PCR试剂的污染:主要是由于在PCR试剂配制过程中,由于加样枪、容器、双蒸水及其它溶液被PCR核酸模板污染。
3. PCR扩增产物污染:这是PCR反应中最主要最常见的污染问题。
因为PCR产物拷贝量大(一般为1013拷贝/ml),远远高于PCR检测数个拷贝的极限,所以极微量的PCR产物污染,就可形成假阳性。
4. 气溶胶污染:在空气与液体面摩擦时就可形成气溶胶,在操作时比较剧烈地摇动反应管,开盖时、吸样时及污染进样枪的反复吸样都可形成气溶胶而污染。
据计算一个气溶胶颗粒可含48000拷贝,因而由其造成的污染是一个值得特别重视的问题。
PCR常见问题及对策

PCR常见问题及对策(一)没有得到扩增产物(1)酶失活或在反应体系中未加入酶。
Taq DNA聚合酶因保存或运输不当而失活,往往通过更换新酶或用另一来源的酶以获得满意的结果。
(2)模板含有杂质。
特别是对甲醛固定及石蜡包埋的组织常含甲酸,造成DNA脱嘌呤而影响PCR的结果。
(3)变性温度是否准确:PCR仪指示温度与实际温度是否相符,过高酶在前几个循环就迅速失活;过低则模板变性不彻底。
(4)反应系统中污染了蛋白酶及核酸酶,应在未加Taq酶以前,将反应体系95℃加热5-10分钟。
(5)引物变质失效。
人工合成的引物是否正确。
是否纯化,或因储存条件不当而失活。
(6)使用PCR试剂盒时还应注意:①是否严格按照说明书操作;②试剂使用前是否充分混匀;③试剂储存过久或不当而失效。
(二)扩增产物在凝胶中涂布或成片状(1)酶量过高。
减少酶量;酶的质量差,调换另一来源的酶。
(2)dNTP浓度过高。
减少dNTP的浓度。
(3)MgCl2浓度过高。
可适当降低其用量。
(4)循环次数过多;增加模板量减少循环次数,缩短退火时间及延伸时间,或改用二种温度的PCR循环。
(5)退火温度过低。
(6)电泳体系有问题:①凝胶中缓冲液和电泳缓冲液浓度相差太大;②凝胶没有凝固好;③琼脂糖质量差。
(7)若为PCR试剂盒则可能:①由于运输储存不当引起试剂盒失效;②试剂盒本身质量有问题,如引物选择、循环参数等选择不当。
(8)降解的陈旧模板扩增也易产生涂布。
(三)溴酚蓝前有区带(很宽)(1)模板量太低。
增加模板DNA的用量。
(2)循环次数太多。
减少循环次数。
(3)复性度偏低。
提高复性温度。
(4)预变性后没有立刻上机循环。
(5)引物3'端是否互补;重新设计合成较长的引物。
(6)引物用量偏多。
降低引物的使用量。
(四)扩增产物出现多条带(1)引物用量偏大,引物的特异性不高。
应调换引物或降低引物的使用量。
(2)循环的次数过多。
适当增加模板的量,减少循环次数。
PCR常见问题分析及解决策略

荧光定量PCR常见问题
溶解曲线不止一个主峰:
引物设计不佳:设计特异性引物; 引物浓度不适:降低引物浓度; 退火温度低:调整退火温度;
镁离子浓度过高:降低镁离子浓度;
模板中有基因组污染:注意提取过程; 耗材仪器不匹配; 反应体系污染等:设置阳性阴性对照。
荧光定量PCR常见问题
扩增效率低:
提高PCR特异性最重要的方法之一。
策略之四使用PCR增强剂
甲酰胺、DMSO、甘油、甜菜碱等 都可充当PCR的增强剂。 其可能的机理是降低熔解温度,从而 有助于引物退火并辅助DNA聚合酶延伸 通过二级结构区。 增强剂浓度要适当。
荧光定量PCR常见问题
荧光定量PCR扩增效率确认: 相关系数(R2):大于0.98 标准曲线斜率:-3~-3.5 PCR扩增效率(E):0.9~1.2 重复性好:STD <0.2 特异性好
PCR常见问题、 原因分析及其对策
PCR技术简介 PCR常见问题、原因分析及其解决方案
提高PCR反应特异性的策略 定量PCR常见问题 临床PCR检测的常见问题
PCR标准反应体系
• DNA模板
• 引物
• 反应缓冲液 • Mg 2+浓度 • dNTPs • dH2O • 耐热聚合酶
反应体系对PCR扩增的影响
PCR常见问题之四-----假阳性
现象:空白对照出现目的扩增产物
原 因
靶序列或扩增产物的交叉污染
对 策
• • 操作时应小心轻柔,防止将靶序列吸入加样枪 内或溅出离心管外; 除酶及不能耐高温的物质外,所有试剂或器材 均应高压消毒。所用离心管及加样枪头等均应 一次性使用。 各种试剂最好先进行分装,然后低温贮存。
现象:正对照有条带,而样品则无
PCR常见问题分析

经DEPC处理好的东西如EP管,应先在70-80度烤干后,再高压剪刀玻璃制品可以用DEPC处理后
180-200度干烤2小时。
假阴性,不出现扩增条带?
参考见解:PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,
④PCR循环条件。寻找原因亦应针对上述环节进行分析研究。! g& ]. O. N9 j" W$ x
以破坏存在的核酸。二是空气中的小片段核酸污染,这些小片段比靶序列短,但有一定的同源 性。可互相拼接,与引物互补后,可扩增出PCR产物,而导致假阳性的产生,可用巢式PCR方法 来减轻或消除。 出现非特异性扩增带? PCR扩增后出现的条带与预计的大小不一致,或大或小,或者同时出现 特异性扩增带与非特异性扩增带? 参考见解:非特异性条带的出现,其原因:一是引物与靶序列不完全互补、或引物聚合形成二 聚体。二是Mg2+离子浓度过高、退火温度过低,及PCR循环次数 过多有关。其次是酶的质和 量,往往一些来源的酶易出现非特异条带而另一来源的酶 则不出现,酶量过多有时也会出现非 特异性扩增。其对策有:①必要时重新设计引物。②减低酶量或调换另一来源的酶。③降低引 物量,适当增加模板量,减少循环次 数。④适当提高退火温度或采用二温度点法(93℃变性, 65℃左右退火与延伸)。 PCR扩增有时出现涂抹带或片状带或地毯样带? 参考见解:其原因往往由于酶量过多或酶的质量差,dNTP浓度过高,Mg2+浓度过高,退火温度 过低,循环次数过多引起。其对策有:①减少酶量,或调换另一来源的酶。②减少dNTP的浓 度。③适当降低Mg2+浓 度。④增加模板量,减少循环次数。 克隆PCR产物的最优条件是什么?% X$ _" F0 f7 Y! Z% O 参考见解:最佳插入片段:载体比需实验确定。1:1(插入片段:载体)常为最佳比,摩尔数 比1:8或8:1也行。应测定比值范围。连接用5ul 2X连接液, 50ng质粒DNA,1Weiss单位的T4连 接酶,插入片段共10ul。室温保温1小时,或4℃过夜。在这2种温度下,缺T-凸出端的载体会自 连,产生蓝斑。室温保温1小时能满足大多数克隆要求,为提高连接效率,需4℃过夜。 PCR产物是否需要用凝胶纯化?& R; i% g' x j% W: y1 d) N3 u 参考见解:如凝胶分析扩增产物只有一条带,不需要用凝胶纯化。如可见其他杂带,可能是积 累了大量引物的二聚体。少量的引物二聚体的摩尔数也很高,这会产生高比例的带有引物二聚 体的克隆,而非目的插入片段。为此需在克隆前做凝胶纯化。 如果没有回收到目的片段,还需要作什么对照实验? 参考见解:$ b9 K5 N- z5 j z- O% t( F" K 1 涂布未转化的感受态细胞。如有菌落,表明氨苄失效,或污染上带有氨苄抗型的质粒,或产 生氨苄抗型的菌落。5 L4 x7 V2 z9 C7 A% `* R5 b: G 2转化完整质粒,计算菌落生长数,测定转化效率。例如,将1ug/ul质粒1:100稀释,1ul用于 100ul感受态细胞转化。用SOC稀释到1000ul后,用100ul铺板。培养过夜,产生1000个菌落。转 化率为:产生菌落的总数/铺板DNA的总量。铺板DNA的总量是转化反应所用的量除以稀释倍数。 具体而言转化用10ng DNA,用SOC稀释到1000u后含10 ng DNA,用1/10铺板,共用1 ng DNA。转
PCR常见问题分析

PCR常见问题分析假阳性现象:阴性样品出现的PCR扩增条带与目的靶序列条带一致常见问题可能原因建议解决方案PCR污染靶序列或扩增产物的交叉污染操作时应小心轻柔,防止将含靶序列的样品吸入加样枪内或溅出离心管外;试剂或器材应高压灭菌,破坏存在的核酸试剂污染各种试剂先进行分装,并低温贮存引物引物设计不合适,选择的扩增序列与非目的扩增序列有同源性重新设计引物出现非特异性扩增现象:PCR扩增后出现的条带与预计的大小不一致,或大或小,或者有时同时出现特异性扩增带与非特异性扩增。
常见问题可能原因建议解决方案引物引物特异性差重新设计引物引物浓度过高适当减少引物浓度Mg2+浓度Mg2+浓度过高适当降低Mg2+浓度,从1 mM到3 mM,间隔0.5 mM进行一系列反应,确定最佳的镁离子浓度耐热聚合酶酶量过多以0.5U为间隔适当减少酶量退火温度退火温度过低适当提高退火温度或采用二阶段温度法PCR循环次数PCR循环次数过多减少PCR循环次数扩增无带常见问题可能原因建议解决方案引物引物设计不合适或降解重新设计引物模板模板降解重新制备模板Mg2+浓度Mg2+浓度过低适当降低Mg2+浓度,从1 mM到3 mM,间隔0.5 mM进行一系列反应,确定最佳的镁离子浓度退火温度退火温度过高适当降低退火温度延伸时间延伸时间短增加延伸时间出现片状拖带或涂抹带常见问题可能原因建议解决方案引物特异性差重新设计引物,改变引物的位置和长度,增强其特异性模板DNA 模板不纯纯化模板或使用试剂盒提取DNA耐热聚合酶酶量过多以0.5U为间隔适当减少酶量Mg2+浓度Mg2+浓度过高适当降低Mg2+浓度,从1mM到3mM,间隔0.5mM进行一系列反应,确定最佳的Mg2+浓度dNTPs dNTPs浓度过高适当降低dNTPs浓度退火温度退火温度过低适当提高退火温度。
PCR常见问题及解决方法

PCR常见问题及解决方法PCR常见问题及解决方法1)、不出现扩增条带a)、引物设计有误:核对引物设计方案。
b)、扩增体系配制错误:重复实验。
c)、扩增反应条件不优化:调整Mg2+浓度、酶量、扩增程序。
d)、模板质粒质量偏差:长期放置、反复冻融会导致模板质粒断裂、开环或降解,应使用新鲜制备的质粒作为模板。
e)、模板的GC含量:GC含量过高会导致DNA的双链无法完全打开,此时加入Vazyme(诺唯赞生物)的PCR Enhancer(货号P021)可以有效降低解链温度;GC 含量过低会导致扩增效率较差,可适当延长引物长度或通过TD PCR摸索合适的反应条件。
2)、出现非特异性扩增带a)、引物设计不够优化:引物与靶序列有非特异性互补或自身聚合成二聚体,可降低引物浓度进行优化,必要时重新设计引物。
b)、模板不纯:模板被污染,需重新制备模板。
c)、试验条件不够优化:如果出现比目的条带小的杂带,可通过提高退火温度、降低循环数调整;如果出现比目的条带大的杂带,可缩短延伸时间、降低循环数;另外,可降低Mg2+及酶的浓度。
3)、条带弥散或拖尾a)、模板降解或过量:可通过电泳检查模板完整性及浓度,必要时重新纯化模板,对于简单模板(例如质粒、λDNA),每50ul反应使用1pg-10ng DNA;对于复杂模板(例如基因组、cDNA),每50ul反应使用1ng-1ug DNA。
b)、酶量加太多:如Vazyme(诺唯赞生物)的高保真系列:50ul反应体系加1U,Taq系列:50ul体系加2U。
4)、条带很暗a)、增加模板量,提高循环数。
b)、多扩几管,胶回收浓缩。
5)、产物有错配a)、检查原始模板是否原本就是突变或错配的。
b)、少量序列存在非严谨序列,有相似重组序列,导致重组错位。
PCR实验中常见问题解决方法

QuikStrip 已变干。
加入 40 μL 水,在装载前轻轻上下移液以混合均匀。
3.电泳凝胶上看不到条带、对照 DNA 和PCR 产物
凝胶未正确制备。
确保正确稀释电泳缓冲液。
融化琼脂糖时需要特别注意较高浓度 (>0.8%) 的凝胶。在倒入凝胶之前,确保溶液 没有“团块 ”和玻璃状颗粒,也可以直接使用配置好的预制胶。省时省力。
凝胶未正确染色。
染色时注意浓度,实在不行就重新染色。
电泳装置或电源出现故障。
请联系电泳仪或电泳设备供应商,帮忙排除故障
4.凝胶染色后,DNA 条带模糊。
凝胶没有染色足够长的时间。
严格按照染色流程说明进行实验操作。
5.染色后,条带可见,但不存在 PCR 产物。
PCR扩增不成功。
注意引物设计是否合理,DNA聚合酶的加入量是否适宜。
PCR实验中常见问题解决方法
PCR实验中常见问题及解决方案
PCR实验中常见问题汇总
问题,管中的液体较少。
样品挥发,损失
确保加热的盖子达到适当的温度。
吸取样本后,尽快盖上PCR 管的盖子。防止挥发。
移液不准确
确保吸取 20 µL 引物混合物和 5 µl Lambda DNA 模板到 PCR 管中。样本量少时需要采用高精度移液器。
确保PCR的正确操作,温度设计是否合理。
6.染色后,凝胶上可见条带和对照 PCR 产物,其中一部分样品不存在。
PCR 反应中添加了错误体积的 DNA 和引物。
熟练使用移液器进行精准移液定量,确保移液的准确度
PCR常见问题总结

PCR常见问题汇总1. 无扩增条带(1)酶失活或在反应体系中未加入酶。
Taq DNA聚合酶因保存或运输不当而失活,往往通过更换新酶或用另一来源的酶以获得满意的结果。
(2)模板含有杂质。
特别是对甲醛固定及石蜡包埋的组织常含甲酸,造成DNA脱嘌呤而影响PCR的结果。
(3)变性温度是否准确:PCR仪指示温度与实际温度是否相符,过高酶在前几个循环就迅速失活;过低则模板变性不彻底。
(4)反应系统中污染了蛋白酶及核酸酶,应在未加Taq酶以前,将反应体系95℃加热5-10分钟。
(5)引物变质失效。
人工合成的引物是否正确。
是否纯化,或因储存条件不当而失活。
(6)引物错误。
利用BLAST检查引物特异性或重新设计引物。
(7)DNA凝胶电泳时加入阳性对照,确保不是DNA凝胶和PCR程序的问题。
2. PCR产物量过少(1)退火温度不合适。
以2度为梯度设计梯度PCR反应优化退火温度。
(2) DNA模板量太少。
增加DNA模板量。
(3) PCR循环数不足。
增加反应循环数。
(4)引物量不足。
增加体系中引物含量。
(5)延伸时间太短。
以1kb/分钟的原则设置延伸时间。
(6)变性时间过长。
变性时间过长会导致DNA聚合酶失活。
(7) DNA模板中存在抑制剂。
确保DNA模板干净a3. 扩增产物在凝胶中涂布或成片状条带弥散(1)酶量过高。
减少酶量;酶的质量差,调换另一来源的酶。
(2)dNTP浓度过高。
减少dNTP的浓度。
(3)MgCl2浓度过高。
可适当降低其用量。
(4)模板量过多。
质粒DNA的用量应<50ng,而基因组DNA则应<200ng。
(5)引物浓度不够优化。
对引物进行梯度稀释重复PCR反应。
(6)循环次数过多;增加模板量减少循环次数至30,缩短退火时间及延伸时间,或改用二种温度的PCR循环。
(7)退火温度过低。
(8)电泳体系有问题:①凝胶中缓冲液和电泳缓冲液浓度相差太大;②凝胶没有凝固好;③琼脂糖质量差。
(9)若为PCR试剂盒则可能:①由于运输储存不当引起试剂盒失效;②试剂盒本身质量有问题,如引物选择、循环参数等选择不当。
PCR常见问题

PCR常见问题及回答RT-PCR1. cDNA产量的很低可能的原因:*RNA模板质量低*对mRNA浓度估计过高*反应体系中存在反转录酶抑制剂或反转录酶量不足*同位素磷32过期*反应体积过大,不应超过50μl2. 扩增产物在电泳分析时没有条带或条带很浅*最常见的原因在于您的反应体系是PCR的反应体系而不是RT-PCR的反应体系*与反应起始时RNA的总量及纯度有关*建议在试验中加入对照RNA*第一链的反应产物在进行PCR扩增时,在总的反应体系中的含量不要超过1/10*建议用Oligo(dT)或随机引物代替基因特异性引物(GSP)用于第一链合成。
由于RNA模板存在二级结构,如环状结果,有可能导致GSP无法与模板退火;或SSⅡ反转录酶无法从此引物进行有效延伸。
*目的mRNA中含有强的转录中止位点,可以试用以下方法解决:a. 将第一链的反应温度提高至50℃。
b. 使用随机六聚体代替Oligo(dT)进行第一链反应。
3. 产生非特异性条带*用RT阴性对照检测是否被基因组DNA污染。
如果RT阴性对照的PCR结果也显示同样条带,则需要用DNase I重新处理样品。
*在PCR反应中,非特异的起始扩增将导致产生非特异性结果。
在低于引物Tm 2至5℃的温度下进行退火,降低镁离子或是目的DNA的量将减少非特异性结果的产生。
*由于mRNA剪切方式的不同,根据选择引物的不同将导致产生不同的RT-PCR结果。
4. 产生弥散(smear)条带*在PCR反应体系中第一链产物的含量过高*减少引物的用量*优化PCR反应条件/减少PCR的循环次数*在用DNase处理被DNA污染的RNA样品时,其产生的寡核苷酸片段会产生非特异性扩增,一般会显示为弥散背景。
5. 产生大分子量的弥散条带*大多数情况下是由于退火温度过低而导致的非特异性的起始及延伸产生的*对于长片段的PCR,建议将反应体系中cDNA的浓度稀释至1:10(或1:100-1:200)6. 在无反转录酶的情况下,对照RNA获得扩增结果*通常是由于对照RNA中含有痕量DNA而导致的。
PCR常见问题分析(无、非特异、拖尾)

问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低6.循环次数过多对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存。
PCR常见问题、原因分析及其对策

化学修饰
•
•
Roche : FastStart Taq Abgene: Thermo-start® DNA Polymerase Stratagene: SureStart™ Taq
•大大提高PCR
反应的特异性
抗体抑制
Invitrogen: AccuPrimeTM Taq Platinum® Taq • TaKaRa: ExTaqTM HotStart Version
PCR试剂盒 复杂模板扩增、大规模基因检测
特异性
- 热启动 Taq酶
原 理
• 蜡封 • 抗体抑制 • 化学修饰
特 点
用 途
• 避免非特异性扩增 • 提高PCR反应的 特异性 • 基因组扩增
• RT-PCR
特异性
产 品 类 型
- 热启动 Taq酶
产品名称
• 天为时代: HotStart Taq
•
产品性能
策略之四
• 使用PCR增强剂
甲酰胺,DMSO,甘油,甜菜碱等都可充当PCR的增强剂。 其可能的机理是降低熔解温度,从而有助于引物退火并辅 助DNA聚合酶延伸通过二级结构区。
增强剂浓度要适当
北京天为时代科技有限公司
http//
免费咨询:800-810-2177
PCR常见问题之三
• 拖尾
现象:产物在凝胶上呈Smear状态。
M 1 2
PCR常见问题之三
• 拖尾
原 因
1.
2. 3. 4. 5. 6.
模板不纯 Buffer不合适 退火温度偏低 酶量过多 dNTP、Mg2+浓度偏高 循环次数过多
1.
2.
对 策
3. 4. 5.
PCR常见问题分析
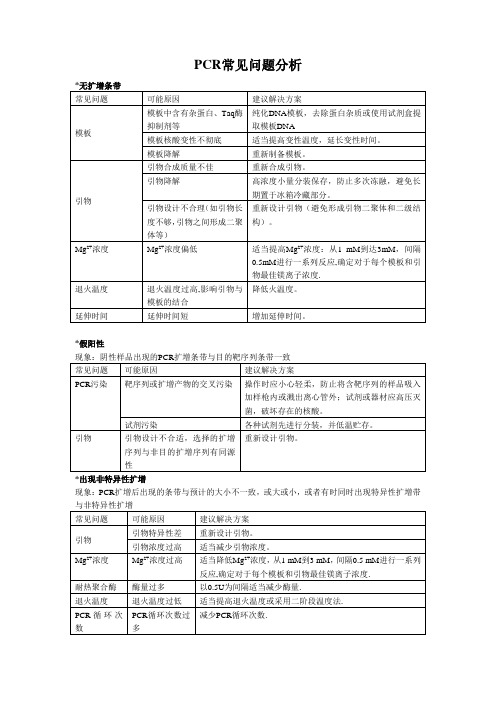
PCR常见问题分析
*假阳性
*出现非特异性扩增
现象:PCR扩增后出现的条带与预计的大小不一致,或大或小,或者有时同时出现特异性扩增带
*如何进行长片段的扩增?
首先需选择正确的耐热聚合酶。
Long Taq DNA Polymerase是具有3′-5′外切核酸酶活性的耐热DNA聚合酶,扩增效率高并且错配率低,对简单模板可扩增长达1 kb的片段,对复杂二级结构(GC rich等)和具有重复序列的模板可良好扩增长达15 kb的片段。
此外,较长产物的扩增还需要相应调整引物设计、延伸时间、变性时间和缓冲液pH等。
引物使用标准方法设计,通常18~24mers会得到较好的产量。
按1kb/分钟的速率增加延伸时间使DNA聚合酶完成聚合反应。
为了保证有效的长片段扩增,可以将延伸温度设置为68℃左右。
同时为防止模板损伤,在每个循环将94℃变性时间减少到30秒或更短,扩增前升温至94℃的时间应低于1分钟。
*如何提高PCR扩增的保真性?
下游应用为基因筛选、测序、突变检测和分子诊断的用户,对PCR保真性要求很高。
降低PCR扩增的错误率可以通过使用各种具有高保真性的DNA聚合酶来实现。
DNA聚合酶的保真度用错误率来表示,包括碱基错配率、PCR产物突变百分数等。
在目前已发现的所有耐高温DNA聚合酶中,Pfu酶的出错率最低,保真度最高(见附表)。
除对酶进行选择,研究者也可通过优化反应条件来进一步减少PCR突变率,包括优化缓冲液组成、耐热聚合酶的浓度及对PCR循环条件进行优化等。
*应用/acl分析,通过对/acl目标基因进行扩增和克隆,检测PCR产物突变百分数,从而测定DNA 聚合酶的错误率。
PCR常见问题分析及对策

PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性) 问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。
PCR 常见问题分析

PCR常见问题总汇PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
假阴性,不出现扩增条带PCR反应的关键环节有:①模板核酸的制备;②引物的质量与特异性;③酶的质量及浓度;④PCR循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多或吸入酚。
⑤模板核酸变性不彻底。
在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了毛病,因而要配制有效而稳定的消化处理液,其程序亦应固定不宜随意更改。
酶失活:需更换新酶,或新旧两种酶同时使用,以分析是否因酶的活性丧失或不够而导致假阴性。
需注意的是有时忘加Taq酶或溴乙锭。
引物:引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因。
有些批号的引物合成质量有问题,两条引物一条浓度高,一条浓度低,造成低效率的不对称扩增,对策为:①选定一个好的引物合成单位。
②引物的浓度不仅要看OD值,更要注重引物原液做琼脂糖凝胶电泳,一定要有引物条带出现,而且两引物带的亮度应大体一致,如一条引物有条带,一条引物无条带,此时做PCR有可能失败,应和引物合成单位协商解决。
如一条引物亮度高,一条亮度低,在稀释引物时要平衡其浓度。
③引物应高浓度小量分装保存,防止多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。
④引物设计不合理,如引物长度不够,引物之间形成二聚体等。
Mg2+浓度:Mg2+离子浓度对PCR扩增效率影响很大,浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带。
反应体积的改变:通常进行PCR扩增采用的体积为20ul、30ul、50ul。
或100ul,应用多大体积进行PCR扩增,是根据科研和临床检测不同目的而设定,在做小体积如20ul后,再做大体积时,一定要模索条件,否则容易失败。
pcr常见问题分析与对策

PCR引物设计的11条黄金法则1.引物最好在模板cDNA的保守区内设计。
DNA序列的保守区是通过物种间相似序列的比较确定的。
在NCBI上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区。
2.引物长度一般在15~30碱基之间。
引物长度(primer length)常用的是18-27 bp,但不应大于38,因为过长会导致其延伸温度大于74℃,不适于Taq DNA 聚合酶进行反应。
3.引物GC含量在40%~60%之间,Tm值最好接近72℃。
GC含量(composition)过高或过低都不利于引发反应。
上下游引物的GC含量不能相差太大。
另外,上下游引物的Tm值(melting temperature)是寡核苷酸的解链温度,即在一定盐浓度条件下,50%寡核苷酸双链解链的温度。
有效启动温度,一般高于Tm值5~10℃。
若按公式Tm= 4(G+C)+2(A+T)估计引物的Tm值,则有效引物的Tm为55~80℃,其Tm值最好接近72℃以使复性条件最佳。
4.引物3′端要避开密码子的第3位。
如扩增编码区域,引物3′端不要终止于密码子的第3位,因密码子的第3位易发生简并,会影响扩增的特异性与效率。
5.引物3′端不能选择A,最好选择T。
引物3′端错配时,不同碱基引发效率存在着很大的差异,当末位的碱基为A时,即使在错配的情况下,也能有引发链的合成,而当末位链为T时,错配的引发效率大大降低,G、C 错配的引发效率介于A、T之间,所以3′端最好选择T。
6. 碱基要随机分布。
引物序列在模板内应当没有相似性较高,尤其是3’端相似性较高的序列,否则容易导致错误引发(False priming)。
降低引物与模板相似性的一种方法是,引物中四种碱基的分布最好是随机的,不要有聚嘌呤或聚嘧啶的存在。
尤其3′端不应超过3个连续的G或C,因这样会使引物在GC富集序列区错误引发。
PCR新手常见5大问题

PCR新手常见5大问题PCR新手经常会遇到各式问题,本文做以简述。
在参考下述5大问题之前,请先确认使用的所有试剂都是正确的,尤其是换了某种新的试剂时更许注意,一句话首先避免低级错误!1、PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,24h可置-4度;再长请放-20;电泳时莫忘记加EB。
2、假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量,④PCR循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。
⑤模板核酸变性不彻底。
在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了毛病,因而要配制有效而稳定的消化处理液,其程序亦应固定不宜随意更改。
模板是最先需要考虑的因素,尤其是使用复杂模板如cDNA和基因组DNA时,尤需注意DNA的质量;同时使用的模板数量也是一个需要调整的重要参数。
酶失活:需更换新酶,或新旧两种酶同时使用,以分析是否因酶的活性丧失或不够而导致假阴性。
需注意的是有时忘加Taq酶或溴乙锭。
引物:引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因。
有些批号的引物合成质量有问题,两条引物一条浓度高,一条浓度低,造成低效率的不对称扩增,对策为:①选定一个好的引物合成单位。
②引物的浓度不仅要看OD 值,更要注重引物原液做琼脂糖凝胶电泳,一定要有引物条带出现,而且两引物带的亮度应大体一致,如一条引物有条带,一条引物无条带,此时做PCR有可能失败,应和引物合成单位协商解决。
如一条引物亮度高,一条亮度低,在稀释引物时要平衡其浓度。
③引物应高浓度小量分装保存,防止多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。
④引物设计不合理,如引物长度不够,引物之间形成二聚体等。
PCR实验室常见问题及经验分享

PCR实验室常见问题及经验分享一、没有ct值二、ct值过晚三、阴性对照扩增有信号四、标准曲线不佳五、熔解曲线峰不特异六、扩增曲线异常七、扩增效率低聚合酶链式反应(PCR)是一种用于放大扩增特定的DNA片段的分子生物学技术,它可看作是生物体外的特殊DNA复制,PCR的最大特点是能将微量的DNA大幅增加。
一、没有ct值检测结果遇到没有Ct值情况,排查是否有以下问题:1、循环数不够(一般不超过45循环,不仅背景值提高,定量也不准);2、PCR程序设置错误,检测荧光信号的步骤有误。
一般SG法采用72℃延伸时采集,TaqMan法则一般在退火结束时或延伸时采集信号,另外荧光采集是否选中;3、引物或探针降解。
可通过PAGE电泳检测引物和探针是否降解;4、模板量可能降解或上样量不足(不超过500ng,根据试剂盒说明书即可),对未知浓度的样本应从系列稀释样本的最高浓度做起;如果发生模板降解,应考虑样本准备中杂质的引入及反复冻融的情况,建议将模板样本小量分装储备,避免反复冻融;5、引物探针是否合适(尤其是引物跨越内含子,以确保扩增基因组DNA;上下游引物Tm值超过4℃以上也会影响扩增)。
二、ct值过晚在相对定量中,Ct值一般控制在15—25之间比较好,如果在绝对定量中,对低拷贝数的样品,Ct值会增大,但是一般不宜超过40循环,否则定量不准确。
因此,判断Ct值出现过晚是否属于非正常情况,需要根据具体实验设计和目的进行。
1、扩增效率低。
引物之间或者引物和探针的比例不合适,需要进行优化;引物或探针设计不合理,需要重新设计;2、PCR程序不合适,改用三步法进行反应,或者优化退火/延伸温度,可以适当降低退火温度;退火/延伸时间短(可以在推荐的时间条件下延长10s);3、MgCl2浓度不合适,增加镁离子浓度等。
PCR各种反应成分的降解或加样量的不足;4、PCR产物太长。
PCR产物设计超过500bp;5、模板存在抑制物。
用高纯度模板进行PCR检测或将模板进行稀释。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
献给初学者:PCR常见问题分析
变性温度是否准确:PCR仪指示温度与实际温度是否相符,过高酶在前几个循环就迅速失活;过低则模板变性不彻底。
1没有扩展条带
可能的原因及对应的解决方案如下:
酶失活或在反应体系中未加入酶。
Taq DNA聚合酶因保存或运输不当而失活,往往通过更换新酶或用另一来源的酶以获得满意的结果。
模板含有杂质。
特别是对甲醛固定及石蜡包埋的组织常含甲酸,造成DNA脱嘌呤而影响PCR的结果。
变性温度是否准确:PCR仪指示温度与实际温度是否相符,过高酶在前几个循环就迅速失活;过低则模板变性不彻底。
反应系统中污染了蛋白酶及核酸酶,应在未加Taq酶以前,将反应体系95℃加热5~10分钟。
引物变质失效。
人工合成的引物是否正确。
是否纯化,或因储存条件不当而失活。
引物错误。
利用BLAST检查引物特异性或重新设计引物。
DNA凝胶电泳时加入阳性对照,确保不是DNA凝胶和PCR程序的问题。
2PCR产物量过少
可能的原因和对应的解决方案如下:
退火温度不合适。
以2度为梯度设计梯度PCR反应优化退火温度。
DNA模板量太少。
增加DNA模板量。
PCR循环数不足。
增加反应循环数。
引物量不足。
增加体系中引物含量。
延伸时间太短。
以1 kb/分钟的原则设置延伸时间。
变性时间过长。
变性时间过长会导致DNA聚合酶失活。
DNA模板中存在抑制剂。
确保DNA模板干净
3扩增产物跑电泳条带弥散
可能的原因和对应的解决方案如下:
酶量过高。
减少酶量;酶的质量差,调换另一来源的酶。
dNTP浓度过高。
减少dNTP的浓度。
MgCl?浓度过高。
可适当降低其用量。
模板量过多。
质粒DNA的用量应&lt;50 ng,而基因组DNA则应&lt;200 ng。
引物浓度不够优化。
对引物进行梯度稀释重复PCR反应。
循环次数过多;增加模板量减少循环次数至30,缩短退火时间及延伸时间,或改用二种温度的PCR循环。
退火温度过低。
电泳体系有问题:
①凝胶中缓冲液和电泳缓冲液浓度相差太大;
②凝胶没有凝固好;
③琼脂糖质量差。
若为PCR试剂盒则可能:
①由于运输储存不当引起试剂盒失效;
②试剂盒本身质量有问题,如引物选择、循环参数等选择不当。
降解的陈旧模板扩增也易产生涂布。
4扩展产物出现杂带
可能的原因和对应的解决方案如下:
引物用量偏大,引物的特异性不高。
应调换引物或降低引物的使用量。
循环的次数过多。
适当增加模板的量,减少循环次数。
酶的用量偏高或酶的质量不好,应降低酶量或调换另一来源的酶。
退火温度偏低,退火及延伸时间偏长。
应提高退火温度,减少变性与延伸时间,也可采用二种温度的PCR扩增。
以2度为梯度设计梯度PCR反应优化退火温度。
样品处理不当。
Mg2+浓度偏高,因适当调整Mg2+使用浓度。
若为PCR试剂盒,也可能时试剂盒本身质量有问题。
复制提前终止。
使用非热启动的聚合酶时常有发生。
冰上准备反应体系或采用热启动聚合酶。
反应缓冲液未完全融化或未充分混匀。
确保反应缓冲液融化完全并彻底混匀。
