《临床研究设计》PPT课件
合集下载
临床医学科研设计PPT课件

3. 根据研究目的选择适当的受试对象
纳入对象及标准、排除临对床象医学及科标研方准法(13) 4. 设计合理的对照 5. 抽样与分组尽可能采用随机化 6. 盲法的应用
单盲:研究对象(病人) 双盲:研究对象和研究执行者(病人和医生) 三盲:研究对象、研究执行者和资料不分知道析研者究对
(病人、医生和研究者) 象是处理组还
评价指标
指运用科学的方法制定标临准床医,学科用研这方法些(17) 标准去评价各种临床科研活动,就是鉴定 课题实施后所获得的结果、结论、观点等。
是否反映客观实际而具有真实性? 是否能得以重复而具有可靠性? 是否可在临床推广而具有适应性?
拟 解 决 关 键
评价内容:
临床医学科研方法(29)
1. 临床意义的评价对疾病的病因、诊断、
临床医学科研方法(4)
☆研究对象的复杂性 ☆涉及到医德和伦理学问题 ☆建立实验动物模型的必要性 ☆内容广泛,涉及学科众多
临床医学科研主临床要医学内科研容方法(5) ( DME )
★设计(design) ★测量(measurement) ★评价(evaluation)
临床科研设计原则
(四原则)
1. 对照原则:
的各种问题与现象,就是观察指标的选择。 1. 指标选择要求 ▣目的性 ▣客观性 ▣准确性 ▣可测量性
临床指标 临床医学科研方法(16) 硬指标:死亡、病残、存活、痊愈 软指标:减轻、好转、恶化
生理学指标:生理、生化指标如血糖、
心功能
生活质量指标:健康问卷、测试生活质量 卫生经济学指标:费用测算指标、综合 益
2.选择最恰当的设计方案:
◆病因分析:随机对照试验(RCT)、队列研究 ◆诊断试验:随机对照试验 ◆治疗评价:随机对照试验、序贯试验 ◆疾病预后研究:队列研究、随机对照试验 ◆罕见病介绍:病例报告、病例分析
临床医学技术培训PPT临床研究与临床试验设计

将受试对象随机分配到试验组和对照组, 适用于两组间比较。
将受试对象按一定条件配成对子,再随机 分配到试验组和对照组,适用于两组间比 较且要求严格控制非处理因素的影响。
析因设计
序贯设计
研究多个处理因素对结果的影响及因素间 的交互作用。
根据已积累的结果调整后续试验方案,适 用于需要动态调整的情况。
试验设计的优化与改进
临床医学技术培训PPT 临床研究与临床试验设 计
: 2023-12-30
目 录
• 临床研究概述 • 临床试验设计基础 • 临床研究中的数据收集与分析 • 临床试验中的伦理与法规问题 • 临床研究与试验设计的挑战与对策 • 案例分析与讨论
临床研究概述
01
定义与目的
定义
临床研究是以人体为研究对象, 通过科学的方法和手段,探讨疾 病的病因、诊断、治疗、预防及 康复等方面的研究。
受试者选择
根据新药适应症和入选标 准,选择符合条件的受试 者进行试验。
试验过程
包括基线评估、给药、随 访和终点评估等环节,确 保试验数据的准确性和完 整性。
案例二:某医疗器械临床研究实践分享
01
研究目的
评估医疗器械的安全性和有效性 ,为医疗器械注册提供科学依据
。
03
受试者选择
根据医疗器械的适应症和入选标 准,选择符合条件的受试者进行
团队成员构成
包括临床研究医师、护士、统计师、药师等多学科专业人员,确保团 队的专业性和综合性。
团队培训与管理
定期开展临床研究相关培训,提高团队成员的专业素养和研究能力; 建立完善的管理制度,确保团队的高效运转和项目的顺利实施。
团队成果展示
积极展示团队在临床研究方面取得的成果和经验,促进学术交流与合 作。
临床科研设计基础知识ppt课件

临床科研设计 ——基础知识
水舞青风 2016年12月
•完整最新ppt
•1
设计一个临床研究,就是以临床研究数据为主线讲述一个破绽尽 可能小的“故事”,来证明被提出的研究选题!
•完整最新ppt
•2
什么是临床研究?
•
临床研究是以人为研究对象,尤其是以患者为研究对象,其最基本的出发点在于阐明
疾病的病因、诊断、治疗、预防、自然病程及其预后等方面的重要问题,从而认识疾病的本
研究对象研究因素效应指标研究对象a研究对象b非研究因素临床研究的基本原则均衡随机研究对象研究因素效应指标研究对象a研究对象b随机对照试验研究对象分组依据队列研究处理因素随访观察结局事件不发生结局事件发生结局事件不发生平行组对照示意图结局结局试验组对照组样本目标人群结局机对照临床试验的基本原理时间方向洗脱期试验组试验组对照组对照组交叉对照示意图未发生结局未发生结局nowfuture发生结局列研究原理示意图研究对象研究因素效应指标研究对象a研究对象b研究对象分组依据病例对照研究诊断试验调查方向
•完整最新ppt
•8
科学性原则
•针对选题有合适的方法进 行科学的研究设计,尽量 能体现科学性原则。
•科研假设有一定的理论或实践依据。
•完整最新ppt
•9
可行性原则
• 有能力和有条件开展研究,工作量适中。 • 对于研究生来讲,一方面是否有足够的资源驾驭这样的研究,另一 方面研究生学位论文的工作量需要达到一定规模。
•干预措施 的结局
•25
例3:霉酚酸酯治疗重型肝炎的临床研究
•完整最新ppt
•26
预后研究选题的基本要素
研究因素
研究对象
效应指标
可疑的影响 预后的因素
水舞青风 2016年12月
•完整最新ppt
•1
设计一个临床研究,就是以临床研究数据为主线讲述一个破绽尽 可能小的“故事”,来证明被提出的研究选题!
•完整最新ppt
•2
什么是临床研究?
•
临床研究是以人为研究对象,尤其是以患者为研究对象,其最基本的出发点在于阐明
疾病的病因、诊断、治疗、预防、自然病程及其预后等方面的重要问题,从而认识疾病的本
研究对象研究因素效应指标研究对象a研究对象b非研究因素临床研究的基本原则均衡随机研究对象研究因素效应指标研究对象a研究对象b随机对照试验研究对象分组依据队列研究处理因素随访观察结局事件不发生结局事件发生结局事件不发生平行组对照示意图结局结局试验组对照组样本目标人群结局机对照临床试验的基本原理时间方向洗脱期试验组试验组对照组对照组交叉对照示意图未发生结局未发生结局nowfuture发生结局列研究原理示意图研究对象研究因素效应指标研究对象a研究对象b研究对象分组依据病例对照研究诊断试验调查方向
•完整最新ppt
•8
科学性原则
•针对选题有合适的方法进 行科学的研究设计,尽量 能体现科学性原则。
•科研假设有一定的理论或实践依据。
•完整最新ppt
•9
可行性原则
• 有能力和有条件开展研究,工作量适中。 • 对于研究生来讲,一方面是否有足够的资源驾驭这样的研究,另一 方面研究生学位论文的工作量需要达到一定规模。
•干预措施 的结局
•25
例3:霉酚酸酯治疗重型肝炎的临床研究
•完整最新ppt
•26
预后研究选题的基本要素
研究因素
研究对象
效应指标
可疑的影响 预后的因素
临床研究方案设计ppt课件

假如是类试验设计
• 非随机试验 同一个医院两名医生同时开展急性冠脉综合征的研究,
其中一个医生的患者单用他汀,另一个医生的患者用两药联
合治疗,比较这两位医生患者的疗效、安全性。
23
THANK
YOU
SUCCESS
2019/4/23
试验性研究示意图
试验组
疗效好
疗效不好
受试者
非 随 随 机 机 分 分 组 组
队列 研究
生态 学研 究
29
临床研究的类型与研究设计类型
• 病因学研究
– 横断面研究、病例对照研究、队列研究
• 诊断研究
– 横断面研究、病例对照研究、队列研究
• 治疗研究
– 队列研究、临床试验
• 预后研究
– 病例对照研究、队列研究
各研究设计方案在不同临床问题中的应用
研究设计方案没有高下,只有合适与否
• 队列研究(cohort study)
• 临床试验(clinical trial)
3
临床研究 按是否干预 分类 观察性研究 试验性研究
4
临床研究
按是否干预 分类
观察性研究
试验性研究
按暴露/结局 的先后分类 病例对照 研究
随机、对照 是否完整
横断面研究
队列研究
真试验(RCT)
类试验
调查、筛查、 生态学等
随机对照试验(randomized controlled trial,
RCT)最为常见。是指通过随机化分配,将研究对象 分成试验组和对照组,然后接受相应的试验措施, 使非试验因素在组间尽可能一致,以便客观地评价 试验措施效应。
随机对照试验设计图示
实验组
发病
临床医学研究常用设计方案PPT课件

干间隔,系统地抽取一个单位的方法。第一个系统号的确定是 随机产生的 ➢该方法简便易行,易于理解,但系统误差较大
临床医学研究常用设计方案
(3)分层抽样(stratified sampling)是先将调查总体按不同特 征分层,然后分别在各层中进行随机抽样或系统抽样,最后各 层集合组成一个样本
考虑了各层次间的影响,代表性好 如:拟调查某县农村地区高血压的患病率,首先将该县农村地
研究论证强度差,研究质量较低
临床医学研究常用设计方案
二、横断面研究种类
➢ 普查(census)
➢ 抽样调查(sampling survey)
临床医学研究常用设计方案
(一)普查
➢指在特定时间对特定范围内的全部人群进行调查。 ➢时间:较短(1~2天或1~2周) ➢范围:某个地区或具有某种特征的人群 ➢目的:疾病的早期发现和早期治疗;
➢特点:以小测大、以少窥多、以部分估计总体 ➢被抽查的人群称为总体,抽出的部分称为样本
临床医学研究常用设计方案
1.抽样方法
(1)单纯随机抽样(simple random sampling)是采用随机数字 表、抽签、抓阄等方法确定每一研究对象
➢使每个抽样单位被选入样本的机会相等 ➢较少单独使用,特别是当研究样本量较大时更少独立应用 (2)系统抽样(systematic sampling)指对全部试验对象每隔若
➢临床医生较常用,特别是基层医院的医生 ➢用于分析某种疾病的临床表现和治疗效果 ➢回顾性研究,不设立对照组 ➢论证强度较弱,难以获得真正的因果关系,属于低级别证据
临床医学研究常用设计方案
(二)病例分析的内容 病例分析在临床上应用较为广泛,几乎可以应用到临床
各个方面,主要包括: 治疗措施效果的评价; 预后结局观察; 诊断与鉴别诊断结果的描述; 主要的临床表现,即症状、体征阳性率的描述; 主要的检查结果,如心电图、彩超、CT、各项生化指标
临床医学研究常用设计方案
(3)分层抽样(stratified sampling)是先将调查总体按不同特 征分层,然后分别在各层中进行随机抽样或系统抽样,最后各 层集合组成一个样本
考虑了各层次间的影响,代表性好 如:拟调查某县农村地区高血压的患病率,首先将该县农村地
研究论证强度差,研究质量较低
临床医学研究常用设计方案
二、横断面研究种类
➢ 普查(census)
➢ 抽样调查(sampling survey)
临床医学研究常用设计方案
(一)普查
➢指在特定时间对特定范围内的全部人群进行调查。 ➢时间:较短(1~2天或1~2周) ➢范围:某个地区或具有某种特征的人群 ➢目的:疾病的早期发现和早期治疗;
➢特点:以小测大、以少窥多、以部分估计总体 ➢被抽查的人群称为总体,抽出的部分称为样本
临床医学研究常用设计方案
1.抽样方法
(1)单纯随机抽样(simple random sampling)是采用随机数字 表、抽签、抓阄等方法确定每一研究对象
➢使每个抽样单位被选入样本的机会相等 ➢较少单独使用,特别是当研究样本量较大时更少独立应用 (2)系统抽样(systematic sampling)指对全部试验对象每隔若
➢临床医生较常用,特别是基层医院的医生 ➢用于分析某种疾病的临床表现和治疗效果 ➢回顾性研究,不设立对照组 ➢论证强度较弱,难以获得真正的因果关系,属于低级别证据
临床医学研究常用设计方案
(二)病例分析的内容 病例分析在临床上应用较为广泛,几乎可以应用到临床
各个方面,主要包括: 治疗措施效果的评价; 预后结局观察; 诊断与鉴别诊断结果的描述; 主要的临床表现,即症状、体征阳性率的描述; 主要的检查结果,如心电图、彩超、CT、各项生化指标
最新临床医学研究设计的基本原则 医学PPT课件

– 是一种简单实用的随机化方法。
– 可以进行随机抽样、随机分组。
表 随机数字表
(1)随机抽样:
• 例如,欲在某医院门诊随访的250名高血压
患者中随机抽取20名作为一种降压新药的 试验对象。
– 先将250名高血压患者从1~250顺序编号,
– 然后从随机数字表任何一行的任何一列开始, 顺序产生20个00~99之间的随机数,
– 可先从第1~20(第一部分)之间随机抽出一 个观察单位,如为12号,
– 此后按每隔20抽取一个单位,即32、52、 72……至1992号组成样本。
• 系统抽样的优点:
– 简单易行, – 适用于大样本的流行病学调查, – 样本的观察单位在总体中分布均匀, – 抽样代表性较好。
• 系统抽样的缺点
– 每个数字乘以250取前3位数,超过250号的, 取前2位数,重复的数弃去重抽,
– 最后,以对应编号的患者组成参加本次试验的 样本。
– 注意,一旦确定行、列或斜向顺序后,中途不 能任意更改方向。
(2)随机分组:
• 例如,欲将合乎试验要求的20名患者,随机分配
为试验组(T),对照组(C)2组。
– 首先将患者从1至20编号,
• 在分层随机分组中,主要以研究对象中某
些可能产生混杂作用的特征作为分。
• 层因素,如研究对象的重要临床特征或预
后因素(包括年龄、性别、病情、有无并 发症等)。
• 临床医学研究中的分层因素:
– ①研究疾病或其并发症的危险因素; – ②对所研究疾病预后有明显影响的因素; – ③遵循最小化原则,将分层因素控制到最低限
临床医学研究设计的基本原则 医学
科研设计的基本原则
1. 随机原则 2. 对照原则 3. 均衡原则 4. 重复原则 5. 盲法原则(临床试验时,可属均衡之列) 作用:减少误差,提高实验效率。
– 可以进行随机抽样、随机分组。
表 随机数字表
(1)随机抽样:
• 例如,欲在某医院门诊随访的250名高血压
患者中随机抽取20名作为一种降压新药的 试验对象。
– 先将250名高血压患者从1~250顺序编号,
– 然后从随机数字表任何一行的任何一列开始, 顺序产生20个00~99之间的随机数,
– 可先从第1~20(第一部分)之间随机抽出一 个观察单位,如为12号,
– 此后按每隔20抽取一个单位,即32、52、 72……至1992号组成样本。
• 系统抽样的优点:
– 简单易行, – 适用于大样本的流行病学调查, – 样本的观察单位在总体中分布均匀, – 抽样代表性较好。
• 系统抽样的缺点
– 每个数字乘以250取前3位数,超过250号的, 取前2位数,重复的数弃去重抽,
– 最后,以对应编号的患者组成参加本次试验的 样本。
– 注意,一旦确定行、列或斜向顺序后,中途不 能任意更改方向。
(2)随机分组:
• 例如,欲将合乎试验要求的20名患者,随机分配
为试验组(T),对照组(C)2组。
– 首先将患者从1至20编号,
• 在分层随机分组中,主要以研究对象中某
些可能产生混杂作用的特征作为分。
• 层因素,如研究对象的重要临床特征或预
后因素(包括年龄、性别、病情、有无并 发症等)。
• 临床医学研究中的分层因素:
– ①研究疾病或其并发症的危险因素; – ②对所研究疾病预后有明显影响的因素; – ③遵循最小化原则,将分层因素控制到最低限
临床医学研究设计的基本原则 医学
科研设计的基本原则
1. 随机原则 2. 对照原则 3. 均衡原则 4. 重复原则 5. 盲法原则(临床试验时,可属均衡之列) 作用:减少误差,提高实验效率。
《临床研究设计》课件

YOUR LOGO
20XX.XX.XX
《临床研究设计》PPT课件
PPT,a click to unlimited possibilities
汇报人:PPT
目 录
01 单 击 添 加 目 录 项 标 题 02 临 床 研 究 概 述 03 研 究 问 题 与 假 设 04 研 究 对 象 与 样 本 选 择 05 研 究 方 法 与 设 计 06 数 据 收 集 与 分 析 方 法
样本量计算方法:简单随机 抽样、分层抽样、系统抽样 等
样本量确定方法:根据预期 效应大小、检验水准、研究
误差等因素进行计算
样本量确定注意事项:避免 样本量过大或过小,确保研
究的科学性和实用性
样本选择的伦理与法规要求
伦理要求:尊重受试者权益,遵守知情同意原则,确保受试者安全 法规要求:遵守国家相关法律法规,如《涉及人的生物医学研究伦理审查办法》等 伦理审查:进行伦理审查,确保研究符合伦理要求 法规监管:接受相关部门的监管,确保研究符合法规要求
解释研究结果: 对研究结果进行 深入解释,包括 对结果的背景、 意义和影响进行 讨论。
分析研究结果: 对研究结果进行 深入分析,包括 对结果的可靠性、 稳定性和可重复 性进行评估。
讨论研究结果: 对研究结果进行 讨论,包括对结 果的局限性、潜 在问题和未来研 究方向进行探讨。
研究结论的得出与意义
研究结论的得 出:对研究结 果进行解释和 总结,得出研
意愿和权利
03
研究问题与假设
研究问题的提出
临床实践中的问题 文献回顾与现状分析 专家咨询与讨论 确定研究问题与假设
假设的形成与检验
假设的形成:基于问题、文 献、理论等
假设的定义与作用
20XX.XX.XX
《临床研究设计》PPT课件
PPT,a click to unlimited possibilities
汇报人:PPT
目 录
01 单 击 添 加 目 录 项 标 题 02 临 床 研 究 概 述 03 研 究 问 题 与 假 设 04 研 究 对 象 与 样 本 选 择 05 研 究 方 法 与 设 计 06 数 据 收 集 与 分 析 方 法
样本量计算方法:简单随机 抽样、分层抽样、系统抽样 等
样本量确定方法:根据预期 效应大小、检验水准、研究
误差等因素进行计算
样本量确定注意事项:避免 样本量过大或过小,确保研
究的科学性和实用性
样本选择的伦理与法规要求
伦理要求:尊重受试者权益,遵守知情同意原则,确保受试者安全 法规要求:遵守国家相关法律法规,如《涉及人的生物医学研究伦理审查办法》等 伦理审查:进行伦理审查,确保研究符合伦理要求 法规监管:接受相关部门的监管,确保研究符合法规要求
解释研究结果: 对研究结果进行 深入解释,包括 对结果的背景、 意义和影响进行 讨论。
分析研究结果: 对研究结果进行 深入分析,包括 对结果的可靠性、 稳定性和可重复 性进行评估。
讨论研究结果: 对研究结果进行 讨论,包括对结 果的局限性、潜 在问题和未来研 究方向进行探讨。
研究结论的得出与意义
研究结论的得 出:对研究结 果进行解释和 总结,得出研
意愿和权利
03
研究问题与假设
研究问题的提出
临床实践中的问题 文献回顾与现状分析 专家咨询与讨论 确定研究问题与假设
假设的形成与检验
假设的形成:基于问题、文 献、理论等
假设的定义与作用
临床研究ppt课件

等,以保证较高的统计效能。
33
二、对照组的类别 ●同期随机对照 (concurrent randomized control) ●自身对照( self control) ●历史对照(historical control) ●非随机同期对照 (non-randomized concurrent control) ●配对对照 (matching control)
种类
研究现场 研究对象 干预措施施加
现场试验 社 区 尚未患病的健康 针对个人
(个体)
人群或高危人群
社区(干预) 社 区 试验
同上
针对社区
临床试验
医院
到医院就诊的已 患某病的患者
针对个人
4
经典性实验研究
如: James Lind 关于坏血病病因的研究;
George Baker 关于铅与腹绞痛因果关系 的研究;
含义
分配方法及结果 见表5-5
能保证区组内和组间的病例数相等,且随时保持两 组间例数的平衡。
要注意的是每个区组内人数不宜过多;
25
26
(四)系统随机抽样 (systematic sampling) (五)多级抽样法 (multi-stage sampling)
27
三、随机化的优缺点
随机分配可提高可比性,防止混杂偏倚; 随机抽样可提高代表性,减少选择偏倚; 缺点是设计和实施较难。
8
临床科研设计的“三要素” 与“三原则”
研究对象 三要素 处理因素
效应指标
三原则
随机化 设立对照 盲法观察
9
1.研究因素(处理因素)
研究因素是根据研究目的 所确定的需要研究的某干预 措施。
10
临床试验设计中,确定处理因素 时应明确以下几方面:
33
二、对照组的类别 ●同期随机对照 (concurrent randomized control) ●自身对照( self control) ●历史对照(historical control) ●非随机同期对照 (non-randomized concurrent control) ●配对对照 (matching control)
种类
研究现场 研究对象 干预措施施加
现场试验 社 区 尚未患病的健康 针对个人
(个体)
人群或高危人群
社区(干预) 社 区 试验
同上
针对社区
临床试验
医院
到医院就诊的已 患某病的患者
针对个人
4
经典性实验研究
如: James Lind 关于坏血病病因的研究;
George Baker 关于铅与腹绞痛因果关系 的研究;
含义
分配方法及结果 见表5-5
能保证区组内和组间的病例数相等,且随时保持两 组间例数的平衡。
要注意的是每个区组内人数不宜过多;
25
26
(四)系统随机抽样 (systematic sampling) (五)多级抽样法 (multi-stage sampling)
27
三、随机化的优缺点
随机分配可提高可比性,防止混杂偏倚; 随机抽样可提高代表性,减少选择偏倚; 缺点是设计和实施较难。
8
临床科研设计的“三要素” 与“三原则”
研究对象 三要素 处理因素
效应指标
三原则
随机化 设立对照 盲法观察
9
1.研究因素(处理因素)
研究因素是根据研究目的 所确定的需要研究的某干预 措施。
10
临床试验设计中,确定处理因素 时应明确以下几方面:
临床科研设计方案ppt课件

RCT的新发现
❖ 既往认为有效的治疗措施经RCT证实无效 ❖ 病理生理机制推论有效的治疗措施,经RCT证
实无效或有害 ❖ 其它类型的研究设计方案可能夸大或缩小治疗
措施的真实效果 ❖ 单个RCT试验的局限
二、应用范围
❖ 治疗性、预防性研究 ➢探讨某一干预措施的确切疗效,为正确的 医疗决策提供科学依据
第二节 交叉对照试验
一、定义 是将研究对象随机地分为两组,分 别接受试验药物和对照药物,进行治疗。当 试验期终结时,即停用试验药物而进入消洗 期;当规定的消洗期结束后,则进入后一阶 段的试验,前一阶段接受试验药物的试验组 则改为对照组的药物,而在前一阶段接受对 照药物的对照组,则在后一阶段接受试验药 物,如此两组研究对象则构成了前后交叉。
随机化分组
简单随机化法(simple randomization) 分层随机法(stratified randomization) 整群随机法(cluster randomization)
设立对照
原因
不能预知的结局 霍桑效应(Hawthorne effect) 安慰剂效应(placebo effect) 潜在的未知因素的影响
× × √ √
结局评估 或
数据分析 者
× × ×
√
四、设计模式
试验组 随访观察
研究人群随机分组
对照组 随访观察
有效
无效 有效
目标人群
无效
RCT随机设计模式示意 图
结果分析模式
RCT试验的数据可整理成以下四格表
RCT试验的治疗结果分析 表
分组 有效 无效 合计
试验组
a
b
对照组
c
d
合计
a+c
临床研究设计方法ppt课件

研 究 误 差
24
临床研究的“生理”
总 结
25
临床研究设计方法
制订研究计划
从“研究问题”开始
提纲 计划书 工作手册
步骤
一纲在手
想法逐渐清晰 便于交流讨论
推断在胸
听取意见 预试验 反复修改
妥协
26
研究问题
27
研究问题
好问题来自
全面掌握文献/前沿 关注新思路/新技术 对传统观点持怀疑态度 保持丰富的想象 导师
预测参数(干预) 结局参数 混杂参数…
举例
鱼与心血管疾病
我们吃鱼多吗? 吃鱼能降低心血管疾病
的风险吗?
16
临床研究的“解剖”
统计分析
假设
无效假设 备择假设
计算样本量
Effect Size Power Statistical Significance
5
临床研究的“解剖”
背景和意义
已知 未知 新知
关于这个“研究问题”…
这个问题重要吗? 哪些方面已经搞清楚了? 以前的研究存在什么缺陷? 哪些方面还没有搞清楚? 搞清楚这些到底有什么用?
带来科学新知? 影响临床指南? 助力公卫政策?
6
临床研究的“解剖”
几率抽样
简单随机抽样 系统抽样 分层随机抽样 整群抽样
35
研究对象
募集
代表性强
无应答 失访
样本量够
36
参数测量
37
参数测量
参数分类
连续变量 分类变量
名义变量 等级变量 二分变量
24
临床研究的“生理”
总 结
25
临床研究设计方法
制订研究计划
从“研究问题”开始
提纲 计划书 工作手册
步骤
一纲在手
想法逐渐清晰 便于交流讨论
推断在胸
听取意见 预试验 反复修改
妥协
26
研究问题
27
研究问题
好问题来自
全面掌握文献/前沿 关注新思路/新技术 对传统观点持怀疑态度 保持丰富的想象 导师
预测参数(干预) 结局参数 混杂参数…
举例
鱼与心血管疾病
我们吃鱼多吗? 吃鱼能降低心血管疾病
的风险吗?
16
临床研究的“解剖”
统计分析
假设
无效假设 备择假设
计算样本量
Effect Size Power Statistical Significance
5
临床研究的“解剖”
背景和意义
已知 未知 新知
关于这个“研究问题”…
这个问题重要吗? 哪些方面已经搞清楚了? 以前的研究存在什么缺陷? 哪些方面还没有搞清楚? 搞清楚这些到底有什么用?
带来科学新知? 影响临床指南? 助力公卫政策?
6
临床研究的“解剖”
几率抽样
简单随机抽样 系统抽样 分层随机抽样 整群抽样
35
研究对象
募集
代表性强
无应答 失访
样本量够
36
参数测量
37
参数测量
参数分类
连续变量 分类变量
名义变量 等级变量 二分变量
临床研究常见的设计类型PPT幻灯片
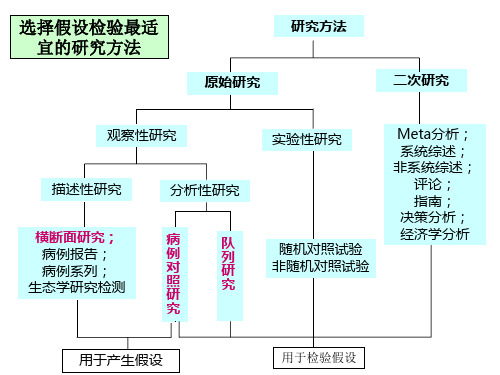
选择假设检验最适 宜的研究方法
研究方法 原始研究
二次研究
观察性研究
描述性研究
横断面研究; 病例报告; 病例系列; 生态学研究检测
分析性研究
病 例 对 照 研
队 列 研 究
究
实验性研究
随机对照试验 非随机对照试验
Meta分析; 系统综述; 非系统综述;
评论; 指南; 决策分析; 经济学分析
用于产生假设
用于检验假设
现况调查(prevalence study)
• 定义:是研究特定时间与特定空间内人群 有关变量与疾病或健康状况的关系。由于 所获得的资料是在某一特定时间上收集的, 好似时间的一个横断面,故又称横断面调 查(横断c面ro研s究s常s常e被c用tio来n建a立l 临s床tu现d象y之)间。的因果关系假设。
♀♀♀♀♀ ♀♀♀♀♀
回忆暴露历史
比较暴露因素♀♀♀♀♀ ♀♀♀♀♀回 Nhomakorabea暴露历史
肺癌患者
♀♀♀♀♀ ♀♀♀♀♀
对照组:没患肺癌者
♀♀♀♀♀ ♀♀♀♀♀
作出结论
病例对照研究示意图
队列研究(cohort study)
定义:是指将特定人群按照暴露和未暴露于某
因素(危险因素、致病因素或保护因素)分为两 组,然后追踪观察一定时间后,比较两组发病或 死亡的结局,从而判断暴露因素与疾病的关联及 关联强度的一种研究方法。
假设条件:低高密度脂蛋白可能会影响冠心病的预后 特定时间:2010年-2012年; 特定空间:中国地区; 人群变量:血脂异常(低高密度脂蛋白); 疾病类型:冠心病; 试验目的:研究低高密度脂蛋白(临床现象)与冠心病预后
之间是否存在因果关系,以便找出特点或规律,指导临 床实践。
研究方法 原始研究
二次研究
观察性研究
描述性研究
横断面研究; 病例报告; 病例系列; 生态学研究检测
分析性研究
病 例 对 照 研
队 列 研 究
究
实验性研究
随机对照试验 非随机对照试验
Meta分析; 系统综述; 非系统综述;
评论; 指南; 决策分析; 经济学分析
用于产生假设
用于检验假设
现况调查(prevalence study)
• 定义:是研究特定时间与特定空间内人群 有关变量与疾病或健康状况的关系。由于 所获得的资料是在某一特定时间上收集的, 好似时间的一个横断面,故又称横断面调 查(横断c面ro研s究s常s常e被c用tio来n建a立l 临s床tu现d象y之)间。的因果关系假设。
♀♀♀♀♀ ♀♀♀♀♀
回忆暴露历史
比较暴露因素♀♀♀♀♀ ♀♀♀♀♀回 Nhomakorabea暴露历史
肺癌患者
♀♀♀♀♀ ♀♀♀♀♀
对照组:没患肺癌者
♀♀♀♀♀ ♀♀♀♀♀
作出结论
病例对照研究示意图
队列研究(cohort study)
定义:是指将特定人群按照暴露和未暴露于某
因素(危险因素、致病因素或保护因素)分为两 组,然后追踪观察一定时间后,比较两组发病或 死亡的结局,从而判断暴露因素与疾病的关联及 关联强度的一种研究方法。
假设条件:低高密度脂蛋白可能会影响冠心病的预后 特定时间:2010年-2012年; 特定空间:中国地区; 人群变量:血脂异常(低高密度脂蛋白); 疾病类型:冠心病; 试验目的:研究低高密度脂蛋白(临床现象)与冠心病预后
之间是否存在因果关系,以便找出特点或规律,指导临 床实践。
临床研究方法设计ppt

横断面研究 (cross sectional study)
特征:一个时间点发生率 单臂试验 无对照 简便快速
诊断试验设计表
常用临床研究方法优缺点比较
谢 谢!
干预措施:药物、疗法、手术 研究方法:确定实施方案
10
临床实验的设计
1. 明确研究目的 2. 确定研究因素 3. 选择研究对象 4. 估计样本含量 5. 确定实验结局
统一明确入选条件和排除标准 干预试验必须证实对人体无害 研究对象需体征明显依从性好 特殊人群(老弱幼孕)应排除
D 伦理问题
24
临床实验分期小组测试1-30随机盲法对照 100-300
多中心试验
1000-3000
新药上市后监测 长期效果 罕见作用
25
观察性研究 --队列研究(cohort study)
特征:定群研究 先确定病人是否存在某因素(暴露与否) 然后随访一段时间 再确定病人是否出现阳性结局 暴露与否---随访时间-------结局 统计学分析:RR 95%CI
8
临床实验的设计
1. 明确研究目的 2. 确定研究因素 3. 选择研究对象 4. 估计样本含量 5. 确定观察结局
暴露疾病 病因学 干预结局 疗效分析 通常一次实验只解决一个问题
9
临床实验的设计
1. 明确研究目的 2. 确定研究因素 3. 选择研究对象 4. 估计样本含量 5. 确定观察结局
其他因素
处理因素
降压药
受试对象
高血压病人
其他效应
实验效应
血压值
A 处理因素
例:药剂、手术方法、毒物 抓住主要处理因素 区分处理与非处理因素 处理因素必须标准化
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
性别 健康标准 排除标准 • 剂量选择:根据临床前试验
参考同类药物临床使用的安全、有效剂量范围
医学PPT
29
——耐受性试验 • 分组:一般3-5组,5-6人/组,
8-10人/ 接近临床剂量组 • 给药途径:剂型
临床前药理毒理试验 临床拟用药途径 • 观察指标:临床症状、体征 实验室检查
医学PPT
医学PPT
8
二、临床试验的目的和内容
临床研究的内容 临床试验的目的 药代动力学研究与药物研发过程 的关系
医学PPT
9
临床研究的内容
• 临床试验:Ⅰ期 Ⅱ期 Ⅲ期 Ⅳ期
• 生物等效性试验
医学PPT
10
应当进行Ⅰ期、Ⅱ期、Ⅲ期、/Ⅳ期临床试验的 新药:
• 未在国内外上市销售的药品。——分类1 • 改变给药途径且尚未在国内外上市销售的制
Ⅲ期进行。
医学PPT
22
Ⅲ期临床试验的特点:
• 验证疗效 • 适应症相对固定 • 剂量、治疗方案相对确定 • 受试者:更广泛 • 疗程:
对于预计长期服用的药物,药物的长期暴露 试验通常在Ⅲ期进行。
医学PPT
23
(四)Ⅳ期临床试验——扩大应用
新药上市后由申请人自主进行的应用研究阶段。 目的: • 考察在广泛使用条件下的药物的疗效和不良反
医学PPT
3
医学PPT
4
临床研究的基本条件
药学基础 药理毒理基础 临床方案设计的基础考虑
医学PPT
5
药物临床试验的依据
• 机理研究 • 临床前动物安全性研究结果 • 临床前动物药效学研究结果 • 相同或类似产品的安全性、有效性研究结果 • 相同或类似产品的应用现状
对新药的评价具有参考意义
医学PPT
化学药物临床研究的 目的和设计
主讲人:卓宏 讲习组成员:赵明、赵德恒、钱思源、 杨进波、康彩练、王涛 药品审评中心 2004.9
医学PPT
1
一、临床研究的基本要求 二、临床试验的目的和内容 三、临床试验的设计 四、临床试验结果的评价
医学PPT
2
一、临床研究的基本要求
临床研究的基本条件 临床研究的基本要求 临床研究遵循的法规
医学PPT
26
三、临床试验的设计 及实例分析
Ⅰ期临床试验 Ⅱ、Ⅲ期临床试验
人体生物等效性试验
实例分析
医学PPT
27
Ⅰ期临床试验的设计
——耐受性试验
• 设计方法 • 受试者 • 分组 • 给药途径
• 观察指标 • 试验终止 • 结果分析 • 注意
医学PPT
28
——耐受性试验
• 内容:单剂量递增(SD)、多剂量递增(MD) • 设计方法:开放、基线对照/ 随机、盲法 • 受试者:年龄
医学PPT
13
临床试验的目的
(一)Ⅰ期临床试验: 初步的临床药理学及人体安全性评价试验。
目的: 观察人体对于新药的耐受程度和药 代动力学,为制定给药方案提供依据。
其他目的:处方、剂型的筛选
医学PPT
14
内容:
初始人体安全性和耐受性评估 药物代谢动力学 药效学评价 药物活性的早期测定 根据需要进行
晚期:平行量效研究设计,确定药物对可能适应 症的量效关系
• 受试者范围窄
• 治疗方案不确定
医学PPT
21
(三) Ⅲ期临床试验——验证
治疗作用确证阶段。
目的: • 进一步验证药物对目标适应症患者的治疗作用和安全
性 • 评价利益与风险关系 • 为药物注册申请获得批准提供充分的依据 • 为完成药品的使用说明书提供所需要的信息 内容: 具有足够样本量的随机盲法对照试验 对于预计长期服用的药物,药物的长期暴露试验通常在
剂。——分类2 • 增加适应症等——补充申请
医学PPT
11
进口药品
未在国内外获准上市的: 进行Ⅰ、Ⅱ、Ⅲ、Ⅳ期临床试验
已在国外上市的: 人体药代动力学、随机对照临床试验
(100对)
进口原料药: 使用其制剂进行临床研究
医学PPT
12
其他有上市基础的新药或相似情况下: 进行验证性临床试验
或人体生物等效性研究
调节的间隔,并根据患者的特征进行适当调节。 ➢ 确定一个治疗剂量。超过此剂量时受益不会增
加或不良反应增加。
医学PPT
19
Ⅱ期临床试验其他目的:
• 评价潜在研究终点 • 评价治疗方案 • 评价目标人群(例如轻度与重度疾病比较)
医学PPT
20
Ⅱ期临床试验的特点:
量效关系
25
药代动力学研究与药物研发过
程的关系
• 药物吸收、分布代谢和排泄(A.D.M.E)特征的研究通 常贯穿整个研发过程。
• 阶段性特征: 阶段性结果支持相应阶段研究 ➢ Ⅰ期临床的药代动力学研究主要目标是初步确定
A.D.M.E特征。 ➢ 后期:亚人群 肝肾功能不全
老年人、儿童、妇女 人种 药物相互作用
医学PPT
15
通过Ⅰ期临床试验
• 了解到人体可耐受的剂量范围 • 为二期临床剂量选择提供依据 • 为二期临床提供给药频率及给药时间 • 了解到预期不良反应的性质及剂量范围
医学PPT
16
(二)Ⅱ期临床试验:——探索
治疗作用初步评价阶段 目的: • 探索药物治疗作用 • 初步评价药物对目标适应症患者的治疗作用和
安全 • 为III期临床试验研究设计和给药剂量方案的
确定提供依据。
内容:随机盲法对照临床试验
医学PPT
17
探索治疗作用
• 探索药物对于特定适应症的疗效、安全性 • 探索适应症-肿瘤(瘤种探索)
医学PPT
18
探索剂量:
• 新药上市应当提供有合理设计的量效关系资料。 • 采用3个以上剂量进行随机平行量效关系研究。 • 剂量探索研究应达以下目的: ➢ 确定合理的初始治疗剂量 ➢ 确定合理的、由疗效所指导的剂量调节步骤及
应 • 评价在普通或者特殊人群中使用的利益与风险
关系 • 改进给药剂量 内容: 大样本量的开放性试验
医学PPT
24
(五)生物等效性试验
目的: 通过研究新制剂与相同药物已知制剂
在人体内是否具有生物等效性,推断两 者是否具有相同疗效和不良反应 内容:
生物利用度比较试验( BE ) (口服固体制剂)
医学PPT
6
临床研究的一般要求
临床研究实施前的要求 • 经国家药品监督管理局批准 • 在具有药物临床试验资格的机构进行 • 试验用药品需检验合格 • 对临床方案的要求
医学PPT
7
新药临床研究必须要遵循相关法规
《中华人民共和国药品管理法》 《中华人民共和国药品管理法实施条例》 《药品注册管理办法》 《药物临床试验管理规范》(GCP)
参考同类药物临床使用的安全、有效剂量范围
医学PPT
29
——耐受性试验 • 分组:一般3-5组,5-6人/组,
8-10人/ 接近临床剂量组 • 给药途径:剂型
临床前药理毒理试验 临床拟用药途径 • 观察指标:临床症状、体征 实验室检查
医学PPT
医学PPT
8
二、临床试验的目的和内容
临床研究的内容 临床试验的目的 药代动力学研究与药物研发过程 的关系
医学PPT
9
临床研究的内容
• 临床试验:Ⅰ期 Ⅱ期 Ⅲ期 Ⅳ期
• 生物等效性试验
医学PPT
10
应当进行Ⅰ期、Ⅱ期、Ⅲ期、/Ⅳ期临床试验的 新药:
• 未在国内外上市销售的药品。——分类1 • 改变给药途径且尚未在国内外上市销售的制
Ⅲ期进行。
医学PPT
22
Ⅲ期临床试验的特点:
• 验证疗效 • 适应症相对固定 • 剂量、治疗方案相对确定 • 受试者:更广泛 • 疗程:
对于预计长期服用的药物,药物的长期暴露 试验通常在Ⅲ期进行。
医学PPT
23
(四)Ⅳ期临床试验——扩大应用
新药上市后由申请人自主进行的应用研究阶段。 目的: • 考察在广泛使用条件下的药物的疗效和不良反
医学PPT
3
医学PPT
4
临床研究的基本条件
药学基础 药理毒理基础 临床方案设计的基础考虑
医学PPT
5
药物临床试验的依据
• 机理研究 • 临床前动物安全性研究结果 • 临床前动物药效学研究结果 • 相同或类似产品的安全性、有效性研究结果 • 相同或类似产品的应用现状
对新药的评价具有参考意义
医学PPT
化学药物临床研究的 目的和设计
主讲人:卓宏 讲习组成员:赵明、赵德恒、钱思源、 杨进波、康彩练、王涛 药品审评中心 2004.9
医学PPT
1
一、临床研究的基本要求 二、临床试验的目的和内容 三、临床试验的设计 四、临床试验结果的评价
医学PPT
2
一、临床研究的基本要求
临床研究的基本条件 临床研究的基本要求 临床研究遵循的法规
医学PPT
26
三、临床试验的设计 及实例分析
Ⅰ期临床试验 Ⅱ、Ⅲ期临床试验
人体生物等效性试验
实例分析
医学PPT
27
Ⅰ期临床试验的设计
——耐受性试验
• 设计方法 • 受试者 • 分组 • 给药途径
• 观察指标 • 试验终止 • 结果分析 • 注意
医学PPT
28
——耐受性试验
• 内容:单剂量递增(SD)、多剂量递增(MD) • 设计方法:开放、基线对照/ 随机、盲法 • 受试者:年龄
医学PPT
13
临床试验的目的
(一)Ⅰ期临床试验: 初步的临床药理学及人体安全性评价试验。
目的: 观察人体对于新药的耐受程度和药 代动力学,为制定给药方案提供依据。
其他目的:处方、剂型的筛选
医学PPT
14
内容:
初始人体安全性和耐受性评估 药物代谢动力学 药效学评价 药物活性的早期测定 根据需要进行
晚期:平行量效研究设计,确定药物对可能适应 症的量效关系
• 受试者范围窄
• 治疗方案不确定
医学PPT
21
(三) Ⅲ期临床试验——验证
治疗作用确证阶段。
目的: • 进一步验证药物对目标适应症患者的治疗作用和安全
性 • 评价利益与风险关系 • 为药物注册申请获得批准提供充分的依据 • 为完成药品的使用说明书提供所需要的信息 内容: 具有足够样本量的随机盲法对照试验 对于预计长期服用的药物,药物的长期暴露试验通常在
剂。——分类2 • 增加适应症等——补充申请
医学PPT
11
进口药品
未在国内外获准上市的: 进行Ⅰ、Ⅱ、Ⅲ、Ⅳ期临床试验
已在国外上市的: 人体药代动力学、随机对照临床试验
(100对)
进口原料药: 使用其制剂进行临床研究
医学PPT
12
其他有上市基础的新药或相似情况下: 进行验证性临床试验
或人体生物等效性研究
调节的间隔,并根据患者的特征进行适当调节。 ➢ 确定一个治疗剂量。超过此剂量时受益不会增
加或不良反应增加。
医学PPT
19
Ⅱ期临床试验其他目的:
• 评价潜在研究终点 • 评价治疗方案 • 评价目标人群(例如轻度与重度疾病比较)
医学PPT
20
Ⅱ期临床试验的特点:
量效关系
25
药代动力学研究与药物研发过
程的关系
• 药物吸收、分布代谢和排泄(A.D.M.E)特征的研究通 常贯穿整个研发过程。
• 阶段性特征: 阶段性结果支持相应阶段研究 ➢ Ⅰ期临床的药代动力学研究主要目标是初步确定
A.D.M.E特征。 ➢ 后期:亚人群 肝肾功能不全
老年人、儿童、妇女 人种 药物相互作用
医学PPT
15
通过Ⅰ期临床试验
• 了解到人体可耐受的剂量范围 • 为二期临床剂量选择提供依据 • 为二期临床提供给药频率及给药时间 • 了解到预期不良反应的性质及剂量范围
医学PPT
16
(二)Ⅱ期临床试验:——探索
治疗作用初步评价阶段 目的: • 探索药物治疗作用 • 初步评价药物对目标适应症患者的治疗作用和
安全 • 为III期临床试验研究设计和给药剂量方案的
确定提供依据。
内容:随机盲法对照临床试验
医学PPT
17
探索治疗作用
• 探索药物对于特定适应症的疗效、安全性 • 探索适应症-肿瘤(瘤种探索)
医学PPT
18
探索剂量:
• 新药上市应当提供有合理设计的量效关系资料。 • 采用3个以上剂量进行随机平行量效关系研究。 • 剂量探索研究应达以下目的: ➢ 确定合理的初始治疗剂量 ➢ 确定合理的、由疗效所指导的剂量调节步骤及
应 • 评价在普通或者特殊人群中使用的利益与风险
关系 • 改进给药剂量 内容: 大样本量的开放性试验
医学PPT
24
(五)生物等效性试验
目的: 通过研究新制剂与相同药物已知制剂
在人体内是否具有生物等效性,推断两 者是否具有相同疗效和不良反应 内容:
生物利用度比较试验( BE ) (口服固体制剂)
医学PPT
6
临床研究的一般要求
临床研究实施前的要求 • 经国家药品监督管理局批准 • 在具有药物临床试验资格的机构进行 • 试验用药品需检验合格 • 对临床方案的要求
医学PPT
7
新药临床研究必须要遵循相关法规
《中华人民共和国药品管理法》 《中华人民共和国药品管理法实施条例》 《药品注册管理办法》 《药物临床试验管理规范》(GCP)
