物理化学(下)试题库
物理化学下期末试题

《物理化学》(下)期末试题闭卷考试 时间120分钟一、选择题(每空2分,共28分) 1.利用反应A B 生产物质B ,提高温度对产品产率有利,这表明( )A 、E a ,1> E a ,2B 、 E a ,1< E a ,2C 、E a ,1= E a ,2D 、不能确定两者的相对大小2.四种浓度都是0.01mol/kg 的电解质溶液,其中平均活度系数最小的是:( )A 、HClB 、CuCl 2C 、AlCl 3D 、MgSO 43.某反应速率常数k =mol -1·dm 3·s -1,则该反应为( ) A 、一级反应B 、二级反应C 、三级反应D 、零级反应4.在电解池的阴极上,首先发生还原反应的是( ) A 、标准电极电势最大的反应B 、标准电极电势最小的反应C 、析出电势最小的反应D 、析出电势最大的反应5.如图所示,带有活塞的连通管,在两端各吹一个大小不同的肥皂泡,当打开活塞两端连通,最后的状态为( )A 、泡1变大,泡2消失B 、泡1、泡2都消失C 、泡1消失,泡2变大D 、泡1、泡2大小相等6.当电流通过化学电源或电解池时,电极将因偏离平衡而发生极化,如下图。
则( )表示化学电源的阳极,( )表示电解池的阳极。
127.某电池的电池反应可写成:(1) H2(g) + 1/2O2(g) →H2O(l)(2) 2H2(g) + O2(g) →2H2O(l)用E1,E2表示相应反应的电动势,K1,K2表示相应反应的平衡常数,下列各组关系正确的是()A、E1=E2 K1=K2B、E1≠E2K1=K2C、E1=E2K1≠K2D、E1≠E2K1≠K28.一个玻璃毛细管分别插入25℃和75℃的水中,则毛细管的水面在两不同温度水中上升的高度()A、相同B、无法确定C、25℃水中高于75℃水中D、75℃水中高于25℃水中9.在一个密封的玻璃容器中有着大小不等的两个小水滴,则随着放置时间的延长,会出现的现象是()A、大水珠变小,小水珠变大B、大水珠变大,小水珠变小C、大小水珠的大小都不变D、不能确定10.已知298K时,NH4C1、NaOH、NaCl的无限稀释摩尔电导率分别为1.499×10-2,2. 487×10-2,1.265×10-2S·m2·mol-1,则NH4OH的无限稀释摩尔电导率是:()A、0.277×10-2S·m2·mol-1B、2.931×10-2S·m2·mol-1C、2.253×10-2S·m2·mol-1D、2.721×10-2S·m2·mol-111.已知连串反应A →B →C中,如果需要的是中间产物B,则为得其最高产率应当()A、增大反应物A的浓度B、增大反应速率C、控制适当的反应温度D、控制适当的反应时间12.往AgI负溶胶中分别加入浓度相同的NaCl、CaCl2、AlCl3电解质溶液,其聚沉能力大小顺序为()A、AlCl3>CaCl2> NaClB、CaCl2 >AlCl3>NaClC、NaCl >CaCl2> AlCl3D、NaCl>AlCl3> CaCl213.关于过渡态理论,下列说法错误的是:()A、过渡态理论又叫活化络合物理论B、总反应速率由活化络合物转化成产物的速率决定C、反应物分子之间相互作用势能是分子间相对位置的函数D、活化络合物能量较反应物能量高,较产物能量低二、判断题(每题1分,共10分)1.反应的反应级数总是等于反应分子数。
物理化学下册题库

A.5、3
B.4、3
C.3、3
D.2、2
2、物质 A 与 B 可形成低共沸混合物 E,已知纯 A 的沸点小于纯 B 的沸点,若将任意比例的 A+B 混合在一个精馏塔中精馏,则塔顶的馏出物是( C )
A.纯 A
B.纯 B
C.低共沸混合物
D.都有可能
3、克拉贝隆-克劳修斯方程适用于( C )
A. I 2(s) I 2(g)
B.仅是压力的函数
C.同是温度和压力的函数
D.除了温度压力以外,还是其他因素的函数
14、在实验室的敞口容器中装有单组份液体,对其不断加热,则看到( A )
A.沸腾现象
B.三项共存现象 C.临界现象
D.生化现象
15、相图与相率之间的关系是( B )
A.相图由相率推导得出
B.相图由实验结果绘制得出,不能违背相率
hing at a time and All things in their being are good for somethin
附近冰的升华热约为( B )
A.38.83 kJ mol 1
B.50.81 kJ mol 1
C.-38.83 kJ mol 1
D.-50.81 kJ mol 1
20、在相图上,当物系点处于哪一点时,只存在一个相( C )
A.恒沸点
B.熔点
C.临界点
D.最低共沸点
21、具有最低恒沸温度的某两组份体系,在其 T-x 相图的最低点有( A )
A. f 0; xg xl B. f 1; xg xl C. f 0; xg xl
D. f 1; xg xl
A.紫色变深
B.紫色变浅
C.颜色不变
D.有液态碘出现
物理化学下册复习题

07电化学一、单选择题(1) 电解质溶液1.下列溶液中哪个溶液的摩尔电导最大:A .0.1M KCl 水溶液B .0.001M HCl 水溶液C .0.001M KOH 水溶液D .0.001M KCl 水溶液2.1摩尔电子的电量与下列哪一个相同A .安培秒B .库仑C .法拉第D .单位电荷3.分别将CuSO 4、H 2SO 4、HCl 、NaCl 从0.1mol ·dm -3 降低到0.01mol ·dm -3,则Λm 变化最大的是:A .CuSO 4B .H 2SO 4C .NaClD .HCl4.下面那种阳离子的离子迁移率最大A .Be 2+B ..Mg 2+C .Na +D .H +5.不能用测定电解质溶液所得的电导来计算出的物理量是:A .离子迁移数B .难溶盐溶解度C .弱电解质电离度D .电解质溶液浓6.用0.5法拉第的电量可以从CuSO 4溶液中沉淀出铜大约(原子量Cu 为64,S 为32,O 为16)A .16克B ..32克C .48克D .64克7.在界面移动法则定离子的迁移数的实验中,其实验结果的准确性主要取决于A .界面移动清晰程度B .外加电压大小C .正负离子的价数值相等D .正负离子运动数相同否8.298K 时,0.1mol ·dm -3NaCl 溶液的电阻率为93.6m ⋅Ω它的电导率为A .114.6--⋅ΩmB .11936.0--⋅ΩmC .1136.9--⋅ΩmD .11011.0--⋅Ωm9.摩尔电导率的定义中固定的因素有A .两个电级间的距离B .两个电极间的面积.C .电解质的数量固定D .固定一个立方体溶液的体积10.0.4000ml 水溶有2克无水BaCl 2,溶液的电导率为0.00585 S ·m -1,该溶液的摩尔电导率为A .127101--⋅⋅⨯mol m SB .1261041.2--⋅⋅⨯mol m S (BaCl 2式量为208)C . 1241041.2--⋅⋅⨯mol m SD .1231041.2--⋅⋅⨯mol m S11.科尔劳乌斯关于电解质溶液的摩尔电导率与其浓度关系的公式:)1(C m m β-Λ=Λ∞仅适用于A .强电解质稀溶液B .弱电解质C .无限稀的溶液D .摩尔浓度为一的溶液12.无限稀释的水溶液中,离子摩尔电导率最大的是A .CH 3CO -B .OH -C .Cl -D .Br -13.在无限稀释的电解质溶液中,正离子浓度∞+U 正离子的摩尔电导率∞+m λ和法拉第常数的关系是A .∞+U F m =∞+λ/B .∞+U F m =⨯∞+λC .∞+U 1=⨯⨯∞+F m λD .F U m =∞+∞+/λ14.无限稀释溶液中,KCl 的摩尔电导率为130 S ·m 2·mol -1,同样温度下的KCl 溶液中,Cl -的迁移数为0.505,则溶液中K +离子的迁移率(112--⋅⋅V s m )为A .0.495B .130C .64.3D .65.715.已知:150)(4=Λ∞Cl NH m ,248)(=Λ∞NaOH m ,127)(=Λ∞NaCl m ,的∞Λm 单位是:124101--⋅⋅⨯mol m S 。
《物理化学》(下册)期末模拟试题

《物理化学》(下册)模拟试题一、填空(在以下各小题画有“ ”处填上正确答案。
)1.在298K ,101325Pa 下,将直径d =0.1mm 的毛细管插入水中,已知水的表面张力γ水-气=0.0728N/m ,水的密度ρ=1.0g/cm 3,接触角θ=0˚,重力加速度g =9.8m/s 2,则平衡后液面上升高度 h = m 。
2.在400 K 时,某气相反应的速率常数k p = 10-3(kPa)-1·s -1,若速率常数用 k C 表示,则 k C = (mol·m -3)-1·s -1。
3.设计一个可求AgI 溶液K sp 的电池: 。
4.某温度下,反应A —→B 为一级反应,若21t 和41t 分别代表该反应物A 消耗掉50%和75% 所需时间,则比值21t :41t =________________。
5.若某1-1型电解质溶液的摩尔电导率为正负离子的摩尔电导率之和,这一规律适用于: 。
6.由AgNO 3和KI 生成AgI 溶胶,若Al(NO 3)3,Mg(NO 3)2和NaNO 3对该溶胶的聚沉值分别为0.067mol·dm -3,2.60 mol·dm -3和140 mol·dm -3,则该AgI 的胶团结构为: 。
7.一维简谐振子振动能级的简并度为 ,线型刚性转子转动能级的简并度为 。
8.一个双原子分子的振动配分函数表示为1/[1-exp(- v /T )],该配分函数是以 为能量零点的振动配分函数。
二、选择题:(请将答案填在答案表格中)1.在25℃时,若电池Pb(Hg)(a 1)∣Pb(NO 3)2(aq) ∣Pb(Hg)(a 2)中,a 1> a 2,则电池电动势E A. >0B. <0C. =0D. 无法确定2.某电池电动势与温度的关系为: E /V=1.01845-4.05×10-5(T /K-293) -9.5×10-7(T/K-293)2 在298K 时,若该电池可逆放电,则过程热: A.Q > 0B. Q < 0C. Q = 0D.不能确定3.在溶胶的光学性质中,散射光的强度I 与入射光的波长λ、分散相及分散介质的折射率n 、n 0之间的关系中正确的是:A .I 与λ4成正比,I 与(n 2-n 20)2成正比B .I 与λ4成反比,I 与(n 2+n 20)2成正比C .I 与λ4成正比,I 与(n 2-n 20)2成反比D .I 与λ4成反比,I 与(n 2-n 20)2成正比4.(N 、U 、V )确定的离域子系统中,某种分布的微观状态数W D 为:A .∏ii n i n g N i !!B .∏ii ni n g i !C .∑ii g in n i!D .∑ii ni n g i !5.已知某复合反应的反应历程为121,k k k AB BCD -+−−→则B 的浓度随时间的变化率=dtdc BA .k 1c A − k 2cB cC B .k 1c A −k -1c B −k 2c B c C C .k 1c A −k -1c B + k 2c B c CD .−k 1c A + k -1c B + k 2c B c C6.HI 分解反应在没有催化剂条件下时活化能为184.1kJ·mol -1,反应速率常数为k 非,平衡转化率为α非,反应热为Q 非,平衡常数为K 非。
物理化学下试题

《物理化学》(下)试题闭卷考试时间120分钟一、选择题(下列各题 A ,B ,C ,D 四个选项中,只有一个选项是正确的,请将正确选项填写在相应的位置上。
每小题2分,共30分)1. 一个溶液的导电能力决定于溶液中所含离子的( )A. 离子数目,价数B. 离子移动速率C. 离子数目,移动速率D. 离子数目,移动速率和价数2. 用界面移动法测量离子迁移数,应选用下列哪一对电解质溶液:( )A. HCl与CuSO4; B. HCl与CdCl2;C. CuCl2与CuSO4; D. H2SO4与CdCl2。
3. 在一定的温度下,当电解质溶液被冲稀时,其摩尔电导率变化为:( )A. 强电解质溶液与弱电解质溶液都减少;B. 强电解质溶液与弱电解质溶液都增大;C. 强电解质溶液增大,弱电解质溶液减少;D. 强弱电解质溶液都不变。
4. 25℃时电池反应 H2(g) + ½O2(g) = H2O(l) 对应的电池标准电动势为E10,则反应2H2O(l) = 2H2(g) + O2(g) 所对应的电池的标准电动势E20是:( )A. E20 = - 2E10;B. E20 = 2E10;C. E20 = - E10;D. E20 = E10。
5. 有关催化剂的性质,说法不正确的是: ( )A. 催化剂参与反应过程,改变反应途径;B. 催化反应频率因子比非催化反应大得多;C. 催化剂提高单位时间内原料转化率;D. 催化剂对少量杂质敏感。
6. 在一个连串反应A →B →C中,如果需要的是中间产物B,则为得其最高产率应()A. 增大反应物A的浓度B. 增大反应速率C. 控制适当的反应温度D. 控制适当的反应时间7.由过量KBr与AgNO3溶液混合可制得溶胶,以下说法正确的是:()A. 电位离子是Ag+;B. 反号离子是NO3-;C. 胶粒带正电;D. 它是负溶胶。
8. 对临界胶束浓度(CMC)说法不正确的是()A. CMC是形成胶束的最低浓度;B.在CMC前后溶液的表面张力有显著的变化;C. 在CMC前后溶液的电导值变化显著;D. 达到CMC后溶液的表面张力不再有明显的变化。
物理化学下册期末复习试卷1题目

物理化学复习题一[一]单选择题(1) 导体可分为两类,第一类是电子导体,第二类是离子导体。
当温度升高时,其导电能力(a )第一类导体增大,第二类导体也增大(b )第一类导体降低,第二类导体也降低 (c )第一类导体增大,第二类导体降低(d )第一类导体降低,第二类导体升高(2) 某溶液的浓度为 c (mol dm -3)电导率为κ(S m-1),则摩尔电导率Λm (用 SI 单位)与 c 和 κ 的关系为:(a )Λm =κ⨯103/c (b )Λm =κ⨯10-3/c(c )Λm =κ/c (d )Λm =κ⨯10-6/c (3) 下述各量与电池反应方程式的书写无关的是:(a )Q R ; (b )r m H ∆(c )K ; (d )E(4) 某温度下,电池 Na(Hg)(a 1)|NaCl(aq)|Na(Hg)(a 2)的电动势E <0,则a 1和a 2的关系为:(a )a 1>a 2 (b )a 1<a 2 (c )a 1=a 2 (d )难以确定 (5) 实际电解时,在阳极上首先发生氧化作用而放电的是:(a )标准电极电势最正者(b )标准电极电势最负者(c )考虑极化后的不可逆电势最高者 (d )考虑极化后的不可逆电势最低者(6)用同一电导池分别测定浓度为 0.01 mol dm -3KCl 与1 mol dm -3 的 AgNO 3电解质溶液,其电导分别为 1.0⨯10-4及 1.0⨯10-3S, 则二溶液的摩尔电导率的比是:(a )10:1 (b )5:1(c )20:1 (d )1:1(7) 浓度为m 的Al 2(SO 4)3溶液中,正负离子的活度系数分别为γ+ 和 γ-,则平均活度系数γ±等于: (a )(108)1/5m (b )(γ+2γ-3)1/5m (c )(γ+2γ-3)1/5(d )(γ+3γ-2)1/5(8)下列可逆电极中,对OH –不可逆的是:(a )Pt | H 2(g)|OH - (b )Pt | O 2(g)|OH –(c )Hg(l)|HgO(s)|OH - (d )Ba(s)|BaSO 4(s)|OH - (9)电池短路时:(a )电池的电动势趋于零(b )电池所做电功要小于可逆放电时的功(规定体系对环境做功为负值) (c )这时反应的热效应Q p = ∆r H m (d )瞬间可作极大电功(10)对于甘汞电极,下列叙述正确的是:(a )电极反应为 Hg 22++2e →Hg ;(b )属于第一类电极;(c )对阴离子可逆,电极电势较稳定;(d )电极电势为E (Hg 2Cl 2)=E (Hg 2Cl 2)+(RT /2F )ln a (Cl -)(11) 电池 Pt |A |A -(a 1)‖A -(a 2)|A |Pt 当电池电动势E >0,则:(a) a 1>a 2 (b) a 1<a 2(c) a 1=a 2 (d) a 1/a 2任意比值都可(12) 电池 Ag(s) | AgNO 3(,1γ±,m 1) || AgNO 3(,2γ±,m 2) | Ag(s) 的电动势E 应为:(a) -(2 RT /F )ln(,1γ±m 1/,2γ±m 2) (b) -(2 RT /F )ln(,2γ±m 2/,1γ±m 1) (c) -(RT /F )ln(,1γ±m 1/,2γ±m 2) (d) -(RT /F )ln(,2γ±m 2/,1γ±m 1) (13)将反应 H ++OH -=H 2O 设计成可逆电池,选出下列电池中正确的一个:(a )Pt │H 2│H +(aq)‖OH -│O 2│Pt (b )Pt │H 2│NaOH(aq)│O 2│Pt(c )Pt │H 2│NaOH(aq)‖HCl(aq)│H 2│Pt (d )Pt │H 2 (P 1)│H 2O(l)│H 2 (P 2)│Pt(17) 相同温度下,液体水、金属银和液体苯三种物质中表面张力最小的是_______。
物理化学试题及答案

化学化工学院物理化学(下)测验题答案一.填空题(每题2分,共30分)1. 具有简单级数的反应,速率常数k =0.1113s )dm (mol ---⋅⋅,反应的起始浓度30dm mol 1.0-⋅=c ,则反应级数n = 2 ,半衰期t 1/2= 100 s 。
2. 1-1级可逆反应的平衡常数K = k 1/k -1 ,等容热效应U ∆= Ea 1- Ea 2 。
3. 设物质A 可发生两个平行的一级反应:(a )A →a k Ea B+C ;(b )A →b k EbD+E ,式中B 和C 是需要的产品,D 、E 为副产品,设两反应的频率因子相等且与温度无关,Ea>Eb ,则反应(a )和(b )相比,速率较大的反应是 (b) ,升高温度对反应 (a) 更为有利。
4. 某反应A+B 11k k -⇔P ,加入催化剂后,正、逆反应的速率常数分别为/1k 和/1-k ,且/1k =21k ,则/1-k = 2 1-k 。
5.链反应分三个阶段进行,分别为 链的引发 , 链的传递和 链的终止 。
6. 0.1mol·kg -1的MgCl 2溶液的γ±=0.70,则其平均摩尔浓度b ±=3004.0;平均活度a ±= 0.111 。
AB k , E k -1, E a,-17. 氢氧电池的电池反应可写成以下两种形式:(1) O(l)2H (g)O (g)2H 222→+,(2) O(l)H (g)O 2/1(g)H 222→+,则E 1 = E 2,1G ∆= 22G ∆。
8. 反应)HCl(Ag(s)AgCl(s))(H 2H 2a p +=+可设计成电池: __ Pt , H 2(p )∣HCl(a )∣Ag(s) , AgCl(s)_。
9. 在双液电池中不同电解质溶液间或不同浓度的同种电解质溶液的接界处存在 液体接界 电势,通常采用加 盐桥 的方法来减少或消除。
物理化学:物理化学2 参考试卷

药学本科《物理化学》下学期参考试卷及答案一、单选题A 型题 每一题有5个选项,其中只有一个选项是正确的。
1.在等温、等压的电池反应中,当反应达到平衡时,电池的电动势 。
A .等于零B .大于零C .等于E ΘD .随温度、压力的数值而变化E .不一定2.298.15K 时,实验测得苯巴比妥钠(NaP )、盐酸和氯化钠的无限稀释摩尔电导率分别为0.00735 S ·m 2·mol -1、0.04262 S ·m 2·mol -1和0.01265 S ·m 2·mol -1,则苯巴比妥的无限稀释摩尔电导率为 。
A .0.06262 S ·m 2·mol -1B .0.04792 S ·m 2·mol -1C .0.03732 S ·m 2·mol -1D .0.02626 S ·m 2·mol -1E .0.01313 S ·m 2·mol -13.当温度一定时,某电池反应的电池电动势温度系数大于零,由此可确定电池恒温可逆放电时是 。
A .吸热B .放热C .不吸热也不放热D .先吸热后放热E .无法确定4.正离子的迁移数与负离子的迁移数之和是 。
A .大于1B .等于1C .小于1D .等于0E .不一定是多少5.金属电极、气体电极、汞齐电极可归类为 。
A .第一类电极B .第二类电极C .第三类电极D .第四类电极E .以上答案均不正确6.电解CuSO 4水溶液时,当通过的电量为2F 时,在阴极上析出Cu 的量为 。
A .0.5mol B .1.0 molC .1.5molD .2.0 molE .2.5 mol7.在下列电池中,其电池电动势与氯离子活度()Cl α-无关的是 。
A .Zn(s) | ZnCl 2(aq) || KCI(aq) | AgCl(s) | Ag(s)(共12页) 一A·2· B .Zn(s) | ZnCl 2(aq) | C12(g) | PtC .Hg(l) | Hg 2C12(s) | KCl(aq) || AgNO 3(aq) | Ag(s)D .Ag(s) | AgC1(s) | KCl(aq) | C12(g) | PtE .A 和B8.在298K 时,电池Pb(Hg) (a 1) | Pb(NO 3)2 (aq) | Pb(Hg) (a 2) 中,若a 1> a 2,则其电动势E 。
物理化学下自测题

物理化学(下)自测题一、选择题( 共15题30分)1. 2 分(3806)CaCl2摩尔电导率与其离子的摩尔电导率的关系是:( )(A) Λ∞(CaCl2) = λm(Ca2+) + λm(Cl-)(B) Λ∞(CaCl2) = ½ λm(Ca2+) + λm(Cl-)(C) Λ∞(CaCl2) = λm(Ca2+) + 2λm(Cl-)(D) Λ∞(CaCl2) = 2 [λm(Ca2+) + λm(Cl-)]2. 2 分(4050)有 4 个浓度都是0.01 mol·kg-1的电解质溶液,其中平均活度系数最大的是:( )(A) KCl (B) CaCl2(C) Na2SO4(D) AlCl33. 2 分(4234)将反应H+ + OH-=H2O 设计成可逆电池,选出下列电池中正确的一个( )(A) Pt│H2│H+(aq)‖OH-│O2│Pt(B) Pt│H2│NaOH(aq)│O2│Pt(C) Pt│H2│NaOH(aq)‖HCl(aq)│H2│Pt(D) Pt│H2(p1)│H2O(l)│H2(p2)│Pt4. 2 分(4336)298 K 时电池反应Ag +12Hg2Cl2=AgCl +Hg的∆S m为32.9 J·K-1·mol-1,电池的E=0.0193 V,则其温度系数(∂E/∂T)p为( )(A) 1.70×10-4 V·K-1(B) 3.4×10-4 V·K-1(C) 1.76×10-2 V·K-1(D) 1.1×10-6 V·K-15. 2 分(4401)已知下列两个电极反应的标准电极电位为:Cu2+ + 2e-─→Cu(s) φ1= 0.337 VCu+ + e-─→Cu(s) φ2= 0.521 V由此可算得Cu2+ + e-─→Cu+的φ 值为:( )(A) 0.184 V (B) 0.352 V (C) -0.184 V (D) 0.153 V6. 2 分(4921)电解金属盐的水溶液时, 在阴极上:( )(A) 还原电势愈正的粒子愈容易析出(B) 还原电势与其超电势之代数和愈正的粒子愈容易析出(C) 还原电势愈负的粒子愈容易析出(D) 还原电势与其超电势之和愈负的粒子愈容易析出某二级反应,反应物消耗 1/3 需时间 10 min ,若再消耗 1/3 还需时间为: ( )(A) 10 min (B) 20 min(C) 30 min (D) 40 min8. 2 分 (5554)两个一级平行反应 A k 1B ,A k 2C ,下列哪个结论是不正确的:( )(A) k 总= k 1 + k 2 (B) k 1/k 2= [B]/[C](C) E 总= E 1 + E 2 (D) t 12= 0.693/(k 1 + k 2)9. 2 分 (5651)两个活化能不相同的反应,如 E 2 > E 1,且都在相同的升温度区间内升温,则: ( )(A)21d ln d ln d d k k T T > (B) 21d ln d ln d d k k T T <(C )21d ln d ln d d k k T T = (D) 21d d d d k k T T>10. 2 分 (6005)在简单碰撞理论中,有效碰撞的定义是: ( )(A) 互撞分子的总动能超过E c(B) 互撞分子的相对总动能超过E c(C) 互撞分子联心线上的相对平动能超过E c(D) 互撞分子的内部动能超过E c11. 2 分 (6556)加催化剂可使化学反应的下列物理量中哪一个改变∶ ( )(A) 反应热 (B) 平衡常数(C) 反应熵变 (D) 速率常数12. (6352)稀溶液反应 CH 2ICOOH + SCN - → CH 2(SCN)COOH + I - 属动力学控制反应, 按照原盐效应,反应速率k 与离子强度I 的关系为下述哪一种? ( )(A) I 增大 k 变小 (B) I 增大 k 不变(C) I 增大 k 变大 (D) 无法确定关系13. 2 分 (6752)同一固体, 大块颗粒和粉状颗粒, 其溶解度哪个大? ( )(A) 大块颗粒大 (B) 粉状颗粒大(C) 一样大 (D) 无法比较已知1000 K 时,界面张力如下:γ( Al2O3(s)-g ) = 1 N·m-1,γ( Ag(l)-g )= 0.92 N·m-1, γ( Ag(l)-Al2O3(s) )= 1.77 N·m-1。
大学《物理化学》下学期试题及答案

⼤学《物理化学》下学期试题及答案⼤学《物理化学》下学期试题及答案2009-2010学年物理化学(下)复习讲义【电化学纲要】⼀、重要概念阳极、阴极,正极、负极,原电池,电解池,电导,⽐电导,(⽆限稀释时)摩尔电导率,迁移数,可逆电池,电池的电动势,电池反应的写法,分解电压,标准电极电位、电极的类型、析出电位,电极极化,过电位,电极反应的次序⼆、重要定律与公式1.电解质部分(1)法拉第定律:(2)电导,电导率,摩尔电导率,摩尔电导率与浓度关系:稀的强电解质(3)离⼦独⽴定律:⽆限稀释溶液,电解质(4)电导应⽤:i. 计算弱电解质的解离度和解离常数ii. 计算难溶盐的溶解度(5)平均活度及活度系数:电解质(6)德拜-许克尔公式:2. 原电池(1)热⼒学G= -zFES= -(,G/, T)= zF (, E/, T) ppH = G + T S = -zFE +zFT (, E/, T) pQ = T S =zFT (, E/, T) irp(2)能斯特⽅程G =zFE= -RTlnK rm(3)电极电势,电池的电动势 E = E- E,电池的写法, + -三、关键的计算题类型1.电解质溶液部分由摩尔电导率计算解离率和解离平衡常数相关的题型。
2.给出电池,写出电极反应及计算电池反应热⼒学基本函数。
这⼀类型相对容易。
3.给出反应,设计电池并计算电池反应热⼒学基本函数。
4.给出⼆个反应的基本量或若⼲个电极的电极电池,求相关反应的电动势或热⼒学量。
这类题⽐较综合。
【化学动⼒学纲要】⼀、主要概念反应速率,依时计量学反应,(⾮依时计量学反应,)消耗速率,⽣成速率,基元反应,⾮基元反应,质量作⽤定律,级数,总级数,(基元反应的)反应分⼦数,速率⽅程,半衰期,反应级数的确定⽅法(积分法,微分法,初浓度法,隔离法,半衰期法),活化能,指1前因⼦,速率常数,表观活化能或经验活化能,对峙反应,平⾏反应,连续反应,稳态处理法,平衡态近似法,单分⼦反应机理,直链反应,⽀链反应,爆炸,碰撞理论,势能⾯,反应途径,过渡状态理论⼆、主要定义式与公式1.反应速率,反应进度,⽣成速率(反应物),消耗速率(产物)。
物理化学下册复习题

某一溶液中含KBr和KI浓度均为0.1m,今将溶液放于带有Pt电极的多孔磁杯中, 将杯放在一个较大的器皿中,器皿中有一Zn电极与大量0.1m ZnCl2 溶液,设H2 在Zn上析出的过电位是0.70 V,O2 在Pt上过电位是0.45 V,不考虑溶液接界电位,Zn, I2,Br2 的析出过电位可忽略,问:(1) 析出99% 的I2 时所需外加电压是多少(2) 析出99% 的Br2 时所需外加电压是多少(3) 当开始析出O2 时,溶液中Br- 浓度是多少解:阴极上,Zn2+,H+ 可能放电:φ(Zn) = φ+ 0.02958lg[Zn2+] = -0.763 + 0.02958lg0.1 = -0.793 Vφ(H2) = φ+ 0.05915lg[H+] - η = 0.05915lg10-7 - 0.70 = -1.114 V因此,阴极上Zn首先析出.阳极上,Br-,I-,OH- 可能放电:φ(I2) = φ- 0.05915lg[I-] = 0.536 - 0.05915lg0.1 = 0.595 Vφ(Br2)= φ- 0.05915lg[Br-] = 1.066 - 0.5915lg0.1 = 1.125 Vφ(O2/OH-) = φ- 0.05915lg[OH-] + η = 0.401 - 0.5915lg10-7 + 0.45 = 1.261 V因此,阳极上放电的顺序为I-,Br-,OH- .(1) 99% 的I2 析出,[I-] = 0.1 × 1% = 10-3φ(I2) = 0.536 - 0.05915lg10-3 = 0.713 V外加电压E = φ(I2) - φ(Zn) = 0.713 - (-0.793) = 1.506 V(2) 99% 的Br2 析出,[Br-] = 0.1 × 1% = 10-3φ(Br2) = 1.065 - 0.05915lg10-3 = 1.242 V外加电压E = φ(Br2) - φ(Zn) = 1242 + 0.793 = 2.035 V(3) O2 析出时,φ(O2) = 1.261 V 1.261 = 1.065 - 0.05915lg[Br-][Br-] = 4.852 × 10-4 mol·dm-31. 气相反应是一个二级反应,当和的初始压力为时,在25℃时反应的半衰期为1h,在35℃时反应的半衰期为。
物理化学下册题库

(一)电化学 一、选择题1、正离子的迁移数与负离子的迁移数之和是( )。
A. 大于1; B. 等于1; C. 小于1; D.无法判断。
2、离子电迁移率为一定条件下的离子运动速率,即( )。
A.在温度为298K 时的离子运动速率;B.在浓度为1mol ·dm -3时的离子运动速率; C.在单位电势梯度时的离子运动速率; D.在浓度为无限稀释时的离子运动速率。
3、无限稀释的KCl 溶液中,Cl -离子的迁移数为0.505,该溶液中K +离子的迁移数为( )。
A. 0.505 ; B. 0.495; C. 67.5; D. 64.3 。
4、电解质溶液活度a B 与其离子平均活度之间的关系为( )。
A. a B = a ±ν;B.a B = a ±1/ν; C.a B =( 1/ν)a ±; D.a B =ν a ± 。
5 25℃无限稀释的KCl 摩尔电导率为130 S ﹒m 2﹒mol -1,已知Cl -的迁移数为0.505,在K+离子的摩尔电导率为(单位:S ﹒m 2﹒mol -1)( )。
A. 130; B. 0.479; C. 65.7; D. 64.35。
6、电解质溶液的离子强度与其浓度的关系为( )。
A.浓度增大,离子强度增强; B.浓度增大,离子强度变弱;C.浓度不影响离子强度;D.随浓度变化,离子强度变化无规律。
7 25 ℃时,电池反应Ag (s )+ (1/2)Hg 2Cl 2 (s) = AgCl (s) + Hg (l)的电池电动势为0.0193 V ,反应时所对应的△r S m 为32.9 J ·K -1·mol -1,则电池电动势的温度系数p T E )/(∂∂为( )。
A.1.70×10-4V ·K -1; B. 1.10×10-6V ·K -1;C.1.01×10-1 V ·K -1 ;D. 3.40×10-4 V ·K -1。
物理化学 下 考试试题及答案

t=3143 h=130.9 d
6
和
。
3.写出电池 Pt|H2(p)|HCl(b)|AgCl(s)|Ag 的阳极反应:
,
阴极反应:
。
4. 根据电极极化产生的原因,可将极化分为两类,即:
极化和
。
5. 链反应一般由和
、
和
三个步骤构成。
2
6. 由光化学第二定律可知:在光化学的初级过程中,系统每吸收 1 摩尔光子,
则活化
摩尔分子。
7. 酶催化的基本特征可概括为催化活性
0.4820 V
2.解:(1) 把 Arrhenius 方程式两边取自然对数,有:
lnk=lnA-Ea/RT
比较:ln(k
/
h 1 )
8938 T/K
20.40
Ea=8.314×8938=74.31 kJ/mol0
A=1020.40=2.512×1020
(2) k=1.135 ×104 h-1
ln1/(1-xA)= kt -ln(1-0.3)= 1.135 ×104t
()
A. 布郎运动
B. 电泳
C. 丁铎尔效应
D.沉降平衡
10. 单分子层吸附理论是由何者所提出?
()
A. Freundlich
B. Gibbs
C. BET
D. Langmuir
11. 根据 DLVO 理论,溶胶相对稳定的主要因素是: ( )
A 胶粒表面存在双电层结构 B 胶粒和分散介质运动时产生ζ电位
A. 零
B. TΔS
C. ΔH
D. -ZEF
4. 有关催化剂的性质,说法不正确的是 ( )
A. 催化剂参与反应过程,改变反应途径
物理化学下册试题及答案

物理化学下册试题及答案一、选择题(每题2分,共20分)1. 在理想气体状态方程PV=nRT中,P代表的是:A. 压力B. 体积C. 温度D. 摩尔数2. 根据热力学第一定律,系统吸收的热量与对外做功的关系是:A. 相等B. 相加C. 相减D. 无关3. 物质的比热容是指:A. 物质的热容与质量的比值B. 物质的热容与体积的比值C. 物质的热容与摩尔数的比值D. 物质的热容与温度的比值4. 化学反应的熵变是指:A. 反应物的熵与生成物的熵之差B. 反应物的熵与生成物的熵之和C. 反应物的熵与生成物的熵之比D. 反应物的熵与生成物的熵之积5. 根据吉布斯自由能变化,下列哪个过程是自发的?A. ΔG > 0B. ΔG < 0C. ΔG = 0D. ΔG ≠ 06. 电化学中,原电池放电时,阳极发生的反应是:A. 氧化反应B. 还原反应C. 既不氧化也不还原D. 既是氧化也是还原7. 物质的溶解度随温度升高而增加的是:A. 强酸B. 强碱C. 盐类D. 气体8. 根据阿伏伽德罗定律,相同温度和压力下,相同体积的任何气体含有相同数量的:A. 分子B. 原子C. 离子D. 电子9. 物质的表面张力是指:A. 物质表面分子间的吸引力B. 物质表面分子间的排斥力C. 物质内部分子间的吸引力D. 物质内部分子间的排斥力10. 根据热力学第二定律,不可能从单一热源吸热使之完全转化为功而无其他变化,这表明:A. 能量守恒B. 能量不守恒C. 能量转换效率D. 能量转换不完全二、填空题(每空1分,共20分)1. 阿伏伽德罗常数的值约为 ________ mol^-1。
2. 理想气体的内能只与 ________ 有关。
3. 一个化学反应的热效应等于反应物的总焓与生成物的总焓之________。
4. 电解质溶液的电导率与溶液的 ________ 成正比。
5. 根据范特霍夫方程,温度升高时,化学平衡向吸热反应方向移动,这是由于 ________ 效应。
物理化学第五版下册试题
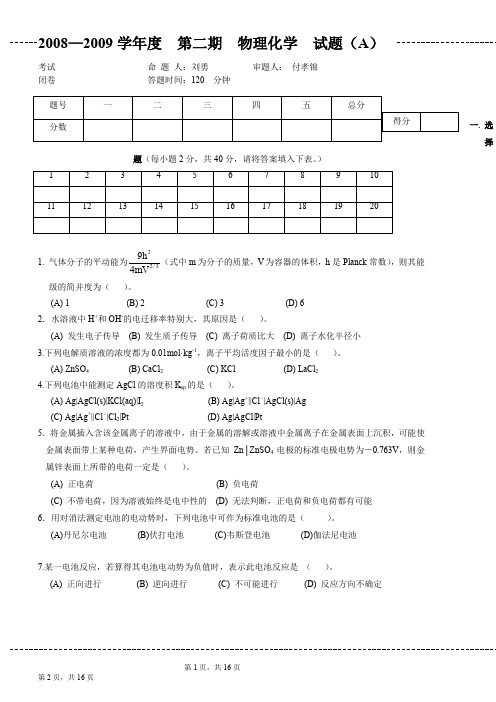
一. 选择题(每小题2分,共40分,请将答案填入下表。
)1. 气体分子的平动能为22/394h mV (式中m 为分子的质量,V 为容器的体积,h 是Planck 常数),则其能级的简并度为( )。
(A) 1 (B) 2 (C) 3 (D) 6 2.水溶液中H +和OH -的电迁移率特别大,其原因是( )。
(A) 发生电子传导 (B) 发生质子传导 (C) 离子荷质比大 (D) 离子水化半径小 3.下列电解质溶液的浓度都为0.01mol·kg -1,离子平均活度因子最小的是( )。
(A) ZnSO 4 (B) CaCl 2 (C) KCl (D) LaCl 2 4.下列电池中能测定AgCl 的溶度积K sp 的是( )。
(A) Ag|AgCl(s)|KCl(aq)|I 2 (B) Ag|Ag +||Cl -|AgCl(s)|Ag (C) Ag|Ag +||Cl -|Cl 2|Pt (D) Ag|AgCl|Pt5.将金属插入含该金属离子的溶液中,由于金属的溶解或溶液中金属离子在金属表面上沉积,可能使金属表面带上某种电荷,产生界面电势。
若已知Zn│ZnSO 4电极的标准电极电势为-0.763V ,则金属锌表面上所带的电荷一定是( )。
(A) 正电荷 (B) 负电荷(C) 不带电荷,因为溶液始终是电中性的 (D) 无法判断,正电荷和负电荷都有可能 6.用对消法测定电池的电动势时,下列电池中可作为标准电池的是( )。
(A)丹尼尔电池 (B)伏打电池 (C)韦斯登电池 (D)伽法尼电池7.某一电池反应,若算得其电池电动势为负值时,表示此电池反应是 ( )。
(A) 正向进行 (B) 逆向进行 (C) 不可能进行 (D) 反应方向不确定8.电解金属盐的水溶液时,在阴极上( )。
(A) 还原电势愈正的粒子愈容易析出(B) 还原电势与其超电势之代数和愈正的粒子愈容易析出 (C) 还原电势愈负的粒子愈容易析出(D) 还原电势与其超电势之和愈负的粒子愈容易析出9.某反应速率常数为2.31×10-2 mol -1·dm 3·s -1,反应起始浓度为1.0 mol·dm -3,则该反应半衰期为:( )。
物理化学(下)_华南师范大学中国大学mooc课后章节答案期末考试题库2023年

物理化学(下)_华南师范大学中国大学mooc课后章节答案期末考试题库2023年1.乳状液、泡沫、悬浮液等作为胶体化学研究的对象, 一般地说是因为它们参考答案:具有胶体的不均匀(多相)性和聚结不稳定性2.对于Helmholz紧密双电层模型, 下列描述中不正确的是参考答案:由于模型上的缺陷, 此双电层模型不能说明电泳现象3.电解金属盐的水溶液时, 在阴极上参考答案:还原电势与其超电势之代数和愈正的粒子愈容易析出4.1、用铜电极电解CuCl2的水溶液,在阳极上会发生:()参考答案:D、铜电极溶解5.在简单碰撞理论中,有效碰撞的定义是参考答案:互撞分子的相对平动能,在连心线上的分量超过阈能Ec6.电解时, 在阳极上首先发生氧化作用而放电的是参考答案:考虑极化后,实际上的不可逆还原电势最小者7.对于一般的化学反应,当温度升高时,下面说法正确的是参考答案:反应到达平衡的时间变短8.下列对原电池的描述哪个是不准确的参考答案:在电池外线路上电子从阴极流向阳极9.下列示意图描述了原电池和电解池中电极的极化规律, 其中表示原电池阳极的是【图片】参考答案:曲线110.一贮水铁箱上被腐蚀了一个洞,今用一金属片焊接在洞外面以堵漏,为了延长铁箱的寿命,选用哪种金属片为好?参考答案:锌片11.关于光化学反应,下列说法错误的是参考答案:光化学反应的平衡常数等于热化学反应的平衡常数12.极谱分析仪所用的测量阴极属于下列哪一种?参考答案:浓差极化电极13.在碰撞理论中,校正因子P小于1的主要原因是参考答案:空间的位阻效应14.极谱分析仪所用的测量阴极属于下列哪一种?( )参考答案:A、浓差极化电极15. 3. Na2SO4溶液的浓度为0.025 mol kg-1时,该溶液的离子强度为( )参考答案:(A) 0.075 mol kg-116.将大分子电解质 NaR 的水溶液用半透膜和水隔开,达到 Donnan 平衡时,膜外水的 pH值参考答案:大于 717.胶体粒子的 Zeta 电势是指参考答案:固液之间可以相对移动处与本体溶液之间的电位降18.用粘度法求出的相对分子质量称为参考答案:粘均相对分子质量19.一个气泡分散成直径为原来 1/10 的小气泡,则其单位体积所具有的表面积为原来的参考答案:10倍20.溶胶的电学性质由于胶粒表面带电而产生,下列不属于电学性质的是参考答案:布朗运动21.将一毛细管端插入水中,毛细管中水面上升 5 cm,若将毛细管向下移动,留了3 cm 在水面,试问水在毛细管上端的行为是参考答案:毛细管上端水面呈凹形弯月面22.在 298 K 时,已知 A 液的表面张力是 B 液的一半,其密度是 B 液的两倍。
物理化学下试题库

物理化学下试题库物理化学下试题库SANY标准化小组#QS8QHH-HHGX8Q8-GNHHJ8-目录Ⅰ.练习题................................................................................................1一、填空题..........................................................................................1二、判断题...................................................................................................5三、选择题(9)四、计算题 (46)五、简答题.............................................................................................53Ⅱ.参考答案.............................................................................................55一、填空题..........................................................................................55二、判断题 (57)三、选择题 (61)四、计算题.............................................................................................63五、简答题 (80)I 练习题一、填空题电解质溶液1. Pt|Cu 2+,Cu + 电极上的反应为Cu 2+ + e -→Cu +,当有1F 的电量通过电池时,发生反应的Cu 2+ 的物质的量为________。
物理化学下册练习题-无答案

第九章界面现象选择题1. 表面现象在自然界普遍存在,但有些自然现象与表面现象并不密切相关,例如(A) 气体在固体上的吸附 (B) 微小固体在溶剂中溶解(C) 微小液滴自动呈球形 (D) 不同浓度的蔗糖水溶液混合2. 液体的内压力和表面张力的联系与区别在于(A) 产生的原因相同而作用点不同(B) 产生的原因相同而作用的方向不同(C) 作用点相同而方向不同(D) 点相同而产生的原因不同4. 对于理想的水平液面,其值为零的表面物理量是(A) 表面能 (B) 比表面吉布斯函数(C) 表面张力 (D) 附加压力5. 表面张力是物质的表面性质,其值与很多因素有关,但是它与下列因素无关(A) 温度 (B) 压力 (C) 组成 (D) 表面积6. 对弯曲液面上的蒸气压的描述正确的是(A) 大于平面液体的蒸气压(B) 小于平面液体的蒸气压(C) 大于或小于平面液体的蒸气压(D) 都不对7. 常见的一些亚稳现象都与表面现象有关,下面的说法正确的是(A) 过饱和蒸气是由于小液滴的蒸气压小于大液滴的蒸气压所致(B) 过热液体形成的原因是新相种子──小气泡的附加压力太小(C) 饱和溶液陈化,晶粒长大是因为小晶粒溶解度比大晶粒的小(D) 人工降雨时在大气中撒入化学物质的主要目的是促进凝结中心形成8. 物理吸附和化学吸附有许多不同之处,下面的说法中不正确的是(A) 物理吸附是分子间力起作用,化学吸附是化学键力起作用(B) 物理吸附有选择性,化学吸附无选择性(C) 物理吸附速率快,化学吸附速率慢(D) 物理吸附一般是单分子层或多分子层,化学吸附一般是单分子层9. 对于物理吸附和化学吸附的关系,以下描述正确的是(A) 即使改变条件,物理吸附和化学吸附也不能相互转化(B) Langmuir吸附等温式只适用于物理吸附(C) 在适当温度下,任何气体都可在任何固体表面上发生物理吸附(D) 升高温度对物理吸附和化学吸附都有利10. 防毒面具吸附毒气而基本上不吸附氧气,这是因为(A) 毒气通常比氧气密度大(B) 毒气分子不如氧气分子活泼(C) 一般毒气都易液化,氧气难液化(D) 毒气是物理吸附,氧气是化学吸附11. Freundlish吸附等温式虽然对气体和溶液都适用,但有具体的条件限制,它不适用于(A) 低压气体 (B) 中压气体(C) 物理吸附 (D) 化学吸附12. 以下的说法中符合Langmuir吸附理论基本假定的是(A) 固体表面是均匀的,各处的吸附能力相同(B) 吸附分子层可以是单分子层或多分子层(C) 被吸附分子间有作用,互相影响(D) 吸附热与吸附的位置和覆盖度有关13. Langmuir吸附等温式有很多形式,而最常见的是θ=bp/(1+bp) ,但它不适用于(A) 多种分子同时被强吸附 (B) 单分子层吸附(C) 物理吸附 (D) 化学吸附14. 溶液表面的吸附现象和固体表面的吸附现象的明显区别是(A) 固体表面的吸附量大,溶液表面的吸附量小(B) 溶液表面的吸附量大,固体表面的吸附量小(C) 溶液表面可以产生负吸附,固体表面不产生负吸附(D) 固体表面的吸附与压力有关,溶液表面的吸附与压力无关15. 涉及溶液表面吸附的下列说法中正确的是(A) 溶液表面发生吸附后表面吉布斯函数增加(B) 溶质的表面张力一定小于溶剂的表面张力(C) 定温下,表面张力不随溶液浓度变化时,浓度增大,吸附量不变(D) 溶液表面的吸附量与温度成反比是因为温度升高,溶液浓度变小16. 表面活性剂在结构上的特征是(A) 一定具有磺酸基或高级脂肪烃基(B) 一定具有亲水基(C) 一定具有亲油基(D) 一定具有亲水基和憎水基17. 表面活性剂是针对某种特定的液体或溶液而言的,表面活性剂的实质性作用是(A) 乳化作用 (B) 增溶作用(C) 降低表面张力 (D) 增加表面张力18. 当溶液中表面活性剂的浓度足够大时,表面活性剂分子便开始以不定的数目集结,形成所谓胶束,胶束的出现标志着(A) 表面活性剂的溶解度已达到饱和状态(B) 表面活性剂分子间的作用超过它与溶剂的作用(C) 表面活性剂降低表面张力的作用下降(D) 表面活性剂增加表面张力的作用下降19. 使用表面活性物质时应当特别注意的问题是(A) 两性型和非离子型表面活性剂不能混用(B) 阳离子型和阴离子型表面活性剂不能混用(C) 阳离子型和非离子型表面活性剂不能混用(D) 阴离子型表面活性剂不能在酸性环境中使用20. 液体对光滑表面的润湿程度常用接触角来量度,下面的说法正确的是(A) θ= 0°时,液体对固体完全不润湿(B) θ= 180°时,液体对固体完全润湿(C) θ= 90°时,是润湿与不润湿的分界线(D) 0°< θ< 90°时,液体对固体润湿程度小21. 弯曲液面(非平面)所产生的附加压力(A) 一定等于零 (B) 一定不等于零(C) 一定大于零 (D) 一定小于零22. 微小晶体与普通晶体相比较,哪一性质是不正确的(A) 微小晶体的蒸气压较大 (B) 微小晶体的熔点较低(C) 微小晶体的溶解度较小 (D) 微小晶体不稳定23. 讨论固体对气体等温吸附的朗格缪尔(Langmuir) 吸附理论最重要的基本假设为:(A) 气体是处在低压下 (B) 固体表面不均匀(C) 吸附层是单分子层 (D) 吸附分子是球形的24. 对物理吸附的描述中,哪一条是不正确的(A) 吸附速度较快(B) 吸附层可以是单分子层或多分子层(C) 吸附热较小(D) 吸附力来源于化学键力,吸附一般不具选择性25. 一定条件下液体在毛细管中上升的高度与毛细管的半径(A) 无关 (B) 成正比 (C) 成反比 (D)不确定26. 若多孔性物质能被水润湿,则当水蒸气含量较大时,可首先在该多孔性物质的孔隙中凝结,这是因为(A) 平液面的蒸气压小于凸液面的蒸气压(B) 平液面的蒸气压大于凸液面的蒸气压(C) 平液面的蒸气压大于凹液面的蒸气压(D) 平液面的蒸气压小于凹液面的蒸气压27. 物理吸附与化学吸附的根本区别在于(A) 吸附力不同 (B) 吸附速度不同(C) 吸附热不同 (D) 吸附层不同28. 当在空气中形成一个半径为r的小气泡时,泡内压力与泡外压力之差为(A)2rσ(B)4rσ(C)4rσ- (D) 029. 若天空云层中小水滴的大小发生变化时,一定是(A) 大水滴变大,小水滴变小(B) 大水滴变小,小水滴变大(C) 大小水滴都变大(D) 大小水滴都变小30. 当在两玻璃板中间加入少量水后,在垂直于玻璃板平面方向上很难将其拉开,故两玻璃板间应该形成(A) 凸液面 (B) 凹液面 (C) 无液面 (D) 无法判断31. 表面活性剂是(A) 能降低溶液表面张力的物质(B) 能增加溶液表面张力的物质(C) 溶入少量就能显着降低溶液表面张力的物质(D) 溶入少量就能显着增加溶液表面张力的物质32.兰格谬尔吸附等温式只适用于(A) 单分子层吸附 (B) 双分子层吸附(C) 多分子层吸附 (D) 不能确定33. 关于表面现象的下列说法中正确的是(A) 毛细管越细, 与液体接触时界面张力越大(B) 温度越高, 增加单位表面时外界做的功越小(C) 维持体积不变的气泡埋在液面下越深, 附加压力越大(D) 同一温度下液体的饱和蒸气压越大, 其表面张力一定越小第十一章化学动力学选择题2. 关于化学反应速率的各种表述中不正确的是(A) 反应速率与系统的大小无关而与浓度的大小有关(B) 反应速率与系统中各物质浓度标度的选择有关(C) 反应速率可为正值也可为负值(D) 反应速率与反应方程式写法无关3. 用化学方法测定反应速率的主要困难是(A) 很难同时测定各物质浓度(B) 不能使反应在指定的时刻完全停止(C) 不易控制温度(D) 混合物很难分离4. 关于反应级数的各种说法中正确的是(A) 只有基元反应的级数是正整数(B) 反应级数不会小于零(C) 反应总级数一定大于对任一反应物级数(D) 反应级数都可通过实验来确定5. 关于反应分子数的不正确说法是(A) 反应分子数是个理论数值(B) 反应分子数一定是正整数(C) 反应分子数等于反应式中的化学计量数之和(D) 现在只发现单分子反应、双分子反应、三分子反应6. 关于对行反应的描述不正确的是(A) 一切化学变化都是可逆反应, 不能进行到底(B) 对行反应中正逆反应的级数一定相同(C) 对行反应无论是否达到平衡, 其正逆反应的速率常数之比为定值(D) 对行反应达到平衡时, 正逆反应速率相同7. 下述结论对平行反应不适合的是(A) 总反应速率等于同时进行的各个反应速率之和(B) 总反应速率常数等于同时进行的各个反应速率常数之和(C) 各产物的浓度之积等于相应反应的速率常数之积(D) 各反应产物的生成速率之比等于相应产物的浓度之比8. 利用活化能和温度对反应速率的影响关系能控制某些复杂反应的速率, 即所谓活化控制。
物理化学下册考试题

第八章 电化学选择题 1.离子独立运动定律适用于(A) 强电解质溶液 (B) 弱电解质溶液(C) 无限稀电解质溶液 (D) 理想稀溶液答案:C3. 在电导测量实验中, 应该采用的电源是(A) 直流电源(B) 交流电源(C) 直流电源或交流电源(D) 测固体电导用直流电源, 测溶液电导用交流电源答案:D4. CaCl 2摩尔电导率与其离子的摩尔电导率的关系是(A))()()(22-∞+∞∞Λ+Λ=ΛCl CaCaCl m m m (B))(2)()(22-∞+∞∞Λ+Λ=ΛCl Ca CaCl m m m (C))()(21)(22-∞+∞∞Λ+Λ=ΛCl Ca CaCl m m m (D))}()({21)(22-∞+∞∞Λ+Λ=ΛCl Ca CaCl m m m 答案:B5.电池Cu ∣Cu +‖Cu 2+,Cu +∣Pt 和Cu ∣Cu 2+‖Cu +,Cu 2+∣Pt 的反应均可简写作Cu+Cu 2+=2Cu +此电池的(A) θm r G ∆、θE 相同 (B)θm r G ∆相同、θE 不同(C)θm r G ∆不同、θE 相同 (D)θm r G ∆、θE 均不同答案:B6. 恒温、恒压下可逆电池放电过程(A) ΔH=Q (B)ΔH <Q (C)ΔH>Q (D)ΔH 、Q 关系不定答案:B7.298K 时,当H 2SO 4溶液的浓度从0.01mol/kg 增加到0.1mol/kg 时,其电导率κ和摩尔电导率Λm将(A) κ减小,Λm 增加 (B) κ增加,Λm 增加(C) κ减小,Λm 减小 (D) κ增加,Λm 减小答案:D8.下列电解质中,离子平均活度系数最大的是A. 0.01 mol/kg NaCl B. 0.01 mol/kg CaCl 2C .0.01 mol/kg LaCl 3 D. 0.01 mol/kg CuSO 4答案:A9.用同一电导池分别测定浓度为0.01mol/kg 和0.1mol/kg 的两个电解质溶液,其电阻分别为1000Ω和500Ω,则它们的摩尔电导率之比为(A) 1:5 (B) 5:1 (C) 10:5 (D) 5:10答案:B9.电极Tl 3+,Tl +/Pt 的电势为θ1E =1.250 V ,电极Tl +/Tl 的电势为θ2E =-0.336V ,则电极Tl 3+/Tl 的电势为θ3E 为A .0.305VB .0.721VC .0.914VD .1.586V答案:C10.LiCl 的无限稀释摩尔电导率为1241003.115-⋅⋅⨯-molm S ,在298K 时,测得LiCl 稀溶液中Li+的迁移数为0.3364,则Cl-离子的摩尔电导率()-ΛCl m 为 (A) 1241033.76-⋅⋅⨯-molm S (B) 1241003.113-⋅⋅⨯-molm S (C) 1241070.38-⋅⋅⨯-mol m S(D) 1221033.76-⋅⋅⨯mol m S答案:A11.在10cm 3、1mol/dm 3 OH 中加入10cm 3水,其电导率将(A) 增加 (B) 减小 (C) 不变 (D) 不能确定 答案:B其摩尔电导率将(A)增加 (B) 减小 (C) 不变 (D) 不能确定 答案:A12.质量摩尔浓度为b 的Na 3PO 4溶液,平均活度系数为±γ,则电解质的活度为(A) ()()44/4±=γθb b a B (B) ()()4/4±=γθb b a B (C) ()()44/27±=γθb b a B (D) ()()4/27±=γθb b a B 答案:C13. 1mol/kg 的K 4Fe(CN)6的离子强度为(A) 10mol/kg(B) 7mol/kg(C) 4mol/kg(D) 15mol/kg答案:A14.下列电池电动势与氯离子活度无关的是(A) Zn│ZnCl2(aq)‖KCl(aq) │AgCl│Ag(B) Pt│H2│HCl(aq) │Cl2│Pt(C) Ag│AgCl(s)│KCl(aq)│Cl2│Pt(D) Hg│Hg2Cl2(s)│KCl(aq)‖AgNO3(aq)│Ag答案:C15. 电解质水溶液的离子平均活度系数受多种因素的影响, 当温度一定时, 其主要的影响因素是(A) 离子的本性(B) 电解质的强弱(C) 共存的它种离子的性质(D) 离子浓度及离子电荷数答案:D16. 离子的迁移数是指正负两种离子在作电迁移运动时各自的导电份额或导电的百分数, 因此, 离子的运动速度直接影响离子的迁移数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目录Ⅰ.练习题 (1)一、填空题 (1)二、判断题 (5)三、选择题 (9)四、计算题 (46)五、简答题 (53)Ⅱ.参考答案 (55)一、填空题 (55)二、判断题 (57)三、选择题 (61)四、计算题 (63)五、简答题 (80)I 练习题一、填空题电解质溶液1. Pt|Cu 2+,Cu + 电极上的反应为Cu 2+ + e -→Cu +,当有1F 的电量通过电池时,发生反应的Cu 2+ 的物质的量为________。
2. 同一电导池测得浓度为0、01mol·dm -3的A 溶液与浓度为0、1 mol·dm -3的B 溶液的电阻分别为1000Ω与500Ω,则它们的摩尔电导率之比Λm (A)/Λm (B)等于________。
3. 已知m Λ∞(Na +)=50、11×10-4S·m 2·mol -1,m Λ∞(OH -)=198、0×10-4S·m 2·mol -1,在无限稀释的NaOH 溶液中t ∞(Na +)等于________,t ∞(OH -)等于________。
4. 25℃时,在0、002mol·kg -1CaCl 水溶液中离子平均活度系数为γ±1,在0、002mol·kg -1CuSO 4水溶液中离子平均活度系数为γ±2,则γ±1_______γ±2。
5. 已知NaAc 、NaCl 、HCl 水溶液无限稀释时的摩尔电导率分别为Λ1,Λ2,Λ3,则HAc 的摩尔电导率为________________。
6. 25℃时,1mol·kg -1的BaCl 2水溶液的γ±=0、399,则a ±= 。
7. 相同温度、相同浓度的NaCl,MgCl 2,MgSO 4的稀水溶液,其离子平均活度因子的大小就是:γ±(NaCl) γ±(MgCl 2) γ±(MgSO 4)(选填<,=,>)。
8. 电解质的离子强度定义为I = ,1 mol·kg -1的CaCl 2水溶液的I =mol·kg -1。
9. 等量的0、05 mol·kg -1的LaCl 3水溶液及0、05 mol·kg -1的NaCl 水溶液混合后,溶液的离子强度I = 。
10. 25℃时,AgCl 饱与水溶液的电导率为3、41×10-4S ·m -1,所用水的电导率为1、60×10-4S ·m -1。
则AgCl 的电导率为 。
11. 用银电极电解AgNO 3溶液,通电一段时间后,测知在阴极上析出1、15g 的Ag,并知阴极区溶液中Ag +的总量减少了0、6g,则该硝酸银溶液中离子的迁移数 t (Ag +)=_______ ,3(NO )t -=________。
已知Ag 的相对原子质量为107、9。
12. 强电解质MX 、MY 与HY 的摩尔极限电导分别为Λ1、Λ2、Λ3,则HX 的摩尔极限电导为______________。
可逆电池的电动势及其应用1. 电池Pt(s)|Cl 2(p 1)|HCl(0、1mol·kg -1)|Cl 2(p 2)|Pt(s)的负极反应 ,正极反应 ,电池反应 ,若p 1>p 2,则此电池电动势 0。
2. 电池Pb(s)| H 2SO 4(b ) | PbO 2(s)作为原电池时, 负极就是 ,正极就是 ;作为电解池时,阳极就是 ,阴极就是 。
3. Ag(s)|AgNO 3(b 1=0、01 mol·kg -1,γ±, 1=0、90)|| AgNO 3(b 2=0、01 mol·kg -1,γ±,2=0、72)|Ag(s)在25℃时的电动势E = 。
4. 若已知某电池反应电动势的温度系数()0p E T ∂∂>,则该电池可逆放电时的反应热Q r ;Δr S m 。
(选择填入>0, <0,或=0)5. 定温定压下原电池可逆放电时电池反应的焓变Δr H m Q p 。
(选填<,=,>)6. 电池的可逆电动势为E r ,若该电池以一定的电流放电,两电极的电势差为E ,则E _E r 。
7. 铅电极Pb(汞齐)(a =0、1)|Pb 2+(a =1)与Pb|Pb 2+(a =1)的电极电势分别为φ1与φ2,则φ1φ2。
8. 25℃时,电池Pb(汞齐)( a 1)|Pb(NO 3)(aq)| Pb(汞齐) (a 2)的电动势E>0,则a 1 a 2 ,电池反应为 。
9. 电池Pt|X 2(g,100kPa)|X -(a 1)||X - (a 2,)| X 2 (g,100kPa)| Pt 的电动势E >0,则a 1 a 2,,电池反应为 。
10. 对电池反应AgCl(s)+I -(aq) →AgI(s)+ Cl -(aq),所设计的原电池为 。
11. 电池Pt| H 2 (g,110kPa)| HCl(b )| Cl 2 (g,110kPa)|Pt,电池反应可写作 。
12. 电解硫酸铜水溶液时,溶液的pH 值将 。
电解与极化作用1. 电池不可逆放电时,电流密度增大,阳极的电极电势变得更 ,阴极的电极电势变得更 ,两极的电势差 ;电池不可逆充电时,电流密度增加,阳极的电极电势变得更 ,阴极的电极电势变得更 ,两极电势差 。
化学动力学基础(一)1. H 2+Cl 2→2HCl,其反应速率公式为r=K[H 2][Cl 2]1/2,总反应级数为___________。
2. 一个链反应一般包括三个基本阶段,它们就是_______________、__________________、____________________。
3. 链反应分为___链反应与 ___链反应,爆炸的原因有___________与__________。
4. 对连串反应,中间物为主产物时,为达到最大产量,反应应________。
5. 对复合反应 A →B →C,若B 就是目标产物,为提高B 的产量,应该控制___________。
若A →B 的活化能比B →C 的活化能小,同时还应控制________________。
6. 一般情况下,温度升高10K,反应速率约为原来的______倍。
7. 对于反应 A 2+B 2−→−1k A 2B 2(慢),A 2B 2−→−2k2AB(快),中间物的浓度可用______________处理得到,反应速率r AB =____________________。
8. 对于连串反应,若中间物为主产物,为得到较多的主产物,应采取的手段就是控制____________(反应温度,反应时间,反应物浓度)。
表面物理化学1. 弯曲液面的附加压力Δp 与液体的表面张力及曲率半径的关系为Δp =_________。
2. 通常以接触角θ值的大小来衡量液体对固体表面的润湿程度,若θ小于90°,称为________。
3. 为了提高农药杀虫效果,应选择润湿角(>90°, <90°) _________的溶剂。
4. 配置农药时,为了提高农药的利用率,通常配成乳状液,越分散越好。
根据学到的表面化学知识,该乳状液在作物表面上的润湿角应为_________,它与_________________________________________________ 有关。
5. 将一滴汞滴在水与苯的界面上,达平衡时其润湿角与相关表面张力的关系为:_______________________。
6. 室温时,水在一根粗细均匀的玻璃毛细管中,将上升到高度h 。
如将毛细管折断至 h /2处,水将沿壁升至 _______ 处,此时管中水面的曲率半径将 _________ 。
7. 半径为R 的球形肥皂泡内的附加压力就是_________。
8. 液滴的半径越小,饱与蒸气压越_________,液体中的气泡半径越小,气泡内液体的饱与蒸压越_____。
9. 憎液固体,其表面不能被液体所润湿,其相应的接触角θ_____90°。
10. 相同温度下,同一液体,随表面曲率半径不同具有不同的饱与蒸气压,若以p 平、p 凹、p 凸分别表示平面、凹面、凸面液体上的饱与蒸气压,则三者的关系就是_________。
11. 加入表面活性剂,使液体的表面张力_________,表面活性剂在溶液表面的浓度一定_________它在体相的浓度。
12.润湿液体在毛细管中上升的高度与毛细管内径成_________关系,与液体的表面张力成_________关系。
13.温度升高时,纯液体的表面张力_________。
14.在讨论固体对气体等温吸附的兰格谬尔理论中,最重要的基本假设为:吸附就是_________层的。
15.表面活性物质在结构上的特点就是同时具有_________基与_________基。
ngmuir吸附等温式为_______________________,适用于_____________吸附。
胶体分散系统与大分子溶液1.分散相粒子直径在________范围内的分散体系称为胶体分散体系。
2.氢氧化铁溶胶显_________色,胶粒直径的大小在_________m之间。
由于氢氧化铁溶胶胶粒带_________电荷,所以通过直流电时,在_________附近颜色逐渐变深。
3.丁达尔效应就是光_________所引起的,其强度与入射光波长的_____次方成______比例。
4.乳状液的类型可以分为_________与_________两类。
5.KI与AgNO3形成溶胶时,KI过量或AgNO3时,形成的胶团结构式为__________________或__________________。
6.KI与过量的AgNO3形成溶胶,该溶胶电泳时胶粒向_______移动;在KCl、KCO3、K3Fe(CN)6三种电解质中,对该溶胶聚沉能力最大的就是_________。
7.丁达尔效应的本质就是__________________________________。
8.布郎运动就是_________________________________________。
9.胶体系统的动力性质为(1)____________________,(2)____________________,(3)___________________。
10.溶胶(憎液胶体)的主要特征就是: 的; 的;热力学的均相系统。
大分子溶液(亲液胶体)的主要特征就是的; 热力学的均相系统。
