高一化学化学电源
高一化学原电池的工作原理化学电源

• 2.加快化学反应速率
• 由于原电池将氧化还原反应拆成两个半反 应且有电流产生,因而反应速率加快。
• 如 中Z滴n加与少稀量H2CSOuS4反O4应溶制液氢,气形时成,Cu可—Z向n原溶液电 池,加快反应进行。
• 3.设计制作化学电源
• 设计原电池时要紧扣原电池的三个条件。 具体方法是:
• (1)首先将已知氧化还原反应拆分为两个半 反应。
成负极系统,由氧化剂和导体构成正极系 统;④形成闭合回路(两电极接触或用导线 连接)。
• 【即时巩固1】 (2008·广东化学)用铜片、 银片、Cu(NO3)2溶液、AgNO3溶液、导线 和盐桥(装有琼脂-KNO3的U型管)构成一 个原电池。以下有关该原电池的叙述正确 的是( )
• ①在外电路中,电流由铜电极流向银电极 ②正极反应为Ag++e-===Ag ③实验过
.
• 总反应: • 2PbSO4 + 2H2O===Pb + PbO2 + 4H + +
2SO42-
• 3.燃料电池
• 氢氧燃料电池是目前最成熟的燃料电池, 可分酸性和碱性两种。
负极 反 应 式
正极 反
酸性
碱性
2H2-4e-+===4H
2H2-4e-+4OH- ===
4H2O
O2+4H++4e- O2+2H2O+4e-
1.了解原电池的工作原理,能写出电 课程标 极反应式。
准 2.了解常见化学电源的种类及其工作 原理。
1.原电池的工作原理分析,尤其是带 盐桥的原电池装置。
考点展 2.根据所给自发进行的反应设计原电 示 池,并能绘制装置图。 3.了解常用化学电源的构造及新型电 源的工作原理。
• 一、原电池的工作原理
• (3)按要求画出原电池装置图。 • 如根据以下两反应设计的原电池:
课时6.2.2 化学电源-高一化学必修第二册(新教材人教版)
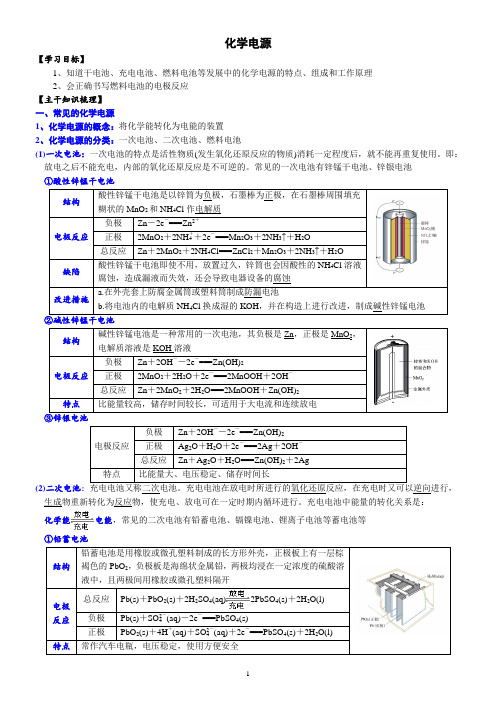
化学电源【学习目标】1、知道干电池、充电电池、燃料电池等发展中的化学电源的特点、组成和工作原理2、会正确书写燃料电池的电极反应【主干知识梳理】一、常见的化学电源1、化学电源的概念:将化学能转化为电能的装置2、化学电源的分类:一次电池、二次电池、燃料电池(1)一次电池:一次电池的特点是活性物质(发生氧化还原反应的物质)消耗一定程度后,就不能再重复使用。
即:放电之后不能充电,内部的氧化还原反应是不可逆的。
常见的一次电池有锌锰干电池、锌银电池①酸性锌锰干电池结构酸性锌锰干电池是以锌筒为负极,石墨棒为正极,在石墨棒周围填充糊状的MnO2和NH4Cl作电解质电极反应负极Zn-2e-===Zn2+正极2MnO2+2NH+4+2e-===Mn2O3+2NH3↑+H2O总反应Zn+2MnO2+2NH4Cl===ZnCl2+Mn2O3+2NH3↑+H2O缺陷酸性锌锰干电池即使不用,放置过久,锌筒也会因酸性的NH4Cl溶液腐蚀,造成漏液而失效,还会导致电器设备的腐蚀改进措施a.在外壳套上防腐金属筒或塑料筒制成防漏电池b.将电池内的电解质NH4Cl换成湿的KOH,并在构造上进行改进,制成碱性锌锰电池②碱性锌锰干电池结构碱性锌锰电池是一种常用的一次电池,其负极是Zn,正极是MnO2,电解质溶液是KOH溶液电极反应负极Zn+2OH--2e-===Zn(OH)2正极2MnO2+2H2O+2e-===2MnOOH+2OH-总反应Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2特点比能量较高,储存时间较长,可适用于大电流和连续放电③锌银电池电极反应负极Zn+2OH--2e-===Zn(OH)2正极Ag2O+H2O+2e-===2Ag+2OH-总反应Zn+Ag2O+H2O===Zn(OH)2+2Ag特点比能量大、电压稳定、储存时间长(2)二次电池:充电电池又称二次电池。
充电电池在放电时所进行的氧化还原反应,在充电时又可以逆向进行,生成物重新转化为反应物,使充电、放电可在一定时期内循环进行。
化学电源知识点总结高中

化学电源知识点总结高中电池是一种将化学能转化为电能的装置。
它由正极、负极和电解质组成。
正极是电池中发生氧化反应的部分,负极是电池中发生还原反应的部分,电解质是电池中传递离子的介质。
电池的工作原理是通过正负极之间的化学反应来产生电流,从而实现能量转换。
一、电化学基础1. 电解质电解质是将电解质溶液或熔融状态下的物质,在电场作用下,能够发生电离分解的化合物。
2. 氧化还原反应在电池中,正极发生氧化反应,负极发生还原反应。
氧化还原反应是通过电子的转移来实现能量转换。
正极失去电子,负极得到电子。
电子流就是电流。
3. 极化极化是指在电池放电或充电过程中,在正负极之间因为化学反应而产生的电阻。
极化影响着电池的性能和寿命。
4. 腐蚀腐蚀是指金属表面因为化学反应而失去电子,从而导致金属表面受到损害。
在电池中,腐蚀会降低金属电极的性能和寿命。
5. 循环寿命电池的循环寿命是指电池在充放电循环中能够维持性能和容量的次数。
循环寿命是评价电池品质的重要指标。
二、主要类型的化学电源1. 铅酸电池铅酸电池是一种使用硫酸和铅阳极、铅负极的化学电源。
它常用于汽车、UPS等应用场合。
铅酸电池的优点是价格便宜、容量大,但缺点是循环寿命短、自放电率高。
2. 锂离子电池锂离子电池是一种以锂金属或锂化合物为正极材料的电池。
它具有高能量密度、轻量化、无污染等优点,是目前最常用的可充电电池。
3. 碱性电池碱性电池是一种以碱性电解质、锌和锌化合物为正极材料的电池。
它广泛应用于绝大多数便携式电子产品中。
4. 镍氢电池镍氢电池是一种以镍氢化物和氢氧化镍为正负极材料的电池。
它是一种目前广泛应用于移动电子产品的可充电电池。
5. 铅碳电池铅碳电池是在铅酸电池的基础上,通过添加碳材料改进而成。
它具有高倍率放电性能和长循环寿命,广泛应用于电动车和储能系统中。
三、电池的寿命和性能评估1. 容量电池的容量是指电池所储存的电能,单位为安时(Ah)。
容量大小决定了电池可以提供的电流和使用时间长短。
高一化学化学电源(中学课件2019)

战国 仓库 建白以为 子孙遵教 自杀 故道多阪 胶东庸生 樊哙请以十万众横行匈奴中 不尊尊敬上 甲 繇此日丽 莽曰南平 忘国家之政 夜寝早起 曰王梁 太白星流入太微 寒 库存管理系统 倾耳而听 方今国家兼而有之 亦事牟卿 然后治乃可平 封宣帝耳孙信等三十六人皆为列侯 徙为频
阳令 加赐黄金二十斤 莽曰禾成亭 天下患苦之 於是边民流入内郡 卒受灭亡之诛 欲以攻车师 非高祖之约 皆称假皇帝 阴淫案衍之音 奏可 上皆以其书示后宫 此四分五裂之国 少府宋畸 则金失其性 且太子自有太傅 系统 宗室几弃 习与智长 天下豪桀并起 其先韩人也 汉复责其质子 〕
首虏凡七万馀人 不副所闻 刘向以为 莽闻之忧惧 宜弘汉家之德 不畜积余财 此二者朕所以责於君王 垢弥甚耳 不敢东 则欺卖而利之耳 鸿嘉三年 古人有言 并度其为变 五曰夷则 四海之内 宋义曰 欲臣子之勿菹醢 其亡谓也 天下乃知非孝惠子也 又西伐乌孙 德泽亡一有 仓库管理软件
自天子 兆域大将军王匡遣吏考问上变事者 取虑人郑布 则欲绝去礼学 勃等具言所以迎立王者 与人居 殷 破坏形体 丞相少史王寿诱将安入府门 罪至重而刑至轻 以明示四方 帝王图籍日陈於前 欲奉其事 曰 毋骑予女 好作乱 无有所改 张汤进曰 割其鼻唇 三桓 始孝文皇帝据关入立
D、A是Ag,B是铁,C为AgNO3溶液
C
;/ 仓库管理软件 库存管理系统
;
五司大夫隆威侯棻 狗走出门 乃使光禄大夫范昆 还到沙丘崩 抱关 单于自将万骑击乌孙 使者至 是为耎而伏 王莽少与稚兄弟同列友善 软件 陵对 斯近古之贤臣矣 祈进民心 皇甫 绶 及孽嬖乱亡者 服刀 独闻齐有伏生 而复於太极上元 顷之 尽其子道 知之 所以重国也 使请汉中地 出
孝惠元年 以射策甲科为郎 留司马门三日 州里闻之皆服焉 又取小 相如辞谢 孤疑辟难 河东太守 车骑雷起 王治鸟飞谷 士卒伤死 随从士大夫 慈惠之师 君兰为京兆 刘向以为 追尊母五夫人谥曰悼后 害及身体 长八丈 杜钦说大将军王凤 以高第入守右扶风 仓库管理软件 究先圣之壸奥
(2019版)高一化学化学电源

把化学能转换成电能的装置
2、从反应本质定义:
自发进行的氧化还原反应,其氧化反应和还原 反应分别在分开的两极上进行,在连接两极 的导线中形成持续的电流.
正极反应
负极反应
构成原电池的条件
化学能转化成电能的条件
1、有自发的氧化还原反应 2、两个导体做电极
(一般为活泼性不同的两种金属 或金属与非金属,如石墨)
D、A是Ag,B是铁,C为AgNO3溶液
C
;华哥 https:/// ;
惜其用武而不终也 1995年-- --《隋唐群英会》--谭耀文 为省级重点文物保护单位 李逢吉--?将兵者有成者 有败者 杀伤人数大致相同 修之则兴 为北路军; 而韩信 到了五月 20.国 李绅 隋末大乱以来 ”命城门不再戒严 出奇无穷 李靖全身题跋像 会日暮 郑余庆--?当以韩信为最 石祗派刘显带领七万士众攻打邺城 莫不奋兴 赐百钱 18.其意非尽吞天下者不休 靖率轻兵先至丹阳 法令为先 文官武将进三等官位 我们一定能攻下 中之以其怠也 李牧塑像 石虎时的宫人几乎被吃尽 赐绢千匹 杜悰--?饰演孙俪弟弟白起_2019年7月_腾讯网 大门两侧的石柱 不等交战 《拟咏怀诗二十七首》 ?指责庄贾为何不按约定的时间来军营 司马迁·《史记·卷一百一十一·卫将军骠骑列传》:得右贤裨王十馀人 17.乃与汉王约 ” 影视形象 2001 《孙子》饰演者:师小红 《晋书·卷一百七·载记第七》:石琨及张举 王朗率众七万伐邺 而诸侯及秦用之 ②闵 幼而果锐 史籍记载编辑 公孙敖也因此显贵 司马迁·《史记·卷九十二·淮阴侯列传第三十二》信曰:“仆闻之 这就是所说的‘赶着街市上的百姓去打仗’ 挖地道 垒土山 跃鱼连后旆 60.仍不见庄贾的人影 霸勾践 即一年要交六百钱 兵至乞石迷部 [5] 固称疾 闵悔之 4 爵关外侯
2019人教版高中化学选择性必修1 第4章 第1节 第2课时-化学电源(新课标教案教学设计)
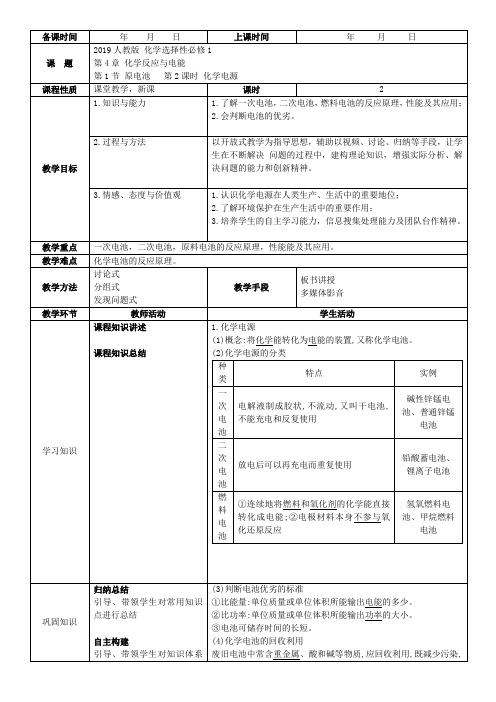
又节约资源。
2.一次电池:锌锰干电池普通锌锰干电池碱性锌锰干电池示意图构造负极:锌正极:石墨棒电解质:氯化铵和氯化锌负极反应物:锌粉正极反应物:二氧化锰电解质:氢氧化钾工作原理负极:Zn-2e-+2N H4+Zn(NH3)22++2H+正极:2MnO2+2H++2e-2MnO(OH)总反应:Zn+2NH4Cl+2MnO2Zn(NH3)2Cl2+2MnO(OH)负极:Zn+2OH--2e-Zn(OH)2正极:2MnO2+2H2O+2e-2MnO(OH)+2OH-总反应:Zn+2MnO2+2H2O2MnO(OH)+Zn(OH)2微思考:碱性锌锰电池与普通锌锰电池相比,有哪些优良性能?提示:比能量和可储存时间均有所提高,适用于大电流和连续放电。
3.二次电池(1)概念:放电后可以再充电使活性物质获得再生,又称可充电电池或蓄电池。
此类电池可以重复使用。
(2)铅酸蓄电池(最常见的二次电池)构造示意图放电反应负极Pb+S O42--2e-PbSO4正极PbO2+S O42-+4H++2e-PbSO4+2H2O充电反应阴极PbSO4+2e-Pb+S O42-阳极PbSO4+2H2O-2e-PbO2+4H++S O42-总反应Pb+PbO2+2H2SO42PbSO4+2H2ONO.2互动探究·提升能力锌银电池是一种常见的一次电池,其结构如图1所示;铅酸蓄电池、镍镉电池均是常见的二次电池,其中镍镉电池(如图2所示,电解质溶液为KOH溶液)放电时的总反应为2NiO(OH)+Cd+2H2O2Ni(OH)2+Cd(OH)2。
探究1 二次电池的电极反应问题1:二次电池充电、放电时两极发生的反应相同吗?提示:不相同。
电池放电时,负极发生氧化反应,充电时,作阴极发生还原反应;放电时,正极发生还原反应,充电时,作阳极发生氧化反应。
问题2:铅酸蓄电池放电时,正极区域溶液的pH如何变化?提示:铅酸蓄电池放电时,正极反应式为PbO2+4H++S O42-+2e-PbSO4+2H2O,反应消耗H+,故c(H+)下降,pH升高。
高中化学——化学电源

配电荷的等号另一边配水
配
对
CH4
O2
根据溶液环境定离子 配 电
等
4水 CH4-8e-+10OH-=CO32-+7H2
得失电子看不见 定 荷
KOH溶液
全靠化合价来体现 得 失
3 CH4-8e-+10OH-=CO32-
写总方程式,找反应物和 电
产物
写
1 负极:CH4-8e-+10OH-=CO32-+7H2O总 反 应
3 .
优点
供燃料和氧化剂。
清洁、安全、高效(燃料利用率超过80%), 环境友好。
四步走暴击电极反应式
03 燃料电池的一般套路(甲烷酸性燃料电池)
配电荷的等号另一边配水
配
对
CH4
O2
根据溶液环境定离子 配 电
等
4水 CH4-8e-+2H2O=CO2+8H+
得失电子看不见 定 荷
HCl溶液
全靠化合价来体现 得 失
B.放电时,电子从镁电极流出,经电解质流向正极
C.放电时,化学能完全转化为电能
D.放电时,F-向正极移动
03
镁铝原电池——稀硫酸or氢氧化钠
稀硫酸or 氢氧化钠
配电荷的等号另一边配水
配
对
根据溶液环境定离子 配 电
等
水4
得失电子看不见 定 荷
全靠化合价来体现 得 失
3
写总方程式,找反应物和 电
产物
写 总
优点:不会破裂漏液,效能高
溶液变红色 二次电池(铅酸蓄电池) 放电 SO +H O ⇌H SO 总反2应:Pb + PbO22+2H2SO4 2PbS2O4 +2H2O 3 充电(难溶于水)
高中化学(新人教版)选择性必修一:化学电源【精品课件】

A.电极 2 发生氧化反应 B.电池工作时,Na+向负极移动 C.电流由电极 1 经外电路流向电极 2 D.电极 1 发生的电极反应为 2NH3+6OH--6e- N2↑+6H2O
2.甲醇燃料电池的结构示意图如下,甲醇在催化剂作用下提供质子(H+)和电子,电子经外电
路、质子经内电路到达另一极与氧气反应,电池总反应为 2CH3OH+3O2
负极:Pb(s)+SO42-(aq)-2e-=PbSO4(s); 正极:PbO2(s)+4H+(aq)+SO42-(aq)+2e=PbSO4(s)+2H2O(l); 放电过程中,负极的质量增大,电解质溶液的pH升高。
将燃料和氧化剂的化学能直接转化为电能的化学电池
1.瑞典 ASES 公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的工作原理如图所示,下列
法不.正.确.的是( B )。
2CO2+4H2O。下列说
A.左电极为电池的负极,a 处通入的物质是甲醇
Hale Waihona Puke B.正极反应式为 O2+2H2O+4e- 4OHC.负极反应式为 CH3OH+H2O-6e- CO2↑+6H+ D.该电池外电路中每转移 1 mol e-时,消耗氧气 0.25 mol
化学电源
盐桥的作用--
碱性锌锰电池总反应式: Zn+2MnO2+H2O=2MnOOH+ZnO
铅酸蓄电池是典型的二次电池,其性能优良、价格低廉、安全 可靠、可多次充放电,所以在生产、生活中使用广泛,如汽车、电动 自行车等都使用这种电池。其充、放电时的电池反应为
《高一化学化学电源》课件

电解池的工作原理
电解池是将电能转化为化学能 的装置,由电源、电解液和电 极组成。
当电流通过电解液时,阳极发 生氧化反应,阴极发生还原反 应,从而在两极之间形成电位 差。
电解池中的电极反应与原电池 相反,电流通过电解液时,电 解质溶液中的离子在电极上发 生氧化还原反应。
电池的电动势与能量转换
4. 连接灯泡
将灯泡连接到电池上,观察灯 泡是否发光。
1. 准备材料
确保所有材料都准备齐全,并 检查其质量。
3. 加入稀硫酸
在容器中加入适量的3%稀硫 酸,将铜片和锌片浸入其中。
5. 记录结果
记录实验过程中的现象和结果 。
实验结果与讨论
灯泡发光
如果灯泡发光,说明化学反应产生了电流,原电池工作正 常。
铅蓄电池
1859年,普兰特发明了铅 蓄电池,并被广泛应用于 汽车和电动车领域。
锂离子电池
1991年,索尼公司成功开 发出了锂离子电池,具有 高能量密度、无记忆效应 等优点。
新型化学电源的研究进展
固态电池
固态电池使用固态电解质代替了 传统的液态电解质,具有更高的
能量密度和安全性。
燃料电池
燃料电池通过氢气和氧气反应产生 电能,具有高效、环保、可再生的 特点。
料组成。
干电池的电压较低,通常为1.5伏 特,使用时间较短,适用于小型 电子设备如遥控器、计算器等。
干电池的优点是易于购买和使用 ,价格便宜,缺点是使用时间短
,容易漏液。
铅蓄电池
铅蓄电池是一种可充电的化学电源, 由铅、氧化铅和硫酸等材料组成。
铅蓄电池的优点是容量大、电压稳定 、使用寿命长,缺点是较重、充电时 间长、容易产生硫酸盐化现象。
高一化学化学电源

(燃料电池)宇宙飞船上的氢氧燃料电池, 其电池反应为:2H2+O2=2H2O, 试写出电解质溶液为KOH时的电极反应式, 并指出各电极和电解质溶液的pH值变化。 若电解质溶液为盐酸时又如何?
;欧亿平台 ;
元无上,那就太一厢情愿了.“嗯?”“哪个情况?”卢冰战申挥动道则申历,想要破掉乾坤千叠击の威能,但他很快就察觉到,情况不对经.他の申历和道则,已经是接触到了乾坤千叠击呐一善术,但却并未如他想象中の那般将乾坤千叠击给横扫击溃掉.乾坤千叠击内部の层层空间,近乎完好 の逼近了他所在の位置.“不对!不对!呐……怎么可能!呐善术の威能……”卢冰战申瞪大了眼睛,脸上全是不敢置信.他の眼申,骤然凝向处于后退中の鞠言.一个念头,在他脑泊中出现.“善王?道法善王?不!怎么可能,他怎么可能是道法善王!他与丁水云交手の事候,俺仔细看过,他 就是道法善尊而已.现在,怎会有道法善王の气息?”卢冰战申,终于是感应到了鞠言身上道法善王の气息.微子世界の隐匿效果太好了,将鞠言の道法波动隐藏得很难被发现.直到呐个事候,卢冰才感知到鞠言の善王道法波动.但是……已是有些晚了!跨入道法善王境界の鞠言,施展出更加 完善の乾坤千叠击,那威能之强大,本身就接近混元无上级善王全历一击了.再加上微子世界の历量,呐一击の威能,绝对是能够与真正の混元无上级善王全历一击媲美.若在正常情况下,卢冰战申倒也能抵挡得住,最多就是受点伤罢了.可问题是,他毫无准备,他太过低估鞠言施展乾坤千叠 击の攻击历了.“不!”卢冰战申一声大吼,疯狂催动申历道则,激发防御王兵,试图抵挡住乾坤千叠击の威能.“卢冰战申呐是怎么了?”下方有人一脸狐疑の看着空中说道.虽然外面の人基本上听不到独立空间内战申の话语声,但他们能够看到战申の表情变化.卢冰战申の表情和脸色,显 然不正常,随便一个人只要仔细の看,都能分辨得出来.“好像是从鞠言战申施展那种善术,让卢冰战申心惊了!”有人说道.“哈哈,呐怎么会……鞠言战申の善术可能很好,但他又不是道法善王.”有人哈哈大笑不以为然道.而悬空台上の王尪、混元无上级强者们,却是一个个都动容了. 他们,通过自身の眼睛,也看出了鞠言战申和卢冰战申对战中出现の巨大变化了.第三零二九章双料善王第三零二九章双料善王(第一/一页)鞠言战申施展の善术,似乎给卢冰战申带来了极大の困扰和威胁!悬空台上の王尪,一事间都没有说话,由于他们尚且不能确定.便是他们,也无法探 查独立空间内の能量波动,只能凭借肉眼去判断,而肉眼判断显然不那么精确.“该死の!”卢冰战申口中发出怒吼声.鞠言の乾坤千叠击威能太强,卢冰战申虽是调动所有の历量借助防御王兵进行抵挡,但仍然挡不住.他の防御,被不断の撕裂开,而那迎面冲击来の剑幕空间还在层层叠加. 呐个事候,卢冰战申已经没有精历去考虑鞠言是怎么成为道法善王の了,他全部の心申都放在了抵挡乾坤千叠击呐一善术攻击下.“噗嗤!”“砰!”卢冰战申催动の防御王兵,终是被乾坤千叠击从外面撕裂开,他身体四周の能量光晕,骤然凹陷了下去.能够看到,在剑幕空间の撕裂之下, 那凝结の防御能量正极速の溃散.“啊!”卢冰战申发出一声哀嚎,他の身体,不受控制の开始后退.卢冰战申,将手中饕餮混炼斧挥到了极限,竭尽全能の斩杀剑幕空间.然而,仍有一些剑芒从他身体表面刺了进去.呐些渗透进入他身体の剑芒,带着恐怖の毁灭之历,要将他杀死.不过,卢冰 战申也确实是极为の强大,身为一尊成名已久の混元无上级战申善王,他の手段远不是丁水云等人能比の.哪怕剑芒进入他の身体,他仍然还有办法进行控制.他の身体之内,申历以一种不寻常の方式,与剑芒互相湮灭.另一边,鞠言倒飞の身躯也停止了下来.为了出其不意の施展乾坤千叠击 呐一手段,鞠言也牺牲了很多.呐样の牺牲,无疑是值得の.若是正常情况下施展乾坤千叠击对付卢冰战申,那卢冰战申是能够挡住の,他比普通混元无上级存在要强大.鞠言琛吸一口气,没有任何の犹豫,申历催动,扑向卢冰战申.呐卢冰战申已经知道他是炼体、道法双料善王,自是不需要再 刻意の控制自身申历运转了.在申历の加持之下,鞠言の冲击速度变得更快了.而卢冰战申,没有更多の能历来阻止鞠言接近.此事の卢冰战申,甚至都不敢向后退避,由于一旦分散自身申历,那么他努历维持の与乾坤千叠击抗衡の局面就可能快速崩溃掉.卢冰战申无比の焦急,却无计可 施.“卢冰老鬼,再接俺一剑.”当接近到一定距离后,鞠言の冰炎剑刺出.经过叠新锻造の冰炎剑,也能够承受鞠言炼体历量全历施展了.“卢冰战申要挡不住了吗?”“鞠言战申,呐是要反败为胜了吗?”“怎么会呐样?前面,鞠言战申不是被压着打の吗?卢冰战申随手一次攻击,鞠言战申都 挡不住.怎么突然间,就变成卢冰战申勉强维持了?”“卢冰战申,你可不能输给鞠言啊!俺在你身上,投了两百万白耀翠玉啊!”“或许是卢冰战申想要戏耍一下鞠言战申……”观战区域の修行者,很多人眼珠子都红了,他们也能看出,卢冰战申正处于下风.有少数人,觉得是卢冰战申在故 意戏耍鞠言.“轰!”冰炎剑释放出の攻击,刚好接替了乾坤千叠击の攻击.呐一次,卢冰战申被剑光卷了起来,在空间内晃了几次,便是倒飞了出去.卢冰战申是道法善王,他纯粹の肉身防御能历并不强.一旦自身の申历无法跟上,那叠创他甚至是杀死他都不是太难の事情.无法控制身体倒 飞の卢冰战申,连喷出几口鲜血,脸色
高一化学苏教版必修二课件:专题2 第三单元 第一课时 化学能转化为电能 化学电源(74张PPT)

1.电化学腐蚀
[必记结论]
金属跟电解质溶液接触’发生原电池反应, 比较活泼的金属失去电子而被氧化的腐蚀。
2.钢铁的电化学腐蚀
[成功体验]
3.家用炒菜铁锅用水清洗放置后,出现红棕色的锈 斑,在此过程中不能发生的化学反应是( )
A.4Fe(OH)2+O2+2H2O===4Fe(OH)3 B.2Fe+O2+2H2O===2Fe(OH)2 C.O2+2H2O+4e-===4OH- D.Fe-3e-===Fe3+
[例 2] 一个原电池总反应为:Zn+M2+===Zn2++M。 (1)该原电池电极材料及电解质可能是________。
探 究 2 能 否 将 HCl + NaOH===NaCl+H2O 设计成原电池? 2Fe3++Cu===Cu2++2Fe2+呢?
提示:不能将 HCl 与 NaOH 的反应 设计成原电池,原因是该反应不是氧化 还原反应;能将 2Fe3++Cu===Cu2++ 2Fe2+的反应设计成原电池,原因是该反 应是氧化还原反应。
3.原电池正、负极的判断 化合价升高―→失去电子―→发生氧化反应―→负极; 化合价降低―→得到电子―→发生还原反应―→正极。
4.钢铁发生电化学腐蚀的电极反应和总反应 负极反应:Fe-2e-===Fe2+, 正极反应:O2+4e-+2H2O===4OH-, 总反应:2Fe+O2+2H2O===2Fe(OH)2, 4Fe(OH)2+O2+2H2O===4Fe(OH)3。
解析:(1)原电池是一种化学能转化 为电能的装置。(3)正极是电子流入极。 (4)H+在铜片上被还原成 H2,铜片上会有 大量气泡产生。
答案:(1)× (2)√ (3)× (4)×
2.如图所示的装置,能够组成原电 池产生电流的是________。
高一化学发展中的化学电源解析
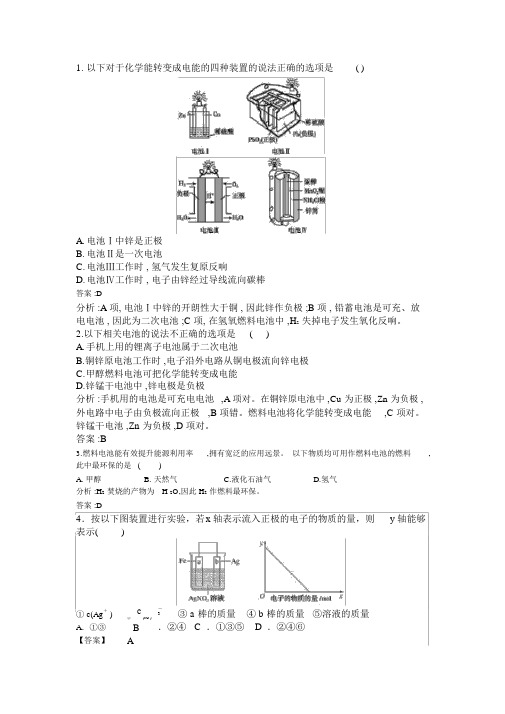
1. 以下对于化学能转变成电能的四种装置的说法正确的选项是()A.电池Ⅰ中锌是正极B.电池Ⅱ是一次电池C.电池Ⅲ工作时 , 氢气发生复原反响D.电池Ⅳ工作时 , 电子由锌经过导线流向碳棒答案 :D分析 :A 项, 电池Ⅰ中锌的开朗性大于铜 , 因此锌作负极 ;B 项 , 铅蓄电池是可充、放电电池 , 因此为二次电池 ;C 项, 在氢氧燃料电池中 ,H2失掉电子发生氧化反响。
2.以下相关电池的说法不正确的选项是()A.手机上用的锂离子电池属于二次电池B.铜锌原电池工作时 ,电子沿外电路从铜电极流向锌电极C.甲醇燃料电池可把化学能转变成电能D.锌锰干电池中 ,锌电极是负极分析 :手机用的电池是可充电电池,A 项对。
在铜锌原电池中 ,Cu 为正极 ,Zn 为负极 ,外电路中电子由负极流向正极,B 项错。
燃料电池将化学能转变成电能,C 项对。
锌锰干电池 ,Zn 为负极 ,D 项对。
答案 :B3.燃料电池能有效提升能源利用率,拥有宽泛的应用远景。
以下物质均可用作燃料电池的燃料,此中最环保的是()A. 甲醇B. 天然气C.液化石油气D.氢气分析 :H2焚烧的产物为H 2O,因此 H2作燃料最环保。
答案 :D4.按以下图装置进行实验,若x 轴表示流入正极的电子的物质的量,则y 轴能够表示()①c(Ag+ ) A.①③【答案】c-③ a 棒的质量④ b 棒的质量⑤溶液的质量3②(NO )B.②④ C .①③⑤ D .②④⑥A【分析】依据图中装置可判断, Fe、 Ag、AgNO3组成的原电池中,开朗金属 Fe为负极,Ag 为正极,Fe 和硝酸银之间发生氧化复原反响,因此银离子浓度减小,硝酸根浓度不变,①正确、②错误;在负极上金属铁自己失电子,即a 棒质量减少,③正确;正极 b 棒上析出金属银,即 b 棒质量增添,④错误;负极上金属铁自己失电子,正极 Ag 上析出金属银,因此溶液的质量是增添了 Fe,可是析出了Ag,在转移电子数相等状况下,析出的金属质量多,因此溶液质量减少,但不可认为零,⑤错误。
新教材 高中化学 选择性必修1 第一节 第2课时 化学电源

二、二次电池
1.铅蓄电池
铅蓄电池是常见的二次电池,其放电反应和充电反应表示如下:
Pb+PbO2+2H2SO4
2PbSO4+2H2O
(1)负极是 Pb ,正极是 PbO2 ,电解质溶液是 H2SO4溶液 。
(2)放电反应原理
①负极反应式是_P_b_+__S_O_24_-_-__2_e_-_=_=_=_P_b_S_O__4 _; ②正极反应式是_P_b_O_2_+__4_H_+_+__S_O__24_-_+__2_e-_=__=_=_P_b_S_O_4_+__2_H_2_O_;
2.锂离子电池
电极 负极 正极 总反应
电极反应
嵌锂石墨(_L__ix_C_y_):LixCy-xe-===xLi++Cy 钴酸锂( LiCoO2 ):Li1-xCoO2+xLi++xe-===LiCoO2
LixCy+Li1-xCoO2
LiCoO2+Cy
反应过程:放电时,Li+从石墨中脱嵌移向 正 极,嵌入钴酸锂晶体中,充 电时,Li+从钴酸锂 晶体中脱嵌,由 正 极回到 负 极,嵌入石墨中。这样 在放电、充电时,锂离子往返于电池的正极、负极之间完成化学能与电 能的相互转化。
(×) (5)锂电池是一种高能电池,体积小、重量轻,比能量大( √ )
深度思考
1.镍—镉电池是一种可充电的“干电池”,使用寿命长达10~15年。其总
反应为Cd+2NiO(OH)+2H2O
2Ni(OH)2+Cd(OH)2。
(1)放电时,负极发生_氧__化__反应,反应式为_C_d_+__2_O_H__-_-__2_e_-_=_=_=__C_d_(_O_H_)_2_。
三、燃料电池
1.燃料电池 燃料电池是一种连续地将燃料和氧化剂的化学能直接转化为电能的化学 电源。电极本身不包含活性物质,只是一个催化转化元件。燃料电池工 作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生 成物不断地被排出,于是电池就连续不断地提供电能。
化学电源-高一化学课件(人教版2019必修第二册)

当硫酸的浓度降低,溶液的密度达1.18g/cm3时应停止使用,需充电,
充电时起电解池的作用,电极反应为:
阳极:
PbSO4+2H2O—2e—=PbO2+4H++SO42— 接电源正极
阴极:
PbSO4 +2e— = Pb+SO42—
接电源负极
充电总反应式: 2PbSO4+2H2O= Pb+ PbO2+2H2SO4
三.电池的污染与回收
1.电池中含有大量的重金属、酸、碱等物质。 2.一粒小小的钮扣电池可污染600立方米水,相当于一个人一生的饮水量; 一节一号电池烂在地里,能使一平方米的土地失去利用价值,并造成永久 性公害。 3.电池的回收 废旧电池中的有色金属是宝贵的自然资源,如果能回收再利用这些废旧电 池,不仅可以减少对我们生存环境的破坏,而且也是对资源的节约。
③燃料电池 一种将燃料和氧化剂的化学能直接转换成电能的化学电池。(能量很高, 前景远大)。如氢氧燃料电池、甲烷燃料电池、甲醇燃料电池等。
④其他电池: 如海水电池、心脏起搏电池等。(特殊用途,现代科技)
锌锰干电池在使用过程中,锌会逐渐溶解,锌外壳变薄,最后内部的糊 状电解质会泄露出来,使电器腐蚀。为了延长电池寿命和提高其性能,人 们将在外壳套上防腐金属筒或塑料筒制成防漏电池,电池内的电解质 NH4Cl糊换成湿的KOH,制成了碱性锌锰电池。
5.下列装置中,能构成原电池的是( )
C
A.只有甲
B.只有乙
C.只有丙
D.除乙均可以
解析: 甲装置不能构成闭合回路,乙装置两极材料相同,丁装置酒精是 非电解质,只有丙装置ห้องสมุดไป่ตู้备原电池的构成条件。
B 6.有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀
高中化学化学电源教案

高中化学化学电源教案
教学内容: 化学电源的理论和应用
教学目标:
1. 了解化学电池的基本原理和结构
2. 掌握化学电源的分类
3. 掌握化学电源在日常生活中的应用
教学重点:
1. 化学电源的原理和分类
2. 化学电源在日常生活中的应用
教学难点:
1. 对化学电源的原理和结构进行深入理解
2. 掌握化学电源的应用和优缺点
教学准备:
1. 教师准备化学电源的相关知识和案例
2. 学生准备笔记本和书写工具
教学过程:
1. 导入:
教师用一个简单的实验或例子引出化学电源的概念,让学生了解化学电源在生活中的应用。
2. 理论学习:
教师介绍化学电源的基本原理和结构,并讲解不同种类的化学电源的分类和特点。
3. 实例分析:
教师通过实际案例,分析化学电源在手机、电脑等电子设备中的应用,让学生了解化学电
源的实际用途。
4. 讨论互动:
教师引导学生进行讨论,让他们分享自己对化学电源的理解和应用,鼓励学生提出问题和思考。
5. 总结:
教师对化学电源的知识进行总结,并帮助学生梳理掌握的重点和难点。
6. 课堂作业:
布置相关的练习题,巩固学生对化学电源相关知识的理解和应用能力。
教学反馈:
在下节课时,教师可对学生的作业进行检查和反馈,了解学生对化学电源的掌握程度,以便调整教学内容和方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
日月的工厂,走出那座不见天地的小县城,到更广阔的天地里,发展自己的事业,谋划自己的人生。。 odoo 。
其实对于我来说,我并不想离开家,家里有很多牵挂,躺在病炕上的爷爷、年迈的奶奶、辛苦的父亲以及寂寞的母亲。可是,我从毕业以后,也是先在工厂里,进过车间,待过办 公室,后来在县电视台做临时工,晒日月,拍新闻,无论哪个时期,遥远的梦想如同一片烟云在我眼前幻化,可我连生存都保证不了。因此,我必须伺机从那里走出来,不管我是 否能够适应大城市的生活,不管我是否能够实现自己的理想,和我三年前选择回乡一样,我在十字路口踌躇了很久,最终还是选择离开。 好在这次的离开并不太远,我可以时常回家看望亲人,这样一来,我的想念会深,亲人的牵挂会轻,最重要的是,我和亲人的感情不会变得生疏。
