新药保护期、过渡期、行政保护期、专利保护期、监测期、试行期
药品专利保护期是多久

药品专利保护期是多久
⼤家应该知道专利是什么吧。
那么专利保护期呢?专利保护期就是对这项专利进⾏保护的时期。
那么,药品专利保护期有多久呢?今天,店铺⼩编就为⼤家整理带来了关于药品专利保护期的相关资料,希望能为您提供帮助。
接下来就让我们⼀起来看看吧。
药品专利保护期是多久
专利分为发明、实⽤新型和外观设计三种。
发明的保护期是20年,实⽤新型和外观设计的保护期是10年。
从申请⽇起开始计。
1、发明专利——20年
2、实⽤新型——10年
3、外观设计——10年
须注意的是专利保护期的起始⽇为⾃申请⽇起计算,⽽不是专利授予⽇。
发明专利,是指对产品、⽅法或者其改进所提出的新的技术⽅案。
如产品的制造⽅法或⼯艺、材料的配⽅、药品的配⽅等。
实⽤新型专利,是指对产品的形状、构造或者其结合所提出的适于实⽤的新的技术⽅案。
凡是产品结构、形状或者结构和形状相结合,申请实⽤新型专利。
发明和实⽤新型专利中都提到"新的技术⽅案",简单地讲就是要有创造性,要⽐现有技术先进,⽐现有技术落后就不能申请专利。
外观设计专利,是指对产品的形状、图案、⾊彩或者其结合所作出的富有美感并适于⼯业上应⽤的新设计。
这⾥强调"外观",即外表。
以上就是⼩编总结的相关内容,如果您还有相关法律咨询或者其他事项不明⽩的可以致电店铺在线律师解答,律师的专业知识能够帮助到你。
新药定义及一类药注册分类

关键词:专利保护
1993年执行修订后的专利法,开始保护药品专利权
谢 谢 聆 听!
关键词:标准试行期 2002年《药品注册管理办法(试行)》和2005年《药品注册管理办法》 新药经批准生产后,其药品标准为试行标准,试行期为2年。
关键词:中药保护 中药保护品种的保护期限: 中药一级保护品种分别为三十年、二十年、十年。 中药二级保护品种为七年。中药二级保护品种在保护期满后可以延长七年。 擅自仿制中药保护品种的,由县级以上卫生行政部门以生产假药依法论处。
大纲
药品审批历史沿革
新药定义
一类新药注册分类 新药保护
新药定义
• 1978年国务院颁布的《药政管理条例》,规定新药系指我国创 制和仿制的药品。
• 1985年卫生部颁布的《新药审批办法》,规定新药系指我国未 生产过的药品。已生产的药品,凡增加新的适应症、改变给药 途径和改变剂型的亦属新药范围。 • 1999年国家药监局修订《新药审批办法》,规定新药系指我国 未生产过的药品。已生产的药品改变剂型、改变给药途径、增 加新的适应症或制成新的复方制剂,亦按新药管理。 • 2002年国家药监局颁布《药品注册管理办法(试行)》,规定 新药申请是指未曾在中国境内上市销售的药品的注册申请。已 上市药品改变剂型、改变给药途径、增加新适应症的,按照新 药申请管理。
2002年《中华人民共和国药品管理法实施条例》和《药品注册管理办法
(试行)》及之后的《药品注册管理办法》 新药的监测期自批准该新药生产之日起计算,不超过5年。对于不同新
药,根据其现有的安全性研究资料、境内外研究状况,确定不同的监
测期限。 监测期内的新药,国家药品监督管理局不批准其他企业生产和进口。
新药保护措施
日,卫生部颁布并实施了《新药审批办法》。 第五阶段: 1998年3月,国家药品监督管理局成立,修订了《新药审批办法》 ,于1999年5月1日开始实施。 2002年12月1日,国家食品药品监督管理局颁布实施了《药品注册
药物注册人员定级

注册人员定级如果你是刚入行的新丁,一定很想搞明白做注册到底是怎样的工作吧?在以往的讨论中,我们暂时的把注册人员定位为四级,分别是:初级、中级、高级和特级。
㈠初级(P级)这个级别的,最下游的基本上是“跑”注册,先是复印装订资料,然后来回于各有关部门和机构。
通过学习,逐渐加深对法规的理解。
而后,对基本法规《药品注册管理办法》注册程序和要求方面章节比较熟悉了;知道监测期、过渡期、新药保护期、中药行政保护、行政保护、专利保护的意义;能够从法律上分析一个药能不能报,按几类报,需要哪些证明性文件和申报资料;哪些要试验资料,哪些可以用文献替代;哪些可以免临床,哪些必须做生物等效性;能够写一些文献资料和综述资料。
——这时,是从体力劳动向脑力劳动的过渡。
然而,切不可长期停留在这个阶段,此阶段的工作也就是“文秘”+“业务员”。
论写材料,上不了档次,还不能发表;论跑腿办事,又不如做市场的人有利可图;对法规知其然而不知其所以然,往往理解僵化(看山是山,看水是水);上不上下不下,高不成低不就的,颇为尴尬。
㈡中级(M级)这个级别的,能力比之初级更高些,因为劳动更加需要智力。
基本上,此阶段的注册立项人员应该是科研出身的,或者是生产出身的。
会从研发和生产的角度思考问题,懂试验操作;熟悉行业市场,能估计产品的前景。
中级者,立项时就不单只考虑到法律限制了,同时还能评价该品种的试验、生产难度和风险;积累了相当的资源,善于查询文献,会高效快速的搜集到所需信息,并作出分析判断;能把握审评原那么和技术要求,检查出实验设计中所犯的技术问题;能非常敏感的发现申报资料中的技术错误(比如加强破坏试验做得是否合理,图谱分离度、基线、拖尾及设置量程等是否符合要求),可看出有无方法学设计错误(比如正交试验设计是否合理、有无设空白,药理试验的动物模型是否合理、与功能主治或适应症是否一致,毒理的指标和脏器是否符合要求,统计学是否合理等),对试验结果和结论有判断能力(结构确认的解谱是否正确,工艺收率或制剂处方是否合理等)。
7我国药品知识产权的保护

二、保护中药知识产权的两种 形式
在知识产权中商标、版权、专利的外观
设计和实用新型等形式只是对中药的名 称、外观形状和包装等外部特征的保护。 对中药产品技术的保护则只有专利和技 术诀窍两种方式。
技术诀窍保护,就是中药领域中的“祖
传秘方”保护形式。因为中药自身有效 成分的复杂性,使得人们对公开使用的 中药也不能通过反向工程对其解密。只 要不泄密,这种保护的时间就没有限制, 可以保护到几百年,例如云南“白药” 的保护
《药品行政保护条例实施细则》第24条:
在药品行政保护申请日前获准进行临床 研究,且在药品行政保护授权日前经国 家药品监督管理局批准生产的同一药品, 在药品行政保护授权之后,可以在批准 范围内继续生产、销售,但不得向第三 方转让。
药品行政保护有关问题的说明: · 时间性:所在国1986年一1993年批准的产
外国专利药物获得行政保护后,将
不允许他人未经授权生产和销售, 但在申请行政保护获得批准之前, 国内企业也可抢先仿制并申报新药。 因此这个条例对专利药物的保护还 处于较低水平。
中国医药知识产权保护的现状:
目前涉及医药有关知识产权保护的我国
法律、法规有: ( 一 ) 《中华人民共和国专利法》 (1985 年 实施,1992, 2000年二次修订) 1985 年 4 月 1 日实施的中国专利法只对药 品的生产方法给予专利保护,对药品及 用化学方法获得的物质不给予专利保护。 1993 年 1 月 1 日实施的修改后的中国专利 法,对药品和用化学方法获得的物质给 予专利保护
( 三 ) 《中华人民共和国药品管理法》及
其实施条例、相关法规及规章 《中华人民共和国药品管理法》于1984 年实施,2001年修订。在此就未披露数 据和新药监测期做如下介绍。
最新药品管理法心得体会

《药品管理法》作为药品监管行政执法的法律依据,对药品监管中许多问题都做出了原则性规定。
下面是带来的药品管理法心得体会,希望对大家有帮助。
篇一:药品管理法心得体会近日,读完横峰县局《药品管理法》第八十二条存疑一文后,经仔细推敲,也有几点看法:一、“伪造、变造、买卖、出租、出借许可证或者药品批准证明文件的”放在同一条款中规定处罚幅度,笔者认为是合理的。
“伪造、变造许可证或者药品批准证明文件的”是一种许可证件缺失或者说是一种应经行政许可而未获行政许可的即从事某种行为的违法行为。
“买卖、出租、出借许可证或者药品批准证明文件的”对于买方(租入方、借入方)来讲,也是一种许可证件缺失或者说应经行政许可而未获行政许可即从事某种行为的违法行为;对于出卖方(出租方、出借方)来讲,其许可证件本来应该说有效的或者已获得行政许可从事某种行为的资格,但出卖方(出租方、出借方)的许可证件或药品批准证明文件的出卖(出租、出借)行为,客观上也充当了买入方(租入方、借入方)许可证件缺失或者说应经行政许可而未获行政许可即从事某种行为的违法行为的共犯,属于共同违法,按照共同违法行为一并处理的原则,应该合并处理。
因此,笔者认为“伪造、变造、买卖、出租、出借许可证或药品批准证明文件的”放在同一条款中规定处罚幅度是合理的。
二、也谈处罚幅度的合理性,一是从主观过错上,笔者也赞成横峰县局提出的对“伪造、变造、买卖、出租、出借许可证或者药品批准证明文件的”最低处罚幅度应不低于《药品管理法》中规定的对无证生产(经营)的处罚。
“伪造、变造、买卖、出租、出借许可证或者药品批准证明文件的”一般来说,主观上都存在明知未获得行政许可即从事药品的生产(经营)行为,即明知故犯。
相对于《药品管理法》中规定的无证经营行为的社会危害性(社会影响)应说有过之而无不及。
二是最低处罚幅度的规定上,该条规定:“伪造、变造、买卖、出租、出借许可证或者药品批准证明文件的,没收违法所得,并处违法所得一倍以上三倍以下的罚款;没有违法所得的处二万元以上十万元以下的罚款”。
新药受理审查要点

国家食品药品监督管理局药品注册司
(3)新药复方制剂的注册类别有1.5、3.2、和5类,注
意区别。
23
SFDA
新药受理要点
国家食品药品监督管理局药品注册司
(二)申请生产 1、药品名称: 与临床研究批件或审批意见通知件一致。
24
SFDA
新药受理要点
国家食品药品监督管理局药品注册司
2、申请限制
关联化学原料药与制剂:
药厂提出新药临床研究申请。
○ 相同原料药来源仅供一个相同制剂申报使用,制 剂不得早于原料药受理。
17
SFDA
新药受理要点
国家食品药品监督管理局药品注册司
(7)同时申请非处方药
符合以下条件:
○改剂型,已上市剂型应为非处方药; ○化学药品3.2类的复方制剂:各组分应为非处方药。 需在申报资料3“立题依据”中附非处方目录。
1、新编原始编号
2、原受理号:临床受理号,生产受理号 3、批准文号
38
SFDA
新药受理中应注意的问题
国家食品药品监督管理局药品注册司
注意: ○《审批意见通知件》或《临床批件》或《生产批
件》上写明有原始编号的品种,其以后的申请原始编号
应与写明的原始编号一致。
39
SFDA
新药受理中应注意的问题
国家食品药品监督管理局药品注册司
18
SFDA
新药受理要点
国家食品药品监督管理局药品注册司
(8)申请人资格 ○药品生产企业:
《药品生产许可证》及其生产范围
营业执照
《药品GMP认证证书》及其认证范围
19
SFDA
新药受理要点
国家食品药品监督管理局药品注册司
○属新建药品生产企业或新建车间: 申请人需取得相应的生产范围(包括青霉素类、头
药事法规时间总结记忆

60日:行政复议的时限是60日3个月:执业药师注册证有效期满前3个月重新注册行政诉讼的时限时3个月6个月:“三证”有效期满前6个月重新申请在期满前6个月申请换发药品生产批准文号、《医药产品注册证》、《进口药品注册证》1 年:被吊销《药品广告批准文号》1年不受理其药品广告审查申请麻醉药品和第一类精神药品的运输证明有效期后为1年药品生产操作人员每年进行健康检查药品生产记录保存至有效期后1年批生产记录、批销售记录保存至有效期后1年药学或相关专业双学士、研究生或硕士毕业生报考执业药师资格考试的工作年限为1年药品批发购销、验收、出库记录、药品零售购进记录保存至药品有效期后1年参保人员对选定的定点医疗机构可在1年后提出更改要求定点医疗机构、定点零售药店服务协议有效期1年医院制剂使用中发现不良反应有关病历、检验、检查报告单等原始记录保存至少1年2年:第一类精神药品、第二类精神药品、毒性药品处方保存2年疫苗的购进、购销、分发、供应等记录保存至超过有效期2年药品零售购进记录保存不得少于2年《国家基本医疗保险药品目录》每2年调整一次外配处方保存2年医疗机构配制记录和质量检查记录至少保存2年备查3年:《麻醉药品、第一类精神药品购用印鉴卡》有效期为3年购用印鉴卡执业药师注册证有效期为3年麻醉药品处方保存3年备查精一按处方管理办法保存3年物料的储存一般不超过3年无有效期的药品其批生产记录、销售记录至少保存3年医疗机构制剂批准文号的有效期为3年药学或相关专业本科毕业报考执业药师的工作年限为3年药品批发购销、验收、出库记录保存不得少于3年药品批发企业退货记录保存3年向吸毒者提供麻精,处3年以下徒刑,情况严重3到7年5年:三证有效期5年新药监测期5年毒药生产记录5年麻醉原植物专册保存5年GAP证书、药品批准文号有效期5年10年:出售假药、严重劣药不得从事药业工作年限10年中药一级保护期:10年、20年、30年。
关于发布新药监测期期限的通知关于发布新药监测期期限的通知
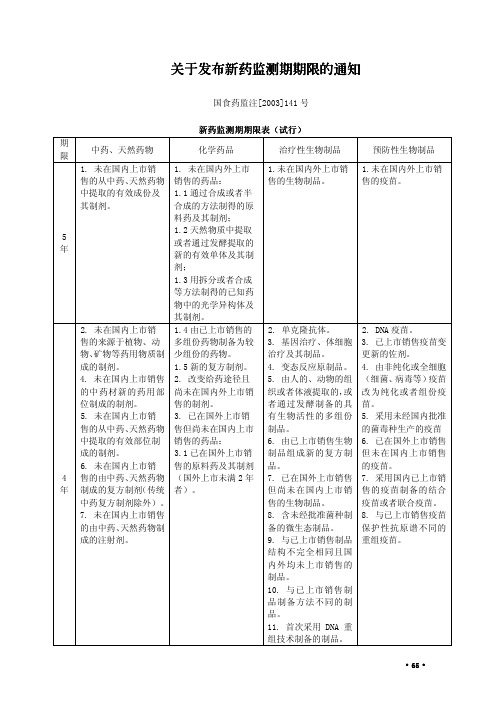
6. 未在国内上市销售 售但尚未在国内上市 制品的剂型但不改变 销售疫苗的剂型,但不
的由中药、天然药物制 销售的原料药(其制剂 给药途径的生物制品。 改变给药途径的疫苗。
成的复方制剂(传统中 已在国内上市销售)。
13. 改变免疫剂量或
不 设
药复方制剂)。
5. 改变国内已上市销
9. 改变国内已上市销 售药品的剂型,但不改
制剂。
(国外上市超过 2 年
细胞基质生产的疫苗。
9. 改变国内已上市 者)。
10. 改变灭活剂(方
销售药品剂型的制剂 3.2 已在国外上市销
法)或者脱毒剂(方法)
(工艺有质的改变者)。 售的复方制剂。
的疫苗。
10. 改变国内已上市 3.3 改变给药途径并
11. 改变给药途径的
销售药品工艺的制剂 已在国外上市销售的
位制成的制剂。
售的制剂。
者通过发酵制备的具 苗。
5. 未在国内上市销 3. 已在国外上市销 有生物活性的多组份 5. 采用未经国内批准
售的从中药、天然药物 售但尚未在国内上市 制品。
的菌毒种生产的疫苗
中提取的有效部位制 销售的药品:
6. 由已上市销售生物 6. 已在国外上市销售
成的制剂。 6. 未在国内上市销
65656565关于发布新药监测期期限的通知关于发布新药监测期期限的通知关于发布新药监测期期限的通知关于发布新药监测期期限的通知国食药监注2003141号新药监测期期限表新药监测期期限表新药监测期期限表新药监测期期限表试行试行试行试行期限中药天然药物化学药品治疗性生物制品预防性生物制品5年1
关于发布新药监测期期限的通知
物、矿物等药用物质制 少组份的药物。
治疗及其制品。
行政保护期、新药保护期、新药过渡期、新药监测期、中药保护期、专利保护期

何谓行政保护期、新药保护期、新药过渡期、新药监测期、中药保护期、专利保护期?行政保护期:为了扩大对外经济技术合作与交流,对外国药品独占权人的合法权益给予行政保护。
药品行政保护期为7年零6个月,自药品行政保护证书颁发之日起计算。
新药保护期:新药经国家药品监督管理局批准颁发新药证书后即获得保护。
各类新药的保护期分别为:第一类新药12年;第二、三类新药8年;第四、五类新药6年。
凡有试产期的新药,其保护期包含试产期。
新药的保护期自国家药品监督管理局批准颁发的第一个新药证书之日算起。
新药保护期满,新药保护自行终止。
新药过渡期:修订的《中华人民共和国药品管理法》(以下简称《药品管理法》)及《中华人民共和国药品管理法实施条例》(以下简称《实施条例》)分别于2001年12月1日和2002年9月15日施行。
《实施条例》修改了新药的定义,将“新药是指我国未生产过的药品”,修改为“新药是指未曾在中国境内上市销售的药品”。
随着新药定义的改变,新药注册管理制度将发生较大变化,新药的行政保护制度已被取消。
对于2002年9月15日以前我局已经批准临床研究但未批准生产的新药,仍按照原药品注册管理的有关规定审批。
批准生产后,按照原《新药审批办法》属于一类新药的,给予5年的过渡期;属于二类新药的,给予4年的过渡期;属于三类至五类新药的,给予3年的过渡期。
在过渡期内,其他药品生产企业不得生产相同品种的药品。
新药过渡期自发给新药证书之日起计算。
新药监测期:对于2002年9月15日以前我局已经受理但未批准临床研究的新药,以及2002年9月15日以后我局受理的新药,按照修订的《药品管理法》及《实施条例》的有关规定审批。
即:对未曾在中国境内上市销售的品种,按照新药审批,并且对批准药品生产企业生产的新药,设立不超过5年的监测期;自新药批准生产之日起计算。
中药保护期:中药一级保护品种分别为三十年、二十年、十年。
中药二级保护品种为七年。
专利保护期:发明专利权的期限为二十年,实用新型专利权和外观设计专利权的期限为十年,均自申请日起计算。
药品各种记录文件保存时限

药品各种记录、文件保存时限1.保存至超过药品有效期一年,但不得少于三年(1)药品生产、经营企业采购药品时按规定留存的资料和销售凭证。
(药品流通监督管理办法,P184,12条)(2)医疗机构药品购进记录。
(药品流通监督管理办法,P185,25条)(3)医疗机构药品验收记录必须保存至超过药品有效期1年,但不得少于3年.(医疗机构药品监督管理办法(试行),P198,10条)2.超过有效期两年(1)疾病预防控制机构、接种单位购进疫苗时的证明文件:超过疫苗有效期两年。
(疫苗流通和预防接种管理条例,P103,17条)(2)疫苗生产企业、疫苗批发企业的购销记录:超过疫苗有效期两年.(18条)(3)疾病预防控制机构的购进、分发、供应记录:超过疫苗有效期两年。
(18条)3.一年事项(1)托运或自行运输麻醉、一类精神药申领的运输证明有效期1年。
(麻醉药品和精神药品管理条例,P83,52条)(2)医疗机构制剂使用过程中发现不良反应,保留的病历和有关检验、检查报告单等原始记录至少一年备查。
(医疗机构制剂配制质量管理规范(试行),P210,65条)(3)《基本医疗保险药品目录》新药增补工作每年进行一次。
(城镇职工基本医疗保险用药范围管理暂行办法,P238,11条)(4)《中国药典》增补本,原则上每年一版。
(药品标准,P22)(5)社会保险经办机构与定点零售药店签订的协议有效期一般为1年。
(城镇职工基本医疗保险定点零售药店管理暂行办法,P236,8条)4。
两年事项(1)医疗机构有关配制制剂的记录和质量检验记录应完整归档,至少保存2年备查。
(医疗机构制剂配制质量管理规范,P209,52条)(2)《基本医疗保险药品目录》每两年调整一次.(城镇职工基本医疗保险用药范围管理暂行办法,P238,11条)(3)定点批发企业的条件:单位及工作人员2年内没有违反有关禁毒的法律、行政法规的行为。
(麻醉药品和精神药品管理条例,P80,23条)(4)《药品广告审查表》原件保存2年.(药品广告审查办法,P248,17条)(5)医疗机构调整抗菌药物供应目录的周期原则上为2年,最短不得少于1年。
国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(1)

国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(1)文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2003.10.10•【文号】国食药监注[2003]278号•【施行日期】2003.10.10•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于确定新药保护期、过渡期或监测期及有关事宜的通知(国食药监注[2003]278号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局),解放军总后卫生部:根据国家药品监督管理局《关于<中华人民共和国药品管理法实施条例>实施前已批准生产和临床研究的新药的保护期的通知》(国药监注[2003]59号)、我局《关于发布新药监测期期限的通知》(国食药监注[2003]141号)的有关规定,现就2002年9月15日以后批准新药的保护期、过渡期或监测期事宜通知如下:一、对2002年9月15日以来批准的新药,尚未确定保护期、过渡期或监测期的,按其申报与审批情况分别予以确定,并自该新药证书或生产批准之日起生效。
具体品种见附件。
二、对处于过渡期内的新药,我局不受理其他申请人同品种的新药或已有国家标准药品申请,省、自治区、直辖市食品药品监督管理局(药品监督管理局)应当将已经收到的申请退回申请人。
三、对没有保护期、过渡期或未设监测期的新药,自其获得药品批准文号之日起,我局不再受理其他申请人同品种的新药申请,省、自治区、直辖市食品药品监督管理局(药品监督管理局)应当将已经收到的申请退回申请人。
四、过渡期内新药技术转让的申报与审批,按照原国家药品监督管理局对新药保护期的相关规定办理。
特此通知附件:2002年9月15日以来尚未确定的新药保护期、过渡期或监测期确定表国家食品药品监督管理局二00三年十月十日附件:2002年9月15日以来尚未确定的新药保护期、过渡期或监测期确定┎────┬───────┬──┬────────────┬────┬────┬──────┬────┬──────────────┬────┬─────┒┃批准日期│新药名称│注册│保护期、过渡期或监测期│批件编号│药品批准│药品生产企业│新药证书│新药证书持有人│申请日期│受理号┃┃││分类│││文号││编号│││┃┃││││││││││┃┃││├───┬──┬─────┤││││││┃┃│││ 种类│期限│终止期│││││││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│克拉霉素胶囊│ 四│保护期││保护期已过│2002H052│国药准字│珠海润都制药│国药证字│珠海润都制药有限公司│2000-9- │CXS00570┃┃17││││││0│H2002048│有限公司│H2002034││18│┃┃│││││││8││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│克拉霉素胶囊│ 四│保护期││保护期已过│2002H052│国药准字│珠海润都制药│国药证字│珠海润都制药有限公司│2000-9- │CXS00571┃┃17││││││1│H2002048│有限公司│H2002034││18│┃┃│││││││9││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用己酮可可│ 四│监测期│不设││2002H052│国药准字│吉林省辉南长│国药证字│东北制药集团公司沈阳第一制药│2002-1-7│CXS2002000┃┃17│碱│││││2│H2002049│龙生化药业股│H2002035│厂,吉林省辉南长龙生化药业股││1┃┃│││││││0│份有限公司│0│份有限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用烟酸占替│ 四│监测期│不设││2002H052│国药准字│吉林省辉南长│国药证字│东北制药集团公司沈阳第一制药│2002-1-7│CXS2002000┃┃17│诺│││││3│H2002049│龙生化药业股│H2002035│厂,吉林省辉南长龙生化药业股││2┃┃│││││││1│份有限公司│1│份有限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用烟酸占替│ 四│监测期│不设││2002H053│国药准字│国药集团国瑞│国药证字│合肥恒星药物研究所│2001-4- │CXS01216┃┃22│诺│││││0│H2002050│药业有限公司│H2002035││23│┃┃│││││││7││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│复方苯佐卡因凝│ 三│过渡期│3年│至2005-9-│2002H053│国药准字│广西半宙制药│国药证字│广西半宙制药股份有限公司,南│2001-9-3│CXS01455┃┃22│胶││││21│1│H2002050│股份有限公司│H2002035│宁市安科新技术研究所││┃┃│││││││8││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│复方苯佐卡因凝│ 三│过渡期│3年│至2005-9-│2002H054│国药准字│广西半宙制药│国药证字│广西半宙制药股份有限公司,南│2001-9-3│CXS01456┃┃22│胶││││21│0│H2002051│股份有限公司│H2002035│宁市安科新技术研究所││┃┃│││││││7││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│胞磷胆碱钠氯化│ 四│保护期│6年│至2007-10-│2002H053│国药准字│武汉久安药业│国药证字│北京德生堂医药卫生研究所│2001-12-│CXS01753┃┃24│钠注射液││││8│9│H2002051│有限公司│H2002036││18│┃┃│││││││6││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│过渡期│3年│至2005-9-│2002H055│国药准字│齐鲁制药厂│国药证字│山东省医药工业研究所,齐鲁制│2000-6-2│CXS00340┃┃26│磷酸二氢钠││││25│0│H2002054││H2002037│药厂││┃┃│││││││0││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│阿奇霉素枸橼酸│ 四│过渡期│3年│至2005-9-│2002H054│国药准字│浙江康裕制药│国药证字│合肥医工医药研究所,浙江康裕│2001-11-│CXS01691┃┃26│二氢钠││││25│1│H2002033│有限公司│H2002036│制药有限公司│28│┃┃│││││││7││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│过渡期│3年│至2005-9-│2002H054│国药准字│浙江康裕制药│国药证字│合肥医工医药研究所,浙江康裕│2001-11-│CXS01692┃┃26│枸橼酸二氢钠││││25│3│H2002033│有限公司│H2002036│制药有限公司│28│┃┃│││││││8││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│过渡期│3年│至2005-9-│2002H054│国药准字│浙江康裕制药│国药证字│合肥医工医药研究所,浙江康裕│2001-11-│CXS01693┃┃26│枸橼酸二氢钠││││25│2│H2002033│有限公司│H2002036│制药有限公司│28│┃┃│││││││9││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│结核分支杆菌核│ 四│保护期│8年│至2008-9-│2002S006│国药准字│华美生物工程│国药证字│华美生物工程公司│2001-1-3│CSS01001┃┃30│酸扩增(PCR)荧││││22│1│S2002009│公司│S2002003│││┃┃│光检测试剂盒││││││5││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│阿奇霉素磷酸二│ 四│过渡期│3年│至2005-9-│2002H054│国药准字│齐鲁制药厂│国药证字│山东省医药工业研究所、齐鲁制│2000-6-2│CXS00339┃┃30│氢钠││││29│9│H2002053││H2002037│药厂││┃┃│││││││9││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│保护期│6年│至2005-6-│2002H056│国药准字│辽宁天龙药业│国药证字│包头市千年健科技开发有限责任│2000-9- │CXS00559┃┃30│││││24│2│H2002055│有限公司│H2002038│公司,辽宁天龙药业有限公司│13│┃┃│││││││0││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│克林霉素磷酸酯│ 四│过渡期│3年│至2005-9-│2002H056│国药准字│华北制药集团│国药证字│华北制药集团制剂有限公司│2000-9- │CXS00565┃┃30│外用溶液剂││││29│3│H2002055│制剂有限公司│H2002038││18│┃┃│││││││1││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用高三尖杉│ 四│监测期│不设││2002H056│----│西安大唐制药│国药证字│西安新通药物研究有限公司│2001-4- │CXS01203┃┃30│酯碱│││││1││有限公司│H2002038││17│┃┃│││││││││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用高三尖杉│ 四│监测期│不设││2002H056│----│西安大唐制药│国药证字│西安新通药物研究有限公司│2001-4- │CXS01204┃┃30│酯碱│││││0`││有限公司│H2002038││17│┃┃│││││││││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用阿奇霉素│ 四│保护期│6年│至2005-6-│2002H054│国药准字│河南辅仁怀庆│国药证字│开封康诺生化制药厂│2001-4- │CXS01208┃┃30│││││24│8│H2002053│堂制药有限公│H2002037││18│┃┃│││││││0│司│1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│己酮可可碱葡萄│ 四│保护期│6年│至2007-10-│2002H056│国药准字│大连德泽制药│国药证字│大连天宇制药有限公司│2001-6- │CXS01302┃┃30│糖注射液││││24│4│H2002055│有限公司│H2002038││14│┃┃│││││││2││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│胞磷胆碱钠氯化│ 四│保护期│6年│至2007-10-│2002H056│----│----│国药证字│安徽科苑药业有限公司│2001-11-│CXS01676┃┃30│钠注射液││││8│6│││H2002038││21│┃┃│││││││││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│烟酸占替诺氯化│ 四│保护期│6年│至2007-6-│2002H056│国药准字│大连德泽制药│国药证字│中国人民解放军第九八九二工│2001-11-│CXS01677┃┃30│钠注射液││││28│5│H2002055│有限公司│H2002038│厂,丹东市鸭绿江医药研究开发│23│┃┃│││││││3││6│中心││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│口服补液盐溶液│ 四│过渡期│3年│至2005-9-│2002H056│国药准字│上海强生制药│国药证字│上海强生制药有限公司│2002-2-5│CXS2002010┃┃30│││││29│7│H2002055│有限公司│H2002038│││9┃┃│││││││4││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│多西他赛│ 四│过渡期│3年│至2005-9-│2002H055│国药准字│江苏恒瑞医药│国药证字│中国医学科学院药物研究所,江│2002-4-8│CXS2002027┃┃30│││││29│3│H2002054│股份有限公司│H2002037│苏恒瑞医药股份有限公司││3┃┃│││││││2││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│注射用多西他赛│ 四│过渡期│3年│至2005-9-│2002H055│国药准字│江苏恒瑞医药│国药证字│中国医学科学院药物研究所,江│2002-4-8│CXS2002027┃┃30│││││29│4│H2002054│股份有限公司│H2002037│苏恒瑞医药股份有限公司││4┃┃│││││││3││7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│丁苯酞│ 一│过渡期│5年│至2007-9-│2002H055│国药试字│石家庄制药集│国药证字│中国医学科学院药物研究所│2002-5- │CXS2002045┃┃30│││││29│1│H2002000│团欧意药业有│H2002037││29│2┃┃│││││││8│限公司│4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│丁苯酞软胶囊│ 一│过渡期│5年│至2007-9-│2002H055│国药试字│石家庄制药集│国药证字│中国医学科学院药物研究所│2002-5- │CXS2002045┃┃30│││││29│2│H2002000│团欧意药业有│H2002037││29│3┃┃│││││││9│限公司│5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│司他夫定│ 四│保护期│6年│至2008-9-│2002H055│国药准字│东北制药总厂│国药证字│东北制药总厂│2002-9- │CXS2002098┃┃30│││││12│7│H2002054││H2002038││28│2┃┃│││││││7││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│司他夫定胶囊│ 四│保护期│6年│至2008-9-│2002H055│国药准字│东北制药总厂│国药证字│东北制药总厂│2002-9- │CXS2002098┃┃30│││││12│8│H2002054││H2002038││28│3┃┃│││││││8││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│司他夫定胶囊│ 四│保护期│6年│至2008-9-│2002H055│国药准字│东北制药总厂│国药证字│东北制药总厂│2002-9- │CXS2002098┃┃30│││││12│9│H2002054││H2002038││28│4┃┃│││││││9││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│小儿豉翘清热颗│ 三│过渡期│3年│至2005-9-│2002Z010│国药准字│江苏帝益药业│国药证字│天津药物研究院,江苏帝益药业│2001-9- │CZS01045┃┃30│粒││││29│5│Z2002009│有限公司│Z2002007│有限公司│26│┃┃│││││││6││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃ 2002-9-│小儿豉翘清热颗│ 三│过渡期│3年│至2005-9-│2002Z010│国药准字│江苏帝益药业│国药证字│天津药物研究院,江苏帝益药业│2001-9- │CZS01046┃┃30│粒││││29│6│Z2002009│有限公司│Z2002007│有限公司│26│┃┃│││││││7││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│丙型肝炎病毒分│ 一│无│││2002S006│----│----│国药证字│中国人民解放军军事医学科学院│2001-11-│CSS01064┃┃16│片段抗体检测试│││││0│││S2002003│放射医学研究所,深圳益生堂生│21│┃┃│剂盒(蛋白芯片)││││││││4│物企业有限公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│头孢呋辛酯│ 四│保护期│6年│至2006-5-│2002H057│----│----│国药证字│南京海光应用化学研究所│2000-12-│CXS00733┃┃16│││││26│1│││H2002039││18│┃┃│││││││││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│头孢呋辛酯片│ 四│保护期│6年│至2002-9-6│2002H057│----│----│国药证字│南京海光应用化学研究所│2000-12-│CXS00734┃┃16││││││2│││H2002039││18│┃┃│││││││││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│胸腺肽&A1│ 四│过渡期│3年│至2005-10-│2002H055│国药准字│四川源基制药│国药证字│四川源基制药有限公司,成都地│2001-3- │CXS01123┃┃16│││││15│5│H2002054│有限公司│H2002037│奥九泓制药厂│15│┃┃│││││││4││8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用胸腺肽& │ 四│过渡期│3年│至2005-10-│2002H055│国药准字│成都地奥九泓│国药证字│成都地奥九泓制药厂│2001-3- │CXS01124┃┃16│A1││││15│6│H2002054│制药厂│H2002037││15│┃┃│││││││5││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│甲磺酸托烷司琼│ 二│过渡期│4年│至2006-10-│2002H057│国药准字│北京四环医药│国药证字│中国人民解放军军事医学科学院│2001-3- │CXS01129┃┃16│││││15│7│H2002056│科技股份有限│H2002039│毒物药物研究所│19│┃┃│││││││2│公司│6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│甲磺酸托烷司琼│ 二│过渡期│4年│至2006-10-│2002H057│国药准字│北京四环医药│国药证字│中国人民解放军军事医学科学院│2001-3- │CXS01130┃┃16│片││││15│8│H2002056│科技股份有限│H2002039│毒物药物研究所│19│┃┃│││││││3│公司│7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│甲磺酸托烷司琼│ 二│过渡期│4年│至2006-10-│2002H057│国药准字│北京四环医药│国药证字│中国人民解放军军事医学科学院│2001-3- │CXS01131┃┃16│注射液││││15│9│H2002056│科技股份有限│H2002039│毒物药物研究所│19│┃┃│││││││4│公司│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氟康唑葡萄糖注│ 四│保护期│6年│至2008-7-│2002H058│国药准字│河南天方药业│国药证字│河南天方药业股份有限公司│2001-9- │CXS01474┃┃16│射液││││18│0│H2002056│股份有限公司│H2002039││10│┃┃│││││││5││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│托吡酯片│ 四│过渡期│3年│至2005-10-│2002H056│国药准字│西安杨森制药│国药证字│西安杨森制药有限公司│2001-11-│CXS01701┃┃16│││││15│8│H2002055│有限公司│H2002038││28│┃┃│││││││5││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│托吡酯片│ 四│过渡期│3年│至2005-10-│2002H056│国药准字│西安杨森制药│国药证字│西安杨森制药有限公司│2001-11-│CXS01702┃┃16│││││15│9│H2002055│有限公司│H2002038││28│┃┃│││││││6││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│托吡酯片│ 四│过渡期│3年│至2005-10-│2002H057│国药准字│西安杨森制药│国药证字│西安杨森制药有限公司│2001-11-│CXS01703┃┃16│││││15│0│H2002055│有限公司│H2002038││28│┃┃│││││││7││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│胞磷胆碱钠氯化│ 四│保护期│6年│至2007-10-│2002H058│国药准字│济南三九益民│国药证字│山东九新医药科技开发有限责任│2001-12-│CXS01789┃┃16│钠注射液││││8│3│H2002056│制药有限责任│H2002040│公司,济南三九益民制药有限责│29│┃┃│││││││8│公司│2│任公司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氯雷他定│ 四│保护期│6年│ 至2008-5-│2002H057│国药准字│深圳海王药业│国药证字│南京臣功制药有限公司,深圳海│2002-1-7│CXS2002000┃┃16│││││29│3│H2002055│有限公司│H2002039│王药业有限公司││3┃┃│││││││8││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氯雷他定颗粒剂│ 四│过渡期│3年│至2005-10-│2002H057│国药准字│南京三锐药业│国药证字│南京臣功制药有限公司│2002-1-7│CXS2002000┃┃16│││││15│5│H2002056│有限公司│H2002039│││4┃┃│││││││0││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氯雷他定咀嚼片│ 四│过渡期│3年│至2005-10-│2002H057│国药准字│深圳海王药业│国药证字│南京臣功制药有限公司,深圳海│2002-1-7│CXS2002000┃┃16│││││15│6│H2002056│有限公司│H2002039│王药业有限公司││5┃┃│││││││1││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氯雷他定胶囊│ 四│过渡期│3年│至2005-10-│2002H057│国药准字│深圳海王药业│国药证字│南京臣功制药有限公司,深圳海│2002-1-7│CXS2002000┃┃16│││││15│4│H2002055│有限公司│H2002039│王药业有限公司││8┃┃│││││││9││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│盐酸左布比卡因│ 四│过渡期│3年│至2005-10-│2002H058│国药准字│江苏恒瑞医药│国药证字│江苏恒瑞医药股份有限公司│2002-1-7│CXS2002000┃┃16│││││15│4│H2002056│股份有限公司│H2002040│││9┃┃│││││││9││3│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│盐酸左布比卡因│ 四│过渡期│3年│至2005-10-│2002H058│国药准字│江苏恒瑞医药│国药证字│江苏恒瑞医药股份有限公司│2002-1-7│CXS2002001┃┃16│注射液││││15│5│H2002057│股份有限公司│H2002040│││0┃┃│││││││0││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│胞磷胆碱钠氯化│ 四│保护期│6年│至2007-10-│2002H058│国药准字│武汉滨湖双鹤│国药证字│武汉滨湖双鹤药业有限责任公司│2002-1-9│CXS2002002┃┃16│钠注射液││││8│1│H2002056│药业有限责任│H2002040│││0┃┃│││││││6│公司│0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用己酮可可│ 四│监测期│不设││2002H058│国药准字│武汉海特生物│国药证字│湖北中远医药有限公司│2002-1- │CXS2002002┃┃16│碱│││││2│H2002056│制药股份有限│H2002040││14│5┃┃│││││││7│公司│1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│头孢克洛缓释片│ 四│保护期│6年│至2005-12-│2002H058│国药准字│礼来苏州制药│国药证字│礼来苏州制药有限公司│2002-2-6│CXS2002012┃┃16│││││29│6│H2002057│有限公司│H2002040│││4┃┃│││││││1││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│西尼地平│ 二│过渡期│4年│至2006-10-│2002H058│国药准字│安徽新力药业│国药证字│天津药物研究院,安徽新力药业│2002-8- │CXS2002072┃┃22│││││21│9│H2002057│股份有限公司│H2002040│股份有限公司蚌埠涂山分厂│12│8┃┃│││││││8│蚌埠涂山分厂│8│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│西尼地平片│ 二│过渡期│4年│至2006-10-│2002H058│国药准字│安徽新力药业│国药证字│天津药物研究院,安徽新力药业│2002-8- │CXS2002072┃┃22│││││21│8│H2002057│股份有限公司│H2002040│股份有限公司蚌埠涂山分厂│12│9┃┃│││││││7│蚌埠涂山分厂│7│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│阿司待因片│ 三│过渡期│3年│至2005-10-│2002H058│国药准字│山东新华制药│国药证字│山东新华制药股份有限公司│2001-11-│CXS01662┃┃23│││││22│7│H2002057│股份有限公司│H2002040││16│┃┃│││││││6││6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│头孢呋辛钠│ 四│保护期│6年│至2005-5-│2002H059│国药准字│浙江永宁制药│国药证字│四川抗菌素工业研究所│2002-1- │CXS2002002┃┃23│││││13│2│H2002058│厂│H2002041││10│2┃┃│││││││1││1│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用头孢呋辛│ 四│保护期│6年│至2005-5-│2002H059│国药准字│浙江永宁制药│国药证字│四川抗菌素工业研究所│2002-1- │CXS2002002┃┃23│钠││││13│3│H2002058│厂│H2002041││10│3┃┃│││││││2││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用头孢呋辛│ 四│保护期│6年│至2005-5-│2002H059│国药准字│浙江永宁制药│国药证字│四川抗菌素工业研究所│2002-1- │CXS2002002┃┃23│钠││││13│4│H2002058│厂│H2002041││10│4┃┃│││││││3││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│奈韦拉平│ 四│监测期│不设││2002H059│国药准字│上海迪赛诺化│国药证字│上海迪赛诺生物医药有限公司│2002-10-│CXS2002104┃┃23││││││0│H2002057│学制药有限公│H2002040││18│8┃┃│││││││9│司│9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│奈韦拉平片│ 四│监测期│不设││2002H059│国药准字│上海迪赛诺生│国药证字│上海迪赛诺生物医药有限公司│2002-10-│CXS2002104┃┃23││││││1│H2002058│物医药有限公│H2002041││18│9┃┃│││││││0│司│0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│西尼地平│ 二│过渡期│4年│至2006-10-│2002H059│国药准字│山西泰盛制药│国药证字│山西泰盛制药有限公司,北京克│2002-10-│CXS2002099┃┃24│││││21│5│H2002058│有限公司│H2002041│莱瑞科贸有限公司呼和浩特分公│16│7┃┃│││││││4││3│司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│西尼地平片│ 二│过渡期│4年│至2006-10-│2002H059│国药准字│山西泰盛制药│国药证字│山西泰盛制药有限公司,北京克│2002-10-│CXS2002099┃┃24│││││21│6│H2002058│有限公司│H2002041│莱瑞科贸有限公司呼和浩特分公│16│8┃┃│││││││5││4│司││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│复方平贝口服液│ 三│过渡期│3年│至2005-10-│2002Z010│国药准字│大连金泉生物│国药证字│大连金泉生物工程制药有限公司│2001-1- │CZS01003┃┃24│││││23│8│Z2002010│工程制药有限│Z2002007││10│┃┃│││││││0│公司│6│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│琥乙红霉素分散│ 四│保护期│6年│至2005-7-│2002H060│国药准字│三九企业集团│国药证字│合肥新思达医药技术有限公司│2001-3- │CXS01159┃┃29│片││││28│9│H2002059│永安制药厂│H2002042││28│┃┃│││││││9││4│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│己酮可可碱葡萄│ 四│保护期│6年│至2007-10-│2002H061│国药准字│安庆制药有限│国药证字│安徽省安泰医药生物技术有限责│2001-4-2│CXS01172┃┃29│糖注射液││││24│6│H2002061│公司│H2002042│任公司││┃┃│││││││6││9│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│硫酸钡混悬液│ 四│过渡期│3年│至2005-10-│2002H061│国药准字│汕头金石制药│国药证字│汕头金石制药总厂│2001-5- │CXS01265┃┃29│││││28│7│H2002061│总厂│H2002043││29│┃┃│││││││7││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│硫酸钡混悬液│ 四│过渡期│3年│至2005-10-│2002H061│国药准字│汕头金石制药│国药证字│汕头金石制药总厂│2001-5- │CXS01266┃┃29│││││28│9│H2002061│总厂│H2002043││29│┃┃│││││││9││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│硫酸钡混悬液│ 四│过渡期│3年│至2005-10-│2002H061│国药准字│汕头金石制药│国药证字│汕头金石制药总厂│2001-5- │CXS01267┃┃29│││││28│8│H2002061│总厂│H2002043││29│┃┃│││││││8││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│硫酸钡混悬液│ 四│过渡期│3年│至2005-10-│2002H062│国药准字│汕头金石制药│国药证字│汕头金石制药总厂│2001-5- │CXS01268┃┃29│││││28│0│H2002062│总厂│H2002043││29│┃┃│││││││0││0│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│高三尖杉酯碱氯│ 四│保护期│6年│至2008-7-│2002H063│国药准字│陕西金裕制药│国药证字│陕西金裕制药股份有限公司│2001-6-4│CXS01286┃┃29│化钠注射液││││24│9│H2002063│股份有限公司│H2002044│││┃┃│││││││1││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氟康唑葡萄糖注│ 四│保护期│6年│至2008-7-│2002H062│----│----│国药证字│山东省医药工业研究所│2001-7- │CXS01367┃┃29│射液││││18│4│││H2002043││18│┃┃│││││││││2│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│氟康唑葡萄糖注│ 四│保护期│6年│至2008-7-│2002H063│国药准字│山东天福制药│国药证字│山东省医疗器械研究所│2001-8-8│CXS01403┃┃29│射液││││18│1│H2002062│厂│H2002043│││┃┃│││││││4││5│││┃┠────┼───────┼──┼───┼──┼─────┼────┼────┼──────┼────┼──────────────┼────┼─────┨┃2002-10-│注射用硫酸奈替│ 四│保护期│6年│至2007-11-│2002H064│----│----│国药证字│北京华睿鼎信科技有限公司,湖│2001-9-3│CXS01462┃┃29│米星││││6│0│││H2002044│北午时药业股份有限公司││┃。
关于保护期、监测期、过渡期等几个新手困惑的问题

关于保护期、监测期、过渡期等几个新手困惑的问题自1998年国家药品监督管理局成立以来,对于注册法规修订较大,1999年4月22日颁布《新药审批办法》、《新生物制品审批办法》、《新药保护和技术转让的规定》、《仿制药品审批办法》和《进口药品管理办法》,启动了对药品注册审评模式的改革,逐步与国际接轨。
随着我国2001年加入WTO和新修订的《药品管理法》及其《实施条例》的颁布实施,原国家药品监督管理局对上述办法进行了修订,于2002年12月1日颁布实施《药品注册管理办法》(试行),以适应WTO关于知识产权的相关原则,适应《药品管理法实施条例》后对“新药”定义修改的新形势。
由于近几年注册规章的频繁修订,对于药品注册相关规章的理解发生偏差,使在药品注册申请过程中出现了许多问题,如新药类别、新药保护期、过渡期、监测期的理解等。
而实际上,当我们把目光不单单局限在《药品注册管理办法》上,回头看看老的注册法规、看看药品监管的“基本法”《药品管理法》,许多问题实际上并不难理解。
《药品管理法》作为药品监管行政执法的法律依据,对药品监管中许多问题都做出了原则性规定。
例如在第一章总则中对药品监管的目的、适用范围、执法部门等均做出了原则性规定,尤其是第一条“为加强药品监督管理,保证药品质量,保障人体用药安全,维护人民身体健康和用药的合法权益,特制定本法”,更是整个药品监管的核心——确保人民用药安全有效。
在第四章第25条规定了配制医疗机构制剂“应当是本单位临床需要而市场上没有供应的品种,并须经所在地省、自治区、直辖市人民政府药品监督管理部门批准后方可配制。
配制的制剂必须按照规定进行质量检验;合格的,凭医师处方在本医疗机构使用。
特殊情况下,经国务院或者省、自治区、直辖市人民政府的药品监督管理部门批准,医疗机构配制的制剂可以在指定的医疗机构之间调剂使用”,从这一条我们可以知道如果要申请医疗机构制剂,需要得到省级药品监督管理局的批准方可以配制。
关于新药保护期

关于新药保护期、过渡期、行政保护期等的解释(2010-02-21 18:57:04)转载分类:经验标签:健康1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能够让首仿企业在相当长的时间内独家的占领市场。
这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾:有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。
为了解决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。
在如今看,这种光限制自家人的规定,实属汉奸条款。
但在当时,却是有益的,如果不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护期却显得如此的不合时宜。
还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新药审批办法》以后,就已经没有新药保护期了。
另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。
无论新药保护期,还是过渡期,都已经是历史名词了,会逐渐湮没。
2.行政保护期,这是对我国早期专利法的妥协。
中国85~93年间的《专利法》不保护药品的知识产权,这和“No patent, no drug”的国际新药开发认知是相悖的,于是在国际社会(其实就是那某个强国)的强烈抗议下,中国作出了一个行政干预的补救措施,就是但凡某外企的品种在85-93间在国外享有知识产权或独占权且未过期者,可以提出申请,获得7.5年的行政保护,只要得到该保护,则在保护期内既不再允许批准国产,也不允许批准其他的进口。
新药保护期过渡期监测期的区别

新药保护期、过渡期、监测期的区别
2008-11-27 15:21:42
1、新药保护期(1985~2002.9.15)
1985~1999/5/1 ,新药保护期如下:
1999/5/1~2002/9/15 ,新药保护期如下:
2、过渡期(适用于2002.9.15前批临床但未批生产的)
对于2002年9月15日以前我局已经批准临床研究但未批准生产的新药,仍按照原药品注册管理的有关规定审批。
批准生产后,按照原《新药审批办法》属于一类新药的,给予5年的过渡期;属于二类新药的,给予4年的过渡期;属于三类至五类新药的,给予3年的过渡期。
在过渡期内,其他药品生产企业不得生产相同品种的药品。
3、监测期
对于2002年9月15日以前我局已经受理但未批准临床研究的新药,
以及2002年9月15日以后我局受理的新药,按照修订的《药品管理法》及《实施条例》的有关规定审批。
即:对未曾在中国境内上市销售的品种,按照新药审批,并且对批准药品生产企业生产的新药,设立不超过5年的监测期;对已经在中国境内上市销售的品种,按照已有国家标准药品审批。
具体监测期限见下表
新药监测期期限表(试行).。
新药保护期

新药保护期、过渡期、监测期…一次说清楚1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能够让首仿企业在相当长的时间内独家的占领市场。
这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾:有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。
为了解决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。
在如今看,这种光限制自家人的规定,实属汉奸条款。
但在当时,却是有益的,如果不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护期却显得如此的不合时宜。
还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新药审批办法》以后,就已经没有新药保护期了。
另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。
无论新药保护期,还是过渡期,都已经是历史名词了,会逐渐湮没。
2.行政保护期,这是对我国早期专利法的妥协。
中国85~93年间的《专利法》不保护药品的知识产权,这和“No patent, no drug”的国际新药开发认知是相悖的,于是在国际社会(其实就是那某个强国)的强烈抗议下,中国作出了一个行政干预的补救措施,就是但凡某外企的品种在85-93间在国外享有知识产权或独占权且未过期者,可以提出申请,获得7.5年的行政保护,只要得到该保护,则在保护期内既不再允许批准国产,也不允许批准其他的进口。
《新药审批办法》

1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能够让首仿企业在相当长的时间内独家的占领市场。
这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾:有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。
为了解决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。
在如今看,这种光限制自家人的规定,实属汉奸条款。
但在当时,却是有益的,如果不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护期却显得如此的不合时宜。
还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新药审批办法》以后,就已经没有新药保护期了。
另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。
无论新药保护期,还是过渡期,都已经是历史名词了,会逐渐湮没。
2.行政保护期,这是对我国早期专利法的妥协。
中国85~93年间的《专利法》不保护药品的知识产权,这和“No patent, no drug”的国际新药开发认知是相悖的,于是在国际社会(其实就是那某个强国)的强烈抗议下,中国作出了一个行政干预的补救措施,就是但凡某外企的品种在85-93间在国外享有知识产权或独占权且未过期者,可以提出申请,获得7.5年的行政保护,只要得到该保护,则在保护期内既不再允许批准国产,也不允许批准其他的进口。
新药研发过程中的知识产权保护

新药研发过程中的知识产权保护[内容提要]药品尤其是中药的知识产权保护是知识产权领域的热点问题。
其中新药研发过程中的知识产权保护问题不仅是知识产权法律制度中的理论问题,更是医药行业有关药品研发的实务问题。
国家药品食品监督管理局在其中起着重要而关键的作用。
本文通过分析新药研发不同阶段所形成的技术成果的权利形态,提出相应的知识产权保护策略及方法[关键词]新药权利形态知识产权保护长期以来,我国一直是一个医药消费大国,同时又远远不是一个医药强国。
其主要原因就在于我们的新药研发能力薄弱。
自上个世纪八十年代改革开放以来,我国的许多行业如通信、IT业甚至汽车行业籍着开放的契机,或通过引入资金,或通过引入技术,均获得了长足的发展,缩小了与世界先进水平的差距。
但在医药行业,由于制药工业的极度分散、新药研发机构的经济实力有限,再加上医药行业较之其它行业更为严格的行政管制制度及措施,我国的新药研发能力并没有获得长足的进展。
在发达国家对药品的严格的知识产权保护措施及压力下,我国的许多企业及科研机构只能利用国内政策的优势,通过对国外药品的仿制作为自己新药的研发途径。
这种方式虽然可以暂时满足医药市场的需求,缓解公民越来越强烈的对健康保障的需求,但却不能从根本上提高国内医药行业的研发水平,更不可能籍此缩小与发达国家医药行业研发水平的差距。
在加入WTO以后,进入知识经济的时代,我们面临的形势是一方面以TRIPS 协议为代表的国际知识产权保护制度越来越趋于完善,致使我国医药行业通过仿制国外药品来提高自己的医药研发水平越来越不现实;另一方面研发具有自主知识产权的新药特别是充分利用传统医药中的中药资源研发新药已成为我国医药企业和研发机构所独有的优势。
简单的说,机遇与挑战并存。
能否抓住机遇,战胜挑战,并缩小与发达国家医药行业新药研发水平的差距,甚至在中药领域形成新药研发的垄断性优势,这是摆在国内医药行业的一道难题。
对于新药研发过程中相关成果的知识产权保护是解开这道难题的法律保障。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能够让首仿企业在相当长的时间内独家的占领市场。
这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾:有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。
为了解决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。
在如今看,这种光限制自家人的规定,实属汉奸条款。
但在当时,却是有益的,如果不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护期却显得如此的不合时宜。
还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新药审批办法》以后,就已经没有新药保护期了。
另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。
无论新药保护期,还是过渡期,都已经是历史名词了,会逐渐湮没。
2.行政保护期,这是对我国早期专利法的妥协。
中国85~93年间的《专利法》不保护药品的知识产权,这和“No patent, no drug”的国际新药开发认知是相悖的,于是在国际社会(其实就是那某个强国)的强烈抗议下,中国作出了一个行政干预的补救措施,就是但凡某外企的品种在85-93间在国外享有知识产权或独占权且未过期者,可以提出申请,获得7.5年的行政保护,只要得到该保护,则在保护期内既不再允许批准国产,也不允许批准其他的进口。
详见《药品行政保护条例》。
按道理来说,通产药品的专利也就20年,所以03年就应该不再存在可以获得行政保护的品种,但是,某些时候,其品种在国外的专利可以按法规(例如美国的《药品价格竞争和专利期恢复法》(Drug Price Competition and Patent Term Restoration Act))得以延长,所以,现在还陆陆续续有行政保护的申请,但在过几年估计就差不多没有了,那时,行政保护自然湮灭。
行政保护是专利的补偿,所以和专利保护期一样,其他企业的同品种仿制可以在行政保护到期前2年申报,但行政保护到期后方能批准仿制。
而且,其在本国的独占权过期的话,哪怕行政保护期尚未满7.5年,也同时无效。
3.专利保护期,这个没什么可说的,但凡在专利期内的,都不能进口和国产。
可是,如果你认为可以规避其专利,或者该专利尚未授权,则照样可以申请——专利是可以诉无效来破解的。
这里再说说题外话,前年有段时间,注册司中药处压着一些品种不批(宫炎平胶囊之类),说是有专利纠纷问题,语焉不详。
这是违反《行政许可法》的,因为专利是归知识产权局管的,而且属于“民不告,官不究”的情况,是否侵权,要专利申请人向法院打官司,判下来才能说明是否侵权,药监局没有权利审查专利是否侵权,反正企业在申报时都提交了《不侵权声明》,保证自己承担后果,没注册司什么事。
在专利到期前2年,就可以提交仿制的注册申请,等专利到期后方能批准。
4.中药品种保护,这个和进口关系不大,不讨论了。
以后我会发个中药走向世界方面的话题,我在那里讨论中药品种保护的问题。
5.监测期,如上述,新药行政保护已经沦为事实上的汉奸条款,只制肘国产而有利进口,已经不合时宜;而且这样的行政干预也有逻辑上的矛盾。
所以,在2002年《药品注册管理办法(试行)》中,提出了“监测期”的概念,这个概念号称为了用药的安全,对于首次上市使用的药品,给予若干时间的监测期,貌似合情合理,但大家心知肚明,在实战中,药企仍然将他视为一种保护期。
监测期规定,在未到期前,不受理进口和国产的注册申请,这相比“新药保护期”而言,不但更加平衡,也更加“合理”(例如改剂型没有监测期,中药6.1没有监测期等,都是合理的,早期原料药也批监测期很不合理,不过后来改正了)。
而且,深层次的看,它的法律基础是修订后的《药品管理法实施条例》中的新药定义:“没有在中国境内销售过的药”就是“新”药。
——题外话,这个“新药”定义,却成了改剂型泛滥的法律依据。
值得注意的是,监测期必须国产品种才能申请,进口药品没有资格申请监测期。
大面儿上的说法是进口的在国外已经上市过,不用再监测了,但实战中,却是有利于国产的爱国条款,这个咱们自己知道就行了。
还有就是,首家通过审批进入监测期时,如果其他国产厂家的同品种已经批准了临床,则一起加入该监测期俱乐部;但如果彼时尚未获得临床批件,那么就会被退审出局,俗称“关门”。
——能不能挤进门,对很多药企来说,至关重要。
那么,监测期是不是就一点破解办法都没有了呢?《药品注册管理办法》附件二中有这么一句话:
注册分类1~5的品种为新药,注册分类6的品种为已有国家标准的药品。
对监测期内的新药,如生产工艺确有重大改进,经国家食品药品监督管理局批准后,仍可按照该新药原注册分类申报。
这一段的意思是,监测期是可以规避的,但条件是“生产工艺确有重大改进”,注意是“改进”而不是“改变”,这就意味着,必须是一种改善、提高的工艺改变才行。
若能如此,则监测期随时可破。
——关于这个条款的实际可操作性,专业人士自有把握。
此外,需要强调的是,增加新的适应症,无论是化药1.6,还是3.4,都是没有“监测期”的。
6.标准试行期,说白了,就是专门针对国内企业,专门针对改剂型注册的一个行政干预。
看看《药品注册管理办法》相关的内容就可以知道,它和进口注册是没有任何关系。
其实标准试行期在实战中已经沦为一种对改剂型的“保护期”。
无论是2002年的“试行版”《药品注册管理办法》,还是2005年“转正版”《药品注册管理办法》,标准试行期都煌煌其间,从这些法规规定,可以确确凿凿的看出一段时间以来国家对“改剂型”的纵容和鼓励。
进口注册的药品标准是不公布、不试行也不存在转正一说的,所以,标准试行期就是中国人和中国人自己玩儿的游戏规则。
当前的大气候已经不鼓励改剂型了,这个标准试行期的日子,恐怕也该到头了。
——还有一点,理论上来说,标准试行期是2年,再加上药典会审查复核的1年行政时间,按说3年就该转正了,但事实却往往未必如此。
在实战中企业都是将它作为“保护期”来看待的,这样的心态下,可能会采取各种办法,让这个试行期越晚转正越好。
