氯化钠溶液的密度
化学实验报告 配置氯化钠溶液

化学实验报告【实验目的】1、练习配制一定溶质质量分数或量浓度一定的溶液。
2、加深对溶质的质量分数以及量浓度概念的理解。
【实验器材】托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管。
氯化钠、浓盐酸溶液、蒸馏水、容量瓶、漏斗。
【实验步骤】1、配置质量分数为6%的氯化钠溶液(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:NaCl:50g*6%=3g ;水:47g。
(2)称量:用托盘天平称取所需的氯化钠,放入烧杯中。
(3)量取:用量筒量取所需的水(水的密度可近似看作1g/cm3),倒入盛有氯化钠的烧杯中。
(4)溶解:用玻璃棒搅拌,使氯化钠溶解。
2、用已配制好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:所得溶液中,氯化钠的质量为50g*3%=1.5g,所以需要质量分数为6%的氯化钠溶液25g(体积为26ml),蒸馏水25g(体积约为25ml)(2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。
(3)混匀:用玻璃棒搅拌,使溶液混合均匀。
将上述配制好的溶液分别转入试剂瓶内,并贴上标签,区分开来。
3、配制250ml,2mol/L的稀盐酸(1)计算所需浓盐酸的体积设所需浓盐酸的体积为V1,则C1*V1=0.25L*2mol/L12mol/L*V1=0.25L*2mol/L解得该体积为41.7ml(2)用量筒量取41.7ml的浓盐酸(3)在烧杯中加入少量(大大少于250ml)的水和量取好的浓盐酸,用玻璃棒搅拌稀释。
(4)使用漏斗将烧杯内的溶液转移到容量瓶中。
(5)用水洗涤盛过盐酸的量筒和烧杯,并把洗涤液转移至容量瓶。
(6)定容:用胶头滴管继续加水,直至溶液凹液面达到250ml刻度。
(7)压紧容量瓶瓶盖将溶液摇匀。
氯化钠溶液的配制

实验活动5
二、配制质量分数为3%的氯化钠溶液 用已配好的质量分数为6%的氯化钠溶液(密度约为 1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。 1、计算: 6%的氯化钠溶液 25 g 50g×3%÷6%=25g (体积 24 mL );25g÷1.04g/cm3=24mL 水 25 g。 50g-25g=25g 2、量取:用量筒量取24mL的6%氯化钠溶液和25mL 的水,倒入烧杯中。 3、混匀: 用玻璃棒搅拌,使溶液混合均匀。 三、把配制好的上述两种氯化钠溶液分别装入试剂瓶中, 盖好瓶塞并贴上标签(标签中应包括药品名称和溶液 中溶质的质量分数),放到试剂柜中。 【问题与交流】
[2009]“食盐加碘”通常是在氯 化钠中加人碘酸钾。右图是氯 化钠和碘酸钾的溶解度曲线图。 下列说法错误的是[ ]C A.氯化钠易溶于水 B.碘酸钾的溶解度随温度 升高而增大 C.20℃时不可能制得相同 质量分数的碘酸钾溶液和氯化 钠溶液 D.20℃时两者的饱和溶液, 氯化钠的质量分数大
课 题 3 溶 液 的 浓 度
[2010]KCl是一种常用的钾肥,其溶解度如下表。下列说 法正确的是( D ) 0 20 40 60 温度/℃ 34.0 40.0 45.5] 溶解度/g 27.6 A.KCI饱和溶液中不能再溶解其他物质 B.20℃时,100 g KCl饱和溶液中含KCI 34.0 g C.40℃时,KCl饱和溶液的质量分数为40.0% D.60℃的KCl饱和溶液降温至20℃,有晶体析出
第九单元 配制
实验活动5 一定溶质质量分数的氯化钠溶液的配制 【实验目的】1、练习配制一定溶质质量分数的溶液。 2、加深对溶质的质量分数概念的理解。 【实验用品】托盘天平、烧杯、玻璃棒、药匙、量筒、 胶头滴管、 试剂瓶。氯化钠、蒸馏水。 【实验步骤】 一、配制质量分数为6%的氯化钠溶液 1、计算: 氯化钠:50g×6%=3g 水:50g–3g= 47g 2、称量: 用托盘天平称量3g氯化钠,放入烧杯中; 3、量取: 用量筒量取47mL的水,倒入烧杯中。 4、溶解: 用玻璃棒搅拌,使氯化钠溶解。 5、装瓶: 把配好的溶液装入试剂瓶,盖好瓶塞。 6、贴标签: 写上名称[氯化钠溶液]和溶质的质量分数[6%] 最后放到试剂柜中。
化学实验报告 配置氯化钠溶液

化学实验报告【实验目的】1、练习配制一定溶质质量分数或量浓度一定的溶液。
2、加深对溶质的质量分数以及量浓度概念的理解。
【实验器材】托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管。
氯化钠、浓盐酸溶液、蒸馏水、容量瓶、漏斗。
【实验步骤】1、配置质量分数为6%的氯化钠溶液(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:NaCl:50g*6%=3g ;水:47g。
(2)称量:用托盘天平称取所需的氯化钠,放入烧杯中。
(3)量取:用量筒量取所需的水(水的密度可近似看作1g/cm3),倒入盛有氯化钠的烧杯中。
(4)溶解:用玻璃棒搅拌,使氯化钠溶解。
2、用已配制好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:所得溶液中,氯化钠的质量为50g*3%=1.5g,所以需要质量分数为6%的氯化钠溶液25g(体积为26ml),蒸馏水25g(体积约为25ml)(2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。
(3)混匀:用玻璃棒搅拌,使溶液混合均匀。
将上述配制好的溶液分别转入试剂瓶内,并贴上标签,区分开来。
3、配制250ml,2mol/L的稀盐酸(1)计算所需浓盐酸的体积设所需浓盐酸的体积为V1,则C1*V1=0.25L*2mol/L12mol/L*V1=0.25L*2mol/L解得该体积为41.7ml(2)用量筒量取41.7ml的浓盐酸(3)在烧杯中加入少量(大大少于250ml)的水和量取好的浓盐酸,用玻璃棒搅拌稀释。
(4)使用漏斗将烧杯内的溶液转移到容量瓶中。
(5)用水洗涤盛过盐酸的量筒和烧杯,并把洗涤液转移至容量瓶。
(6)定容:用胶头滴管继续加水,直至溶液凹液面达到250ml刻度。
(7)压紧容量瓶瓶盖将溶液摇匀。
仅供个人用于学习、研究;不得用于商业用途。
For personal use only in study and research; not for commercial use.Nur für den persönlichen für Studien, Forschung, zu kommerziellen Zwecken verwendet werden.Pour l 'étude et la recherche uniquementà des fins personnelles; pas à des fins commerciales.толькодля людей, которые используются для обучения, исследований и не должны использоваться в коммерческих целях.以下无正文仅供个人用于学习、研究;不得用于商业用途。
nacl密度

1.nacl密度?
答:nacl密度为2.165。
NaCl,食盐的主要成分,离子型化合物。
无色透明的立方晶体,熔点为801 ℃,沸点为1413 ℃,有咸味,含杂质时易潮解;溶于水或甘油,难溶于乙醇,不溶于盐酸,水溶液中性。
在水中的溶解度随着温度的升高略有增大。
当温度低于0.15 ℃时可获得二水合物NaCl·2H2O。
氯化钠大量存在于海水和天然盐湖中,可用来制取氯气、氢气、盐酸、氢氧化钠、氯酸盐、次氯酸盐、漂白粉及金属钠等,是重要的化工原料;可用于食品调味和腌鱼肉蔬菜,以及供盐析肥皂和鞣制皮革等;经高度精制的氯化钠可用来制生理食盐水,用于临床治疗和生理实验,如失钠、失水、失血等情况。
可通过浓缩结晶海水或天然的盐湖或盐井水来制取氯化钠。
渗透压摩尔浓度标准物质(氯化钠溶液)

一、概述渗透压是指在一定温度下,溶液中溶质的浓度。
在生物学和生物化学中,渗透压是一个重要的生物学参数,它对细胞膜的通透性、生长和代谢活动等有着重要影响。
测定渗透压需要标准物质,而氯化钠溶液常被用作标准物质。
本文将以渗透压摩尔浓度标准物质(氯化钠溶液)为主题,介绍其相关知识。
二、氯化钠溶液的制备1. 氯化钠(NaCl)的质量浓度计算公式:C = M/V,其中C为质量浓度,M为氯化钠的质量(g),V为溶液的体积(L)。
根据需要制备不同浓度的氯化钠溶液,可按公式计算所需质量和体积。
2. 将所需质量的氯化钠称量于容器中。
3. 加入适量的去离子水,并充分搅拌溶解。
三、氯化钠溶液的性质1. 密度:氯化钠溶液的密度随浓度的变化而变化,通常可以在标准条件下进行测定。
2. 折射率:氯化钠溶液的折射率也随浓度的变化而变化,可用折射计进行测定。
3. 渗透压:氯化钠溶液的渗透压随浓度的变化而变化,可通过渗透压计进行测定。
四、氯化钠溶液的应用1. 生物学实验:氯化钠溶液常用于生物学实验中,用作细胞培养液的基础成分或生理生化实验的试剂。
2. 医学诊断:氯化钠溶液也常用于医学诊断中,用作盐水冲洗、输液等。
五、渗透压摩尔浓度标准物质的重要性1. 在生物学和生物化学研究中,需要准确测定细胞内外的渗透压,而渗透压摩尔浓度标准物质(氯化钠溶液)可以提供准确的浓度参考。
2. 渗透压摩尔浓度标准物质的准确制备和使用,对实验结果的准确性和可重复性至关重要。
六、渗透压摩尔浓度标准物质的测定方法1. 渗透压计法:利用渗透压计通过测定氯化钠溶液的渗透压来确定其摩尔浓度。
2. 冰点降压法:利用氯化钠溶液的冰点降压来确定其摩尔浓度。
七、结语渗透压摩尔浓度标准物质(氯化钠溶液)是生物学和生物化学研究中的重要参考物质,其准确制备和使用对实验结果具有重要影响。
希望本文能够帮助读者更深入地了解渗透压摩尔浓度标准物质(氯化钠溶液)的相关知识,为科研工作者和实验人员提供参考与帮助。
化学实验报告 配置氯化钠溶液

化学实验报告【实验目的】1、练习配制一定溶质质量分数或量浓度一定的溶液。
2、加深对溶质的质量分数以及量浓度概念的理解。
【实验器材】托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管。
氯化钠、浓盐酸溶液、蒸馏水、容量瓶、漏斗。
【实验步骤】1、配置质量分数为6%的氯化钠溶液(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:NaCl:50g*6%=3g ;水:47g。
(2)称量:用托盘天平称取所需的氯化钠,放入烧杯中。
(3)量取:用量筒量取所需的水(水的密度可近似看作1g/cm3),倒入盛有氯化钠的烧杯中。
(4)溶解:用玻璃棒搅拌,使氯化钠溶解。
2、用已配制好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:所得溶液中,氯化钠的质量为50g*3%=1.5g,所以需要质量分数为6%的氯化钠溶液25g(体积为26ml),蒸馏水25g(体积约为25ml)(2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。
(3)混匀:用玻璃棒搅拌,使溶液混合均匀。
将上述配制好的溶液分别转入试剂瓶内,并贴上标签,区分开来。
3、配制250ml,2mol/L的稀盐酸(1)计算所需浓盐酸的体积设所需浓盐酸的体积为V1,则C1*V1=0.25L*2mol/L12mol/L*V1=0.25L*2mol/L解得该体积为41.7ml(2)用量筒量取41.7ml的浓盐酸(3)在烧杯中加入少量(大大少于250ml)的水和量取好的浓盐酸,用玻璃棒搅拌稀释。
(4)使用漏斗将烧杯内的溶液转移到容量瓶中。
(5)用水洗涤盛过盐酸的量筒和烧杯,并把洗涤液转移至容量瓶。
(6)定容:用胶头滴管继续加水,直至溶液凹液面达到250ml刻度。
(7)压紧容量瓶瓶盖将溶液摇匀。
仅供个人用于学习、研究;不得用于商业用途。
For personal use only in study and research; not for commercial use.Nur für den persönlichen für Studien, Forschung, zu kommerziellen Zwecken verwendet werden.Pour l 'étude et la recherche uniquementà des fins personnelles; pas à des fins commerciales.толькодля людей, которые используются для обучения, исследований и не должны использоваться в коммерческих целях.以下无正文仅供个人用于学习、研究;不得用于商业用途。
人教版九年级化学下册一定溶质质量分数的氯化钠溶液的配制实验报告单

班级:姓名:桌号:日期:年月日
实验名称:一定溶质质量分数的氯化钠溶液的配制
一、实验目的:1、练习配制一定溶质质量分数的溶液。
2、加深对溶质的质量分数概念的理解。
二、实验用品:烧杯、玻璃棒、托盘天平、量筒、胶头滴管、药匙、试剂瓶、水、氯化钠。
三、实验步骤:
1、配制质量分数为6%的氯化钠溶液.
(1)、计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:
氯化钠g;水gmL(水的密度可近似看做1g/cm3)
(2)、称量:用称量氯化钠克,放入烧杯中。
(3)、量取:用量取mL的水。倒入盛有氯化钠的烧杯中。用搅拌使之完全溶解。其中玻璃棒的作用。
(4)、溶解:Байду номын сангаас搅拌,使氯化钠溶解。
2、配制质量分数为3%的氯化钠溶液。
用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水的质量分别为:6%的氯化钠溶液g(体积mL);水g(体积mL)。
(2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。
(3)混匀:用玻璃棒搅拌,使溶液混合均匀。
3、把配制好的上述两种氯化钠溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。
初中化学 配制氯化钠溶液实验报告

实验探究∶一定溶质质量分数的氯化钠溶液的配制初中化学实验报告班级:学生姓名:日期:2019·02·25一【实验目的】1加深对溶质质量分数理解2简单了解配制过程及其操作步骤二【实验仪器与药品】氯化钠,烧杯,玻璃棒,量筒,胶头滴管,试剂瓶,托盘天平,药匙三、【实验步骤】1、配制质量分数为6%的氯化钠溶液。
(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠_______g;水__________g。
(2)称量:用_________称量所需的氯化钠,放入____________中。
(3)量取:用_____________量取所需的水(水的密度可近似看做1g/cm3),倒入盛有氯化钠的_____________中。
(4)溶解:用______________搅拌,使氯化钠溶解。
整个配制过程如下图所示。
2、配制质量分数为3%的氯化钠溶液。
用已配好的质量分数为6%的氯化钠溶液(密度约为1.041g/cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水分别为:6%的氯化钠溶液____________g(体积__________ml);水__________g。
(2)量取:用________量取所需的氯化钠溶液和水,倒入________中。
(3)混匀:用____________搅拌,使溶液混合均匀。
3、把配制好的上述俩种氯化钠的溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液的溶质的质量分数),放到实验桌上。
【问题与交流】1.用量筒量取液体时,读数应注意什么?2.准确配制一定溶质质量分数的溶液,在实际应用中有什么意义?请举例;。
任务一 一次盐水的制备计算试题与答案.
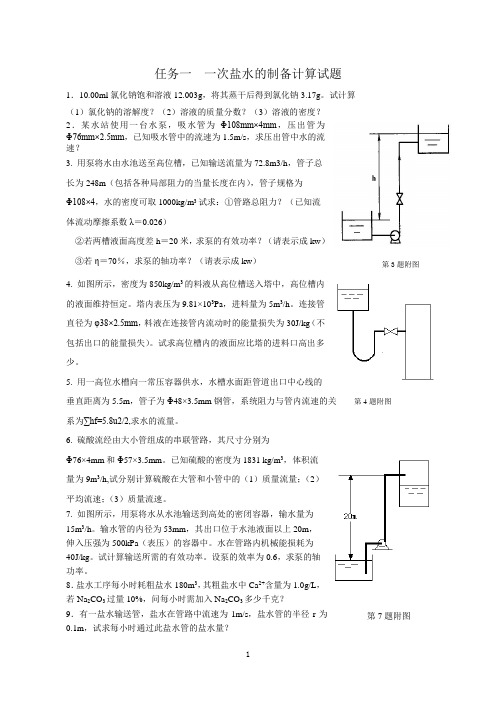
第3题附图第4题附图第7题附图 任务一 一次盐水的制备计算试题1.10.00ml 氯化钠饱和溶液12.003g ,将其蒸干后得到氯化钠3.17g 。
试计算(1)氯化钠的溶解度?(2)溶液的质量分数?(3)溶液的密度?2.某水站使用一台水泵,吸水管为Φ108mm×4mm ,压出管为Φ76mm×2.5mm ,已知吸水管中的流速为1.5m/s ,求压出管中水的流速?3. 用泵将水由水池送至高位槽,已知输送流量为72.8m3/h ,管子总长为248m (包括各种局部阻力的当量长度在内),管子规格为Φ108×4,水的密度可取1000kg/m 3试求:①管路总阻力?(已知流体流动摩擦系数λ=0.026)②若两槽液面高度差h =20米,求泵的有效功率?(请表示成kw )③若η=70%,求泵的轴功率?(请表示成kw )4. 如图所示,密度为850kg/m 3的料液从高位槽送入塔中,高位槽内的液面维持恒定。
塔内表压为9.81×103Pa ,进料量为5m 3/h 。
连接管直径为φ38×2.5mm ,料液在连接管内流动时的能量损失为30J/kg (不包括出口的能量损失)。
试求高位槽内的液面应比塔的进料口高出多少。
5. 用一高位水槽向一常压容器供水,水槽水面距管道出口中心线的垂直距离为5.5m ,管子为Φ48×3.5mm 钢管,系统阻力与管内流速的关系为∑hf=5.8u2/2,求水的流量。
6. 硫酸流经由大小管组成的串联管路,其尺寸分别为Φ76×4mm 和Φ57×3.5mm 。
已知硫酸的密度为1831 kg/m 3,体积流量为9m 3/h,试分别计算硫酸在大管和小管中的(1)质量流量;(2)平均流速;(3)质量流速。
7. 如图所示,用泵将水从水池输送到高处的密闭容器,输水量为15m 3/h 。
输水管的内径为53mm ,其出口位于水池液面以上20m ,伸入压强为500kPa (表压)的容器中。
3%的氯化钠溶液标签书写

3% 的氯化钠溶液标签书写在医疗和实验室领域,氯化钠溶液是一种常见的液体,用于输液、洗涤和实验等。
正确书写氯化钠溶液的标签非常重要,可以确保溶液的正确性和安全性。
本文将介绍如何正确书写 3% 的氯化钠溶液标签。
下面是本店铺为大家精心编写的5篇《3% 的氯化钠溶液标签书写》,供大家借鉴与参考,希望对大家有所帮助。
《3% 的氯化钠溶液标签书写》篇13% 的氯化钠溶液是一种常用的液体,在医疗和实验室领域都有广泛的应用。
正确书写氯化钠溶液的标签非常重要,可以确保溶液的正确性和安全性。
下面是书写 3% 的氯化钠溶液标签的步骤:1. 标签应该包括以下信息:溶液名称、浓度、体积、生产日期和批号。
对于 3% 的氯化钠溶液,标签上应明确标注“3% 氯化钠溶液”或“3%NaCl 溶液”。
2. 浓度应该以百分数的形式表示,并在标签上醒目地标注。
对于 3% 的氯化钠溶液,浓度应标注为“3%”。
3. 标签上应标注溶液的体积,通常以毫升 (mL) 为单位。
例如,如果瓶中有 1000mL 的 3% 氯化钠溶液,则应在标签上标注“1000mL”。
4. 生产日期和批号也应该在标签上注明。
生产日期应按照年、月、日的格式标注,例如“2023 年 2 月 18 日”;批号应按照一定的格式标注,例如“230218-01”。
5. 标签的颜色和字体也应该一致,并且应该清晰易读。
建议使用黑色或蓝色的笔或打印机打印标签。
6. 标签的位置应该在瓶子的正面或侧面,以便于观察和识别。
如果瓶子有多个面,则应在每个面上都标注标签。
正确书写 3% 的氯化钠溶液标签非常重要,可以确保溶液的正确性和安全性。
《3% 的氯化钠溶液标签书写》篇23% 氯化钠溶液的标签应该包含以下信息:1. 产品名称:3% 氯化钠溶液2. 规格:1000ml/瓶3. 主要成分:氯化钠 30g/1000ml4. 性状:无色至微黄色透明液体5. 适应症:用于补充体液、纠正脱水、酸中毒及维持体内电解质平衡6. 用法用量:静脉滴注,用量视病情而定,成人每次 1-2 瓶,每日总量 2-4 瓶。
检验氯化钠的方法

检验氯化钠的方法氯化钠是一种常见的无机化合物,也是一种重要的食盐和化工原料。
日常生活中,我们可以用不同的方法来检验氯化钠的纯度和质量。
一、物理性质检验1.外观检验:氯化钠为白色结晶固体,可以通过观察样品的外观检验其纯度。
如果出现杂质、颜色变化或非结晶形态,则可能是由于杂质的存在。
2.溶解性检验:氯化钠在常温下具有较高的溶解度。
将样品加入适量的水中,如果完全溶解,则说明纯度较高。
如果有残留物或悬浮物,则说明可能存在不纯物质。
3. 密度测定:利用密度差异也可以初步判断样品是否为氯化钠。
氯化钠的密度为2.16 g/cm³,在与水的混合物中测量其密度,并与纯水进行对比,可以判断样品的纯度。
二、化学性质检验1.氢气氧化法(检验氯离子):将样品溶解在适量的水中,加入适量的硫酸。
然后将生成的气体通入盐酸中,观察是否产生白色沉淀,若有沉淀生成,可以判定氯化钠中存在可溶性氯化银离子,证明样品中有氯离子。
2.硫代硫酸钠法(检验阴离子):取样品溶解在适量的水中,加入少量的氢氧化钡溶液,用硫酸将其酸化,通入氢硫酸钠后观察是否产生沉淀。
如果产生沉淀,可以判断样品中的阴离子是硫酸根离子。
3.美拉德试剂法(检验金属离子):将样品溶解在适量的水中,加入适量的美拉德试剂溶液,观察是否产生颜色变化。
根据颜色的变化可以初步鉴别样品中的金属离子种类。
三、仪器分析方法1.火焰光度法:利用氯化钠中的钠离子在火焰中的吸收特性,可以通过测量其发射光谱来确定氯化钠样品中钠的含量。
2.离子色谱法:利用氯化钠样品中的阳离子和阴离子在特定条件下的分离和检测,可以确定样品中氯离子的含量。
以上是常用的几种检验氯化钠的方法,通过综合运用这些方法可以得出较为准确的结论。
在实际应用中,需要根据具体情况选择合适的检验方法,并结合实验室仪器和设备的使用进行分析。
氯化钠物理化学性质

氯化钠物理化学性质氯化钠物理性质熔点:801°C1074K沸点:1465°C1738K密度:2.165克每立方厘米折光率:1.3431mol/L溶液在589nm氯化钠的晶体形成立体对称。
其晶体结构中,较大的氯离子排成立方最密堆积,较小的钠离子则填充氯离子之间的八面体的空隙。
每个离子周围都被六个其他的离子包围着。
这种结构也存在于其他很多化合物中,称为氯化钠型结构或石盐结构。
氯化钠是白色无臭结晶粉末。
熔点801℃,沸点1465℃微溶于乙醇、丙醇、丁烷,在和丁烷互溶后变为等离子体,易溶于水。
NaCl分散在酒精中可以形成胶体.,其水中溶解度因氯化氢存在而减少,几乎不溶于浓盐酸。
无臭味咸,易潮解。
易溶于水,溶于甘油,几乎不溶于乙醚。
以矿物岩盐广泛存在于自然界中。
把以矿盐形式存在地下的盐水蒸发而得井盐、岩盐;将海水用阳光晒干而得海盐;将井盐、岩盐或海盐精制而得纯净氯化钠。
氯化钠化学性质1、制取金属钠:2NaCl=电解=2NaCl2↑2、电解食盐水:2NaCl2H2O=电解=H2↑Cl2↑2NaOH3、和硝酸银反应:NaClAgNO3=NaNO3AgCl↓4、氯化钠固体中加入浓硫酸:2NaCl+H2SO4浓=加热=2HCl↑+Na2SO4NaCl+H2SO4浓 =微热=HCl↑+NaHso4检验方法:1、向溶液中滴入硝酸酸化的硝酸银溶液,有白色沉淀产生。
2、用铂丝蘸取少量溶液,置于酒精灯上灼烧,火焰呈黄色,可证含有NaCl。
氯化钠储存方法操作注意事项:密闭操作,加强通风。
操作人员必须经过专门培训,严格遵守操作规程。
建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。
避免产生粉尘。
避免与氧化剂接触。
搬运时要轻装轻卸,防止包装及容器损坏。
配备泄漏应急处理设备。
倒空的容器可能残留有害物。
储存注意事项:储存于阴凉、通风的库房。
远离火种、热源。
应与氧化剂分开存放,切忌混储。
