第四章 福州大学 有机化学
大学有机化学第四章

第四章炔烃、二烯烃要求深刻理解和熟练掌握的内容:炔烃的化学性质;共轭二烯烃的结构;共轭二烯烃的化学性质要求一般理解和掌握的内容:乙炔的制法及用途;二烯烃的分类和命名;天然橡胶及合成橡胶难点:共轭效应和超共轭效应分子中含有碳碳叁键的烃叫做炔烃。
其通式为C n H2n-2;官能团为-C C-(一)炔烃一、炔烃的异构和命名(1)异构现象——从丁炔开始有异构体.由碳链不同和叁键位置不同所引起。
由于在碳链分支的地方不可能有叁键的存在,所以炔烃的异构体比同碳原子数的烯烃要少。
同时,由于叁键碳上只可能连有一个取代基,因此炔烃不存在顺反异构现象.(2) 炔烃的命名◎系统命名法:①以包含叁键在内的最长碳链为主链,按主链的碳原子数命名为某炔,代表叁键位置的阿拉伯数字以取最小的为原则而置于名词之前,侧链基团则作为主链上的取代基来命名.②炔烃分子中同时含有碳碳双键时,命名时选择含有双键和三键的最长碳链为主链,先命名烯再命名炔。
编号要使两者位次数值和最小,若有选择时应使双键的位次最小。
例如:乙炔分子是一个线形分子,四个原子都排布在同一条直线上.乙炔的两个碳原子共用了三对电子.二、炔烃的结构以最简单的分子乙炔为例炔烃的结构特征是分子中具有碳碳叁键。
由炔烃叁键同一个碳原子上的两个sp杂化轨道所组成的σ键是在同一直线上方向相反的两个键.•在乙炔中,每个碳原子各形成了两个具有圆柱形轴对称的σ键.它们是Csp -Csp和Csp-Hs.乙炔分子中的σ键乙炔分子中的π键◎乙炔的每个碳原子还各有两个相互垂直的未参加杂化的p轨道,不同碳原子的p轨道又是相互平行的.◎一个碳原子的两个p轨道和另一个碳原子对应的两个p轨道,在侧面交盖形成两个碳碳π键.两个互相垂直的π键中电子云的分布位于σ键轴的上下和前后部位,当π轨道重叠后,其电子云形成以C-Cσ键为对称轴的圆筒形状。
乙炔分子的π电子云三、炔烃的物理性质(1)炔烃的物理性质和烷烃,烯烃基本相似;(2)低级的炔烃在常温下是气体,但沸点比相同碳原子的烯烃略高;(3)随着碳原子数的增加,沸点升高.(4)叁键位于碳链末端的炔烃(又称末端炔烃)的沸点低于叁键位于碳链中间的异构体.(5)炔烃不溶于水,但易溶于极性小的有机溶剂,如石油醚,苯,乙醚,四氯化碳等.◎与硝酸银的液氨溶液作用CH≡CH+2Ag(NH3)2NO3→AgC≡CAg↓+2NH4NO3+2NH3乙炔银(白色沉淀)RC≡CH+Ag(NH3)2NO3→RC≡CAg↓+NH4NO3+NH3◎与氯化亚铜的液氨溶液作用CH≡CH+2Cu(NH3)2Cl→CuC≡CCu↓+2NH4Cl+2NH3乙炔亚铜(红色沉淀)RC≡CH+Cu(NH3)2Cl→RC≡CCu↓+NH4NO3+NH3(2) 生成炔化银和炔化亚铜--炔烃的定性检验注:1.炔化物和无机酸作用可分解为原来的炔烃。
《有机化学》章节习题答案.docx
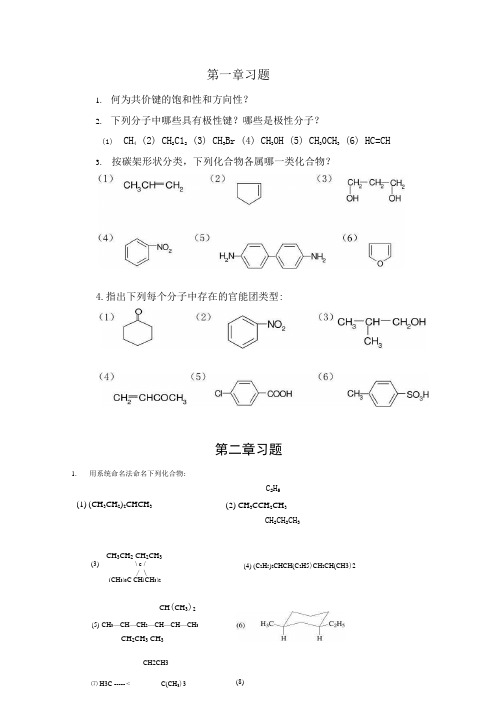
第一章习题1.何为共价键的饱和性和方向性?2.下列分子中哪些具有极性键?哪些是极性分子?(1)CH4 (2) CH2C12 (3) CH3Br (4) CH3OH (5) CH30CH3 (6) HC=CH3.按碳架形状分类,下列化合物各属哪一类化合物?第二章习题1.用系统命名法命名下列化合物:(1) (CH3CH2)2CHCH3C2H5 (2) CH3CCH2CH3CH2CH2CH3CH3CH2 CH2CH3(3)\ c // \(CH3)3C CH(CH3)2(4) (C2H5)2CHCH(C2H5)CH2CH(CH3)2CH(CH3)2(5)CH3—CH—CH2—CH—CH—CH3CH2CH3 CH3CH2CH34.指出下列每个分子中存在的官能团类型:⑺ H3C ----- < C(CH3)3 (8)2. 写出下列化合物的构造式:(1) 由一个叔丁基和异丙基组成的烷炷; (2) 含一侧链甲基,分子量为98的环烷炫(3) 分子量为114,同时含有1°、2°、3。
、4。
碳的烷炷。
3.写出下列化合物的结构式,如其名称与系统命名原则不符,请予以改正。
(1)3, 3-二甲基丁烷 (2)2, 3-二甲基-2-乙基丁烷 (3) 4 -异丙基庚烷(4) 3> 4-二甲基-3 -乙基戊烷(5)3, 4, 5-三甲基-4-正丙基庚烷 ⑹2 -叔丁基-4, 5 -二甲基己烷4. 相对分子质量为72的烷任进行高温氯化反应,根据氯化产物的不同,推测各种烷炷的结构式。
(1)只生成一种一氯代产物(2)可生成三种不同的一氯代产物(3) 生成四种不同的一氯代产物 (4)只生成二种二氯代产物 5.不查表将下列烷炷的沸点由高至低排列成序: (1)2, 3-二甲基戊烷 (2) 2-甲基己烷 (3)正庚烷 (4) 正戊烷(5)环戊烷6. 写出下列化合物的优势构象—( 「CH2CH3 (1) BrCH 2CH 2Cl (2) CH 3CH 2CH 2CH 2CH 3 (3) '、'、—/(4)反-1-甲基-4-叔丁基环己烷7. 写出1, 3-二甲基环已烷和1-甲基-4-异丙基环已烷的顺、反异构体优势构象,并比较每组中哪个稳定。
福州大学化学化工学院化学系07级有机化学(下)期中考试(含答案)
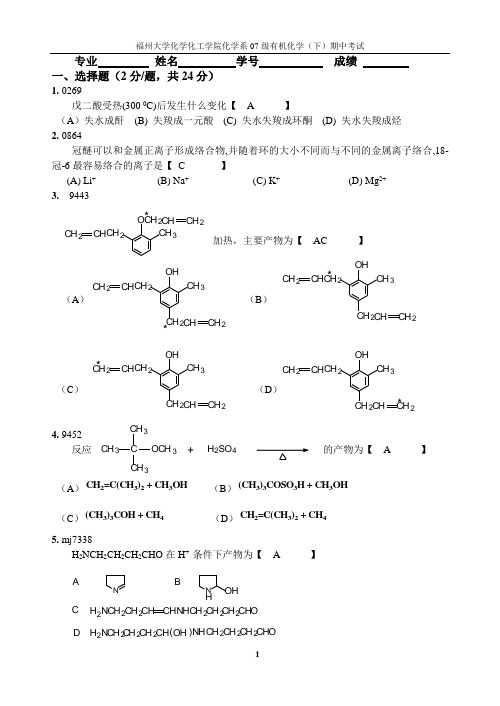
专业 姓名 学号 成绩 一、选择题(2分/题,共24分)1. 0269戊二酸受热(300 0C)后发生什么变化【 A 】(A )失水成酐 (B) 失羧成一元酸 (C) 失水失羧成环酮 (D) 失水失羧成烃 2. 0864冠醚可以和金属正离子形成络合物,并随着环的大小不同而与不同的金属离子络合,18-冠-6最容易络合的离子是【 C 】 (A) Li + (B) Na + (C) K + (D) Mg 2+ 3. 9443加热,主要产物为【 AC 】(A ) (B )(C ) (D )4. 9452反应的产物为【 A 】 (A )CH 2=C(CH 3)2 + CH 3OH (B )(CH 3)3COSO 3H + CH 3OH (C )(CH 3)3COH + CH 4 (D )CH 2=C(CH 3)2 + CH 4 5. mj7338 H 2NCH 2CH 2CH 2CHO 在H + 条件下产物为【 A 】NN HOHA BCH 2NCH 2CH 2CH CHNH CH 2CH 2CH 2CHOD H 2N CH 2CH 2CH NHCH 2CH 2CH 2()OH CHO CH 2CH 2CH CH 2CH 3CH 2CH CH 2O *CH 2CH CH 2CH 3OHCH 2CH CH 2*CH 2CH CH 2CH 3OH CH 2CH CH 2*CH 2CH CH 2CH 3OH CH2CH 2*CH 2CH CH 2CH 3OHCH 2CH CH 2*H 2SO 4C CH 3CH3CH 3OCH 3+6. mj7361在浓硫酸处理时发生Beckmann 重排,产物为【 A 】(A )HN CH 3OC 6H 5 (B )CH 3NHC 6H 5O(C )CH 36H 5CO 2H (D )CH 3CHNH 2C 6H 57. 4109下列四个试剂,不跟CH 3CH 2COCH 2CH 3反应的是【 B 】 (A) RMgX (B) NaHSO 3饱和水溶液 (C) (C 6H 5NH 2NH 2 (D) LiAlH 4 8. 9526在碱存在下, 与1mol 溴反应时,卤化发生的位置【 B 】(A )羰基碳上 (B )亚甲基上 (C )甲基上 (D )羰基氧上 9. kxb8下列化合物水解速度最快的是【 A 】(A)(B)(C)(D)CH 3COCl H 3CCOCl H 3CCH 2COClCH 2COCl10. Lxb4最容易发生外消旋化的化合物是【 D 】(A ). (B ).(C ). (D ).11.0262HCOOH(I),CH 3COOH(II),(CH 3)2CHCOOH(III),(CH 3)3CCOOH(IV)的酸性大小【 B 】(A) IV>III>II>I (B) I>II>III>IV (C) II>III>IV>I (D) I>IV>III>II 12. jL7660通过Michael 加成反应可以合成如下哪类化合物【 A 】(A) 1,5- 二羰基化合物 (B) 1,3- 二羰基化合物 (C) 1,6- 二羰基化合物 (D) 1,4- 二羰基化合物CH 3CN C 6H 5OHCH 2C OCH 3Cl CO 2CH 3CO 2CH 3Br HO二、命名:(2分/题,共4分)1. 2.3-羟基-4,5-二甲氧基苯甲醛 N -乙基对甲苯基乙酰胺三、完成下列反应:(2分/题,共32分)1.fi5569CH 3OCH 3 + C 2H 5OH2. 5555O3. 5571PhCOCH 3 + CH 3OH4. jt3b 115. fj55886. Lt3b1CH 32COOHO42( )CH 32COOHOH?H 2,Pd/CCH 2OEtCH 3O?-OH,H 2OPhC OCH 3CH 2H 3O +?(2)Zn Hg/ HCl ŨCHOOCH 33HO CH 3H 2C ONHC 2H 5OCH 3 1. (CH 3)2CuLi/Et 2O2. H 3O ?O CH 3CH 37. 5591 PhCH=CHCHO8. 5599CHO9. 5623OO 10. 6159CHOCH 2OH11. kt3b14?HOCH 2(CH 2)4CH 2BrHOCH 2(CH 2)4CH 2COOH △(1)NaCN (2)H 3O +12. 5682OO13. 5688PhCH 2COOPh 14. 5723CH 3COO - + PhCOCH 315. 5793CH 2N(CH 3)216. kL5737+PhCHO CH 3CHO OH -?OHC(CH)4CHO?_CHO CH 2CHO+HCN( mol)?1PhCOOHO ?PhOH?PhCH C OCH 3CH 2O Ph?OH -, H 2O((21) H 2O) L iAlH 4,Et 2O ?CON(CH 3)2-COOEt四、机理题(5分/题,共10分) 写出下述反应合理的、分步的反应机理。
大学有机化学教案

大学有机化学教案第一章:有机化学导论1.1 有机化学的概念与发展历史1.2 有机化合物的特点与分类1.3 有机化学的研究方法与实验技能1.4 有机化学的基本概念与术语第二章:烷烃与卤代烃2.1 烷烃的结构与性质2.2 卤代烃的结构与性质2.3 烷烃与卤代烃的反应2.4 烷烃与卤代烃的制备方法第三章:烯烃与炔烃3.1 烯烃的结构与性质3.2 炔烃的结构与性质3.3 烯烃与炔烃的反应3.4 烯烃与炔烃的制备方法第四章:立体化学4.1 立体化学的基本概念4.2 手性碳原子与对映异构体4.3 立体化学的构型与构象4.4 立体化学的反应与合成第五章:醇、酚与醚5.1 醇的结构与性质5.2 酚的结构与性质5.3 醚的结构与性质5.4 醇、酚与醚的反应与合成第六章:羧酸与酮6.1 羧酸的结构与性质6.2 酮的结构与性质6.3 羧酸与酮的反应6.4 羧酸与酮的制备方法第七章:糖类与脂肪7.1 糖类的结构与分类7.2 糖的代谢与合成7.3 脂肪的结构与性质7.4 脂肪的代谢与合成第八章:氨基酸与蛋白质8.1 氨基酸的结构与分类8.2 蛋白质的结构与功能8.3 氨基酸的合成与代谢8.4 蛋白质的制备与性质研究第九章:杂环化合物9.1 杂环化合物的结构与分类9.2 杂环化合物的性质与反应9.3 杂环化合物的制备方法9.4 杂环化合物在药物化学中的应用第十章:有机合成反应10.1 有机合成的策略与方法10.2 碳碳键的形成与断裂反应10.3 官能团转换与修饰反应10.4 有机合成反应的调控与应用第十一章:天然有机化合物11.1 天然有机化合物的分类与分布11.2 天然有机化合物的结构与性质11.3 天然有机化合物的提取与分离11.4 天然有机化合物在药物与食品中的应用第十二章:有机金属化学12.1 有机金属化合物的结构与性质12.2 有机金属化合物的反应与合成12.3 有机金属化合物在催化与材料科学中的应用12.4 有机金属化学的研究进展与发展方向第十三章:有机光电材料13.1 有机光电材料的结构与性质13.2 有机光电材料的制备与表征13.3 有机光电材料在器件中的应用13.4 有机光电材料的研究进展与发展方向第十四章:环境有机化学14.1 环境有机污染物的来源与迁移14.2 环境有机污染物的分析与检测14.3 环境有机污染物的处理与降解14.4 环境有机化学的研究方法与未来挑战第十五章:有机化学实验15.1 有机化学实验的基本操作与安全15.2 有机化合物的制备与表征实验15.3 有机化学实验的设计与评价15.4 有机化学实验中的问题与解决方案重点和难点解析重点:1. 有机化学的基本概念与术语2. 烷烃、卤代烃、烯烃、炔烃的结构与性质3. 立体化学、醇、酚、醚的反应与合成4. 羧酸、酮、糖类、脂肪的结构与代谢5. 氨基酸、蛋白质的合成与功能6. 杂环化合物的分类与反应7. 天然有机化合物的分类、结构与提取8. 有机金属化合物的结构、反应与应用9. 有机光电材料的结构、制备与器件应用10. 环境有机污染物的来源、分析与处理11. 有机化学实验的基本操作、设计与评价难点:1. 立体化学中的手性碳原子与对映异构体2. 有机金属化学的结构与反应机理3. 有机光电材料的制备与器件制作4. 环境有机污染物的分析与处理技术5. 有机化学实验中的安全操作与问题解决。
福州大学化学考研真题

福州大学化学考研真题福州大学化学考研真题福州大学是福建省内知名的综合性大学之一,其化学专业一直以来备受考生的关注。
对于有志于攻读化学研究生的考生来说,了解福州大学化学考研真题是非常重要的。
本文将从历年的真题中选取几道典型题目,以供考生参考和学习。
一、有机化学题目1. 下列反应中,哪一个是酯水解反应?A. 酯+醇→酯醇B. 酯+酸→酯酸C. 酯+碱→酯碱D. 酯+醛→酯醛这道题目考察的是对酯水解反应的理解。
正确答案是B,酯与酸反应生成酯酸。
2. 以下哪一个化合物是具有手性的?A. 甲基乙酮B. 丙烯酸C. 乙醇D. 丙酮这道题目考察的是对手性的判断。
正确答案是C,乙醇是手性分子,因为它含有一个手性碳原子。
二、物理化学题目1. 下列哪一个物理量可以用来描述溶液的浓度?A. 质量分数B. 摩尔浓度C. 溶解度D. 电导率这道题目考察的是对溶液浓度的理解。
正确答案是B,摩尔浓度是描述溶液中溶质的摩尔数量与溶液体积之比。
2. 在常温下,以下哪一个物质是固体?A. 氨气B. 水蒸气C. 氧气D. 二氧化碳这道题目考察的是对物质状态的判断。
正确答案是D,二氧化碳在常温下是固体。
三、无机化学题目1. 以下哪一个元素在自然界中属于稀有气体?A. 氮B. 氧C. 氖D. 氢这道题目考察的是对稀有气体的理解。
正确答案是C,氖是自然界中的稀有气体之一。
2. 以下哪一个化合物是无机酸?A. HClB. CH3COOHC. H2SO4D. H2O这道题目考察的是对无机酸的判断。
正确答案是C,H2SO4是无机酸,其他选项是有机酸或无机物。
以上只是选取了几道典型的福州大学化学考研真题进行了解析,实际考试中还有更多不同类型的题目。
考生在备考过程中,应该注重对基础知识的掌握和理解,同时也要进行大量的练习和模拟考试,以提高解题能力和应试水平。
总之,福州大学化学考研真题是考生备考的重要参考资料,通过对真题的研究和分析,考生可以更好地了解考试的难度和出题方向,从而有针对性地进行备考。
福州大学化学化工学院化学系08级有机化学(下)期中考试(含答案)

班级 姓名 学号 成绩一、选择题(2分/题,共24分)1.ixb1欲从制备 ,应选用哪种反应条件【 B 】 (A )CH 3OH/CH 3ONa (B )CH 3OH/H + (C )CH 3OH/H 2O (D )CH 3OCH 3 2.9448化合物CH 3CH 3O2H 5CH 与浓HBr / 加热反应,主要得到什么化合物?【 A 】A :CH 32H 5C H HOB :CH 3C 2H 5CHC :CH 32H 5C HBr D :CH 32H 5CH H3.jxb 3下列化合物与饱和NaHSO 3H 发生加成反应,最慢的是:【 C 】(A) (B) (C) (D)4.0256苯乙酮 主要得到下列何种产物? 【 C 】(A) 苯甲酸甲酯 (B) 苯甲酸 + CH 3COOH (C) 乙酸苯酯 (D) 苯甲酸+HCOOH 5.810下面四个化合物中,能给出银镜反应的是: 【 D 】(A)Ⅱ (B)Ⅱ,Ⅲ和Ⅳ (C)Ⅰ (D)Ⅱ和Ⅲ(H 3C)2C CHCH 3O (CH 3)2C CHCH 3OHH 3CHONO 2CHO CHO NO 2CHO 2NO 2NO 2CF 3CO OO H3O OHO H 3CH O ( I ) ( II )( III )( IV )6.qj6814先与CH 3Li 反应,再水解,所得产物为哪个?【 B 】OOCH 3CH 3HOCH 3CH 3CH 3OCH 3CH 3CH 3ABCD7.kxb 6下列化合物① ② ③ ④ 的酸性从强至弱的顺序是【B 】(A )④,③,②,①(B )④,②,①,③(C )②,④,①,③(D )③,②,①,④ 8.kxb12下列化合物中α-C -H 的pka 最小的是:【 A 】 (A) CH 3COCl (B) (CH 3CO)2O (C) CH 3COOCH 3 (D) CH 3CONH 2 9.kxb13水解反应速度最快的化合物是【 D 】A. B. C. D. 10.Lxb6下列化合物中,α-C -H 酸性最强的是【 D 】A.乙酰乙酸乙酯B. 丙二酸二乙酯C. 乙酸乙酯D. 2,4-戊二酮 11.9753化合物OO用LiAlH 4还原,产物为【 C 】D.A. CH 3(CH 2)3CO 2HB. CH 3(CH 2)3CH 2OHC.HOCH 2(CH 2)3CH 2OHO12. 4111乙酰乙酸乙酯在EtONa 作用下所生成的共轭碱,可以写成多种共振式,其中能量最低的,“贡献”'最大的是【 B 】COOH 2COOH 3COOH Cl COOH CO 2CH 323CO 2CH 3CO 2CH 3CH 3CO 2CH 3OCH 3二、命名及填空:(2分/题,共8分)(一)用CCS 系统命名法命名下列化合物1.it1b1 2.Jt1b2O C HCH 3CH(CH 3)22-甲基-3-苯氧基丁烷,或:1,2-二甲基丙基苯基醚二对氯苯基甲酮,或:4,4’-二氯苯基甲酮 3.kt1b 5H 2C ONCH 3CH 2CH 3 N-甲基-N-乙基苯乙酰胺(二)排序: kt2b1酸性从强到弱:ClCH 2CO 2H>HOCH 2CO 2H>CH 3CO 2H>HOCO 2H ; HOCH 2CO 2H ;CH 3CO 2H ;HOCO 2H ;ClCH 2CO 2H三、完成反应:写出下列反应的主要反应产物或所需原料试剂及反应条件(2分/题,共26分)1.It3b8 C 6H 5OC(C 6H 5) + C 6H 5OH + ClC(C 6H 5)32. 2CHO + CH 3COCH 3-2OCH=CH3.jt3b 4O+ NH 2NHCNH 2O( )ONNHCNH 24.O OOEt(D)O -OOEt(C)O -OOEt(B)(A)OEtO-O -OClCl-2OO O 5. mj5802ON6. 5584+ HCO2HCH2OHOCH3 7.5623OO8.kt3b20NHOH9.CH3 +H O, H+O18OC(C6H5)3CH3O18OH+ HOC(C6H5)310. Lt3b 16CO2EtCO2EtCO2EtCO2EtCO2EtCO2EtOONH+O?(2)H3O+HCH O+OCH3CHO130-2_LiAlHNHO11. jL8095。
《有机化学》章节目录

《有机化学》章节目录绪论1.有机化合物的定义2有机化合物的特性2.1有机化合物组成单元的特点-----有机化合物种类繁多2.2 有机化合物结构上的特点-----同分异构现象2.3 有机化合物性质上的特点-----易燃难溶反应慢3 有机化合物中的共价键4 有机化合物的结构4.1分子的结构4.2 分子间作用力5有机化合物的分类5.1 碳架分类5.1.1开链化合物5.1.2碳环化合物5.2官能团分类6 有机化学中的酸碱概念6.1酸碱的电离理论6.2酸碱质子理论6.3酸碱电子理论7 现代有机合成手段7.1有机热反应7.2有机光反应7.3有机电合成7.4有机声化学7.5有机微波化学反应8现代光谱技术8.1 红外光谱8.2 紫外光谱8.3 核磁共振谱8.4 质谱阅读材料-文献与有机化学学习参考第一章烷烃和环烷烃1.1烷烃和环烷烃的通式和构造异构1.1.1 烷烃和环烷烃的通式1.1.2 烷烃和环烷烃的构造异构1.1.3 分子式、构造式和构造简式1.2烷烃和环烷烃的命名1.2.1伯、仲、叔、季碳原子与伯、仲、叔氢原子1.2.2 烷基的概念1.2.3 烷烃的命名1.2.4 环烷烃的命名1.3 烷烃和环烷烃的结构1.3.1 烷烃的结构1.3.2 环烷烃的结构与环的稳定性1. 4 烷烃和环烷烃的构象1.4.1 乙烷的构象1.4.2 丁烷的构象1.4.3 环己烷的构象1.4.4 取代环己烷的构象1.5烷烃和环烷烃的物理性质1.5.1 沸点1.5.2 熔点1.5.3相对密度1.5.4溶解度1.5.5折射率1.6烷烃和环烷经的化学性质1.6.1自由基取代反应1.6.2氧化反应1.6.3异构化反应1.6.4裂化反应1.6.5小环环烷烃的加成反应1.7 烷烃和环烷烃的主要来源和制法1.7.1烷烃和环烷烃的来源——石油和天然气1.7.2烷烃和环烷烃的制法第二章烯烃和二烯烃2.1 烯烃的分类异构和命名2.1.1 烯烃的分类2.1.2 烯烃的结构2.1.3 烯烃的命名(2.2 烯烃的物理性质2.3烯烃的来源和制法2.3.1烯烃的来源2.3.2 烯烃的制法2.4 烯烃的反应2.4.1烯烃的催化加氢2.4.2 烯烃的亲电加成2.4.3 烯烃的自由基加成反应2.4.4烯烃的氧化反应2.4.5 烯烃的硼氢化反应2.4.6 烯烃α-氢取代反应2.4.7烯烃的聚合反应2.5 共轭二烯烃2.5.1共轭二烯烃的结构2.5.2共轭二烯烃的共轭现象2.5.3共轭二烯烃的反应2.5.4共轭体系与共轭二烯烃加成反应历程2.6 异戊二烯和橡胶阅读材料:烯烃的复分解反应第三章炔烃3.1 炔烃的结构3.2 炔烃的异构和命名3.3 炔烃的物理性质3.4 炔烃的化学性质3.4.1 叁键碳上氢原子的活泼性(弱酸性) 3.4.2 加成反应3.4.3 氧化反应3.4.4 聚合反应3.5 重要的炔烃-乙炔阅读材料:导电聚合物——聚乙炔第四章芳烃及非苯芳烃4.1 苯的结构4.1.1 苯的凯库勒式4.1.2苯分子结构的近代概念4.1.3苯的结构的表示方法4.2苯的异构现象和命名4.2.1 苯的异构现象4.2.2 命名4.3 芳烃的来源和制法4.4芳烃的物理性质4.5芳烃的化学性质4.5.1 亲电取代反应4.5.2 苯的加成和氧化反应4.5.3芳烃侧链反应4.6 苯环上亲电取代反应的规律4.6.1 定位效应4.6.2定位规律的理论解释4.6.3苯的二元取代产物的定位规律4.6.4 定位规律在合成中的应用4.7 多环芳烃4.8非苯芳烃4.9 重要的化合物阅读材料:苯的发现和苯分子结构学说第五章立体化学5.1 手性和对映体5.2 分子的对称因素5.3 旋光性和比旋光度5.3.1 旋光性5.3.2 旋光仪与比旋光度5.4 含一个手性碳原子的化合物5.4.1 手性碳原子5.4.2 外消旋体5.5 构型的表示方法、构型的确定和构型的标记5.5.1 构型的表示方法5.5.2 构型的标记5.6 含有多个手性碳原子化合物的立体异构5.7 含假不对称碳原子的分子5.8 外消旋体的拆分5.9 不对称合成(手性合成)5.10含手性碳原子的化合物的对映异构阅读材料:诺贝尔化学奖与手性化合物第六章卤代烃6.1 卤代烃的分类、命名6.2 卤代烃的制法6.3卤代烃的物理性质6.4 卤代烃的化学性质6.4.1亲核取代反应6.4.2消除反应6.4.3与金属作用6.4.4 还原反应6.5 卤代烃的亲核取代反应机理6.5.1双分子亲核取代反应机理6.5.2 单分子亲核取代反应机理6.5.3影响亲核取代反应的因素6.6卤代烃的消除反应机理6.7 卤代烯烃和卤代芳烃6.8重要的卤代烃阅读材料:饮水中卤代烃第七章醇和醚7.1 醇的结构、分类和命名7.1.1醇的结构7.1.2醇的分类和命名7.2 醇的来源与制备7.2.1醇的工业来源与制备7.3醇的物理性质7.4醇的化学性质7.4.1 羟基中氢的反应7.4.2 醇的氧化与脱氢反应7.4.3醇羟基的亲核取代反应7.4.4 醇的脱水反应7.4.5成酯反应7.4.6多元醇的特殊性质7.5 重要的醇7.6醚的结构、分类与命名7.6.1醚的结构、分类7.6.2 醚的命名7.7醚的来源与制备7.7.1由醇脱水7.7.2威廉姆逊(Williamson)合成法7.7.3乙烯基醚的制取7.8醚的物理性质7.9醚的化学性质7.9.1形成8.1.2酚的命名8.2酚的来源与制备8.2.1酚的天然来源8.2.2人工合成法8.2.3 卤代芳烃水解法8.2.4 重氮盐水解法8.3酚的物理性质8. 4酚的化学性质8.4.1酚羟基的反应8.4.2、与三氯化铁的反应8.4.3、芳环上的反应8.4.4、氧化反应8.4.5、还原反应8.4.6、酚的其它反应8. 5重要的酚8.6醌的结构和命名8.7醌的来源与制备8.8醌的化学性质9.8.1加成反应8.8.2.还原反应8.9重要的醌阅读材料:超分子化学第三代主体----杯芳烃第九章醛、酮9.1 醛和酮的结构9.2醛和酮的分类和命名9.2.1 醛酮的分类9.2.2 醛酮的命名9.3.醛酮的制备方法9.3.1由烯烃和炔烃制备9.3.2 由同碳二卤代物水解制备9.3.3 由醇氧化或脱氢反应制备9.3.4 由芳烃制备9.3.5 由酰氯制备9.3.6 由腈制备9.4醛酮的物理性质9.5化学性质9.5.1 亲核加成反应9.5.2 羰基α-H的反应9.5.3 醛酮的氧化和还原9.6重要的醛、酮第十章羧酸及其衍生物10.1 羧酸的结构、分类和命名10.1.1 羧酸的结构10.1.2 羧酸的分类和命名10.2 羧酸的制法10.2.1 氧化法10.2.2 水解法10.2.3 Grignard试剂与CO2作用10.3 羧酸的物理性质10.4 羧酸的化学性质10.4.1羧酸的酸性和电子效应10.4.2 羰基的还原反应10.4.3 脱羧反应10.4.4羧酸衍生物的生成10.4.5 a-氢原子的反应10.5 取代酸10.5.1 卤代酸10.5.2 羟基酸10.6 重要的羧酸10.7 羧酸衍生物的命名10.8 羧酸衍生物的制法10.8.1 酰氯的制法10.8.2 酸酐的制法10.8.3 羧酸酯的制法10.8.4 酰胺的制法10.8.5 腈的制法10.9 羧酸衍生物的物理性质10.10 羧酸衍生物的化学性质10.10.1 酰基碳上的亲核取代(加成-消除)反应10.10.2 水解10.10.3 醇解10.10.4 氨解10.10.5 酸解10.10.6 与Grignard试剂的反应10.10.7 还原10.10.8 氧化10.10.9霍夫曼(Hofmann)降解10.11 重要的羧酸衍生物10.12 油脂和蜡(Oil and Wax)10.12.1 油脂的组成和结构10.12.2 油脂的性质10.12.3 蜡10.13碳酸衍生物10.13.1 碳酰氯10.13.2 碳酰胺10.13.3胍10.14 腈及其衍生物10.14.1腈10.14.2 异腈10.14.3 异氰酸酯阅读材料:共轭二油酸第十一章b-二羰基化合物11.1 烯醇式和酮式的互变异构11.1.1 酸和碱对烯醇式和酮式的互变异构的影响11.1.2 化合物结构对烯醇式和酮式的互变异构的影响11.1.3 b-二羰基化合物的酸性和烯醇负离子的稳定性11.2 乙酰乙酸乙酯的合成及其应用11.2.1 克莱森(酯)缩合反应(Claisen condensation) 11.2.2 乙酰乙酸乙酯在有机合成上的应用11.3 丙二酸酯的合成及在有机合成中的应用11.4碳负离子的亲核加成反应及在有机合成上的应用11.4.1麦克尔反应(Michael reaction)11.4.2瑞佛马斯基反应11.4.3克脑文盖尔反应11.4.4达尔森反应11.4.5普尔金反应阅读材料:β-二羰基化合物的应用第十二章含氮化合物12.1 硝基化合物的分类、结构和命名12. 2硝基化合物的制备12.3 物理性质12.4 化学性质12.4.1 酸性12.4.2 缩合反应12.4.3 还原反应12.4.4 硝基对苯环邻、对位基团的影响12.5 胺的结构、分类和命名12.5.1的结构12.5.2 胺的分类和命名12.6 胺的制法12.6.1 氨或胺的烃基化12.6.2 硝基化合物的部分还原12.6.3 腈和酰胺的还原12.6.4 霍夫曼(Hofmann)降解反应12.6.5 盖布瑞尔(Gabriel)合成法12.6.6 醛或酮的氨化还原12.7 胺的物理性质12.8 胺的化学性质12.8.1 胺的碱性12.8.2烷基化反应12.8.3 酰基化反应12.8.4 磺酰化反应12.8.5 与亚硝酸反应12.8.6 氧化反应12.8.7 芳胺芳环上的反应12.9 季铵盐与季铵碱12.9.1 季铵盐12.9.2 季铵碱12.10 重氮盐的制备及其结构12.11 重氮盐的反应及其应用12.11.1 放氮反应12.11.2 留氮反应12.12 偶氮化合物和偶氮染料12.13 重氮甲烷12.14 叠氮化合物第十三章杂环化合物13.1 杂环化合物的分类和命名13.2 五元杂环化合物13.2.1 含有一个杂原子的五元杂环体系13.2.2 含有两个杂原子的五元杂环体系13.2.3 五元稠杂环体系13.3 六元杂环化合物13.3.1 含有一个杂原子的六元杂环体系13.3.2 含有两个杂原子的六元杂环体系13.3.3六元稠杂环体系阅读材料:生物碱第十四章天然化合物----糖,氨基酸,萜及甾族化合物14.1 糖14.1.1 单糖14.1.2 双糖14.1.3多糖14.2 氨基酸14.2.1氨基酸的结构、命名和分类14.2.2 氨基酸的制法14.2.3氨基酸的性质14.3 萜类14.3.1萜的涵义和异戊二烯规律14.3.2 萜的分类和命名14.4 甾族化合物14.4.1甾的基本结构和命名14.4.2甾族化合物的结构14.4.3甾族的种类阅读材料:米勒人工合成氨基酸。
大学科目《有机化学》各章节课件

3
芳香烃的性质
具有较高的熔点和沸点,难溶于水,易溶于有机 溶剂;具有共轭体系和电子离域效应,容易发生 亲电取代反应。
芳香烃的命名与分类
芳香烃的命名
01
以苯环为母体,根据取代基的不同进行命名,如甲苯、二甲苯
医药化学
研发新药、合成药物中间体等, 用于治疗疾病和保障人类健康。
农业化学
合成农药、肥料等,提高农作物 产量和品质,保障粮食安全。
环境科学
研究有机污染物的来源、迁移转 化和治理方法,保护生态环境。
02 烷烃
烷烃的结构与性质
结构特点
化学性质
碳原子之间以单键相连,形成链状或 环状结构;每个碳原子上的剩余价键 均与氢原子相连。
卤代烃的反应与合成
反应类型
卤代烃的反应类型丰富多样,主要包括亲 核取代反应、消除反应、还原反应以及与 金属有机化合物的反应等。这些反应在有 机合成中具有重要的应用价值,可用于构 建碳碳键、引入或转化官能团等。
VS
合成方法
卤代烃的合成方法主要有两种:一种是通 过烃类的直接卤化反应得到相应的卤代烃; 另一种是通过烯烃或炔烃与卤化氢的加成 反应得到卤代烷。此外,还可利用醇与氢 卤酸的取代反应制备卤代烃。在实际合成 中,需根据目标产物的结构和性质选择合 适的合成路线和反应条件。
03 烯烃
烯烃的结构与性质
01
烯烃的通式与结构特点
烯烃是一类含有碳碳双键的烃类化合物,通式为CnH2n。其结构特点
包括碳碳双键的存在以及与之相连的四个原子共平面。
02 03
烯烃的物理性质
烯烃的物理性质与其分子量和双键位置有关。一般来说,随着分子量的 增加,烯烃的沸点、熔点和密度逐渐升高。双键位置对物理性质也有影 响,如顺式异构体的沸点通常高于反式异构体。
有机化学10第四章ppt

②按照凯库勒结构,苯的邻二卤代物应有以 下两种结构,它们应有区别。
X X
X 但实际上苯的邻二卤代物只有一种, 也就是说此两种结构应相同。
X
现代物理方法测得苯的结构为:
H
H
H
所有原子共平面,正六
0.1397 nm
C C
C键长为:0.1397 n H键长为:0.110 nm
H H 0.11H0 nm
所有键角都为:1200
发烟 H2SO4
200~245℃
SO3H SO3H
常用的磺化剂:浓硫酸、发烟硫酸、 三氧化硫和 氯磺酸(ClSO3H)等。
• 磺化反应是一个可逆反应。
H2SO4
SO3H
稀 H2SO4
+ H2SO4
除水、加过量苯有利于正反应; 稀酸、加热有利于逆反应.
磺化反应的应用
-----可作位置保护基用于有机合成
H2/Pt
② 苯的一元取代产物为什么只有一种?
X
=
原因是苯的一元取代的这两种 X 可能的产物结构其实是完全相
同的结构。
① 凯库勒结构式实际上是环己三烯。
则其中的“C-C”单键和“C=C”双键键长 应不同,实测结果在苯中所有的“C-C”键 长 均 为 0. 140nm 、 “ C-H” 键 长 也 均 为 0.110nm,并很难进行加成或氧化反应,这 与环己三烯的性质的差别较大。
SO3H
CH3 Cl 稀 H2SO4
CH3 Cl
SO3H
可作位置保护基
4 、 傅瑞德尔-克拉夫茨反应
• 在无水三氯化铝催化下,芳烃环上的氢被烷基和 酰基取代的反应,分别叫烷基化反应和酰基化反
应,统称Friedel-Crafts reaction。
有机化学第四章习题答案

p941.解释下列名词。
共轭效应互变异构1,4-加成亲核加成乙烯基化反应氢化热离域能(共轭能)超共轭效应双烯合成亲双烯体红外活性键的伸缩振动键的弯曲振动解:共轭效应:由于结构的原因,双键π电子云不再只定域在双键上,也有部分离域到分子的其它部分,即发生了键的离域。
这种离域效应叫共轭效应。
互变异构:在一般条件下,两个构造异构体可以迅速地相互转变的异构现象。
1,4-加成:一分子试剂加在共轭双键两端的加成反应。
亲核加成:由亲核试剂进攻而引起的加成反应。
乙烯基化反应:反应物分子中的氢原子被乙烯基取代的反应。
氢化热:每一摩尔烯烃催化加氢时放出的能量叫氢化热。
离域能(共轭能):共轭分子中由于键的离域而导致分子的额外的稳定能,称为离域能。
超共轭效应:σ轨道与π轨道相互作用而引起的离域效应。
双烯合成:共轭二烯和某些具有碳碳双键的化合物发生1,4-加成,生成环状化合物的反应。
亲双烯体:在双烯合成中能和共轭二烯反应的重键化合物叫做亲双烯体。
红外活性:能吸收红外辐射的性质。
键的伸缩振动:只改变键长,而不改变键角的振动。
键的弯曲振动:只改变键角,而不改变键长的振动。
2.用系统命名法命名下列化合物:(1) (CH3)3CC≡CCH2CH3(2) HC≡CCH2Br (3) CH2=CHC≡CH (4)CH2=CHCH2CH2C≡CH (5) CH3CHClC≡CCH2CH3(6) CH3C≡CC(CH=CH2)=CHCH2CH3(7)解:(1) 2,2-二甲基-3-己炔(2) 3-溴丙炔(3) 1-丁烯-3-炔(4) 1-己烯-5-炔(5) 2-氯-3-己炔(6) 4 –乙烯基-4 –庚烯-2-炔(7) 1,3,5-己三烯3.写出下列化合物的构造式。
(1) 4 –甲基-1-戊炔(2) 3 –甲基-3-戊烯-1-炔(3) 二异丙基乙炔(4) 1,5 –己二炔(5) 异戊二烯(6) 丁苯橡胶(7) 乙基叔丁基乙炔解:(1) CH≡CCH2CH(CH3)CH3(2) CH≡CC(CH3)=CHCH3(3) (CH3)2CHC≡CCH(CH3)2(4) CH≡CCH2CH2C≡CH (5) CH2=C(CH3)CH=CH2(6) -[-CH2CH=CHCH2CH(C6H5)CH2-〕n- (7)CH3CH2C≡CC(CH3)34.写出1-丁炔与下列试剂作用的反应式。
大学有机化学第四章 链烃和环烃

2、加卤素:环丙烷、环丁烷与烯烃相似,在常温下可以与卤素发生加成反应。
3、加卤代氢:环丙烷、环丁烷及其衍生物很容易与卤化氢发生加成反应。开环发生在含氢最多和含氢最少的两个碳原子之间,加成反应遵循马氏规则。
环戊烷以上的环烷烃,在室温下难以与卤代氢发生加成反应。
炔氢也能与重金属(Ag或Cu)作用形成不溶于水的炔化物。常用试剂为硝酸银或氯化亚铜的氨溶液。
6、聚合反应
(五)、炔烃的制备
二卤代烷在强碱性条件下脱卤化氢及金属炔化物与伯卤代烃亲核取代反应是制备炔烃的常用方法。
二、二烯烃
分子中含有两个双键的开链烃称为二烯烃(diene),其通式为CnH2n-2。
(一)、分类和命名
2、其它烷烃的氯代反应
其它烷烃在相似条件下也可以发生氯代反应,但产物更复杂。
3、烷烃和其它卤素的取代反应
4、甲烷卤代反应历程
反应历程是指由反应物至产物所经历的过程。一个反应历程是根据这一反应的许多实验事实,总结归纳作出的理论假设。这种假设必须符合并能说明已经发生的实验事实。
(1)、甲烷氯代反应机制
甲烷的卤代反应历程是自由基取代反应历程。
烯烃在一定条件下,发生自身加成反应生成分子量很大的聚合物,这种反应称为聚合反应,参加反应的烯烃称为单体。
六、烯烃的制备
1、醇的脱水
2、卤代烷脱卤化氢
卤代烷与强碱(如氢氧化钾、乙醇钠)的醇溶液共热时,脱去一分子卤化氢生成烯烃。
3、邻二卤代烷脱卤化氢
邻二卤代烷与锌粉一起共热,可脱去一分子卤素生成烯烃。
第三节炔烃和二烯烃
三、烷烃的结构
根据杂化理论认为碳原子在形成甲烷分子时发生了sp3杂化,所以甲烷分子是正四面体结构。烷烃分子中的碳原子是正四面体结构,因此除乙烷外烷烃分子中的碳原子并不排布在一条直线上,而是以锯齿形或其他可能的形式存在。所以“直链烷烃”仅指不带支链的烷烃。
有机化学第4章

CH3-CH=CH-CΞCH
3-戊烯-1-炔
2-戊烯-4-炔 1-戊炔-4-烯
CH3-CΞC-CH-CH2-CH=CH-CH3 CH=CH2
5-乙烯基-2-辛烯-6-炔
魏能俊 主讲教师:曹瑞军
有机化学
19-11
1、炔氢的反应
炔氢与同周期的其它氢化物相比活性如下:
HF > H2O > RCΞCH > NH3 > CH4
魏能俊 主讲教师:曹瑞军
有机化学
18-15
(3)价键理论解释1,3-丁二烯的结构
0.134nm
H
H
C1=C2 H
0.146nm
H C3=C4
H
H
按照杂化轨道理论,1,3-丁二烯中每个C都以SP3杂化,使的4个C、6个H 都在同一平面,
尽管共轭体系中4个C之间没有单、双键的区别,但由于他们所处的环境 不同,使C1-Cቤተ መጻሕፍቲ ባይዱ和C3-C4之间的键长接近于双键,C2-C3的键长接近于单键,
π-π共轭:由两个或多个π键形成的共轭体系,如 CH3-CH=CH-CH=CH2
p-π共轭:由原子p轨道与π键形成的共轭体系,如
CH2=CH-Cl
魏能俊 主讲教师:曹瑞军
有机化学
18-13
(2)分子轨道理论解释1,3-丁二烯的稳定性
分子轨道认为,只要p轨道相互平行,就可重新线性组合,形成新的 分子轨道。 有能量降低的成键轨道和能量升高的反键轨道。 轨道的总能量和总数目不变。电子排列在成键轨道上,能量降低。如:
常见的α-H:
魏能俊 主讲教师:曹瑞军
烯丙基溴有专用的溴化试剂NBS
+
NBS
O N-Br O
(NEW)福州大学化学学院612无机化学和有机化学历年考研真题汇编

第一部分 福州大学612无机化学和有机化学考研真题 2015年福州大学化学专业考研复试回忆 2011年福州大学有机化学考研真题 2010年福州大学612化学原理考研真题(回忆版) 2005年福州大学314有机化学(A)考研真题 2004年福州大学314有机化学考研真题
第二部分 兄弟院校无机化学和有机化学考研真题 2013年武汉大学880无机化学和有机化学考研真题 2010年武汉大学636无机化学和有机化学考研真题 2014年苏州大学635有机化学A考研真题 2014年苏州大学835有机化学B考研真题 2014年苏州大学628有机化学(F)考研真题 2014年南京航天航空大学626有机化学考研真题 2014年南京航空航天大学813无机化学(A卷)考研真题 2013年南京航天航空大学626有机化学考研真题
此复试内容适合:无机化学、有机化学、分析化学、物理化学、食 品化学、材料新能源等专业(具体还有哪些专业,可以看复试的安排, 然后对号入座)
福大15年的复试来的特别早,18、19号报道,20号开始复试,而调 剂系统18号才开,对于北方的考生,必须提前一步开始赶往福建,才能 按时报道,兴许你的志愿填报是在旅途中。在国家调剂系统开放之前, 福大化学学院会有自己的预调剂系统,用来收集有意向考生的信息,然 后从中进行挑选,再进行电话或者短信的确认,所以一般是当你准备去 福大复试的时候,你已经获得了比较明确的复试资格,只要在规定时间 内填报了调剂志愿,一定可以给你复试的名额。对于那些提前没有预调 剂,仅仅在国家调剂系统开放后才填报福州大学的考生,抱着试一试的 心态的考生,最好慎重填报,珍惜志愿机会(我想对于想要调剂的考 生,一定是之前电话或者邮件做好准备,如果你仅仅是单纯的填写了志 愿,没有其他的举动,那你就是自己不看重调剂,自己对自己不负责)
福州大学至诚学院有机化学作业答案概要

3)异丙醇
4)正丙醇
CH3-CH=CH2
① H2SO4 ② H2 O
① B2H6 CH3-CH=CH2 ②H2O2, OH- H2O CH3CH2CH2OH
CH3-CH-CH3 - OH
5)1,2,3-三氯丙烷 CH3-CH=CH2
Cl2 500℃
Cl2
CH2-CH=CH2 - Cl
CH2-CH-CH2 - - - Cl Cl Cl
2.写出下列各基团或化合物的结构式
1)乙烯基 -CH=CH2 2)丙烯基 -CH=CH-CH3 3)烯丙基 CH2=CH-CH2- 4)异丙烯基 CH2=C-CH3 5)4-甲基-顺-2-戊烯
CH3 H3C CH C H C H CH3
CH3CH2CH2 C CH3 C CH2CH3 CH3
6) (E)-3,4-二甲基-3-庚烯
氢时,10mg样品可吸收8.40mL氢气。原样品经臭氧化反
CHO H 应后分解,只得到甲醛[ C O ]和乙二醛 [ CHO H
]。
问这个烃是什么化合物。 10mg样品为: 10/80=0.125mmol
8.40mL 氢气为: 8.40mL/22.4(L/mol)=0.375mmol
可见化合物分子中有三个双键或一个双键、一个叁键。 CnH2n-4=12n+2n-4=14n-4=80 CH2=CH-CH=CH-CH=CH2 n=6 分子式:C6H8 但是根据臭氧化反应产物,确定化合物分子式为:
HC CH
H2/Lindlar催化剂
9. 以乙炔为原料合成下列化合物
H2C CH2
HBr
CH3CH2Br
HC CH
NaNH2/液氨
HC CNa
HC CCH2CH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
o
CH2 CHOCH3
甲基乙烯基醚
丙烯腈
HC CH
HOOCCH3
乙酸锌—活性炭 o 160-165 C
CH2 CHOOCCH3
乙酸乙烯酯
炔烃亲核加成机理:
CH3C CH CH3O
CH3 C CH2 OCH3
- CH3OH CH3 C CH OCH3 CH3O
CH3 CH O 乙醛
重排 C C H O
烯醇式(不稳定)
C C H O
酮式(稳定)
HgSO4 CH3(CH2)5C CH + HOH H SO 2 4
CH3(CH2)5C CH2 OH
重排
CH3(CH2)5C CH3 O
(四) 亲核加成-炔烃易进行亲核加成
HC CH HOCH3 20%KOH/H2O 160-165 C ,2-2.5MPa
CH2 CH CH CH2
HBr
CH3 CH CH CH2Br + CH3 CH CH CH2
1,4-加成
Br
1,2-加成
(-80oC) (20oC)
20% 80%
80% 20%
反应机理:
CH2 CH CH CH2
H
X
CH2 CH2 CH CH2 CH3 CH CH CH2
CH3 CH CH CH2
Br2
CH3
Br Br C CH Br Br
现象是溴的红棕色消失,用于检验不饱和烃
双键、叁键同时存在,双键先加成
CH2 CH CH2 C CH + Br2 -20 C CCl4 Br CH2 CHCH2 C CH Br 90%
卤素加成的活性顺序:氟 〉氯 〉溴 〉碘
2. 与卤化氢加成
炔烃与卤化氢加成的加成比烯烃困难,需用催化剂。
C2-C3: 0.148nm (0.154nm)
C1-C2:键长略变长
SP2杂化 P轨道互相 平行,重叠 C2-C3:部分重叠, 键长变短 P电子不是集中在C1-C2和C3-C4 大π键 π44(离 域键)
之间,而是在C1-C2-C3-C4之间
键长部分平均化 共轭效应
产生
分子内能低,稳定性高
四、共轭二烯烃的化学性质
顺丁烯二酸酐
O
O 20oC Benzene O O O O O
+
O O
(白),共轭二烯 烃的定性检验方法
通过环状过渡态一步完成,属周环反应(协同反应)
通式: 共轭二烯烃与某些具有不饱和键的化合物
进行1,4-加成反应,生成环状化合物
+
双烯烃 亲双烯体
COOCH3
+
C C COOCH3
△
COOCH3 COOCH3
o
HC CH
3 H2
炔烃的制备
1.二卤代烷脱卤化氢
(CH3)3C CH CH2 Br Br (CH3)3COK 2HBr
(CH3)3C C 91%
CH
①NaNH2 CH3(CH2)4CH2 CH Cl H+ ② Br
CH3(CH2)4C 60%
CH
2.炔烃的烷基化
HC CH NaNH2, 液NH3 -33 C
CH3C CCH3 + 2H2
Ni,C2H5OH 25 C,5MPa
CH3CH2CH2CH3
炔烃比烯烃更容易进行催化氢化
使用一般的催化剂,在H2 过量的情况下,不容易停留在 烯烃阶段,要部分氢化,要使用活泼性较低的催化剂。 用喹啉或醋酸铅部分毒化的Pd-CaCO3,一般称 为Lindlar催化剂,或用金属还原.
C2H5-C≡C-C2H5 + H2
Pd-CaCO3 喹啉
H3CH2C C C H (CH2)3CH3
C 2H 5 C H C H C2H5
顺 式 产 物 反 式 产 物
CH3CH2C≡C(CH2)3CH3
① Na-NH3
② NH3-H2O
H
(三)亲电加成
1. 与卤素加成
CH3 C CH
Br2
CH3 C CH Br Br
X Y
X
Y
C CH
炔氢的反应
(一)炔烃的活泼氢反应
1.炔氢的酸性
H2O
pKa 5.7
HC≡CH
25
NH3
34 SP 50
CH2=C H2 CH3CH3
36.5 SP2 33 SP3 25 42
碳原子的杂化状态 s成分(%)
电负性
3.29
2.73
2.48
2.金属炔化物的生成及其应用
Na, 110 C HC CH or NaNH2, 液NH3, -33oC
CH3 CH CH CH2
+ CH3 CH CH
1 2 3
+ CH2
4
1,2-加成产物 + 1,4-加成产物
Br
1,2-加成产物
Br
H
CH3-CH=CH-CH=CH2
+ - + -
HBr
CH3-CH=CH-CH-CH2 CH3-CH-CH=CH-CH2
1,4-加成产物
Br
H
(二)、Diels-Alder反应(1,4-环加成反应,双烯合成)
CH3CH2C CCH2CH3
变为烯,烷或卤代烃,合成上的应用
3.炔烃的鉴定
HC≡CH + 2Ag(NH3)2NO3 AgC≡CAg + 2NH4NO3 + 2NH3 乙炔银(白色)
CH3CH2C CH Ag(NH3)2NO3 CH3CH2C CAg 丁炔银 NH4NO3 NH3
HC CH
2Cu(NH3)2Cl
CH3CH2CH2 C
CH2
Br HBr CH3CH2CH2 C CH3 Br
Br
炔烃加 HBr 也有过氧化物效应:
CH3CH2CH2CH2 C CH HBr ROOR
CH3CH2CH2CH2 C H
C H Br
3. 与水的加成
CH CH + H2O HgSO4 H2SO4
[H2C CH]
OH 乙烯醇
催化氢化(加氢)、亲电加成、氧化反应、聚合、DielsAlder反应
(一)、加成反应:1,2-, 1,4-加成
CH2 CH CH CH2
Br2
BrCH2 CH CH CH2Br + BrCH2 CH CH CH2 Br 1,2-加成 1,4-加成 46% 90% 54% 10%
(-15oC) (60oC)
o
o
HC CNa
Na, 190-220 C NaC or NaNH2, 液NH3, -33oC
CNa
CH3CH2CH2Br 液NH3, -33 C
o
CH3CH2CH2 C C CH2CH2CH3
卤代烃不能用叔卤代烃
NaNH2, 液NH3 CH3CH2C CH -33 C
o
CH3CH2C CNa
CH3CH2Br 液NH3, -33oC
C C
C C C C
第一节
一、炔烃的结构
1.实验事实
炔烃(alkynes)
0.120nm
H
0.106nm
C
C
180°
H
线性分子,四个原 子在同一直线上
C C
键能 / kJ mol · 键长 / nm
-1
C C
611 0.134
C C
837 0.120
347 0.154
2.理论解释
1) 碳原子轨道的 sp 杂化
6 5
CH2CH3 C C
4 3
2
1
CH3
H
(3E,5E)-3,4-二甲基-3,5-辛二烯
三、二烯烃的结构
1. 累积二烯烃的结构
H
CH2=C=CH2
SP2杂化 SP杂化
H C H C
C H
2. 共轭二烯烃的结构 CH2=CH-CH=CH2
1 2 3 4
H H H H C C H C C H
四个C,六个H在同一平面上 C1-C2: 0.134nm (0.133nm)
注意: C≡C-C-C C× ∵叁键不能有支链,∴无顺反异构体,因此炔烃 的异构体数目比烯烃少,比烯烃简单
三、炔烃的命名
1. 与烯烃相似,选择含有C≡C为主链,使其编号最小
H3C CH3 HC C CCHCH3
1 2 3 4
3,4-二甲基-3-乙基-1-戊炔
CH2CH3
5
CH3CHCH2C CH CH3CHC CCHCH3 CH3CHCH2C CCH3 CH3 CH3 CH3 CH3
o
CH3CH2CH2CH2Br
HC CNa
液NH3, -33oC
HC C CH2CH2CH2CH3 80%
第二节
一、二烯烃的分类
二烯烃(dienes)
根据两个双键相对位置的不同分为三类:
1. 累积二烯烃:两双键连在同一个C上 2. 共轭二烯烃:两双键被一个单键分开 CH2=C=CH2 CH2=CH-CH=CH2
4-甲基-1-戊炔
2,5-二甲基-3-己炔
5-甲基-2-己炔
2. 分子中同时含有C=C和C≡C
1)主链选择:含C=C和C≡C在内的最长碳链ຫໍສະໝຸດ 2)编号:烯加炔的编号和最小;
若双键和三键处于相同的位次供选择时, 优先给双键最低编号。 3)命名:先烯后炔,C数写在烯之前 ()-某烯-()-炔
CH3CH CH C CH
CuC CCu
2NH4Cl
2 NH3
乙炔亚铜(棕红色)
用于定性鉴定含有-C≡CH基团 的有机物
