2018人教版高中化学06总复习:化学中的常用计量(提高)知识讲解
高考化学 化学中常用计量知识精讲
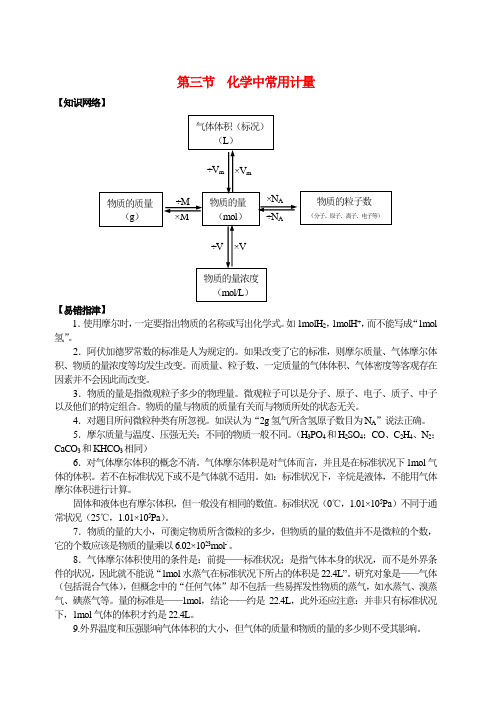
第三节化学中常用计量【知识网络】【易错指津】1.使用摩尔时,一定要指出物质的名称或写出化学式。
如1molH2,1molH+,而不能写成“1mol 氢”。
2.阿伏加德罗常数的标准是人为规定的。
如果改变了它的标准,则摩尔质量、气体摩尔体积、物质的量浓度等均发生改变。
而质量、粒子数、一定质量的气体体积、气体密度等客观存在因素并不会因此而改变。
3.物质的量是指微观粒子多少的物理量。
微观粒子可以是分子、原子、电子、质子、中子以及他们的特定组合。
物质的量与物质的质量有关而与物质所处的状态无关。
4.对题目所问微粒种类有所忽视。
如误认为“2g氢气所含氢原子数目为N A”说法正确。
5.摩尔质量与温度、压强无关;不同的物质一般不同。
(H3PO4和H2SO4;CO、C2H4、N2;CaCO3和KHCO3相同)6.对气体摩尔体积的概念不清。
气体摩尔体积是对气体而言,并且是在标准状况下1mol气体的体积。
若不在标准状况下或不是气体就不适用。
如:标准状况下,辛烷是液体,不能用气体摩尔体积进行计算。
固体和液体也有摩尔体积,但一般没有相同的数值。
标准状况(0℃,1.01×105Pa)不同于通常状况(25℃,1.01×105Pa)。
7.物质的量的大小,可衡定物质所含微粒的多少,但物质的量的数值并不是微粒的个数,它的个数应该是物质的量乘以6.02×1023mol-`。
8.气体摩尔体积使用的条件是:前提——标准状况;是指气体本身的状况,而不是外界条件的状况,因此就不能说“1mol水蒸气在标准状况下所占的体积是22.4L”。
研究对象是——气体(包括混合气体),但概念中的“任何气体”却不包括一些易挥发性物质的蒸气,如水蒸气、溴蒸气、碘蒸气等。
量的标准是——1mol,结论——约是22.4L,此外还应注意:并非只有标准状况下,1mol气体的体积才约是22.4L。
9.外界温度和压强影响气体体积的大小,但气体的质量和物质的量的多少则不受其影响。
2018年全国卷高考化学专题突破《化学中的常用计量》知识点归纳总结

B 的物质的量浓度。
2、表达式:物质的量浓度( mol/L )= 要点诠释:
溶质的物质的量( mol) 溶液的体积(L)
(1) 溶液体积不能等同于溶剂体积,应是溶质在溶剂中溶解后的实际体积。
(2) 溶液具有均一性,即从一定物质的量浓度的溶液中取出任意体积的溶液,物质的量浓度保持不变。
(3) 溶质是用物质的量表示而不是质量表示;体积表示溶液的体积,而不是溶剂的体积,体积单位为
( 2)相对密度法: M 1 M2
M :气体的摩尔质量,数值上等于相对分子质量。
1 2
( 3)公式法: M
m总 (混合气体的平均化学式量) n总
考点四、物质的量浓度:
1、定义:从单位体积的溶液里所含溶质 B 的物质的量来表示溶液组成的物理量叫做溶质 符号为 c (B) ,单位有 mol / L (或 mol·L ―1)等。
就像不能将 π 与 3.14 等同一样。
4.摩尔质量
( 1)概念:单位物质的量的物质所具有的质量。
( 2)单位: g· mol―1 或 kg· mol - 1 。 ( 3)数值:当摩尔质量单位是 g·mol -1 时数值上等于物质的相对分子质量或相对原子质量。
( 4)物质的量( n)、物质的质量( m)和物质的摩尔质量( M)之间的关系式: n
Vm=22.4 L ·mol ―1。
2.阿伏加德罗定律 ( 1)内容:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。即气体物质的量之比等
于气体体积之比,也等于气体分子数之比。
即: V1 N1 n1 。 V2 N 2 n2
( 2)两个推论:
①同温同压下:气体密度之比等于气体式量之比
M1
要点诠释:
常用化学计量知识点整理

常用化学计量知识点整理一、物质的量与阿伏伽德罗常数:1、物质的量描述对象:微观粒子,比如分子、原子、粒子、中子、质子、电子等。
单位mol 符号n2、阿伏伽德罗常数12 g 12C中所含有的碳原子数,1mol=1 个≈6.02×1023个3、摩尔质量:单位物质的量的物质所具有的质量,单位一般为g·mol-1,此时与相对原子质量(Ar)或相对分子质量(Mr)数值相等,摩尔质量有单位而相对原子质量或相对分子质量无单位。
4、气体摩尔体积:单位物质的量的气体的体积大小与温度、压强有关标准状况下的气体(纯气体或混合气体)摩尔体积:约 22.4 (近似值)5、阿伏加德罗定律及其推论定律:同温同压下,相同体积的任何气体都含有相同的分子数。
PV=nRT6、物质的量浓度:单位溶液体积包含的溶剂的物质的量单位:溶液稀释与浓缩的换算式溶质质量分数(a%)、溶解度(S)、物质的量浓度(c)、溶液密度(ρ)的换算关系(饱和溶液):不同密度的溶液相互混合,总体积计算式:例题:取14.3 g Na2CO3·xH2O溶于水配成100 mL溶液,然后逐滴加入稀盐酸直至没有气体放出为止,用去盐酸10 mL,并收集到气体1120 mL(标准状况)。
求: (1)Na2CO3·xH2O的物质的量;(2)稀盐酸的物质的量浓度;(3)x的值。
二、一定物质的量浓度溶液的配置1、容量瓶、烧瓶、玻璃棒、托盘天平、药匙、胶头滴管。
2、计算、称量、溶解(稀释)、冷却、移液、定容、装瓶贴标签。
3、注意:容量瓶使用前要验漏、洗涤,不能润洗。
只能配一定体积的溶液。
转移溶液是要是室温,玻璃棒在瓶颈刻度线下。
4、误差分析阿伏伽德罗常数的应用陷阱问题1、状况条件:考查气体时,一定要特别关注是标准状况下还是非标准状况,标准状况可以用22.4mol/L计算。
2、物质状态:考查气体摩尔体积时,常用标准状况(0℃,常压)下非气态的物质来迷惑学生,在标准状况下,水、SO3、碳原子数大于4的烃、乙醇、四氯化碳、氯仿、苯、HF、二硫化碳等许多有机物都不是气态。
高中化学知识点:化学常用计量总结

高中化学知识点:化学常用计量总结
化学中的常用量,特别是以“物质的量”为中心的相关概念,必须深刻理解和灵活掌握。
(1)对相关概念的理解求“准”
有的常用量,比如“相对原子质量”,靠死记硬背是不能把握的,必须分清什么是“原子的相对原子质量”、“原子的近似相对原子质量”、“元素的相对原子质量”、“元素的近似相对原子质量”等,它们相对谁?绝不能含糊;再如有关的浓度:“物质的量浓度”、“质量分数”、“体积分数”等,都是一定条件下溶液浓度的表示方法,它们有区别、有联系,也不能混淆。
(2)对相关概念的运用求“活”
对相关概念的适用条件必须灵活掌握,如“气体摩尔体积”,该概念的使用条件为标准状况下的气体,若为固体(如S03)或液体(如CS2、HF、己烷等)则不存在该概念;又如质量守恒定律的使用范围是反应物与生成物的原子个数的相等关系,如果物质之间并不是恰好反应,那过量的部分就不存在该概念。
--来源网络整理,仅供学习参考。
化学中常用计量

精品文档
2、配制(pèizhì)的步
计算 骤 (jìsuàn)
称量 (量取) (chēnɡ liànɡ)
溶解
摇匀
定容
转移
考虑:天平、量筒、滴定管的最小读数是多少? 考虑:称量NaOH 时应注意哪些问题? 考虑:容量瓶是否一定要干燥?
考虑:移液时,为何要将溶液冷却至室温? 考虑:烧杯和玻棒要用蒸馏水冲洗二、三次并将冲洗液全部倒入
(1)它只适用于气体(单一或混合气体都可以)。 (2)必须是标准状况下(0℃,1.01×105Pa)。 (3)气体的物质的量为1mol时,体积约为22.4 L。
精品文档
4、阿伏加德罗定律及其有关(yǒuguān)推论: (1)阿伏加德罗定律(dìnglǜ): 同温度和压强时,相同体积的任何气体(qìtǐ)都含有相同数目的分子。 (2)阿伏加德罗定律的推论: ①同温同压时,气体物质的体积与物质的量成正比
精品文档
(一)物质的量
1.物质(wùzhì)的量 :国际上规定的一个(yī ɡè)基本物理
〔n〕
量。
意义:含有(hán yǒu)一定数目粒子的集体。
单位:摩尔,符号“ mol”,简称“摩”。
1mol任何粒子具有阿伏加德罗常数个微粒。
2.阿伏加德罗常数(NA:mol-1)
一个精确的数值
科学上规定:0.012kg 12C中所含的碳原子数目,
元素的相对(xiāngduì)原子质量则是该元素各种同位素的相对 (xiāngduì)原子质量的平均值。
Δ相对分子质量:
化学式中各原子的相对原子质量的总和。
由气体的密度或相对密度求气体相对分子质量。
(1)标准状况下气体 : M = ρ ·22.4L/mol
高考二轮专题复习课件专题2化学中的常用计量.ppt

22V.4×M w=1000+22V.4×M×100%
V 22.4 c=1000+22V.4×M ρ·1000
3.物质的量浓度、溶质的质量分数、溶解度之间的 换算
(1)溶解度与质量分数(w)的关系:
w=100 Sg+S×100%(仅适合饱和溶液)
(2)物质的量浓度与质量分数
1000 mL·L-1·ρ g·mL-1·w
► 探究点二 对阿伏加德罗定律及其推论的考查
1.阿伏加德罗定律:在相同的温度和压强下,相同 体积的任何气体都含有相同数目的分子。
2.阿伏加德罗定律推论 对于气体有: (1)同温同压下:V1 ∶V2=n1 ∶n2=N1 ∶N2; (2)同温同压下:ρ1 ∶ρ2=M1 ∶M2 ; (3)同温同压等质量时:V1 ∶V2=M2 ∶M1 ; (4)同温同体积时:p1 ∶p2=n1∶n2=N1 ∶N2;
所以 M(甲)>M(乙),D 答案错。由于它们的质
量相等,所以甲的物质的量比乙的物质的量少, 甲的分子数比乙少,A 答案错,B 答案正确。由 于它们的外界条件相同,所以它们的摩尔体积 相同,C 答案错。
► 探究点三 对物质的量浓度、质量分数和溶解度的考查
1.物质的量浓度的计算
(1)c(mol·L-1)=nV溶质溶液
【点评】 该题以阿伏加德罗常数的应用为载体, 考查学生对气体摩尔体积、微粒数、分子结构,电化学 等基本理论知识的掌握应用和相关的计算能力,考查学 生的基础知识和思维的缜密性、灵活性。
涉及阿伏加德罗常数(NA)的问题重现率很大。在解
答这类题目时,要认真审题,特别注意试题中一些关键 性的字、词,留心有无上面本考点说明中所列的“陷 阱”。
B.常温下,Cu-Zn 原电池中,正极产生 1.12 L H2 时,转移的电子数为 0.1 NA
高考化学复习《化学常用计量》知识点解析及练习题含答案

1.了解相对原子质量、相对分子质量的定义,并能进行有关计算。
2.理解物质的量的含义,并能用于进行简单的化学计算。
3.了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积,物质的量浓度、阿伏加德罗常数的含义。
4.根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
5.能运用化学方程式和离子方程式进行有关计算。
6.了解溶液的组成。
理解溶液中溶质的质量分数的概念,并能进行有关计算。
7.能根据要求配制一定溶质质量分数、物质的量浓度的溶液。
知识点一、阿伏加德罗常数的应用阿伏加德罗常数的常见考查内容和设错形式:对阿伏加德罗常数的考查往往以选择题的形式,渗透于高中各个知识点中进行考查,试题的知识覆盖面较大,但难度较小,该类试题的特点就是“容易忽视”,即容易落入命题者设置的“陷阱”中,因此明确命题者的考查方向和设错方式有利于我们快速、准确地作出选择。
同时要求同学们在解决该类试题时一定要细心、仔细。
1.考查气体体积与物质的量、微粒数目等关系时,故意忽略标准状况条件或给出常温常压条件。
2.物质状态问题。
考查气体摩尔体积时,常常用标准状况下非气态的物质来迷惑考生,如水、三氧化硫、己烷、三氯甲烷等。
3.结合氧化还原反应考查电子转移的数目问题,特别是歧化反应的电子转移数目,如过氧化钠与水反应、氯气与水的反应等。
4.结合物质结构的有关知识考查物质的微粒数目(如分子、原子、质子、中子、电子等)、化学键数目等。
此处常常涉及的物质有稀有气体(单原子分子)、Na 2O 2(阴阳离子个数比)、SiO 2、Si 、P 4、CO 2(化学键数目)、特殊物质的质量与微粒数间的关系,如D 2O 、18O 2等。
5.考查溶液中离子数目时故意忽视盐类的水解,弱电解质的电离等。
高考化学复习《化学常用计量》知识点解析及练习题含答案6.结合化学平衡考查时,故意忽视可逆反应不能进行到底的特点。
【特别提醒】阿伏加德罗常数应用题常设的五大“陷阱”。
高中化学中常用计量

高中化学中常用计量化学中常用计量1.同位素相对原子质量以12C的一个原子质量的1/12作为标准,其他元素的一种同位素原子的质量和它相比较所得的数值为该同位素相对原子质量,单位是“一”,一般不写。
2.元素相对原子质量(即平均相对原子质量)由于同位素的存在,同一种元素有若干种原子,所以元素的相对原子质量是按各种天然同位素原子所占的一定百分比计算出来的平均值,即按各同位素的相对原子质量与各天然同位素原子百分比乘积和计算平均相对原子质量。
3.相对分子质量一个分子中各原子的相对原子质量×原子个数的总和称为相对分子质量。
4.物质的量的单位——摩尔物质的量是国际单位制(SI)的7个基本单位之一,符号是n。
用来计量原子、分子或离子等微观粒子的多少。
摩尔是物质的量的单位。
简称摩,用mol表示①使用摩尔时,必须指明粒子的种类:原子、分子、离子、电子或其他微观粒子。
②1mol任何粒子的粒子数叫做阿伏加德罗常数。
阿伏加德罗常数符号NA,通常用6.02×1023molˉ1这个近似值。
③物质的量,阿伏加德罗常数,粒子数(N)有如下关系:n=N·NA5.摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量。
用M表示,单位:g·molˉ1或kg·molˉ1。
①任何物质的摩尔质量以g·molˉ1为单位时,其数值上与该物质的式量相等。
②物质的量(n)、物质的质量(m)、摩尔质量(M)之间的关系如下:M=m·n6.气体摩尔体积:单位物质的量气体所占的体积叫做气体摩尔体积。
用Vm表示,Vm=V÷n。
常用单位L·molˉ1①标准状况下,气体摩尔体积约为22.4L·molˉ1。
阿伏加德罗定律及推论:定律:同温同压下,相同体积的任何气体都会有相同数目的分子。
理想气体状态方程为:PV=nRT(R为常数)由理想气体状态方程可得下列结论:①同温同压下,V1:V2=n1:n2②同温同压下,P1:P2=Ml:M2③同温同体积时,nl:n2=Pl:P2………7.物质的量浓度以单位体积里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。
化学常用计量PPT教学课件

mol·L-1Na2CO3溶液逐滴加入到40 mL 0.5
mol·L-1的MCln盐溶液中,恰好将溶液中的Mn
+完全沉淀为碳酸盐,则MCln中n值是( )
A.4
B.3
C.2
D.1
【解析】 由反应的离子方程式 2Mn++nCO23- M2(CO3)n↓可得,2×15 mL×10-3 L·mL
- 1×2 mol·L - 1 = 40 mL×10 - 3L·mL - 1×0.5 mol·L-1×n,所以 n=3。 【答案】 B
•戈文亮渴望自己成为什么样的人? •他对男子汉的理解 是什么?
•他认为必须做什么才能证明他自己 是个真正的男子汉?
仔细阅读4、5、6三部分,在其中 寻找有哪些因素催化了戈文亮性格 的突变,致使他最终放弃了杀狐? 在这些因素中?谁又起到了关键的 作用?
读第7部分,思考,当戈文亮最终放弃了自 己的猎狐行动,读者在为他喝彩时,他自己 是怎样的呢?他意识到自己成功了吗?他的 情绪怎么样?请揣摩他当时的心态,在课文 中找到相关的语句。是谁最终肯定了他的成 功?
高考热点示例
考点一 阿伏加德罗常数的应用
例1 下列说法正确的是(NA表示阿伏加德罗常数的 值)_______(选填数字序号)。 ①常温常压下,1 mol氮气含有NA个氮分子 ②标准状况下,以任意比例混合的甲烷和丙烷混合气体 22.4 L,所含的气体的分子数约为NA ③标准状况下,22.4 L NO和11.2 L氧气混合,气体的分 子总数约为1.5NA ④将NO2和N2O4分子共NA个降温至标准状况下,其体积 为22.4 L ⑤常温下,18 g重水所含中子数为10NA个 ⑥常温常压下,1 mol氦气含有的核外电子数为2NA
温度、压强的高低无关;物质的量浓度的大小与所取该 溶液的体积多少无关(但溶质粒子数的多少与溶液体积 有关)。
高考化学专题复习讲义:化学常用计量

第2讲化学常用计量知考点明方向满怀信心正能量设问方式①有关阿伏加德罗常数的综合判断[例](2018·全国卷Ⅰ,10),(2018·全国卷Ⅱ,10),(2017·全国卷Ⅲ,10),(2017·海南卷,7)②以“物质的量”为核心的多角度计算[例](2018·全国卷Ⅲ,8)③一定物质的量浓度溶液的配制[例](2018·全国卷Ⅱ,11)知识点网络线引领复习曙光现释疑难研热点建模思维站高端考点一阿伏加德罗常数的应用▼ 命题规律:1.题型:正误判断型选择题2.考向:以选择题的形式考查一定量的物质所含粒子(分子、原子、离子、质子、中子等)数目、氧化还原转移电子的数目、一定量的物质所含某种化学键的数目等。
▼ 方法点拨:1.关于阿伏加德罗常数试题常设的“陷阱”(1)气体摩尔体积的运用条件陷阱:考查气体时经常给定非标准状况下(如25 ℃、1.01×105 Pa)气体体积,考生易用22.4 L·mol-1进行换算,误入陷阱。
(2)物质的聚集状态陷阱:22.4 L·mol-1适用对象是标准状况下的气体。
命题者常用在标准状况下非气态的物质来迷惑考生,如H 2O 、CCl 4、辛烷、汽油、SO 3、C 6H 6等。
(3)单质的组成陷阱:气体单质的组成除常见的双原子分子外,还有单原子分子(如He 、Ne 等)、三原子分子(如O 3)等。
(4)某些氧化还原反应中电子转移的数目陷阱:命题者常用一些反应中转移电子的数目来迷惑考生,如Na 2O 2与H 2O 反应、Cl 2与NaOH 溶液反应、Fe 与HCl 反应、HNO 3与过量Fe 反应、电解CuSO 4溶液等。
(5)物质的组成、结构陷阱:如Na 2O 2是由Na +和O 2-2构成,而不是Na +和O 2-;NaCl 为离子化合物,只有离子没有分子;苯中不含碳碳单键和碳碳双键。
(6)电离、水解对溶液中离子数目的影响陷阱:考查电解质溶液中离子数目或浓度时常设置弱电解质的电离、盐类水解方面的陷阱。
高三化学复习基本概念复习三―常用的化学计量

化学基本概念复习三――常用的化学计量诸城二中王洪兵[知识归纳]物质的量贯穿于整个高中化学的始终,是化学计算中处于核心地位的重要概念。
它是掌握物质的质量、体积(标准状况下)、物质的量浓度、反应热、化学方程式计算的前提,是高考的必考点之一。
要掌握这一考点,除抓概念的内涵与外延外,还要及时总结小规律。
一、以物质的量为中心的相互关系二、阿伏加德罗定律及推论1.定律:同温同压下,相同体积的任何气体都含有相同数目的分子。
2.推论:(1)同温同压下,气体的体积之比等于气体的物质的量之比,即V1:V2=n1:n2。
(2)同温同压下,两种不同气体的密度之比等于气体的摩尔质量之比,即ρ1:ρ2=M1:M2。
(3)同温同压下,同体积的任何气体其质量之比等于气体的摩尔质量之比,即m1:m2=M1:M2。
(4)同温同压下,同质量任何气体的体积之比等于其摩尔质量倒数之比,即V1:V2=M2:M1。
(5)同温同体积下,气体的压强之比等于气体的物质的量之比:P1:P2==n1:n2。
三、物质的量与气体平均相对分子质量之间的计算1.(m总为气体总质量,n总为气体总物质的量) (此公式也适合非气态物质)2.已知混合气体的体积分数或摩尔分数求平均相对分子质量。
其中M A、M B、……,为组分气体的相对分子质量;a%、b%、……,为组分气体对应的体积分数或摩尔分数。
3.其中ρ为气体在标准状况下的密度。
4.其中D相对为混合气体对某已经气体的相对密度,M已知为已知气体的相对分子质量。
四、物质的量浓度及有关计算原理1.关于物质的量浓度概念的计算主要包括:(1)溶质的质量、溶液的体积和物质的量浓度之间的计算。
可运用公式:n=m/M,c=n/V,所以。
(2)已知气体溶质的体积(标准状况下)、溶剂的体积和溶液的密度,计算溶液中溶质的物质的量浓度。
应先运用n=V/22.4L·mol—1,求出溶质的物质的量;再运用V(溶液)=m/ρ求出溶液的体积,其中m为气体和水的质量和,即溶液的质量,ρ为溶液的密度,V(溶液)的单位为L;最后用物质的量浓度公式计算。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考总复习 化学中的常用计量【考试要求】1.认识相对原子质量、相对分子质量的含义,并能进行有关计算。
2.了解物质的量的单位——摩尔(mol )、摩尔质量、气体摩尔体积、阿伏加德罗常数的含义。
3.根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
4.掌握阿伏加德罗定律及质量守恒定律的实际应用。
【知识网络】以物质的量为核心的各物理量的相互关系:【要点梳理】考点一、物质的量及其单位 1.物质的量(n )(1)概念:用0.012 kg 12C 中所含的原子数目作为标准来衡量其他微粒集体所含微粒数目多少的物理量。
(2)单位:摩尔,简称“摩”,符号:mol 。
要点诠释:物质的量与质量、长度一样是七个基本物理量之一,它表示含有一定数目的粒子的集合体,用n 表示。
作为专用名词,“物质的量”四个字是一个整体,不得拆分或简化,不得添加任何字,更不能将其当做物质的数量或物质的质量。
2.摩尔(1)概念:摩尔是物质的量的单位,1 mol 物质含有阿伏加德罗常数值个微粒。
(2)适用范围及注意事项①用mol 为单位只能用于物质的微观粒子,如分子、原子、离子或它们的特定组合。
不能用于宏观物质。
②用mol 为单位必须指明物质微粒(或微粒组合)的符号。
3.阿伏加德罗常数(N A )(1)含义:0.012 kg 12C 中所含碳原子数为阿伏加德罗常数,根据实验测得其数值约为6.02×1023。
1 mol 任何物质均含有阿伏加德罗常数个相应微粒。
(2)单位:mol ―1,符号N A 。
(3)微粒数(N )、物质的量(n )与阿伏加德罗常数(N A )三者关系。
n =ANN ,利用该关系式,已知其中任意两个量,可以求第三个量。
要点诠释:受客观条件的限制,目前科学界还不能测出阿伏加德罗常数的准确值,通常使用6.02×1023 mol -1这个近似值。
也就是说,1 mol 任何粒子的粒子数约为6.02×1023,如1 mol 氧原子中约含有6.02×1023个氧原子。
阿伏加德罗常数与6.02×1023 mol -1是常数与近似值的关系,不能将阿伏加德罗常数与6.02×1023 mol -1等同,就像不能将π与3.14等同一样。
4.摩尔质量(1)概念:单位物质的量的物质所具有的质量。
(2)单位:g ·mol ―1或kg ·mol -1 。
(3)数值:当摩尔质量单位是g ·mol -1时数值上等于物质的相对分子质量或相对原子质量。
(4)物质的量(n )、物质的质量(m )和物质的摩尔质量(M )之间的关系式:mn M=。
5.相对原子质量(1)、定义:以12C 原子质量的1/12为标准,其它原子的质量跟它相比较所得到的比值,作为这种原子的相对原子质量。
(2)、两种原子的质量之比与其相对原子质量之比有何关系:二者相等。
因为任何一种原子的相对原子质量,都是以12C 质量的1/12为标准所得的比值。
所以,任何原子的质量之比,就等于它们的相对原子质量之比。
要点诠释:相对分子质量等于构成分子的各原子的相对原子质量之和,单位是1,通常不写出。
当摩尔质量以g ·mol -1为单位时,摩尔质量与相对分子质量在数值上是相等的。
考点二、气体摩尔体积1.气体摩尔体积(1)概念:一定温度和压强下,单位物质的量的气体所占的体积,符号为V m 。
(2)常用单位:L /mol (或L ·mol -1)和m 3/mol (或m 3·mol ―1)。
(3)数值:在标准状况下(指温度为0℃,压强为1.01×105 Pa )约为22.4L ·mol ―1。
(4)物质的量和气体摩尔体积之间的关系为:mV n V =。
(5)影响因素:由于气体体积与温度、压强有关,故气体摩尔体积的数值V m 它决定于气体所处的温度和压强,也随温度、压强的变化而变化,在标准状况下V m =22.4 L ·mol ―1。
2.阿伏加德罗定律【高清课堂:化学中的常用计量】(1)内容:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
即气体物质的量之比等于气体体积之比,也等于气体分子数之比。
即:111222V N n V N n ==。
(2)两个推论:①同温同压下:气体密度之比等于气体式量之比1122M M ρρ=, 12ρρ的比值称为气体1对气体2的相对密度。
②同温同体积下:气体压强之比等于气体物质的量之比1122P n P n = 说明:M :摩尔质量 m :质量 n :物质的量考点三、气体式量的基本计算方法:(1)密度法:m m M V ρ= m ρ:该气体在标准状况下的密度,g ·L -1。
m V :气体摩尔体积,22.4 L ·mol -1(标准状况)。
M :气体的摩尔质量,数值上等于相对分子质量。
(2)相对密度法:1122M M ρρ= (3)公式法:m M n =总总(混合气体的平均化学式量) 考点四、物质的量浓度:1、 定义:从单位体积的溶液里所含溶质B 的物质的量来表示溶液组成的物理量叫做溶质B 的物质的量浓度。
符号为c (B),单位有mol / L (或mol·L ―1)等。
2、表达式:物质的量浓度(mol/L )=要点诠释:(1)溶液体积不能等同于溶剂体积,应是溶质在溶剂中溶解后的实际体积。
(2)溶液具有均一性,即从一定物质的量浓度的溶液中取出任意体积的溶液,物质的量浓度保持不变。
(3)溶质是用物质的量表示而不是质量表示;体积表示溶液的体积,而不是溶剂的体积,体积单位为L 。
(4)带结晶水的物质溶于水后,溶质是不含结晶水的化合物,溶剂中的水包括结晶水。
(5)气体溶于一定体积的水中,溶液的体积不等于溶剂的体积,而应根据溶液密度和溶液质量求算。
(6)若浓溶液稀释或浓度差别较大的溶液混合,混合后溶液的总体积比原来的体积之和小。
考点五:配制一定物质的量浓度溶液 1、步骤:由固体配制溶液(需确定溶质的质量)和由浓溶液配制稀溶液(需确定要量取的浓溶液体积)。
整个过程可细化为八个步骤:计算、称量、溶解或稀释、转移、洗涤、转移、定容、摇匀。
2、仪器:容量瓶(注意规格)、托盘天平(固体配制溶液)或滴定管(用浓溶液配制稀溶液)、量筒(用于量取溶剂)、烧杯(溶解)、玻璃棒(搅拌、引流)、胶头滴管(用于定容)、药匙(溶质是固体时使用)。
3、检查容量瓶是否漏液的方法:容量瓶上标有刻度线、适用温度、容量。
使用前一定要检查容量瓶是否漏液,其方法是:向瓶内加一定量水,塞好瓶塞,用左手食指顶住瓶塞,右手托住瓶底,将容量瓶倒置,看是否有水漏出。
如不漏水,再将容量瓶正立,将瓶塞旋转180°,重复上述操作,两次均不漏水的容量瓶才能使用。
4、注意事项:(1)称量时一般用托盘天平,量取时一般用量筒,它们只能准确到小数点后一位(0.1 g 或0.1 mL ),因此计算所用溶质的质量或体积时保留到小数点后一位。
(2)称量时左物右码,有吸湿性和腐蚀性的药品放在烧杯中快速称量;用量筒量取的液体倒入烧杯后,量筒内壁附着的溶质不要洗涤到烧杯中。
(3)溶解时一般先在烧杯中加入溶质,后加溶剂进行溶解。
浓硫酸的稀释一定要注意将浓硫酸沿烧杯内壁慢慢倒入水中,且边加边用玻璃棒搅拌。
mol 溶质的物质的量()溶液的体积(L)(4)配制一定物质的量浓度的溶液,是将一定质量或体积的溶质按溶液的体积在选定的容量瓶中定容,因而完全不需要计算水的用量。
(5)不能配制任意体积的溶液,因为配制过程中是用容量瓶来定容的,而容量瓶的规格又是特定值。
常用容量瓶的规格有100 mL、250 mL、500 mL、1000 mL等。
(6)不能在容量瓶中溶解、稀释或久贮溶液(尤其碱性溶液),更不可在容量瓶中进行化学反应。
配制完溶液后,应将溶液倒入干燥、洁净的试剂瓶中。
(7)溶液注入容量瓶前要使其温度恢复到室温,这是因为热的溶液转入容量瓶会使所配的溶液的体积偏小(玻璃的膨胀系数小于液体),所配溶液浓度偏大。
(8)溶液转移至容量瓶时,要用玻璃棒引流,并用蒸馏水洗涤烧杯及玻璃棒(上面粘有少量溶质)2~3次,将洗涤液移入容量瓶。
(9)当容量瓶中液面上升到离刻度线1~2 cm处,要改用胶头滴管加入蒸馏水,防止液面超过刻度线。
若加水定容时超过刻度线,必须重新配制。
(10)定容后的溶液要注意反复摇匀。
静置后若发现液面下降,稍低于标线,不要再加蒸馏水,否则会引起结果偏低。
如果摇匀后洒出几滴,溶液的浓度不变。
5、配制误差分析:根据n mcV MV==判断。
其他正常时,凡是使m或n增大的因素,使c偏大;凡是使m或n减小的因素,使c偏小;凡是使V增大的因素,使c偏小;凡是使V减小的因素,使c偏大。
(1)若称量固体溶质时,操作无误,但所有砝码生锈,m偏大,结果偏高。
(2)若没有洗涤烧杯内壁,使n偏小,结果偏低。
(3)若容量瓶中有少量蒸馏水,或定容后反复摇匀后发现液面低于刻度,则对结果无影响。
(4)仰视刻度线(图甲)。
由于操作时是以刻度线为基准加水,从下向上看,最先看见的是刻度线,刻度线低于液面的实际刻度,故加水量偏多,导致溶液体积偏大,结果偏低。
(5)俯视刻度线(图乙)。
恰好与(4)相反,刻度线高于液面的实际刻度,使得加水量偏小,结果偏高。
【典型例题】类型一、物质的量的有关概念例1、(2015 北京四中期中)下列说法正确的是()A.1 mol任何物质均含有阿伏加德罗常数个分子B.1 mol H2O的质量是18 g/molC.H2O的摩尔质量是18 gD.18 g水中所含氧原子数约为6.02×1023个【思路点拨】①有些物质不是由分子构成的②摩尔质量的单位是g/mol。
【答案】D【解析】有些物质不是由分子构成的,故A项错误;1 mol H2O的质量是18 g,H2O的摩尔质量是18 g/mol,故B、C项错误;18 g水为1 mol,所含氧原子数约为6.02×1023个,D项正确。
【总结升华】注意摩尔质量是单位物质的量的物质所具有的质量,单位为g / mol。
举一反三:【变式1】下列关于物质的量和摩尔质量的叙述,正确的是()A.水的摩尔质量是18 gB.0.012 kg 12C中约含6.02×1023个C原子C.1 mol水中含有2 mol氢和1 mol氧D.1 mol任何物质都含有6.02×1023个分子【答案】B【变式2】下列说法中正确的是()A.摩尔既是物质的数量单位又是物质的质量单位B.阿伏加德罗常数是12 kg 12C中含有的碳原子数C.1 mol水中含有2 mol氢原子和1 mol氧原子D.一个NO分子的质量是a g,一个NO2分子的质量是b g,则氧原子的摩尔质量是(b―a)g·mol―1【答案】C【解析】摩尔是物质的量的单位;1 mol粒子集体所含的粒子数是阿伏加德罗常数,与0.012 kg 12C中所含的碳原子数相同;摩尔质量以g·mol―1为单位时,数值上等于相对原子质量或相对分子质量。
