实验四人类染色体的识别与核型分析 (1)
人类显带染色体核型分析

医学遗传学实验报告【实验题目】人类显带染色体核型分析【实验目的】掌握染色体核型分析的常用方法及G分带的带型特征,会初步识别G分带人类染色体。
【实验原理】将一个细胞内的染色体按照一定的顺序排列起来构成的图像称为该细胞的核型(karyotype),这通常是用显微摄影得到的染色体相片剪贴而成。
在显带技术问世以前,人们主要根据染色体的大小、着丝粒的位置,将人类染色体顺次由1编到22号,并分为7组。
但要想精确、有把握地鉴别每条染色体是比较困难的。
70年代初出现了染色体显带技术,不仅解决了染色体识别困难的问题,而且为深入研究染色体异常及基因定位创造了条件。
将染色体标本用显带方法处理后,再用Giemsa染色,这类技术称为G分带,通过显微摄影,就可得到G带染色体的显微相片。
【实验方法和步骤】(1)胰酶液的配制:称取胰酶0.2g溶于100mlHanks液中,搅拌30min,用1mol/L NaOH调pH值至7.0~7.2,冷冻保存(最好现配现用)。
(2)先将胰酶液水浴加热到37℃。
(3)将染色体标本浸入胰酶液中,作用时间几秒到几十秒不等,依标本存放时间长短而定(标本需预先经60℃~70℃烤2h,或37℃恒温老化5~7d。
若标本太新鲜,则染色体有些毛糙)。
(4)取出玻片标本,在生理盐水中过一下,再用蒸馏水洗。
(5)Giemsa染液染色8min。
(6)自来水洗、晾干。
(7)镜检:选择分散及显带良好的分裂象,在油镜下观察。
如观察到染色体变粗并显得边缘毛糙,有时甚至呈糊状,是处理过度了。
观察细胞的标准:1)细胞完整,轮廓清晰,染色体在同一平面上均匀分布。
2)染色体形态和分散良好,最好无重叠现象,即使染色体个别重叠,也要能明显辨别。
3)所观察的染色体长短大致一样,处于同一有丝分裂时期。
4)在所观察的染色体周围没有多个或单个散在的染色体。
(8)显微摄影,将相片上的染色体逐个剪下,按丹佛和人类染色体遗传学命名的国际机制(ISCN)排列编号。
遗传学实验:人的染色体核型分析

实验结果
• 作人类染色体核型图
• • • • • • • • • A-G 染色体组的名称 1-22 染色体编号 X,Y 性染色体 del 缺失 der 结构重排的染色体 dup 重复 inv 倒位 t 易位 +/在染色体符号前表示染色体增加或减少,在 染色体符号后表示染色体多出或缺少一部分
实验步骤
1. 计数,沿边缘剪下染色体,编号 2. 初步目测配对,分组 3. 测量长度,计算相对长度、着丝粒指数、 臂比,相同的染色体间配对 4. 将配对好的染色体排列并粘贴在纸上,每一 组下面画一横线,在两端注明起止号,并在 横线下的中部写明A-G组号,染色体从大到 小编为1-22号,性染色体单独列为一组
染色体的特征
• 数目 (2n=?)
• 长度 (绝对长度、 相对长度)
• 着丝粒位置 (M\SM\ST\T)
• 随体与次溢痕的数目、 大小和位置 • 带型分析
人类23对染色体
组型分析实验方法
• • 染色体数目确定 染色体形态特征:
长度:绝对、相对 相对长度=每条染色体的长度/全套染色体长度 臂比=长臂/短臂
记述一特定带时,需 要写明4个内容:染 色体号,长短臂,区 的号序和带的号序。 这些内容按顺序写, 不用间隔或加标点。 如果某一带被再细分, 在原带号数后加一小 数点,编号原则仍按 从着丝粒往臂端序贯 编号。如1p31.2代表 一号染色体短臂3区1 带第2亚带
核型描述
• 首先列出染色体总数,然后是性染色体组成, 接着列出异常的染色体数目或形态。下列统一 的命名符号:
着丝点指数=短臂/(长+短臂)
随体的有无
分组排队原则
• 着丝粒类型相同,相对长度相近的分一组 • 同一组的按染色体长短顺序配对排列 • 各指数相同的染色体配为一对 • 可根据随体的有无进行配对 • 将染色体按长 短排队,短臂向上
染色体核型分析报告

染色体核型分析报告:核型染色体分析报告染色体核型分析弱精染色体核型分析46 xn 染色体核型分析46 xy篇一:染色体核型分析细胞遗传学(染色体核型)分析克隆性染色体异常是诊断恶性血液病的重要依据。
许多特异性染色体畸变和特定的恶性血液病亚型相联系,因而成为恶性血液病诊断分型的重要指标;诊断时的染色体核型对恶性血液病具有独立的预后价值,对于治疗方案的选择具有指导意义;同时染色体畸变可作为监测白血病缓解、复发及突变的重要参考指标,也为分子学研究提供了重要线索。
比如t(9;22)异常的急性淋巴细胞白血病、复杂染色体异常的白血病预后很不好,应尽早进行异基因造血干细胞移植等。
WHO制定的恶性血液病分型系统中,将染色体核型作为最重要的分型及诊断指标,发现重现性异常的染色体可提前作出AML的诊断。
很多染色体异常导致特异性的白血病融合基因。
染色体分析除用于各类恶性血液病患者,如急、慢性白血病、MDS、MPNs、淋巴瘤、多发性骨髓瘤(MM)患者外,还可用于儿童遗传性疾病、先天性畸形的染色体检测,以及习惯性流产、不孕不育等疾病的诊断。
但是染色体分裂相的制备和分析具有一定的难度,需要时间长,因此导致临床染色体的诊断缺乏及时性,往往发报告时间需要一个月甚至更长的时间;染色体核型分析需要细胞分裂才能完成,因此需要细胞具有良好的分裂活性,部分患者的细胞不分裂就不能观察到可供分析的中期分裂相(正常染色体分裂相,核型排列后如图3和图4),在一定程度上影响了患者的确诊和治疗。
此外染色体一般只能分析20-30个分裂相细胞,敏感性只有百分之一,当异常细胞比例较低时,也难以发现异常的染色体。
异常染色体核型的判断需要经验丰富的技术人员,尤其对一些复杂染色体异常,或异常较小的染色体,往往难以正确判断。
采用染色体全自动扫描暨自动核型分析系统可以加快染色体检测和发报告速度。
通过加用一些促细胞分裂的试剂可增加可供分析的核型。
图3 正常男性的染色体核型图4:正常女性核型 46,XX不同血液恶性肿瘤常见的染色体异常见表2,具体介绍如下。
染色体核型分析实验报告

染色体核型分析实验报告染色体核型分析实验报告染色体核型分析是一项重要的实验技术,它能够帮助我们了解个体的遗传特征以及染色体异常与疾病之间的关系。
本次实验旨在通过染色体核型分析,观察和分析不同个体的染色体组成,并探讨染色体异常与遗传疾病之间的关联。
实验过程中,我们选择了一组健康的个体作为研究对象,采集了其外周血样本。
通过细胞培养和染色体制备技术,我们成功地制备出了染色体悬液。
接下来,我们使用高倍显微镜观察了染色体的形态和数量。
在观察过程中,我们发现了不同个体之间染色体的差异。
正常情况下,人类细胞核中的染色体应该为23对,其中包括22对常染色体和一对性染色体。
常染色体是指除性染色体以外的其他染色体,它们负责携带遗传信息,决定了个体的大部分遗传特征。
性染色体则决定了个体的性别。
通过观察,我们发现了某些个体的染色体数量存在异常。
这种异常可能是由于染色体缺失、重复或结构异常等原因引起的。
染色体缺失是指染色体上的一部分或整个染色体丢失,而染色体重复则是指染色体上的一部分或整个染色体重复出现。
染色体结构异常则是指染色体上的片段发生断裂、倒位、交换等变化。
染色体异常与许多遗传疾病之间存在着密切的关系。
例如,唐氏综合征是由于21号染色体上的三个染色体引起的,患者通常具有智力发育迟缓、面部特征异常等症状。
另外,爱德华氏综合征是由于18号染色体异常引起的,患者通常出现心脏和肾脏畸形等问题。
通过染色体核型分析,我们可以准确地检测出这些染色体异常,为遗传疾病的诊断和治疗提供有力的依据。
除了遗传疾病,染色体核型分析还可以应用于其他领域。
例如,它可以用于法医学领域的亲子鉴定,通过比对父母与子女的染色体核型,确定亲子关系。
此外,染色体核型分析还可以用于评估环境因素对染色体的影响,例如辐射和化学物质对染色体的损伤程度。
总结起来,染色体核型分析是一项重要的实验技术,它可以帮助我们了解个体的遗传特征以及染色体异常与疾病之间的关系。
通过观察染色体的形态和数量,我们可以准确地检测染色体缺失、重复和结构异常等问题,并为遗传疾病的诊断和治疗提供依据。
人类染色体标本制备及核型分析(1)

图像分析
核型描述与命名
将观察到的染色体图像进行数字化处理, 利用计算机图像分析技术对染色体进行自 动或半自动的识别、测量和分类。
根据染色体的形态、结构和数量特征,对 核型进行描述和命名,建立核型数据库。
数据解读与报告生成
数据解读
通过对核型数据的解读,可以了解待测生物体的遗传特征、染色体变异情况以及与疾病的关系等信息 。
更好的分裂相。此外,对于某些难以染色的标本,可以尝试使用不同的
染色方法和染色剂。
结果判读和数据分析方法
要点一
结果判读
根据染色体的形态、大小和着丝粒位置等特征进行识别。 对于异常染色体核型,需结合临床信息进行综合判断。
要点二
数据分析
采用专业的染色体核型分析软件对实验结果进行统计分析 。通过比较正常和异常核型的比例、染色体变异类型及频 率等指标,评估标本的质量和实验结果的可靠性。
伦理道德审查
在应用染色体标本制备及核型分析技术时,应进行严格的 伦理道德审查。这包括评估实验目的、样本来源、数据使 用等方面的合规性和合理性,确保技术的使用符合伦理道 德要求。
保护个人隐私和权益
在染色体标本制备及核型分析过程中,应严格保护个人隐 私和权益。这包括确保样本信息的保密性、限制数据使用 和共享范围、尊重个人知情权和选择权等方面的措施。
人类染色体标本制备及核型分析
汇报人:XX
目录
• 染色体标本制备基础 • 核型分析原理及方法 • 人类染色体异常类型及影响 • 实验操作技巧与经验分享 • 临床应用前景与挑战
01
染色体标本制备基础
染色体概念及结构
染色体定义
染色体是细胞核内具有遗传信息 的线性结构,由DNA、蛋白质和 少量RNA组成。
人类核型分析

实验四人类核型分析一.实验目的了解人类染色体的形态特征,掌握其核型分析的基本方法。
二.材料人正常和异常的染色体标本,人显带染色体标本三.试验内容与方法:核型:指某种生物个体或某一分类群(种、亚种或变种、居群)的一个体细胞全部中期染色体的数目、大小和形态等特征的总和。
用来表述物种的特点和亲缘种属之间的关系。
核型分析:将待测细胞的染色体按照该生物固有的染色体形态特征和规定,进行配对、编号和分组,并进行形态分析的过程过程。
Denver体制:按照Denver会议(1960年)提出的染色体命名和分类标准,将人类体细胞的46条染色体按大小(根据长度递减顺序)、着丝粒的位置分成七组(A、B、C、D、E、F、G、)23对的排列,并将副缢痕和随体作为识别染色体的辅助指标。
人类染色体核型分析标准是丹佛(Denver)体制(人类有丝分裂染色体的标准命名体制)。
该体制规定:每一条染色体可通过相对长度、臂率和着丝粒指数等三个参数予以识别;非显带染色体:染色体标本制作好后,不经处理直接染色,整条染色体均匀着色(相对于后面的显带染色体而言)。
人中期细胞染色体(数目2N=46)结构特点G显带染色体:G带技术是其中最常用的技术,由Pardue和Gall(1970)建立。
中期染色体经胰酶处理及Giemsa染色后,能在其长轴上显示出明暗交替的横纹,每个染色体都有特定的带纹,可应用染色体分带技术,来准确地辨别每个染色体。
一个细胞中期分裂相的G显带技术,每个染色体被染成深浅相间的带纹,浅的部分称为明带或浅带,深的部分称为暗带或深带。
G带反映了染色体DNA上A -T的丰富区,在人类中约有2000条G带可被鉴别,在间期核呈固缩状态,而且是DNA晚复制区之一。
有相当一部分中度重复序列DNA可能在G带区,Giemsa染料在G带区是与DNA结合,而且与结合DNA的染色质非组蛋白有关。
G带区位于染色体的两臂上,和Q带区相对应,而与R带区相反。
人类细胞染色体共分24种不同的带纹(22对常染色体和X、Y染色体)(一)人类正常染色体及其带型的识别1. 非显带染色体的识别:根据染色体按大小(根据长度递减顺序)、着丝粒的位置分①A群:包括第1、2、3对染色体,体积大,彼此易于区别,有中央着丝粒,第二对染色体的着丝粒略偏离中央。
人类染色体G带观察与核型分析

人类染色体G带观察与核型分析一、实验目的掌握人类体细胞染色体组型分析的方法二、实验原理○1核型:染色体组型又称核型,是指将动物、植物、真菌等的某一个体或某一分类群(亚种、种、属等)的体细胞内的整套染色体,按它们相对恒定的特征排列起来的图像。
核型模式图是指将一个染色体组的全部染色体逐个按其特征绘制下来,再按长短、形态等特征排列起来的图像。
核型( karyotype )是指一个细胞内的整套染色体按照一定的顺序排列起来所构成的图像,通常是将显微摄影得到的染色体照片剪贴面成。
正常细胞的核型能代表个体的核型。
组型( idiogram )是以模式图的方式表示,它是通过对许多细胞染色体的测量取其平均值绘制而成的,是理想的、模式化的染色体组成。
它代表了一物种染色体组型的特征,核型的研究对人类医学遗传研究及临床应用,对探讨动植物起源、物种间亲缘关系、鉴定远缘杂种等方面都有重大意义。
○2带染色技术也称为改良的 iemsa 染色法。
因用 iemsa 染色,所以称为带。
它是目前应用最广泛的染色体分带技术之一。
染色体标本放到37℃胰酶中是带显示的一种预处理方式,它可以从染色体上抽取蛋白质特定的成分,从而经 iemsa 染色后获得良好一致的分带类型。
带的形成与 iemsa 染料的组成及染色特性分不开。
iemsa 染料即噻嗪-曙红染料,染色首先取决于两个噻嗪分子同DNA 的结合,在此基础上它们结合一个曙红分子,其次取决于一个有助于染料沉淀物积累的疏水环境。
通过胰前预处理可以使阴性带区的疏水蛋白被除去或使它们的构型变为更疏水状态。
从而造成了染色体蛋白质的差异,这种差异就是明暗相间的染色体带。
染色体带技术为染色体遗传病诊断、杂种细胞检定、特殊细胞株标记、染色体的识别等开创了一系列检测方法,大大加速了染色体研究的进展。
○3对任何一个染色体的基本形态学特征来说,重要的参数有3个:描述染色体的三个参数: 1.相对长度:指单个染色体长度与包括X(或Y)染色体在内的单倍染色体总长之比,以百分率表示。
人类染色体和染色体的识别
n 估计平均每3000bp为一个基因,每条染 色体可能代表几个或几百个基因
G显带深染带富含AT,富含长分散 DNA序列(long interspersed sequence, LINES)是DNA的重复区域,不编码表达 基因.
nR-显带:反G带 nQ-显带:荧光显带,同G显带带纹 nT-显带:末端显带 nC-显带:着丝粒显带
NOR:特异显示近端着丝粒染色体的核仁 组织区
R显带
Q-显带:荧光显带,同G显带带纹
T-显带:末端显带
C-显带:着丝粒显带
NOR:特异显示近端着丝粒染色体
三、人类细胞遗传学研究进展
(一)染色体高分辨显带
1949年,加拿大细胞学家Barr等人,在雌 猫神经原细胞核中发现一种浓缩小体,但在雄 猫中看不到这种结构。
进一步研究发现,除猫以外,其它雌性哺乳 动物(包括人类)也同样存在这种显示性别差 异的结构,称为Barr小体,既X染色质。
正常女性的间期细胞核中紧贴核膜内缘有一 个染色较深,约为1微米大小的椭圆形小体, 既X染色质。
➢正常女性有两条X染色体,男性只有一条 X染色体(和一条Y),X染色体有数量 差异。那么,位于X染色体上的基因产物 是否存在差异昵?为什么只有女性才有X 染色质而男性没有?为什么某一种X连锁 的突变基因纯合子女性的病情并不比半 合子的男性严重?
➢1961年,英国的遗传学家Mrry Lyon等 四人,根据各自的实验提出了X染色体失 活假说,后称为Lyon 假说,来解释上述 问题。
图 6-1 人类染色体核型模式图(非显带)
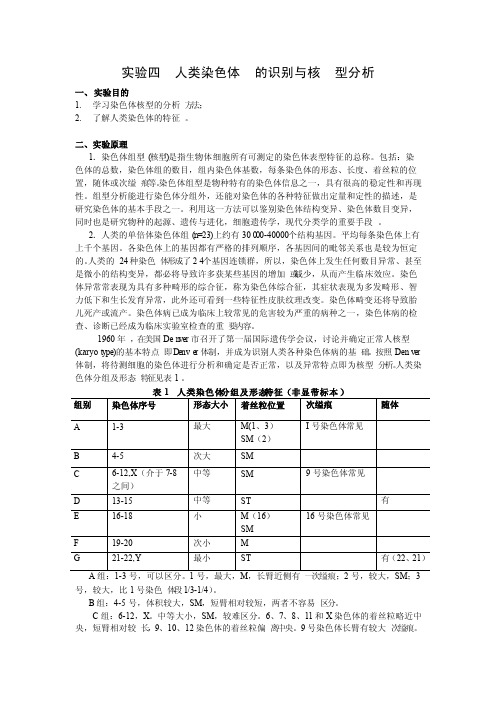
表6—1 人类非显带染色体核型分组及形态特征(Denver 体制)
实验四人类染色体的识别与核型分析
实验四人类染色体的识别与核型分析一、实验目的1.学习染色体核型的分析方法;2.了解人类染色体的特征。
二、实验原理1.染色体组型(核型)是指生物体细胞所有可测定的染色体表型特征的总称。
包括:染色体的总数,染色体组的数目,组内染色体基数,每条染色体的形态、长度、着丝粒的位置,随体或次缢痕等。
染色体组型是物种特有的染色体信息之一,具有很高的稳定性和再现性。
组型分析能进行染色体分组外,还能对染色体的各种特征做出定量和定性的描述,是研究染色体的基本手段之一。
利用这一方法可以鉴别染色体结构变异、染色体数目变异,同时也是研究物种的起源、遗传与进化,细胞遗传学,现代分类学的重要手段。
2.人类的单倍体染色体组(n=23)上约有30000-40000个结构基因。
平均每条染色体上有上千个基因。
各染色体上的基因都有严格的排列顺序,各基因间的毗邻关系也是较为恒定的。
人类的24种染色体形成了24个基因连锁群,所以,染色体上发生任何数目异常、甚至是微小的结构变异,都必将导致许多获某些基因的增加或减少,从而产生临床效应。
染色体异常常表现为具有多种畸形的综合征,称为染色体综合征,其症状表现为多发畸形、智力低下和生长发育异常,此外还可看到一些特征性皮肤纹理改变。
染色体畸变还将导致胎儿死产或流产。
染色体病已成为临床上较常见的危害较为严重的病种之一,染色体病的检查、诊断已经成为临床实验室检查的重要内容。
1960年,在美国Den ver市召开了第一届国际遗传学会议,讨论并确定正常人核型(karyot ype)的基本特点即D enve r体制,并成为识别人类各种染色体病的基础。
按照Denv er 体制,将待测细胞的染色体进行分析和确定是否正常,以及异常特点即为核型分析。
人类染色体标本的制备与G显带核型分析报告

人类染色体标本的制备与G显带核型分析报告概述核型分析是指通过对细胞的染色体观察,了解它们的数量、形态,从而判断个体的性别以及是否存在染色体异常。
本文将介绍人类染色体标本的制备方法以及采用G显带染色技术进行核型分析的过程和结果。
材料与方法标本制备:1.通过体内生长的细胞系培养得到细胞,并将它们发送至染色体形态捕获系统实验室。
2.将收到的细胞进行样品准备。
先加入均浆剂净水,并初次混合。
待与细胞量相等的5%高马尔谷酸(Na2HPO4)特性缓冲液和1%偏硫酸,最后混合。
3.轻轻转动管子,并且离开它说较长时间,使得细胞得以与溶液完全变淡。
4.通过四氯化碳进行固定,直至样品中的细胞结构都没有被损坏。
5.利用各种化学剂处理样本,以预处理出更好的结构。
G显带染色:1.将钟室内的标本压片,使细胞的核形成按制定的标准排序,并在有机玻璃片底部粘贴。
2.加入如下染料:a. Giemsa液:Giemsa指的是罗马帝国时期的波尔多区Giemsa教授。
G显带染色技术将溶液中的Giemsa染色质直到他们的总量到达6倍于DNA总量。
Giemsa染料在滴定时间内还要使染色质呈现某些将染色质透过玻片清楚可见的颜色。
b. Sorenson’s Buffer:Sørensen’s缓冲液是一种被设计为模仿人类体液的缓冲液。
在G显带染色过程中,它发挥的作用是将不同颜色的细胞内组成分离出来,使得它们不会在一幅核型图像中混杂在一起。
3. 在加入染料后将玻璃片封起来,等待颜料与核相结合。
4. 将镜头放置在显微镜底座中,并通过显微镜观察标本。
分析:我们使用的显微镜是能见度很好的显微镜,能够让细胞结构非常清晰可见。
我们可以在屏幕上观察到标本图像。
我们首先计算出图像中每个单独的染色体的数目以及它们的大小和形状。
在一张图像上,我们可以很容易地区分每个单独的染色体,并根据它们的大小、形状和位置来确定它们在细胞核中的位置。
结果我们的细胞核型分析结果显示,这个体细胞核内的染色体数目为46个。
遗传学课件遗传学实验-人类染色体核型分析

[3] Smith J, Johnson M, Levine A. Karyotyping in clinical practice.
American Journal of Human Genetics, 2017, 91(6): 987-998.
附录:相关图表和数据
图1
人类染色体核型图谱
表1
染色体异常类型及临床表现
障碍等问题。
倒位
染色体倒位是指染色体局部发 生倒转的现象,可能导致胎儿 智力障碍、生长发育迟缓等问 题。
缺失
染色体缺失是指染色体部分缺 失的现象,可能导致胎儿智力 障碍、生长发育迟缓等问题。
重复
染色体重复是指染色体部分重 复的现象,可能导致胎儿智力 障碍、生长发育迟缓等问题。
染色体异常的遗传机制
染色体异常的遗传机制主要包括基因突变和染色体畸变。基因突变是指在基因序 列中发生碱基对的增添、缺失或替换等现象,可能导致胎儿发育畸形、智力障碍 等问题。
实验材料准备
准备好染色体标本、显微镜、染色剂、载玻片、 盖玻片、显微操作器等实验器材和试剂。
实验环境设置
确保实验室环境整洁、无尘,并保持适宜的温度 和湿度。
实验人员要求
实验人员应具备基本的遗传学知识和实验技能, 熟悉实验操作流程和注意事项。
实验操作流程
01
02
03
04
标本制备
采用适当的细胞培养和固定方 法,制备染色体标本。
遗传学课件-人类染色体核型 分析
目录
• 人类染色体介绍 • 染色体核型分析技术 • 人类染色体核型异常 • 染色体核型异常与疾病 • 实验操作和注意事项 • 参考文献和附录
01
人类染色体介绍
染色体的组成和功能
实验四、 人的染色体核型分析

人类男性的染色体
中期染色体的典型形态结构: 中期染色体的典型形态结构:
染色体的类型形态
1.00~1.7 ~
1.71~3.00 ~
3.01~7.00 ~
∞ 7.01~ ~
三、实验材料与仪器
1.材料:人染色体放大照片。
2.器具:量尺、镊子、剪刀、小圆规、胶水 等。
四、实验方法
• • 染色体数目确定 染色体形态特征:
人的染色体核型分析
一、 实验目的
• 理解染色体核型分析的分类、分组标准 理解染色体核型分析的分类、 • 掌握染色体核型分析的基本方法
二 、实验原理
指染色体组在有丝分裂中期的表型, 核型 : 指染色体组在有丝分裂中期的表型, 是染色 体数目、大小、形态特征的总和。 体数目、大小、形态特征的总和。 核型分析: 在对染色体进行测量计算的基础上, 核型分析: 在对染色体进行测量计算的基础上, 进 行分组、排队、配对, 并进行形态分析的过程。 行分组、排队、配对, 并进行形态分析的过程。 核型图: 核型图:指将一个染色体组的全部染色体逐个按其特 征绘制下来,再按长短、 征绘制下来,再按长短、形态等特征排列起来的图 像。 核型分析的意义: 确定和发现染色体异常和染色体 核型分析的意义:是确定和发现染色体异常和染色体 畸变综合征的基本手段和诊断基础, 畸变综合征的基本手段和诊断基础,经过核型分析 后,可以根据染色体结构和数目的变异来判断生物 的病因, 的病因,比如是由于缺少了什么样的基因才导致的 这种疾病 。
长度:绝对、相对 相对长度=每条染色体的长度/单倍体染色体长度 臂比=长臂/短臂 着丝点指数=短臂/(长+短臂) 随体的有无
人类染色体核型分析标准是丹佛 (Denver) ) 体制
人类染色体的识别与核型分析(精选)

人类染色体的识别与核型分析应用人类染色体分析,为诊断疾病、探讨病因和发病机制,针对具体情况采取必要的措施提供了科学的依据。
因此染色体的研究已成为临床医学中一个不可缺少的组成部分。
人类染色体分析与鉴定是否可靠,直接关系到遗传咨询和产前诊断的准确性。
因此如何准确识别染色体,鉴别正常与异常染色体是十分必要的。
(一)染色体的命名和常用命名符号人类细胞遗传学标准化国际命名体制(ISCN1985)包括了1960年、1963年、1968年、1971年、1978年、1981年、1985年7次人类细胞遗传学国际命名会议的结果。
主要决议的文本是人类细胞遗传学的国际法规,为了简便地记述人类染色体及染色体畸变,制定了统一的命名符号,详见表13-5。
表13-5染色体常用命名符号表示符号说明表示符号说明ace→bcen:::csctdelderdirdicdisdup无着丝粒片段从→到断裂着丝粒断裂断裂与重接染色体染色单体缺失衍生染色体正位双着丝粒体远侧端重复/+-?minmospph1przqrrcprearec将不同的细胞分开多余丢失不能确定微小点嵌合体染色体短臂费城染色体粉碎染色体长臂环形染色体相互易位重排重组染色体(续表)表示符号说明表示符号说明eendffrafemghiinvmalmar互换内复制断片脆性位点女性裂隙次缢痕等臂染色体插入倒位男性标记染色体robsscettantertrivar;罗伯逊易位随体姊妹染色单体互换易位串联易位染色体末端三射体三着丝粒体染色体可变区在涉及一个以上染色体重排中,用来分开各染色体1.非显带染色体的命名:一个典型的中期染色体由2条姊妹染色单体组成,2条姊妹染色单体借着丝粒(次缢痕)相连,着丝粒将染色体分为长臂和短臂,根据着丝粒在染色体上所处的位置不同分为中着丝粒、亚中着丝粒和近端着丝粒染色体。
人类的1号、9号、16号染色体长臂近着丝粒端有1个次缢痕。
在近端着丝粒染色体上,常借1个纤细的染色质丝连接上1粒状结构称随体。
实验四人类染色体的识别及核型分析

实验四人类染色体的识别及核型分析引言:人类染色体是人类细胞中的遗传物质,负责传递和保存人类遗传信息。
人类染色体共有23对,分为22对体染色体和一对性染色体。
通过对人类染色体的识别和核型分析可以帮助人们了解人类基因组的结构和功能,以及相关的遗传疾病。
一、人类染色体的识别:1.细胞培养和准备:从人群体内采集细胞样本,如口腔上皮细胞、皮肤细胞等。
将细胞样本培养在含有培养基和适宜温度的培养皿中,使细胞得到良好生长。
2.细胞处理:培养细胞到足够的数量后,停止细胞分裂,使染色体得以固定。
常用的处理方法有醋酸乙酯加热法和免疫细胞化学法。
-醋酸乙酯加热法:将细胞溶胀后,加入冷甲醇-冷醋酸乙酯(3:1)混合液,使染色体得以固定。
然后将固定后的细胞涂片中加入碘化钾并加热,使染色体显色。
-免疫细胞化学法:利用特异性的抗原-抗体反应,将标记染色剂连接到染色体上,使其显色。
3.显微镜观察:将染色后的细胞涂片放置在显微镜下观察,通过显微镜的放大倍数和聚焦调节,可以看到显色的染色体。
二、核型分析:1.统计染色体数目:统计观察到的染色体个数,人类正常细胞染色体数目为46个。
2.染色体排序:将染色体按照一定次序进行排列,通常按照染色体大小和带纹特征,可分为7组:1,2,3,4,5,6和X,Y。
对于体染色体,按照从大到小的顺序编号;对于性染色体,女性为XX,男性为XY。
3.染色体的异常分析:检测并分析染色体的异常,如染色体数目异常、染色体结构改变等。
常见的染色体异常有单体、三体、四体等。
4.矫正:如果在染色实验中发现了染色体数目异常或者结构异常的情况,可以进行矫正。
通过进一步的实验,如细胞分裂抑制剂的使用等,可以获得更准确的核型结果。
结论:通过对人类染色体的识别和核型分析,我们可以了解人类基因组的结构和功能,以及与染色体异常相关的遗传疾病。
这些分析对于遗传学研究、遗传疾病的诊断和治疗等方面都具有重要的意义和应用价值。
最新医学遗传学实验:人类染色体常规核型分析教学讲义ppt

一次固定: 5 加固定液至6ml,吹打2-
离心7min,弃上清
3min,室温静置20min
注意事项:
秋水仙素用量过大,时间过长,会使分裂细胞增 多,染色体过度收缩而短,乃至染色单体离散; 用量过小则影响分裂相,使分裂细胞少,染色 体细长。
低渗不够,则染色体分散不好;低渗过度,则 细胞破碎,染色体丢失。
离心7min,弃上清 7
滴片、干燥
低渗: 3 加KCL至6ml,轻轻吹打
1~2min,37℃,25min
离心7min,弃上清
二次固定: 6 加固定液至6ml,短暂吹
打,室温静置20min
预固定:
离心7min,弃上清
4 加固定液0.6~0.7ml,
轻轻吹打1~2min
一次固定: 5 加固定液至6ml,吹打2-
注意:
1.用镊子取冰片,千万不要用手摸冰片的表面, 以免染色体不能附着。
2.滴片时要有一定高度,且玻片要稍倾斜。
3.冰片一定要清洁湿冷,易于染色体的分散。
染色
1∶10 Giemsa染液(pH 6.8)染色10min。 流水冲洗,吹风机吹干,镜检。
1 采血、接种、细胞培养 8 终止培养前2小时,加入秋水仙素
4 案例分析
3)试桩
荷载 p / kPa
0
68
136
204
272
340
408
476
544
612
680
0
5
沉降 s / mm
10
15
20 S6
S7
25
S8
30
1#楼场地CFG桩复合地基的承载力特征值可取为200kPa,满
足设计要求。
核型分析实验报告

核型分析实验报告引言:核型分析是一种常用的细胞遗传学实验技术,主要用于研究细胞的染色体组成和结构。
通过核型分析,可以了解染色体数目、大小、形态以及染色体的异常情况,为疾病的诊断和治疗提供重要依据。
本实验旨在通过核型分析技术,深入了解人类染色体的结构和变异。
实验方法:1. 细胞准备:从实验者手指上集取一小滴新鲜血液,将血液样品转移到离心管中,在37℃恒温箱中孵育20分钟。
2. 细胞分离:取出离心管,将血液样品缓慢加入热平衡后的无菌生理盐水中,使血液与生理盐水均匀混合。
使用移液管向离心管中加入几滴0.075%胷缓慢搅拌,使细胞溶解。
离心管再次放入37℃恒温箱中孵育5分钟。
3. 细胞染色:将上一步得到的细胞溶液倒在带标尺的载玻片上,然后用玻璃棒慢慢摩擦,使细胞均匀分布于载玻片上。
将载玻片浸入无菌水中,再浸入4%磷酸中,使细胞进行裂解,并在4℃下孵育5分钟。
4. 染色体显色:将载玻片转移到绿琼瑶水混合液中,加热显色约15秒钟,然后反复洗涤,使游离染料被冲洗掉,最后在显微镜下观察和分析。
实验结果:通过显微镜观察,我们成功得到了一份标本的核型分析结果。
在正常染色体图像中,我们清晰地观察到了23对染色体,其中有22对自动体染色体和一对性染色体。
染色体根据大小和带有的着丝粒的位置,分别被编号为1-22对。
性染色体由一个X染色体和一个Y染色体组成,男性为XY型,女性为XX型。
在观察过程中,我们还发现了某些异常的染色体情况。
出现染色体缺失、错位或重复的异常现象,例如染色体18上出现三个染色体而非两个。
这些异常情况可能与染色体突变或遗传疾病有关。
进一步的研究和分析将有助于了解这些异常染色体的具体病因和治疗方法。
讨论与结论:通过本实验,我们成功利用核型分析技术对人类染色体进行了观察和分析。
除了得到正常核型的基本信息外,我们还观察到了一些异常的染色体情况。
这些变异的染色体可能与染色体的遗传异常和疾病有关,为我们深入研究疾病发生机制和提供精确的诊断方法提供了重要的依据。
实验四人类染色体的识别与核型分析 (1)
实验四人类染色体的识别与核型分析一、实验目的1.学习染色体核型的分析方法;2.了解人类染色体的特征。
二、实验原理1.染色体组型(核型)是指生物体细胞所有可测定的染色体表型特征的总称。
包括:染色体的总数,染色体组的数目,组内染色体基数,每条染色体的形态、长度、着丝粒的位置,随体或次缢痕等。
染色体组型是物种特有的染色体信息之一,具有很高的稳定性和再现性。
组型分析能进行染色体分组外,还能对染色体的各种特征做出定量和定性的描述,是研究染色体的基本手段之一。
利用这一方法可以鉴别染色体结构变异、染色体数目变异,同时也是研究物种的起源、遗传与进化,细胞遗传学,现代分类学的重要手段。
2.人类的单倍体染色体组(n=23)上约有30000-40000个结构基因。
平均每条染色体上有上千个基因。
各染色体上的基因都有严格的排列顺序,各基因间的毗邻关系也是较为恒定的。
人类的24种染色体形成了24个基因连锁群,所以,染色体上发生任何数目异常、甚至是微小的结构变异,都必将导致许多获某些基因的增加或减少,从而产生临床效应。
染色体异常常表现为具有多种畸形的综合征,称为染色体综合征,其症状表现为多发畸形、智力低下和生长发育异常,此外还可看到一些特征性皮肤纹理改变。
染色体畸变还将导致胎儿死产或流产。
染色体病已成为临床上较常见的危害较为严重的病种之一,染色体病的检查、诊断已经成为临床实验室检查的重要内容。
1960年,在美国Denver市召开了第一届国际遗传学会议,讨论并确定正常人核型(karyotype)的基本特点即Denver体制,并成为识别人类各种染色体病的基础。
按照Denver体制,将待测细胞的染色体进行分析和确定是否正常,以及异常特点即为核型分析。
人类染色体分组及形态特征见表1。
表1 人类染色体分组及形态特征(非显带标本)组别染色体序号形态大小着丝粒位置次缢痕随体I号染色体常见A 1-3 最大M(1、3)SM(2)B 4-5 次大SM中等SM 9号染色体常见C 6-12,X(介于7-8之间)D 13-15 中等ST 有E 16-18 小M(16)16号染色体常见SMF 19-20 次小MG 21-22,Y 最小ST 有(22、21)A组:1-3号,可以区分。
人类染色体的识别及核型分析

人类染色体的识别及核型分析人类染色体的识别及核型分析一直是遗传学和医学领域的重要研究内容。
染色体是生物体内储存遗传信息的主要结构,它们的异常会导致多种疾病,如唐氏综合症、染色体异常等。
因此,对人类染色体的识别及核型分析具有重要的理论和实际意义。
本文将详细介绍人类染色体的识别方法和核型分析技术。
人类染色体识别的方法主要包括染色体观察、核型分析和分子遗传学方法。
染色体观察是最基本的方法,通过直接观察染色体的形态和数量来判断是否有染色体异常。
这可以通过显微镜下染色体的结构特征、染色体带分析、核型分析和染色体画图等技术来实现。
染色体带分析是一种常用的方法,可以使用各种染色剂对染色体进行着色,并根据染色体上的不同带纹来识别染色体的类型。
核型分析是确定染色体数量和结构的方法,通过计数染色体的数量,并观察其带纹图案,从而确定核型的类型。
另外,染色体画图是将染色体的形态特征展示在图上,通常配合核型分析,可以更直观地显示染色体的结构。
分子遗传学方法是一种高效且准确的识别染色体的方法,包括荧光原位杂交(FISH)和基因组微阵列分析(CGH)。
FISH是一种常用的技术,它通过标记具有特定序列的探针,与待测样本中的染色体特异序列发生互补杂交,从而标记特定染色体或染色体区域。
FISH技术可用于检测染色体异常、染色体重排及部分基因扩增或缺失等。
CGH是一种高通量全基因组检测方法,可以检测得到全部或部分染色体的大的扩增或缺失。
CGH技术主要通过比较待测样品的DNA和对照DNA的荧光信号强度来判断染色体的异常情况。
核型分析是对染色体数量和结构的综合评估,可以通过核型分析来判断是否存在染色体异常。
核型分析的方法主要包括常规细胞培养和染色体制备、胚胎分期和染色体分析等。
常规细胞培养是指在培养基中培养活细胞,使其进入有丝分裂期,然后对细胞进行取样,制备出细胞的染色体。
胚胎分期是通过观察胚胎的形态特征来判断其发育阶段,然后对其进行染色体分析。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验四人类染色体的识别与核型分析一、实验目的1.学习染色体核型的分析方法;2.了解人类染色体的特征。
二、实验原理1.染色体组型(核型)是指生物体细胞所有可测定的染色体表型特征的总称。
包括:染色体的总数,染色体组的数目,组内染色体基数,每条染色体的形态、长度、着丝粒的位置,随体或次缢痕等。
染色体组型是物种特有的染色体信息之一,具有很高的稳定性和再现性。
组型分析能进行染色体分组外,还能对染色体的各种特征做出定量和定性的描述,是研究染色体的基本手段之一。
利用这一方法可以鉴别染色体结构变异、染色体数目变异,同时也是研究物种的起源、遗传与进化,细胞遗传学,现代分类学的重要手段。
2.人类的单倍体染色体组(n=23)上约有30000-40000个结构基因。
平均每条染色体上有上千个基因。
各染色体上的基因都有严格的排列顺序,各基因间的毗邻关系也是较为恒定的。
人类的24种染色体形成了24个基因连锁群,所以,染色体上发生任何数目异常、甚至是微小的结构变异,都必将导致许多获某些基因的增加或减少,从而产生临床效应。
染色体异常常表现为具有多种畸形的综合征,称为染色体综合征,其症状表现为多发畸形、智力低下和生长发育异常,此外还可看到一些特征性皮肤纹理改变。
染色体畸变还将导致胎儿死产或流产。
染色体病已成为临床上较常见的危害较为严重的病种之一,染色体病的检查、诊断已经成为临床实验室检查的重要内容。
1960年,在美国Denver市召开了第一届国际遗传学会议,讨论并确定正常人核型(karyotype)的基本特点即Denver体制,并成为识别人类各种染色体病的基础。
按照Denver体制,将待测细胞的染色体进行分析和确定是否正常,以及异常特点即为核型分析。
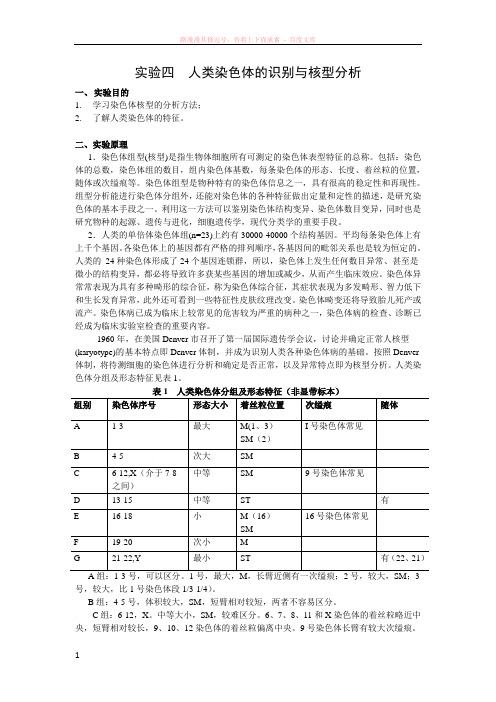
人类染色体分组及形态特征见表1。
表1 人类染色体分组及形态特征(非显带标本)组别染色体序号形态大小着丝粒位置次缢痕随体I号染色体常见A 1-3 最大M(1、3)SM(2)B 4-5 次大SM中等SM 9号染色体常见C 6-12,X(介于7-8之间)D 13-15 中等ST 有E 16-18 小M(16)16号染色体常见SMF 19-20 次小MG 21-22,Y 最小ST 有(22、21)A组:1-3号,可以区分。
1号,最大,M,长臂近侧有一次缢痕;2号,较大,SM;3号,较大,比1号染色体段1/3-1/4)。
B组:4-5号,体积较大,SM,短臂相对较短,两者不容易区分。
C组:6-12,X。
中等大小,SM,较难区分。
6、7、8、11和X染色体的着丝粒略近中央,短臂相对较长,9、10、12染色体的着丝粒偏离中央。
9号染色体长臂有较大次缢痕。
X 染色体介于7-8之间,但在非显带标本中难以区分。
D 组:13-14号,中等大小,ST ,均具有随体,但不一定显现或同时显现,随体的大小存在个体的差异。
在非显带标本中难以区分13-15号染色体。
E 组:16-18。
染色体小。
16,M ,长臂近着丝粒处有一次缢痕,其存在使16号染色体的大小存在较大差异;17,SM ,短臂较长;18,SM ,是SM 中最短的一对染色体,短臂较短。
在质量较好的标本中,一般可以区分16-18染色体。
F 组:19-20,次小的M 。
在非显带标本中难以区分。
G 组:21-22,Y ,最小的ST 。
21、22染色体的长度略有差别,但为适应临床上已将Down 综合征沿用为21三体(而显带证明与此综合征相关的是较小的那条染色体)综合征的叫法,巴黎会议(1971)建议,把这最小的一对改称为第21号(而稍大的一对称为22号),而把这较小的这对第21号染色体排在稍大的22号前面。
Y 染色体的特征,无随体,染色体一般比21、22长;两条姊妹染色单体长臂常平行并拢,而21、22则相互叉开;长臂端部常呈现绒毛状,形态不清晰;与其他染色体相比,着色往往较深;着丝粒不明显。
根据Denver 体制规定,正常核型的描述方式为:46,XX ;46,XY 。
3.人们用各种不同的方法,以及用不同的染料处理染色体标本后,使每条染色体上出现明暗相间,或深浅不同带纹的技术称为显带技术(banding technique )。
本世纪70年代以来,显带技术得到了很大发展,且在众多的显带技术中(Q 带、G 带、C 带、R 带、T 带)。
G 带是目前被广泛应用的一种带型。
染色体标本经胰蛋白酶、NaOH 、柠檬酸盐或尿素等试剂处理后,再用Giemsa 染色,可使每条染色体上显示出深浅交替的横纹,因为它主要是被Giemsa 染料染色后而显带,故称之为G 显带技术,其所显示的带纹分布在整个染色体上。
每条染色体都有其较为恒定的带纹特征,所以G 显带后,可以较为准确的识别每条染色体,并可发现染色体上较细微的结构畸变。
三、材料与试剂人类染色体非显带、显带标本。
直尺,剪刀等。
四、实验步骤1.分析的主要依据着丝粒指数(%)——短臂占整条染色体的百分比:%100⨯+qp p臂比——长臂与短臂的比值(q/p)。
反映着丝粒位置的指标。
SAT(随体)1.0-1.7(M); 1.7-3.0(SM); 3.0-7.0(St); 7.0-(Ot);相对长度(%)——某条染色体的相对长度为该染色体长度占染色体总长度的百分比。
人类某条染色体的相对长度(%) =该条染色体长度/∑22条染色体长度+X 染色体长 2.分析的主要步骤① 测量、计算,。
② 配对 ③ 剪贴④ 排列——原则:从大到小;短臂向上;着丝粒在一条线上;性染色体单排 ⑤ 画出模式图——(相对比例)原则同上。
3.图像分析方法20世纪60年代起,人们开始将图像处理技术应用于核型分析中来。
目前已实现计算机自动检测染色体分散良好的中期细胞,并自动完成核型分析。
但这样的软件往往价格高昂,一般的单位是不具有的。
Abode Photoshop 是一款流行的功能强大的图像处理软件,它比专门的核型分析软件容易获得。
用这款软件,可以很容易的完成染色体的排列、测量等工作。
程序远较传统方法简单。
同时,他还具备传统方法所不具备的诸多功能,诸如去除原照片中的斑点、划痕,调整亮度、对比,对交叉重叠的染色体臂进行修整等,使分析结果比较完美。
基本方法如下:(1)图片获得将图片输入电脑中。
有两种获得图片的方法:一是选择染色体分散良好的有丝分裂中期的细胞,用数码相机进行拍摄(100万像素即可),然后输入电脑;一是按传统方法拍摄,再用300dpi或更高的分辨率将照片扫描进计算机。
(2)图片处理用剪裁工具(Crop tool)将不需要的部分裁去,调整图像的位置,视情况调整亮度、对比度;去除斑点、划痕等,然后储存图像,名之为“原始图”。
在进一步分析前,用橡皮工具(Eraser tool)等将照片中除染色体以外的其他区域擦除干净。
然后将图像另存为“核型图”,利用这张背景干净的“核型图”进行核型分析。
(3)图片分析根据目测,对染色体进行大致归拢。
首先将一组染色体中非常明显(如最长、最短,具有随体等)、较易分辨的同源染色体进行配对,归类。
其余的染色体可以根据自己的判断,暂且将它们配对。
按从长到短的顺序或其他规则,将这些配对的染色体排列起来。
然后,测量各条染色体的总长及各臂长度。
根据测量结果,再对第一步中“误配”的染色体进行调整。
将染色体大致归类的过程仅需要反复使用套索(Lasso)与自由变形(Free transform)两个工具即可。
用套索工具从图中圈选同源染色体,从Edit菜单中选择Free transform,此时被圈选的染色体外出现一个矩形的框,用鼠标按住矩形框的一个角可自由地旋转被圈选中的染色体,使短臂朝上,长臂朝下。
而将鼠标伸入矩形框中并按住,则可将选中的染色体拖向任何位置。
移动到目的地后,按回车键又可回到套索工具中来。
自由变形的快捷键是Ctrl+T,使用此快捷键可省力不少。
重复上述过程,将所有同源染色体配成对。
在配对过程中,可借助放大工具(zoom tool),看清染色体的细节。
染色体间如存在交叉重叠,我们可以同时处理几个染色体重叠较少的细胞,先用套索工具小心地将叠在上面的染色体圈选、移走,再从另一张照片找到相应的细节,用橡皮图章工具(clone stamp tool)仔细地“克隆”到因“分离”而造成的“断臂”处。
注意,克隆前要将两个染色体的尺寸调整成一样大。
这样“修补”后的染色体比“嵌合体”式的染色体特征更典型。
视需要在画布中拉一条或几条参考线,选用套索与自由变形两种工具,按核型分析中染色体排列的规则,圈选并拖动配好对的染色体排列,将着丝点排在参考线上。
测量每条染色体的总长与臂长,调整“误配”的染色体。
在菜单中选Edit→preference →Guide、Grid&Slice,将其中的Grid line every设为1cm,Subdivision则可视精度需要设为10或其他值,在菜单中选View→Ruler、View→Show→Grid显示标尺与网格,将图像放大到300%左右,根据网格线标示准确测量每条染色体的长度及相应的臂长,并做记录。
由此读出的尺寸即是被扫描的原始照片中的染色体的尺寸,虽然显示在屏幕上的染色体要比原始照片中的大。
如果一条染色体臂是弯曲的,可按前文叙述的方法圈选并旋转染色体,分段测量。
这种测量方法既简便又准确。
算出每条染色体的总长、臂长、臂比等参数。
这些参数最为接近的两条染色体为同源染色体。
根据这些结果,对目测有误的配对结果进行调整。
调整“核型图”画布的大小,将“原始图”移进“核型图”中来,按需要调整大小和位置。
用文字工具(type tool)在图的下方对核型图做些说明。
合并所有的图层。
另存成“核型分析”。
最后,用光泽照片纸或高分辨率纸将结果打印出来或插入到其他文档中即可。
五、结果分析1.根据所给定的染色体图片(非显带和显带标本)进行测量,结果填写表2编号绝对长度相对长度短臂长臂臂比着丝粒指数随体类型2. 按照Denver体制规定,分组贴图。
六、参考文献1.刘祖洞,江绍慧编,遗传学实验(第二版),高等教育出版社,北京,2004.2.李凤霞,遗传学实验指导及图谱,吉林人民出版社,长春,2006.3.王金发,戚康标,何炎明,遗传学实验教程,高等教育出版社,北京,2008.4.杨大翔,遗传学实验,科学出版社,北京,2004.图2 人类G-显带染色体附人类染色体非显带标本。
图1 人类非显带染色体(上为男性,下为女性)。
